Verwendete Mutationen bei P450 BM-3
Werbung

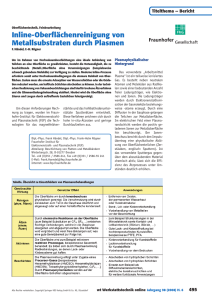
Biotransformation of the sesquiterpene (+)-valencene by cytochrome P450cam and P450BM-3 Rebecca J. Sowden, Samina Yasmin, Nicholas H. Rees, Stephen G. Bell and Luet-Lok Wong* Department of Chemistry, Inorganic Chemistry Laboratory, University of Oxford, South Parks Road, Oxford, UK Received 25th August 2004, Accepted 11th October 2004 First published as an Advance Article on the web 18th November 2004 Gewünschte Umsetzung: ● ● aus Orangenöl Synthasegen in E.coli exprimiert billig ● aus Grapefruitsaft ● gefragter Duftstoff teuer Ansatz: Biologische Oxidation von (+)-Valencene mit P450 Monooxygenase zu (+)-Nootkatone Probleme: ● ● ● (+)-Valencene kein Substrat für Wildtyp P450 (+)-Nootkatone inhibiert P450 Neben (+)-Nootkatone entstehen auch andere Produkte Verwendung von Enzymen mit Punktmutationen Verwendete Enzyme: Cytochrom P450cam Cytochrom P450BM-3 ● aus Pseudomonas putida ● ● Substrat: Campher ● ● gut charakterisiert ● aus Bacillus megaterium Substrat: mittel- bis langkettige Fettsäuren gut charakterisiert Verwendete Mutationen bei P450cam: ● F87A: kleinere AS ● Y96F: hydrophobere AS ● ● Die Versuche wurden in vitro durchgeführt V247L: schließt Substrattasche L244A: schafft Platz am Häm Ergebnisse für P450Cam Bei natürlichem Substrat Campher: - Rate 1000min-1 - Ausbeute > 95% Ergebnisse für P450cam: ● Mutanten haben niedrige Aktivität für (+)-Valencene verglichen mit Campher ● Aber hohe Regioselektivität für C2-Oxidation ● F87A/Y96F/L244A Mutante erzeugt hohen Anteil an Nootkatone ● F87A/Y96F/L244A/V247L Mutante hat hohe Selektivität für (+)-transnootkatol: Eventuell Umsetzung zu Nootkatone mit Dehydrogenase bei gleichzeitiger Regeneration von NADH möglich? Verwendete Mutationen bei P450BM-3: ● R47L: kleiner und unpolar ● Y51F: unpolare AS ● F87A: kleinere AS ● I263A: kleinere AS Durchführung: ● In vivo Ansatz in E.coli zur Produktbildung und –isolation ● Problem: Produkte sind toxisch für Mikroorganismen ● Zugabe von 2% v/v n-Hexadecan ● Produkte gehen in organische Phase ● Trennung der Produkte per Säulenchromatographie ● Analyse per Gaschromatographie Ergebnisse für P450BM-3: Aktivität bei Fettsäuren: ca 5000 min-1 Große Anzahl an weiteren Produkten erhalten Ergebnisse für P450BM-3: ● ● Geringe Aktivität für (+)-Valencene verglichen mit dem natürlichen Substrat Geringe Regioselektivität: Wahrscheinlich verschiedene Orientationen des Substrats möglich ● Hohe Substratumsetzung ● Keine Inhibition durch Nootkatone Zusammenfassung: ● P450cam oxidiert Valencene mit hoher Regioselektivität aber geringer Aktivität: Wahrscheinlich nur eine Orientierung des Substrats möglich ● P450cam produzierte bis zu 47% Nootkatone ● P450BM-3 zeigt höhere Aktivität als P450cam ● P450BM-3 zeigt geringe Regioselektivität, dadurch große Produktvielfalt ● Keine Inhibition durch Nootkatone bei beiden Enzymen ● Beide Enzyme benötigen weitere Optimierung Fragen?