Bestimmung der Enzymaktivität am Beispiel der alkalischen Phosp
Werbung

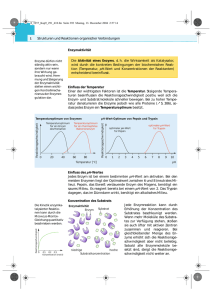
Bestimmung der Enzymaktivität am Beispiel der alkalischen Phosphatase Reaktionen, die im Organismus mit Hilfe eines Enzyms katalysiert werden, laufen im einfachsten Fall nach folgendem Schema ab: Enzym + Substrat ⇔ Enzymsubstratkomplex ⇔ Enzym + Produkt K1 K3 [ E ][ S ] = [ ES ] [ E ][ P ] K 2 Es bestehen grundsätzlich zwei Möglichkeiten, Enzymaktivitäten nachzuweisen: a) durch die Abnahme der Konzentration des Substrates, das mit Hilfe des Enzyms in das Produkt umgewandelt wird, oder b) durch die Zunahme der Konzentration des Produktes, das im Laufe der Enzymreaktion gebildet wird. Welche der beiden Möglichkeiten in der Praxis gewählt wird, hängt von der Nachweismöglichkeit von Substrat und Produkt ab. Da das Substrat meist in hohen Konzentrationen vorliegt, ist die Bestimmung der Zunahme des gebildeten Produktes genauer als die Messung der Abnahme des Substrates. Die Einheit der Enzymaktivität ist das Katal, als Benennung kat: 1 kat ist diejenige Menge Enzym, die in 1 Sek. einen Substratumsatz (Produktbildung) von 1 mol katalysiert. Diese unhandliche Einheit (handlicher 1 µkat, 1 nkat) führt dazu, daß die nicht mehr empfohlene Einheit "Enzymeinheit" (enzyme unit, EE oder U) ein zähes Leben hat. 1 EE(U) ist diejenige Menge Enzym, die den Umsatz von 1 µmol Substrat in 1 min katalysiert. Die Enzymaktivität wird unter "optimalen Bedingungen" gemessen, die für jedes Enzym individuell festgelegt werden müssen und die bei der Angabe einer Enzymaktivität zu nennen sind. Die spezifische Aktivität ist die Aktivität eines Milligramms des Enzymproteins. Die Feststellung einer spezifischen Aktivität erfordert zwei Messungen, die der Enzymaktivität und eine Proteinbestimmung. Die spezifische Aktivität eines reinen Enzyms ist ein für dieses charakteristisches Merkmal (z.B. reine ADH aus Hefe unter optimalen Bedingungen 250 U/mg bzw. 4,16 µkat/mg). Ein Präparat, das eine niedrigere spezifische Aktivität hat, ist mit Fremdprotein verunreinigt oder teilweise denaturiert. Die Praktikumsaufgabe hat zum Ziel, das Prinzip der Aktivitätsbestimmung und der zugehörigen Auswertung kennenzulernen. Die Alkalische Phosphatase ist unser Beispiel, nicht Hauptinhalt der Aufgabe. Untypisch ist an ihr, daß sie ziemlich unspezifisch gegenüber ihren Substraten ist und daß deshalb auch der Einsatz eines unphysiologischen Substrats wie des p-Nitrophenylphosphats möglich ist. Bei der Reaktion wird das farblose Substrat (I) durch Hydrolyse in das gelb gefärbte p-Nitrophenol (II) überführt, das durch Dissoziation in das Anion (III) und ein Proton eine weitere Farbvertiefung (Bathochromie) erfährt. Das dahinterstehende chemische Prinzip ist für sehr viele Messungen enzymatischer Reaktionsverläufe Grundlage und wird deshalb im Begleitseminar diskutiert. H2 O O2N 2- O PO 3 O2N OH HPO 2- O- H+ 4 PNPP O2N PNP Aufgabenstellung: Die Aktivität der Alkalischen Phosphatase wird mit einer "kontinuierlichen" und einer "diskontinuierlichen" Methode gemessen. Außerdem soll beobachtet werden, wie sich die Änderung einzelner Reaktionsparameter (Temperatur, pH-Wert, Pufferkonzentration) auf die Aktivität auswirkt. Reagentien: − 1,5 mol/l Tris-HCl pH 8 − 14,5 mmol/l p-Nitrophenylphosphat (pH 8 mit NaHCO3 einstellen) − 1 mol/l KPO4 pH 8 − Alkalische Phosphatase. Ausgegeben wird eine verdünnte Enzymlösung in 1,5 mol/l TRIS-Puffer pH 8.0, die eine Aktivität von etwa 1 U/ml hat. Zur Veränderung der Reaktionsparameter stehen folgende Puffer zur Verfügung: − 1,5 mol/l Tris-HCl pH 7,5 − 0,05 mol/l Tris-HCl pH 8,0 − 0,05 mol/l Tris-HCl pH 7,5 Die angegebenen Puffer können bei verschiedenen Temperaturen eingesetzt werden: − Temperatur 20 °C (Raumtemperatur) − Temperatur 13 °C (Wasserbad) − Temperatur 30 °C (Wasserbad) Von einem zum nächsten Experiment soll immer nur ein Parameter (also entweder Pufferkonzentration oder Temperatur) geändert werden. Achtung! Selbst entscheiden, ob sich die kontinuierliche oder die diskontinuierliche Methode besser eignet für einen Versuch mit geändertem Parameter! Entscheidung im Protokoll begründen! Aufgaben: 1. Kontinuierliche Methode: Hierbei wird die Bildung des Produktes kontinuierlich verfolgt, ohne daß die Reaktion gestoppt wird. In eine Halbmikroküvette werden 0,74 ml des Tris-Puffers und 0,25 ml der pNitrophenyl-phosphatlösung pipettiert und gemischt. Nach dem Notieren der Anfangsextinktion bei 405 nm werden 10 µl der Enzymlösung eingemischt. Dann wird jede volle Minute die Extinktion abgelesen und notiert. Der Verlauf der Extinktionsänderung kann auch mit dem Schreiber aufgezeichnet werden. Die Reaktion soll so lange verfolgt werden, wie es für das sichere Zeichnen der Geraden im Diagramm nötig ist. 2. Diskontinuierliche Methode: Hierbei wird aus einem großen Reaktionsansatz (15 ml) in genau zu notierenden Zeitabständen ein Aliquot entnommen und durch Einmischen in eine vorgelegte Phosphatlösung "gestoppt", so daß die Reaktion wegen Hemmung des Enzyms nicht weiterlaufen kann. In 16 eindeutig markierten Reagenzgläsern wird je 0,1 ml des Phosphatpuffers vorgelegt. In einem Reagenzglas wird der Reaktionsansatz vorbereitet: 10,0 ml des Tris-Puffers, 5,0 ml der p-Nitrophenylphosphatlösung. Von diesem Gemisch werden 0,9 ml in die erste der 16 vorbereiteten Reagenzgläser gegeben. Die Ablesung der Extinktion dieses Reagenzglases ist der Null-Wert, d. h. die Extinktion zum Reaktionszeitpunkt 0. Der Reaktionsansatz im Reagenzglas wird durch Einmischen von 50 µl der Enzymlösung "gestartet". Nach jeder vollen Minute werden nun je 0,9 ml daraus entnommen und in die weiteren Reagenzgläser pipettiert, die jeweils sofort durchgemischt werden. Dadurch wird die Reaktion gestoppt. Danach werden die Extinktionen der 16 Proben im Photometer gemessen. 3. Änderungen der Reaktionsparameter: Bei Versuch 1 und 2 lauteten die Bedingungen: Zimmertemperatur, angegebene Konzentrationen. Es soll nun untersucht werden, wie sich die Änderung jeweils eines Parameters auf die Reaktionsgeschwindigkeit auswirkt. Geändert werden kann z. B.: - die Temperatur - die Pufferkonzentration (die bei 1 und 2 gewählte Konzentration ist für eine - enzymatische Reaktion ungewöhnlich hoch. Was geschieht, wenn eine "normale" Konzentration, z. B. 0,05 mol/l Tris, gewählt wird?) der pH-Wert. Da jeder Puffer einen begrenzten Pufferbereich hat, bedeutet eine wesentliche Änderung des pH-Wertes zugleich einen Wechsel des Puffers. Auswertung: Alle Ergebnisse, gleichgültig ob kontinuierlich oder diskontinuierlich gewonnen, werden zunächst als Extinktions-Zeit-Diagramme dargestellt. Daraus werden die Reaktionsge-schwindigkeiten in µmol/min und kat für 1 ml der verwendeten Enzymlösung berechnet. Der Extinktionskoeffizient des p-Nitrophenolats beträgt ε405 = 18,5 l/mmol-1 cm-1 . Ergebnisse aus Versuchteil 3 in die Diagramme aus 1 bzw. 2 eintragen und vergleichend diskutieren! Literatur: R. B. McComb, G. N. Bowers, S. Posen, Alkaline Phosphatase. Plenum Press New York 1979.