Al(OH) 3
Werbung
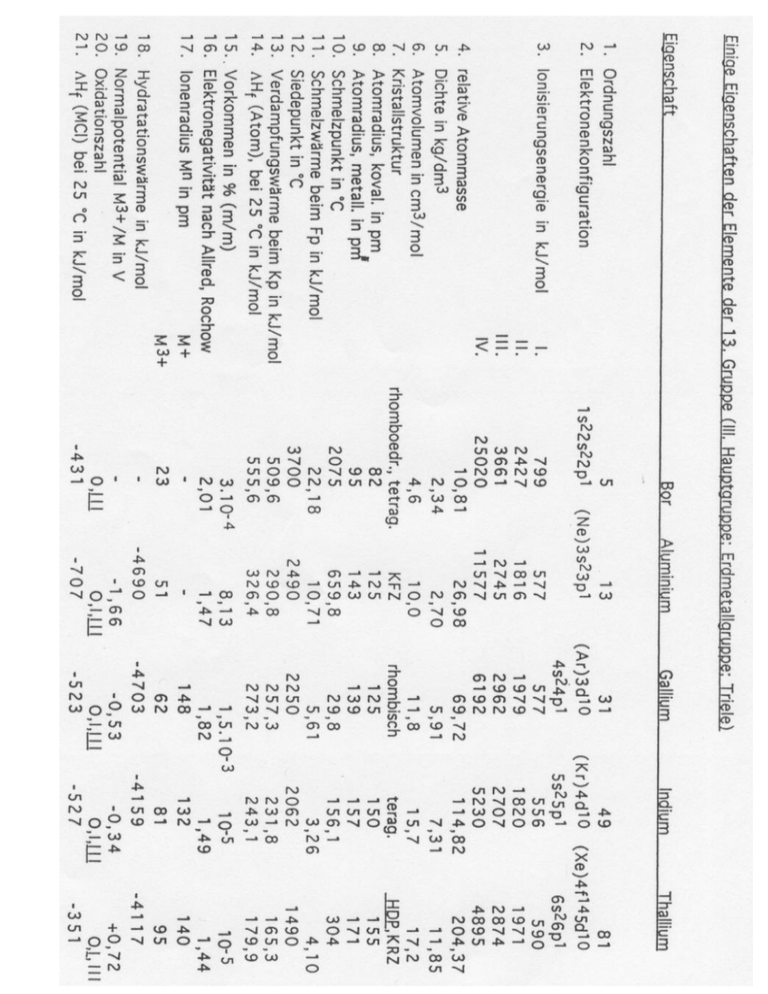
Eigenschaften der Elemente der 13. Gruppe 13. Gruppe B Al,Ga In,Tl ns2np1 Sonderstellung von Bor: Halbmetall Wichtigste Oxidationszahl: + III (außer Tl) Beständigkeit der Oxidationszahl +III nimmt ab von Ga →Tl Beständigkeit der Oxidationszahl +I nimmt zu von Ga →Tl Bindungscharakter häufig zwischen ionisch und kovalent ionischer Charakter nimmt zu B → Tl Oxide: sauer B2O3 amphoter Al2O3 Ga2O3 Schrägbeziehung B – Si !! basisch In2O3 Tl2O3, Tl2O B_Bor Vorkommen: als Salze der Polyborsäuren, z.B. Borax ( Na2B4O7· 10 H2O ) Kernit ( Na2B4O7· 4 H2O ) als Borsäure H3BO3 (in heißen Quellen, speziell vulkanischen Dampfquellen) B_Bor Darstellung: sehr schwierig, reines Bor herzustellen ! 1. Amorphes unreines Bor a) Reduktion mit Mg oder Na, z.B.: B2O3 + 3 Mg → 2 B + 3 MgO Auskochen mit verd. HCl, auswaschen mit H2O b) Schmelzflusselektrolyse eines Gemischs aus KBF4, KCl, B2O3 bei 800°C ergibt Reinheit von 95 bis 98% 2. Hochreines Bor a) Thermische Zersetzung von BI3 an heißen Ta- oder W-Drähten (1000-1500°C) „van Arkel-Verfahren“ 2 BI3 → 2 B + 3 I2 b) Reduktion mit H2 2 BCl3 + 3 H2 → 2 B + 6 HCl B_Bor Eigenschaften: Hohe Ionisierungsenergie → keine B3+-Ionen; bevorzugt kovalente Bindungen! 4 Valenzorbitale – aber nur 3 Valenzelektronen → häufig Mehrzentrenbindungen! Grundeinheit aller Bor-Modifikationen (und vieler Borverbindungen): B12-Ikosaeder 13 bindende MO pro B12-Ikosaeder, mit 26e- besetzt, dh. 26 e- über gesamtes Ikosader delokalisiert 10 e- zur Bindung mit Nachbar-Ikosaedern B_Bor Eigenschaften: -rhomboedrisches Bor: einfachste Struktur ~ kubisch dichteste Packung von B12-Ikosaedern -rhomboedrisches Bor: thermodynamisch stabilste Modifikation -tetragonales Bor: aus B12-Ikosaedern und einzelnen B-Atomen -tetragonales Bor: komplizierte Struktur alle Modifikationen sind sehr hart, halbleitend -rhomboedrisches B B_Bor B_Bor -rhomboedrisches B Dreizentren-BBB-Bindung B_Bor B_Bor Verwendung: in Stählen; in Kernreaktoren zur Regelung (10B hat hohen Einfangquerschnitt für Neutronen); Herstellung von Boriden (Ti, Zr, Cr, …); Herstellung von Verbundmaterialien (B-Fasern in Metall- oder Kunststoffmatrix) B_Bor Wasserstoffverbindungen (Borane): • • • • • BnHn+4 (n=2,5,6,8,10,12,14,16,18) BnHn+6 (n=4,5,6,8,9,10,13,14,20) BnHn+8 (n=8,10,12,14,15,30) BnHn+10 (n=8,26,40) außerdem B20H16 Einfachstes Boran wäre BH3, ist nicht als solches isolierbar, dimerisiert B2H6 An den Bindungen in den Boranen sind beteiligt: B-H Zweizentrenbindungen B-B H B B B B B offene B Dreizentrenbindungen B B geschlossene B_Bor als Beispiel: B6H10 B-H 6 12 e- B-B H 2 4 e- B 4 8 e- B 2 4 e- B B B Summe = 28 e- B_Bor Dreizentrenbindung im B2H6 VB-Theorie: H B H H B H H die Boratome sind etwa sp3-hybridisiert H B B H H „Bananenbindung“ MO-Theorie: B B‘ sp3 bindendes und antibindendes MO aus den sp3-Orbitalen 1s H bind. und antibind. MO aus bind. sp3-Orbital und 1s-Orbital Al_Aluminium Vorkommen: (häufigstes Metall, dritthäufigstes Element der Erdrinde) Aluminium- und Alumosilicate Feldspat ( [AlSi3O8]– ) Glimmer ( [AlSi3O10](OH)27– ) Tone (z.B. Kaolinit, Al4[Si4O10](OH)8 ) Lehm Al2O3 („Tonerde“) als Korund (rein) und Schmirgel (+Fe2O3, SiO2); in Form von Edelsteinen (Rubin, Saphir) Kryolith Na3AlF6 Bauxit als Ausgangsmaterial für Al-Gewinnung (~ AlO(OH), Al(OH)3; +Tonmineralien, Fe2O3) ~ 100 Mio t/a Al_Aluminium Eigenschaften: Leichtmetall gute Leitfähigkeit (~ 2/3 der Leitfähigkeit von Cu!) sehr dehnbar (Folien, Drähte; bis 0,004 mm) laut Spannungsreihe ziemlich unedel, jedoch → Passivierung (dünne schützende Oxidschicht); Schutzwirkung verbessert durch anodische Oxidation (Eloxal) löst sich in verdünnten Säuren ( EAl0 1,68 V ) Al + 3 H+ → Al3+ + 3/2 H2 löst sich nicht in oxidierenden Säuren wegen Passivierung! gegen H2O beständig; stark exotherme Rektion mit O2 bei Erhitzen: 2 Al + 3/2 O2 → Al2O3 H f0 1 677 kJ mol 1 genutzt im aluminothermischen Verfahren und im Thermitverfahren (früher Blitzbirnen) Al_Aluminium Darstellung: ~ 20 Mio t/a Schmelzflusselektrolyse von Al2O3 Bauxit reines Al2O3 Schmelzflussel. a) Herstellung von reinem Al2O3 aus Bauxit ( AlO(OH)/Al(OH)3 + Fe2O3 + SiO2 ) Bayer-Verfahren („Nasser Aufschluss“) Prinzip: Al(OH)3 amphoter, Fe2O3, SiO2 nicht! Bauxit + NaOH 170°C Druck (ca. 6 bar) Na[Al(OH)4] + Fe2O3 + Silicate Filtrieren, verdünnen, animpfen: Na[Al(OH)4] Filtrieren, erhitzen: 2 Al(OH)3 NaOH + Al(OH)3 ↓ 1200°C Al2O3 + 3 H2O b) Elektrolyse (Hall-Héroult-Verfahren) Fp(Al2O3) 2050°C daher auflösen in Na3AlF6 (Kryolith) (~10% Al2O3 in ~90% Na3AlF6, Fp 960°C) für 1 kg Al: 1,9 kg Al2O3 (aus 4,5 kg Bauxit) 0,5 kg Elektrodenkohle 14 kWh Aluminium-Elektrolyse Al2O3 + Al2O3- Kathode: Anode: Al2O3 2 Al3+ + 6 e– 3 O2– 2 Al3+ + 3 O2– 2 Al 3 / O + 6 e– 2 2 ___________________________________________________________________________ Al2O3 ( an der Anode:C + O2 CO2 2 Al + 3/2 O2 !) Aluminium-Elektrolyse A modern potline - this one can produce over 200 000 tonnes of aluminium per year Pre-Bake carbon anodes Al_Aluminium Verwendung: Al-Legierungen: Magnalium (10-30 % Mg) Hydronalium (3-12 % Mg) Duraluminium (2,5 – 5,5 Cu, 0,5 -2 Mg, 0,5 – 1,2 Mn, 0,2 – 1 Si) Al-Folien (Verpackung, Kondensatoren) Al-Pulver (Schutzanstriche, Pyrotechnik) Al-Grieß für Aluminothermie (Gewinnung von Metallen) z.B.: 2 Al + Cr2O3 2 Cr + Al2O3 H o = -547 kJ mol-1 Thermit-Verfahren (-Schweißen) 8 Al + 3 Fe3O4 9 Fe + 4 Al2O3 H o = -3341 kJ mol-1 Al_Aluminium Wasserstoff-Verbindungen: AlH3, Al2H6 (AlH3)n „Alan“ H 3-Zentren-2-Elektronen-Bindung: Al Al H Hydridoaluminate (Alanate) [AlH ]- stabil 4 z.B. Li[AlH4] und Na[AlH4] als Reduktions- und Hydrierungsmittel 4 LiH + AlX3 Li[AlH4] + 3 LiX X = Cl, Br analog Li[AlD4] Al_Aluminium Sauerstoff-Verbindungen [Al(H2O)6]3+ ist stark protolysiert (hydrolysiert): [Al(H2O)6]3+ [Al(H2O)5(OH)]2+ + H+ etc. daher reagieren alle Al-Salze in wässr. Lsg. sauer! Al(OH)3: drei Modifikationen – die beiden wichtigsten: Hydrargillit = -Al(OH)3 Bayerit = -Al(OH)3 (metastabil, nicht in der Natur) aus Al3+-Lösungen fällt amorphes Al(OH)3 aus; kristallines Al(OH)3 erhält man durch: 2 [Al(OH)4]– + CO2 2 Al(OH)3 + CO32– + H2O Al(OH)3 amphoter: [Al(H2O)6]3+ H+ – OH Al(OH)3 H+ – [Al(OH)4]– OH Al_Aluminium Sauerstoff-Verbindungen Aluminate: durch Wasserabspaltung aus z.B. Na[Al(OH)4] ----------> NaAlO2 ( [AlO2]nn– ) AlO(OH): zwei Modifikationen in der Natur: Diaspor = -AlO(OH) Böhmit = -AlO(OH) Entwässern von Al(OH)3: ~150°C ~400°C >1000°C Al(OH)3 -AlO(OH) -Al2O3 -Al2O3 (metastabil) Al_Aluminium Sauerstoff-Verbindungen Al2O3 („Tonerde“): in der Natur als Korund (reines -Al2O3; sehr hart) Schmirgel (verunreinigt) Rubin (+Cr2O3) Saphir (+Fe2O3, TiO2) 2 Modifikationen: -Al2O3 und -Al2O3 Al_Aluminium Sauerstoff-Verbindungen -Al2O3: hergestellt durch Entwässern aus -Al(OH)3 (Hydrargillit) -AlO(OH) (Böhmit) -Al2O3 ist metastabil; säurelöslich; große Oberfläche, gutes Adsorptionsvermögen (Chromatographie, Katalyse) (spinellartige Struktur (kubisch)) -Al2O3: in der Natur nur -Al2O3; stabile Modifikation; hergestellt durch Glühen aus -Al2O3 (bei ca. 1000°C) -AlO(OH) (Diaspor) (bei ca. 500°C) säureunlöslich; sehr hart! (kristallisiert in der Korundstruktur (hexagonal)) Al_Aluminium Sauerstoff-Verbindungen -Al2O3: technisch in großen Mengen aus Bauxit hergestellt (Bayer-Verfahren) größter Teil zur Al-Herstellung Rest für Schleif- und Poliermittel; für hochfeuerfeste Geräte (Sinterkorund) Al2O3 im elektrischen Ofen geschmolzen, nach Bedarf zerkleinert künstliche Edelsteine durch Verneuil-Verfahren für Schmuckstücke, Uhrenindustrie, Spinndüsen, Laser Al2O3 bildet Doppeloxide mit MeO, z.B. MgAl2O4 (Spinell) ß-Al2O3: eigentlich Na2O.11 Al2O3 (auch „Na-ß-aluminat“) ein fester Na+-Ionenleiter! Verneuil-Verfahren Sauerstoff Al2O3 Wasserstoff Brenner künstl. Edelstein Al_Aluminium Halogen-Verbindungen (Lewis-Säuren!) AlF3: (Fp = 1290°C) – unlöslich Ionengitter aus AlF6-Oktaedern Fluoroaluminate – [AlF6]3-, [AlF5]2-, [AlF4]am wichtigsten Na3 AlF6 (Kryolith) heute hauptsächlich synthetischhergestellt: H2SiF6 + 6 NH3 + 2 H2O 6 NH4F + SiO2 6 NH4F + 3 NaOH + Al(OH)3 Na3 AlF6 + 6 NH3 + 6 H2O AlCl3: (sublimiert bei 183°C) • im festen Zustand Schichtgitter aus AlCl6-Oktaedern • flüssig, gasförmig aus Al2Cl6-Molekülen Cl Cl Cl Al Al Cl Cl Cl zwei AlCl4-Tetraeder Al(s,l) + Cl2(g) AlCl3 (s) aus wässriger Lösung nur [Al(H2O)6]Cl3, kann nicht entwässert werden, spaltet HCl ab zur Textilimprägnierung, in der Kosmetik (als Desodorant, Antiseptikum) Al_Aluminium Aluminiumsalze Aluminiumsulfat: 2 Al(OH)3 + 3 H2SO4(conc.) Al2(SO4)3 + 6 H2O es kristallisiert Al2(SO4)3.18H2O hydrolysiert in wässriger Lsg. Al(OH)3 Verwendung: Leimen von Papier Gerben von Häuten Beizmittel in der Färberei Flockungsmittel für Wasserreinigung Herstellung anderer Al-Salze Alaune: Me+Me3+(SO4)2.12 H2O [Me(H2O)6]+ [Me(H2O)6]3+(SO42-)2 Me+: Na, K, Rb, Cs, NH4, Tl Me3+: Al, Sc, V, Cr, Mn, Fe, Co, Ga, In Doppelsalze „Alaun“ = KAl(SO4)2.12 H2O „Essigsaure Tonerde“: basisches Al-acetat Al(CH3COO)2OH Al_Aluminium Al(I)-Verbindungen Al2O(g) Subhalogenide z.B. AlCl (g) Ga, In, Tl Vorkommen und Darstellung: Ga, In, Tl als Begleiter von Zn in ZnS; Tl in Spuren im FeS2 Darstellung durch Elektrolyse wässriger Lösungen (z.B. [Ga(OH)4] - ) große „Überspannung“ von H2 an Ga, In, Tl Eigenschaften: Ga – Fp = 29,8°C (!), Kp 2400°C Passivierung durch Ga2O3 silberweiß, weich In – silberweiß, sehr weich Tl – weißglänzend, läuft an Luft grau an mit O2-hältigem Wasser langsam TlOH leicht löslich in HNO3, schlecht löslich in HCl (TlCl ) und H2SO4 (Tl2SO4 ) grüne Flammenfärbung Tl und Verbindungen giftig !!! Verwendung: Ga, In, Tl Verbindungen: Al Ga In Tl > Stabilität der Oxidationsstufe +I nimmt zu > basischer Charakter nimmt zu Ga: wichtigste Oxidationsstufe +III Ga(III)-Verbindungen ähnlich Al(III) Ga(OH)3 amphoter + OH - [Ga(OH)4] – Ga2O3 GaX3 (X = F, Cl, Br, I) GaAs – Halbleiter Ga(I) In: Ga(I)-Vbdgn. durch Komproportionierung z.B. 4 Ga + Ga2O3 3 Ga2O auch GaCl, GaBr, GaI In(III) stabiler als In(I); In(I) in wässriger Lösung nicht stabil In(III)-Verbindungen ähnlich Al(III), Ga(III) In(I) In(OH)3 basischer als Ga(OH)3, aber immer noch amphoter + OH - [In(OH)6] 3– 700°C In2O3 In2O + O2 auch InCl, InBr, InI; in wässriger Lösung Disproportionierung Ga, In, Tl Tl: Tl(I) stabiler als Tl(III) Tl(I)-Verbindungen ähnlich Alkalimetall- bzw. Ag-Verbindungen TlOH – starke Base! 800°C Tl2O3 Tl2O + O2 Tl2(SO4)3 – wichtigstes Tl(III)-Salz Tl I3 = Tl+ (I3- ) Tl-Verbindungen sehr giftig !!











