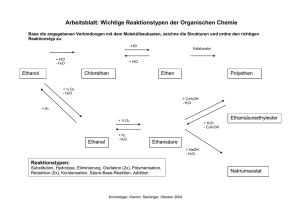
ppt - ChidS
Werbung

Metalloxide Experimentalvortrag AC WS 2007/08 Angela Herrmann Gliederung 1. Allgemeines 2. Darstellung 3. Verwendung 4. Schulrelevanz 2 1. Allgemeines 4 1. Allgemeines Natürliches Vorkommen: • Magnetit (Fe3O4), Roteisenstein (Fe2O3) • Pyrolusit (MnO2), Hausmannit (Mn3O4) Roteisenstein • Rutil (TiO2) • Massicotit (PbO) Pyrolusit • Cuprit (Cu2O) Cuprit • Tonerde (Al2O3) • Zinnstein (SnO2) Saphir 5 1. Allgemeines Eigenschaften: • Sehr unterschiedlich • Manche Metalloxide reagieren in wässriger Lösung basisch: CaO (s) + H2O Ca(OH)2 (s) Ca2+(aq) + 2 OH-(aq) • Metalle der Nebengruppen können verschiedene Oxide ausbilden, aufgrund der Oxidationsstufen +1 +2 Bsp.: CuO2 und CuO 6 1. Allgemeines Versuch 1 Deutschlandfahne - chemisch 7 1. Allgemeines Versuch1 Versuch 1: Deutschlandfahne - chemisch Blei(IV) wird durch das Erhitzen stufenweise reduziert: +4 • Stufe I: 3 PbO2 (s) schwarz +2/+4 • Stufe II: 2 Pb3O4 (s) +2/+4 Pb3O4 (s) + O2 (g) ↑ rot +2 6 PbO (s) + O2 (g) ↑ gelb 8 1. Allgemeines Versuch 1 Bleioxide und ihre Verwendung Pb3O4 (Mennige) • Orangerot bis leuchtend rot • Früher als Rostschutzmittel (Anstrich von Schiffen) verwendet Mennige 9 1. Allgemeines PbO (Bleiglätte): • Gelb • Für Bleigläser • Früher auch als Farbe verwendet Massicotit (PbO) PbO2: • Schwarzbraun • Bleiakkumulator • Früher in Streichholzzündköpfen 10 2. Darstellung 2. Darstellung Darstellungsarten: 1. Thermische Zersetzung von Carbonaten 2. Aus den Metallen mit Hilfe von Oxidationsmitteln 3. Aus Metallsalzen 4. Durch Reinigung natürlicher vorkommender Metalloxide 5. Aus den Metallen durch Verbrennung an der Luft 6. Durch Entwässern der Hydroxide 12 1. Allgemeines 1. Darstellung aus Carbonaten: • Durch Erhitzen von Ca(CO3) (Kalk) erhält man CaO (gebrannter Kalk): Ca(CO3) (s) • CaO (s) + CO2 (s) Reaktion in Wasser zu Ca(OH)2 (gelöschter Kalk): CaO (s) + H2O Ca(OH)2 (s) 13 1. Allgemeines • Gelöschter Kalk wird für Luftmörtel verwendet: Sand, Ca(OH)2 und Wasser werden gemischt • Ca(OH)2 reagiert mit dem Luft-Kohlendioxid zum Carbonat: Ca(OH)2 (aq) + CO2 (g) Ca(CO3) (s) + H2O 14 1. Allgemeines Demo 1 Luftmörtel 15 2. Darstellung 2. Darstellung aus Metallen mit Oxidationsmitteln: Versuch 2 Berger Mischung 16 2. Darstellung Versuch 2 Reaktionsgleichungen: Startreaktion: NH4Cl (s) + H2O 0 +1 Zn (s) + 2 H3O+ (aq) NH3 (g) + H3O+(aq) + Cl-(aq) +2 +1 0 Zn2+(aq + 2 H2O + H2 (g) ↑ ∆H << 0 17 2. Darstellung Versuch 2 Hauptreaktionen: 0 +2 Oxidation 1: Zn (s) Zn2+(aq) + 2 e- -3 Oxidation 2: 2 NH4+(aq) 0 N2 (g) + 8 H+(aq) + 6 e- +5 Reduktion: 2 NO3-(aq) + 10 e- Gesamt: Zn (s) + NH4(NO3) (aq) 0 N2 (g) + 6 O2- Komproportionierung ZnO (s) + N2 (g) + 4 H2O 18 2. Darstellung Demo 2 Wunderkerzen 19 2. Darstellung Demo 2 Reaktionsgleichungen: • Bariumnitrat dient als Oxidationsmittel/Sauerstofflieferant +5 -2 0 • 2 Ba(NO3)2 (s) 0 2 BaO (s) + 2 N2 (g) + 5 O2 (g) • Die Metalle verbrennen mit Sauerstoff zu den entsprechenden Oxiden: 0 0 • 4 Al (s) + 3 O2 (g) 0 0 • 2 Mg (s) + O2 (g) +3 -2 2 Al2O3 (s) +2 (Eisen analog) -2 2 MgO (s) 20 2. Darstellung 3. Aus Metallsalzen: Versuch 3 Chemischer Vulkan Kilauea-Ausbruch 1983 21 2. Darstellung Versuch 3 Reaktionsgleichungen: -3 Oxidation: 2 NH4+ +6 Reduktion: Cr2O72- + 6 e- Gesamt: (NH4)2Cr2O7 (s) 0 N2 + 8 H+ + 6 e+3 Cr2O3 + 4 O2- Cr2O3 (s) + N2 (g) + 4 H2O 22 2. Darstellung Feuerwerk: • Diese Darstellungen sind sehr exotherm • Nutzt man für Feuerwerk aus • Metalloxide werden dabei auch selbst als Oxidationsmittel verwendet (z.B. CuO; früher auch PbO2) 23 2. Darstellungsarten Geschichtliches zum Feuerwerk: • Anfänge durch Entdeckung des Schießpulvers in China während der Hau-Dynastie (25 – 250 n. Chr.) • In der Sung-Zeit (960 – 1279) gibt es die ersten Raketen • Ende des 13. Jahrhunderts Überlieferung nach Europa • Blütezeit des Feuerwerks in der Barock-Zeit • 1838 erste Feuerwerksfirma in Deutschland 24 2. Darstellung 4. Darstellung von Titandioxid: Sulfat-Verfahren: • Als Ausgangstoff dienen Ilmenit (FeTiO3) oder Titanschlacke • Wird mit konz. Schwefelsäure aufgeschlossen • Zugabe von Eisenschrott (Fe2+) 25 2. Darstellung Fortsetzung: • Nach Abkühlen kristallisiert Eisensulfat aus (FeSO4∙7H2O) • Rest: Eisenfreies Titanylsulfat (TiOSO4 (aq)) • Durch Erhitzen erhält man Titandioxid-Hydrat und verdünnte Schwefelsäure • Im Drehofen entsteht je nach Temperatur Anatas oder Rutil 26 2. Darstellung Chlorid-Verfahren: • Ausgangsstoff: Titanschlacke (verunreinigtes Rutil) • Umsetzung mit Koks und Chlor zu Titanchlorid (TiCl4): TiO2 (s) + 2 C(s) + Cl2 (g) TiCl4 (l) + 2 CO (g) • Reinigung durch Destillation: TiCl4 (l) TiCl4 (g) • Reaktion mit Wasserdampf oder Sauerstoff zu Rutil: TiCl4 (g) + H2O (g) TiO2 (s) + 4 HCl (g) TiCl4 (g) + O2 (g) TiO2 (s) + 2 Cl2 (g) 27 3. Verwendung 3. Verwendung Titandioxid – wo nutzt man es? • • • • • • Anstrichfarbe Zahnpasta Kunststoffe Papier Keramik Salami 29 3. Verwendung Versuch 4 Nachweis von Titandioxid 30 3. Verwendung Versuch 4 Reaktionsgleichungen: • TiO2 (s) + K2S2O7 (s) • TiOSO4 (s) + 5 H2O ∆ TiOSO4 (s) + K2SO4 (s) [Ti(OH)2(H2O)4]2+(aq) + SO42-(aq) • [Ti(OH)2(H2O)4]2+(aq) + H2O2 (aq) [Ti(O2)(OH)(H2O)3]+(aq) + 2 H2O + H+ (aq) orangegelb 31 3. Verwendung Versuch 4 Titanperoxokomplex: + O O HO H2O Ti OH2 H2O 32 3. Verwendung Versuch 5 Aluminothermie 33 3. Verwendung Versuch 5 Aufbau: Wunderkerze umwickelt mit Mg-Band BaO2 & Mg-Pulver Fe2O3 & Al-Grieß Filterpapier 34 2. Darstellung Versuch 5 Reaktionsgleichungen: 0 Oxidation: +3 Al3+ + 3 e- Al (s) +3 0 Reduktion: Fe3+ + 3 e- Fe (s) Gesamt: Al (s) + Fe2O3 (s) Fe (s) + Al2O3 (s) Die Mischung aus Bariumperoxid und Magnesium dient als Zündung: -1 0 BaO2 (s) + Mg (s) -2 +2 -2 BaO (s) + MgO (s) ∆H << 0 35 3. Verwendung Geschichtliches: • Erfinder der Aluminothermie war Hans Goldschmidt (1861-1923) Hans Goldschmidt • Entwickelte das Verfahren weiter um Schienenstränge zu verschweißen (Thermitschweißverfahren) 36 3. Verwendung • Bei der Patentanmeldung (1895): Patentbeamter: „Sehen Sie, Herr Doktor, Sie zünden das Gemisch an und es brennt weiter, das ist doch keine Erfindung; wenn Sie eine Zigarre anzünden, brennt sie auch weiter.“ Goldschmidt: „Nur kann man mit einer brennenden Zigarre keine Schienen schweißen.“ 37 3. Verwendung Industrielle Eisendarstellung • Großtechnisch wird Eisen im Hochofenprozess aus Eisen(III)oxid dargestellt • Dabei wird Eisen(III)oxid durch Kohlenstoff reduziert Arbeiter vor flüssigem Eisen 38 Aufbauschema eines Hochofens 39 3. Verwendung Reaktionsgleichungen des Hochofenprozess: +3 400 °C: 700 °C: +2/+3 +4 3 Fe2O3 (s) + CO (g) 2 Fe3O4 (s) + CO2 (g) +2/+3 +2 +2 Fe3O4 (s) + CO (g) 0 1200 °C: +2 FeO (s) + CO2 (g) +4 +2 C (s) + CO2 (g) +2 +2 FeO (s) + CO (g) 0 +4 0 1600-2300 °C: 2 C (s) + O2 (g) 2 CO (g) 0 +4 Fe (l) + CO2 (g) +2 -2 2 CO (g) 40 3. Verwendung Stromquellen: • Primärelement: Strom durch Redoxreaktion der Elektrodensubstanzen – keine Aufladung möglich • Sekundärelement: Strom durch Redoxreaktion der Elektrodensubstanzen – Aufladung möglich • Brennstoffzelle: Der Brennstoff wird den Elektroden kontinuierlich zugeführt 41 3. Verwendung Geschichte der Batterie: • Schon bei Ägyptern (ca. 2300 v. Chr.) und Parthern (ca. 250 v. Chr.) vorhanden? „Bagdad-Batterie“ • 1800: Volta baut die „Voltasche Säule“ Voltasche Säule 42 3. Verwendung • 1802: „Rittersche Säule“ – erster Akkumulator Johann Wilhelm Ritter • 1836: Daniell-Element – Nutzung für Telegrafen • 1860: Entwickelt Leclanché die Zink-Braunstein-Zelle – wird später zur Trockenzelle weiterentwickelt 43 3. Verwendung Ein Primärelement Versuch 6 Leclanché-Element Georges Leclanché 44 Aufbau eines Leclanché-Elements: Abdichtung Kohlestift Mangandioxid Zink Elektrolyt NH4Cl 45 3. Verwendung Versuch 6 Kathode (Graphitelektrode): +4 +3 2 MnO2 (s) + 2 H2O + 2 e- 2 MnO(OH) (s) + 2 OH- Anode (Zinkblech): 0 Zn (s) +2 Zn2+(aq) + 2 e- Elektrolyt (NH4Cl): 2 NH4Cl (aq) + 2 OH- + Zn2+(aq) Zn(NH3)2Cl2 (s) + 2 H2O Gesamt: 2 MnO2 (s) + Zn (s) + 2 NH4Cl (aq) 2 MnO(OH) (s) + Zn(NH3)2Cl2 (s) 46 3. Verwendung Sekundärelement – der Bleiakkumulator • 1859 von Planté entwickelt • Verwendung als Autobatterie • Blei- und Bleidioxidelektrode • Elektrolyt: 20 %-ige Schwefelsäure • Ladungszustand kann durch Dichtemessung ermittelt werden 47 3. Verwendung Reaktionen des Bleiakkumulators: Negative Elektrode: 0 Pb (s) + SO4-(aq) +2 PbSO4 (s) + 2 e- Positive Elektrode: +4 +2 PbO2 (s) + SO4-(aq) 4 H3O+(aq) + 2 eGesamt: Pb (s) + PbO2 (s) + 2 H2SO4 (aq) PbSO4 (s) + 2 H2O Entladung Ladung 2 PbSO4 (s) + 2 H2O 48 3. Verwendung Glas: • Hauptbestandteil: SiO2 – bildet Netzwerk mit [SiO4]Tetraedern (Nahordnung) • Basische Oxide (wie Na2O, K2O, CaO) bilden Trennstellen (Trennstellenbildner) • Al2O3, B2O3 sind Netzwerkbildner • Metalloxide der Nebengruppen sorgen für die Färbung von Glas 49 3. Verwendung Demo 3 Demo 3 Farbiges Glas Rosettenfenster in Carcassonne 50 3. Verwendung Demo 3 • Oxidfärbung Beimischung Metalloxid FeO CoO MnO2 Fe2O3 CuO Cr2O3 Farbe Grün Blau Violett Gelbbraun Blaugrün Smaragdgrün 51 3. Verwendung Demo 3 • Anlauffärbung durch kolloidale Metalle (z.B. Rubinglas mit Gold) Pokal aus Rubinglas • Milchglas durch Einlagerung kleiner fester Teilchen (z.B. SnO2) Tasse aus Milchglas 52 4. Schulrelevanz 4. Schulrelevanz Lehrplan (Hessen G8): • G7.2: – Reaktionen von Metallen (und Nichtmetallen) mit Luft (Sauerstoff) – Umkehrung der Oxidbildung – Metallgewinnung aus Erzen • G8.1: – Oxidationszahlen • G10.1: – Redoxreaktionen – Elektrochemische Spannungsquellen 54 Vielen Dank! 55