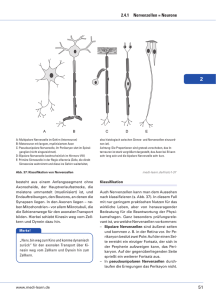
Ausgedehnte und fokale Hirnentwicklungs
Werbung

GESELLSCHAFTSNACHRICHTEN SCHWERPUNKT NEUROLOGIE IN ÖSTERREICH KONGRESSHIGHLIGHTS FÜR DIE PRAXIS Ausgedehnte und fokale Hirnentwicklungsstörungen als Ursache kindlicher Epilepsien Mit modernsten Imaging-Verfahren lässt sich bei ca. 25–40 % der Kinder und Jugendlichen mit therapieresistenter Epilepsie eine ausgedehnte oder auch umschriebene Malformation des zerebralen Kortex nachweisen. Das Spektrum der erkennbaren Pathologien umfasst ätiologisch äußerst unterschiedliche Krankheitsbilder, welche zusammengenommen die häufigste Ursache schwer behandelbarer Epilepsieformen und kognitiver Entwicklungsverzögerung im Kindesalter darstellen. Die derzeit bestmögliche Therapiestrategie ist die frühzeitige epilepsiechirurgische Evaluierung an einem spezialisierten Zentrum. H Hirnentwicklungsstörungen werden mehr und mehr als Ursache therapieresistenter Epilepsieformen im Kindes- und Jugendalter anerkannt. In ca. 25–40 % der Fälle lassen sich mit modernsten Neuroimaging-Verfahren Malformationen des zerebralen Kortex nachweisen1. Das Spektrum umfasst unterschiedliche Veränderungen im kindlichen Gehirn, die mit Aufbaustörungen in der kortikalen Schichtung und fehlentwickelten neuronalen Zellformen einhergehen. Vor nicht allzu langer Zeit wurden all diese Pathologien unter dem Decknamen „Migrationsstörung“ zusammengefasst. Nach heutigem Stand des Wissens handelt es sich allerdings nicht nur um Störungen der neuronalen Migration, sondern um ganz unterschiedliche Pathomechanismen, die in verschiedene, zeitlich abhängige Stadien der Hirnentwicklung eingreifen und daher Defekte in der Ausreifung des Gehirns setzen2. Ätiologie Trotz zahlreicher neuer Erkenntnisse in den letzten Jahren bleibt die Ätiologie der meis- ten Störungen jedoch nach wie vor ungeklärt. Die Fortschritte lassen sich in erster Linie als spezifische genetische Defekte definieren. Prinzipiell sind Hirnfehlbildungen als Ursachen für eine schwer behandelbare Epilepsie seit 200 Jahren bekannt. Allerdings hat erst die Ära der hochauflösenden Magnetresonanztomographie (MRT) den tatsächlichen Durchbruch zur besseren Korrelation zwischen bildgebenden Verfahren, neurologischen Funktionsausfällen, Entwicklungsrückständen und elektro-klinischen Daten gebracht3. In diesem Zusammenhang haben zahlreiche Arbeiten in den letzten Jahren gezeigt, dass aberrante neuronale Netzwerke innerhalb einer kortikalen Fehlbildung epileptogen sind. Diese scheinen jedoch auch in unmittelbarer Kommunikation mit dem funktionell zugehörigen oder anatomisch umgebenden intakten Neokortex zu stehen4. Diese teilweise sehr umschriebenen Veränderungen lassen sich nur Dr. Angelika Mühlebner-Fahrngruber Universitätsklinik für Kinder- und Jugendheilkunde, Abteilung für Neonatologie, pädiatrische Intensivmedizin und Neuropädiatrie, Medizinische Universität Wien schwer mittels Bildgebung detektieren und werden vielfach als kryptogen eingestuft. Die allerdings äußerst schwer behandelbare Epilepsie sowie die häufig damit verbundenen komorbiden Störungen wie kognitive Entwicklungsverzögerung oder psychiatrische Krankheitsbilder lassen mehr und mehr an eine Hirnentwicklungsstörung denken. Aus diesem Grund werden zunehmend auch Kinder einer prächirurgischen Abklärung unterzogen, um weitere neurologische Ausfälle zu verhindern und Verbesserungen in der neurokognitiven Entwicklung zu erzielen. Diese Zunahme an epilepsiechirurgischen Eingriffen v. a. im Kindesalter hat ein reges Interesse an dem nunmehr verfügbaren Tab.: Das ILAE-Klassifikationsschema FCD-Typ I (isoliert) FCD Ia: gestörte radiäre Laminierung FCD-Typ II (isoliert) FCD IIa: mit dysmorphen Neuronen FCD-Typ III (assoziiert mit einer anderen Läsion) FCD IIIa: kortikale Laminierungsstörung im Temporallappen bei Hippokampus-sklerose FCD Ib: gestörte tangenziale Laminierung FCD Ic: Kombination aus Ia und Ib FCD IIb: dysmorphe Neurone und Ballonzellen FCD IIIb: kortikale FCD IIIc: kortikale LamiLaminierungsstörung in nierungsstörung bei vasZusammenhang mit glia- kulären Malformationen len und glioneuronalen Tumoren FCD IIId: kortikale Laminierungsstörung in Zusammenhang mit einer anderen Läsion, z. B. Infarkt adaptiert von Blümcke I et al.10 16 Abb. 1: FCD-Varianten nach der neuen ILAE-Klassifikation Gehirngewebe ausgelöst. Auch hier konnte in den letzten Jahren ein großer Fortschritt im Hinblick auf Klassifikation und Pathomechanismen der damit verbundenen Epilepsieformen gemacht werden. Bis jetzt ist die genaue Inzidenz der kortikalen Entwicklungsstörungen unbekannt. An großen epilepsiechirurgischen Zentren konnte allerdings eine Zunahme der diagnostisch gesicherten Hirnfehlbildungen verzeichnet werden, welche in erster Linie auf die verfeinerte Diagnostik zurückzuführen ist5–8. Klassifikation In den letzten Jahren wurden verschiedenste Klassifikationsschemata zur Einteilung von Hirnentwicklungsstörungen publiziert. Aus diesem Grund ist bis jetzt keine einheitliche Nomenklatur für alle Veränderungen vorhanden. Ganz im Gegenteil, die derzeit verwendeten Diagnosen können sich von Zentrum zu Zentrum unterscheiden. Als gemeinsamer Nenner ließ sich herausarbeiten, dass schwere Fehlbildungen im Gehirn zu profunden Entwicklungsstörungen beim Kind und zum frühen Auftreten von schweren Epilepsieformen führen, wohingegen eher mildere Varianten nach dem ersten Anfall in jeder Altersgruppe bei sonst neurologisch gesunden Personen entdeckt werden können1, 4. Die Einbeziehung elektro-klinischer, genetischer und bildgebender Daten hat zu einer Übersichtsarbeit aller Hirnentwicklungsstörungen9 sowie zu einer Ad-hoc-Taskforce der Internationalen Liga gegen Epilepsie (ILAE) zur Klassifikation der häufigsten operativ zugänglichen Fehlbildungen geführt – den fokalen kortikalen Dysplasien (FCD)10. FCD Die Bezeichnung „fokale kortikale Dysplasie“ wurde erstmals 1971 von Taylor et al. verwendet. In den chirurgisch entfernten Resektaten von 10 EpilepsiepatientInnen wurden „große dysmorphe Nervenzellen“ und „groteske blasse, nicht eindeutig zuzuordnende Zellformen“ im Rindenband und im subkortikalen Marklager beschrieben11. Weiters fiel den Autoren die Ähnlichkeit mit den im tuberösen Sklerosekomplex (TSC) vorkommenden Läsionen auf11. Seit dieser detaillierten A. Normaler Neokortex (Nissl-LFB). B. Säulchenbildung durch kleine Nervenzellen in einer FCD-Typ Ia (Nissl-LFB). C. Abnorme horizontale, kortikale Schichtung mit fehlender Schicht 4 in einer FCD-Typ Ib (Nissl-LFB). D. FCD-Typ IIa mit aufgehobener Rindenarchitektur und zahlreichen dysmorphen Nervenzellen (Nissl-LFB). E. FCD-Typ IIb mit einem deutlich gestörten Rindenaufbau, dysmorphen Nervenzellen und Ballonzellen (Nissl-LFB). F. Neuronale Cluster in der Schicht 2 als typisches Merkmal einer FCD-Typ IIIa (Nissl-LFB). G. Neokortex abseits eines glioneuronalen Tumors mit Säulchenstruktur, jedoch ohne Tumorinfiltration (Nissl-LFB). H. Rindenarchitekturstörung bei einem Patienten mit Sturge-Weber-Syndrom (Nissl-LFB). I. Fehlerhafte Laminierung nach einem peripartalen Mediainsult (Nissl-LFB). J. MRT eines Patienten mit rechts-frontaler FCD. K. Dysmorphe Nervenzelle als typisches Merkmal der FCD-Typen IIa und IIb (HE). L. Ballonzelle als Charakteristikum der FCD-Typ Ib. Der Balken in E und I repräsentiert 500 µm und gilt auch für A, B, C, D, F, G und H. Der Balken in L zeigt 50 µm und gilt auch für K. Nissl-LFB = Nissl-luxol fast blue; HE = Hämatoxilin und Eosin Beschreibung erweiterte sich das neuropathologische Spektrum um zahlreiche Neuzugänge direkt proportional zur Zunahme epilepsiechirurgischer Eingriffe. In diesem Zusammenhang wurde immer wieder versucht, alle Veränderungen in eine allgemeingültige Klassifikation zu bringen7, 9, 12, 13. Die am meisten verwendete wurde 2004 von Palmini et al. als Konsensusklassifikation publiziert13. Leider war es damit nicht möglich, klare Aussagen in Bezug auf klinische Zusammenhänge zu tätigen. Ein Grund dafür lag in der unklaren Definition der einzelnen Typen. Die daraus resultierenden Daten zur Anfallsfreiheit nach epilepsie- chirurgischen Eingriffen schwankten zwischen 20 % und 80 %6, 10, 14, 15. Um neue Erkenntnisse in Bezug auf prächirurgische Abklärung und postoperative Anfallsfreiheit zu erlangen, schloss sich kürzlich eine Taskforce der ILAE zusammen und beschloss eine neue Konsensusklassifikation16, welche strikt isolierte FCD von assoziierten trennt. Sie ist in 3 Typen unterteilt (Tab.): • Der Typ I kennzeichnet kortikale Laminierungsstörungen (Aufhebung der 6 regulären Kortexschichten) in Form von vertikaler Säulenbildung (FCD-Typ Ia) oder horizontaler Verlust einzelner Schichten (FCD-Typ Ib) oder eine Mischung aus beidem (FCD-Typ Ic). 17 GESELLSCHAFTSNACHRICHTEN SCHWERPUNKT NEUROLOGIE IN ÖSTERREICH Abb. 2: MRT-Beispiele unterschiedlicher Hirnentwicklungsstörungen KONGRESSHIGHLIGHTS FÜR DIE PRAXIS • FCD-Typ II basiert auf der alten Beschreibung von Taylor et al. und ist im Wesentlichen ident mit der von Palmini et al.11, 13. FCD-Typ IIa beinhaltet eine schwere Störung der Rindenarchitektur mit Einlagerung dysmorpher Nervenzellen und bei FCD-Typ IIb sind zusätzlich Ballonzellen eingelagert. • Unter die neu geschaffene Kategorie FCD-Typ III fallen alle Störungen der Rindenarchitektur, die mit einer anderen Läsion gemeinsam auftreten, Hippokampussklerose (FCD-Typ IIIa), Tumor (FCDTyp IIIb), vaskuläre Fehlbildungen (FCDTyp IIIc) und andere Läsionen, die im frühen Kindesalter auftreten können, z. B. Infarkte und Entzündungen (FCD-Typ IIId). Die verschiedenen histologischen Bilder sind in Abbildung 1 dargestellt. Die Definition klarer histopathologischer Kriterien und gute klinisch-pathologische Zusammenarbeit stellen die nächsten Schritte zur besseren Behandlung von EpilepsiepatientInnen mit FCD dar17. Hemimegalenzephalie Hemimegalenzephalie ist eine seltene Hirnentwicklungsstörung, welche durch eine deutliche Vergrößerung und Rindenarchitekturstörung einer Hirnhemisphäre definiert wird. In den meisten beschriebenen Fällen zeichnet sie sich klinisch durch einen massiven Entwicklungsrückstand, neurologische Defizite und eine äußerst schwer behandelbare Epilepsie in den ersten Lebensmonaten aus18–22. Die primäre Diagnosestellung erfolgt klinisch-radiologisch. Die Erfolge mittels Epilepsiechirurgie (z. B. funktionelle Hemisphärotomie) sind eher bescheiden23. Im neuropathologischen Spektrum sind sämtliche Veränderungen wie Rindenarchitekturstörung, dysmorphe Nervenzellen und auch Ballonzellen nachweisbar (Abb. 2A). Lissenzephalie A. Koronares und axiales MRT-Bild eines 9 Jahre alten Mädchens mit klassischer DCX-Mutation und Ausbildung bilateraler subkortikaler Bandheterotopien (siehe Pfeilspitzen). B. Axiale MRT-Bilder auf unterschiedlicher Höhe eines 6-jährigen Jungen mit linksseitiger Hemimegalenzephalie (siehe Pfeilspitzen). C. Rechtsseitige Polymikrogyrie mit kleinen irregulär geformten Gyri (siehe Pfeilspitzen) eines 5 Jahre alten Jungen. 18 Eine gestörte Hirnentwicklung kann durch aberrante Proliferation, Differenzierung und Migration neuronaler Vorläuferzellen hervorgerufen werden. Der letzte Punkt führt of- fensichtlich zu fehlerhafter Lokalisation von Nervenzellen und fehlender kortikaler Laminierung13. Ist die Auswanderung unreifer Nervenzellen in allen Bereichen derart gestört, dass sich eine komplett glatte Hirnoberfläche ausbildet, dann bezeichnet man diese Art der Fehlbildung als Lissenzephalie24. Eine klassische Lissenzephalie hat eine Prävalenz von 11,7/ 1 Mio. Geburten25. Die Anzahl an milderen Formen ist unklar. Bei einer normalen Hirnentwicklung lässt sich eine agyre Hirnoberfläche bis zur 11. Schwangerschaftswoche nachweisen. Danach bilden sich Gyri aus, beginnend bei der Sylvischen Furche. Die Gyrierung ist normalerweise in der 32. Schwangerschaftswoche abgeschlossen. Somit ergibt sich ein Zeitfenster von der 11. bis 13. Schwangerschaftswoche für die Bildung lissenzephaler Störungen. Im Wesentlichen handelt es sich um eine genetische Erkrankung, die mit Mutationen auf zwei verschiedenen Genen einhergeht: das erste ist Doublecortin (DCX) auf dem X-Chromosom und das zweite LIS1 auf Chromosom 1726, 27. Mutationen im DCXGen verursachen eine klassische Lissenzephalie (XLIS) bei hemizygoten Buben sowie subkortikale Bandheterotopien bei heterozygoten Mädchen28 (Abb. 2B). Buben sind also schwerer betroffen als Mädchen, es ist mit schwerer neurokognitiver Entwicklungsverzögerung und therapieresistenter Epilepsie zu rechnen. DCX ist ein mikrotubuliassoziiertes Protein, welches für die Stabilität im Zytoskelett zur neuronalen Migration und Reifung verantwortlich ist29. Heterozygote Deletionen im Bereich des Chromosoms 17p13 (LIS1) führen ebenfalls zur Lissenzephalie und zwar zum klassischen Miller-Dieker-Syndrom, welches auch Gesichtsdysmorphien beinhaltet. Es ist außerdem mit einer deutlich reduzierten Lebenserwartung zu rechnen. Eine weitere Form der Lissenzephalie beruht auf einer Mutation im Reelin-Gen (RELN)30. In diesem Fall ist die Hirnoberfläche nicht zur Gänze glatt, sondern pflastersteinartig von konfluierenden Mikrogyri durchbrochen. Der Ausdruck „Heterotopien“ umfasst die Ansammlung von großen Mengen an Nervenzellen in der tiefen, weißen Substanz. Je nach Lokalisation und Verteilung der Neurone unterscheidet man drei verschiedene Arten: • lose Nervenzellen innerhalb der weißen Substanz, Unter Polymikrogyrie versteht man die Ausbildung einer großen Anzahl kleiner irregulär konfigurierter Gyri, welche eine an sich vergröberte Hirnoberfläche hinterlässt. Polymikrogyrie kann alle Lappen des Hirns gleichermaßen betreffen und ist mit einem weiten Spektrum an klinischen Erscheinungsbildern assoziiert. Diese reichen von einer schweren epileptischen Enzephalopathie bis hin zu milden fokal-neurologischen Defiziten. In Tiermodellen konnte gezeigt werden, dass funktionelle Defizite über die eigentliche Läsion hinausgehen31, 32. Aus diesem Grund sollte ein epilepsiechirurgischer Eingriff in ausreichendem Ausmaß geplant werden, da die alleinige Entfernung des polymikrogyren Areals meist nicht ausreichend ist, um eine adäquate Anfallsreduktion bzw. -freiheit zu ¢ erzielen33, 34 (Abb. 2C). 1 12 23 Guerrini R, Sicca F, Parmeggiani L, Epilepsy and malformations of the cerebral cortex. Epileptic Disord 2003; 5 Suppl 2:S9–26 2 Aronica E, Becker AJ, Spreafico R, Malformations of cortical development. Brain Pathol 2012; 22(3):380–401 3 Kuzniecky RI, Neuroimaging of epilepsy: therapeutic implications. NeuroRx 2005; 2(2):384–93 4 Guerrini R, Dobyns WB, Barkovich AJ, Abnormal development of the human cerebral cortex: genetics, functional consequences and treatment options. Trends Neurosci 2008; 31(3):154–62 5 Frater JL et al., Surgical pathologic findings of extratemporal-based intractable epilepsy: a study of 133 consecutive resections. Arch Pathol Lab Med 2000; 124(4):545–9. 6 Lerner JT et al., Assessment and surgical outcomes for mild type I and severe type II cortical dysplasia: a critical review and the UCLA experience. Epilepsia 2009; 50(6):1310–35. 7 Tassi L et al., Focal cortical dysplasia: neuropathological subtypes, EEG, neuroimaging and surgical outcome. Brain, 2002; 125(Pt 8):1719–32. 8 Wolf HK et al., Surgical pathology of temporal lobe epilepsy. Experience with 216 cases. J Neuropathol Exp Neurol 1993; 52(5):499–506. 9 Barkovich AJ et al., A developmental and genetic classification for malformations of cortical development. Neurology 2005; 65(12):1873–87. 10 Blümcke I et al., The clinicopathologic spectrum of focal cortical dysplasias: a consensus classification proposed by an ad hoc Task Force of the ILAE Diagnostic Methods Commission. Epilepsia 2011; 52(1):158–74. 11 Taylor DC et al., Focal dysplasia of the cerebral cortex in epilepsy. J Neurol Neurosurg Psychiatry 1971; 34(4):369–87. Heterotopien Mischel PS, Nguyen LP, Vinters HV, Cerebral cortical dysplasia associated with pediatric epilepsy. Review of neuropathologic features and proposal for a grading system. J Neuropathol Exp Neurol 1995; 54(2):137–53. 13 Palmini A et al., Terminology and classification of the cortical dysplasias. Neurology 2004; 62(6 Suppl 3):S2–8. 14 Krsek P et al., Different presurgical characteristics and seizure outcomes in children with focal cortical dysplasia type I or II. Epilepsia 2009; 50(1):125–37. 15 Spreafico R, Blümcke I, Focal Cortical Dysplasias: clinical implication of neuropathological classification systems. Acta Neuropathol 2010; 120(3):p.359–67. 16 Blümcke I, Spreafico R, An international consensus classification for focal cortical dysplasias. Lancet Neurol 2011; 10(1):26–7. 17 Muhlebner A et al., Neuropathologic measurements in focal cortical dysplasias: validation of the ILAE 2011 classification system and diagnostic implications for MRI. Acta Neuropathol 2012; 123(2):259–72. 18 Janszky J et al., Functional organization of the brain with malformations of cortical development. Ann Neurol 2003; 53(6):759–67. 19 Sanghvi JP, Rajadhyaksha SB, Ursekar M, Spectrum of congenital CNS malformations in pediatric epilepsy. Indian Pediatr 2004; 41(8):831–8. 20 Sasaki M et al., Clinical aspects of hemimegalencephaly by means of a nationwide survey. J Child Neurol 2005; 20(4):337–41. 21 Tinkle BT et al., Epidemiology of hemimegalencephaly: a case series and review. Am J Med Genet A 2005; 139(3):204–11. 22 Trounce JQ, Rutter N, Mellor DH, Hemimegalencephaly: diagnosis and treatment. Dev Med Child Neurol 1991; 33(3):261–6. • knotenförmige Ansammlungen von Neuronen, • bandförmiger Zusammenschluss. Alle drei Arten können über weite Strecken im kindlichen Gehirn vorhanden sein, was den operativen Zugang dieser Fehlbildungen erschwert. Polymikrogyrie Jonas R et al., Cerebral hemispherectomy: hospital course, seizure, developmental, language, and motor outcomes. Neurology 2004; 62(10):1712–21. 24 Walsh CA, Genetics of neuronal migration in the cerebral cortex. Ment Retard Dev Disabil Res Rev 2000; 6(1):34–40. 25 De Rijk-van Andel JF et al., Epidemiology of lissencephaly type I. Neuroepidemiology 1991; 10(4):200–4. 26 Gleeson JG, Walsh CA, Neuronal migration disorders: from genetic diseases to developmental mechanisms. Trends Neurosci 2000; 23(8):352–9. 27 Stefan H et al., Epilepsy outcomes in elderly treated with topiramate. Acta Neurol Scand 2008; 118(3):164–74. 28 Dobyns WB et al., Differences in the gyral pattern distinguish chromosome 17-linked and X-linked lissencephaly. Neurology 1999; 53(2):270–7. 29 Horesh D et al., Doublecortin, a stabilizer of microtubules. Hum Mol Genet 1999; 8(9):1599–610. 30 Hong SE et al., Autosomal recessive lissencephaly with cerebellar hypoplasia is associated with human RELN mutations. Nat Genet 2000; 26(1):93–6. 31 Jacobs KM, Hwang BJ, Prince DA, Focal epileptogenesis in a rat model of polymicrogyria. J Neurophysiol 1999; 81(1):159–73. 32 Redecker C et al., Differential downregulation of GABAA receptor subunits in widespread brain regions in the freeze-lesion model of focal cortical malformations. J Neurosci 2000; 20(13):5045–53. 33 Sisodiya SM, Surgery for malformations of cortical development causing epilepsy. Brain 2000; 123 (Pt 6):1075–91. 34 Sisodiya SM, Malformations of cortical development: burdens and insights from important causes of human epilepsy. Lancet Neurol 2004; 3(1):29–38. 19