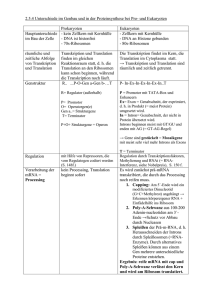
E. coli
Werbung
Regulation! des ! Metabolismus ! und...! Bakterielle Viren = Bacteriophagen ! Überblick! Transkription! Translation ! posttranslational ! ! ! !langsam (min)! !langsam (min)! !schnell (≤ sec) Überblick! Transkription! ! !langsam (min)! !Repression & Induktion durch DNA-Bindeproteine! !negative Kontrolle - Repressor! !positive Kontrolle - Aktivator! !Operon vs. Regulon! Translation ! ! !langsam (min)! posttranslational ! !schnell (≤ sec)! !kovalente & nicht-kovalente Enzymhemmung! ! ! !(Rückkopplung) Induction of the maltose operon in E. coli Positive control (Maltose) In E. coli , the genes required for maltose utilization are spread out over the Chromosome, each of which is regulated by the mal-activator protein (REGULON) Globale Regulationsmechanismen! = Reaktion auf veränderte Umweltbedingungen !betrifft Regulation vieler verschiedener Gene! ! Bsp:! ! wenn E.coli mehrere Zucker gleichzeitig als C-Quelle zur ! Verfügung hat, wird Glucose immer zuerst verbraucht! ! reguliert durch Katabolitrepression:! verhindert Synthese von katabolischen Enzymen, die zur! Glucoseverwertung unnötig sind! ! bei anderen Organismen andere Zucker von primärer Bedeutung! Sinn der Katabolitrepression:! beste C- und Energie-Quelle wird zuerst verbraucht Katabolitrepression! Effekt: Diauxie! 2 exponentielle Wachstums-! phasen bei 2 C-Quellen! ! ß-Gal-Synthese von ! Katabolitrepression reguliert! ! Katabolitrepression! Mechanismus:! RNA-Polymerase bindet nur dann an DNA, wenn ! Katabolitaktivatorprotein (CAP) zuerst gebunden hat! ! CAP = allosterisches Protein, bindet DNA nur in Gegenwart von! !cAMP! ! Glucose hemmt cAMP-Synthese und stimuliert cAMP-Transport! aus der Zelle! ! Regulation betrifft lac-Operon, mal-Regulon, und! andere katabolische Operons in E. coli! ! Cyclic AMP Synthesis from ATP by adenylatecyclase adenylate cyclase ATP cAMP + PPi Model of the interaction of cAMP-binding protein with DNA Positive control mechanism cAMP C-α trace CAP controls 7 E. coli operons. CAP binds to DNA only if it has first bound cAMP Overall regulation of the lactose operon Transkript – 35 Sequenz Pribnow-Box negative Kontrolle durch lac-Repressor, aufgehoben durch ! !Lactose! positive Kontrolle durch CAP, ausgelöst durch cAMP! Die stringente Antwort! Übergang von aa-Überschuss zu aa-Mangel:! ! Stop der Synthese von rRNA & tRNA! !keine Ribosomenneusynthese, keine Translation! ! !hemmt Proteinbiosynthese & DNA-Synthese! !aktiviert aa-Biosynthese! ! reguliert durch Guanosintetraphosphat ppGpp! ! !und Guanosinpentaphosphat pppGpp! ! Die stringente Antwort! Guanosine tetraphosphate (ppGpp/pppGpp) Guanosintetraphosphat ppGpp und ! Guanosinpentaphosphat pppGpp (Alarmone)! ! akkumulieren bei aa-Mangel! ! gebildet von RelA! Die stringente Antwort! Bindung nichtbeladener tRNA an translatierende Ribosomen führt zur Alarmon-Synthese durch RelA! Die stringente Antwort! Weitere globale Kontrollsysteme in E.coli! TABLE 8.1 A few of the global control systems known in Escherichia colia System Signal Primary activity Number of regulatory protein of genes regulated Aerobic respiration Presence of O2 Repressor (ArcA) 50+ Anaerobic respiration Lack of O2 Activator (FNR) 70 + Catabolite repression Cyclic AMP concentration Activator (CAP) 300+ Heat shock Temperature 36 Nitrogen utilization NH3 limitation Oxidative stress SOS response Oxidizing agent Damaged DNA Alternative sigma (!32) Activator (NRI) / alternative sigma (!54) Activator (OxyR) Repressor (LexA) 12+ 30+ 20+ Weitere globale Kontrollsysteme in E.coli! Operon! Regulon! ! globale Kontrollsysteme bewirken Regulation von mehr als! einem Regulon! ! Modulon: Gengruppe, die vom gleichen regulatorischen Protein! ! reguliert wird, aber zu verschiedenen Regulons! ! gehört! ! Stimulon: Gengruppe, die auf das gleiche Umweltsignal reagiert ! ! ! Weitere globale Kontrollsysteme in E.coli:! alternative Sigma Faktoren! Sigma Faktor = Untereinheit der RNA Polymerase, die für ! ! ! Promotorerkennung verantwortlich ist! Konzentration in der Zelle reguliert durch Transkription/Translation! !und Abbau ! Aktivität reguliert durch Anti-Sigma-Faktoren! Weitere globale Kontrollsysteme in E.coli:! Hitzeschockantwort! Sigma Faktor 32 instabil, t1/2 = 30 sec! T Anstieg hemmt Sigma Faktor 32 Abbau! hohe [Sigma Faktor 32] aktiviert Transkription von! !Hitzeschockgenen! ! Hitzeschockproteine:! !auch induziert durch Chemikalien & Strahlung! !3 Hauptklassen in E.coli: Hsp70, Hsp60, Hsp10! !DnaK = Hsp70; verhindert Proteinaggregation! !GroEL, GroES = Hsp60 & Hsp10, ! ! ! ! propagieren Proteinfaltung! !ausserdem Proteasen, die denaturierte Protein abbauen! !meist hoch konserviert! bei T-Senkung inaktiviert DnaK Sigma 32! Weitere globale Kontrollsysteme in E.coli:! Kälteschockantwort! ausgelöst durch verlangsamte Proteinbiosynthese! ! Kälteschockproteine: ! !Helicasen, Nucleasen, ribosomengebun-! !dene Proteine, reduzieren Synthese von Makromolekülen! !! ausserdem: Synthese kompatibler löslicher Stoffe als! ! ! !Gefrierschutz! Quorum Sensing! = regulatorische Wege, die von der Dichte der Zellen der ! eigenen Art kontrolliert werden! ! stellt sicher, dass eine ausreichende Mengen Zellen einer ! Spezies vorliegt, bevor eine bestimmte biologische Antwort! ausgelöst wird! ! verbreitet bei gram- Bakterien! ! Mechanismus:! Zellen synthetisieren und sezernieren ! !acyliertes Homoserinlacton (AHL)! Konzentration in der Umgebung nur dann hoch, wenn viele! !Zellen AHL ausscheiden! hohe [AHL] führt zur Bindung an Transkriptionaktivator für! !spezifische Gene! Quorum Sensing! Virulence factors (e.g.toxins) Biofilm formation Bioluminescence Quorum Sensing! Bioluminescent Vibrio fischeri producing luciferase Quorum Sensing: andere Beispiele! Krankheitserreger: ! ! !Pseudomonas aeruginosa! Quorum sensing führt zu Wachstum als Biofilm auf sezernierten! Polysacchariden; steigert Pathogenität & verhindert eindringen! von Antibiotika! ! !Staphylococcus aureus! sezerniert Peptide, die Wirtszellen schädigen & Immunsystem! ! auch in Archaea! Attenuation! Regulation durch Kontrolle der Transkription nach deren Initiation! d.h. kontrolliert wird die Anzahl vollständiger Transkripte! ! häufig aa-Biosynthese in gram- Bakterien! ! Bsp: Tryptophan Operon in E.coli! ! Promoter & Operator für negative Kontrolle durch Rückkopplung! ! zusätzlich am 5’ Beginn des Operons: Leadersequenz! ! kodiert Leaderpeptid, das 2 Trp Codons enthält & als Attenuator! !wirkt! Attenuation: Bsp Trp Operon! stop Translated leader sequence + Trp: Leaderpeptid wird synthetisiert, Transkription des! !restlichen Operons terminiert! - Trp: Leaderpeptid wird nicht synthetisiert, Transkription des! restlichen Operons findet statt! Attenuation: Mechanismus -i! in Prokaryoten finden Transkription & Translation gleichzeitig statt! Attenuation findet statt, wenn die mRNA einen stem-loop bilden! !kann, der mit der RNA-Polymerase interferiert! ! Attenuation: Mechanismus -ii! in Prokaryoten finden Transkription & Translation gleichzeitig statt.! Attenuation findet nicht statt, wenn die mRNA einen stem-loop bildet, der nicht mit der RNA-Polymerase interferiert! ! Attenuation: Mechanismus! in Prokaryoten finden Transkription & Translation gleichzeitig! !statt! Attenuation findet nur statt, wenn die mRNA einen stem-loop !bildet, der mit der RNA-Polymerase interferiert! ! Attenuation: andere Beispiele! Leader peptides of other operons coding for amino acid synthesis Isoleucin Attenuation: the movie! Signaltransduktion ! = Weiterleitung von Signalen aus der Umwelt in der Zelle über Sensor in der Cytoplasmamembran an regulatorische ! Maschinerie in der Zelle! ! meist 2-Komponenten-Systeme:! Sensorkinase in der Zellmembran + Response-Regulatorprotein! ! Sensorkinase:! hochkonserviert! detektiert Umweltsignal! Autophosphorylierung an His! Übertragung des Phosphats auf Response-Regulator! ! Response-Regulator:! DNA-Bindeprotein, das Transkription reguliert! Signaltransduktion ! Regulation über Rückkopplung beteiligt: Phophatase, die Response-Regulator dephosphoryliert! ! die Sensorkinase kann auch Phosphatase-Aktivität haben;! alternativ Dephosphorylierung durch zusätzliches Protein! ! Dephosphorylierung läuft mit konstanter Geschwindigkeit! langsamer als Phosphorylierung! konstitutiv! Signaltransduktion: 2-Komponenten-System ! (O2, pH, T, light, nutrients, cells) 1 autokatalytisch Repressor 2 Beispiele für 2-Komponenten-Systeme ! TABLE 8.3 Some two-component regulatory systems from Escherichia coli that regulate transcription System Environmental Sensor Response Activity of response signal kinase regulator regulatora Arc System O2 ArcB ArcA Repressor/Activator Nitrate and Nitrate and NarX and NarL Activator/Repressor nitrite nitrite NarQ anaerobic NarP Activator/Repressor regulation(Nar) Nitrogen NH4+ NRII, the NRI, the Activates RNA utilization (Ntr) product of product of polymerase at glnL glnG promoters requiring !54. Pho regulon Inorganic PhoR PhoB Activator phosphate Porin Osmotic EnvZ OmpR Activator/Repressor regulation pessure In E. coli ~ 50 different two-component systems few in Archaea none in bacterial parasites also in microbial eukaryotes (S. cerevisiae) Regulation der Chemotaxis ! Detektion von temporären Konzentrationsänderungen,! nicht von absoluter Konzentration! ! Detektion mit 2-Komponenten-System! ! Output verändert Flagellenbewegung! ! 1) Reaktion auf ein Signal:! Sensorproteine in der Zellmembran ! (Methyl-Akzeptor-Chemotaxisproteine, MCPs; 5 in E.coli)! binden an Chemoattractant/Repellant, direkt oder indirekt! !interagieren mit cytoplasmatischer Sensorkinase CheA! !Autophosphorylierung von CheA! !CheA-P phosphoryliert Response-Regulatoren! ! !CheY (schnell) und CheB (langsam)! Regulation der Chemotaxis ! 1) Reaktion auf ein Signal:! Sensorproteine in der Zellmembran ! binden an Chemoattractant/Repellant! !interagieren mit cytoplasmatischer Sensorkinase CheA! !Autophosphorylierung von CheA ! (- durch attractants, + repellants)! !CheA-P phosphoryliert Response-Regulatoren! ! !CheY (schnell) und CheB (langsam)! ! 2) Kontrolle der Flagellenrotation:! !CCW = vorwärts, CW = Taumeln! !CheY-P interagiert mit dem Flagellenmotor, bewirkt Taumeln! CheZ dephosphoryliert CheY-P! ! ! Regulation der Chemotaxis ! 3) Anpassung:! Sensorproteine in der Zellmembran ! (Methyl-Akzeptor-Chemotaxisproteine, MCPs)! werden durch CheR methyliert (langsam, konstitutiv)! !CheB-P = Demethylase! !Methylierung beeinflusst Konformation von MCPs &! ! !steuert Anpassung! ! [Attractant] = hoch! ![CheA-P] [CheY-P] [CheB-P] = niedrig! Zelle schwimmt vorwärts! Methylierung der MCPs nimmt zu, Reaktion auf Attractant ab! !dadurch nimmt CheA-P, CheB-P zu! Zelle beginnt zu taumeln! !MCPs durch CheB-P demethyliert, Sensitivität nimmt zu ! !etc.! Regulation der Chemotaxis ! Picture?! Regulatorische RNAs ! Regulation durch kleine RNAs (sRNAs)! 40-400 Nukleotide! 1. sRNA im Signalerkennungspartikel! 2. sRNAs binden an mRNA durch komplementäre Basenpaarung = Antisense-RNAs, verhindern Translation, Abbau der mRNA! ! Antisense-RNAs sRNAs ~40-400 nucleotides long Regulatorische RNAs ! Regulation durch kleine RNAs (sRNAs)! 40-400 Nukleotide! 1. sRNA im Signalerkennungspartikel! 2. sRNAs binden an mRNA durch komplementäre Basenpaarung = Antisense-RNAs, verhindern Translation, Abbau der mRNA! 3. Riboswitches:! am 5’-Ende von mRNAs! können kleine Moleküle binden Bindung verhindert Translation! != Rückkopplungsmechanismus, z.B. in der Thiamin-Synthese! ! Regulatory RNAs: riboswitches (Vitamine) Thus far riboswitches have only been found in some bacteria and a few fungi and plants. Bakterielle Viren ! φRsG1 Viruses infecting a cell of Rhodobacter sphaeroides Duchrow, M., G. W. Kohring and F. Giffhorn. 1985. Virulence as a consequence of genome instability of a novel temperate bacteriophage RsG1, of Rhodobacter sphaeroides Arch. Microbiol. 142, 141-147. Virus Klassifikation 1. Anhand der Wirtszellen: Bakterien, Pflanze, Tier 2. Anhand des Genoms im Viruspartikel (Virion) 3. Es gibt ein formales System der Virusklassifikation, das Viren in verschiedene Taxa einordnet (Ordnungen, Familien, Gattung/Art) Virusfamilien haben das Suffix –viridae (Polioviridae) Reverse Transcriptase Schematic representation of the main types of bacterial viruses The nucleocapsid of φ6 is surrounded by a membrane Determination of phage titers! EM counts of viruses are higher than plaque-forming units ! Bacteriophagen ! 2 prinzipielle Lebenszyklen:! ! virulent: lysieren Wirte nach Infektion! ! temperent: Phagengenom wird zusammen mit Wirtsgenom! ! ! !repliziert, ohne den Wirt zu töten! Replikationszyklus ! virulenter Phage! Phagen: 20-60 min! Animal viruses: 8-40 h! ! Virulente Bacteriophagen, Bsp T4! > 25 Strukturproteine! ds DNA Genom! ringförmig permutiert, d.h. lineare DNA wird verpackt, ! entstanden durch Öffnung eines Rings, an verschiedenen Stellen! am Ende der DNA: 3-6 kb terminale Wiederholungssequenzen! ! Replikation:! zuerst Replikation injizierter, linearer DNA, dann! Concatemerbildung durch Rekombination an den Enden! Verpackung durch Schneiden mit Endonuclease! “ein Kopf voll” DNA wird verpackt! ! Virulente Bacteriophagen, Bsp T4! Restriktionsenzyme T-even phages protect their DNA from restriction by glycosylation! 5-hydroxymethylcytosine is unique in the DNA of T-even bacteriophages of E. coli! Glykosylierung von Hydroxymethylcytosin verhindert! Schneiden durch Wirts-Endonucleasen! Virulente Bacteriophagen, Bsp T4! Zeitverlauf einer in T4 Infektion ! Temperente Bacteriophagen! Lysogenie:! ! die meisten Virusgene werden nicht exprimiert! Virusgenom (‘Prophage’) wird mit Wirtsgenom repliziert und an! !Tochterzellen weitergegeben! unter spezifischen Bedingungen wird Virusbildung induziert! ! Lysogene sind immun gegen Infektion vom selben Phagentyp! Temperente ! Bacteriophagen! Temperente Bacteriophagen, Bsp Lambda! Electron micrograph of the E. coli phage lambda Head diameter ~ 65 nm