Glossar Atombau
Werbung
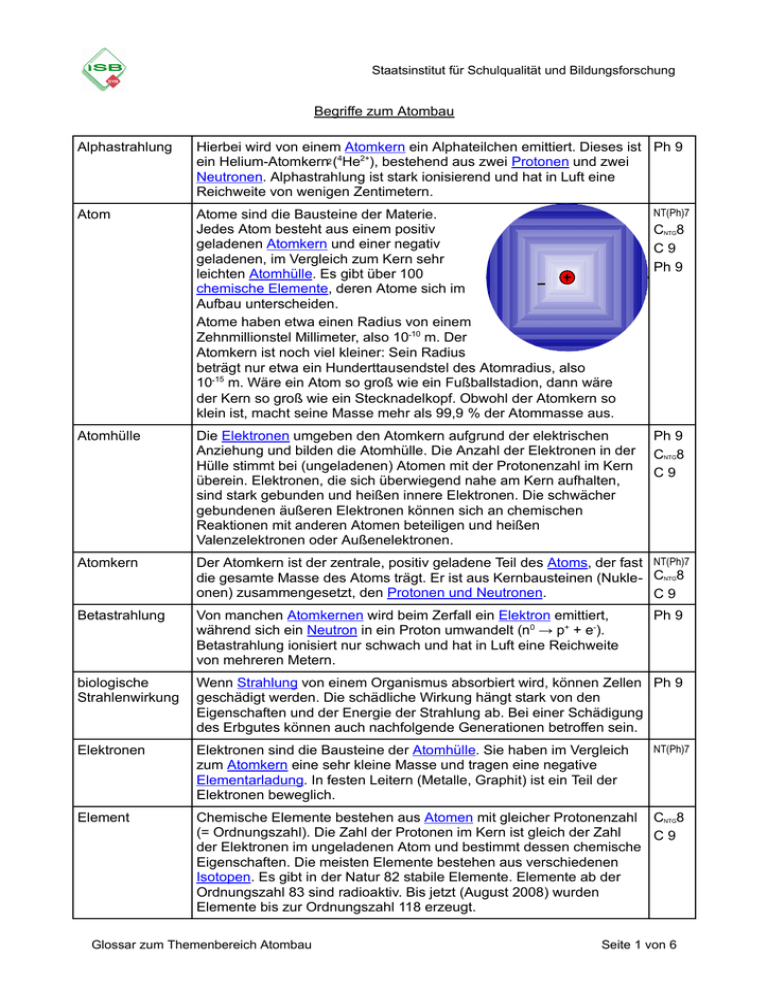
Staatsinstitut für Schulqualität und Bildungsforschung Begriffe zum Atombau Alphastrahlung Hierbei wird von einem Atomkern ein Alphateilchen emittiert. Dieses ist Ph 9 ein Helium-Atomkern2 (4He2+), bestehend aus zwei Protonen und zwei Neutronen. Alphastrahlung ist stark ionisierend und hat in Luft eine Reichweite von wenigen Zentimetern. Atom Atome sind die Bausteine der Materie. Jedes Atom besteht aus einem positiv geladenen Atomkern und einer negativ geladenen, im Vergleich zum Kern sehr leichten Atomhülle. Es gibt über 100 chemische Elemente, deren Atome sich im Aufbau unterscheiden. Atome haben etwa einen Radius von einem Zehnmillionstel Millimeter, also 1010 m. Der Atomkern ist noch viel kleiner: Sein Radius beträgt nur etwa ein Hunderttausendstel des Atomradius, also 1015 m. Wäre ein Atom so groß wie ein Fußballstadion, dann wäre der Kern so groß wie ein Stecknadelkopf. Obwohl der Atomkern so klein ist, macht seine Masse mehr als 99,9 % der Atommasse aus. NT(Ph)7 Atomhülle Die Elektronen umgeben den Atomkern aufgrund der elektrischen Anziehung und bilden die Atomhülle. Die Anzahl der Elektronen in der Hülle stimmt bei (ungeladenen) Atomen mit der Protonenzahl im Kern überein. Elektronen, die sich überwiegend nahe am Kern aufhalten, sind stark gebunden und heißen innere Elektronen. Die schwächer gebundenen äußeren Elektronen können sich an chemischen Reaktionen mit anderen Atomen beteiligen und heißen Valenzelektronen oder Außenelektronen. Ph 9 CNTG8 C9 Atomkern Der Atomkern ist der zentrale, positiv geladene Teil des Atoms, der fast NT(Ph)7 die gesamte Masse des Atoms trägt. Er ist aus Kernbausteinen (Nukle- CNTG8 onen) zusammengesetzt, den Protonen und Neutronen. C9 Betastrahlung Von manchen Atomkernen wird beim Zerfall ein Elektron emittiert, während sich ein Neutron in ein Proton umwandelt (n0 → p+ + e-). Betastrahlung ionisiert nur schwach und hat in Luft eine Reichweite von mehreren Metern. biologische Strahlenwirkung Wenn Strahlung von einem Organismus absorbiert wird, können Zellen Ph 9 geschädigt werden. Die schädliche Wirkung hängt stark von den Eigenschaften und der Energie der Strahlung ab. Bei einer Schädigung des Erbgutes können auch nachfolgende Generationen betroffen sein. Elektronen Elektronen sind die Bausteine der Atomhülle. Sie haben im Vergleich zum Atomkern eine sehr kleine Masse und tragen eine negative Elementarladung. In festen Leitern (Metalle, Graphit) ist ein Teil der Elektronen beweglich. Element Chemische Elemente bestehen aus Atomen mit gleicher Protonenzahl CNTG8 (= Ordnungszahl). Die Zahl der Protonen im Kern ist gleich der Zahl C9 der Elektronen im ungeladenen Atom und bestimmt dessen chemische Eigenschaften. Die meisten Elemente bestehen aus verschiedenen Isotopen. Es gibt in der Natur 82 stabile Elemente. Elemente ab der Ordnungszahl 83 sind radioaktiv. Bis jetzt (August 2008) wurden Elemente bis zur Ordnungszahl 118 erzeugt. Glossar zum Themenbereich Atombau CNTG8 C9 Ph 9 Ph 9 NT(Ph)7 Seite 1 von 6 Elementarladung Die Elementarladung e ist der kleinste Betrag der Ladung, die ein freies Teilchen tragen kann. Die Ladung jedes Teilchens und jedes Körpers ist stets ein ganzzahliges Vielfaches der Elementarladung. Ihr Wert ist e = 0,00000000000000000016022 As = 1,6022·10-19 As. Typische Träger einer Elementarladung sind das Elektron (eine negative Elementarladung) und das Proton (eine positive Elementarladung). Ph 8 CNTG8 C9 Energieaufnahme/-abgabe Ein Atom kann Energie aufnehmen und wieder abgeben. Der Betrag der Energieänderung kann aber nicht jeden beliebigen Wert annehmen, sondern nur einzelne, für das jeweilige System (z. B. ein einzelnes Atom) charakteristische Werte, die durch den Energieunterschied E zwischen den angeregter Zustand beteiligten Energiestufen bestimmt sind. Deshalb treten im Spektrum der Strahlung EnergieEnergienur Photonen aufnahme abgabe bestimmter Energiewerte auf. Es wird ein diskretes Spektrum Grundzustand (Linienspektrum) erzeugt. Erklärung nach dem Energiestufenmodell (Schalenmodell): Bei der Anregung, z. B. in einer Gasbrennerflamme, können Elektronen der Atomhülle auf energetisch höhere Schalen wechseln. Beim Zurückfallen auf eine Schale niedrigerer Energie werden Photonen abgegeben, deren Energie genau dem Energieunterschied zwischen den beiden Schalen entspricht. Nach steigender Energiedifferenz ist das Infrarotstrahlung, sichtbares Licht oder UVStrahlung. Wenn stark beschleunigte Elektronen auf Metallatome treffen, können sie Elektronen aus den inneren Schalen herausschlagen. Die dadurch entstehenden Lücken werden durch Elektronen aus weiter außen liegenden Schalen aufgefüllt, wobei sehr kurzwellige Strahlung entsteht, so genannte Röntgenstrahlung. Ph 9 CNTG8 C9 Energiebilanz, E = m·c² Nach Einsteins berühmter Formel E = m·c² sind Masse und Energie äquivalent. Bei Kernumwandlungen (z. B. Fusion, Spaltung, Zerfall) werden besonders große Energiebeträge frei. Dabei beobachtet man, dass die Gesamtmasse der Teilchen nach der Reaktion kleiner ist als vor der Reaktion. Beispiel: Bei der Fusion von vier Wasserstoffatomen entsteht ein Helium-Atom, dessen Masse etwa um 0,7 % kleiner ist als die Summe der Massen der vier Wasserstoffatome. Die der Massendifferenz entsprechende Energie wird freigesetzt. Ph 9 Glossar zum Themenbereich Atombau Seite 2 von 6 Energiestufenmodell (Schalenmodell) Die Elektronen in der Atomhülle befinden sich auf bestimmten CNTG8 Energiestufen (Energieniveaus). Diese Energiestufen werden auch als C9 „Schalen“ bezeichnet. Nach steigender Energie sind dies die K-, L-, M-, N-, O-, P- und Q-Schale. Beispiel: Elektronenanordnung (Elektronenkonfiguration) eines Natrium-Atoms (die Besetzung der Energiestufen erfolgt im Grundzustand in der Reihenfolge zunehmender Energie): E M-Schale L-Schale K-Schale Gammastrahlung Alpha- und Betastrahlung werden oft von der Emission energiereicher Ph 9 Photonen (Gammaquanten) begleitet. Diese Gammastrahlung unterscheidet sich nur durch ihren Entstehungsprozess und ihre Photonenenergie von Licht und Röntgenstrahlung. Sie besitzt eine sehr große Reichweite und ionisiert nur schwach. Halbwertszeit Die Halbwertszeit eines Nuklids gibt an, nach welcher Zeit von einer ursprünglich vorhandenen großen Anzahl von Atomen die Hälfte zerfallen ist. Beispiel: Das Cäsiumisotop 137Cs besitzt eine Halbwertszeit von 30 Jahren. Nach 30 Jahren ist noch die Hälfte, nach 60 Jahren ein Viertel der Cäsiumatome übrig. Die anderen haben sich inzwischen durch radioaktiven Zerfall in Bariumatome umgewandelt. Ph 9 Ion Ionen sind elektrisch geladene Teilchen, die aus Atomen oder Molekülen durch Aufnahme oder Abgabe von Elektronen entstehen können. Man unterscheidet zwischen Kationen und Anionen. Kationen sind positiv geladene Teilchen, da sie über weniger Elektronen als Protonen verfügen. Anionen sind negativ geladene Teilchen, da sie über mehr Elektronen als Protonen verfügen. NT(Ph)7 Isotop Atome, welche die gleiche Protonenzahl aufweisen und sich lediglich in Ph 9 der Neutronenzahl unterscheiden, verhalten sich chemisch gleich. Man bezeichnet sie als Isotope eines chemischen Elementes. Beispiel: 35Cl und 37Cl sind die beiden stabilen Isotope von Chlor. 35 Cl ist ein Nuklid mit 17 Protonen (Chlor: Ordnungszahl 17) und 18 Neutronen. Das Nuklid 37Cl hat ebenfalls 17 Protonen, aber 20 Neutronen. Glossar zum Themenbereich Atombau CNTG8 C9 Seite 3 von 6 Kernfusion Bringt man zwei leichte Atomkerne (die nur wenige Protonen und Ph 9 Neutronen enthalten) dazu, sich zu berühren, so können sie zu einem neuen Atomkern verschmelzen. Bei solchen Fusionsvorgängen wird ein im Vergleich zu chemischen Umwandlungen millionenfach größerer Energiebetrag frei. Die Sonne bezieht ihre Energie aus der in mehreren Schritten ablaufenden Fusion von Wasserstoffkernen zu Heliumkernen. Kernspaltung Atomkerne, die besonders viele Protonen und Neutronen enthalten, Ph 9 werden durch Absorption (Aufnahme) eines Neutrons instabil und zerfallen in zwei Bruchstücke. Bei diesem Prozess werden zwei bis drei Neutronen freigesetzt, die weitere Kerne spalten können (Kettenreaktion). Bei Spaltprozessen wird ein ähnlich hoher Energiebetrag wie bei der Kernfusion frei. Dies wird in Kernkraftwerken genutzt. Leicht spaltbar sind bestimmte Isotope von Uran und Plutonium. Molekül Ein Molekül ist ein Verband von Atomen, die durch chemische CNTG8 Bindungen (Elektronenpaarbindung) zusammengehalten werden. C9 Beispiele sind das Wasserstoffmolekül H2 (bestehend aus zwei Wasserstoffatomen) und das Wassermolekül H2O (bestehend aus zwei Wasserstoffatomen und einem Sauerstoffatom). Nuklid Ein Nuklid ist eine durch die Angabe der Protonenzahl (bzw. des chemischen Symbols) und der Massenzahl festgelegte Atomsorte. Gelegentlich wird der Begriff „Nuklid“ auch nur für eine Sorte von Atomkernen verwendet. Beispiel: 19F ist ein Nuklid mit 9 Protonen (Fluor: Ordnungszahl 9) und 10 Neutronen. Ph 9 Orbital Als Orbital bezeichnet man vereinfacht den Aufenthaltsraum, in dem ein Elektron oder Elektronenpaar eines Atoms mit einer hohen Wahrscheinlichkeit anzutreffen ist. CNTG8 C9 Ordnungszahl (Z) Zahl der Protonen in den Atomkernen eines Elements (Protonenzahl, Kernladungszahl) Periodensystem der Elemente (PSE) Auflistung der Elemente nach steigender Ordnungszahl, bei der Elemente mit gleicher Valenzelektronenzahl untereinander in Gruppen zusammengefasst werden. Nebeneinander stehende Elemente gehören einer Periode an. Die Periodennummer entspricht der Anzahl der Energiestufen eines Atoms dieser Periode. CNTG8 C9 CNTG8 C9 Ausschnitt aus dem (gekürzten) PSE: Periode Gruppe I II III IV V VI VII VIII 3 (M) H Li Na Be Mg B Al C Si N P O S F Cl He Ne Ar … … … … … … … … … 1 (K) 2 (L) Glossar zum Themenbereich Atombau Seite 4 von 6 Photon Durch elektromagnetische Strahlung wird Energie stets nur portionsweise übertragen. Eine solche Strahlungsportion wird als Photon bezeichnet. Die verschiedenen Bereiche der elektromagnetischen Strahlung unterscheiden sich durch ihre Photonenenergie: Ph 9 zunehmende Photonenenergie infrarotes Licht sichtbares Licht UV-Licht Röntgenstrahlung Gammastrahlung Beispiel: Die Photonenenergie von UV-Licht reicht aus, um Hautzellen zu schädigen. Deshalb kann UV-Licht einen Sonnenbrand auslösen, im Gegensatz zu sichtbarem Licht. Proton, Neutron Atomkerne bestehen aus Protonen und Neutronen (Sammelbegriff dieser Kernbausteine: Nukleonen). Ein Proton trägt eine positive Elementarladung, Neutronen sind elektrisch neutral. Protonen und Neutronen haben jeweils etwa die Masse 1 u (atomare Masseneinheit 1 u = 1,66 10 –27 kg). Die Summe aus Protonen- und Neutronenzahl heißt Massenzahl des Atoms. Protonen und Neutronen sind ihrerseits aus noch elementareren Bausteinen aufgebaut, den Quarks. Quarks Protonen und Neutronen sind ihrerseits aus elementaren Teilchen Ph 9 aufgebaut, die als Quarks bezeichnet werden. Sie tragen die Ladungen 2 /3 e (up-Quark) und 1/3 e (down-Quark), treten aber in gewöhnlicher Materie nur in Dreiergruppen auf, so dass sich ganzzahlige Vielfache der Elementarladung ergeben. Die Existenz dieser TeilProton Neutron chen wurde in Experimenten nachgewiesen, bei e denen man zum Beispiel + e Protonen mit sehr schnellen + e + e Elektronen beschoss und die Verteilung der gestreu e e ten Elektronen untersuchte. Radioaktivität, Zerfall Bestimmte Atomkerne zerfallen spontan, d. h. sie wandeln sich ohne Ph 9 Einwirkung von außen in andere Atomkerne um und senden dabei Strahlung aus. Diese Erscheinung heißt Radioaktivität. Je nach Art der emittierten Teilchen unterscheidet man Alpha-, Beta- und Gammastrahlung. Glossar zum Themenbereich Atombau CNTG 8 C9 Ph 9 Seite 5 von 6 Spektrum Wird elektromagnetische Strahlung durch eine geeignete Vorrichtung Ph 9 (bei Licht: z. B. Prisma) nach der Photonenenergie aufgetrennt, so ergibt sich ein Spektrum der Strahlung. Spektren werden oft als Diagramme dargestellt, bei denen die Intensität gegen die Photonenenergie aufgetragen ist. Jede Strahlungsquelle erzeugt ein charakteristisches Spektrum (Emissionsspektrum). Das Spektrum einer Glühlampe ist kontinuierlich, d. h. in einem breiten Bereich kommen alle Photonenenergien vor. Andere Strahlungsquellen (z. B. Gasentladungslampen) erzeugen ein Linienspektrum, d. h., es sind nur einzelne (diskrete) Photonenenergien vertreten. kontinuierliches Spektrum Intensität Photonenenergie Strahlenschutzmaßnahmen Intensität Photonenenergie Um sich vor Strahlenschäden zu schützen, sollte man folgende Grundregeln beim Umgang mit gefährlicher Strahlung beachten: - Strahlenquelle (radioaktives Präparat) nicht in den Körper aufnehmen, also nicht verschlucken oder einatmen. - Abstand halten. - Strahlung, wenn unvermeidbar, nur kurze Zeit einwirken lassen. - Strahlung Linienspektrum Ph 9 Abschirmung verwenden. Manche Körper bzw. deren Atome senden Energie in Form von Strahlung aus. Strahlung kann bestehen aus Ph 9 - materiellen Teilchen wie Heliumatomkernen (Alphastrahlung) oder Elektronen (Betastrahlung). - Photonen: Sichtbares, Infrarot- oder UV-Licht, aber auch Röntgenund Gammastrahlung fallen in diese Kategorie. Diese Photonenstrahlung nennt man auch elektromagnetische Strahlung. Valenzelektronen Als Valenzelektronen (Außenelektronen) bezeichnet man die (bis zu 8) CNTG 8 Elektronen der höchsten Energiestufe eines Atoms. Sie können sich an C 9 chemischen Reaktionen beteiligen. Glossar zum Themenbereich Atombau Seite 6 von 6











