Vorlesung 17 Umwandlung von Alkoholen in Ester (Vollhardt, 3. Aufl
Werbung
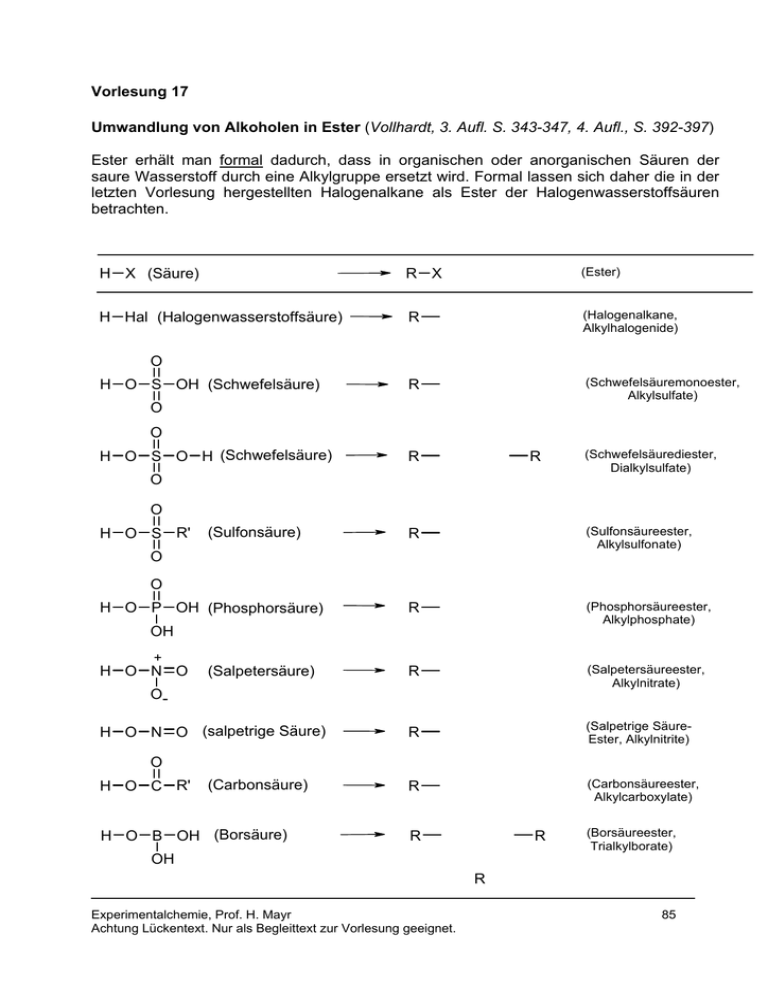
Vorlesung 17 Umwandlung von Alkoholen in Ester (Vollhardt, 3. Aufl. S. 343-347, 4. Aufl., S. 392-397) Ester erhält man formal dadurch, dass in organischen oder anorganischen Säuren der saure Wasserstoff durch eine Alkylgruppe ersetzt wird. Formal lassen sich daher die in der letzten Vorlesung hergestellten Halogenalkane als Ester der Halogenwasserstoffsäuren betrachten. H X (Säure) R X (Ester) H Hal (Halogenwasserstoffsäure) R (Halogenalkane, Alkylhalogenide) R (Schwefelsäuremonoester, Alkylsulfate) O H O S OH (Schwefelsäure) O O H O S O H (Schwefelsäure) R R O (Schwefelsäurediester, Dialkylsulfate) O H O S R' (Sulfonsäure) R (Sulfonsäureester, Alkylsulfonate) R (Phosphorsäureester, Alkylphosphate) R (Salpetersäureester, Alkylnitrate) R (Salpetrige SäureEster, Alkylnitrite) R (Carbonsäureester, Alkylcarboxylate) O O H O P OH (Phosphorsäure) OH + H O N O (Salpetersäure) OH O N O (salpetrige Säure) O H O C R' (Carbonsäure) H O B OH (Borsäure) R R OH (Borsäureester, Trialkylborate) R Experimentalchemie, Prof. H. Mayr Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 85 Das auf die Herstellung von Bromalkanen angewandte Syntheseprinzip R OH + H X [H2SO4] R X + H2O lässt sich auch auf die Herstellung anderer Ester anwenden, z. B. Schwefelsäureester, Salpetersäureester, Ester der salpetrigen Säure, Carbonsäureester, Borsäureester. Salpetersäureester: Glycerintrinitrat (Trivialname: Nitroglycerin); Bekannter Sprengstoff H2C OH HC OH + 3 HONO2 H2SO4 HC H2C H2C OH Glycerin H2C Salpetersäure Nitroglycerin ist eine farblose, ölige Flüssigkeit, die in kleinen Mengen gefahrlos abbrennt, bei Schlag, Stoß oder rascher Überhitzung aber heftig explodiert, wobei nur gasförmige Produkte entstehen. (CO, CO2, NO2, N2, H2Ogas). Versuch: Detonation von Nitroglycerin bei Schlag Durch Aufsaugen des Nitroglycerins in Kieselgur gewinnt man das gegen Erschütterungen unempfindliche Dynamit (Alfred Nobel, 1886). Sicherheitssprengstoff, der durch Initialzündung zur Detonation gebracht wird. Versuch: Herstellung und Abbrennen von Dynamit Sprengstoffe sind Verbindungen mit folgenden Eigenschaften: 1. Sie zersetzen sich mit hoher Reaktionsgeschwindigkeit 2. Die Zersetzungsreaktion ist stark exotherm 3. Die Reaktionsprodukte sind gasförmig Medizinische Anwendung bei Asthma und Angina pectoris: Gefäßerweiternde Wirkung Ester der salpetrigen Säure Versuch: Herstellung von Ethylnitrit aus Ethanol, Natriumnitrit und Schwefelsäure (Entstehung bei Raumtemperatur) Experimentalchemie, Prof. H. Mayr Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 86 NaNO2 + H2SO4 HNO2 + NaHSO4 H O N O CH3CH2OH + Ester der salpetrigen Säure sind gelb (der Chromophor –N=O absorbiert blaues Licht). Sie wirken gefäßerweiternd. Carbonsäureester werden im Detail später besprochen Borsäureester bilden sich leicht aus Alkohol und Borsäure in Gegenwart von Schwefelsäure. OH 3 H3C OH + B HO H2SO4 OH Herstellung des mit grüner Flamme verbrennenden Borsäuretrimethylesters (Sdp. 68 °C) Versuch: Phosphorsäureester haben im Organismus verschiedene Funktionen (detaillierte Besprechung später) Alkylsulfonate (Sulfonsäureester) sind wichtige Derivate der Alkohole, da bei ihnen die schlechte Abgangsgruppe –OH der Alkohole durch die gute Abgangsgruppe –OSO2R ersetzt ist. O R OH + Cl S CH3 + Base + Base . HCl O primärer p-Toluolsulfonylchlorid oder Abk. TsCl sekundärer Alkohol meist tertiäres Amin z.B. R3NH Cl - Im Gegensatz zu OH sind Sulfonatreste gute Abgangsgruppen und lassen sich in SN2Reaktionen ersetzen. Da bei der oben beschriebenen Herstellungsweise bei Verwendung eines chiralen Alkohohls die Konfiguration erhalten bleibt, lässt sich auf dem Umweg über Alkylsulfonate die OH-Gruppe in Alkoholen unter Konfigurationsumkehr ersetzen. R1 R2 C H OH TsCl Pyridin R1 R2 C O Nu- C H Experimentalchemie, Prof. H. Mayr Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 87 Übung A17-1. Geben Sie ein Verfahren an, um aus cis-3-Methylcyclopentanol selektiv trans-1-Methoxy-3methylcyclopentan herzustellen. Sind die eingesetzten Reagenzien sowie das Produkt chiral? Schwefelsäureester Beim Vermischen von Schwefelsäure mit Ethanol entsteht zuerst der Monoethylester der Schwefelsäure O O H O S O H + H O C CH3 H2 O + H2O H O S O Monoethylester der Schwefelsäure (Trivialname: Ethylschwefelsäure) 2x Diethylester der Schwefelsäure (Diethylsulfat) Erhitzt man den Monoethylester der Schwefelsäure in Vakuum, lässt sich das im Gleichgewicht vorliegende leichtflüchtige Diethylsulfat abdestillieren. Schwefelsäuredimethylester (Dimethylsulfat) ist ein wichtiges technisches Methylierungsmittel. Sehr tückisches Gift, da es geruchlos ist und zunächst keine Wirkung zeigt. Beim Einatmen: Lungenödem (Verätzung der Atemorgane). Dimethylsulfat kann durch die Haut eindringen. Carcinogen. Übung A17-2. Formulieren Sie die Herstellung von Isopropylmethylether unter Verwendung von Dimethylsulfat. Durch Erhitzen von Ethylschwefelsäure wurde 1795 von fünf holländischen Chemikern erstmals Ethylen erhalten (Versuch) O H H O C H HOSO3- C S O HH O H 190 °C Experimentalchemie, Prof. H. Mayr Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 88 Eliminierungen (Vollhardt, 3. Aufl., S. 259-268, 4. Aufl., S. 296-307; Hart, S. 232-237; Buddrus, S. 221-231) Unter Eliminierung versteht man die Entfernung zweier Atome oder Atomgruppen aus einem Molekül. Die Abspaltung erfolgt meist von benachbarten C-Atomen unter Ausbildung einer Doppelbindung (1,2-Eliminierung oder β-Eliminierung) H X 2 1 C C H OH C H + HX Katalytische Dehydratisierung von Ethanol am Al2O3-Kontakt Versuch: H C C C HH Al2O3 + H2O 400°C ΔHo = + 46 kJ mol-1 ΔG0 = ΔH0 – TΔS0 Wegen der positiven Entropie (Zunahme der Teilchenzahl: 1 → 2) wird ΔG0 der endothermen Reaktion bei hohen Temperaturen negativ. Spaltungsreaktionen werden bei hohen Temperaturen begünstigt, deren Umkehr (Additionsreaktionen) bei tiefen Temperaturen. Wie nucleophile Substitutionen laufen auch Eliminierungen nach zwei verschiedenen Mechanismen ab. Am wichtigsten sind die E1- und E2-Mechanismen. Unimolekulare Eliminierungen (E1) verlaufen, wie SN1-Reaktionen, über intermediäre Carbokationen. Die früher besprochenen Faktoren, die SN1-Reaktionen begünstigen, begünstigen auch E1-Reaktionen. Die Reaktion von tert-Butylbromid mit Methanol liefert 80% tert-Butylmethylether und 20% 2-Methyl-propen. (CH3)3C Br H3C H3C SN1 H C C H H E1 Experimentalchemie, Prof. H. Mayr Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 89 Geschwindigkeitsgesetz 1. Ordnung: d [tert-BuBr] dt v = = Bei bimolekularen Eliminierungen (E2) werden CH-Bindung und CX-Bindung gleichzeitig gelöst (anti-Übergangszustand). Sie laufen unter ähnlichen Bedingungen wie SN2Reaktionen ab und werden gegenüber der SN2-Reaktion durch Temperaturerhöhung begünstigt. Video zur E2-Reaktion (Bimolekulare Eliminierung) H H Br C C H H C CH3 CH3 C O - SN 2 An einem tertiären Substrat ist der Rückseiten-Angriff nicht möglich. Daher kommt es bei der Umsetzung von tert-Alkylhalogeniden mit starken Nucleophilen (Basen) zur Eliminierung. Wie SN2-Reaktionen folgen E2-Reaktionen einem Geschwindigkeitsgesetz 2. Ordnung: d [tert-BuBr] v = dt = Durch Verwendung sterisch anspruchsvoller Basen wird die E2-Reaktion gegenüber der SN2-Reaktion begünstigt. H H3C Br C H + - Na O CH2CH3 HH H H H3C + C Br C + C HH K + - EtOH SN2 (91%) E2 (9%) SN2 (15%) E2 (85%) CH3 O C CH3 CH3 tBuOH Übung A17-3. Welche Produkte erwarten Sie beim Erhitzen von Natriummethanolat mit Chlorcyclohexan bzw. 1-Chlor-1-methylcyclohexan? Experimentalchemie, Prof. H. Mayr Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 90 Übung B17-1. Vollhardt, 3. Aufl., S. 277, Nr. 14a, c, f, g, i; 4. Aufl., S. 318, Nr. 40a, c, f, g, i. Übung B17-2. Die E2-Reaktion von trans-1-Brom-4-(1,1-dimethylethyl)cyclohexan und Natriummethoxid verläuft wesentlich langsamer als beim entsprechenden cis-Isomer. Erklären Sie dies! Lösung B17-1: a) Methylencyclopentan c) racem. H3C–CH(OH)–CH2CH3 f) racem. CH3CH2–CI(CH3)–CH2CH2CH3 g) Keine Reaktion außer reversiblem Protonentransfer i) (S) - CH3CH2CH(SH)CH3 Lösung zu B17-2. Br Br H (CH3)3C anti (CH3)3C H In beiden Fällen bevorzugt die 1,1-Dimethylethyl-Gruppe die äquatoriale Stellung. Daher steht im cis-Isomer die Abgangsgruppe anti zu zwei Wasserstoffatomen. Im trans-Isomer nimmt Brom zwangsläufig eine äquatoriale Stellung ein ohne anti-ständige Wasserstoffatome. Damit Eliminierung stattfinden kann, muss das Molekül zunächst seine Konformation ändern, wofür ungefähr 23 kJ/mol aufgebracht werden müssen (Vollhardt, 3. Aufl., Tab. 4-3, S.138, 4. Aufl., S.159) Experimentalchemie, Prof. H. Mayr Achtung Lückentext. Nur als Begleittext zur Vorlesung geeignet. 91
![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)