Allgemeine Grundlagen
Werbung

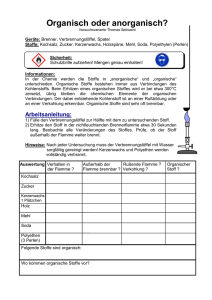
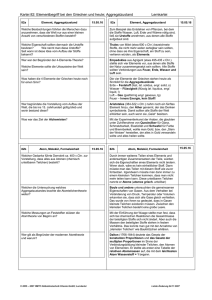
2. Grundbegriffe 2.1 Zum Stoffbegriff 2.1.1 Heterogene Stoffe 2.1.2 Homogene Stoffe 2.2 Zustände und Zustandsänderungen 2.2.1 Die Aggregatzustände 2.2.2 Phasendiagrame einkomponentiger Systeme Stoff Ein Sammelbegriff für Materie mit “gleichen” Eigenschaften abgesehen von Größe und Gestalt. • • • • • • • • • Tonwaren Gold Porzellan Alkohol Schwefel Säuren Rosenwasser Weißer Phosphor Magnesium • • • • • • • • • Stickstoff Sauerstoff Natrium Zink Luft Glaubersalz Kohle Soda Pottasche Einteilung von Stoffen • Heterogene Stoffe Ein Stoff aus mehreren Phasen, d.h. es sind Phasengrenzflächen vorhanden • Homogene Stoffe Einphasiger Stoff, d.h. in sich völlig homogen mit vom Ort unabhängigen Eigenschaften Stoffe Homogene Stoffe Heterogene Stoffe Gestein Phasen (Minerale) Gestein (Granit) Feldspat Biotit Quarz Legierung Phasen (Intermetalle) Legierung (Mg40Pd60) MgPd (50 At.-% Mg) Mg5Pd2 (71.4 At.-% Mg) 0.2 mm Einphasige Stoffe Mg78Pd22 0.05 mm Einphasige Legierung Einkristall Si System Ein System ist ein Teil des Universums, der zur Untersuchung ausgesucht wurde. Der Rest des Universums heißt dann Umgebung. Phase Ein physikalisch homogener und durch eine Oberfläche begrenzter Teil eines Systems. Dieser ist somit vom Rest des Systems mechanisch separierbar. Beispiele für ein- und mehrphasige Stoffe • Einphasige Stoffe – Fest (Eis) – Flüssig (Wasser) – Gasförmig (Wasserdampf) • Mehrphasiges System – Eis/Wasser – Eis/Wasserdampf – Wasser/Wasserdampf – Eis/Wasser/Wasserdampf Die Aggregatzustände gasförmig verdampfen kondensieren sublimieren resublimieren fest flüssig schmelzen erstarren Aufheizkurve von reinem Wasser Temperatur T 100 °C Siedepunkt KP flüssig + gasförmig 0 °C Schmelzpunkt FP fest + fest flüssig flüssig Zeit gasförmig Phasendiagramm des Wassers (schematisch) Druck / Pa Kritischer Punkt Tk = 374 °C Pk = 22088 kPa fl. Wasser (l) 1013 hPa Eis (s) Sublimationskurve Schmelzkurve Dampfdruckkurve Tripelpunkt TTr.= 0.01 °C PTr. = 613.3 Pa Wasserdampf (g) Temperatur / °C Phasendiagramm von Kohlendioxid 76.3 bar CO2 (l) Krit. Punkt Druck CO2 (s) 5.03 bar Triplepunkt und Schmelzpunkt CO2 (g) 1.013 bar Sublimation -78.5 °C -56.7 °C Temperature 31 °C Trockeneis Sublimation von TE in Wasser Komponenten eines Systems Komponenten eines Systems sind die kleinste Anzahl von unabhängig variablen chemischen Konstituenten, die notwendig und ausreichend sind die Zusammensetzung jeder Phase des Systems in jedem Gleichgewichtszustand zu beschreiben. - unär binär ternär quaternär quinternär eine Komponente zwei Komponenten drei Komponenten vier Komponenten fünf Komponenten Phasendiagramm Phasendiagramm ist eine geometrische Darstellung der Orte thermodynamischer Parameter eines Gleichgewichtszustands unterschiedlicher Phasen unter festgelegten Bedingungen. Intensive Variable Extensive Variable Temperatur, T Entropie, S Druck, p Volume, V Chemische Potential, i Anzahl Mole von of i, ni 2. Grundbegriffe 2.3 Der gasförmige Zustand 2.3.1 2.3.2 2.4 2.5 2.5.1 2.5.2 2.5.3 Gesetz von Boyle-Mariotte Gesetze von Gay-Lussac Der flüssige Zustand Der feste Zustand Der kristalline Zustand Die 14 Bravais-Gitter Der Glaszustand Das Teilchenmodell gasförmig ungeordnet fest - kristallin ferngeordnet flüssig nahgeordnet Der gasförmige Zustand • ist weder form- noch volumenstabil • weist eine geringe Dichte und hohe Kompressibilität auf • ist in Näherung durch eine allgemeine Zustandsgleichung beschreibbar • ist ein unordneter Zustand mit homogen und isotropen Verhalten Boyle-Mariottsches Gesetz P V = const. bei T = const 3.5 Druck p / 106 Pa 3.0 2.5 Temperatur in K 800 K 500 K 300 K 100 K 2.0 1.5 Robert Boyle 1.0 0.5 5 10 15 20 Volumen V / 103 m3 25 30 Gay-Lussacsches Gesetz p/T = const. bei V = const. V/T = const. bei p = const. Volumen in l 1l Druck p / 106 Pa 2.5 2 4l 1.5 Gay-Lussac 1 7l 0.5 10 l 13 l 17 l 20 l 200 400 Temperatur T / K 600 800 Halogene CHLOR BROM IOD Copyright: T. Seilnacht Ideales Gas • Thermische Zustandsgleichung eines idealen Gases: pV = nRT für 1 mol Gas: pVm = RT R ist die Gaskonstante: R = 8, 314510 J mol₋1 K₋1 1 = 0, 0876 L atm K ₋1 mol ₋ Der flüssige Zustand ist nicht formstabil aber volumenstabil • weist eine hohe Dichte und geringe Kompressibilität auf • ist nicht durch eine allgemeine Zustandsgleichung beschreibbar • ist ein unordneter Zustand • einphasige Flüssigkeiten sind homogen und isotrop • Nahordnung ist möglich Flüssiger Stickstoff Verwendung: Kühlmittel in Medizin und Technik Foto mit freundlicher Genehmigung der Gebr. Gloor AG Pb Simulation der Erstarrung von flüssigem NaCl 0 ps 40 ps 52 ps 55 ps 50 ps 60 ps Fp (NaCl) = 808 °C, 540 Teilchen bei 837 °C, 1013 hPa Der feste Zustand • ist form- und volumenstabil •weist eine hohe Dichte und geringe Kompressibilität auf • ist nicht durch eine allgemeine Zustandsgleichung beschreibbar • Kristalle sind ferngeordnet mit homogenen und anisotropen Verhalten • Gläser beschreiben einen unordneten Zustand mit homogenen und isotropen Verhalten; Nahordnung ist möglich Der kristalline Zustand Elementarzelle Gitter + Basis + Basis Die Kristallstruktur des NaCl 281 pm NaCl6/6 Na+1 Cl-1 Kristallstruktur des Aluminium 10·10-2 m 40.5·10-10 m 10·10-6 m a = 4.0496·10-10 m Die 14 Bravais-Gitter c Kristallographisches Achssystem a b Bravai-System Bravais-Typ Restriktionen der Metrik kubisch primitiv (cP) innenzentriert (cI) flächenzentriert (cF) a = b = c, = = = 90° hexagonal hexagonal (hP) a = b ≠ c, = = 90°, = 120° rhomboedrisch rhomboedrisch (hR) a = b ≠ c, = = 90°, = 120° tetragonal primitiv (tP) innenzentriert (tI) a = b ≠ c, = = = 90° orthorhombisch primitiv (oP) innenzentriert (oI) C-zentriert (oC) flächenzentriert (oF) a ≠ b ≠ c, = = = 90° monoklin primitiv (mP) C-zentriert (mC) a ≠ b ≠ c, = = 90°, triklin triklin (aP) a ≠ b ≠ c, ≠ ≠ Kristallstruktur des Quarz Kristallographische Daten Formel Si O2 Z 3 Kristallsystem trigonal Bravaissystem hexagonal primitiv Raumgruppe P3221 (Nr. 154) Gitterparameter a = 4.9128 Å c = 5.4042 Å Zellvolumen V = 112.96 Å3 Atomlagen Aufsicht Atom Wyck. x Si1 3a 0.46875(20) O1 6c 0.41211(40) y z 0.00000 0.00000 0.26563(40) 0.11865(20) Der feste Zustand • ist form- und volumenstabil • weist eine hohe Dichte und geringe Kompressibilität auf • ist nicht durch eine allgemeine Zustandsgleichung beschreibbar • Kristalle sind ferngeordnet mit homogenen und anisotropen Verhalten • Gläser beschreiben einen unordneten Zustand mit homogenen und isotropen Verhalten; Nahordnung ist möglich Was ist Glas? Der Glaszustand Volumen Flüssigkeit unterkühlte Flüssigkeit schnell abgekühltes Glas langsam abgekühltes Glas Kristall Fiktive Temperatur Temperatur Schmelztemperatur / 2 – Diffractometer STOE STADI MP Bragg-Brentano Modus, Flachpräparat Der Glaszustand STOE Powder Diffraction System λ = 1.54056·10-10 m 24000 20000 Absolute Intensity 16000 Quarz – SiO2 12000 Quarzglas - SiO2 8000 4000 0 10.0 20.0 30.0 40.0 50.0 60.0 70.0 80.0 90.0 2Theta Was ist Glas? Die Struktur von Glas SiO2 kristallin SiO2 glasartig Ausdehnungskoeffizient von Glas Rasotherm - Glas Quarz- Glas Was ist Glas? Chemische Einteilung der Gläser • Quarzglas SiO2 (aus Sand) • Kalknatronglas 71 - 75% SiO2 (aus Sand) 12 - 16% Na2O (aus Soda) 5 - 15% CaO (aus Kalk) • Bleiglas 54 - 67% SiO2 (Sand) 5 - 38% PbO (Bleiweiß) 5 - 15% Na2O (aus Soda), 5 - 15% K2O (aus Pottasche) • Borosilicatgläser 70 - 80% SiO2 (Sand) 7 - 13% B2O3 (aus Borax) 4 - 8% Na2O (aus Soda) 4 - 8% K2O (aus Pottasche) 2 - 7% Al2O3 (aus Pottasche) • Spezialglas SiO2 (aus Sand) und weiteren Elementen des PSE Was ist Glas? Wichtige Rohstoffe für die Glasherstellung • • • • • • • • • • • SiO2 Na2CO3 · 10H2O K2CO3 Na2SO4 CaCO3 MgCO3 Al2O3 NaAlSi3O8 PbO Pb3O4 Na2B4O5(OH)4 · 8H2O Sand Soda Pottasche Glaubersalz Kalk Magnesit Tonerde Feldspat Bleiglätte Menninge Borax Siliciumdioxid, Quarz Natriumcarbonat Kaliumcarbonat Natriumsulfat Calciumcarbonat Magnesiumcarbonat Aluminiumoxid Albit Blei(II)-oxid Blei(II,III)-oxid Natriumtetraborat Schmelz-Spin Verfahren zur Herstellung metallischer Gläser Ar pressure melt Ta-nozzle induction coil metallic ribbon copper wheel Einteilung von Stoffen Stoffe Homogene Stoffe Gemische oder Lösungen Heterogene Stoffe Reinstoffe Verbindungen Elemente Definitionen Heterogene Stoffe bestehen aus mehreren Phasen, d.h. es sind Phasengrenzflächen vorhanden Homogene Stoffe sind einphasige Stoffe, d.h. in sich völlig homogen mit vom Ort unabhängigen Eigenschaften Chemische Elemente Stoffe, die sich durch chemische Reaktionen nicht weiter in einfachere Stoffe auftrennen lassen. Verbindung Bezeichnung für homogene reine Stoffe, die mindestens aus zwei unterschiedlichen Elementen bestehen Reinstoff Element oder Verbindung Gemische oder Lösungen Homogene Stoffe, die sich mit Hilfe physikalischer Trennmethoden in Reinstoffe zerlegen lassen Einteilung heterogener Stoffe • • • • • fest – fest fest – flüssig fest – gasförmig flüssig – flüssig flüssig – gasförmig Gemenge Suspension Rauch oder Gasstein Emulsion Nebel oder Schaum Stoffe - Beispiele Stoff Gold Methan Kochsalz Schaum Granit Rauch Luft Nebel Wasser Kochsalzlös. Bimsstein Alko. -Wass. Sauerstoff Kalkmilch Messing Quecksilber Milch homogen + + + + + + + + + + - Aggregatzustand fest gasf. fest flüssig – gasf. fest – fest fest – gasf. gasf. gasf. - flüssig flüssig flüssig fest -gasf. flüssig gasf. fest - flüssig fest flüssig flüssig - flüssig Bezeichnung Reinstoff: Element Reinstoff: Verbindung Reinstoff: Verbindung Schaum Gemenge Rauch G emisch: Gas - Gas Nebel Reinstoff: Verbindung Lösung: Festst. - Flüss. „Gasstein“ Gemisch: Flüss. - Flüss. Reinstoff: Element Suspension Gemisch: Feststoff - Festst. Reinstoff: Element Emulsion Trennung von Diamant und Gestein • Fördern des Gesteins: 43 Mio. t/a an Kimberlit in Südafrika in 1977 • Brechen des Gesteins bis auf 30 mm Durchmesser • Grobtrennen vom leichten Gestein z. B. durch float and sink • Feintrennung des Diamanten vom Restgestein mit Fettherden und durch Aussortieren mit Röntgenstrahlen • Ausbeute ca. 0,1 g/t Diamant bzw. 1 kg auf 10000 t Gestein bei Weltproduktion ca. 20 t/a Aussortieren mit Hilfe von Röntgenstrahlen Typische Diamantenmine und einige Rohdiamanten Das Periodensystem der Elemente H 1 He 2 Li 3 Be 4 B 5 C 6 N 7 O 8 F 9 Ne 10 Na 11 Mg 12 Al 13 Si 14 P 15 S 16 Cl 17 Ar 18 K 19 Ca 20 Sc 21 Ti 22 V 23 Cr 24 Mn 25 Fe 26 Co 27 Ni 28 Cu 29 Zn 30 Ga 31 Ge 32 As 33 Se 34 Br 35 Rb 37 Sr 38 Y 39 Zr 40 Nb 41 Mo 42 Tc 43 Ru 44 Rh 45 Pd 46 Ag 47 Cd 48 In 49 Sn 50 Sb 51 Te 52 I 53 Xe 54 Cs 55 Ba 56 La-Lu Hf 72 Ta 73 W 74 Re 75 Os 76 Ir 77 Pt 78 Au 79 Hg 80 Tl 81 Pb 82 Bi 83 Po 84 At 85 Rn 86 Fr 87 Ra 88 Ac-Lr La 57 Ce 58 Pr 59 Nd 60 Pm 61 Sm 62 Eu 63 Gd 64 Tb 65 Dy 66 Ho 67 Er 68 Tm 69 Yb 70 Lu 71 Ac 89 Th 90 Pa 91 U 92 Np 93 Pu 94 Am 95 Cm 96 Bk 97 Cf 98 Es 99 Fm 100 Md 101 No 102 Lr 103 • 77 Metalle • 8 Halbmetalle • 18 Nichtmetalle Kr 36