Kapitel 3.1-3.2
Werbung
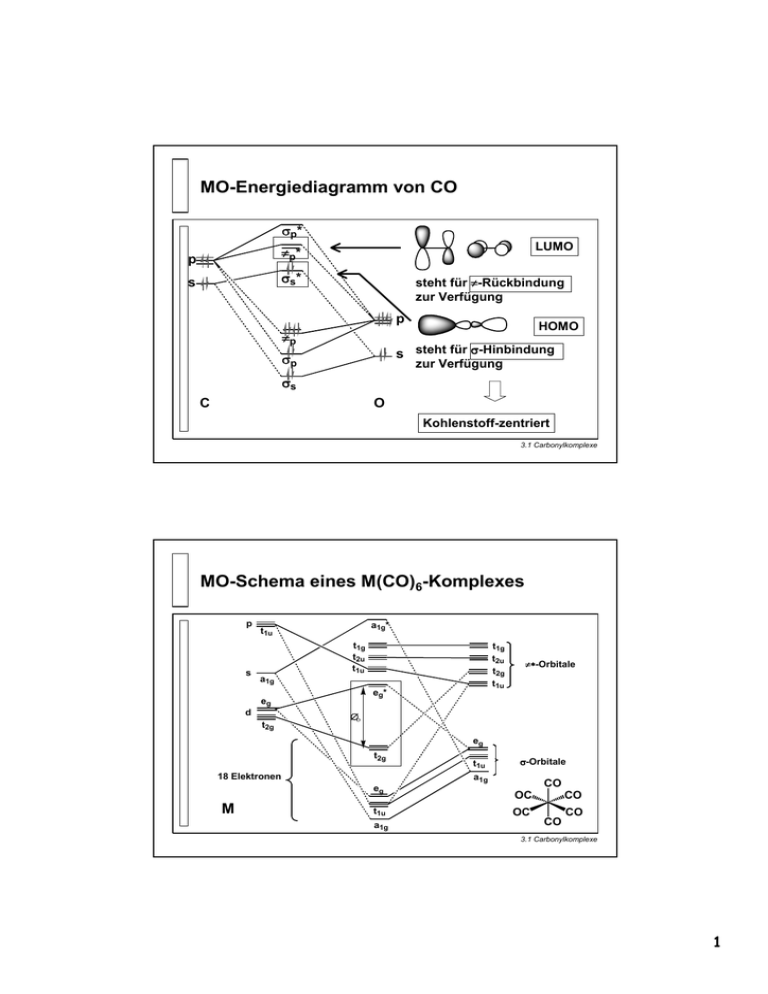
MO-Energiediagramm von CO σp* p πp* s σs* LUMO steht für π-Rückbindung zur Verfügung p πp HOMO s steht für σ-Hinbindung σp zur Verfügung σs C O Kohlenstoff-zentriert 3.1 Carbonylkomplexe MO-Schema eines M(CO)6-Komplexes p s a1g* t1u t1g t2u t1u t1g t2u t2g t1u a1g eg* eg d t2g π∗-Orbitale ∆ο eg t2g 18 Elektronen σ-Orbitale a1g eg M t1u t1u a1g CO OC CO OC CO CO 3.1 Carbonylkomplexe 1 Binäre einkernige Metallcarbonyle 4 5 6 7 8 - V(CO)6 Cr(CO)6 - Fe(CO)5 - Ni(CO)4 - - - Mo(CO)6 - Ru(CO)5 - - - - - W(CO)6 Os(CO)5 - - - - 9 10 11 3.1 Carbonylkomplexe Darstellung von Carbonylkomplexen a) Direkte Synthese 150 – 200 °C Fe + Fe(CO)5 200 bar CO b) Reduktion von Metalloxiden durch CO Re2O7 5 CO + 17 CO Re2(CO)10 + 7 CO2 c) Reduktion von Metallsalzen durch andere Reduktionsmittel 140 °C CrCl3 + Al + 6 CO Cr(CO)6 + AlCl3 300 bar CO d) Bildung von polynuklearen Carbonylkomplexen hν ν 6 Fe(CO)5 3 Fe2(CO)9 Fe3(CO)12 + 3 Fe(CO)5 3.1 Carbonylkomplexe 2 Anionische Carbonylkomplexe Anionische Carbonylkomplexe = Carbonylmetallate hohe Bildungstendenz mononuklear: mono- oder dianionisch polynuklear: dianionisch (2 Elektronen ersetzen ein CO) Beispiele [Fe(CO)4]2 [Mn(CO)5]¯ _ [Fe3(CO)11]2 _ [Cr(CO)4]2 _ 3.1 Carbonylkomplexe Darstellung anionischer Carbonylkomplexe Darstellung durch Reduktion von Carbonylkomplexen [Mn2(CO)10] [Cr(CO)6] + + 2 Na[Mn(CO)5] 2 Na 2 Na - 2 CO Na2[Cr2(CO)10] Darstellung durch nukleophilen Angriff auf koordinierten CO-Liganden Pionierarbeiten durch Hieber Hiebersche Basen Fe(CO)5 NaOHaq O Na+ (OC)4Fe C H O - CO2 Na[HFe(CO)4] reduktive Decarbonylierung 3.1 Carbonylkomplexe 3 Carbonylhydride O C Carbonylhydrid Co OC O C O C CO OC CO OC Mn CO OC CO OC Fe H C O H H H AggregatsZustand, mp gelbe Flüssigkeit, -26 °C farblose Flüssig- farblose Flüssigkeit, -25 °C keit, -70 °C Stabilität > -26 °C Zers. in Co2(CO)8 und H2 stabil bei rt Gas bei rt > -10° C Zersetz. sauer (pKs) stark (1) schwach (7) schwach (4,7;14) 1H-NMR -10 ppm -7,5 ppm -11,5 ppm 3.1 Carbonylkomplexe Reaktionen von Carbonylkomplexen a) Nukleophiler Angriff des koordinierten Carbonylliganden LnM CO Nu Nu L nM C O b) Elektrophiler Angriff des koordinierten Carbonylliganden Cl(PR3)4Re H+ Cl(PR3)4Re AlMe3 Cl(PR3)4Re CO H CO CO AlMe3 c) Substitution des Carbonylliganden + L' - CO LnM CO LnM LnM L' + CO 3.1 Carbonylkomplexe 4 Reaktionen mit dem Collman‘s Reagenz R-X oder RCOX Darstellung von Aldehyden, Carbonsäuren und Ketonen Verlängerung um 1 C-Atom R Fe(CO)4 X2 R-X R'X - NaX O2 O CO Na2[Fe(CO)4] R R'X - NaX O R R X O O R' R OH R X O2 X2 C Fe(CO)4 O hohe Ausbeuten und hohe Toleranz gg. funktionellen Gruppen 3.1 Carbonylkomplexe Isolobalanalogien Definition: Zwei Fragmente sind isolobal, wenn: Anzahl, Energie und Gestalt der Grenzorbitale und die darin enthaltene Anzahl der Elektronen ähnlich – nicht identisch – sind. Symbol: basierend auf MO-Berechnungen entwickelt von R. Hoffmann 1982 2.3 Isolobalanalogien 5 Isolobalanalogien: Grenzorbitale in metallorganischen Fragmenten ML6, ML5, ML4, ML3 ML6 ML5 -L ML4 ML3 -L -L a1 e a1 b2 a1 Antibindende MOs Grenzorbitale t2g Bindende MOs 18 17 16 15 Anzahl VE M Sukzessives Entfernen von Liganden erzeugt nicht-bindende Orbitale L M L L M L L L L L M L L L L L L M L L L L 2.3 Isolobalanalogien Isolobalanalogien: Grenzorbitale in organischen Fragmenten CH4, CH3, CH2, CH CH4 -H CH3 -H CH2 -H CH Antibindende MOs b2 a1 a1 e a1 Grenzorbitale Bindende MOs 8 7 6 5 Anzahl VE H C C H H H C H H H H C C H H 2.3 Isolobalanalogien 6 Isolobalanalogien: Beispiele L L H H3C H H L M L L C L L M L L H C H2C H HC H L C d7-ML5 (OC)5Mn d8-ML4 (OC)4Fe d9-ML3 (OC)3Co L M L L 2e 2.3 Isolobalanalogien σ-Liganden mit mindestens einer MetallKohlenstoff-Bindung O M CR3 M Aryl Alkyl M M C CR Alkinyl R Acyl M C Vinyliden CR2 M CR2 M R Alkyliden oder Carben Vinyl sp3 CR2 sp2 M CR Alkylidin oder Carbin sp Hybridisierung am Kohlenstoff 3.2 Alkylkomplexe 7 Metallalkyle können als stabilisierte Carbanionen betrachtet werden Beispiel: Grignard-Verbindung δ+ δR X Mg δR δ+ MgX Nukleophiles Carbanion R¯ Kohlenstoff ist elektronegativer als jedes Metall des Periodensystems Abhängig von Elektronegativitätsunterschied Kovalente Alkyle: Polare Alkyle: RLi, RMgX, R2Zn, R3Al, RHg+, RAuL, Alkylkomplexe mit späten Alkylkomplexe mit frühen Übergangsmetallen Übergangsmetallen weniger elektropositive Metalle elektropositive Metalle kinetisch stabilere Verbindungen Carbanion starkes Nukleophil H2O- und O2-empfindlich abnehmender nukleophiler Charakter des Carbanions 3.2 Alkylkomplexe Frühe Entdeckung von Alkylkomplexen mit Hauptgruppenelement 1760 Louis-Claude Cadet As2O3 + KOOCCH3 H3C CH3 CH3 As O As CH3 Kakodyloxid (griech.: kakos = stinkend) In der Folge wurden von fast 1848 Edward Frankland allen Hauptgruppenmetallen geplant: 2EtI + Zn Et + ZnI2 gefunden:2EtI + 2Zn Et2Zn + ZnI2 stabile Alkylkomplexe gefunden. Diethylzink Alkylkomplexe mit Übergangsmetallen blieben selten bis ~ 1960 1900 Victor Grignard Alkylmagnesium halogenide Warum? 3.2 Alkylkomplexe 8 Thermodynamische vs. kinetische Stabilität thermodynamisch stabil instabil kinetisch inert labil Metallorganische Verbindungen sind: - oft thermodynamisch instabil - in Gegenwart von Sauerstoff thermodynamisch instabil M-R + O2 Metalloxid, CO2, H2O Isolierbare metallorganische Verbindungen sind in den meisten Fällen als kinetisch stabil (inert) zu bezeichnen SnMe4: luftstabil InMe3: pyrophor und H2O-empfindlich ∆Hf0 = -19 kJ/mol bei Oxidation wird 3590 kJ/mol frei kinetisch stabilisiert ∆Hf0 = + 173 kJ/mol sowohl instabil als auch labil tetraedrisch, gut abgeschirmtes Sn wenig polare Bindung polare Bindung, Elektronenlücke erlaubt Angriff des O2 Moleküls 3.2 Alkylkomplexe Homolytische Spaltung 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 H 18 He • • M-C M + C Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Spaltung, da Metallradikal stabil ist Spaltung, da Bindungen schwach sind Grenzwerte: Spaltung > 200 °C oder h ν 3.2 Alkylkomplexe 9 Stabilität von Alkylkomplexen von Übergangsmetallen • M-C Bindugsenergie • • • Die M-C Bindung ist schwächer als M-O, M-N oder M-X Bdg. nützliche Eigenschaft für katalytische Reaktionen Bindungsenergie nimmt mit steigender Ordnungszahl zu sterische Effekte berücksichtigen ~ 150 – 300 kJ/mol TiEt4 sollte stabiler sein als PbEt4 C MMe4 350 M(CH2tBu)4 Si 300 Hf Ge Zr 250 Sn Ti 200 TiEt4 -80 °C Zers. Pb 150 0 20 40 60 80 PbEt4 +100 °C Zers. 100 Ordnungszahl 3.2 Alkylkomplexe Kinetische Stabilität PbEt4 4 σ-Bdg. bilden ein Oktett alle Valenzorbitale gefüllt 5d-Schale gefüllt 6d- und σ*-Orbitale energetisch zu hoch unbesetzt 3d-Orbitale Wechselwirkung mit C-H-Bdg. kein homolytischer Bdgsbruch günstiger Zersetzungsweg: H günstiger Zersetzungsweg: Et2Ti homolytischer Bindungsbruch TiEt4 • • PbEt4 PbEt3 + Et erfordert Energie H2C CH2 CH2 CH3 1 H Et2Ti H2C CH2 + CH2 CH3 2 Et2Ti + CH3-CH3 3.2 Alkylkomplexe 10 Stabile Alkylkomplexe durch Unterdrückung der β-H-Eliminierung β-H-Eliminierung HH H H HH H LnM H H H H H H LnM H LnM H Bildung des 4-gliedrigen Metallazyklus erfordert: • planare M-C-C-H Anordnung • freie Koordinationsstelle cis zur Alkylgruppe Stabile Alkylkomplexe Alkylliganden ohne β-H-Atom Alkylliganden, bei welchen das β-H-Atom nicht erreichbar ist (aus geometrischen oder sterischen Gründen) Komplexe ohne freie Koordinationsstelle (18-Elektronen oder durch Blockierung mit andern Donorliganden) Alkylkomplexe kinetisch inerter Metallzentren sperrige Alkylliganden 3.2 Alkylkomplexe Darstellung von Alkylkomplexen Alkylierung von Metallhalogeniden a) mit Grignard-Reagenzien RMgX b) mit Alkyllithiumreagenzien RLi c) andere Hauptgruppenorganyle z. B. Al2Me6 Oxidative Addition von Alkylhalogeniden Olefin-Insertion in die Metallhydrid-Bindung 3.2 Alkylkomplexe 11 Reaktivität von Alkylkomplexen Einschub (Insertion) von ungesättigten Kleinmolekülen M O CO, CNR oder CO2 C M C C O oder M C C N R C C oder M O Einschub (Insertion) von Alkenen oder Alkinen Alken oder Alkin M M C C C C oder M C C C Spaltung durch Elektrophile M X2 M X E+ M+ + E C + X C C 3.2 Alkylkomplexe kinetisch inerte Co(III)-Komplexe: zum Beispiel Vitamin B12 CONH2 R H2NOC Me HN N CONH2 N N O H2NOC Me O HO O P O O- N Co N N O HO CONH2 CH3 CH3 H3C H O O N N Co N N O O H N Modellverbindung: Dimethylglyoxim-Komplex luft- und wasserstabil Co(III): low spin d6 3.2 Alkylkomplexe 12 Carben- oder Alkylidenkomplexe Komplexe mit einer Metall-Kohlenstoff-Doppelbindung R' LnM C R Erstes Beispiel von E. O. Fischer: 1964 [(CO)5M=CR(OR’)] M = Cr, Mo, W 1973 Nobelpreis für Chemie “On the road to carbene and carbyne complexes” zusammen mit G. Wilkinson “The long search for stable transition-metal alkyls” 3.2 Carbenkomplexe Zwei Typen von Carbenkomplexen Unterscheidung entsprechend ihrem chemischen Verhalten Elektrophiles Verhalten Fischer-Carbene Nukleophiles Verhalten Schrock-Carbenen C,H XR X = N, O, S π-Donoren LnM C R' Metal in niedrigen Oxidationsstufen Metal-Carben Rückbindung ist schwach zusätzliche Liganden: in der Regel π- Akzeptoren: meist CO Ln M C C,H Metal in hohen Oxidationsstufen Zusätzliche Liganden: Cp, Cl, OR 3.2 Carbenkomplexe 13 Darstellung von Fischer-Carbenen Nukleophiler Angriff auf koordinierte Liganden (CO)5Cr-CO + (i-Pr)2NLi OEt OLi [Et3O]BF4 (CO)5Cr C (CO)5Cr C N(i-Pr)2 N(i-Pr)2 (CO)5W-CS + R2NH SH (CO)5W C NR2 Cl Cl2(PPh3)Pt-CNR + EtOH NHR Pt C OEt Ph3P Cl 3.2 Carbenkomplexe Elektrophiler Charakter von FischerCarbenen Nukleophiler Angriff am Carben C-Atom (CO)5W C (CO)5Cr OMe + PhLi - 78 °C Ph C OMe + EtNH2 Me OMe Ph HCl (CO)5W C Ph (CO)5W C - 78 °C Ph Ph NHEt (CO)5Cr C Me 3.2 Carbenkomplexe 14 Struktur von Fischer-Carbenen Carben C-Atom: trigonal-planar (~sp2) M-C-Bindung: kürzer als eine M-C-Einfachbindung länger als eine M-CO Bindung C-X-Bindung: kürzer als eine entsprechende Einfachbindung XR LnM C XR XR LnM C LnM C R' R' R' 3.2 Carbenkomplexe Spektroskopische Charakterisierung von Carbenkomplexen Infrarot-Spektroskopie Cr(CO)6: (MeO)MeC=Cr(CO)5 trans zum Carbene: ν(CO) Streckschwingung 2108 cm-1 1953 CO ist der bessere π-Akzeptor als das Carbene Das Carbene ist der bessere σ-Donor als CO M C NMR-Spektroscopie OMe M, C, X, R‘ coplanar: 4 Resonanzen bei -40 °C LnM C Me LnM C Me OMe 3.2 Carbenkomplexe 15 Schrock-Carbene Seite von Dick Schrocks Laborbuch 1973 Prep. of TaP5 ? (P = CH2tBu) TaP3Cl2 + 2 PLi Mol. wt (benzene) = 472 tBu (tBuCH2)3Ta C H Geburt der Chemie der nukleophilen Carbene Unterschrift 3.2 Carbenkomplexe Darstellung des ersten Alkyliden-Komplexes Intramolekulare α-Deprotonierung durch α-H-Eliminierung tBu (tBuCH2)3Ta Cl + 2 tBuCH2Li Cl - 2 LiCl C (tBuCH2)3Ta C tBu tBu (tBuCH2)3Ta C + tBuCH3 H H # H H H α-Kohlenstoff α-H-Eliminierung 3.2 Carbenkomplexe 16 Nukleophiler Charakter von SchrockCarbenen Bildung von Olefinen durch Reaktion mit Aldehyden Nucleophiles C-Atom tBu tBu tBu R tBu Ta tBu C O + C tBu Ta H + C H H tBu tBu Elektrophiles C-Atom R C O H H tBu tBu " (tBuCH ) Ta " + 2 3 (tBuCH2)3Ta H O R H R O H Bildung eines Metallazyklus 3.2 Carbenkomplexe Reaktivität von Carben-Komplexen: Olefin-Metathese (griech. Umstellung) R'' R R R' LnM R' C H + H H H R'' 1. Schritt LnM H R R LnM H H R R'' H LnM R H H 3. Schritt H + H LnM R' R H H R'' R H R' LnM H R' R' H H H R R R' H H + H R H R H H LnM R'' R'' H R' R' R' LnM H + H R H + 2. Schritt R' LnM H + H R 2 LnM H R' H R + R'' H 3.2 Carbenkomplexe 17 Reaktivität von Schrock-Carbenen: Ring-Opening-Metathese-Polymerisation (ROMP) R LnM C R M + H R H LnM H LnM CRH 3.2 Carbenkomplexe Beispiele von Carbenkomplexen Tebbe's Reagenz Cp 2 Ti Cl Cl + H2 C Al2 Me 6 - Me 2 AlCl - CH 4 Schrock-Katalysator Cp 2 Ti Me Al Cl Me "AlMe 2 Cl"-stabilisiertes Carben ein Grubbs-Katalysator PCy 3 iPr iPr CF 3 N CF 3 Mo CF 3 CF 3 O O CMe 2 Ph H Cl Ph Ru Cl H PCy 3 3.2 Carbenkomplexe 18 Elektronenzählen bei Carbenliganden als Neutralligand (Fischer-Carben) 2-Elektronendonor CRR‘ als zweifach negativ geladener Ligand (SchrockCarben) 2-CRR‘ 4-Elektronendonor 3.2 Carbenkomplexe Bindung in Schrock-Carbenen: nukleophiles Verhalten σ∗ LUMO, metallzentriert π∗ HOMO, C-zentriert 2-CR 2 π σ M M C C 3.2 Carbenkomplexe 19 Bindung in Fischer-Carbenen: elektrophiles Verhalten σ∗ LUMO, C-zentriert π∗ CXR n. b. HOMO, metallzentriert π σ X M M C C X C X X 3.2 Carbenkomplexe Carbin- oder Alkylidinkomplexe Verbindungen mit einer M≡ ≡C-Dreifachbindung LnM C R Erste Beispiel von E. O. Fischer: 1973 [I(CO)4M≡ ≡CR M = Cr, Mo, W (CO)5M C (CO)5M C OR' R X R + 2 BX3 + BX2(OR') (CO)5M C R + + BX4 + BX2(OR') OC CO X M C R OC CO 3.2 Carbinkomplexe 20 Darstellung von Carbinkomplexen aus Fischer-Carbenen (CO)5M C OR' + 2 BX3 R CO OC (CO)5M C R + + BX4 + BX2(OR') X M C R OC CO aus Schrock-Carbenen Deprotonierung des α-H-Atoms durch Metathese von Verbindungen mit M≡M-Einheiten und Acetylenen tBuO tBuO tBuO OtBu W tBuO OtBu + RC W 2 tBuO CR OtBu W CR tBuO 3.2 Carbinkomplexe Bindung in Carbinen Fischer-Carbin σ-Bindung Schrock-Carbin M C R M C R M C R M C R M C R M C R π-Bdgen. formale Ladung des Liganden: 1-fach negativ 3-fach negativ 3.2 Carbinkomplexe 21 Bindungslängen- und Winkelvergleich in Alkyl-, Carben- und Carbinliganden M≡ ≡C-Dreifachbindung: 178 pm tBu C ) 175° tBu 124° ) PMe2 PMe2 W CH2 150° ( C H M-C-Einfachbindung: 225 pm tBu M=C-Doppelbindung: 194 pm 3.2 Carbinkomplexe 22







![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)



