Komplexe mit einfachen Hydroxo-, Alkoxo
Werbung

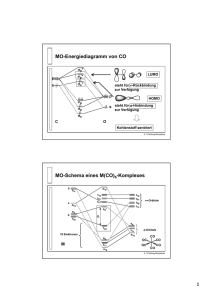
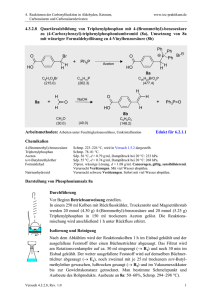
Seminar Anorganische Chemie Komplexe mit einfachen Hydroxo-, Alkoxo- und Amidliganden Boris Kosog 07. Dezember 2006 R. G. Bergman, Acc. Chem. Res. 2002, 35, 44-56 Komplexe mit einfachen Hydroxo-, Alkoxo- und Amidliganden 1. M-O- und M-N-Komplexe als Intermediate in metallkatalysierten Reaktionen 2. Synthesemethoden für Alkoxo- und Amidkomplexe 3. Chemie der M-O- und der M-N-Bindung 4. H-X / M-X Austausch 5. Ungewöhnliche Reaktionen spezieller Hydroxo- und Amidkomplexe 1. M-O- und M-N-Komplexe in metallkatalysierten Reaktionen Komplexe mit Metall-Heteroatom-Bindungen spielen wichtige Rolle bei der Katalyse, sowohl in biologischen Systemen als auch in der Synthese Beispiele: • Enzymkatalysierte Überführung von 1,4-Dienen in Alkylhydroperoxide mit Lipoxygenase • Wackerprozess und Hydroaminierung • Enantioselektive Synthese chiraler Alkohole Beispiel in der Natur Enzymkatalysierte Überführung von 1,4-Dienen in Alkylhydroperoxide mit Lipoxygenase OOH Lipoxygenase H H R L5Fe R' III OH R L5Fe H H R H R' II R' OH2 R R' Wackerprozess, Hydroaminierung Wackerprozess H2C CH2 1/2 O2 O cat. PdCl2 CuCl2 H2O H3C Hydroaminierung R2C CR2 HNR'2 cat. MLn HCR2CR2NR'2 H Mechanismus Nu Nu Nu (1) LnM LnM LnM Nu (2) Nu Nu = R2N-, RO- LnM • migratorische Insertion in M-X-Bindung (1) oder • externer nucleophiler Angriff an das koordinierte Olefin (2) Enantioselektive Synthese chiraler Alkohole – Noyori-Katalysatoren Enantioselektive Synthese chiraler Alkohole durch H-Transferhydrierung von Ketonen OH O R 1 cat. R 2 H3C CH3 H OH O H3C CH3 H3C H Ru H3C O H O Ph2 N H Ph2 Von Noyori vorgeschlagener Übergangszustand * R1 H R2 2. Synthesemethoden für Alkoxo-, Hydroxo- und Amidkomplexe Es sind bereits M-X-Komplexe diverser Metalle, beispielsweise Ni, Ir, Ru, Rh, Re, mit verschiedenen Heteroatomen, wie O, N, S, P bekannt, jedoch sind nicht alle Synthesemethoden auf alle Metalle und Heteroatome gleich gut anwendbar; dabei spielt auch das verwendete Lösungsmittel eine wichtige Rolle. Einige wichtige Darstellungsmethoden sind: • Metathese von Metallchlorid- und Metalltriflatkomplexen • Austausch der Heteroatomgruppe am Metallkomplex • Salz-Metathese zur Synthese der Hydroxokomplexe Metathese von Metallchloridkomplexen AgOAc Toluol -AgCl *Cp *Cp OAc Ir Ph3P Cl Me Ir Ph3P Me *Cp LiNHPh THF -LiCl NHPh Ir Ph3P Me KOPh THF -KOAc *Cp OPh Ir Ph3P Me Metathese von Metalltriflatkomplexen 1) TfOH/MeOH 2) NaOMe/MeOH Cp* -NaOTf Cp* Ni Et3P OMe Ni Et3P Me Cp* TfOH CH2Cl2 O - OTf = O F S O F F Ni Et3P Cp* LiNHTol THF -LiOTf OTf Ni Et3P NHTol Austausch der Heteroatomgruppe am Metallatom *Cp *Cp OEt RXH Ir XR EtOH Ir Ph3P Ph3P H X = O; R = CD2CD3, n-Pr, i-Pr, Ph H X = NH; R = Ph, CH2Ph Ln M L nM X Silica O Si O O O LnM = Cp*(PEt3)(Ph)Ir; X = OH; LnM = Cp*(PEt3)Ni; Y-H Y = p-NO2C6H4O X = NHTol; Y = p-NO2C6H4O L nM Y Salzmetathese *Cp Ph Ir Ph3P *Cp CsOH -CsOTf OTf Ph Ir Ph3P OH 78 % *Cp X Ir Ph3P *Cp NaNH2 NH3(l)/THF 1:1 H X = OH, Cl NH2 Ir Ph3P H 78 %, nur in Lösung stabil 3. Chemie der M-O- und M-N-Bindung Reaktivität der wenigen untersuchten Komplexe entspricht weitgehend Alkalimetallsalzen von Alkoxiden und Amiden. Die Liganden sind • sehr starke Nucleophile, greifen elektrophile organische Stoffe wie Säurechloride an • starke Basen, deprotonieren selbst schwache Säuren wie Phenylacetylen, Alkohole, Amine, Fluoren • zwar aktiv in migratorischen Insertionsreaktionen mit weniger elektrophilen Reagenzien wie CO und Alkenen, jedoch weniger aktiv als M-C-Bindungen Orbitalschema π*-Orbital π-Orbital p-π/d-π-Wechselwirkung zwischen gefülltem Heteroatom-p-Orbital (X = O, N) und leerem (z.B. 16-ElektronKomplexe) oder gefülltem Übergangsmetall-d-Orbital Filled-filled-Wechselwirkung erklärt ungewöhnlich starke Nucleophilie und Basizität des Heteroatoms Relative Bindungsenergien Bislang sind kaum absolute M-X-Bindungsenergien gemessen worden. Bryndza und Bercaw haben relative Bindungsstärken durch Vergleich zwischen M-X und entsprechender H-X-Bindungsenergie bestimmt. Die MX-Bindung ist dann stark wenn die H-X-Bindung stark, schwach wenn die H-X-Bindung ebenfalls schwach ist. Beispiel: Differenz der Bindungsdissoziationsenergien von [Pt]-OMe und H-OMe ist gleich der entsprechenden Differenz bei [Pt]-NMePh und H-NMePh. Bindungsstärken: M-S > M-O > M-N; M-OAr > M-OR Nucleophile Reaktionen mit organischen Elektrophilen *Cp *Cp H Y=C=Z Ir Ph3P Ir Ph3P XR X = O, R = Et; O Z XR Y Y = O, S, NAr, NMe; Z = O, S X = NH, R = Ph; Y = S; Z=S O *Cp H Ir Ph3P *Cp O OEt Ir Ph3P O H O O COOEt Wasserstoffbrücken Cp* OH Cp* Me3P Ni Me3P Ni OTol OTol H O Nachweis der sehr asymmetrischen und nahezu linearen (O-H-O-Winkel ca. 166°) H-Brücken durch Röntgendiffraktometrie und 1H-NMR-Spektroskopie Röntgenstruktur des Nickelkomplexes ORTEP-Diagramm P. L. Holland, J. Am. Chem. Soc. 1997, 119, 12800-12814 Wasserstoffbrücken In diesem Nickelkomplex wird über H-Brücke gebundenes Kresol sehr schnell mit freier Spezies ausgetauscht, auch bei -80 °C zeigen ortho-Protonen des Kresol nur ein Singulett. Bindungsenthalpie der H-Brücke: ∆H = -11,4 kcal/mol, Assoziationskonstante 1,5⋅103 (gemessen in Benzol mit 1H-NMR und Kalorimetrie), also sehr starke H-Brücke Vergleich: ∆H (Phenol-Anisol) = -3,5 kcal/mol, ∆H (Kresol-Pyridin) = -6,88 kcal/mol (beide gemessen in CCl4) 4. H-X / M-X Austausch In allen Systemen mit H-Brücken auch Austausch des metallgebundenen Alkoxo- und Aryloxo-Liganden mit freien Alkoholen (schon bei Raumtemperatur) und Phenolen (H-Brücken, erst bei 45 °C) ( Synthese) Generell: abhängig von Reaktionsbedingungen Entsprechendes gilt für Amidkomplexe H-X / M-X Austausch an Nickelkomplex Cp* Ni Me3P Cp* H2N(C6H4R) NHTol Ni H2NTol Me3P HOTol HSTol H2N(C6H4R) HOTol H2NTol Cp* Cp* HSTol Ni Me3P Ni STol R = Ac, CF3, F, Me, OMe, NMe2 NH(C6H4R) Me3P OTol Reaktionsmechanismus Wahrscheinlicher Reaktionsmechanismus für H-X / M-X Austausch: Protonentransfer von freiem Alkohol auf Heteroatom, anschließend Ligandaustausch Ligand- H+ LnM OR H OR' LnM OR - OR' LnM OR' H OR 5. Ungewöhnliche Reaktionen Folgende ausgewählte Beispiele sollen die besonderen Eigenschaften der Metall-Heteroatom-Komplexe zeigen: • Reaktion eines Ru-Hydroxokomplexes mit einem Keton • Reaktion des entsprechenden Ru-Amidkomplexes mit Fluoren • Migratorische Insertion an einem Ir-Hydroxokomplex mit verschiedenen Nichtelektrophilen Reaktion eines Ru-Hydroxokomplexes O O OH P P R P Ru P R = p-C6H4CH3, X = H, -H2 R = X = CF3, -HCF3 P H R O X -H2 P Ru P P P H P H O Ru X = CF3 -HCF3 - X - P OH P Ru P R P OH O P R O O P P P P P H P P P H P P = DMPE P OH X=H β-H-Eliminierung Ru Ru H R OH X R X H P P R. G. Bergman, Organometallics 1998, 17, 5072-5085 Reaktionen eines Ru-Amidkomplexes A- NH3 P P P Ru A-H P NH2 P -NH3 P H P A P Ru P P H Ru P P H H H NH3 P P Ru P P H Deprotonierung von Fluoren durch metallorganischen Amidokomplex! R. G. Bergman, J. Am. Chem. Soc. 2000, 122, 8799-8800 Migratorische Insertion mit Nichtelektrophilen - OTf *Cp *Cp Ph Ph Ir Ir Me3P Me3P *Cp OH - OTf Ph Ir Me3P OH H2C=CH2 PMe3 Ir Ph Cp* *Cp *Cp Ph Ph Ir Ir Me3P OTf Me3P OH Migratorische Insertion mit Nichtelektrophilen Äquivalente Reaktion *Cp *Cp Ph Ir Me3P Ar C N Ph 5 mol% Ir Me3P OTf OH Aufbau einer Peptidbindung! *Cp Ph O Ir Me3P N H Ar Zusammenfassung • seit einiger Zeit deutlich mehr Komplexe untersucht • verschiedene Syntheserouten, auch zu monomeren, unsubstituierten M-OH und M-NH2 Komplexen gefunden • sehr starke Nucleophilie und Basizität des Ligandheteroatoms aufgrund sehr starker Polarität der M-XBindung • Einsatz als Katalysatoren in der organischen Synthese? In der Zukunft sicher noch weiter interessantes Forschungsgebiet






![[Mo(CO)6], [Ru(CO)5] und [RhCl(CO)(PPh3)2]](http://s1.studylibde.com/store/data/005606366_1-015cff068bd8932129b59ee7ad5cb2c5-300x300.png)