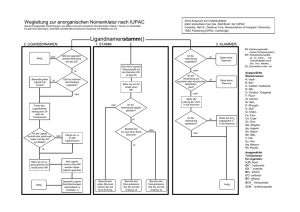
M M M 6. Metallorganische π-Komplexe (organische σ/π-Donor
Werbung

6. Metallorganische π-Komplexe
(organische σ/π-Donor-π-Akzeptor-Liganden)
• Grundlagen und allgemeine Übersicht
Bindungsverhältnisse:
σ-Donator-Bindung:
meist πb-MO′s
π-Akzeptor-Bindung:
meist πab-MO′s leer
besetzt
Lage des Übergangsmetalls:
C2H2:
außerhalb der Achse linearer Liganden
C2H4:
außerhalb der Ebene planarer Liganden
C5H5:
in der Hauptachse planarer Liganden
M
M
M
Stöchiometrie:
Die Verbindungen unterliegen der 18 VE-Regel/Edelgas-Regel):
y
[MLig n] : VE
ÜM
− y + n EZ Lig = 18
KZ = n =
18−VE
ÜM
+y
EZ Lig
Jede π-Bindung fungiert als 2 Elektronen-Donor
Beispiele:
C2H4:
2-Elektronen-Donor
C2H2:
2 oder 4-Elektronen-Donor
C5H5:
5-Elektronen-Donor, aber auch 3e – oder 1e-Donor (vgl. Kap. 5)
18 VE-Regel:
Bei Übergangsmetallen können bis zu 9 AO′s bei der Bindungsbildung beteiligt sein.
Aufteilung in nσb-, nσab-MO′s und (9-n)-Grenzorbitale (9-n-nichtbindende bzw. bindende
MO′s), die mit maximal 18 Elektronen besetzt werden können.
Faustregel: Du sollst keine antibindenden MO′s besetzen
Vereinfachtes MO-Diagramm (für ÜMLign)
(n+1)p
nσab
(n+1)s
(9-n)nb
nd
nσb
Übergangsmetall
n Lig
Elektronenzahl der wichtigsten Liganden
EZLig Ligand (neutral)
1
Alkyl, Aryl, H, Halogeno
2
Alken, CO, RCN, CNR, PR3, Carben
3
Allyl, C3R3, NO, Carbin
4
Dien, C4R4 (CBD)
5
Dienyl (Cp = C5H5, Cp* = C5Me5)
6
Trien, Benzol
7
Trienyl (CHT = Tropyl = C7H7)
8
Tetraen (COT = C8H8)
Besonderheiten:
• Bei Komplexen mit M–M-, M=M- oder M≡M-Bindungen ist jedes Übergangsmetall ein
1-, 2- oder 3-Elektronendonor des anderen.
• Halogenbrücken (ebenso SR- oder PR2-Brücken zählen als 3-Elektronendonoren).
• Komplexe von Übergangsmetallen mit d8- oder d10-Systemen sind oft mit 16 VE zufrieden und bilden tetragonal bzw. trigonal planare Strukturen.
6.1 Alken-Komplexe (2e-Donoren)
•
Darstellungsmöglichkeiten:
a) Direkte Alkenierung als Addition
R3P
OC
Ir
Cl
PR3
→
+
R3P
OC
Ir
Cl
PR3
„Vaska′s compound“
b) Direkte Alkenierung als Substitution
−
→ K+
K2[PtCl4] +
Cl
Cl
Cl
Pt
+ KC l
„Zeise-Salz“
c) Reduktive Alkenierung
RhCl3×H2O
ROH
+
2 C2H4 –––→
½ {(C2H4)2RhCl}2
• Einige Beispiele mit Strukturen:
+
Ag
R3P
R3P
Pt
Rh
Cl
Cl
Rh
OC
Rh
M
Ni
OC
Ni−CDT
C
O
CO
M = Cr, Mo, W
Bindungsverhältnisse
a) π-MO-Diagramm von C2H4
−
+
leer (2 KE)
πab
−
+
+
+
]
2 × pz-AO's
πb
besetzt (1 KE)
−
−
2 × CH2-Gerüste
b)
Überlappung ohne/mit KE (⊥σh)
C2H4
σ-Donor
π-Akzeptor
πb
z
y
−
−
+
−
+
πab
−
+
x
Verzerrung möglich
+
−
Überlappung
+
leer
−
M
+
−
+
sp3d2-Hybrid
oder
s-, pz-, dz2-AO
c) Folgeerscheinungen (für Alkene als Nukleophile)
⇒ Schwächung der C=C-Bindung
⇒ Vergrößerung der C–C-Abstände
⇒ Verzerrung der Planarität (sp2 → sp3)
⇒ Alkenligand wird zum Elektrophil umgepolt
⇒ Nukleophiler Angriff wird erleichtert
⇒ Katalyserelevanz !
−
M
+
−
dxz-AO
oder
px-AO
besetzt
d) Einige Abstände und IR-Frequenzen:
Verbindung
d(C–C) [pm]
< (C=C) [cm-1]
C2H4
135
1623
K[PtCl3(C2H4)]
137
1516 (sp2)
(Ph3P)2Ni(C2H4)
146
< 1450 (sp3?)
≈ 154
Alkane
–
(sp3)
Im Extremfall diskutiert man (durch Verzerrung) Metallacyclopropane:
LnÜM
bzw.
Alken "einzähnig"
η2-Alken-Komplex
sp2-C-Atome
LnÜM
Alken "zweizähnig"
Metallacyclopropan
sp3-C-Atome
• Reaktionen von ÜM-π-Alken-Komplexen
β-Addition bzw. β-Eliminierung (σ-π-Umlagerung, reversibel)
LnM
H +
R
H
H
LnM
LnM
Rotation
CH2
(α)
R
π-Komplex
Merke:
• planarer 4-Zentren-Übergangszustand
• Mitwirkung von d–AO′s des Übergangsmetalls
• Stabilitätsvergleich:
CHR (β)
LnM
CH2
σ-Komplex
CH2R
a) SiMe4 (TMS, NMR-Standard)
keine d–AO′s
PbMe4
sehr stabil
Kp 110°C
TiMe4
WMe6
Fp: -30°C (Td)
Fp: 30°C (Oh)
d–AO′s
b) Metallacycloalkane (speziell ~ pentane) sind relativ stabil (trotz β–H-Atomen), zerfallen
erst bei höheren Temperaturen aufgrund angeregter konformativer Änderungen:
LnM
LnM
LnM
LnM
"envelope"
(4 : 1)
Konformation
"twist"
(3 : 2)
6.2 Alkin-Komplexe (2e- und 4e-Donoren)
Alkin-Komplexe spielen eine Rolle bei der katalytischen Cyclooligomerisierung von Alkinen (zu Benzol bzw. COT nach Reppe).
• Bindungsverhältnisse (MO-Darstellung):
Alkine besitzen zwei orthogonale π-MO′s an sp-C-Atomen:
2 × CH
(sp-Hybrid)
mit py-, pz-AO's
Orbitalbilder:
π-MODiagramm:
πab
z
y
x
–
πb
−
+
C
+
C
−
−
C
+
−
C
+
C
−
besetzt
−
C
+
C
+
−
C
+
πy
π-Akzeptor-Funktion
(nur M-πzab-MO dargestellt):
leer
−
C
+
C
−
−
+
−
M −
+
sp3d2-Hybrid
oder
s-, pz-, dz2-AO
C
+
Überlappung
leer
−
−
+
πzb
C
+
πz
σ-Donor-Funktion
(nur M-πzb-MO dargestellt):
+
−
+
M
besetzt
+
−
dxz-AO
oder
px-ΑΟ
πzab
Merke:
a) Ligandenfunktion: 2e- bzw. 4e-Donor
b) Keine „lineare“ (wie bei N2-Komplexen), sondern „tetraedrische“ (selten auch tetrag.
planare) Brückenfunktion
c) Ein- bis vierzähnige Koordinationsmöglichkeit
• Übersicht/Beispiele/Strukturen
Alkine:
d (C≡C) :
124 pm
ν (C≡C) : 2100 cm-1 (Raman)
Zähnigkeit:
Donorfunktion:
Typ
ein
zwei
zwei
vier
2e
2e
4e
4e
C
C
C
C
M
C
M
M
C
C
M
Ph
Ph
Mn
OC
CO
R3P
Ph
CpNi
Pt
M
Tetrahedran-Cluster
Metallacyclopropen
Beispiel
M
C
Ph
NiCp
R
(CO)3Co
R
Co(CO)3
CpNi bzw. NiCp
PR3
Daten:
<) R−C−C
d (C≡C)
ν (C≡C)
160-180°
124
2020
≈ 140°
132
1750
≈ 140°
135
?
Verlust der Linearität in Alkinen
sp3
sp
< 140°
146 [pm]
?
[cm-1]
•
Darstellung mit Beispielen
Substitutionsreaktionen:
(Ph3P)2Pt(C2H4)
Co2(CO)8
O
(CO)3 Co
+ C2R2
+ RC≡CR
O
→
(Ph3P)2Pt(C2R2) + C2H4
→
{(CO)3CoCR}2 + 2 CO
R
R
→
C
C
(CO)3 Co
Co (CO)3
2 × {6 + 9 + 1 + 2} = 18 VE-Regel:
Co (CO)3
2 × {6 + 9 + 1 + 1 + 1} =
2 × 18 VE
Wade-Regel:
GEZ = 18 + 12 + 10 =
–2 × 12 –2 × 2
b-VE
40
= –28
=
12
= 6 b-MO′s
= n+2
⇒ nido-Cluster
= n+1
⇒ Tetraeder
Komplexbildung von instabilem Arin (C6H4)
Cp*
Me
120°
M
Me
− CH4
Me
Cp*
Ta
136
141
M = Nb, Ta
Cyclooligomerisationsreaktionen (ÜM-vermittelte organische Synthese)
a) Reppe-Synthese
Ni(CN)2/CaC2
n=4
COT
n C2H2
dito/PPh3
n=3
Benzol
b) Vollhardt-Reaktion
C
C
R1
H
(CH2)n
C
+
R1
CpCo(CO)2
(CH2)n
C
C
c)
C
H
R2
2
R
Khand-Reaktion (Alken, Alkin + CO)
+
C
C
+ CO
O
Co2(CO)8
stereo- und regioselektiv
6.3
Cyclopentadienyl-Komplexe (5e-Donoren)
6.3.1 Metallocene (Cp als Ligand)
•
Historisches
1951: Entdeckung durch 2 Arbeitsgruppen
300°C
a) Fe + C5H6
––→
Fe(C5H5)2 + H2
Miller, Tebboth, Tremaine
n=2
C10H10
n=3
Fe(C5H5)2 + 1/2 C10H10 + 3 MgBrCl
b) nC5H5MgBr + FeCl3
Kelly, Pauson
1952: Aufklärung durch 2 Arbeitsgruppen
a) E.O. Fischer: Doppelkegel-Struktur
Basis: Röntgenbeugung, Diamagnetismus, chem. Verhalten
b) G. Wilkinson/R.B. Woodward: Sandwich-Struktur
Basis: IR-Spektroskopie, Dipolmoment, Diamagnetismus
⇒ MO-Theorie
+ C10H8
Fulvalen
• Allgemeiner Überblick
Metallocene MCpn gehorchen nicht der 18 VE-Regel:
n = 1: Alkalimetalle, In, Tl
n = 2: Erdalkalimetalle, Lanthanoide (M2+)
ÜM = Ti, V, Cr, Mn, Fe, Co, Ni (und Homologe)
–→
VE = 14
18
20
M = IV. Hauptgruppe = Si, Sn, Ge, Pb
n = 3: Lanthanoide (M3+)
n = 4: Zr, Nb, Ta, Mo, U, Th, Hf (Actinoide4+)
Eigenschaften variieren von salzartig (Ionengitter, reaktiv, hydrolysieren, nicht sublimierbar) bis kovalent (Molekülgitter, hydrolysebeständig, sublimierbar)
• Strukturen/Besonderheiten/18 VE-Regel
a)
M
M
M = Fe, Ru, Os
eclipsed
D5h
auf Deckung
Rotationsbarriere (Gas): 4 kJ/Mol
M = Co, Ni
staggered
D5d
auf Lücke
ebenso Cp*2Fe (Cp* = C5Me5)
Diskussion:
ÜM
Fe
Co
Ni
Ru
Os
VE
18
19
20
18
18
M–Cp
204
210
218
221
222 [pm]
Cp–Cp
332
340
360
368
370 [pm]
b) Titanocen
Manganocen
(Dihydrido-Fulvalendiyl-Brücken)
gas: Monomere, staggered
fest: Kettenstruktur
H
Ti
Ti
Mn
H
Mn
ungewöhnliches magn. Verhalten:
high-/low-spin cross over
(Temperatur- u. Umgebungsabhängigkeit)
16 VE pro Titan
Grenzorbitalbereich in MnCp2:
e1
205 pm
Mn
Mn
a1
e2
6A1g
173 pm
2E2g
ΔE ≈ 2 kJ/Mol
Die Reihenfolge der Grenzorbitale e2 (dx2-y2, dxy), a1 (dz2) und e1 (dxz, dyz) axialsymmetrischer Metallocene resultiert aus einem einfachen Abstossungsmodell aufgrund
der „Ladungsschleifen“ der Cp′s auf die d-AO′s.
c) Cp2ME-Typen (M = IV. Hauptgruppe)
R
R
R
α (M
M
R
sp2-Hybrid
gewinkelt
M = Si (α = 155°)
M = Sn:
R = H (125°), Me (144°)
M:
M : s2 u. px, y, z
linear (coplanar)
M = Si (α = 180°)
M = Sn:
R = Ph (180°, propellerartig verdreht)
• Bindungsverhältnisse (MO-Darstellung)
a) π–MO-Schema mit Orbitalüberlappung von Cp−
−
Ring-Aufsicht mit sp2-C-Atomen,
pz-AO ⊥ Ringebene, Elektronendichte
ist delokalisiert
E
2 KE
πab δ−Akzeptor
Cp
M
1 KE
π2b π−Donor
Cp
M
0 KE
π1b σ−Donor
Cp
M
b) Orbitalüberlappung zwischen Cp und ÜM
σ-Donor (π1b)
π-Donor (1π2b)
δ-Akzeptor (1πab)
y
M
M
M
x
sp3d2-Hybrid
oder
s, pz, dz2-AO
dxz-AO
oder
dyz, px, py-AO
dx2-y2-AO
oder
dxy-AO
• Darstellung von Metallocenen
a)
Anionische Cyclopentadienylierung (Salzmetathese)
180°C
––→
C10H12
2 C5H6 + 2 Na
2 C5H6
→
(Retro-Diels-Alder-Reaktion)
2 NaC5H5
MCl2 + 2 NaC5H5 →
MCp2
+
H2 (CpH ÷ pKA ≈ 15)
+ 2 NaCl
(M = U, Cr, Mn, Fe, Co)
[Ni(NH3)6]Cl2
→
+ 2 CpH
NiCp2
+ 4 NH3
+ 2 NH4Cl (Base!)
NH3(l)
Co(NH3)4(SCN)2 + 2 LiCp –––→
Δ
[Co(NH3)6]Cp2 –→ CoCp2
b)
[Co(NH3)6]Cp2
+
+ 2 LiSCN
↓
6 NH3
Oxidative Cyclopentadienylierung (Metall + CpH)
M + n C5H6 →
MCpn +
n/2 H2
n = 1 : M = Li, Na, K (leicht)
n = 2 : M = Mg, Fe
(>50°C)
• Reaktionen von Metallocenen
a)
Elektrophile Substitutionsreaktionen (speziell FeCp2)
E
E
E
M
b)
M E
M
M
−H
Cp
Cp
Cp
Cp
18 VE
18 VE
17 VE
18 VE
Elektrophiler Abbau zu Tripeldecker-Komplexen (Werner, 1972)
Cp2Ni
HBF4
–––→
20 VE
[CpNiC5H6]+ ––→
{CpNi}⊕
18 VE
14 VE
– C5H6
H
Ni
Ni
+ NiCp2
–––––→
[Ni2Cp3]⊕
34 VE
Ni
Ni
Ni
6.3.2 Ternäre Cp-Komplexe (Cp-Metall-Derivate)
Übersicht
Carbonyl-
Halogeno-
Nitrosyl-Derivate:
Hydrido-Derivate:
O
N
Mn
C
O
Cr
CO
C
O
N
O
Ti
Cr
N
O
Cl
W
H
Cl
N
O
2 × 18 VE
18 VE
16 VE
18 VE
• Carbonyl-Derivate
Systematik:
Übergangsmetalle mit ungerader Elektronenzahl: einkernig (a)
Übergangsmetalle mit gerader Elektronenzahl: zweikernig (b)
a)
Mn
V
OC
OC
CO
CO
Cu
Co
CO
C
O
"pianostool"
OC
OC
CO
C
O
Jedes Übergangsmetall besitzt somit 18 VE
O
C
b)
C
M
C
O
C
O
M
O
O
CO
{CpFe(CO)2}2
C
O
M = Cr (2 CO-Brücken)
M = Mo, W (0 CO-Brücken)
H
Ni
Ni
vgl. c)
"butterfly"
c) Isomere von {CpFe(CO)2}2
O
O
O
C
Fe
Fe
Fe
C
O
C
O
Fe
C
O
O
O
O
C
C
C
O O
C
O
Fe
Fe
Fe
C
C
O
O
cis-Anordnung
O
C
Fe
C
O
trans-Anordnung
"scrambling of ligands"
Darstellung:
a) Oxidative Decarbonylierung mit C5H6
H
Fe
+ C5H6
β-Elim.
Fe
− 2 CO
Fe
− CO
H
η5-C5H5
η4-C5H6
− 1/2 H2
FeCp2 + Fe
220°C
1/4 {CpFe(CO)}4
- CO
Disproportionierung
140°C
50°C
1/2 {CpFe(CO)2}2
- CO
Clusterbildung
O
C
Fe
Fe
Fe
C
O
O
C
CO
Fe
4 × μ3-CO
Tetrahedranbzw. Cuban-Gerüst
b)
Carbonylierung von Metallocenen
Cp2Mn + 3 CO
Cp2Ni + Ni(CO)4
––→
–––→
CpMn(CO)3 +
{CpNiCO}2
–2 CO
..........
Symproportionierung
c)
Reduktive Carbonylierung von Halogen-Derivaten
Cp2TiCl2
+ Zn
+ 2 CO
NH3
––→
Cp2Ti(CO)2
+ [Zn(NH3)4]Cl2
Reaktionen:
a)
Substitution von CO-Liganden
THF/hν
Mn
+ Lig
Mn
− CO
Mn
− THF
O
Lig
"Cymantren"
b)
Redoxreaktionen
X2
2
Oxidation
Fe
{CpFe(CO)2}2
X
2 Na
−
2 Na+
Reduktion
Fe
c)
Ringsubstitutions-Reaktionen
Wie FeCp2 gehen auch CpMn(CO)3 und CpV(CO)4 typische „aromatische“
elektrophile Substitutionsreaktionen ein:
E
M
Lig.
E+
M
Lig
+
H+ (E+ = Elektrophil)
• Nitrosyl-Derivate
NO fungiert meist als 3e-Donorligand; es gibt ein- und zweikernige Derivate mit NO als
terminalem und verbrückendem Liganden
Einige Beispiele (mit Strukturen):
O
+
N
OC
Cr
C
O
Mn
NO
OC
C
O
Fe
N
O
Fe
N
O
"pianostool"
O
N
Cr
N
O
N
O
Cr
Co
Ni
N
O
O
N
N
Co
N
O
O
vgl. {CpFe(CO)2}2
vgl. {CpNiCO} 2 ("butterfly")
"Melkschemel"
Darstellung
Nitrosylierung von Metallocenen:
Cp2Ni
+
NO
20 VE
•
→
CpNiNO
+
½ C10H10
18 VE
Halogeno-Derivate
Halogenoliganden sind 1e-Donorliganden, in Brückenfunktionen 3e-Donoren; es gibt vor
allem Cp-Übergangsmetall-Carbonyl-Halogenide:
Beispiele (mit Strukturen):
Cl
Cl
Ti
V
M
Cl
Cl
Cl
16 VE
16 VE
OC
C
O
M
X
C
O
M = Cr, Mo, W
OC
M
M = Mo, W
18 VE
I
Ni
OC
C
O
I
alle 18 VE
M = Fe, Ru
Darstellung:
a)
Partielle anionische Cyclopentadienylierung
TiCl4
b)
+
→
Cp2TiCl2
+
2 NaCl
Oxidative Spaltung von Dimeren (X = Halogen)
{CpFe(CO)2}2
c)
2 NaCp
+ X2
→
CpFe(CO)2X
Halogenierung von Hydrido-Komplexen (H–Cl-Austausch)
Cp2MoH2 + 2 CHCl3
→
Cp2MoCl2
CpM(CO)3H + CCl4
→
CpM(CO)3Cl + CHCl3
(M = Mo, W)
vgl. S. 49 unten!
+ 2 CH2Cl2
Reaktionen:
Knüpfung von ÜM–C-, ÜM–M- und ÜM–NM-Bindungen:
a) Cp2TiCl2 + 2 MeLi
Ti
− 2 LiCl
Me
Me
Katalysator für homogene Alkenpolymerisation (nach Ziegler-Natta)
b) Cp2TiCl2 + (NH4)2S5
S
Ti
− 2 NH4Cl
S
S
S
S
Titanapentathiacyclohexan
Edukt für Polyschwefel-Cyclen: Gezielte Umsetzung mit Polysulfandichloriden:
Cp2TiS5
+ SnCl2
c) CpFe(CO)2X + Na[Mn(CO)5]
Cp2TiCl2
+
Fe
O
C
− NaX
OC
C
O OC
S5+n
O
C
Mn
C
O
CO
• Hydrido-Derivate
Es gibt nur wenige ternäre Verbindungen, dafür mehr mit CO- als Coliganden.
Ternäre Beispiele (Cp2MHn):
Re
H
M
H
H
M = Mo, W
H
M
H
H
M = Nb, Ta
Andere Beispiele:
H
H
OC
M
CO
C
H O
Re
H
H
H
H
M = Mo, W (≈ C3v)
vgl. auch
ReH92-
PBP
Darstellung:
MoVCl5 + 2 NaCp + NaBH4
→
Cp2MoIVH2 + ......
6.4 π-Perimeter-Komplexe
Hier werden als Übersicht zwei Typen von Verbindungsklassen vorgestellt, die Metallund damit Elektronenzahl-abhängig die cyclisch konjugierten Systeme CnHn(+,
0,–,2-)
als
Liganden in gemischten Sandwich-Komplexen (neben Cp-Liganden) bzw. Halbsandwich-Komplexen (neben M(CO)3-Fragmenten) enthalten und der 18 VE-Regel gehorchen:
• Cp-Metall-π-Perimeter-Komplexe
V
VI
VII
VIII
NG
Cp
Cp
Cp
Cp
Cp
Cp
V
Cr
Mn
Fe
Co
Ni
C7H7!
C7H7
C6H6
C5H5
C4H4
C3R3
7
6
5
4
3
• π-Perimeter-Metall-Tricarbonyl-Komplexe
V
VI
VII
7
6
5
C7H7
C6H6
V
(CO)3
VIII
NG
4
3
n
C5H5
C4H4
C3H3
Cr
Mn
Fe
Co
(CO)3
(CO)3
(CO)3
(CO)3
n
• Strukturen
Cp-Metall-π-Perimeter-Komplexe:
Cr
Mn
Fe
Co
Ni
Fe
Co
π-Perimeter-Metall-Tricarbonyl-Komplexe:
V
Cr
Mn






![[Cu{C2H4(NH2)2}2][CuI2]2 - chemie.uni](http://s1.studylibde.com/store/data/002538470_1-50622418e8086ee1fd60bf91727579d9-300x300.png)