[Cu{C2H4(NH2)2}2][CuI2]2 - chemie.uni
Werbung
![[Cu{C2H4(NH2)2}2][CuI2]2 - chemie.uni](http://s1.studylibde.com/store/data/002538470_1-50622418e8086ee1fd60bf91727579d9-768x994.png)
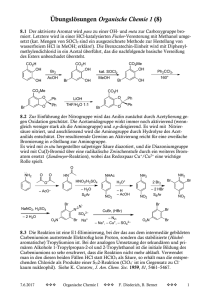
Bis(äthylendiamin)kupfer(ll)-dijodocuprat(I) [Cu{C2H4(NH2)2}2][CuI2]2
CuSO4 ∙ 5 H2O + 2 C2H4(NH2)2 -> [Cu{C2H4(NH2)2}2]SO4
249,69
120,20
279,80
[Cu{C2H4(NH2)2}2]SO4 + BaI2 ∙ 2 H2O -> [Cu{C2H4(NH2)2}2]I2 + BaSO4
279,80
427,18
437,55
233,40
[Cu{C2H4(NH2)2}2]I2 + 2 CuI - > [Cu{C2H4(NH2)2}2][CuI2]2
437,55
380,90
818,45
Das hydratisierte Kupfer(II)-Ion wird durch Jodid leicht zum unlöslichen CuI reduziert; das
Bis(äthylendiamin)kupfer(II)-Ion dagegen bleibt unter den gleichen Bedingungen unverändert. Komplexe
Kupfer(I)-Verbindungen, z.B. die Jodocuprat(I)-Ionen [CuI2]- und [CuI3]2-, sind gegenüber einer Oxidation
ähnlich stabil. Die Titelverbindung ist ein interessantes Beispiel für die Stabilisierung beider Oxidationsstufen des Kupfers durch Koordination.
a) Bis(äthylendiamin)kupfer(II)-jodid-Lösung
10 g 70-75proz. Äthylendiamin werden unter Rühren in eine Lösung von 12,5 g (50 mmol) CuSO4 ∙ 5 H2O in
50 ml H2O gegeben. Diese Lösung wird portionsweise unter Rühren mit 21,4 g (50 mmol) BaI2 ∙ 2 H2O in 50
ml H2O (praktisch hergestellt durch Lösen der berechneten Menge BaCO3 in Jodwasserstoffsäure) versetzt.
Das ausgefallene BaSO4 wird ab filtriert und 2 mal mit jeweils 25 ml Wasser gewaschen. Das Waschwasser
wird mit dem Filtrat vereinigt.
b) Reaktion mit CuI
In einer siedenden Lösung von 120 g (720 mmol) KI in 150 ml H2O werden 19,05 g (100 mmol) CuI gelöst.
Die Lösung wird heiß filtriert, nochmals zum Sieden erhitzt und dann unter intensivem Rühren der ebenfalls
siedenden Lösung a) zugesetzt. Die sofort beginnende Fällung ist nach Abkühlung auf Zimmertemperatur
vollständig. Die braunen Kristalle werden ab filtriert, 5mal mit l00 ml-Portionen Eiswasser und anschließend
mit 100 ml Aceton gewaschen. Getrocknet wird entweder an der Luft oder bei 110 °C im Ofen.
Ausbeute mindestens 33,6 g (82 °/o).
Eigenschaften:
Schokoladenbraune, kristalline Verbindung. F. 267 °C (Zers.). Schwerlöslich in kaltem H2O und organischen
Solventien. Siedendes H2O zersetzt sofort zu unlöslichem CuI und einer rötlich-blauen Lösung von
Bis(äthylendiamin)kupfer(II)-jodid. Reduziert eine kalte wässrige AgNO3-Lösung sofort zu metallischem
Ag.
Literatur:
B. E. Douglas, J. Chem. Educ. 29, 119 (1952).
G. W. Polly, D. E. Jackson u. B. E. Bryant, Inorg. Synth. 5, 16 (1957).