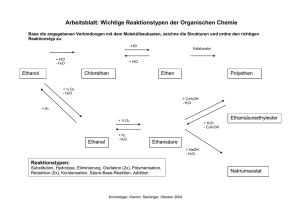
ppt - ChidS
Werbung

Es ist flüssig! Es ist klar! Es riecht nicht! Man kann es trinken! Wasser H2O Ein nicht allzu trockenes Thema! Übersicht 1. Allgemeines und Historisches 2. Das Wassermolekül 3. Eigenschaften 4. Reaktionen von Wasser 5. Umwelt und Wasseraufbereitung 6. Schulrelevanz 1. Allgemeines und Historisches 1.1 Vorkommen Globale Wasservorräte: 1,38 Mrd. km3 • 97,4% Salzwasser • 2,6 % Süßwasser, einschließlich Eis in Meeren und Gletschern) • 0,27% Trinkwasser: 3,6 Mio. km3 1. Allgemeines und Historisches 1.2 Das „Element“ Wasser: Annahme bis zu Beginn des 18.Jahrhunderts: Wasser eines der vier alten Elemente des Mittelalters: (Luft, Erde, Feuer und Wasser) 1. Allgemeines und Historisches Wasser: alle Flüssigkeiten Erde: alle Feststoffe (Metalle, Holz, Oxide, Salze) Luft : alle Gase z.B. brennbare Luft (air inflammable) = Wasserstoff atembare Luft (air respirable) = Sauerstoff Feuer: Energie (freigewordene bzw. zugeführte Energie) 1. Allgemeines und Historisches 1.3 Entlarvung der Verbindung Wasser Cavendish, 1783: Bei Verbrennung der brennbaren Luft entsteht Wasser. Monges, Lavoisiers und Laplaces Idee: Wasser ist ein zusammengesetzter Körper (Verbindung) aus der air inflammable (H2Gas) und der air respirable (O2-Gas). 1. Allgemeines und Historisches 1.3 Entlarvung der Verbindung Wasser Lavoisier, 1784 erkannte: Wasser ist ein Oxid. Reaktionsgleichung: 0 +I -II +II/+III -II 0 3 Fe(s) + 4 H2O(g) Fe3O4 (s) + 4 H2 (g) 1. Allgemeines und Historisches V1: Zersetzung von Wasser Reaktionsgleichung: 0 +I +II 0 Mg(s) + H2O(g) MgO(s) + H2(g) 2. Das Wassermolekül V2: Elektrolyse von Wasser Eigendissoziation des Wassers: H2O 2 H+(aq) + OH (aq) - Anode: 4 OH (aq) O2 (g) + 2 H2O + 4 eKathode: 4 H+(aq) + 4 e- 2 H2 (g) ___________________________________________________________ - 4 H+(aq) + 4 OH (aq) 2 H2 (g) + O2 (g) + 2 H2O Wasser besteht aus Wasserstoff und Sauerstoff im Verhältnis: 2:1 2. Das Wassermolekül V2a+b: Nachweis von H2 + O2 (a) Nachweis von Wasserstoff (Knallgasprobe): 0 0 +I -II H2 (g) + ½ O2 (g) H2O (g) H<0 (b) Nachweis von Sauerstoff (Glimmspanprobe): 0 0 +IV -II C(s) + O2 (g) CO2 (g) 2. Das Wassermolekül 2.1 Struktur des Wassermoleküls H2O O-Atom: sp3-hybrisiert daher Molekül gewinkelt Erwartet: Winkel von 109,5° (Tetraeder) Jedoch: Winkel von 104,45° Laut VSEPR-Theorie: freie Elektronenpaare des Sauerstoffs benötigen mehr Platz Verkleinerung des HOH-Winkels 2. Das Wassermolekül 2.2 Wasser ist ein Dipol – unterschiedlich starke Anziehung der bindenden Elektronen – beschreibt die Elektronegativität: O: 3,5 H: 2,1 • O: partiell negativ • H: partiell positiv Dipol: „Moleküle, in denen die Ladungsschwerpunkte der positiven und negativen Partialladungen nicht zusammenfallen, stellen einen Dipol dar.“ 2. Das Wassermolekül D1: Ablenkung eines Wasserstrahls 3. Eigenschaften 3.1 Allgemeine Eigenschaften – Schmelz- und Siedepunktsanomalie (0°C/100°C) 3. Eigenschaften Wasserstoffbrückenbindung Energie: 21 kJ/mol 3. Eigenschaften Aggregatzustände Struktur von Eis 1 -Tridymit-Struktur 7 kristalline Phasen bekannt 3. Eigenschaften D2: Schwimmen einer Büroklammer Oberflächenspannung Wasserstoffbrückenbindungen Grenzflächenaktive Substanzen (z.B. Tenside) können diese herabsetzen. Die Klammer geht unter! 3. Eigenschaften 3.2 Anomalie des Wassers Eis besitzt als Festkörper eine geringere Dichte als flüssiges Wasser. Eis schwimmt auf Wasser. Eis dehnt sich aus. Sprengungen 3. Eigenschaften 3.3 Löslichkeit von Salzen und Gasen 3.3.1 Salze 3. Eigenschaften V3: Lösen von Salzen Lösen von CaCl2 Erwärmung der Lösung Bildung von Ca2+ und Cl-Ionen Hydratationsenergie größer als die Gitterenergie des Kristalls Lösen von NH4NO3 Abkühlung der Lösung + Bildung von NH4 und NO3 -Ionen Hydratationsenergie niedriger, 3. Eigenschaften Demonstration 3: 3.3.2 Gase 3. Eigenschaften V4: Leitfähigkeitsmessung (a) Entionisiertes Wasser (b) Leitungswasser (c) Salz (d) Salzlösung H2O NaCl(s) Na+ (aq) - + Cl (aq) 3. Eigenschaften 3.4 Leitfähigkeit Durch Elektrolyte, hier die gelösten Ionen Träger des elektrischen Stroms: Ionen – Kationen zur Kathode (negativ) – Anionen zur Anode (positiv) 3. Eigenschaften 3.5 Wasser definiert den pH-Wert Definition: pH = -log [c(H3O+)] Wasser hat pH 7, d.h. c(H3O+) = 10-7 mol/L Autoprotolyse des Wassers: 2 H2O H3O+(aq) + OH (aq) Durch Lösen von Salzen kann sich der pH-Wert ändern. 3. Eigenschaften V5: pH-Wert (a) Lösen von NaHSO4 NaHSO4(s) HSO4-(aq) + H2O + HSO4 (aq) 2SO4 (aq) + H3O+(aq) Säure 1 Base 1 Na+(aq) Base 2 Säure 2 sauer (b) Lösen von Na2CO3 2- Na2CO3(s) 2 + CO3 (aq) 2CO3 (aq) + H2O HCO3 (aq) +OH-(aq) Na+(aq) Base 1 Säure 2 alkalisch Säure 1 Base 2 4. Reaktionen mit Wasser V6: Erkennungsreaktion Wasserfreies weißes Kupfersulfat wird bei Anwesenheit von Wasser blau. 4 H2O koordinieren quadratisch-planar Fünfte über H-Brücken an Sulfationen und Koordinationswasser gebunden. [Cu(H2O)4]SO4·H2O 100°C -2H2O CuSO4·3H2O 130°C -2H2O CuSO4·H2O 250°C -H2O CuSO4 4. Reaktionen mit Wasser V7: Reaktion mit Natrium Reaktionsgleichung: 0 +I 2 Na(s) + 2 H2O 2 +I Na+(aq) 0 - + 2 OH (aq) + H2 (g) alkalisch Phenolphthalein färbt sich violett 5. Umwelt und Wasseraufbereitung 5.1 Täglicher Verbrauch: In Deutschland seit 1980: Verbrauch im Haushalt pro Person täglich konstant etwa 145 L einschließlich des industriellen Verbrauchs etwa 220 L pro Einwohner und Tag. Deckung: 62% Grundwasser 12 % Quellwasser 6% Uferfiltrat 20% Oberflächenwasser 5.1 Täglicher Verbrauch: Aufteilung des täglichen Trinkwasserverbrauchs in Deutschland pro Einwohner Toilettenspülung Baden, Duschen Wäschewaschen Körperpflege Geschirrspülen Garten bewässern Auto waschen Kochen, Trinken Sonstiges 46 L 44 L 17 L 9L 9L 6L 3L 3L 8L 5. Umwelt und Wasseraufbereitung 5.2 Wasseraufbereitung Entfernung suspendierter Teilchen Siebung, Sedimentation, Flockung, Filtration Entölung Aktivkohlefilter Entfernung unerwünschter Ionen Ionenaustauscher, Umkehrosmose 5. Umwelt und Wasseraufbereitung 5.3 Energie aus Wasser und Wasserstoff Walchensee-Kraftwerk 5. Umwelt und Wasseraufbereitung 5.3 Energie aus Wasser und Wasserstoff Wasserstoffauto 6. Schulrelevanz Klasse 8 – 2.2 Wasser und Wasserstoff • Eigenschaften und Bedeutung des Wassers • Synthese von Wasser • Kreislauf des Wassers Klasse 9 – 3. Elektrolyse und Ionenbegriff Klasse 10 – 2.3 Wassermolekül als Dipol • • • • Flüssigkeitsstrahl im elektrischen Feld Räumlicher Bau des Wassermoleküls Wasser als Lösungsmittel für Salze Wasserstoffbrückenbindungen