Begleitmaterial zur Vorlesung ACI (LA) Teil 3
Werbung
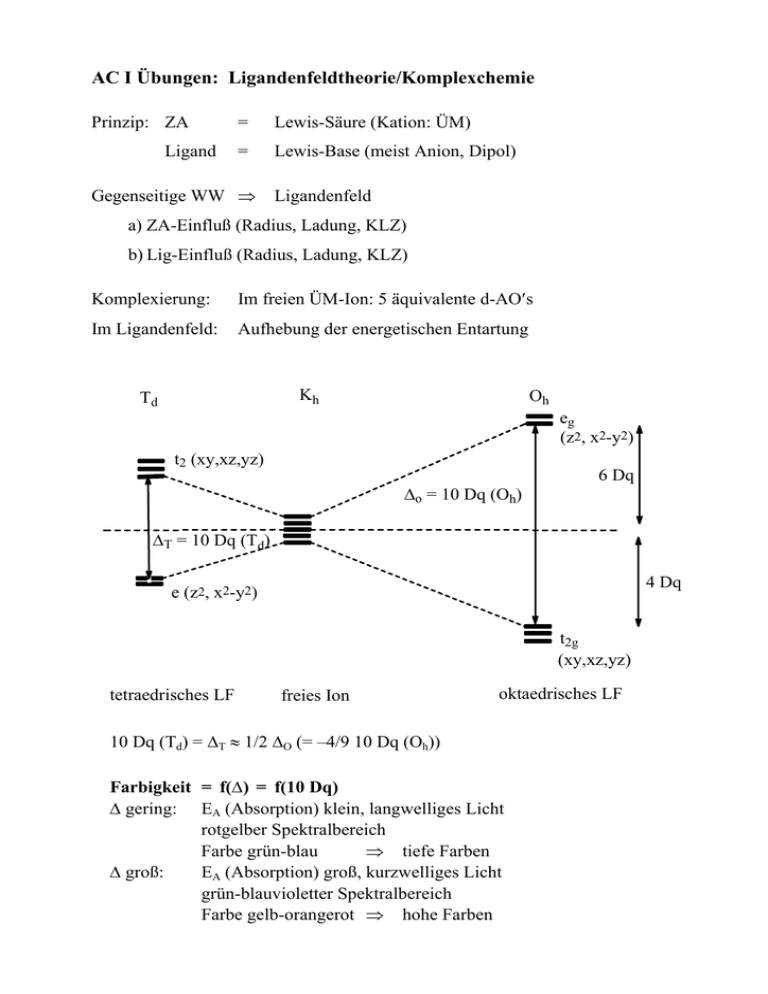
AC I Übungen: Ligandenfeldtheorie/Komplexchemie Prinzip: ZA Ligand = Lewis-Säure (Kation: ÜM) = Lewis-Base (meist Anion, Dipol) Gegenseitige WW ⇒ Ligandenfeld a) ZA-Einfluß (Radius, Ladung, KLZ) b) Lig-Einfluß (Radius, Ladung, KLZ) Komplexierung: Im freien ÜM-Ion: 5 äquivalente d-AO′s Im Ligandenfeld: Aufhebung der energetischen Entartung Kh Td Oh eg (z2, x2-y2) t2 (xy,xz,yz) ∆o = 10 Dq (Oh) 6 Dq ∆T = 10 Dq (Td) 4 Dq e (z2, x2-y2) t2g (xy,xz,yz) tetraedrisches LF freies Ion oktaedrisches LF 10 Dq (Td) = ∆T ≈ 1/2 ∆O (= –4/9 10 Dq (Oh)) Farbigkeit = f(∆) = f(10 Dq) ∆ gering: EA (Absorption) klein, langwelliges Licht rotgelber Spektralbereich Farbe grün-blau ⇒ tiefe Farben ∆ groß: EA (Absorption) groß, kurzwelliges Licht grün-blauvioletter Spektralbereich Farbe gelb-orangerot ⇒ hohe Farben ∆ = 10 Dq ist vorhersagbar ⇒ Größe, Ladung ZA Stärke, Ladung Lig Spektrochemische Serie der ZA: (steigende ∆-Werte v.l.n.r.) Mn2+ < Ni2+ < Co2+ < Fe2+ < Fe3+ < Cr3+ < Co3+ < Ti3+ Beispiel: M(H2O)6n+-Komplexe schwachrosa grün blau violett Spektrochemische Serie der Liganden: (steigende ∆-Werte v.l.n.r.) I¯ < Br¯ < S2− < Cl¯ < F¯ < OH¯ < H2O < NH3 < NO2¯ < CN¯ < CO schwache Liganden Beispiele: Cu2+: gelbgrün Co2+: starke grün-blau tiefblau blau rosa Ni2+: grün blau Anwendung : a) Exsikkatoren (Co2+/Silicagel) wasserfrei, trocken: blau CoCl2 wasserhaltig: rosa [Co(H2O)6]2+Cl2 b) Sympathetische Tinte Schreiben mit [Co(H2O)6]Cl2 (auf rosa Papier, unsichtbar) nach Erwärmen blaue Schriftzüge zu sehen c) Hydratisomerie CrCl3 • 6 H2O [Cr(H2O)6]Cl3 [Cr(H2O)5Cl]Cl2•H2O [Cr(H2O)4Cl2]Cl•2 H2O Farbe: tiefviolett grauviolett grün EA: gelborange orange rot ⇒ Chlorid ist schwächer als H2O Chlorophyll (ein Mg-Komplex mit Porphyrinliganden) (eigentlich vierzähniger 2,3-Dihydroporphyrin-Ringligand = Chlorin) – ohne Chlorophyll keine Photosynthese, ohne PS kein tierisches/pflanzliches Leben R Et Me N N a) R = Me (blaugrün) b) R = C(H)O (gelbgrün) Mg N N Me hydriert 3 Me 2 O C O OC20H39 OMe Phytylrest (lipophil) O zusätzlich C20H39OH = Phytol lipophil Vitamin B12 (Cobalamine) (Co3+ mit Corrin-Gerüst) Co3+ mit M–C-Bindung, natürliche metallorg. Verbindung C(O)NH2 Me O Me C(O)NH2 H2N C Me Me X N C(O)NH2 N Co N N Me X = Me: Methylcobalamin X = CN: Cyanocobalamin (Vitamin B12) X = R = 5'-Desoxyadenosyl (Coenzym) Me H2N(O)C HO OH Me N NH2(O)C O H > C O P O− HN Me N O N HOCH2 O C(O)NH2 O N CH2 N N N > X N NH2 Hämoglobin (Porphinat)imidazol FeIIO2-Komplex Wichtig für O2-Aufnahme (Lunge) u. -Transport (Blut) sowie O2-Speicherung O O N N FeII = Fe ^ N N N N His Porphyrin-Ligand (Muskel) Desoxy-Form: Fe2+/d6-System paramagn./high-spin S=2 FeII out of plane Oxy-Form: Fe2+/d6-System diamagn./low-spin S=0 20 pm shift. FeII in plane Kreislauf des Lebens: Cm(H2O)n Chlorophyll + Licht m CO2 m O2 Wärme + Hämoglobin n H2O








![[Cu{C2H4(NH2)2}2][CuI2]2 - chemie.uni](http://s1.studylibde.com/store/data/002538470_1-50622418e8086ee1fd60bf91727579d9-300x300.png)

