Nomenklatur - Universität des Saarlandes
Werbung

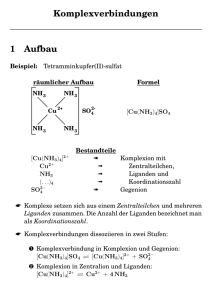
Universität des Saarlandes - Fachrichtung 8.11: Anorganische Chemie Einführungspraktikum Allgemeine und Anorganische Chemie ACG Übung 4 Nomenklatur I. Ionische Verbindungen1 Bei den Verbindungen wird zuerst der elektropositivere Partner benannt. Die Endung des elektronegativeren Partners „-id“ deutet auf ein Elementanion hin: Cl- Chlorid H- Hydrid S2- Sulfid O2- Oxid Ausnahmen: OHCN- Hydroxid Cyanid Die Bezeichnungen von mehratomigen Anionen leitet man von den Säurenamen ab. Bilden die gleichen Elemente mehrere Säuren, so ist die Endung des entsprechenden Anions der sauerstoffreicheren Verbindung „-at“, die Endung des sauerstoffärmeren Anions „-it“. Ein zusätzliches Sauerstoffatom kann durch das Präfix „per-“ und die Endung „-at“, ein Sauerstoffatom weniger durch das Präfix „hypo-“ und die Endung „-it“ gekennzeichnet werden. ClO4- Perchlorat Tetraoxochlorat(VII) NO3- Nitrat ClO3- Chlorat Trioxochlorat(V) NO2- Nitrit ClO2- Chlorit Dioxochlorat(III) SO42- Sulfat ClO- (Mono)Oxochlorat(I) SO32- Sulfit Hypochlorit Bilden Elementpaare mehrere verschiedene Verbindungen, so wird die Oxidationszahl in römischen Ziffern im Anschluß an den Namen des Metalles (oder elektropositiveren Partners) angefügt. ... oder ... Benützung von griechischen Zahlwörtern als Präfixe vor dem entsprechenden Element. Präfixe: mono (1), di (2), tri (3), tetra (4), penta (5), hexa (6), hepta (7), octa (8) etc. Beispiele: 1 Eisen(II)-chlorid, Eisen(III)-chlorid, aber besser: Distickstofftrioxid Jander, Blasius; Lehrbuch der analytischen und präparativen anorganischen Chemie, (1989), XXVII. 2. Komplexe:2,3 Regeln für die Nomenklatur: Zur systematischen Benennung von Komplexsalzen gibt man wie bei den Formeln zuerst das Kation (gleichgültig ob komplex oder nicht) und dann das Anion ein. Die Nennung der Bestandteile einer Koordinationseinheit geschieht in folgender Reihenfolge: 1. Die Anzahl der Liganden wird durch vorangestellte griechische Zahlwörter angegeben: (mono), di, tri, tetra, penta, hexa, hepta, octa usw. Bei Liganden mit kompliziertem Namen oder zur Vermeidung von Mehrdeutigkeiten (z.B. S2O32-) verwendet man die aus den griechischen Zahlwörtern abgeleiteten Multiplikatoren bis, tris, tetrakis, pentakis, hexakis usw. Der hierdurch vervielfachte Teil folgt in Klammern. 2. Art der Liganden: Die verschiedenen Liganden werden ohne Berücksichtigung ihrer Anzahl und ihrer Ladung in alphabetischer Reihenfolge genannt. Anionische Liganden erhalten die Endung –o. Die Namen neutraler Liganden werden nicht verändert. Ausnahmen von dieser Regel sind die Namen von H2O, NH3, CO und NO. 3. Zentralion: In einem komplexen Anion erhält das Zentralion (mit lateinischem Wortstamm) die Endung –at. Ist der Komplex ein Kation oder ein neutrales Molekül, dann ändert sich der Name des Zentralions (mit deutscher Bezeichnung) nicht. 4. Ladung des Zentralions: Die Ladung des Zentralions (=Oxidationszahl) wird durch eine in runde Klammern gesetzte römische Ziffer angegeben und dem Namen der Koordinseinheit nachgestellt. (Ein Pluszeichen wird nicht geschrieben; für Null wird die arabische Ziffer 0 benutzt.) Der vollständige Name der Koordinationseinheit wird in einem Wort geschrieben. Bis auf die Namen der Liganden H2O, NH3, CO und NO werden die Namen aller neutralen Liganden in runde Klammern gesetzt. Die Namen anorganischer anionischer Liganden werden dann in runde Klammern gesetzt, wenn sie bereits numerische Vorsilben enthalten (z.B. triphosphato P3O105-) oder wenn dadurch Mehrdeutigkeiten vermieden werden. Im Namen von Komplexsalzen wird zwischen den Namen des Kations und des Anions ein Bindestrich geschrieben. Hexaammincobalt(III)-chlorid Beispiele: [Co(NH3)6]Cl3 K3[Fe(CN)6] Kalium-hexacyanoferrat FClBr- fluoro chloro bromo SCNCH3COONO2- I- iodo ONO- S2OH- thio hydroxo SO42- 2 3 thiocyanato acetato nitro (N am Zentralion) nitrito (O am Zentralion) sulfato S2O32CO32H2O thiosulfato carbonato aqua NH3 ammin CO NO carbonyl nitrosyl Jander, Blasius; Lehrbuch der analytischen und präparativen anorganischen Chemie, (1989), S/77. W. Amann, …; elemte ChemieII, (Ernst Klett Verlag); (1989), S/139. Übungen zur Gruppenarbeit Nomenklatur KZ = 2 (linear) [Ag(NH3)2]Cl Na3[Ag(S2O3)2] K[Ag(CN)2] KZ = 4 (tetraedrisch) K[Al(OH)4] Na2[Cd(CN)4] Ag2[HgI4] [SiO4]4Li[AlH4] [Pb(OH)4]2KZ = 4 (quadratisch planar) [Pt(NH3)4]Cl2 [Pt(NH3)2Cl2] K[AuF4] KZ = 6 (oktaedrisch) [Ni(OH2)6]2+ [Co(NH3)6]Cl3 [Pt(NH3)4I2]I2 (NH4)2[PtCl6] [Pt(NH3)5OH]Cl3 Na2[SnCl6] K2[MnF6] KZ = 8 (kubisch) K3[TaF8] Name der Verbindung