Eosinophilie bei Tropenrückkehrern und Migranten
Werbung

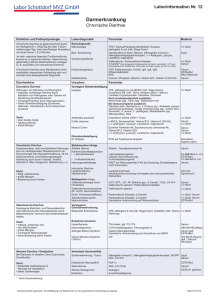
MEDIZIN ÜBERSICHTSARBEIT Eosinophilie bei Tropenrückkehrern und Migranten Stephan Ehrhardt, Gerd D. Burchard ZUSAMMENFASSUNG Einleitung: Eine Eosinophilie bei Tropenrückkehrern wird häufig durch Wurminfektionen ausgelöst. Sie entsteht vor allem bei der Gewebswanderung invasiver Larven. Methode: Übersicht auf der Basis einer Auswertung selektiv recherchierter Literatur in Medline mit den Suchbegriffen „eosinophilia“ und „helminth“ Ergebnisse: Abhängig von der geografischen Anamnese und der Nahrungsmittelanamnese sind bestimmte Wurminfektionen wahrscheinlicher als andere. Die Autoren empfehlen daher gezielte Untersuchungsprogramme für den praktisch tätigen Arzt, die sich im Wesentlichen an Leitsymptomen, aber auch an geografischen sowie nahrungsspezifischen Gegebenheiten orientieren. Aufwendige technische Untersuchungen sind nur in Ausnahmefällen angezeigt. Diskussion: Obgleich die Eosinophilie ohne weitere anamnestische Angaben nur einen geringen positiven prädiktiven Wert für eine Wurminfektion hat, ist sie bei Neuauftreten nach einem Aufenthalt in den Tropen ein deutlicher Hinweis auf eine Helminthose. Dtsch Arztebl 2008; 105(46): 801–7 DOI: 10.3238/arztebl.2008.0801 Schlüsselwörter: Eosinophilie, Wurminfektion, Auslandsreise, Migration, Differenzialdiagnose Bernhard-Nocht-Institut für Tropenmedizin, Hamburg: Dr. med. Ehrhardt Sektion Infektiologie und Bernhard-Nocht-Klinik für Tropenmedizin, I. Medizinische Klinik, Universitätsklinikum Hamburg-Eppendorf, Hamburg: Prof. Dr. med. Burchard ⏐ Jg. 105⏐ ⏐ Heft 46⏐ ⏐ 14. November 2008 Deutsches Ärzteblatt⏐ ie Ursachen einer Eosinophilie sind vielfältig. Sie umfassen beispielsweise allergische Erkrankungen, Hauterkrankungen, maligne Erkrankungen oder auch die Einnahme von Medikamenten (1). Folglich ist bei der Abklärung einer Eosinophilie auch an nicht parasitäre Ursachen zu denken. Bei einer neu aufgetretenen Eosinophilie nach einem Aufenthalt in den Tropen ist jedoch eine Wurminfektion (Helminthose) die wahrscheinlichste Ursache. Bis zu 5 % der asymptomatischen Tropenrückkehrer haben eine abklärungsbedürftige Eosinophilie, zwischen 14 und 48 % der Tropenrückkehrer mit Eosinophilie leiden unter einer behandlungsbedürftigen Parasitose (2–6). Bei Immigranten mit Eosinophilie wurden, abhängig von deren Herkunft, in bis zu 77 % der Fälle Helminthen gesichert (7, 8). Andererseits sind die Sensitivität und Spezifität einer Eosinophilie zur Diagnose einer Helminthose niedrig und der positive prädiktive Wert betrug in manchen Studien lediglich etwa 10 % (4). Irrtümlicherweise wird in der Praxis oft ein erhöhter prozentualer Anteil eosinophiler Granulozyten im Differenzialblutbild als „Eosinophilie“ bezeichnet. Entscheidend ist aber vielmehr die Zahl eosinophiler Granulozyten pro μL Blut. Bei gesunden Menschen sind durchschnittlich weniger als 450 Eosinophile pro μL Blut vorhanden. Je nach Tageszeit kann dieser Wert bis zu 40 % in Abhängigkeit vom Kortisolspiegel variieren (9). Auch das Alter des Patienten, der körperliche Trainingszustand sowie Umweltfaktoren (insbesondere Allergenexposition) beeinflussen die Zahl der Eosinophilen im peripheren Blut. Das Ausmaß einer Eosinophilie kann in folgende Kategorien eingeteilt werden: leichte Eosinophilie: bis 1 500/μL mäßige bis starke Eosinophilie > 1 500/μL (nach [10], modifiziert). Ein weiterer hilfreicher Laborparameter ist das Gesamt-IgE. Eine Erhöhung der IgE-Konzentration tritt bei verschiedenen Wurmerkrankungen auf. Es bestehen zwar wechselseitige pathophysiologische Beziehungen zwischen dem IgE und der Eosinophilie, jedoch nur eine geringe Korrelation (11). Bisher existieren keine Leitlinien zur Abklärung einer Eosinophilie durch den Hausarzt. Ärzte fragen häufig tropenmedizinische Institute um Rat. Die Autoren empfehlen im Folgenden strukturierte Untersuchungsprogramme, die sich an der geografischen D 801 MEDIZIN Abbildung 1: Subkonjunktivale Lokalisation von Loa loa Anamnese und an Leitsymptomen orientieren. Sie basieren auf epidemiologischen Daten zu importierten Erkrankungen (12–20), insbesondere auf Surveillance-Daten aus dem GeoSentinel Netzwerk (21–23). Ökonomisches Vorgehen und eine möglichst geringe Belastung für den Patienten zählten ebenfalls zu den Zielen bei der Entwicklung dieser Programme. Die Autoren schlagen Untersuchungsprogramme für den „Generalisten“ vor, nicht etwa für den Spezialisten, bei dem detailliertes Wissen um Übertragungswege und Manifestationsformen auch sehr seltener tropischer Infektionserkrankungen vorausgesetzt wird. Im Zweifel muss ein Tropenmediziner eingeschaltet werden, der über Spezialwissen zu Prävalenzen und klinischen Manifestationen seltener tropischer Erkrankungen verfügt. Die wichtigsten Helminthosen sind – inklusive Klinik, Diagnostik und Therapie – in der eTabelle zusammengestellt. Systematische Evidenzrecherche Diagnostik und Behandlung von Tropenerkrankungen sollte evidenzbasiert sein. Allerdings gibt es zu vielen tropenmedizinischen Fragestellungen keine ausreichend kontrollierten Studien. Liegen Untersuchungen vor, so sind diese oft in Entwicklungsländern durch- geführt worden und im Ergebnis nicht auf Deutschland übertragbar. Zudem werden viele parasitäre Erkrankungen selten in Industrienationen importiert, sodass ausreichende Fallzahlen nicht zustande kommen. Folglich ist es schwierig, Methoden zur Interpretation und Bewertung der Evidenzstärke anzugeben. Auch die Publikationen der Cochrane Collaboration sind kaum hilfreich. Denn ihre Arbeiten decken aus oben genannten Gründen nur kleine Teilbereiche der Tropenmedizin ab und die Fragestellungen sind in der Regel auf Entwicklungsländer zugeschnitten. Es verwundert somit nicht, dass es international kaum Leitlinien gibt. Auch in Deutschland existieren keine Leitlinien zur Abklärung einer Eosinophilie bei Tropenrückkehrern und Migranten. Die vorliegende Arbeit beruht demnach auf Expertenmeinung und wurde im informellen Konsens erarbeitet. Recherchiert wurde anhand der Datenbank Medline mittels der Suchbegriffe „eosinophilia“ und „helminth“ für den Zeitraum 1983 bis 2008. Diagnostische Strategien Da Infektionen durch Helminthen ernste gesundheitliche Schäden nach sich ziehen können und eine Eosinophilie auch Hinweis auf verschiedene maligne Krankheiten sein kann, ist eine rasche und effiziente Abklärung unerlässlich. Während die Behandlung von Wurmerkrankungen in den meisten Fällen einfach, kostengünstig und sicher ist, ist eine unstrukturierte Abklärung einer Eosinophilie oft zeitintensiv, teuer und belastend für den Patienten. Bei negativen Testergebnissen und fortgesetztem Verdacht auf Helminthose sollte man einen Tropenmediziner hinzuziehen. Anamnese Die geografische Anamnese ist besonders wichtig. Einige Helminthen kommen weltweit vor, andere nur in umschriebenen geografischen Gebieten. Loa loa (Abbildung 1) findet man beispielsweise nur in Zentralund Westafrika, Spulwürmer sind dagegen auf der ganzen Welt verbreitet. Bei Reisenden, die aus Gegenden mit Bilharziose zurückkehren, muss der Kontakt TABELLE 1 Durch Nahrungsmittel übertragene Helminthen (e20–e22) 802 Nahrungsmittel Erreger Fisch, wenn roh oder ungenügend erhitzt Anisakis und Pseudoterranova, Clonorchis sinensis, Opisthorchis, Diphyllobothrium latum Schweinefleisch Taenia solium Rindfleisch Taenia saginata Wasserkresse, Wasserspinat u. a. Fasciola Schalen- und Krustentiere Paragonimus Fisch, Frösche, Schlangen, Haustiere mit Fisch gefüttert Gnathostoma Schwein, Wildschwein, Bär, Pferd, Walross u. a. Trichinella ⏐ Jg. 105⏐ ⏐ Heft 46⏐ ⏐ 14. November 2008 Deutsches Ärzteblatt⏐ MEDIZIN TABELLE 2 Abklärung einer asymptomatischen Eosinophilie Eosinophile pro µl Blut Empfohlenes Screeningprogramm Besonderheiten 1 500 3 × Stuhluntersuchung auf Wurmeier, wenn negativ: Strongyloides- und SchistosomenAntikörper im Serum (wenn Patient aus Bilharziosegebiet; siehe Kasten 1) bei negativen Ergebnissen: Kontrolle nach 3 Monaten > 1 500 3 × Stuhluntersuchung auf Wurmeier 1 × Stuhluntersuchung nach Baermann auf Strongyloides-stercoralis-Larven Strongyloides-, Schistosomen- (wenn Patient aus Bilharziosegebiet; siehe Kasten 1), Fasciola- (wenn Patient nicht aus Bilharziosegebiet) und Zystizerken-Antikörper im Serum EKG, Röntgen-Thorax, Abdomensonografie wenn Patient aus Afrika südlich der Sahara: zusätzlich Filarien-Antikörper im Serum bei negativen Ergebnissen: Überweisung an Tropenmediziner zu natürlichen Süßgewässern gesondert abgefragt werden. Außerdem kann eine Nahrungsmittelanamnese wertvolle Hinweise auf die Art einer Wurminfektion geben. So werden Leberegel meist durch den Verzehr von Wasserpflanzen wie Wasserkresse übertragen, Lungenegel durch Süßwasserkrabben und der Heringswurm durch rohen Seefisch (Tabelle 1). Abbildung 2: Larven von Strongyloides stercoralis im Dünndarm Labordiagnostik Neben der Quantifizierung der Eosinophilie im Differenzialblutbild stehen der direkte Parasitennachweis sowie die Immundiagnostik im Vordergrund. Wünschenswert ist der direkte Nachweis von adulten Würmern, Larven im Blut oder Wurmeiern im Stuhl. Denn dies ist ein eindeutiges Ergebnis und bedarf nicht der Interpretation, wie zum Beispiel bei immundiagnostischen Verfahren. Bei Infektionen mit adulten Würmern oder mit Wurmlarven, die im Gewebe lokalisiert sind, ist ein Direktnachweis jedoch oft nicht möglich. Es ist dann notwendig auf die Antikörperdiagnostik zurückzugreifen. Dabei muss man beachten, dass Kreuzreaktionen innerhalb der drei Gruppen der Bandwürmer (Zestoden), Rundwürmer (Nematoden) und Saugwürmer (Trematoden) häufig sind. Bei Migranten und Reisenden, die sich oft in tropischen Gebieten aufhalten, ist die Möglichkeit einer Seronarbe in Betracht zu ziehen. Molekularbiologische Techniken, insbesondere die Polymerasekettenreaktion (PCR), werden künftig die Diagnostik von Tropenerkrankungen vereinfachen und die Spezifität erhöhen. So wird derzeit eine PCR zum Nachweis einer Bilharziose entwickelt. Asymptomatische Eosinophilie KASTEN 1 Übersicht über Bilharziosegebiete* In folgenden Regionen der Erde ist die Bilharziose endemisch: Afrika, östliches Brasilien, Venezuela, Jemen, Saudi-Arabien, Oman, Irak, Syrien, Iran, China, Laos, Kambodscha, Philippinen, Sulawesi *seltener auch in anderen Ländern (e2, e23) Abbildung 3: Computertomografie. Läsionen der Leber bei Infektion mit Leberegeln (Fasciola hepatica) Tritt eine asymptomatische Eosinophilie nach einer Tropenreise neu auf, sollte man zunächst parasitäre Erkrankungen ausschließen, selbst wenn der Patient allergisch veranlagt ist. In Tabelle 2 ist dazu ein strukturiertes Untersuchungsprogramm gezeigt. Danach empfiehlt sich, zunächst den Stuhl dreimal auf Wurmeier zu untersuchen, und zwar an drei aufeinanderfolgenden Tagen. Wenn die Überprüfung des Stuhls ne⏐ Jg. 105⏐ ⏐ Heft 46⏐ ⏐ 14. November 2008 Deutsches Ärzteblatt⏐ 803 MEDIZIN TABELLE 3 Abklärung einer Eosinophilie mit Fieber Herkunft (vergl. Kasten 1) Empfohlenes Screeningprogramm Besonderheiten aus Bilharziosegebiet 3 × Stuhluntersuchung auf Wurmeier Schistosomen-Antikörper im Serum EKG, Röntgen-Thorax, Abdomensonografie wenn negativ: Untersuchungen wie bei Eosinophilie und Fieber nicht aus Bilharziosegebiet (s. u.) bei akuter Bilharziose (Katayama-Syndrom) evtl. noch keine Eier im Stuhl oder Urin, ggf. erneute Diagnostik nach 4 Wochen bei negativen Ergebnissen: Überweisung an Tropenmediziner nicht aus Bilharziosegebiet 3 × Stuhluntersuchung auf Wurmeier 1 × Stuhluntersuchung nach Baermann auf Strongyloides-stercoralis-Larven Strongyloides-, Trichinella-, Toxocara- und FasciolaAntikörper im Serum EKG, Röntgen-Thorax, Abdomensonografie bei negativen Ergebnissen: Überweisung an Tropenmediziner gativ ausfällt, sollten Untersuchungen auf Strongyloides stercoralis veranlasst werden. Dieser Zwergfadenwurm kommt weltweit in warmen Ländern vor (e1). Die Larven schlüpfen in der Regel schon im Darm, daher sind die Eier in der normalen Stuhluntersuchung nicht nachweisbar (Abbildung 2). Der Ausschluss einer Strongyloidiasis ist wichtig, weil es durch interne und durch externe Autoinfektion zu einer chronisch persistierenden Erkrankung kommen kann. Zudem ist es möglich, dass sich bei Immunsuppression ein bedrohliches Hyperinfektionssyndrom ausbildet. Ferner sollte man nach Antikörpern gegen Schistosomen fahnden, wenn der Patient in einem Bilharziosegebiet war (Kasten 1) und die Stuhlproben negative Ergebnisse liefern. Eine starke Eosinophilie (> 1500/μL Blut) lässt sich durch einen Nachweis von Wurmeiern im Stuhl oft nicht ausreichend erklären. Daher sollten immer sofort zusätzliche Antikörpertests auf einen Zestoden (Bandwurm), einen Trematoden (Saugwurm) und einen Nematoden (Rundwurm) erfolgen. Wegen der Kreuzreaktionen innerhalb dieser Gruppen ist ein po- sitiver Antikörpertest dann Ausgangspunkt für weitere Untersuchungen, die sich aus geografischer und Nahrungsmittelanamnese ergeben. Eine RöntgenThorax-Untersuchung in zwei Ebenen dient zum Ausschluss eosinophiler pulmonaler Infiltrate, die bei der Larvenwanderung diverser Helminthen (häufig: Spulwurm, Hakenwurm oder Zwergfadenwurm) entstehen können. Eine Bildgebung des Oberbauches (Sonografie oder CT; Abbildung 3) kann Leberläsionen zeigen, die den Verdacht auf eine Infektion mit Leberegeln erhärten. Außerdem müssen im EKG unspezifische Endomyokardschäden ausgeschlossen werden, die sich durch Degranulationsprodukte eosinophiler Granulozyten entwickeln können. Findet man keinen Hinweis auf die Genese der Eosinophilie, so ist eine Abklärung durch einen Spezialisten erforderlich. Fieber Bei Patienten mit Eosinophilie und Fieber ist die geografische Anamnese besonders wichtig (Kasten 1 und Tabelle 3). Die häufigste Fieberursache bei Reiserückkehrern aus Bilharziosegebieten, die sich mit TABELLE 4 Abklärung einer Eosinophilie mit Hautschwellungen 804 Art der Hautschwellung Empfohlenes Screeningprogramm Besonderheiten periorbitales Ödem Blutfiltration auf Trichinenlarven Trichinella-Antikörper im Serum bei negativen Ergebnissen: Überweisung an Tropenmediziner Urtikaria 3 × Stuhluntersuchung auf Wurmeier, 1 × Stuhluntersuchung nach Baermann auf Strongyloides-stercoralis-Larven, Strongyloides-Antikörper im Serum, Schistosomen-Antikörper im Serum (wenn Patient aus Bilharziosegebiet; siehe Kasten 1) bei Patienten aus Afrika südlich der Sahara zusätzlich: Filarien-Antikörper im Serum bei negativen Ergebnissen: Überweisung an Tropenmediziner subkutane Schwellungen, ggf. wandernd 3 × Stuhluntersuchung auf Wurmeier 1 × Stuhluntersuchung nach Baermann auf Strongyloides-stercoralis-Larven Strongyloides-, Gnasthostoma-, Filarien- und Paragonimus-Antikörper im Serum bei Patienten aus Zentralafrika: 3 × Blutuntersuchung auf Mikrofilarien im Blut (Untersuchungszeitpunkt gegen 12 Uhr mittags) bei negativen Ergebnissen: Überweisung an Tropenmediziner ⏐ Jg. 105⏐ ⏐ Heft 46⏐ ⏐ 14. November 2008 Deutsches Ärzteblatt⏐ MEDIZIN TABELLE 5 Abklärung einer Eosinophilie mit Abdominalschmerzen Empfohlenes Screeningprogramm Besonderheiten 3 × Stuhluntersuchung auf Wurmeier 1 × Stuhluntersuchung nach Baermann auf Strongyloides-stercoralis-Larven Strongyloides-, Fasciola-, Toxocara-Antikörper im Serum Anisakis-Antikörper im Serum (bei entsprechender Nahrungsmittelanamnese; siehe Tabelle 1) EKG, Röntgen-Thorax, Abdomensonografie bei negativen Ergebnissen: Überweisung an Tropenmediziner einer Eosinophilie präsentieren, ist das KatayamaSyndrom (e2, e3). Ungefähr 14 bis 90 Tage nach Erstkontakt mit Schistosomen kommt es bei dieser akuten Form der Bilharziose zu einem Krankheitsbild mit nächtlichem Fieber, Husten, Myalgien, Kopfschmerzen und Abdominalschmerzen, das sich als Reaktion auf die heranreifenden Würmer entwickelt. Daraus folgt, dass in dieser Phase der Infektion meistens noch keine Eier im Urin (bei der Blasenbilharziose) beziehungsweise im Stuhl (bei der Darmbilharziose) ausgeschieden werden. Auch die Antiköperdiagnostik kann zunächst noch negativ ausfallen. In einem solchen Fall sollte der Patient nach etwa vier Wochen nachuntersucht werden, bei schweren Verläufen wird ein engerer Turnus empfohlen. Wenn dann Eier gefunden werden, kann anhand der Ei-Morphologie die Schistosomenart festgestellt und somit gezielt behandelt werden. Bei Patienten, die sich nicht in einem Bilharziosegebiet aufgehalten haben, ist eine Infektion mit Fasciola spp. (Leberegel) eine mögliche Ursache für eine Eosinophilie mit subfertilen Temperaturen (e4). Man findet bei diesen Patienten intrahepatische Raumforderungen in der Bildgebung und einen positiven Antikörpertest. Für die weitere Versorgung sollte der Patient dann an einen Spezialisten überwiesen werden. Hautschwellungen Das periorbitale Ödem ist bei entsprechender Anamnese – zum Beispiel nach dem Verzehr von unzureichend gegartem Schweine- oder Wildschweinfleisch – (Tabelle 1) typisch für die Trichinose (e5). Es sollte eine Filtration des Blutes auf Trichinenlarven veranlasst werden, auch ein entsprechender serologischer Suchtest steht zur Verfügung (Tabelle 4). Bei Urtikaria muss hingegen zunächst ein Katayama-Syndrom in Betracht gezogen werden. Wechselnde subkutane Schwellungen kommen bei der Gnathostomiasis vor (e6) und auch bei der Loiasis (Calabar-Schwellung). Patienten, die aus Zentralund Westafrika stammen, können daher umgehend auf Loa loa untersucht werden (e7). Jüngste Daten aus dem GeoSentinel Surveillance-Netzwerk zeigen, dass Filarien – also zum Beispiel Loa loa – auch bei kurzen Reisen in Endemiegebiete übertragen werden können (22). ⏐ Jg. 105⏐ ⏐ Heft 46⏐ ⏐ 14. November 2008 Deutsches Ärzteblatt⏐ Abdominalschmerzen Abdominalschmerz in Zusammenhang mit einer Eosinophilie spricht für eine akute Erkrankung (Tabelle 5). Bei Infektionen mit Leberegeln (zum Beispiel Fasciola) leiden die Betroffenen unter dauernden oder auch intervallartig auftretenden Schmerzen. Bauchschmerzen und erhöhte Laborwerte für Transaminasen können ein Hinweis für eine Toxocariasis sein (e8). Bei der Anisakiasis (hervorgerufen vorwiegend durch den Heringswurm Anisakis spp. und den Kabeljauwurm Pseudoterranova spp.) können ein akutes Krankheitsbild bis zum akuten Abdomen oder eine chronische Gastroenteritis mit rezidivierenden Bauchschmerzen auftreten (e9). Solche Erkrankungen werden aber weniger aus den Tropen, als aus Holland, Japan und von den amerikanischen Küsten berichtet. Diese Würmer werden durch den Verzehr von rohem oder unzureichend erhitztem Fisch übertragen (Tabelle 1). Eine KASTEN 2 Abklärung einer Eosinophilie mit erhöhten Konzentrationen von Transaminasen 3 × Stuhluntersuchung auf Wurmeier Stuhluntersuchung nach Baermann auf Strongyloidesstercoralis-Larven Strongyloides-, Fasciola- und Toxocara-Antikörper im Serum KASTEN 3 Abklärung einer Eosinophilie und Diarrhö 3 × Stuhluntersuchung auf Wurmeier 1 × Stuhluntersuchung nach Baermann auf Strongyloides-stercoralis-Larven Strongyloides-Antikörper im Serum Trichinella-Antikörper im Serum (bei entsprechender Anamnese; siehe Tabelle 1) 805 MEDIZIN TABELLE 6 Abklärung einer Eosinophilie mit pulmonalen Infiltraten Empfohlenes Screeningprogramm Besonderheiten 3 × Stuhluntersuchung auf Wurmeier (bei negativem Befund: Wiederholung der Stuhluntersuchung nach 4 Wochen) 1 × Stuhluntersuchung nach Baermann auf Strongyloides-stercoralis-Larven (bei negativem Befund: Wiederholung der Stuhluntersuchung nach 4 Wochen) Strongyloides-, Toxocara- und Paragonimus-Antikörper im Serum zystische Struktur in der Bildgebung: Echinococcus-Antikörper im Serum; wenn positiv Überweisung in spezialisiertes Zentrum; Patient vom indischen Subkontinent: Verdacht auf tropische pulmonale Eosinophilie: Überweisung an Tropenmediziner Sonografie sollte bei Eosinophilie und Abdominalschmerzen immer erfolgen, um zum Beispiel eventuelle Leberläsionen zu finden. Auch seltene Ursachen, wie ein in den Gallengang eingewanderter Spulwurm (Ascaris lumbricoides), können im Ultraschall auffallen. Bei Eosinophilie nach Tropenaufenthalt sollten immer Wurmerkrankungen in Betracht gezogen werden. Bei Infektion mit Darmwürmern findet man im Allgemeinen eine vergleichsweise niedrige Eosinophilie. Erhöhte Konzentrationen von Transaminasen Bei hoher Eosinophilie muss besonders an Gewebswürmer gedacht werden. Eine Toxocariasis kann zu erhöhten Konzentrationen von Transaminasen führen (Kasten 2). Infektionen mit dem Hundespulwurm (Toxocara canis) sind weltweit häufig, werden jedoch nur selten symptomatisch. Bei Migranten aus den Tropen und Subtropen mit Eosinophilie muss immer eine Strongyloidiasis ausgeschlossen werden. Diarrhö Eine Diarrhö nach einem Tropenaufenthalt kommt häufig vor, allerdings sind Helminthen nur selten die Ursache einer akuten Reisediarrhö (e10). Ist die Diarrhö mit einer Eosinophilie verbunden, so muss die übliche Abklärung erweitert werden. Neben der obligaten Untersuchung auf Strongyloidiasis, sollte auch das Frühstadium einer Trichinose erwogen werden (Kasten 3). Pulmonale Infiltrate Wurmlarven, die die Lunge passieren, verursachen flüchtige pulmonale Infiltrate (e11,e12). Bei entsprechendem Verdacht ist eine Stuhluntersuchung etwa 4 bis 6 Wochen nach vermuteter Infektion zu veranlassen (Tabelle 6). Eine Echinokokkose kann sich durch pulmonale, eventuell gekammerte Zysten im Röntgen-Thorax oder im CT-Thorax manifestieren, ein Antikörpertest erhärtet die Diagnose (e13). Importierte Infektionen mit Lungenegeln (Paragonimus) wurden nur in wenigen Einzelfällen bei Migranten beschrieben. Die Wurmzyste mit perizystischer Infiltration erscheint dabei in der Röntgenübersicht als flächige Verschattung und im CT als Ringstruktur. Die Diagnose wird bestätigt durch Ei-Nachweis in Sputum und Stuhl und durch spezifische Antikörper im Serum (e14). Bei Immigranten aus Süd- und Südostasien mit asthmatischen Beschwerden, pulmonalen Infiltraten und hoher Eosinophilie liegt in sehr seltenen Fällen die sogenannte tropische pulmonale Eosinophilie, eine besondere Verlaufsform der lymphatischen Filariasis, vor. Diese Patienten sollten zum Spezialisten überwiesen werden (e15). 806 Klinische Kernaussagen Bei Fieber und starker Eosinophilie nach Aufenthalt in einem Bilharziosegebiet sollte immer ein KatayamaSyndrom erwogen werden. Die Autoren danken Prof. Dr. Dr. Büttner, Bernhard-Nocht-Institut für Tropenmedizin, Hamburg, für die kritische Durchsicht des Manuskripts und für die Überlassung der Abbildungen. Interessenkonflikt Die Autoren erklären, dass kein Interessenkonflikt im Sinne der Richtlinien des International Committee of Medical Journal Editors besteht. Manuskriptdaten eingereicht: 29. 1. 2008, revidierte Fassung angenommen: 30. 6. 2008 LITERATUR 1. Rothenberg ME: Eosinophilia. N Engl J Med. 1998; 338: 1592–600. 2. Whitty CJM, Mabey DC, Armstrong M, Wright SG, Chiodini PL: Presentation and outcome of 1107 cases of schistosomiasis from Africa diagnosed in a non-endemic country. Trans R Soc Trop Med Hyg 2000; 94: 531–4. 3. Harries AD, Fryatt R, Walker J, Chiodini PL, Bryceson AD: Schistosomiasis in expatriates returning to Britain from the tropics. Lancet 1986; 11: 86–8. 4. Libman MD, MacLean JD, Gyorkos TW: Screening for schistosomiasis, filariasis, and strongyloidiasis among expatriates returning from the tropics. Clin Infect Dis 1993; 17: 353–9. 5. Weller PF: Eosinophilia in travellers. Med Clin North Am 1992; 76: 1413–32. 6. Harries AD, Myers B, Bhattacharrya D: Eosinophilia in Caucasians returning from the tropics. Trans R Soc Trop Med Hyg 1986; 80: 327–8. 7. Pardo J, Carranza C, Muro A et al.: Helminth-related eosinophilia in African immigrants, Gran Canaria. Emerg Infect Dis 2006; 12: 1587–9. ⏐ Jg. 105⏐ ⏐ Heft 46⏐ ⏐ 14. November 2008 Deutsches Ärzteblatt⏐ MEDIZIN 8. Seybold LM, Christiansen D, Barnett ED: Diagnostic evaluation of newly arrived asymptomatic refugees with eosinophilia. Clin Inf Dis 2006; 42: 363–7. 9. Nutman TB: Evaluation and differential diagnosis of marked, persistent eosinophilia. Immunol Allergy Clin North Am 2007; 27: 529–49. 10. Brigden ML: A practical workup for eosinophilia. Postgrad Med 1999; 105: 193–210. 11. Löscher T: Fortschritte in der Immundiagnostik und Chemotherapie der Wurminfektionen. Internist 1983; 24: 610–18. 12. Wolfe MS: Eosinophilia in the returning traveller. Med Clin North Am 1999; 83: 1019–32. 13. Whetham J, Day JN, Armstrong M, Chiodini PL, Whitty CJM: Investigation of tropical eosinophilia; assessing a strategy based on geographical area. J Infect 2003; 46: 180–5. 14. Ansart S, Perez L, Vergely O, Danis M, Bricaire F, Caumes E: Illnesses in travelers returning from the tropics: a prospective study of 622 patients. J Travel Med 2005; 12: 312–8. 15. Boggild AK, Yohanna S, Keystone JS, Kain KC: Prospective analysis of parasitic infections in Canadian travelers and immigrants. J Travel Med 2006; 13: 138–44. 16. O'Brien DP, Leder K, Matchett E, Brown GV, Torresi J: Illness in returned travelers and immigrants/refugees: the 6-year experience of two Australian infectious diseases units. J Travel Med 2006; 13: 138–44. 17. Toovey S, Moerman F, van Gompel A: Special infectious disease risks of expatriates and long-term travelers in tropical countries. Part II: Infections other than malaria. J Travel Med 2007; 14: 50–60. 18. Löscher T, Saathoff E: Eosinophilia during intestinal infection. Best Pract Res Clin Gastroenterol 2008; 22: 511–36. 19. Meltzer E, Percik R, Shatzkes J, Sidi Y, Schwartz E: Eosinophilia among returning travelers. A practical approach. Am J Trop Med Hyg 2008; 78: 702–709. 20. Jelinek T: European Network on Imported Infectious Disease Surveillance. Imported schistosomiasis in Europe: preliminary data for 2007 from TropNetEurop. Euro Surveill 2008 Feb 14;13. pii: 8038. 21. Freedman DO, Weld LH, Kozarsky PE, Fisk T, Robins R, von Sonnenburg F, Keystone JS, Pandey P, Cetron MS: GeoSentinel Surveillance Network. Spectrum of disease and relation to place of exposure among ill returned travelers. N Engl J Med 2006; 354: 119–30. ⏐ Jg. 105⏐ ⏐ Heft 46⏐ ⏐ 14. November 2008 Deutsches Ärzteblatt⏐ 22. Leder K, Tong S, Weld L, Kain KC, Wilder-Smith A, von Sonnenburg F, Black J, Brown GV, Torresi J: GeoSentinel Surveillance Network. Illness in travelers visiting friends and relatives: a review of the GeoSentinel Surveillance Network. Clin Infect Dis 2006; 43: 1185–93. 23. Lipner EM, Law MA, Barnett E et al. for the GeoSentinel Surveillance Network: Filariasis in Travelers Presenting to the GeoSentinel Surveillance Network. PLoS Negl Trop Dis 2007; 1: e88. Anschrift für die Verfasser Prof. Dr. med. Gerd D. Burchard Sektion Infektiologie und Bernhard-Nocht-Klinik für Tropenmedizin, I. Medizinische Klinik, Universitätsklinikum Hamburg-Eppendorf Martinistraße 52, 20246 Hamburg E-Mail: [email protected] SUMMARY Eosinophilia in Returning Travellers and Migrants Introduction: Eosinophilia in travelers returning from tropical countries is often caused by helminths. The high eosinophil counts arise particularly from tissue migration of invasive larvae. Methods: Review of literature selected by means of a Medline search using the MeSH terms "eosinophilia" and "helminth." Results: The patient's geographic and alimentary history may suggest infection with particular parasitic worms. A targeted diagnostic approach is suggested. The physician should concentrate on the principal signs and be guided by the geographic and alimentary history. Elaborate diagnostic measures are seldom indicated. Discussion: Although eosinophilia alone has low positive predictive value for a worm infection, it points clearly to helminthosis if the patient has recently returned from the tropics and the eosinophilia is new. Dtsch Arztebl 2008; 105(46): 801–7 DOI: 10.3238/arztebl.2008.0801 Key words: eosinophilia, helminth infection, foreign travel, migration, differential diagnosis @ Mit „e“ gekennzeichnete Literatur: www.aerzteblatt.de/lit4608 eTabelle: www.aerzteblatt.de/artikel08m801 The English version of this article is available online: www.aerzteblatt-international.de 807 MEDIZIN ÜBERSICHTSARBEIT Eosinophilie bei Tropenrückkehrern und Migranten Stephan Ehrhardt, Gerd D. Burchard eLITERATUR e1. Greiner K, Bettencourt J, Semolic C. Strongyloidiasis: a review and update by case example. Clin Lab Sci 2008; 21: 82–8. e2. Gryseels B, Polman K, Clerinx J, Kestens L: Human schistosomiasis. Lancet. 2006; 368: 1106–18. e3. Ross AG, Vickers D, Olds GR, Shah SM, McManus DP: Katayama syndrome. Lancet Infect Dis 2007; 7: 218–24. e4. Garcia HH, Moro PL, Schantz PM: Zoonotic helminth infections of humans: echinococcosis, cysticercosis and fascioliasis. Curr Opin Infect Dis 2007; 20: 489–94. e5. Pozio E, Gomez Morales MA, Dupouy-Camet J: Clinical aspects, diagnosis and treatment of trichinellosis. Expert Rev Anti Infect Ther 2003; 1: 471–82. e6. Clément-Rigolet MC, Danis M, Caumes E: La gnathostomose, une maladie exotique de plus en plus souvent importée dans les pays occidentaux. Presse Med 2004; 33: 1527–32. e7. Boussinesq M: Loiasis. Ann Trop Med Parasitol 2006; 100: 715–31. e8. Despommier D: Toxocariasis: clinical aspects, epidemiology, medical ecology, and molecular aspects. Clin Microbiol Rev 2003; 16: 265–72. e9. Seitz HM: Die Anisakidose (Heringswurmkrankheit). Dtsch Arztebl 1990; 87(41): A 3116–20. e10. Genta RM: Diarrhea in helminthic infections. Clin Infect Dis 1993;16 Suppl 2: S122–9. e11. Chitkara RK, Krishna G: Parasitic pulmonary eosinophilia. Semin Respir Crit Care Med 2006; 27: 171–84. e12. Vijayan VK: How to diagnose and manage common parasitic pneumonias. Curr Opin Pulm Med 2007; 13: 218–24. e13. Gottstein B, Reichen J: Hydatid lung disease (echinococcosis/hydatidosis).Clin Chest Med 2002; 23: 397–408. ⏐ Jg. 105⏐ ⏐ Heft 46⏐ ⏐ 14. November 2008 Deutsches Ärzteblatt⏐ e14. Kagawa F: Pulmonary paragonimiasis. Semin Respir Infect 1997; 12: 149–58. e15. Vijayan VK:Tropical pulmonary eosinophilia: pathogenesis, diagnosis and management.Curr Opin Pulm Med 2007; 13: 428–33. e16. Bethony J, Brooker S, Albonico M et al.: Soil-transmitted helminth infections: ascariasis, trichuriasis, and hookworm. Lancet 2006; 367: 1521–32. e17. Reddy M, Gill SS, Kalkar SR, Wu W, Anderson PJ, Rochon PA: Oral drug therapy for multiple neglected tropical diseases: a systematic review. JAMA 2007; 298: 1911–24. e18. Craig P, Ito A: Intestinal cestodes. Curr Opin Infect Dis 2007; 20: 524–32. e19. Keiser J, Utzinger J: Efficacy of current drugs against soil-transmitted helminth infections: systematic review and meta-analysis. JAMA 2008; 299: 1937–48. e20. Bruckner DA: Helminthic food-borne infections. Clin Lab Med 1999; 19: 639–60. e21. Fried B, Graczyk TK, Tamang L: Food-borne intestinal trematodiases in humans. Parasitol Res 2004; 93: 159–70. e22. Macpherson CN, Gottstein B, Geerts S: Parasitic food-borne and water-borne zoonoses. Rev Sci Tech 2000; 19: 240–58. e23. Steinmann P, Keiser J, Bos R, Tanner M, Utzinger J: Schistosomiasis and water resources development: systematic review, metaanalysis, and estimates of people at risk. Lancet Infect Dis 2006; 6: 411–25. 1 MEDIZIN eTABELLE Klinik, Diagnose und Therapie wichtiger Wurmerkrankungen (e16–e19) Erreger Eosinophilenzahl*1 Klinik Diagnostik Therapie Adulte Nematoden (Rundwürmer) im Darm Ascaris lumbricoides (Spulwurm) Larvenwanderung verursacht pulmonale Symptome, selten Ileus, Leberabszesse, Verschlussikterus während der Larvenwanderung stark erhöht, später leicht erhöht oder normal Ei-Nachweis im Stuhl Mebendazol: 2 x 100 mg/d für 3 Tage Ancylostoma, Necator (Hakenwurm) Larvenwanderung verursacht pulmonale Symptome, abdominale Beschwerden, ggf. (Eisenmangel-)Anämie während der Larvenwanderung stark erhöht, später leicht erhöht oder normal Ei-Nachweis im Stuhl Mebendazol: 2 x 100 mg/d für 3 Tage Strongyloides stercoralis (Zwergfadenwurm) Larvenwanderung verursacht pulmonale Symptome, abdominale Beschwerden, schwere Verläufe bei Immundefekt initial stark erhöht, später mäßig bis leicht erhöht, bei Immundefekt evtl. normal (!) Nachweis der Larven im Stuhl (z.B. Baermann-Test) oder Duodenalsekret Albendazol 2 x 400 mg/d oder Ivermectin*2: 1 x 200 μg/kg für 1–2 Tage, Wiederholung nach 2 Wochen Trichuris trichiura (Peitschenwurm) selten Rektumprolaps leicht erhöht bis normal Ei-Nachweis im Stuhl Mebendazol: 2 x 100 mg/d für 3 Tage Enterobius vermicularis (Madenwurm) perianaler Juckreiz, selten Vaginitis, Appendizitis leicht erhöht bis normal Ei-Nachweis im perianalen Abklatschpräparat Mebendazol: 1 x 100 mg, Wiederholung nach 2 und 4 Wochen Trichostrongylus spp. Diarrhö, Bauchschmerzen leicht erhöht bis normal Ei-Nachweis im Stuhl Mebendazol: 2 x 100 mg/d für 3 Tage Onchocerca volvulus Dermatitis, subkutane Knoten, Augenbeteiligung meist erhöht Nachweis der adulten Würmer in den Hautknoten (evtl. mit Ultraschall) oder der Mikrofilarien in der Haut (skin-snip) Ivermectin*2: 150 μg/kg, evtl. zusätzlich Doxycyclin*2: 100 mg/d für 6 Wochen Loa loa Hautschwellungen, subkonjunktivale Wurmwanderung oft stark erhöht Nachweis der Mikrofilarien im Blut Diethylcarbamazin*2 Vorsicht bei hohen Mikrofilarien-Zahlen Wuchereria bancrofti, Brugia malayi Lymphgefäßobstruktion bis zur Elephantiasis, Lymphadenitis, Lymphangitis in frühen Stadien Nachweis der Mikrofilarien im Blut Diethylcarbamazin*2 Anisakis spp. Bauchschmerzen leicht bis mäßig erhöht klinisch und serologisch endoskopisch, evtl. chirurgisch Toxocara spp. (viscerale Larva migrans) Allgemeinsymptomatik, evtl. neurologische Herdzeichen, Augensymptomatik mäßig bis stark erhöht klinisch und serologisch Albendazol 2 x 400 mg/d über 2–4 Wochen Gnathostoma spp. subkutanes oder viszerales Larva-migrans-Syndrom mäßig bis stark erhöht klinisch und serologisch Albendazol 2 x 400 mg/d über 3 Wochen evtl. auch operative Entfernung Trichinella spp. (Trichinose) abdominale Beschwerden, Myalgien, periorbitales Ödem, evtl. neurologische Herdzeichen mäßig bis stark erhöht klinisch, Blutuntersuchung auf Larven, serologisch Mebendazol: 2 x 200 mg/d für 2 Wochen oder Albendazol: 400 mg/d über 2 Wochen evtl. zusätzlich Corticosteroide Taenia saginata (Rinderbandwurm) abdominale Beschwerden normal bis leicht erhöht Nachweis der Proglottiden im Stuhl Niclosamid: 1 x 2 g oder Praziquantel: 1 x 10 mg/kg Taenia solium (Schweinebandwurm) abdominale Beschwerden normal bis leicht erhöht Nachweis der Proglottiden im Stuhl Niclosamid: 1 x 2 g oder Praziquantel: 1 x 10 mg/kg Diphyllobothrium latum (Fischbandwurm) evtl. megaloblastäre Anämie mit Glossitis normal bis leicht erhöht Ei-Nachweis im Stuhl Niclosamid: 1 x 2 g oder Praziquantel: 1 x 25 mg/kg Hymenolepsis nana (Zwergbandwurm) abdominale Beschwerden, Diarrhö normal bis leicht erhöht Ei-Nachweis im Stuhl Praziquantel: 1 x 25 mg/kg Taenia solium (Zystizerkose) neurologische Herdzeichen, subkutane Knoten normal bis leicht erhöht Bildgebung, Immundiagnostik Albendazol: 15 mg/kg/d für 30 Tage Echinococcus granulosus und E. multilocularis intrahepatische Zysten normal bis leicht erhöht Bildgebung, Immundiagnostik Albendazol: 15 mg/kg/d für 30 Tage, oft mehrere Zyklen erforderlich Schistosoma haematobium initial evtl. Fieber („Katayamafieber“), Dysurie, Hämaturie, Hydronephrose bei Katayamafieber stark erhöht, später leicht erhöht Ei-Nachweis im Urin oder in Rektumbiopsien Praziquantel: 40 mg/kg/d für 3 Tage Schistosoma mansoni, S. japonicum, S. intercalatum initial evtl. Fieber („Katayamafieber“), abdominale Beschwerden, blutiger Stuhl, evtl. Leberfibrose bei Katayamafieber stark erhöht, später leicht erhöht Ei-Nachweis im Stuhl oder in Kolonbiopsien Praziquantel: 40–60 mg/kg/d für 3 Tage Fasciolepsis buski (großer Darmegel) unspezifische Symptome normal bis leicht erhöht Ei-Nachweis im Stuhl Praziquantel: 1 x 15 mg/kg Fasciola spp. (großer Leberegel) Hepatomegalie (oft schmerzhaft), Leberabzesse, Gallengangsymptome bei früher Infektion stark erhöht, später leicht erhöht Ei-Nachweis im Stuhl und Duodenalsekret, adulter Wurm im Ultraschall Triclabendazol*2: 1 x 10 mg/kg bei schweren Infektionen bis 20 mg/kg Clonorchis und Opisthorchis spp. (chinesischerund Katzenleberegel) Gallengangssymptome, pyrogene Cholangitis, Cholangiokarzinom bei früher Infektion stark erhöht, später leicht erhöht Ei-Nachweis im Stuhl und Duodenalsekret Praziquantel: 3 x 25 mg/kg/d für 2 Tage Paragonimus spp. (Lungenegel) chronischer Husten, Thoraxschmerzen, Hämoptysen oder bräunlich tingiertes Sputum bei früher Infektion stark erhöht, später normal Ei-Nachweis im Stuhl und Sputum, Röntgen Praziquantel: 3 x 25 mg/kg/d für 2 Tage Adulte Nematoden (Rundwürmer) im Gewebe Nematodenlarven Zestoden (Bandwürmer) im Darm Bandwurmlarven im Gewebe Trematoden (Egel, Saugwürmer) *1, Ausmaß der Eosinophilie eingeteilt nach Brigden (10; modifiziert): leichte Eosinophilie, 1 500/μL, mäßige bis starke Eosinophilie > 1 500/μL *2, Off-label-use, nur nach Rücksprache mit Tropenmediziner ⏐ Jg. 105⏐ ⏐ Heft 46⏐ ⏐ 14. November 2008 Deutsches Ärzteblatt⏐ 1