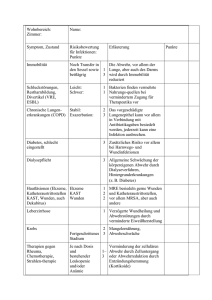
Erregerspezifische Diagnostik - Österreichische Gesellschaft für
Werbung

ISSN 1997-7964 Jahrgang 6 Juni 2012 Eur 7,– jatros P.b.b. Verlagspostamt 1072 Wien GZ 09Z038186 M 2 I 2012 Fachzeitschrif t für Infek tiologie Infektiologie 6. Österreichischer Infektionskongress Erregerspezifische Diagnostik n www.universimed.com au B de erh ara r c af clu H hr te de ® ep o K at nis on Se ch tro ite it i s 12 B en lle Cross Media Content GmbH, Markgraf-Rüdiger-Straße 8, 1150 Wien D © fotolia.de Österreichische Gesellschaft für Infektionskrankheiten und Tropenmedizin 1303044-00/24-05-11 Die Zukunft beginnt. Jetzt. PROGRESS. HIV-Dualtherapie vergleichbar mit HIV-Standardregime in … Wirksamkeit* Sicherheit* Verträglichkeit* Lopinavir/ritonavir (LPV/r) Combined with Raltegravir (RAL) or Tenofovir/Emtricitabine (TDF/FTC) in Antiretroviral-Naïve Subjects: 96-Week Efficacy and Safety Results of the PROGRESS Study (publiziert im April 2011 am XV Congreso Panamericano De Infectología in Punta del Este, Uruguay) * JATROS I mpress u m Herausgeber: Universimed Cross Media Content GmbH, Markgraf-Rüdiger-Straße 8, 1150 Wien. Telefon: +43/1/876 79 56-0. Fax: +43/1/876 79 56-20. Geschäftsführung: Dr. Bartosz Chłap MBA. Chef­­redaktion: Mag. Thomas Schindl. E-Mail: [email protected]. Externer Redakteur: Dr. Norbert Hasenöhrl. Projekt­­­­­ lei­tung: Mag. René Milich. E-Mail: rene.milich@ universimed.com. Grafik & Layout: Daniel Dobernig. Produk­tion & Druck: AV + Astoria Druckzentrum GmbH, 1032 Wien. Ge­richtsstand: Wien. Foto­nach­weis: Archiv. Bezugsbedingungen Abonnement: Bestellung bei Universimed oder unter www.univer­ simed. com. Jahresabo (4) EUR 22,–. Einzelheft EUR 7 inkl. MwSt. und Versand innerhalb von Österreich; im Ausland zzgl. Versandspesen. ISSN 1997-7964. Das Medium JATROS Infektiologie ist für den persönlichen Nutzen des Lesers kon­ zipiert und beinhaltet Informationen aus den Bereichen Expertenmeinung, wissenschaft­ liche Studien und Kongresse. Die mit einem Kreis versehenen Artikel stellen Beiträge nach §26 Mediengesetz dar. Namentlich gekennzeichnete Artikel und sonstige Beiträge sind die per­­ sön­ liche und/oder wissenschaftliche Meinung des Verfassers und müssen daher nicht mit der Meinung der Redaktion und des Herausgebers übereinstimmen. Diese Bei­ träge fallen somit in den persönlichen Verantwortungsbereich des Verfassers. Mit der Einsendung eines Manus­ kriptes erklärt sich der Urheber/Einsender damit einverstanden, dass der entsprechende Bei­ trag ganz oder teilweise in allen Publikationsorganen von Universimed publiziert werden kann. Für unverlangt eingereichte Manuskripte und Bilder übernimmt Universimed keine Haftung. Copyright: Alle Rechte liegen bei Universimed. Nachdruck oder Vervielfältigung – auch aus­zugs­ weise – nur mit schriftlicher Ge­nehmigung des Herausgebers. Die wiedergegebene Meinung deckt sich nicht in jedem Fall mit der Meinung des Herausgebers, sondern dient der Infor­­ ma­tion des Lesers. Die am Ende jedes Artikels vorhandene Zahlenkombination (z.B.: inf110406) stellt eine interne Kodierung dar. Geschlechterbezeichnung: Um die Les­ barkeit der Informa­ tionen zu erleichtern, wird bei Personenbezeich­ nungen in der Regel die männliche Form verwendet. Es sind jedoch jeweils männliche und weibliche Personen gemeint. Fachinformation zu Inserat siehe Seite 39 Wissenschaftliche beiräte Univ.-Doz. Dr. P. Apfalter, Linz; Prim. Dr. C. Aspöck, St. Pölten; Univ.-Prof. Dr. H. Burgmann, Wien; Univ.-Prof. DDr. A. Georgo­poulos, Wien; Univ.-Prof. DDr. W. Graninger, Wien; OA Dr. O. Janata, Wien; Univ.-Prof. Dr. C. Lass-Flörl, Innsbruck; OA Dr. A. Lechner, Salzburg; Univ.-Prof. Dr. A. Lischka, Wien; a.o. Univ.-Prof. DDr. E. Marth, Graz; Univ.-Prof. Dr. I. Mutz, St. Marein i. M.; Univ.-Prof. Dr. M. PeckRadosavljevic, Wien; Univ.-Prof. Dr. E. Presterl, Wien; Ass.-Prof. Dr. A. Rieger, Wien; Univ.-Prof. Dr. T. Staudinger, Wien; a.o. Univ.-Prof. Dr. F. Thalhammer, Wien; Prim. Dr. N. Vetter, Wien; A.o. Univ.-Prof. Dr. G. Weiss, Innsbruck; Prim. Univ.-Doz. Dr. C. Wenisch, Wien; Univ.-Prof. Dr. W. H. Wernsdorfer, Wien; Univ.-Prof. Dr. B. Willinger, Wien. universimed.com Österreichische Gesellschaft für Infektionskrankheiten und Tropenmedizin Infektiologie 2 I 2012 | editorial Sehr geehrte Kolleginnen, sehr geehrte Kollegen! Die vorliegende Ausgabe der JATROS Infektiologie ist dem zu Ende gegangenen 6. Österreichischen Infektionskongress gewidmet, der einen weiteren Meilenstein in unserer jungen Kongresstradition gesetzt hat. Die Entscheidung, den Vortragssaal in die Tennishalle des Hotels Gut Brandlhof zu verlegen, hat sich nach langem Bangen als richtig herausgestellt. Den Herren der Firma Nuntio sei an dieser Stelle Dank und Lob für die Ausgestaltung der Tennishalle zu einem professionell nutzbaren Vortragssaal gesagt. 420 Teilnehmerinnen und Teilnehmer fanden proF. Thalhammer, Wien blemlos Platz; sowohl Sicht als auch Akustik waren ausgezeichnet und ermöglichten spannende Diskussionen. Den Eröffnungsvortrag hielt der international bekannte und geschätzte Prof. Dr. David Livermore aus London (siehe auch Bericht auf den Seiten 26–27). Er wies darin eindrücklich auf die weltweite Resistenzproblematik hin und zeigte mögliche Lösungsansätze auf. Sehr erfreulich war auch die rege wissenschaftliche Teilnahme, die sich in mehr als 50 Abstract-Einreichungen aus ganz Österreich widerspiegelte. Zahlreiche Beiträge konnten mit einem Preis ausgezeichnet werden. Die Moderation der wissenschaftlichen Top-Papers der österreichischen Infektiologinnen und Infektiologen erfolgte durch den Präsidenten unserer Gesellschaft, Univ.-Prof. Dr. Günter Weiss, der wieder einmal souverän zeigen konnte, dass allen Unkenrufen zum Trotz exzellente Wissenschaft in Österreich sehr wohl möglich ist. Als Kongresspräsident hat Univ.-Doz. Dr. Christoph Wenisch die „Grand Round“ neu etabliert, die spannende Fälle zur Diskussion stellte und den Kongressteilnehmerinnen und -teilnehmern interessante Einblicke in das differenzialdiagnostische Denken gewährte. Neben seiner exzellenten Programmorganisation ist dem Kollegen Wenisch auch für seine immer aufs Neue innovative Kraft zu danken; ebenso gebührt der Kongresssekretärin und Kassierin der ÖGIT Dr. Gertrude Seiberl ein großer Dank. Wie immer hat sich auch unser Gesellschafts- und Kongresssekretariat unter der Leitung von Karl und Birgit Buresch bewährt und für einen reibungslosen Kongressablauf gesorgt. Falls Sie Lust auf den nächsten Infektionskongress bekommen haben, müssen Sie sich den 10.–13. April 2013 freihalten. Der Kongress wird wieder im bewährten Gut Brandlhof stattfinden, sein Motto lautet „Nosokomiale Infektionen: Prävention, Diagnostik und Therapie“. Er wird von Univ.-Prof. Dr. Cornelia Lass-Flörl, Direktorin der Sektion für Hygiene und Medizinische Mikrobiologie, Medizinische Universität Innsbruck, organisiert werden. Aus gegebenem Anlass möchte ich explizit darauf hinweisen, dass lediglich die mit dem Logo der ÖGIT gekennzeichneten Seiten mit der Meinung der Österreichischen Gesellschaft für Infektionskrankheiten und Tropenmedizin akkordiert sind, die übrigen Artikel jedoch die Meinung der jeweiligen Autorinnen und Autoren wiedergeben. Das Ihnen vorliegende Medium JATROS Infektiologie genießt in der Landschaft der medizinischen Zeitschriften Österreichs einen fachlich guten Ruf. Ich hoffe und bin überzeugt davon, dass wir als ÖGIT unseren Teil dazu beitragen können, Ihnen auch weiterhin einen qualitativ hochstehenden und sich über die gesamte Breite des interdisziplinären Fachs Infektiologie – von der Allgemeinpraxis bis zur Intensivstation – erstreckenden Querschnitt infektiologischer Themen zu bieten. Mit kollegialen Grüßen Univ.-Prof. Dr. Florian Thalhammer Vizepräsident der ÖGIT 3 I Kompetenz rund um Atemwegsinfektionen Colistin Forest Trockenstechampullen mit Lösungsmittel Umfassende Therapie bei Pseudomonas aeruginosa Colistin Forest – Trockenstechampullen mit Lösungsmittel: Qualitative und quantitative Zusammensetzung: 1 Trockenstechampulle enthält 78,74 mg (1.000.000 I.E.) ColistinmethansulfonatNatrium entsprechend 33,3 mg Colistin. Sonstige Bestandteile: 1 Lösungsmittelampulle enthält 27 mg Natriumchlorid (entsprechend 0,46 mmol Na+) in 3 ml wässriger Lösung. Anwendungsgebiete: Systemisch: Bei schweren Infektionen wie z.B. Pneumonie, Sepsis, Meningitis, Harnwegsinfektionen verursacht durch gramnegative Bakterien, besonders Pseudomonas aeruginosa und Acinetobacter baumannii, wenn andere Antibiotika kontraindiziert oder nicht wirksam sind. Aerosoltherapie: Inhalative Therapie bei Atemwegsinfektionen durch gramnegative Bakterien, insbesondere Pseudomonas aeruginosa bei Patienten mit z.B. cystischer Fibrose. Gegenanzeigen: Systemisch: Überempfindlichkeit gegen Colistin oder Polymyxin B, Myastenia gravis, Früh- und Neugeborene, schwere kardiogene Ödeme. Die intravenöse Injektion ist kontraindiziert, da Konzentrationsspitzen eine neuromuskuläre Blockade mit Atemlähmung auslösen können. Aerosoltherapie: Überempfindlichkeit gegen Colistin oder Polymyxin B, Myastenia gravis, Früh- und Neugeborene. Pharmakotherapeutische Gruppe: Andere Antibiotika, Polymyxine ATC-Code: J01XB01. Inhaber der Zulassung: Forest Laboratories Nederland B.V., 3584 BH Utrecht, Niederlande. Verschreibungspflicht / Apothekenpflicht: Rezept- und apothekenpflichtig, wiederholte Abgabe verboten. Informationen zu Besonderen Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen und Gewöhnungseffekten sind der veröffentlichten Fachinformation zu entnehmen. Stand der Fachinformation: 07/2011 Forest 12/2011-14 Therapiegerechte Packungsgröße inklusive Lösungsmittel sowie kostenlose Zusatzlieferung von Spritzen und Kanülen. JATROS HIV/AIDS 06 08 10 | inhalt Infektiologie 2 I 2012 immunsuppression Geschlechtsspezifische Unterschiede bei später Diagnose Hautinfektionen bei Screening und Management HIV-assoziierte neurokognitive Störungen immunsupprimierten Patienten Hautinfektionen bei immunsupprimierten Patienten Seite 10 ATEMWEGSINFEKTIONEN 14 A. Geusau, Wien ERS/ESCMID-Leitlinie Management tiefer Atemwegsinfektionen beim Erwachsenen ATEMWEGSINFEKTIONEN 19 hygiene-monitor Management tiefer Atemwegs- ECCMID 23 Infektionen mit Clostridium difficile: Strategien gegen das Rezidivrisiko 6. Österr. infektionskongress 26 28 30 31 33 35 36 infektionen beim Erwachsenen Seite 14 H. Flick, Graz Eröffnungsvortrag Bakterielle Resistenzen – Evolution und ihre Folgen Fortschritte in der Mikrobiologie Neue erregerspezifische Diagnostik Gramnegative Erreger Resistenz und empirische Therapie Von der Kontroverse zur Synthese Wie viel Therapie ist genug Therapie? Launch-Symposium Pneumokokken-Konjugatimpfstoff für Erwachsene ab 50 Jahren ANTIBIOTIKARESISTENZ Bakterielle Resistenzen – Evolution und ihre Folgen Seite 26 D. Livermore, London Virushepatitiden Therapie der Hepatitis C Best Papers Infektiologische Forschung in Österreich VIRUSHEPATITIS news/pharma-news 12 13 38 Baraclude (Entecavir) Dauerhafte Kontrolle der chronischen Hepatitis B Therapie der Hepatitis C EASL 2012 Große Fortschritte bei interferonfreier Therapie von Virushepatitis C Seite 35 Neue Waffen gegen gefährliche Infektionskrankheiten universimed.com H. Laferl, Wien 5 I JATROS Infektiologie 2I 2012 HIV/AIDS Geschlechtsspezifische Unterschiede bei später Diagnose In der vorliegenden Arbeit wurde untersucht, ob es einen geschlechtsspezifischen Unterschied bei den späten („late diagnosis“) bzw. bei den Diagnosen im fortgeschrittenen Stadium („advanced diagnosis“) der HIV-Erkrankung gibt. Patientinnen, die von einer späten oder fortgeschrittenen HIV-Diagnose betroffen sind, haben erhebliche Nachteile hinsichtlich der Morbidität sowie der Mortalität zu befürchten. Darüber hinaus entstehen für das öffentliche Gesundheitssystem auch Nachteile durch späte Diagnosen in Hinblick auf ein höheres Risiko für weitere HIV-Infektionen sowie auf höhere Kosten bei der Behandlung der Erkrankten. Methode valenzländern versteht man Länder, in denen die HIVInfektionsrate bei der erwachsenen Bevölkerung ≥1% beträgt; in Niedrigprävalenzländern liegt diese Rate bei <1%. In diese Studie wurden die Daten von sieben österreichischen HIV-Zentren einbezogen: vom AKH Wien, Otto-Wagner-Spital (OWS) Wien, AKH Linz, LKH Graz, LKH KlagenFrauen, die Sex mit MSM furt, LKH Salzburg und M. Jöchl, Innsbruck („men who have sex with vom LKH Innsbruck. Als men“), IDU (intravenösen Zeitraum wurden die Drogenkonsumenten) oder Jahre 2001–2011 herangezogen, in wel- Hämophilen hatten, sind der Kategorie 2 chen die HIV-Infektion bei insgesamt zugeordnet. Sex mit einer Person aus 3.242 Personen diagnostiziert worden einem Hochprävalenzland ist in Kategowar. Von diesen 3.242 Personen wurde rie 3 erfasst. Sex mit einer HIV-positiven bei 832 Frauen (25,7%) und 2.410 Person, die nicht den genannten KategoMännern (74,3%) eine HIV-Infektion rien zuordenbar ist, wurde der Kategorie diagnostiziert. 4 zugeteilt. Die fünfte Kategorie umfasst Patientinnen, die glauben, sich heteroBesonderes Augenmerk wurde auf den sexuell infiziert zu haben. Übertragungsweg der HIV-Infektion gelegt. Da sich der überwiegende Teil der Für die vorliegende Arbeit erfolgte die Frauen auf heterosexuellem Wege infi- Analyse der Risikofaktoren mittels logisziert, wurde der Übertragungsweg durch tischer Regression. Als Definition für heterosexuelle Kontakte zusätzlich in wei- die späte Diagnose wird festgelegt: tere fünf Kategorien unterteilt, um ein CD4-Nadir <350 Zellen/µl innerhalb noch detaillierteres Bild der HIV-Über- von 6 Monaten und/oder AIDS innertragung zu erhalten. halb von 3 Monaten nach dem positiven HIV-Test. Die Diagnose in fortgeIn der Kategorie 1 sind Frauen aus Hoch- schrittenem Stadium weist einen CD4prävalenzländern erfasst. Unter Hochprä- Nadir <200 Zellen/µl innerhalb von 6 I 6 Monaten und/oder AIDS innerhalb von 3 Monaten nach dem positiven HIVTest auf. Ergebnisse Die Auswertung der Kohorte von 832 Frauen ergab, dass das durchschnittliche Alter bei der Infektion bei 31,6 Jahren, der Median bei 29,9 Jahren lag. Zum Zeitpunkt der Datenabfrage, die im Jahr 2011 erfolgte, lag das durchschnittliche Alter dieser HIV-positiven Patientinnen bei 37 Jahren, der Median betrug 35,1 Jahre. Die HIV-Infektion bei den Patientinnen erfolgte in 14,9% der Fälle durch intravenösen Drogenkonsum, in 7,1 % waren andere/fehlende Übertragungswege zu verzeichnen; zum größten Teil, nämlich in 78% der Fälle, kam es durch heterosexuelle Kontakte zur HIV-Infektion. Die oben erwähnte Unterteilung in weitere Subkategorien der heterosexuellen Übertragung gibt die Abbildung wieder. Die meisten Frauen, die sich auf heterosexuellem Weg infizierten, stammen aus einem Hochprävalenzland (Kategorie 1) und stellen somit mit 31,1% den größten Anteil. Die zweitgrößte Gruppe (Kategouniversimed.com | referat © UNIVERSIMED ® Übertragungswege bei Frauen 50% IDU 45% Stammt aus Hochprävalenzland (1) 40% Sex mit MSM, IDU, Hämophilem (2) 35% Sex mit Personen aus Hochprävalenzland (3) 30% 31,1% Sex mit HIV-pos. Person nicht oben genannter Kategorien (4) 25% Patientin glaubt, sich heterosexuell infiziert zu haben (5) 20% Heterosexuell/keine Information 15% anderer Übertragungsweg 14,9% 14,0% 10% 11,2% 9,0% 5% 8,7% 7,1% 4,0% 0% Abb.: Übersicht über die Übertragungswege der HIV-Infektion bei Frauen rie 5) bilden jene Frauen, die davon überzeugt sind, sich auf heterosexuellem Weg infiziert zu haben, insgesamt 11,2%. Mit 9% der Frauen stellt die Kategorie 3 die drittgrößte Gruppe dar, dabei erfolgte eine Infektion durch Sex mit einer Person aus einem Hochprävalenzland. Frauen, die Sex mit einer Person hatten, die nicht den Kategorien 1–3 zugeordnet ist (Kategorie 4), liegen mit 8,7% an der vierten Stelle. Am seltensten infizieren sich Frauen beim Sex mit einem bisexuellen Mann, einem Hämophilen oder einem intravenösen Drogenkonsumenten (zusammengefasst in Kategorie 2), hier liegt der Wert bei 4%. Aus den Regressionsanalysen, die für die Identifikation der Risikofaktoren durchgeführt wurden und bei denen die fehlenden Übertragungswege nicht berücksichtigt wurden, haben sich folgende Resultate ergeben: Bei 395 Frauen, dies sind 51,1% aller diagnostizierten HIV-Infektionen, wurde eine späte Diagnose gestellt. Dies bedeutet, dass der CD4-Nadir <350 Zellen/µl innerhalb von 6 Monaten lag und/oder AIDS innerhalb von 3 Monaten nach dem positiven HIV-Test diagnostiziert wurde. Als Risikofaktoren konnten das Alter und die Übertragungsart identifiziert werden. Bezüglich Alter zeigt sich, dass Frauen, universimed.com die 35 Jahre oder älter sind, ein circa doppelt so hohes Risiko haben, spät diagnostiziert zu werden, als Frauen, die jünger als 35 Jahre sind (RR: 0,6; 95% CI: 0,4–0,8; p<0,001). Bei den Übertragungsarten zeigt sich ein hochsignifikantes Ergebnis bei Frauen, die aus einem Hochprävalenzland (Kategorie 1) stammen. Die Regressionsanalyse ergibt ein RR von 6,0 (95% CI: 3,1–11,5). Ebenfalls hochsignifikant ist das Ergebnis der Kategorie 5, hier ist das Risiko fast gleich hoch wie bei Frauen, die aus Hochprävalenzländern stammen, es liegt bei einem RR von 5,7 (95% CI: 3,0– 10,8). Signifikant (p<0,007) ist auch die Gruppe der Frauen, die Sex mit einer Person, die der Kategorie 4 zugeordnet ist, hatten: Hier beträgt das RR 2,6 (95% CI: 1,3–5,1). terschied, dass die Kategorie 4 im Gegensatz zur späten Diagnose nicht mehr signifikant war. Um einen Vergleich zwischen Frauen und Männern zu ermöglichen, wurden zusätzlich die Anzahl der späten bzw. der Diagnosen im fortgeschrittenen Stadium auch für Männer untersucht. Für beide Diagnosen zeigt sich, dass die Prozentsätze bei den Frauen in den Jahren 2001– 2011 höher liegen als bei Männern. Bei den späten Diagnosen liegen die Werte für Frauen im Jahr 2011 bei den erwähnten 51,1%, bei Männern liegt der entsprechende Wert bei 42,9%. Bei den Diagnosen im fortgeschrittenen Stadium sind die Werte für Frauen mit 30,1% zu 23,5% bei den Männern angegeben. Schlussfolgerungen Die durchgeführte Studie zeigt deutlich auf, dass sowohl späte als auch Diagnosen im fortgeschrittenen Stadium bei Frauen sehr häufig gestellt werden und dass beide Diagnosen häufiger Frauen betreffen, die über 35 Jahre alt sind, sich auf heterosexuellem Wege infizieren und aus Hochprävalenzländern stammen. Frauen, die sich über intravenösen Drogenkonsum (IDU) infizieren, oder Frauen, die aus Niedrigprävalenzländern stammen, haben hingegen eine höhere Chance, eine frühere Diagnose zu erhalten. Wünschenswert wäre es, wenn die Ergebnisse dieser Studie zu einem Überdenken der Zielgruppen bei den HIV-Tests führen würden und in der Folge die Tests optimiert werden könnten. n Ebenfalls mittels logistischer Regressionsanalyse wurden die Berechnungen für die Diagnosen im fortgeschrittenen Stadium der HIV-Erkrankung durchgeführt. Von dieser Diagnose waren im Beobachtungszeitraum 233 Frauen, dies entspricht 30,1%, betroffen. Die Analysen zeigen ein sehr ähnliches Bild wie die bereits beschriebenen Ergebnisse für die späte Diagnose. Auch in diesen Resultaten zeigt sich, dass das Alter hochsignifikant war (p<0,001; RR: 0,5; 95% CI: 0,4–0,7). Auch bei der Übertragungsart zeigen sich gleiche Ergebnisse, mit dem einzigen Un- Autorin: Mag. Margret Jöchl Agentur für Gesundheit und Ernährungssicherheit AGES GmbH – CC INFE HIV-Kohortenstudie Universitätsklinik für Dermatologie Anichstraße 35 6020 Innsbruck Tel.: 0664/884 755 26 E-Mail: [email protected] inf120206 7 I JATROS Infektiologie 2 I 2012 Screening und Management HIV-assoziierte neurokognitive Störungen Die Prävalenz für das Auftreten von neurokognitiven Störungen bei HIV-infizierten Patienten ist im Begriff anzusteigen. Umso relevanter ist ein möglichst frühzeitiges Screening, das regelmäßig nach Therapiebeginn wiederholt werden sollte. Wenn auch gewisse Risikofaktoren für NCI (Neurocognitive Impairment) detektiert werden konnten, so stellt das therapeutische Management nach wie vor eine Herausforderung dar. Obwohl durch die Entwicklung zahlreicher Substanzen zur antiretroviralen Therapie (Antiretroviral Therapy; ART) die erfolgreiche Behandlung der HIV-Infektion möglich ist, werden neurokognitive Symptome aufgrund der neurovirulenten Eigenschaft des HI-Virus unabhängig von der Art der verabreichten ART nach wie vor bei mehr als 50% der HIV-Patienten im Kurz- oder Langzeitverlauf vorgefunden und stellen eine signifikante Barriere bei Therapie und Management der Erkrankung dar.1 Im Zuge des Webcastsymposiums zum Thema „CNS Consequences in HIV – A Practical Approach to Managing Neurocognitive Health“, das am 18. April 2012 stattfand, referierten Prof. Jose MuñozMoreno (Universitätskrankenhaus Germans Trias i Pijol, Barcelona) und Dr. Scott Letendre (Universität Kalifornien, San Diego) über Prävalenz, neurokognitive Testmethoden zur Detektion, Risikofaktoren für das Auftreten und das Management von NCI (Neurocognitive Impairment). Alle Videos und Slides sind unter diesem Link frei zugänglich: http:// www.hivfutureprogress.com/videos Screening-Algorithmen zur Detektion von NCI Zu den Risikofaktoren für NCI zählen u.a. Alter, Komorbiditäten (z.B. HCVI 8 Koinfektion), erhöhte Viruslast und niedriger CD4-Nadir sowie mangelnde Adhärenz bzw. häufige Unterbrechungen. Das Vorliegen von NCI wurde mit schlechter Lebensqualität, schlechterer Adhärenz und höherer Wahrscheinlichkeit für virologisches Versagen in Zusammenhang gebracht. NCI hat sich jedoch auch als Prädiktor für eine höhere Mortalität herauskristallisiert. Umso mehr betont Muñoz-Moreno in diesem Kontext die Relevanz einer erhöhten Awareness für die zahlreichen Risikofaktoren, die mit NCI assoziiert sind. Eine optimierte ART ist die wichtigste Intervention, aber auch nicht pharmakologische Maßnahmen wie kognitive Rehabilitation, Vermeidung von Risikofaktoren oder andere koadjuvante medikamentöse Therapien können zur Anwendung kommen. Bis dato existiert zwar kein standardisierter Algorithmus für die Vorgehensweise bei der Diagnose von NCI, jedoch wurde in den EACS (European Aids Clinical Society)Guidelines 20112 erstmals die Möglichkeit der Erfassung neurokognitiver Störungen berücksichtigt und ein Algorithmus für Diagnosestellung und Management von NCI angeführt. Wird demnach eine HAND (HIV-associated Neurocognitive Disorder) in Form von MND (Mild Neurocognitive Disorders) oder HAD (HIV-associated Dementia) diagnostiziert, sollten eine Optimierung der ART und der Einsatz von potenziell ZNS-aktiven Medikamenten vorgenommen bzw. in Betracht gezogen werden. Potenziell ZNS-aktive Substanzen NRTI: ZDV ABC NNRTI: EFV NVP Boosted PI: IND/r LPV/r Other classes: MAR DRV/r Tab. 1: EACS-Leitlinien 2011 Substanzen mit nachgewiesener Wirksamkeit NRTI: ZDV Boosted PI: LPV/r d4T ABC Tab. 2: EACS 2011 universimed.com | kongress Als „potenziell ZNS-aktive Substanzen“ werden jene ARV-Medikamente definiert, bei denen im Rahmen von Untersuchungen an gesunden HIV-infizierten Personen eindeutig eine Penetration der Blut-Hirn-Schranke (IC90 bei >90% der Patienten) oder eine Wirksamkeit auf die kognitive Funktion bzw. ein Abfall der Viruslast im Liquor cerebrospinalis (Cerebrospinal Fluid; CSF) für eine Dauer von 3 bis 6 Monaten nachgewiesen werden konnte (Tab. 1 und 2). Wann sollte gescreent werden? Als Argumente, dass das Screening auf HIV-assoziierte neurokognitive Störungen relativ früh und in regelmäßigen Intervallen erfolgen sollte, führt Prof. Muñoz-Moreno unter anderem die hohe Prävalenz für das Auftreten von ANI (Asymptomatic Neurocognitive Impairment) an. Innerhalb der verschiedenen Formen von HAND wurde ANI bei 52% der untersuchten Patienten vorgefunden; im Vergleich dazu wiesen 42% der Patienten ein MND (Mild Neurocognitive Disorder) und 7% eine HAD (HIV-Associated Dementia) auf.3 Die Gefahr bei Vorliegen eines ANI besteht darin, dass aufgrund der geringen Beeinträchtigung des täglichen Lebens der Patient sich möglicherweise nicht einmal der kognitiven Veränderungen bewusst ist. Gemäß den Ergebnissen einer an 387 HIV-Patienten durchgeführten Longitudinalstudie4 geht jedoch die Diagnose eines ANI mit einem hohen Risiko für die weitere Entwicklung zu einem symptomatischen HAND einher (Relatives Risiko: 3,02; p<0,001). Insgesamt wiesen Patienten mit der Diagnosestellung eines ANI oder eines MND nach einem medianen Follow-up von 36,1 Monaten im Vergleich zu den initial als neuropsychologisch normal eingestuften Patienten einen größeren Abfall im Bereich der neurokognitiven Leistungen auf (p=0,0002). Umso mehr unterstreichen diese Studienergebnisse die Relevanz eines möglichst frühzeitigen Screenings und engmaschiger Kontrollen in Bezug auf die Überprüfung der neurokognitiven Funktionen. Screening-Tools Die neurophysiologische Leistungsfähigkeit wird anhand von erweiterten Testbatterien erfasst. Diese erweisen sich aber in universimed.com der Praxis insofern als unvorteilhaft, da der erforderliche Zeitaufwand bis zu drei Stunden beträgt und die Testungen von einem spezifisch geschulten Neuropsychologen durchgeführt werden müssen. Einfache Screening-Tools zur Erfassung neurokognitiver Defizite werden gegenwärtig validiert. Der Zeitaufwand für die Überprüfung der HIV-assoziierten NCI beträgt maximal 15 Minuten. Cysique et al5 haben einen Screening-Algorithmus entwickelt, der insbesondere für die Erfassung von HAND bei HIVPatienten mit fortgeschrittener Erkrankung konzipiert ist. Der Test weist nicht nur eine hohe Genauigkeit von 78%, sondern auch eine hohe Spezifität von 70% auf und erfordert einen Zeitaufwand von nur 3 Minuten. Als klinische Variablen zur Erfassung und Vorhersage des Risikos für ein HAND werden Alter, CD4-Zellzahl im Blut, vorangegangene HIV-assoziierte ZNS-Erkrankungen und bisherige Therapiedauer zum Zeitpunkt der Testung herangezogen. Der prädiktive Effekt dieses Algorithmus soll unter Miteinbezug von weiteren Variablen wie Virusstamm, konkomitante HCV-Infektion und CD4-Zellzahl am Nadir in groß angelegten Studien weiter untersucht werden. Immunologische Faktoren, Alter und ART als Prädiktoren für NCI In mehreren Studien wurde eine Assoziation zwischen der CD4-Zellzahl am Nadir und der Manifestation von NCI vor und während der cART (combined ART) beobachtet. Zum Beispiel deuten die von Heaton et al6 publizierten Daten darauf hin, dass durch einen frühen Therapiestart ein neuroprotektiver Benefit resultieren könnte, indem sich der immunprotektive Effekt der ART positiv auf die Prävention von HAND auswirkt. Neurologischen Komplikationen, die mit einer unkontrollierten HIV-Replikation und CD4-Depletion einhergehen, könnte so frühzeitig entgegengewirkt werden. Gleichzeitig wurde der Zusammenhang zwischen neurologischen Effekten von HIV und ART auf die immunologische und virologische Response belegt:7 Patienten, bei denen ein langsamerer Rückgang an HIV-RNA im CSF als im Plasma festgestellt wurde, wiesen niedrigere CD4- und Leukozytenzahlen im CSF sowie eine höhere Rate an HAD auf. Canestri et al8 zeigten in der NICE-Studie, dass Patienten mit einem „viral escape“ im CSF von einer ART-Anpassung basierend auf dem CNS Penetration Effectiveness (CPE) Score profitieren, da es zu einer Senkung der Viruslast im CSF sowie zu einer Verbesserung der neurokognitiven Symptome kommt. Studiendaten zeigten,9 dass 36 Monate nach ART-Initiierung 40% der Patienten mit HAND eine neurokognitive Verbesserung erfahren. Obwohl die meisten Patienten von einer ART profitieren, gibt es einen Teil, der unter Therapie neurokognitive Symptome entwickelt. Für gewisse ARV-Medikamente konnte ein Zusammenhang mit ZNS-Symptomen gezeigt werden. Ein besonderes Augenmerk sollte hierbei auf Efavirenz gelenkt werden. Neben den bekannten kurzfristigen Nebenwirkungen wie Schwindel, Schlaflosigkeit oder abnormale Träume zeigte eine multivariable Analyse einer Querschnittstudie10, dass die Einnahme von Efavirenz mit einem 4-fach erhöhten Risiko für das Auftreten von NCI einhergeht (Odds-Ratio: 4,00; p=0,008). Dr. Letendre schließt mit dem Bild eines „therapeutischen Fensters“: Es handelt sich um einen Balanceakt, die ausreichende Wirkstoffkonzentration im CSF zur Senkung der Viruslast zu erzielen, aber gleichzeitig das Auftreten von neurotoxischen Nebenwirkunken weitgehend zu vermeiden. Referenzen: 1 Heaton R et al, CROI 2009, Abstract 154 2 EACS-Guidelines, Version 6; Oktober 2011 http://www. europeanaidsclinicalsociety.org/images/ stories/EACS-Pdf/eacsguidelines-v6_english.pdf) 3 Munoz-Moreno J et al, J Neurovirol, 2010, 16(S1), 1-93. 4 Heaton RK, et al, CROI 2012, Abstract 77 5 Cysique LA et al, HIV Med 2010; 11(10): 642-649 6 Heaton RK et al J Neurovirol 2011; 17(3): 3-16 7 Ellis, RJ, et al, Neurology 2000; 54(4): 927-936 8 Canestri et al, Clinical Infectious Diseases 2010, 50(4): 773-778. 9 Cysique et al,. Neurology 2009; 73(5): 342-348. 10 Ciccarelli N et al, Neurology 2011; 76(16): 1403-1409 l Bericht: Mag. Dr. Anita Schreiberhuber Entgeltliche Einschaltung mit freundlicher Unterstützung der Fa. Abbott inf120208 9 I JATROS Infektiologie 2 I 2012 Immunsuppression A. Geusau, Wien Hautinfektionen bei immunsupprimierten Patienten Haut und Subkutis spielen beim immunsupprimierten Patienten nicht nur in der Pathogenese, sondern in der initialen Diagnostik von Infektionen eine wichtige Rolle. Die Haut stellt die erste wichtige Abwehrlinie zur Außenwelt dar und ist insbesondere beim Patienten, dessen Abwehrmechanismen wie Phagozytose, zellulär mediierte Immunität oder Antikörperproduktion kompromittiert sind, als Eintrittspforte für Erreger von Bedeutung. Die Haut stellt somit nicht nur eine physikalische, sondern auch eine immunologische Barriere dar. Andererseits kann die Haut erste Hinweise auf eine systemische Infektion bei diesen Patienten geben und ist als solche für jede Art der Diagnostik leicht zugänglich. Von immunologischer Seite sind, neben der Neutropenie, Störungen der zellulären oder humoralen Immunität die wichtigsten Faktoren, die das Angehen einer Infektion an der Haut begünstigen. Die Beschädigung der anatomischen Barriere der Haut, etwa durch operative Eingriffe, liegende Katheter oder durch Bestrahlung, spielt ebenso eine Rolle wie die Gabe von Breitspektrumantibiotika oder längere Hospitalisierung des Patienten, weil dadurch die normale Flora der Haut beeinflusst wird und in der Folge resistente oder normalerweise apathogene Keime der Umwelt zu Infektionen führen können. Der Prototyp des chronisch immunsupprimierten Patienten ist der organtransplantierte Patient (OTP), welcher zur Erhaltung seines Organs die lebenslange Einnahme von immunsuppressiven (IS-) Medikamenten benötigt. Ziele für diese IS-Medikamente sind unter anderem die T-Zell-Aktivierung, die klonale Expansion oder Differenzierung in Effektor-TZellen. Vor allem in der frühen Phase nach der Transplantation machen bei diesen Patienten Hautinfektionen 25% aller Erkrankungen an der Haut aus. Der relative Anteil der Infektionen geht allerdings mit der Zeit zugunsten nicht melaI 10 nozytärer Hauttumoren zurück. Der HIV-infizierte Patient ist ebenfalls ein klassischer Repräsentant des chronisch immunsupprimierten Patienten und das Auftreten bestimmter Hautinfektionen kann überhaupt erst Indikator für eine HIV-Infektion sein oder Zeichen des Fortschreitens der Immunschwäche. Im Gegensatz dazu bleibt der Grad der medikamentös induzierten IS des OTP über Jahre hinweg gleich oder wird, bei guter Organfunktion, sogar reduziert. Welche Infektionen treten auf? Die Klassifikation der Hautinfektionen beim Immunsupprimierten kann einerseits auf Basis der unterschiedlichen Erreger, andererseits auch auf Basis der unterschiedlichen pathophysiologischen Vorgänge, die ablaufen, vorgenommen werden. Als Erstes können an der Haut beim Immunsupprimierten dieselben Streptokokken- oder Staphylokokken-assoziierten Infektionen, wie man sie beim Immunkompetenten kennt, auftreten, etwa das Erysipel. Beim neutropenischen Patienten, bei Patienten, die an einer Leukämie leiden oder unter einer IS-Therapie stehen, können allerdings für das Erysipel auch andere Erreger eine Rolle spie- len, etwa Pseudomonas aeruginosa und andere gramnegative Keime, Anaerobier oder Cryptococcus neoformans. Im Szenario der Immunsuppression können außerdem Infektionen an der Haut wesentlich ausgedehnter oder schwerwiegender ablaufen, bedingt durch Erreger, die unter normalen Umständen nur triviale und sehr lokalisierte Infektionen verursachen. Beispiele dafür sind Infektionen mit humanen Papillomaviren (HPV) oder oberflächliche Pilzinfektionen. In solchen Fällen kann sich auch die Therapie problematisch oder langwierig gestalten, oder es ist überhaupt unmöglich, eine Eradikation, zum Beispiel von HPV-assoziierten Warzen, zu erreichen. Bei Patienten mit Panzytopenie, Makrophagendysfunktion oder solchen, die unter länger dauernder lokaler oder systemischer, die T-zellulär mediierte Abwehr betreffender IS-Therapie stehen, kann die sonst triviale Dermatophyteninfektion zum Beispiel mit T. rubrum lokal invasiv werden und sich als Papeln und Knoten manifestieren. Auch kann eine beim Erwachsenen sehr seltene Tinea capitis auftreten. Die Prävalenz der Onychomykose erscheint bei diesen Patienten nicht erhöht. Es sollte aber eine besondere klinische Manifestation, die proximale weiße subunguale Onychomykose, universimed.com | referat immer an einen zugrunde liegenden Immunmangel denken lassen. Ausgedehnt und chronisch können auch virale Infektionen sein, meist bedingt durch reaktivierte Herpesviren (Abb. 1). Das klinische Erscheinungsbild erstreckt sich von großflächigen Schleimhautulzerationen bis hin zu tumorösen Formationen. Der herpetische Umlauf am Fingerendglied wird meist nicht als Herpesinfektion erkannt, sondern als bakterielle Infektion vergeblich behandelt. Mittel der Wahl in der Behandlung der Herpes-simplex-Virus-Infektionen ist tienten von Pseudomonas aeruginosa bis hin zu endemischen oder opportunistischen Pilzinfektionen. Infektion mit Opportunisten Letztendlich kann die Haut selbst auch direkt Ort der Infektion mit einem echten Opportunisten sein, das sind Erreger, die für den Menschen normalerweise keine pathogene Bedeutung haben. Dies ist die Domäne einer Vielzahl von Pilzen, die sowohl eine lokalisierte als auch eine syste- Zugehörigkeit, die tief sitzende Infektionen an Haut und Subkutis verursachen. Erwähnenswert sind die Hyalohyphomyzeten, die farblos sind und mit weißlichen Kulturen, der bekannteste Vertreter dieser Gruppe ist zum Beispiel Rhizopus, und die Phaeohyphomyzeten, sogenannte „Schwärzepilze“, die aufgrund ihres Melaningehaltes in der Zellwand dunkle Kulturen ausbilden. Zu Letzteren gehört Alternaria spp. (Abb. 2), welcher nicht so selten bei OTP einzelne Haut­herde, meist durch direkte Inokulation verursacht. Die Therapie der opportunistischen Pilzinfektionen beruht auf drei Säulen. Einzelne Herde an der Haut können nach Ausschluss einer systemischen Infektion radikal exzidiert werden. Eine weitere Maßnahme ist, wenn möglich, eine Reduktion der laufenden IS-Therapie; die dritte Säule der Therapie ist natürlich eine systemische antifungale Therapie, welche, wenn die zugrunde liegende Situation nicht modifiziert werden kann, in Einzelfällen lebenslang als Erhaltungstherapie fortgeführt werden muss. Conclusio Abb. 1: Vegetierende Herpes-simplex-Infektion bei einem herztransplantierten Patienten Abb. 2: Alternaria-Infektion an der Haut bei einem lungentransplantierten Patienten Acyclovir. Eine zugrunde liegende Immun­ suppression und die länger dauernde, oft in subtherapeutischen Dosen verabreichte Gabe von Acyclovir können zur Selektion von Thymidinkinase-negativen, resistenten Stämmen führen. Klinisch fällt dabei die fehlende Abheilung unter Therapie auf; in solchen Fällen muss auf Medikamente, die direkt die virale DNA-Polymerase hemmen, ausgewichen werden, wie etwa Cidofovir oder Foscarvir. Epstein-BarrVirus(EBV)-bedingte Manifestationen sind meist an der Schleimhaut lokalisiert und können als orale haarige Leukoplakie oder auch EBV-assoziierte orale Papulose auftreten. EBV spielt auch eine Rolle in der Entstehung des PosttransplantationsLymphoms. Die Dissemination von Erregern, deren Eintrittspforte nicht an der Haut gelegen ist, kann zu metastatischen Absiedelungen in die Haut führen und diese kann somit erste Hinweise auf eine lebensbedrohliche systemische Infektion geben. Das Spektrum der kausalen Erreger reicht beim immunsupprimierten Pa- mische Infektion verursachen können. Opportunistische Pilze kommen einerseits als Besiedler an Haut und Schleimhaut vor, andererseits ubiquitär in der Erde und Vegetation. Der klassische – und auch häufigste medizinisch relevante – Opportunist ist Candida albicans, auch Non-albicans-Stämme spielen eine Rolle. Im Szenario der Immunsuppression kann praktisch jeder in der Umgebung vorkommende Pilz eine Infektion beim Menschen verursachen oder invasiv werden. Die Infektion der Haut erfolgt entweder über eine direkte Inokulation oder über die systemische Streuung nach Infektion über die Atemwege durch die Inhalation von Sporen. Die zweithäufigste opportunistische Infektion ist die Aspergillose, eine meist systemische, schwer zu beherrschende Infektion mit hoher Letalität. Lokalisierte Infektionen an der Haut sind selten und meist durch kontaminierte Katheter oder Sonden bedingt. Zu den sogenannten Non-Aspergillus-Pilzarten gehört eine Vielzahl von Pilzen mit unterschiedlichsten Namen und unterschiedlichster universimed.com Zusammenfassend ist es in der Abklärung von Hautläsionen beim immunkompromittierten Patienten essenziell, auch immer an die Möglichkeit einer Infektion zu denken. Die Indikationsstellung für eine Biopsie sollte daher sehr großzügig ausfallen und Material nicht nur der his­ topathologischen Aufarbeitung, sondern auch allen verfügbaren Methoden zum Keimnachweis weitergeleitet werden. Diese beinhalten Spezialfärbungen, kultur- und molekularbiologische Verfahren inklusive fungaler und bakterieller Breitspektrum-PCR. n Autorin: Univ.-Prof. Dr. Alexandra Geusau FÄ für Dermatologie und Venerologie Klinische Abteilung für Immundermatologie und infektiöse Hautkrankheiten Univ.-Klinik für Dermatologie, Medizinische Universität Wien Währinger Gürtel 18–20, 1090 Wien E-Mail: [email protected] inf120210 11 I JATROS | pharma-news Infektiologie 2 I 2012 Baraclude® (Entecavir) Dauerhafte Kontrolle der chronischen Hepatitis B Das Nukleosidanalogon Baraclude® wird von der EASL uneingeschränkt zur Erstlinientherapie der chronischen Hepatitis B empfohlen: Die Substanz reduziert bei den allermeisten Patienten die Viruslast unter die Nachweisgrenze, Resistenzen werden kaum beobachtet und das Medikament ist gut verträglich. Die Therapieziele bei Hepatitis B sind seitens der EASL (European Association for the Study of the Liver) klar definiert:1 Verbesserung der Lebensqualität und der Überlebensrate von Patienten mit chronischer Hepatitis B. Um diese Ziele zu erreichen, sind die Krankheitsprogression und damit die Entwicklung einer Zirrhose, einer dekompensierten Zirrhose, einer Lebererkrankung im Endstadium sowie eines hepatozellulären Karzinoms zu verhindern. Dies könne durch kontinuierlich anhaltende Virussuppression unter der Nachweisgrenze gelingen, so die EASL-Experten. EASL empfiehlt uneingeschränkt Baraclude® Neben Interferonen werden heute zur Therapie der chronischen Hepatitis B Nukleosid- und Nukleotidanaloga eingesetzt, die die Virusreplikation durch Deaktivierung der HBV-DNA-Polymerase hemmen. Von der EASL werden allerdings nur zwei Substanzen uneingeschränkt (Evidenzgrad 1A) für die Erstlinientherapie der chronischen Hepatitis B empfohlen,1 darunter das seit 2006 in Europa zugelassene Nukleosidanalogon Baraclude® (Entecavir). Die EASL-Experten begründen diese Empfehlung mit der hohen antiviralen Wirksamkeit2, 3 von Baraclude®, dem geringen Risiko für Resistenzentwicklung4 und der guten Verträglichkeit.5 Therapie mit Baraclude® bei 94% der HBeAg-negativen und bei 67% der HBeAg-positiven Patienten innerhalb eines Jahres zu einer Reduktion der Viruslast unter die Nachweisgrenze.8,9 Hinzu kommt die geringe kumulative Wahrscheinlichkeit für genotypische Resistenzen, die in den klinischen Zulassungsstudien bis zum sechsten Therapiejahr bei 1,2% lag.4 zum Jahr zwei zu einer Verringerung der Viruslast unter die Nachweisgrenze. Ein virologischer Breakthrough wurde nur bei 1% beobachtet, womit das geringe Resistenzpotenzial der Substanz im klinischen Alltag bestätigt werden konnte. Auch in dieser Kohorte wurden keine schwerwiegenden Nebenwirkungen unter Therapie mit dem Nukleosidanalogon beobachtet, was die gute Verträglichkeit von Baraclude® unter Praxisbedingungen untermauert. Erleichternd im klinischen Alltag ist zudem, dass unter Baraclude® bei normaler Nierenfunktion kein spezielles Nierenfunktionsmonitoring vorgeschrieben ist (vgl. Fachinformation). Langzeittherapie wirksam und gut verträglich Erfolgreiche Erstlinientherapie mit Baraclude® In einer Dreijahresstudie wurde die Effektivität einer kontinuierlichen Gabe von Baraclude® in der empfohlenen Dosierung von 0,5mg in Hinblick auf die virologische Response und das Auftreten einer viralen Resistenz untersucht.10 In dieser Studie wurden hochsensitive Testmethoden angewendet, die imstande sind, DNA-Kopien bis zu einem Wert von 12IU/ml (60 Kopien/ml) zu detektieren. Die Ergebnisse waren beeindruckend: Bei 91,1% der therapienaiven Patienten mit chronischer Hepatitis B wurde unter Baraclude® 0,5mg eine erfolgreiche Virussuppression nachgewiesen, nur ein Patient entwickelte eine Resistenz, die im dritten Studienjahr manifest wurde. Zudem wurden im Gesamtbeobachtungszeitraum keine schwerwiegenden Nebenwirkungen beobachtet. Die Ergebnisse sowohl der klinischen Studien als auch einer Real-Life-Untersuchung bestätigen, dass die Langzeittherapie mit Baraclude® 0,5mg bei therapienaiven Patienten mit chronischer Hepatitis B bei den allermeisten Patienten die Viruslast unter die Nachweigrenze reduzieren kann.8–11 Die Therapie einer chronischen Hepatitis B mit Baraclude® ermöglicht eine dauerhafte Kontrolle der Erkrankung, bei geringem Risiko für Resistenzentwicklung und guter Verträglichkeit. Höchste antivirale Potenz Anhaltende Virussuppression auch im klinischen Alltag Baraclude® zeigt innerhalb der Substanzklasse der Anti-HBV-Nukleos(t)idanaloga in In-vitro-Studien die höchste antivirale Potenz.6 Bereits die sehr geringe Dosis von 0,5mg ermöglicht eine Reduktion der Viruslast unter die Nachweisgrenze, unabhängig von der medianen Ausgangsviruslast:7 Laut Zulassungsstudien führt die Diese in klinischen Studien nachgewiesene rasche und anhaltende Virussuppression unter Therapie mit Baraclude® 0,5mg wird auch im Real-Life-Setting erreicht, so die Ergebnisse einer italienischen Kohortenstudie mit 376 Hepatitis B-Patienten.11 Demnach führte die Behandlung bei 96% der bislang therapienaiven Patienten bis I 12 Referenzen: 1 EASL-Guidelines, J Hepatol 2009; 50: 227 2 Chang TT, Hepatology 2010; 51: 422 3 Shouval D, AASLD 2008; Poster Nr. 927 4 Tenney DJ, Hepatology 2009; 49 5 Manns M, EASL 2010, Poster Nr. 1016 6 Langely DR, Virol 2007; 81 7 Colomno RJ, J Hepatol 2006; 44 8 Chang TT, NEJM 2006; 354 9 Lai CL, NEJM 2006; 354 10 Chang TT, Am J Gastroenterol 2011; 106 11 Lampertico P, AASLD 2009, Abstract Nr. 220 und 483 Weitere Informationen: Bristol-Myers Squibb GesmbH Dr. Marcus Täuber Rivergate/Gate 1/5. OG Handelskai 92, 1200 Wien Tel.: 01/601 43-261 Fax: 01/601 43-229 E-Mail: [email protected] universimed.com | news EASL 2012: Große Fortschritte bei interferonfreier Therapie von Virushepatitis C Die Ergebnisse entstammen der bislang umfangreichsten interferonfreien PhaseII-Studie mit insgesamt 362 Patienten, die auch Patienten mit fortgeschrittener Lebererkrankung einschließt. Alle Patienten wurden mit einer interferonfreien Kombination aus dem Proteaseinhibitor BI 201335 (Gabe einmal täglich) und dem Polymeraseinhibitor BI 207127 (Gabe zwei- bis dreimal täglich) sowohl mit als auch ohne Ribavirin über verschieden lange Zeiträume behandelt.1 nötigt. Eine Behandlungsoption, die die Patienten von den Nebenwirkungen und der langwierigen Behandlung mit Interferon befreit, wird ein enormer Fortschritt sein“, erläuterte Studienleiter Von allen untersuchten Patienten erreichten 68% nach 28-wöchiger Therapie eine virale Heilung, einschließlich Patienten mit Genotyp 1a non-CC, die als am schwersten zu heilen gelten. Bemerkenswert ist, dass bei bis zu 82% der Patienten mit den Genotypen 1a CC und 1b, die die Mehrheit der Patienten in Europa und Asien/ Pazifik ausmachen, nach 28 Wochen Behandlung eine virale Heilung erzielt wurde. Die Ergebnisse sind bei dieLa Sagrada Familia, Barcelona sen Patientengruppen einzigartig und könnten einen Verzicht auf Interferon ermöglichen, das bei Prof. Dr. Stefan Zeuzem, Direktor der allen derzeit verfügbaren Behandlungs- Medizinischen Klinik I am Klinikum der optionen mit verabreicht werden muss. Johann-Wolfgang-Goethe-Universität Frankfurt. „Eine interferonfreie Thera„Interferonfreie Therapieoptionen wer- pie kann die häufig schweren Nebenden in der Behandlung von Patienten wirkungen verringern und die Patienten mit chronischer Hepatitis C dringend be- motivieren, die Therapie fortzusetzen, universimed.com um so schließlich eine virale Heilung zu erreichen.“ Eine Interferontherapie geht häufig mit Nebenwirkungen wie Depression, gastrointestinalen und dermatologischen Erkrankungen sowie Blutbildveränderungen einher. In seltenen Fällen treten schwerwiegende Nebenwirkungen wie Herzinsuffizienz, Sepsis und Verlust des Sehvermögens auf.2, 3 Die interferonfreie Kombinationstherapie wurde in allen fünf Behandlungsarmen der SOUND-C2-Studie gut vertragen und hat ein günstiges Sicherheitsprofil. Das PhaseIII-Studienprogramm befindet sich derzeit in Planung. Diese Studien werden die Wirksamkeit und Sicherheit der interferonfreien Kombinationstherapie mit BI 207127 und BI 201335 bei Patienten vom Genotyp 1 weiter untersuchen. Referenzen: 1 Zeuzem S et al: SVR4 and SVR12 with an interferon-free regimen of BI 201335 and BI 207127 +/– ribavirin, in treatment-naive patients with chronic genotype-1 HCV infection. Abstract Nr. 101, präsentiert auf dem International Liver CongressTM (ILC), 18.–22. April 2012 © fotolia.de Im Rahmen des Jahreskongresses der European Association for the Study of the Liver (EASL), 18.–22. April in Barcelona, wurden neue Studiendaten zur interferonfreien Therapie der Virushepatitis C (HCV) präsentiert. Die Ergebnisse der größten interferonfreien Phase-II-Studie zeigen, dass bis zu 82% der HCV-Patienten nach nur 28-wöchiger Behandlung eine virale Heilung erreichten.1 Diese Ergebnisse wurden bei Patienten mit den häufigen Genotypen 1a CC und 1b beobachtet, die mit direkt wirksamen, in der klinischen Prüfung befindlichen antiviralen Substanzen von Boehringer Ingelheim behandelt wurden. 2 ational Institutes of Health; US DeN partment of Health and Human Services: Chronic Hepatitis C: Current Disease Management. Bethesda, MD: National Institutes of Health; 2010. NIH Publication 10-4230 4 3 orld Health Organisation: HepaW titis C. 2002; http://www.who.int/ csr/disease/hepatitis/Hepc.pdf (Stand: 16. 4. 12) Quelle: Presseworkshop Boehringer Ingelheim „Unravelling the evolution of HCV and its treatment“, 21. April 2012, Barcelona 13 I JATROS Infektiologie 2 I 2012 ERS/ESCMID-Leitlinie Management tiefer Atemwegsinfektionen beim Erwachsenen H. Flick, Graz Eine Arbeitsgruppe der European Respiratory Society (ERS) und der European Society for Clinical Microbiology and Infectious Diseases (ESCMID) hat im November 2011 eine Überarbeitung der Empfehlungen von 2005 zum Thema tiefe Atemwegsinfektionen beim Erwachsenen veröffentlicht (bzgl. der Empfehlungsgrade siehe Tab. 2).1 Berücksichtigt wurden Publikationen bis Mai 2010. Im Folgenden wurden die Empfehlungen in aller Kürze zusammengefasst und an einigen Stellen durch den Autor mit Blick auf die Situation in Österreich und Deutschland kommentiert. Für einen beträchtlichen Teil aller Infektionen der tiefen Atemwege (engl.: lower respiratory tract infections, LRTI) gelingt weder im klinischen Alltag noch in Studien der Erregernachweis. Unter optimierten Studienbedingungen (kostenintensive Diagnostik und maximaler logistischer Aufwand) ist ein Erregernachweis bei der ambulant erworbenen Pneumonie (engl.: community-acquired pneumonia, CAP) jedoch in bis zu 89% möglich (Tab. 1).2 In 0–14% aller CAP handelt es sich um duale (zwei virale oder zwei bakterielle Erreger) und in 3–30% um gemischte (virale und bakterielle Erreger) Infektionen. Bei älteren Patienten (>70 Jahre), chronisch Nieren- oder Herzerkranken und bei bilateralen oder interstitiellen Pneumonien wird überdurchschnittlich häufig kein Erreger nachgewiesen.3 Ambulant erworbene Pneumonie Extrazelluläre Erreger: Unverändert verursacht Streptococcus pneumoniae (S. pneumoniae) einen Großteil aller CAP. I 14 Bei der hospitalisierten CAP (hCAP) spielen lt. ERS/ESCMID bei den extrazellulären Erregern zusätzlich Enterobacteria-ceae (bis 33%), Haemophilus influenzae (bis 21%), Pseudomonas aeruginosa (bis 12%), Moraxella catarrhalis (bis 4%) und Staphylococcus aureus (bis 4%) eine wichtige Rolle. Der hohe und gramnegativen Bakterien (bis 27%) zu rechnen. Hochvirulente Panton-Valentine-Leukocidin-bildende Staphylococci aurei wurden in Europa bei sCAP sporadisch nachgewiesen, sind insgesamt jedoch noch sehr selten (emerging infection). Anteil an Enterobacteriaceae- und Pseudomonas-Infektionen ist jedoch sehr umstritten und wird z.B. durch aktuelle CAPNETZ-Daten nicht bestätigt (dort nur 3,2% bzw. 1%).5 Bei der schweren CAP (sCAP) ist prinzipiell mit einem höheren Anteil an Staphylococcus aureus (bis 19%), Legionella (bis 30%) Viren: Virusinfektionen spielen in den tiefen Atemwegen eine wichtige Rolle und lassen sich bei bis zu 61% aller LRTI nachweisen. Dies gilt auch für die CAP (ambulant behandelte CAP bis 33%, hCAP bis 24% und sCAP bis 17% viraler Genese oder zumindest mit viraler Beteiligung). Somit sind Viren © fotolia.de Erreger Intrazelluläre Erreger: Hier dominieren Mycoplasma- und Legionella-Infektionen (bis 14%). Entsprechend den CAPNETZ-Daten ist die Bedeutung der Chlamydia-pneumoniae-Pneumonie eher marginal. In einigen Regionen (u.a. Schweiz, Spanien, Großbritannien, Deutschland, Niederlanden) treten immer wieder Coxiella-burnetii-Pneumonien und Q-Fieber-Ausbrüche auf (Zoonose). In Österreich ist Coxiella burnetii ebenfalls endemisch.11 universimed.com | referat Erregerspektrum LRTI aCAP hCAP hCAP (>60 J.) sCAP CAPNETZ AECOPD AEBX Streptococcus pneumoniae 3–30 0–36 3–76 2–48 12–48 45 8–28 6–11 Haemophilus influenzae 3–14 0–14 1–21 2–20 0–12 Extrazelluläre Bakterien Pseudomonas aeruginosa Staphylococcus aureus 0–12 1–10 Enterobacteriaceae Moraxella catarrhalis 1–3 5–7 0–42 10–32 0,4–1,0 0–18 15–33 0–1 0–4 7–29 0–19 5–7 4–22 3–7 0–1 0–33 3–20 0–27 1,3–3,2 5–19 18–53 0–3 0–4 0–4 3–11 2–8 NTM 3–23 Intrazelluläre Bakterien Mycoplasma pneumoniae 1–9 Legionella pneumophila 1–33 0–18 0–7 0–7 6,8 0–13 1–14 0–9 0–30 3,8 0,9 Chlamydia species (alle) 0–3 1–16 0–16 2–13 0–2 Coxiella burnetii 0–1 0–3 0–11 0–6 0–2 Viren (alle) 6–61 2–33 1–24 0–31 0–17 Influenza 4–30 0–19 0–13 0–26 0–9 0–10 2–4 0–34 Viren 12–49 3,2 0–29 Parainfluenza 0–25 Rhinovirus 0–43 Respiratory syncytial virus 0–17 Adenovirus 1–7 LRTI: Infektion der tiefen Atemwege (engl.: lower respiratory tract infections) CAP: ambulant erworbene Pneumonie (engl.: community-acquired pneumonia, CAP) aCAP: ambulant therapierte CAP hCAP: hospitalisierte CAP sCAP: schwere CAP (i.d.R. Intensiv- oder Überwachungspatienten) CAPNETZ: Daten aus dem CAPNETZ. Siehe Quelle in Dtl. 6, 7, 8, 9, 10 AECOPD: akut exazerbierte COPD AEBX: akut exazerbierte Non-CF-Bronchiektasie-Erkrankung Die häufigsten Erreger ≥20% (sehr häufig) ≥10% (häufig) <10% (selten) Tab. 1: Erregerspektrum bei LRTI (adaptiert nach1 und ergänzt durch CAPNETZ-Daten bzgl. CAP) hinter S. pneumoniae die zweithäufigsten CAP-Erreger, was aktuelle Studien aus Schweden und Kanada bestätigen.2, 4 Bei Erwachsenen mit CAP spielen vor allem Influenzaviren (inkl. H1N1), RSV, hMPV, Parainfluenza-, Corona- und Rhinoviren eine Rolle. In endemischen Regionen (z.B. Österreich) treten sporadisch schwere Hanta-Pneumonien auf. Akut exazerbierte COPD (AECOPD) und akut exazerbierte BronchiektasieErkrankung (AEBX) Pneumokokken, Haemophilus influenzae und Moraxella catarrhalis dominieren bei der AECOPD. Bei folgenden Risikofaktoren ist jedoch mit einer Veruniversimed.com schiebung im Erregerspektrum zu rechnen (weniger Pneumokokken, mehr S. aureus, mehr gramnegative Erreger inkl. Enterobacteria-ceae und Pseudomonas): • FEV1 <50% • zystisch-variköse Bronchiektasen • starke Sputumproduktion • antibiotische Vorbehandlung Resistenzen Prinzipiell bestehen zwischen den EULändern erhebliche Unterschiede im Resistenzspektrum. Genaue und aktuelle Informationen liefert das europäische Surveillance Netzwerk EARS-NET (http://www.earss.rivm.nl). Streptococcus pneumoniae Gegenüber Pneumokokken ist Amoxicillin das aktivste orale Betalaktamantibiotikum (BLA) und bei den oralen Cephalosporinen Cefpodoxim und Cefuroxim. Bei Penicillin-MIC >2mg/l sollten keine oralen Cephalosporine verwendet werden. Bei MIC ≤8mg/l ist Penicillin i.v. (2g bzw. 3,2mU alle 4h) noch adäquat. Bei den parenteralen Cephalosporinen sind z.B. Cefotaxim (2g alle 6h) und Ceftriaxon (1g alle 12h) bei MIC ≤8mg/l gut und Ceftazidim schlecht wirksam. Bei penicillinresistenten Pneumokokken (PRSP) sind Carbapeneme die wirksamsten BLA. In Europa ist die Prävalenz von PRSP und von makrolid- bzw. tetrazyklinre15 I JATROS Infektiologie 2 I 2012 © UNIVERSIMED ® Penicillinresistenzen <1% 1 to <5% 5 to <10% 10 to <25% 25 to <50% ≥50% No data reported or less than 10 isolates Not included Liechtenstein Luxemburg Malta Abb. 1: Prävalenz penicillinresistenter Pneumokokken 2010 (http://www.earss.rivm.nl) sistenten Pneumokokken sehr inhomogen verteilt (Abb. 1 und 2). In Österreich lag die Rate an PRSP 2009 bei 7,84%, die Makrolidresistenz bei 15,3% und die Tetrazyklinresistenz bei 1,1%.12 Fluoroquinolone (FQ) sollten nur in ausgewählten Situationen zum Einsatz kommen. Fluoroquinolonresistente Pneumokokken (FQRP) sind in Europa selten (1–3%) und deren Zunahme gilt es zu verhindern. Entsprechend der Antibiotika-Resis-tenz-Surveillance des RKI sind bereits 33% der Pneumokokken gegen Levofloxacin nur noch intermediär sensibel (1,2% resistent und 65,8% sensibel). Bei Moxifloxacin stellt sich die Situation günstiger dar (0,6% resistent, 0,3% intermediär und 99,1% sensibel). Die ERS/ESCMID-Leitlinie hebt hervor, dass Moxifloxacin das größte und Levofloxacin das geringste Potenzial zur Prävention von FQRP hat und empfiehlt primär das potentere FQ. Haemophilus influenzae Die Betalaktamresistenz von Haemophilus wird meist durch Betalaktamasen (BL) bedingt (in Europa 0–18% aller Isolate und in Österreich ca. 5%), es gibt jedoch auch BL-negative amoxicillinresistente (in Europa 0–34%, in Österreich ca. 5%) und selten Amoxicillin/ Clavulansäure-resistente Stämme. Die I 16 Tetrazyklinresistenz variiert in Europa lokal zwischen 1 und 38%. Aufgrund von Effluxpumpen wirken Makrolide nur moderat (>90% nur intermediär sensibel), wobei Azithromycin noch am wirksamsten ist. Die Prävalenz von Tetrazyklinresistenzen ist in Europa lokal unterschiedlich (Großbritannien <1%, Griechenland 38%) und Fluoroquinolonresistenzen sind aktuell in Europa nicht relevant. Mycoplasma pneumoniae Resistenzen gegenüber Makroliden, Tetrazyklin oder FQ sind in Europa bisher selten. In Asien kam es jedoch seit 2000 zu einem raschen Anstieg makrolidresistenter Isolate (bis 30%) und in Eu-ropa gibt es aktuell Hinweise für einen möglichen Anstieg makrolidresistenter Mykoplasmen. Staphylococcus aureus Außer bei älteren, komorbiden Personen und bei Influenzainfektionen ist S. aureus sehr selten die Ursache für eine CAP. Die Relevanz von CA-MRSACAP ist in Eu-ropa aktuell gering. Ambulantes Management von CAP Die Unterscheidung zwischen einer akuten Bronchitis, AECOPD und CAP ist allein aufgrund der klinischen Symptomatik in der hausärztlichen Versorgung oft schwer. Kostenintensive Untersuchungen sollten jedoch nur bei ausgewählten Patienten erfolgen und daher wird ein empirisches und zugleich pragmatisches Vorgehen empfohlen. Diagnostik Beim Vorliegen eines der folgenden Zeichen oder Symptome sollte eine CAP vermutet werden: neue fokale radiologische Veränderungen, Dyspnoe, Tachypnoe, Puls >100/min oder Fieber >4 Tage. Ein CRP <20mg/l nach >24h Beschwerden spricht gegen und ein CRP >100mg/l eher für eine CAP. Bestehen Unklarheiten, wird ein Thoraxröntgen empfohlen [B1]. Mikrobiologische Diagnostik wie Gramfärbung und Kultur [B1] bzw. die Bestimmung des PCT [A1] ist im ambulanten Bereich nicht sinnvoll. Bei älteren Patienten (>65 Jahre) mit Orthopnoe und kardialen Vorerkrankungen ist das Vorliegen einer akuten linksventrikulären Dekompensation zu erwägen. Ein BNP <40pg/ml oder ein NT-proBNP <150pg/mg spricht gegen eine linksventrikuläre Dekompensation [C3]. Prognose Bei LRTI und erhöhtem Komplikationsrisiko ist eine engmaschige Verlaufskontrolle oder die stationäre Einweisung empfohlen. Folgende Faktoren erhöhen bei älteren Personen (>65 Jahre) mit LRTI das Komplikationsrisiko: COPD, Diabetes, Herzinsuffizienz, kürzliche Hospitalisierung oder Antibiotikatherapie, Steroidtherapie, keine Beschwerden im Bereich der oberen Atemwege, Verwirrtheit, Puls >100/min, Fieber, Atemfrequenz >30/ min, Blutdruck <90/60mmHg und der klinische Verdacht auf CAP [A3]. Die Notwendigkeit zur Hospitalisierung ergibt sich aus der ärztlichen Einschätzung der Gesamtsituation, orientiert sich aber universimed.com | referat Makrolidresistenzen © UNIVERSIMED ® an objektiven Kriterien (CRB-65 Score) [A3]. Therapie <1% Antibiotika sind indiziert 1 to <5% bei V.a. CAP [C1] oder bei 5 to <10% LTRI mit relevanten Beglei10 to <25% 25 to <50% terkrankungen (COPD ≥50% III–IV, Herzinsuffizienz, No data reported or less than 10 isolates IDDM, schwere neuroloNot included gische Erkrankungen) [C3]. Prinzipiell haben die traditionellen Antibiotika bei den LRTI den Vorzug und moderne Breitspektrumantibiotika (inkl. FQ) eher eine Reservefunktion. In diesem Sinne kommen Amoxicillin oder Tetrazykline primär als Liechtenstein Luxemburg Mittel der Wahl in Betracht. Malta Bei Penicillinallergie können Tetrazykline oder Makrolide verwendet werden, bei klinisch relevanter Resistenz- Abb. 2: Prävalenz makrolidresistenter Pneumokokken 2010 (http://www.earss.rivm.nl) lage auch Levofloxacin oder Moxifloxacin [C1]. Eine empirische vi- Schock, ausgedehnten Infiltraten oder septischem Schock (ssCAP) innerhalb rustatische Therapie bei V.a. Influenza dekompensierten Begleiterkrankungen von 60min nach Diagnosestellung erfolwird nicht empfohlen [B1]. Bei Hochrisi- (sCAP) sollte der Patient sofort auf eine gen [A1]. Bei gutem Ansprechen sollte kopatienten mit typischer Symptomatik Intensivstation oder Überwachungssta- die Therapiedauer 8 Tage nicht über<2 Tage kann eine virustatische Therapie tion (ICU/IMCU) verlegt werden [A3]. schreiten [C2] und kann unter PCTerwogen werden [A1]. Bei bis dahin Lun- Die Entscheidung hierfür orientiert sich Kontrolle verkürzt werden. Bei Bessegengesunden sollten Antitussiva, Expek- an validierten Scores (modified ATS rule, rung der Beschwerdesymptomatik kann toranzien, Mukolytika, Antihistaminika, IDSA/ATS rule oder SMART-COP). und sollte die Therapie von i.v. auf p.o. inhalative Steroide und Bronchodilataumgestellt werden [A3]. Nach der Umtoren bei akuter LRTI nicht verwendet Diagnostik stellung ist eine stationäre Observation werden [A1]. Vor Beginn der Antibiose werden zwei meist nicht mehr zwingend notwendig Blutkulturen angelegt und bei signifi- [A3]. Monitoring kantem Pleuraerguss eine diagnostische Tritt unter Antibiotikatherapie inner- Punktion durchgeführt [A3]. Sputum- hCAP: Für die unkomplizierte hCAP halb von 3 Tagen keine Besserung ein, färbungen oder -kulturen sind nur sinn- werden folgende BLA empfohlen: Peniwird eine ärztliche Reevaluation emp- voll bei purulentem Sputum und wenn cillin G, Aminopenicilline, Aminopenifohlen. Dasselbe gilt bei Fieber >4 Tage, eine zeitgerechte mikrobiologische Bear- cillin/BLI, Cefotaxim, Ceftriaxon. Vor progredienter Dyspnoe, drohender Ex- beitung möglich ist [A3]. Der Pneumo- allem bei schwer kranken Patienten sikkose oder Verwirrtheit [C3]. Komor- kokkenantigentest (Urin, Pleuraerguss) sollten die BLA mit einem modernen bide Patienten sollten prinzipiell nach 2 und Legionellenantigentest (Urin) Makrolid kombiniert werden. Von den Tagen klinisch reevaluiert werden. sollten vor allem bei sCAP durchgeführt FQ wird nur Moxifloxacin (höchste Anwerden [A3]. Bei antibiotisch anbehan- tipneumokokkenaktivität aller FQ) und Stationäres Management delten Patienten sind PCR-Untersu- Levofloxacin empfohlen [C4]. Bei Pativon CAP chungen zum Nachweis von Pneumo- enten mit ESBL-, aber ohne Pseudomokokken, Influenza, RSV und atypischen nasrisiko kommt auch Ertapenem in BeWie bereits erwähnt, ergibt sich die Not- Erregern gegebenenfalls sinnvolle Er- tracht. wendigkeit zur Hospitalisierung aus der gänzungen [A3]. Eine Bronchoskopie ärztlichen Gesamteinschätzung, sie orien- mit BAL oder geschützter Bürste ist bei sCAP: Für die sCAP (ICU/IMCU) tiert sich aber auch an objektiven Krite- therapierefraktärer CAP indiziert [A3]. ohne Pseudomonasrisiko kann die Komrien (CRB-65 Score) [A3]. Die Bedeubination Cephalosporin Gr. III plus Matung von Biomarkern ist dabei noch Therapie krolid oder Moxifloxacin/Levofloxacin ± nicht ausreichend evaluiert [A3]. Bei re- Die antibiotische Therapie muss so zei- Cephalosporin Gr. III verwendet werspiratorischem Versagen, schwerer Sepsis/ tig wie möglich [A3] und bei CAP mit den. Für die sCAP mit Pseudomonasriuniversimed.com 17 I JATROS siko werden folgende BLA empfohlen: Acylureidopenicillin/BLI, Ceftazidim (in Kombination mit Penicillin), Carbapeneme (Meropenem bevorzugt, 3x2g über 3h). Dabei werden die BLA kombiniert mit Ciprofloxacin (alternativ Levofloxacin 750mg/d oder 500mg 2x/d) oder mit einem Makrolid plus Aminoglykosid [C4]. Begleitmaßnahmen Eine frühzeitige Mobilisation ist anzustreben [A3]. Eine nicht invasive Beatmung ist zu erwägen bei Patienten mit COPD [B3] oder ARDS [A3]. Monitoring Das Therapieansprechen und der Entlassungszeitpunkt werden primär anhand klinischer Parameter (Entfieberung, Stabilisierung der kardiorespiratorischen Situation) und am CRP-Verlauf (Bestimmung an Tag 0, 1 und 3/4) beurteilt bzw. festgelegt [A3]. Ist das CRP an Tag 4 nicht um 50% gefallen, muss mit einer 5-fach erhöhten Mortalität gerechnet und die klinische Situation reevaluiert werden. Empfehlungen für das PCT werden nicht ausgesprochen (Studienlage unzureichend). Aspirationspneumonie Bei Aspiration daheim (kein Pflegeheim) wird eine Monotherapie (p.o. oder i.v.) mit Aminopenicillin/BLI, Clindamycin oder Moxifloxacin bzw. die Kombination aus i.v. Cephalosporin plus p.o. Metronidazol empfohlen. Patienten aus dem Pflegeheim mit Aspiration oder Patienten mit sCAP nach Aspiration erhalten ein Cephalosporin plus Clindamycin bzw. plus Metronidazol. Stationäres Management von AECOPD Diagnostik Bei der AECOPD werden Sputumkulturen empfohlen [A3]. Bei Patienten mit Bronchiektasen sollten Sputumkulturen auch zwischen den Exazerbationen angelegt werden (surveillance of colonization) [B3]. Therapie Eine Antibiose ist nur indiziert bei: • Anthonisen Typ I und II: purulentes I 18 | referat Infektiologie 2 I 2012 Sputum (Hauptkriterium) und ≥1 Nebenkriterium (vermehrt Dyspnoe und/oder vermehrte Sputummenge) [A2] oder • Patienten, die invasiv oder nicht invasiv beatmet werden müssen [A2] Empfehlungsgrade A = Evidenz konsistent (clear outcome) B = Evidenz inkonsistent (unclear outcome) C = Evidenz unzureichend (Consensus) • S uffix für A–C-Empfehlungen: für Studien bzgl. Diagnostik und Therapie 1. = Systematischer Review (SR), Metaanalyse (MA) 2. = ≥1 randomisierte Studie 3. = ≥1 Kohortenstudie (KS) 4. = Sonstiges • Suffix für A–C-Empfehlungen: für Studien bzgl. Prognose und Ätiologie 1. = SR, MA 2. = ≥1 KS 3. = Sonstiges Empfehlungen für PCT/ CRP werden nicht ausgesprochen (Studienlage unTab. 2 zureichend). Bei nicht purulentem Sputum und Anthonisen Typ III werden keine Antibiotika empfohlen [A2]. Kein Pseudomonasrisiko: Bei der AECOPD ohne Pseudomonasrisiko hängt die Wahl des Antibiotikums u.a. von der Schwere der Exazerbation und der lokalen Resistenzsituation ab. Empfohlen wird primär Aminopenicillin/BLI, alternativ Levofloxacin und Moxifloxacin [A2]. Pseudomonasrisiko: Dieses liegt vor, wenn ≥2 der folgenden Kriterien erfüllt sind: • Krankenhausaufenthalt in den letzten 3 Monaten, • Antibiotikabehandlung in den letzten 3 Monaten oder >4 Exazerbationen pro Jahr, • FEV1 <30% • Prednisolontherapie (>10mg/d über mehr als 2 Wochen) [A3]. Bei Pseudomonasrisiko kommt Ciprofloxacin (500mg 2x/d) oder Levofloxacin (750mg/24h oder 500mg 2x/d) in Betracht und für die i.v. Therapie Ciprofloxacin oder BLA mit Pseudomonasaktivität (die Kombination mit Aminoglykosiden ist optional) [A2]. Prophylaxe Bakterielle Extrakte (OM-85 BV) und andere orale H.-influenzae-Vakzine werden nicht empfohlen [B1], ebenso wenig die prophylaktische Therapie mit Makroliden oder inhalativen Antibiotika (Tobramycin) bei Non-CF-Bronchiektasen (Studienlage unzureichend) [C2]. Orale Mukolytika können im Winter bei Patienten mit häufigen oder prolongierten Exazerbationen vorteilhaft sein [B1]. Allen Patienten mit Risikofaktoren (>65 Jahre, chronische Lungenerkrankungen, kardiovaskuläre Erkrankungen, Diabetes u.v.m.) wird die 23-valente Polysaccharid-Pneumokokkenimpfung (PPV) [A1] und die jährliche Grippeschutzimpfung [A2] empfohlen. Die PPV sollte nach frühestens 5 Jahren einmalig aufgefrischt werden [B3]. Konjugierte Pneumokokkenimpfungen werden für Erwachsene noch nicht empfohlen (Studienlage unzureichend). Referenzen: 1 Woodhead M et al, Eur Respir J 2011; 38(6): 1250-1 bzw. Clin Microbiol Infect 2011; 17(Suppl 6): E1-59 2 Johansson N et al, Clin Infect Dis 2010; 50: 202209 3 Ewig S et al, Eur Respir J 2002; 20: 1254-1262 4 Johnstone J et al, Chest 2008; 134: 1141-1148 5 Pletz MW et al, Dtsch Med Wochenschr 2011; 136: 775-780 6 Baum H et al, Eur Respir J 2010; 35: 598-605 7 Baum H et al, Clinical Infectious Diseases 2008; 46: 1356-64 8 Welte T et al, Med Klin 2006; 101: 313-20 9 Baum H et al, Eur Respir J 2011; 37: 1151-1157 10 Baum H et al, BMC Infectious Diseases 2009, 9: 62 11 Allerberger F et al, Q Fever, Austria 2009. AGES 2009 12 Heuberger S et al, AGES Pneumokokken Jahresbericht 2009 n Autor: OA Dr. Holger Flick Klinische Abteilung für Lungenkrankheiten, UKIM-LKH Universitätsklinikum, Medizinische Universität Graz Auenbruggerplatz 20 8036 Graz E-Mail: [email protected] inf120214 universimed.com | kongress ECCMID 2012 Infektionen mit Clostridium difficile: Strategien gegen das Rezidivrisiko Durch das hohe Rezidivrisiko, die gesteigerte Morbidität und Mortalität und verlängerte Krankenhausaufenthalte stellen Infektionen mit Clostridium difficile (CD) eine Belastung für das Gesundheitssystem dar. Unterdiagnose und unzureichende Therapie verschärfen das Problem. In der Therapie geht es vor allem darum, das Risiko für Rezidivepisoden zu verringern. Die neue Substanz Fidaxomicin hat in diesem Punkt Vorteile gegenüber dem Standardmedikament Vancomycin gezeigt. Durchschnittlich kommen in europäischen Ländern auf 10.000 Krankenhaustage 5 Episoden einer CD-Infektion, wie Prof. Emilio Bouza, Madrid, ausführte.1 Die Inzidenz von CD-Infektionen hat nicht nur im Krankenhaus zugenommen, sondern auch im ambulanten Bereich.2 Besonders gefährdet, sich den Keim zuzuziehen, sind ältere Patienten, die eine Antibiotikatherapie bekommen, Patienten mit chronisch entzündlichen Darmerkrankungen, HIV-Patienten und Transplantatempfänger. Abhängig vom Immunsystem wird ein Teil der Patienten eine asymptomatische Kolonisation entwickeln, ein anderer eine Infektion. Das Toxin macht krank, nicht das Bakterium Das Leitsymptom der CD-Infektion ist die Diarrhö, die die meisten Patienten betrifft. Das krank machende Agens ist nicht C. difficile selbst, sondern das Toxin. Häufig findet man auch eine massiv erhöhte Leukozytenzahl, die manchmal auch der einzige Hinweis auf die Infektion sein kann. Doch im Krankenhaus bleiben CD-Infektionen häufig unerkannt, weil bei einem beträchtlichen Teil der Patienten mit Diarrhö eine entsprechende Diagnostik versäumt wird. Je öfter man testet, desto höher ist die Inzidenz der CD-Infektion.2 Kein einzelnes Immunoassay zum Toxinnachweis ist dafür alleine sensitiv und speuniversimed.com zifisch genug, betonte Prof. Mark Wilcox, Leeds, um die Diagnose zu stellen. Die European Society of Clinical Microbiology and Infectious Diseases (ESCMID) empfiehlt deshalb einen zweistufigen diagnostischen Prozess bei Diarrhö, der im ersten Schritt mittels Amplifikation oder Antigentest die Anwesenheit des Keims im Stuhl nachweist und in einem zweiten Schritt mittels Immunoassay das Toxin. Dies wird jedoch in der Praxis häufig nicht gemacht. Eine Untersuchung aus England zeigte, dass 70% der Krankenhäuser 2010 nur ein einzelnes Enzym-Immunoassay benuzten.4 Rezidivrisiko steigt von Episode zu Episode Ein großes Problem sind die häufigen Rezidive von CD-Infektionen, weil sie die Morbidität und die Mortalität erhöhen sowie durch mehr Krankenhaustage die Kosten nach oben treiben. Wie Prof. Ciaran Kelly, Boston, ausführte, steigt das Risiko dafür mit jeder weiteren Episode von zunächst 25% auf weit über 50% an (Abb.).5 Die Höhe des Rezidivrisikos scheint assoziiert zu sein mit der Immunantwort auf die Erstinfektion.6 Bei Patienten, die weitere Episoden durchmachten, fehlte der Anstieg des IgM- und IgG-Antitoxin-A-Spiegels im Serum, der bei Patienten, die nur eine Infektionsepisode erlebten, deutlich ausgeprägt war. Die primäre Ursache für Rezidive ist nicht etwa die Entwicklung einer Antibiotikaresistenz, sondern dass die Antibiotikatherapie zu einem bleibenden Verlust der Abwehr gegen die Kolonisierung führt. Jede weitere Antibiotikatherapie, die Patienten mit wiederholten Episoden bekommen, die keine schützende Immunität aufgebaut haben, wird dazu führen, dass die Resistenz gegen die Kolonisierung weiterhin niedrig bleibt. Daraus entsteht ein Kreislauf ständig wiederkehrender Infektionsepisoden. Es gibt Patienten, die das Problem nie wieder loswerden, so Kelly. Modell zur Abschätzung des Rezidivrisikos Kelly und Mitarbeiter entwickelten prospektiv in einer Patientenkohorte anhand von Publikationen über Risikofaktoren ein einfaches klinisches Vorhersagemodell für das Wiederauftreten von CD-Infektionen und validierten es später in einer weiteren Kohorte:7 - Alter >65 Jahre = 1 Punkt - Schwere oder fulminante Erkrankung (Horn’s Index) = 1 Punkt - Zusätzlicher Antibiotikagebrauch = 1 Punkt Bei einem Score von 3 Punkten betrug das Rezidivrisiko 66,7%, bei einem Score von 2 Punkten 31,1%, bei einem Score von 1 Punkt 16,7% und bei einem Score von 0 Punkten 0%. Für das Vorhersagemodell 23 I | kongress Infektiologie 2 I 2012 Wichtiges Therapieziel: Rezidivrisiko senken Das Ziel der Therapie ist, C. difficile aus dem Darm zu entfernen, damit sich die normale Mikroflora dort erholen kann, erklärte Prof. Oliver Cornely, Köln. Dazu ist die Unterbrechung einer begleitenden Antibiotikatherapie der erste Schritt. Die ESCMID empfiehlt derzeit zur Therapie einer ersten nicht schweren Infektionsepisode 500mg Metronidazol 3x täglich für 10 Tage.8 Eine schwere Episode sollte be- „Fidaxomicin gehört in die erste Linie“ Gibt es Patienten, bei denen Sie heute Fidaxomicin schon primär einsetzen würden? Cornely: Den Platz für Fidaxomicin sehe ich derzeit vor allem für Patienten, die eine zweite Infektionsepisode erleiden, die schwerwiegend ist. Je mehr Erfahrung wir mit dieser neuen Substanz haben, desto mehr werden wir auch darüber nachdenken, bestimmte Patienten schon bei einer ersten Episode damit zu behandeln. Wir haben in den Studien keine Subgruppe gefunden, die nicht von Fidaxomicin profitiert hätte. Wenn wir mit einem Medikament das Wiederauftreten der CD-Infektion verhindern können, wird der primäre Einsatz möglicherweise auch bei einem zu erwartenden hohen Preis ökonomisch sinnvoll sein. vorzugt mit Vancomycin (125mg oral 4x täglich über 10 Tage) behandelt werden. Die meisten Patienten sprechen zwar auf diese Standardtherapie an, aber das Rezidivrisiko wird nicht ausreichend vermindert. „Wir brauchen dringend neue Medikamente, die ähnlich effektiv sind wie Vancomycin, aber auch das Rezidivrisiko senken“, forderte Cornely. Derzeit wird eine Reihe von neuen Medikamenten entwickelt, die möglicherweise das Potenzial haben, den Zyklus wiederholter Episoden zu durchbrechen. Dazu gehört Fidaxomicin. Cornely fasste zwei Phase-III-Studien,9, 10 zusammen, in denen Patienten mit erster oder zweiter Episode einer CD-Infektion für 10 Tage Fidaxomicin (200mg 2x täglich) oder Vancomycin (125mg 4x täglich) erhielten. Daran schloss eine Follow-upPhase von 30 Tagen an, nach der das Rezidivrisiko analysiert wurde. Die klinischen Heilungsraten nach 10 Tagen waren in beiden Studien unter Fidaxomicin und Vancomycin identisch. Doch in der Rezidivrate zeigte sich durchwegs ein klarer und signifikanter Vorteil für Fidaxomicin. Auch eine anhaltende klinische Heilung erreichten unter Fidaxomicin signifikant mehr Patienten als unter Vancomycin. Auch in einer Subgruppe von Patienten mit schwerer CD-Infektion senkte Fidaxomicin die Rezidivhäufigkeit signifikant effektiver9 bzw. führte signifikant häufiger zu einer anhaltenden klinischen Heilung.10 Gepoolte Daten beider Studien weisen auch darauf hin, dass Infektionen mit hypervirulenten Stämmen (z.B. 027) ebenso gut auf Fidaxomicin ansprechen wie auf Vancomycin und dass Patienten, die andere Antibiotikatherapien fortsetzen müssen, mit Fidaxomicin höhere klinische Heilungsraten und häufiger eine anhaltende Heilung erreichen als mit Vancomycin. Medikamentenbezogene unerwünschte Ereignisse traten unter beiden Medikamenten gleichermaßen selten auf. Dies entsprach der Erwartung, da beide kaum resorbiert werden, so Cornely. Referenzen: 1 Bauer MP et al, Lancet 2011; 377: 63-73 2 Murphy CR et al, Infect Control Hosp Epidemiol 2012; 33: 20-28 3 Crobach MJ et al, CIin Microbiol Infect 2009; 15: 1053-1066 4 Goldenberg SD et al, J Hosp Infect 2011; 79: 4-7 5 Aslam S et al, Lancet Infect Dis 2005; 5: 549-557 6 Kyne L et al, Lancet 2001; 357: 189-193 7 Hu MY et al, Gastroenterology 2009; 136: 12061214 8 Bauer MP et al, Clin Microbiol Infect 2009; 15: 1067-1079 9 Louie TJ et al, N Engl J Med 2011; 364: 422-431 10 Cornely O et al, Lancet Infect Dis 2012; 12: 281289 l Bericht: Dr. Angelika Bischoff Quelle: Symposium „Breaking the cycle of recurrent C. difficile infections“ ECCMID-Kongress, 1. April 2012, London Mit freundlicher Unterstützung der Fa. ASTELLAS inf120223 Rezidivrisiko 80% Rezidivrate 60% ~65 40% ~45 20% 0% ~25 % % % Erste Episode Erstes Rezidiv Zweites Rezidiv Nachgefragt bei: Prof. Oliver Cornely, Köln Abb.: Ansteigendes Rezidivrisiko von Episode zu Episode I 24 universimed.com Fachinformation zu Inserat siehe Seite 39 wurde in der Validierungskohorte eine diagnostische Genauigkeit von 71,9% errechnet. Für sinnvoll hält Kelly die Anwendung eines solchen Modells in der Klinik nicht nur, um Patienten mit hohem oder niedrigem Risiko zu erkennen, sondern auch, um das Rezidivrisiko z.B. durch Vermeiden begleitender Antibiotika zu senken, die Aufmerksamkeit für eine rasche Diagnose und Therapie von Rezidiven zu erhöhen und bei Hochrisikopatienten noch effektivere Medikamente einzusetzen, um weitere Episoden zu vermeiden. © UNIVERSIMED ® JATROS NEU Fidaxomicin Das erste makrozyklische Antibiotikum Behandeln Sie C. difficile-Infektionen ... ... und befreien Sie Ihre Patienten von der Rezidivgefahr NEU Fidaxomicin Dauerhaftes Ansprechen. Weniger Rückfälle. JATROS Infektiologie 2 I 2012 Eröffnungsvortrag Bakterielle Resistenzen – Evolution und ihre Folgen D. Livermore, London Festredner und internationaler Ehrengast des 6. Österreichischen Infektionskongresses war Dr. David Livermore, Professor für medizinische Mikrobiologie an der University of East Anglia und einer der weltweit führenden Experten auf dem Gebiet der Antibiotikaresistenzen. In seinem Vortrag zeigte er auf, dass der Kampf gegen bakterielle Infektionen nicht gewonnen und dass, ganz im Gegenteil, die Therapie schwieriger wird; gleichzeitig ist die moderne Medizin entscheidend von der Fähigkeit abhängig, Infektionen wirksam zu behandeln. „Charles Darwin müsste heute nicht mehr auf die Galapagos-Inseln fahren, um das Prinzip der Evolution zu entdecken“, so Prof. Dr. David Livermore, Mikrobiologe an der University of East Anglia, Norwich, und führender Experte der „Health Protection Agency“, London, für den Bereich Antibiotikaresistenzen, zur Eröffnung des 6. Österreichischen Infektionskongresses in Saalfelden. „Er müsste nur einige Monate in einem modernen Krankenhaus verbringen, denn Bakterien geben uns wohl den besten Beweis für die Richtigkeit der Evolutionstheorie!“ Verschiedene Prozesse „In den letzten fünf bis sieben Dekaden haben verschiedene Prozesse stattgefunden, die heute bei der Entwicklung neuer Antibiotikaresistenzen von Bedeutung sind“, erläuterte der Mikrobiologe. Zunächst haben sich die Patienten verändert, die Lebenserwartung – und damit der Altersdurchschnitt – ist gestiegen, das Krankheitsspektrum hat sich erheblich verschoben; infolgedessen hat sich aber auch die Anfälligkeit der Patienten für Keime wie Pseudomonas, Enterobacter oder Acinetobacter, die früher als harmlos galten, gesteigert. Die Selektion resistenter Mutanten durch Antibiotikatherapie betrifft sowohl diese als auch die klassisch I 26 pathogenen Bakterienspezies, wie z.B. Staphylococcus aureus. Daneben gibt es noch ein zweites Prinzip in der Entstehung von bakteriellen Resistenzen: den Austausch von genetischem Material, z.B. in Form von Plasmiden. „Resistenzgene können sich durch horizontalen Transfer sowohl innerhalb derselben Bakterienspezies verbreiten als auch auf diverse andere Spezies übergehen – man spricht hier von GenEpidemien“, erklärte Livermore. „Das größte Problem entsteht dann, wenn ein potentes Resistenzgen auf einen biologisch erfolgreichen, hochgradig verbreitungsfähigen Bakterienstamm trifft“, schilderte Livermore. „Das führt zu sehr rascher Verbreitung von Resistenzen.“ Staphylococcus aureus … Der Methicillin-resistente Staphylococcus aureus (MRSA) stellt weltweit eines der großen, aktuellen Resistenzprobleme dar. Die Resistenz entsteht durch die Akquisition eines Gens namens mecA, das sich seit 1993 weltweit verbreitet hat. In Großbritannien wurden zwei besonders erfolgreiche S.-aureus-Stämme – EMRSA-15 und EMRSA-16 – identifiziert. So waren in England und Wales im Jahr 2002 bereits über 40% aller Bakteriämien durch S. aureus verursacht, 90% davon durch EMRSA-15 und -16. Und insgesamt waren MRSA für 10% aller Bakteriämien verantwortlich. „Diese Betalaktamresistenz führte dazu, dass MRSA häufiger mit Vancomycin behandelt wurden, das jedoch in vieler Hinsicht ein schlechteres Antibiotikum ist“, führte Livermore aus. Eine koreanische Studie, in der Patienten mit Bakteriämie durch Methicillin-empfindlichen Staphylococcus aureus (MSSA) entweder mit Vancomycin oder mit Betalaktamen behandelt wurden, zeigte eine doppelt so hohe bakteriämiebedingte Mortalität in der Vancomycin-Gruppe (37% vs. 18%; p=0,02).1 Durch Einführung einer Meldepflicht für MRSA-Bakteriämien in Großbritannien, besseres Hygienemanagement (einschließlich Gefäßkatheter), aber vielleicht auch durch ein natürliches „Ausbrennen“ bestimmter Stämme (v.a. EMRSA-16) kam es jedoch in der letzten Dekade in Großbritannien zu einem Rückgang der MRSA-Bakteriämien. Ähnliche Reduktionen wurden in anderen europäischen Ländern erzielt. „Die letzten Daten, die ich kenne, zeigen, dass in England jetzt nur noch 10% der S.-aureus-Bakteriämien durch MRSA verursacht werden, was einer Reduktion um 75% entspricht“, zeigte sich Livermore erfreut. universimed.com Österreichische Gesellschaft für Infektionskrankheiten und Tropenmedizin … Escherichia coli … | 6. Österreichischer Infektionskongress Bakteriämieerreger in England „Weltweit betrachtet ist dieses Problem – und die Resistenzproblematik generell – noch viel größer, und zwar besonders in Ländern wie Indien oder China, die nicht mehr arm sind und immer bessere medizinische Versorgung anbieten, aber noch über wenige sinnvolle Maßnahmen zur Resistenzkontrolle verfügen“, ergänzte der Mikrobiologe. So lag bereits 2009 in Indien die Rate der ESBL („Extended-Spectrum Betalactamase“)Bildner bei E. coli 79% und bei Klebsiella oxytoca sogar noch höher.3 „Die Situation in China ist nicht viel besser“, so Livermore. Die Resistenz von E. coli gegen moderne Cephalosporine wird am häufigsten durch verschiedene ESBL-Unterformen vom CTX-M-Typ verursacht. Ein besonders erfolgreicher E.-coli-Stamm, „ST131“, hat CTX-M über große Plasmide, wie z.B. pEK499, akquiriert, die zugleich auch Resistenzgene gegen Aminoglykoside, Chloramphenicol, Makrolide, Fluorchinolone, Sulfonamide, Trimethoprim und Tetrazykline tragen.4 Bakteriämien durch ESBL-bildende Enterobakterien sind im Vergleich zu NichtESBL-Bildnern mit einem um 85% höheren Mortalitätsrisiko assoziiert.5 „Es ist übrigens ein Mythos, dass Plasmide eine Belastung für Bakterien darstellen und deshalb nach Aufhören des Resistenzdrucks durch Antibiotika relativ schnell verschwinden – das Gegenteil ist der Fall. Das Plasmid pEK499 bildet nicht weniger als fünf Abhängigkeitssysteme. Ein Abhängigkeitssystem produziert ein stabiles Toxin und ein instabiles Antitoxin. Verliert ein Bakterium das universimed.com Quelle: Livermore, mod. nach Wilson J et al2 Während S. aureus als Bakteriämieerreger eher zurückgeht, steigt die Zahl der durch E. coli verursachten Bakteriämien weiter an (Abb.).2 „Wir wissen nicht genau, warum das so ist, aber wir wissen sehr wohl, dass die Resistenzraten gramnegativer Keime wie E. coli weiter zunehmen“, hielt Livermore fest. So stiegen in der ersten Dekade des 21. Jahrhunderts die Resistenzraten von E. coli sowohl gegen Fluorchinolone als auch gegen Drittgenerations-Cephalosporine in Europa deutlich an. Abb.: Absinken von MRSA bei gleichzeitigem Anstieg von E. coli Plasmid, so überwiegt nach kurzer Zeit das Toxin und das Bakterium stirbt“, schilderte Livermore. … Carbapenemasen und … Eine logische Folge des Ansteigens von ESBL-Bildnern ist die vermehrte Anwendung von Carbapenemen, die gegen „klassische“ ESBL-Bildner wirksam sind. „Doch damit entstand das nächste Problem – der erhöhte Selektionsdruck führte in den letzten fünf bis sieben Jahren auch zum Ansteigen von Carbapenemasebildnern bei Enterobakterien sowie Acinetobacter“, erklärte der Mikrobiologe. „Auch hier entstanden höchst erfolgreiche Stämme, insbesondere Klebsiella pneumoniae ST258, das KPC-2/3-Carbapenemasen besitzt und sich international verbreitet hat. Gegen solche Stämme haben wir aber keine ,guten‘ Antibiotika mehr in Reserve. Deshalb sind wir gezwungen, Reservesubstanzen wie Polymyxine – nephrotoxisch und bei i.v. Gabe niedrige Gewebespiegel in der Lunge –, Fosfomycin – hohes Resistenzrisiko bei Verwendung außerhalb des Harntrakts – oder Tigecyclin – unsichere Wirksamkeit außerhalb der zugelassenen Indikationen – zu verwenden“, so Livermore. Fluorchinolone, Makrolide, und in den letzten Jahren wurden auch zunehmende Resistenzraten gegen DrittgenerationsCephalosporine berichtet. „Insgesamt ist die Resistenzentwicklung ein dramatisches Beispiel für das Prinzip der Evolution und ein großes medizinisch-praktisches Problem, das unsere Möglichkeiten, Infektionen zu behandeln und anfällige Patienten zu schützen, bedroht“, so Livermore abschließend. „Einige zentrale Fragen bleiben offen, etwa, warum manche Stämme so viel erfolgreicher bei der Akquisition und Verbreitung von Resistenzen sind als andere oder welche Art von Selektionsdruck wir auf Plasmide ausüben.“ Referenzen: 1 Kim SH et al, Antimicrob Agents Chemother 2008; 52(1): 192-197 2 W ilson J et al, Clin Microbiol Infect 2011; 17(3): 451-458 3 Hawser SP et al, Antimicrob Agents Chemother 2009; 53(8): 3280-3284 4 Woodford N et al, Antimicrob Agents Chemother 2009; 53(10): 4472-4482 5 Schwaber MJ und Carmeli Y, J Antimicrob Chemother 2007; 60(5): 913-920 Quelle: Eröffnungsvortrag „Evolution and consequences of bacterial resistance – biological consequences, clinical implications, beliefs and myths“ … Gonokokken Prof. Dr. David Livermore, London 18. April 2012, Saalfelden Auch Gonokokken sind ein Beispiel für eine Spezies, die man ursprünglich für leicht behandelbar hielt. Über die Jahrzehnte entwickelten sie jedoch Resistenzen gegen Sulfonamide, Penicilline, n Bericht: Dr. Norbert Hasenöhrl inf120226 27 I JATROS Infektiologie 2 I 2012 Fortschritte in der Mikrobiologie Neue erregerspezifische Diagnostik Multiplex-PCR und Massenspektrometrie bedeuten erhebliche Fortschritte in der mikrobiologischen Diagnostik, nicht zuletzt wegen des Zeitgewinns. Die Interpretation der Befunde bleibt in Zusammenschau mit der Klinik des individuellen Patienten – insbesondere bei Immunsupprimierten – eine ärztliche Kunst. Die erregerspezifische Diagnostik und vor allem die Dauer der Zeit bis zum Vorliegen der Ergebnisse sind ein zentrales Thema in der heutigen klinischen Mikrobiologie und Infektiologie. Multiplex-PCR und ihre Anwendung „Die Frage ist, ob die derzeit zur Verfügung stehenden Techniken der Multiplex-PCR die jetzt noch vorhandene Latenzzeit bis zur Fertigstellung einer Erregerdiagnostik entscheidend verkürzen können“, leitete Univ.-Prof. Dr. Andrea Grisold, Institut für Hygiene, Mikrobiologie und Umweltmedizin, Medizinische Universität Graz, ihr Referat ein. Die PCR (Polymerase Chain Reaction) ist ein Vervielfältigungsverfahren von Nukleinsäuresequenzen, mit dessen Einsatz eine Identifizierung des vorhandenen genetischen Materials möglich wird. Anwendungsgebiet ist in erster Linie der Erregernachweis, sowohl in der Bakteriologie/Mykologie als auch in der Virologie. Nachgewiesen werden können z.B. aber auch verschiedene Resistenzgene, was für eine evtl. notwendige Therapie eine große Rolle spielen kann. Von den verschiedenen zur Verfügung stehenden PCR-Verfahren kommen in der Infektiologie vor allem die Real-Time- oder quantitative PCR und in letzter Zeit vermehrt auch die sogenannte Multiplex-PCR zum Einsatz. I 28 Bei der Multiplex-PCR werden gleichzeitig mehrere/multiple Primer eingesetzt, was z.B. in automatisierten Systemen innerhalb eines Arbeitsablaufs zeitnah zum Nachweis oder auch Ausschluss mehrerer Erreger verwendet werden kann. „Ein solches automatisiertes Multiplex-PCRSystem ist der SeptiFast®, mit dem innerhalb von sechs Stunden 25 der wichtigsten bei nosokomialen Bakteriämien bzw. Fungämien vorkommenden Erreger nachgewiesen werden können. Dieses System ist in verschiedenen Zentren in Österreich bereits gut etabliert“, erklärte die Infektiologin. „Die bisherigen Studienergebnisse sind durchaus vielversprechend, dennoch kann bzw. sollte dieser Test sicher nicht die Blutkultur als Goldstandard bei der Sepsisdiagnostik ersetzen“, setzte Grisold fort. Von Vorteil ist bei diesem Verfahren der Zeitgewinn – auf der anderen Seite darf nicht vergessen werden, dass naturgemäß nicht alle Erreger erfasst werden können bzw. durch das Verfahren der PCR auch DNA von evtl. nicht mehr kultivierbaren Bakterien nachgewiesen wird.1 „Aus heutiger Sicht ist die MultiplexPCR als Ergänzung der mikrobiologischen Diagnostik zu sehen, die jedoch ebenso wie andere diagnostische Resultate der ärztlichen Interpretation in Zusammenschau mit der Klinik bedarf“, schränkte Grisold ein. So kann z.B. die Konstellation „PCR positiv – Blutkul- tur negativ“ einerseits auf einer Kontamination beruhen, andererseits aber auch bedeuten, dass tatsächlich eine Bakteriämie oder Fungämie vorliegt, die nur in der Blutkultur nicht nachweisbar war. Offene Fragen betreffen – neben der Unterscheidung zwischen Kontamination und Infektion – die Verfügbarkeit des Tests außerhalb der Betriebszeiten des Labors und die Kosteneffektivität. „Die Zukunft wird vielleicht einerseits den Schritt in Richtung Genomsequenzierung mittels PCR-Verfahren bringen, andererseits aber auch Systeme, in denen PCR und Massenspektrometrie gekoppelt werden“, so Grisold. Massenspektrometrische Methoden Eines der derzeit in der Mikrobiologie verwendeten massenspektrometrischen Verfahren ist MALDI-TOF. Die Abkürzung steht für „Matrix-Assisted Laser Desorption Ionisation – Time Of Flight mass spectrometry“, zu Deutsch also „Matrix-unterstützte Laser-Desorption/Ionisation mit Massenspektrometrie sowie Flugzeitanalyse“. „Es handelt sich hier um eine relativ junge Form der Massenspektrometrie, bei der die Proteinzusammensetzung des Erregers zu seiner Identifizierung verwendet wird“, erläuterte Prim. Univ.-Doz. Dr. Petra Apfalter, Institut für Hygiene, universimed.com Österreichische Gesellschaft für Infektionskrankheiten und Tropenmedizin Mikrobiologie und Tropenmedizin, Krankenhaus der Elisabethinen Linz. Bei diesem Verfahren werden ganze Zellen ohne vorherigen Extraktionsschritt analysiert. Das Verfahren beruht auf der Ionisierung der Erregerproteine mittels eines starken Laserstrahls. Die Proteine durchfliegen dann ein elektrisches Feld und landen – nach unterschiedlichen Flugzeiten – auf einem Detektor. So ergibt sich eine Art „molekularer Fingerabdruck“ des untersuchten Erregers. Dieses individuelle Proteinspektrum kann in der Folge durch die Software des Systems (Abb.) mit einer Bibliothek bekannter Spektren abgeglichen werden.2 „Derzeit sind in dieser Datenbank etwa 3.900 Spezieseinträge enthalten, die Zahl steigt aber ständig“, kommentierte Apfalter. Optimales Ausgangsmaterial für MALDI-TOF-Untersuchungen sind Reinkulturen.3–5 „An der Verwendung klinischer Proben wie Blut oder Harn6 für MALDI-TOF wird gearbeitet, sie ist aber aufgrund der im Vergleich zur Reinkultur deutlich niedrigeren Keimzahlen schwieriger“, erläuterte die Mikrobiologin. „Durch Anreicherungsschritte vor der Untersuchung kann die Sensitivität aber deutlich erhöht werden.“ Ein weiteres Problem, das eine Erregeridentifikation verhindern kann, sind bestimmte Zusätze, wie z.B. Kohle in manchen Blutkulturflaschen, da diese mit der Spektroskopie interagieren. „Eine weitere Entwicklung, die uns bevorsteht, ist ESI-TOF, das bedeutet die Auftrennung und massenspektroskopische Identifizierung nicht der Proteine, sondern der DNA oder RNA des Erregers“, so Apfalter. „Auf diese Weise könnte auch der direkte genetische Nachweis von Resistenzmechanismen möglich werden.“ „Was die Wirtschaftlichkeit angeht, so muss man sagen, dass die Kosten für die Anschaffung des Geräts hoch sind und es erst bei hohem Probenvolumen rentabel wird, da es viele Proben gleichzeitig verarbeiten kann. Andererseits gibt es kaum Materialkosten, und man kann damit bis zu 24 Stunden für die Erregeridentifikation gewinnen“, fasste die Mikrobiologin zusammen. universimed.com | 6. Österreichischer Infektionskongress Befundinterpretation bei Immunsuppression „Oftmals gibt es keine eindeutigen Kriterien für die Diagnose einer Infektion“, so Univ.-Prof. Dr. Heinz Burgmann, Klinische Abteilung für Infektionskrankheiten und Tropenmedizin, Universitätsklinik für Innere Medizin I, MUW. „Das ist nicht verwunderlich, gibt es doch nicht einmal eine einheitliche Definition für eines der klinischen Hauptsymptome: das Fieber“, ergänzte der Infektiologe. Zudem wird laut einer Studie zwar bei 90% der Patienten eine mikrobiologische Diagnostik durchgeführt, jedoch nur in 32% beeinflussten deren Ergebnisse auch die antimikrobielle Therapie.7 „Am Beispiel von Infektionen in der Hämatologie und Onkologie, also einer Patientengruppe, die sehr häufig immunsupprimiert ist, lassen sich einige typische Fehler festmachen“, so Burgmann. Darunter fallen z.B. die Bewertung kolonisierender Mikroorganismen der Mundhöhle und des Nasopharynx als Erreger pulmonaler Infiltrate, die Interpretation von Erregern als Surveillance-Kulturen als ätiologisch relevant, die Bewertung von Kontaminationskeimen in Blutkulturen als Bakteriämieerreger, die Herstellung falscher Zusammenhänge zwischen Keimnachweis und manifester Infektion und die Interpretation einer typischerweise durch eine Mischflora verursachten Infektion (v.a. abdominell und perianal) als monobakterielle Infektion aufgrund unzureichender Diagnostik.8 „Die Therapieindikation bei immunsupprimierten Patienten hängt von den Konsequenzen – also der Wahrscheinlichkeit einer Infektionskrankheit bei positivem Nachweis sogenannter Infektionsparameter und der Mortalität der Erkrankung – ab“, erläuterte Burgmann. „Häufig wird wegen schlechter Prognose der manifesten Erkrankung frühzeitig und ohne Nachweis einer Infektionskrankheit antimikrobiell therapiert“, hielt der Infektiologie fest. „Einzelmessungen von Biomarkern sind oftmals nicht sehr hilfreich. Sinnvoll ist die Zusammenschau von mikrobiologischen, bildgebenden und laborchemischen Tests mit Art und Grad der Immunsuppression sowie Art und Outcome der möglichen manifesten Infektion, um eine sinnvolle Therapieentscheidung zu treffen.“ Referenzen: 1 Josefson P et al, Eur J Clin Microbiol Infect Dis 2011; 30(9): 1127-1134 2 Seng P et al, Clin Infect Dis 2009; 49(4): 543-551 3 Kok J et al, PLoS One 2011; 6(8): e23285 4 Juiz PM et al, Eur J Clin Microbiol Infect Dis 2011; [Epub ahead of print] 5 Yan Y et al, J Clin Microbiol 2011; 49(7): 2528-2532 6 Ferreira L et al, J Clin Microbiol 2010; 48(6): 2110-2115 7 Maraha B et al, Clin Microbiol Infect 2000; 6(2): 99-102 8 Maschmeyer G und Sandherr M, Internist (Berl) 2009; 50(2): 187-199 n Quelle: „Neue erregerspezifische Diagnostik“, Symposium 7, 20. April 2012, Saalfelden Bericht: Dr. Norbert Hasenöhrl inf120228 Abb.: MALDI-TOF in der praktischen Anwendung. Quelle: Hartl, www.analyse.eu 29 I JATROS Infektiologie 2 I 2012 Gramnegative Erreger Resistenz und empirische Therapie Langfristig sollte die empirische Therapie durch raschere und bessere mikrobiologische Diagnostik weitgehend überflüssig werden, forderte Prof. Dr. David Livermore in einem weiteren spannenden Referat. „Bei kritisch an einer Infektion erkrankten Patienten hat man keine Zeit zu verlieren. Die empirische antimikrobielle Therapie muss sofort beginnen, weil mit jeder Stunde Verzögerung die Mortalität steigt“,1 so Prof. Dr. David Livermore, London. Eine inadäquate Antibiotikatherapie ist bei schweren nosokomialen Infektionen derjenige Einzelfaktor, der die Mortalität am stärksten erhöht.2 „Aber auch im niedergelassenen Bereich wird aus Zeit- und Kostengründen oft empirisch behandelt.“ Steigende Resistenzraten „Es ist logisch, dass mit steigenden Resistenzraten die Wahrscheinlichkeit für das Ansprechen auf eine empirische Therapie sinkt“, so Livermore. Für Bakteriämien wurde eine signifikante Assoziation zwischen der Zahl der Resistenzen einerseits und der Rate an inadäquaten Therapien sowie der Mortalität andererseits gezeigt.3 Metaanalysen bestätigen, dass das relative Letalitätsrisiko bei Bakteriämien durch ESBL-bildende Enterobakterien um 85% höher ist als durch Enterobakterien, die keine ESBL-Gene tragen.4 „In dieser Metaanalyse wurde auch klar gezeigt, dass der größte Einzelfaktor, der die Mortalität bei ESBL-Bakteriämien erhöht, die Verzögerung bis zum Beginn einer wirksamen Antibiotikatherapie ist“, betonte Livermore. Die kurzfristige … Das Risiko einer inadäquaten empirischen Therapie lässt sich mit einer initialen breiten Therapiestrategie mit anschließender I 30 Deeskalation am Tag 3, nach Eintreffen der mikrobiologischen Befunde, senken.5 „Das Problem ist nur, dass diese Deeskalation aus verschiedenen Gründen, die nicht nur mit Resistenz zu tun haben, oft nicht stattfindet.“ „Kurzfristig sollten wir zwei Dinge tun, um diesem Problem zu begegnen“, erklärte der Mikrobiologie, „einerseits die hygienischen Maßnahmen im Krankenhausbereich überprüfen und andererseits die Beurteilung des Resistenzrisikos verbessern, um die individuelle empirische Therapie zu optimieren.“ Resistente Bakterienstämme sind am wahrscheinlichsten bei hospitalisierten Patienten sowie bei Patienten mit vorangegangener Antibiotikatherapie oder vorangegangener Hospitalisierung. „Uns gehen die Breitspektrumantibiotika aus“, warnte Livermore. … und die langfristige Antwort „Zwar sind einige neue antibiotische Substanzen bzw. Kombinationen bereits in Phase III, aber keine dieser Therapien deckt die sich derzeit im gramnegativen Bereich entwickelnden Resistenzen umfassend ab. Daher glaube ich, dass die Lösung langfristig nur darin liegen kann, die empirische Therapie durch eine individuell gezielte Behandlung zu ersetzen. Das ist aber nur durch eine Beschleunigung der mikrobiologischen Befunderstellung möglich“, forderte Livermore. „Wir brauchen oft heute noch 48 Stunden von der Probenentnahme bis zum Vorliegen eines Antibiogramms, das ist nicht schneller als zu Flemings Zeiten! Wenn man Bakterienstämme und ihre Resistenzen mit genetischen Methoden direkt aus dem klinisch entnommenen Material identifizieren könnte, ohne eine Bakterienkultur anlegen zu müssen, würde sich die Wartezeit auf wenige Stunden beschränken. Und vielleicht wird es die technische Entwicklung in einigen Jahren erlauben, das gesamte Genom des Erregers rasch und mit vertretbaren Kosten zu sequenzieren“, so Livermore abschließend. „Das würde eine optimierte Therapie für den einzelnen Patienten und gleichzeitig eine bessere ,antibiotic stewardship‘ für die Allgemeinheit ermöglichen.“ Referenzen: 1 Kumar A et al, Crit Care Med 2006; 34(6): 15891596 2 Kollef MH et al, Crit Care Med 2000; 28(10): 34563464 3 Peralta G et al, J Antimicrob Chemother 2007; 60(4): 855-863 4 Schwaber MJ und Carmeli Y, J Antimicrob Chemother 2007; 60(5): 913-920 5 Soo Hoo GW et al, Chest 2005; 128(4): 2778-2787 Quelle: „Die Relevanz der Resistenz für die Selektion der empirischen Therapie bei Infektionen durch gramnegative Erreger“, Vortrag von Prof. Dr. David Livermore, London, im Rahmen des Symposiums 3 19. April 2012 Saalfelden n Bericht: Dr. Norbert Hasenöhrl inf120230 universimed.com Österreichische Gesellschaft für Infektionskrankheiten und Tropenmedizin | 6. Österreichischer Infektionskongress Von der Kontroverse zur Synthese Wie viel Therapie ist genug Therapie? Ein neues Sitzungsformat bereicherte den Infektionskongress 2012. Anstelle bloßer Pro-und-KontraSitzungen war die Synthese angesagt, mit anderen Worten: die Einigung der Kontrahenten auf vernünftige Kompromisse. 1. Ambulant erworbene Pneumonien 1.1 Maximal drei Tage „Wenn ich hier eine kurze antimikrobielle Therapie der Pneumonie argumentiere, so meine ich die ambulant erworbene Pneumonie, kurz CAP, durch Pneumokokken“, betonte Univ.-Prof. Dr. Florian Thalhammer, Klin. Abt. f. Infektionen u. Tropenmedizin, UK f. Innere Medizin I, MedUni Wien. Eine Studie zeigte, dass nach drei Tagen Amoxicillin i.v. ein Absetzen des Antibiotikums nicht schlechter ist als eine orale Weiterbehandlung für nochmals fünf Tage.1 Und eine Metaanalyse ergab keinen Nachteil einer kurzen gegenüber einer langen Behandlung bei leichten bis mittelschweren CAP-Fällen.2 „Eine weitere Möglichkeit ist die Single-Shot-Therapie mit 1,5g Azithromycin, langsam infundiert, was auch ambulant möglich ist“, fuhr Thalhammer fort. „Eine Dreitagestherapie sollte bei Kindern sowie bei Erwachsenen mit leichter bis mittelschwerer Pneumokokken-CAP ausreichen, sofern keine Komplikationen wie Pleuraerguss oder Empyem vorhanden sind. Die Vorteile: weniger Nebenwirkungen und bessere Compliance.“ 1.2 Mehr als drei Tage „Ich spreche hier über mittelschwer erkrankte, immunkompetente hospitalisierte Erwachsene mit bakterieller CAP, die nicht antibiotisch vorbehandelt sind, die aber sehr wohl ein gewisses Mortalitätsrisiko haben“, stellte OA Dr. Oskar Jauniversimed.com nata, Hygienebeauftragter, Donauspital, Wien, klar. „Bei Pneumonie erhebt sich die Frage, welchen Zielparameter man für die Behandlung heranziehen soll. Meiner Ansicht nach sollte es die Zeit bis zur klinischen Stabilisierung sein, und das dauert meist länger als drei Tage“, argumentierte Janata. Wie eine Studie mit 680 CAP-Patienten zeigte, hängt die Zeit bis zur klinischen Stabilisierung vom Schweregrad der Erkrankung und von der verwendeten Definition ab.3 „An der vom Vorredner zitierten Amoxicillinstudie1 ist zu kritisieren, dass dort eben jene Patienten ausgeschlossen wurden, die am dritten Tag noch ernsthaft krank waren“, bemerkte Janata. „Ich meine, dass unter bestimmten Voraussetzungen eine kürzere Therapiedauer möglich ist, aber nicht drei Tage, sondern eher fünf“, sagte Janata. „Dies gilt bei leichten bis mittelschweren Pneumonien durch Pneumokokken oder Mykoplasmen, nicht aber für S. aureus, K. pneumoniae oder Legionellen.“ 1.3 Synthese Bei klinisch stabilen Patienten, bei denen kein problematischer Erreger wie S. aureus oder Legionellen nachgewiesen ist, erscheint eine antimikrobielle Therapiedauer von ca. fünf Tagen sinnvoll. Gute Daten gibt es dazu für Chinolone der dritten und vierten Generation, Telithromycin und Ceftriaxon. Ob eine orale Therapie sinnvoll ist, hängt stark von der Pharmakokinetik des verwendeten Antibiotikums ab. 2. Haut- und Weichteilinfektionen 2.1 Zehn Tage i.v. „Bei Haut- und Weichteilinfektionen (HWTI) gibt es ein sehr breites klinisches Spektrum, wobei leichtere Formen oft gar keiner oder nur einer oralen antibiotischen Behandlung bedürfen“, erläuterte Dr. Rainer Gattringer, Institut für Hygiene, Mikrobiologie und Tropenmedizin, KH d. Elisabethinen, Linz. „Bei Erysipelen, Phlegmonen und nekrotisierenden Infektionen ist jedoch sehr wohl ein i.v. Antibiotikum erforderlich“, betonte Gattringer. Einer der häufigsten Erreger ist S. aureus, der laut einer Studie knapp 45% aller HWTI verursacht.4 „Große Fachgesellschaften wie die IDSA empfehlen je nach klinischem Bild eine Therapiedauer von 7–14 Tagen“, betonte Gattringer.5 Bei Patienten mit schwerer HWTI ist es wichtig, schnell hohe Gewebskonzentrationen am Zielort zu erreichen und über einen längeren Zeitraum zu gewährleisten, um Rezidive und das Entstehen von Resistenzen zu verhindern. Dabei ist die veränderte Pharmakokinetik von Betalaktamen bei Infektion zu bedenken.6 S. aureus verursacht zudem häufig Bakteriämien sowie Absiedelungen in anderen Organen (Herz, Knochenmark). „Patienten mit zu niedrigen Antibiotikadosierungen haben ein schlechteres Outcome bei S.-aureus-Bakteriämien. All das sind Argumente für zehn Tage i.v. Therapie“, so Gattringer abschließend.7 31 I JATROS Infektiologie 2 I 2012 2.2 Drei Tage p.o. „Ein 2008 durchgeführtes systematisches Review der vorhandenen Literatur zur Therapie von Erysipelen und Phlegmonen zeigte zum einen eine niedrige bis günstigstenfalls mäßige Studienqualität und zum anderen keinen klinisch bedeutsamen Unterschied bezüglich des Applikationswegs des Antibiotikums“, betonte Univ.-Prof. Dr. Stefan Winkler, Klin. Abt. f. Infektionen u. Tropenmedizin, UK f. Innere Medizin I, MedUni Wien.8 „Weiters ermöglicht eine orale Therapie ein ambulantes Management, verhindert nosokomiale Infektionen, wie z.B. Thrombophlebitiden, und ist außerdem viel billiger“, fuhr Winkler fort. Die meisten antibiotischen Substanzen, die man für HWTI verwendet, werden eher gut resorbiert. „Zwar gibt es zugegebenermaßen keine Studie, die eine orale Dreitagestherapie mit einer intravenösen Zehntagestherapie vergleicht“, gab Winkler zu. „Es gibt aber Daten bei Patienten mit Erysipelen bzw. Phlegmonen, die zeigen, dass fünf Tage Levofloxacin genauso gut sind wie zehn Tage.“9 „Das Dogma, dass man jedes Erysipel zehn Tage i.v. behandeln soll, ist jedenfalls anzuzweifeln“, schloss Winkler. 2.3 Synthese Es gibt keine wirkliche Evidenz für die ideale Therapiedauer. Bei schweren HWTI ist allerdings ein i.v. Beginn der Therapie mit hohen Antibiotikadosen wichtig, dabei sind Erregerspektrum und Pharmakokinetik der verwendeten Substanzen zu beachten. Häufig ist auch eine schnelle chirurgische Intervention erforderlich. Bei gutem klinischem Ansprechen ist ein Umstieg auf orale Therapie nach drei bis vier Tagen sinnvoll, wobei die orale Bioverfügbarkeit des Antibiotikums sowie die mikrobiologischen Befunde zu berücksichtigen sind. 3. Zystitis 3.1 Maximal drei Tage „Die am häufigsten von Harnwegsinfekten (HWI) betroffene Gruppe sind junge Frauen“, berichtete OÄ Dr. Agnes Wechsler-Fördös, hygienebeauftragte Ärztin, KH Rudolfstiftung, Wien. „Wir sprechen hier von einer Krankheit ohne nennenswerte Letalität, aber mit einer gewissen, nicht unbeträchtlichen Morbidität.“ Mittels Antibiotikatherapie sind sowohl klinisch als auch mikrobiologisch signifiI 32 kant höhere Heilungsraten zu erzielen als ohne Antibiotika, allerdings auch mit signifikant mehr Nebenwirkungen.10, 11 Bei Unterlassen einer antibiotischen Therapie der Zystitis kommt es nicht zu einer erhöhten Inzidenz von Pyelonephritiden.11 Deshalb argumentiert die Deutsche Gesellschaft für Allgemein- und Familienmedizin, dass eine rein symptomatische, nicht antibiotische Therapie der akuten unkomplizierten Zystitis eine vertretbare Alternative zur sofortigen Antibiotikagabe darstellt.12 „Die meisten für die unkomplizierte Zystitis für Frauen empfohlenen Antibiotika wie Fosfomycin, Pivmecillinam, Chinolone 3/4, Cefpodoxim und Cotrimoxazol müssen nicht länger als drei Tage gegeben werden“, so Wechsler-Fördös. „Da das Risiko für eine Antibiotika-assoziierte Diarrhö mit der Therapiedauer zunimmt, ist eine kurze Therapie ein wesentlicher Beitrag zur Vermeidung von unerwünschten Wirkungen im Sinne von Antibiotic Stewardship.13 Und asymptomatische Bakteriurien sollten überhaupt nicht behandelt werden, außer bei Risikogruppen.“ 3.2 Mehr als drei Tage „Es gibt Daten, die zeigen, dass nach einer HWI-Therapie mit Single-Shot 22% der Patientinnen weiter Beschwerden haben, nach einer Dreitagestherapie 18% und nach einer Fünftagestherapie 13%“, so Thalhammer.14 Eine Single-Shot-Therapie mit Fosfomycin-Trometamol weist im Vergleich mit Norfloxacin eine signifikant höhere Inzidenz von Nebenwirkungen auf,15, 16 im Vergleich mit Ofloxacin eine signifikant niedrigere Eradikationsrate17 und im Vergleich mit einer Mehrtagestherapie mit Cotrimoxazol oder Ciprofloxacin eine geringere Effektivität; zudem hat Fosfomycin nur eine orale Bioverfügbarkeit von 40%.14, 18 „Aus pharmakokinetischer Sicht wäre es besser, zwei Dosen FosfomycinTrometamol im Abstand von 72 Stunden zu geben“, ergänzte Thalhammer. Außerdem ist Fosfomycin-Trometamol unterhalb einer GFR von 80ml/min kontraindiziert und wirkt nur gegen E. coli.12 Nitrofurantoin ist als Dreitagestherapie nur gegen Placebo untersucht, wirkt bei längerer Therapiedauer (5–7d) besser19, 20 und ist bei Niereninsuffizienz ebenfalls kontraindiziert. Amoxicillin/Clavulansäure ist nicht erste Wahl für eine empirische Dreitagestherapie, für Cefuroxim fehlen hier die Daten, und sowohl Cefpodoxim als auch Fluorchinolone sollten wegen des Einsatzes in anderen Indikationen beim HWI nicht primär verwendet werden. Auch Pivmecillinam und Trimethoprim wirken über fünf bzw. sieben Tage besser als über drei Tage. „Eine ganz rezent im New England Journal publizierte Arbeit weist ebenfalls auf die Unterlegenheit von Kurzzeittherapien bei HWI hin“, so Thalhammer abschließend.21 3.3 Synthese Bei jungen Frauen mit unkomplizierter Zystitis und ohne relevante Begleiterkrankungen oder Risikofaktoren ist eine antibiotische Dreitagestherapie vertretbar und im Hinblick auf Vermeidung von unnötigem Selektionsdruck auch wünschenswert. Referenzen: 1 El Moussaoui R et al, BMJ 2006; 332(7554): 1355 2 Dimopoulos G et al, Drugs 2008; 68(13): 1841-1854 3 Halm EA et al, JAMA 1998; 279(18): 1452-1457 4 Fry DE und Barie PS, Surg Infect (Larchmt) 2011; 12(3): 191-203 5 Stevens DL et al, Clin Infect Dis 2005; 41(10): 13731406 6 Sauermann R et al, Antimicrob Agents Chemother 2005; 49(2): 650-655 7 Jensen AG et al, Arch Intern Med 2002; 162(1): 25-32 8 Morris AD, Clin Evid (Online) 2008:1708 9 Hepburn MJ et al, Arch Intern Med 2004; 164(15): 1669-1674 10 Christiaens TC et al, Br J Gen Pract 2002; 52(482): 729-734 11 Falagas ME et al, J Infect 2009; 58(2): 91-102 12 Naber KG et al, http://www.awmf.org/leitlinien.html 13 Pepin J et al, Clin Infect Dis 2005; 41(9): 1254-1260 14 Norrby SR, Rev Infect Dis 1990; 12(3): 458-467 15 Boerema JB und Willems FT, Infection 1990; 18(Suppl 2): S80-88 16 de Jong Z et al, Urol Int 1991; 46(4): 344-348 17 Naber KG und Thyroff-Friesinger U, Infection 1990; 18(Suppl 2): S70-76 18 Warren JW et al, Clin Infect Dis 1999; 29(4): 745-758 19 Goettsch WG et al, Br J Clin Pharmacol 2004; 58(2): 184-189 20 Spencer RC et al, J Antimicrob Chemother 1994; 33(Suppl A): 121-129 21 Hooton TM, N Engl J Med 2012; 366(11): 1028-1037 n Quelle: „Synthese 1 – Therapiedauer bei Pneumonien, Haut- und Weichteilinfektionen sowie Zystitis“ 19. April 2012 Saalfelden Bericht: Dr. Norbert Hasenöhrl inf120231 universimed.com Österreichische Gesellschaft für Infektionskrankheiten und Tropenmedizin | 6. Österreichischer Infektionskongress Launch-Symposium Pneumokokken-Konjugatimpfstoff für Erwachsene ab 50 Jahren Pneumokokken gehören nicht nur zu den häufigsten bakeriellen Erregern lokalisierter Infektionen wie Otitis media, Sinusitis oder Pneumonie, sondern verursachen oft auch schwere, invasive Erkrankungen wie Meningitis, Bakteriämie oder Sepsis. Mit Prevenar 13® steht nun auch für Erwachsene ab 50 Jahren erstmals ein Konjugatimpfstoff gegen invasive Pneumokokkenerkrankungen zur Verfügung. „Wir haben nun erstmals aktuelle Daten zur Pneumonie aus einer österreichischen Studie zu Verfügung“, berichtete Prim. Univ.-Doz. Dr. Christoph Wenisch, 4. Med. Abteilung, KFJ-Spital, Wien. Die von Pfizer unterstützte APANET-Studie* war eine prospektive, multizentrische, epidemiologische Untersuchung, die zwischen 1. Jänner und 31. Dezember 2011 an neun österreichischen Zentren durchgeführt wurde und insbesondere die möglichen Mortalitäts-Risikofaktoren wie Alter, Wohnsituation, Fähigkeit zur Selbstversorgung, Komorbiditäten und Pneumonieerreger evaluierte. In die Studie wurden alle hospitalisierten Patienten aufgenommen, die ein pneumonisches Infiltrat im Röntgen zeigen und zumindest ein klinisches Symptom einer unteren Atemwegsinfektion aufwiesen (wie z.B. Fieber, Husten, purulentes Sputum, Dyspnoe oder pleuritschen Schmerz). Patienten, bei denen eine infektiöse Genese ausgeschlossen werden konnte, wurden nicht in die Studie aufgenommen. „Auf die Therapie hatten wir keinen Einfluss, es handelte sich um eine reine Beobachtungsstudie“, stellte Wenisch universimed.com 12 200 Invasive Erkrankung Todesfälle 10 © UNIVERSIMED ® Inzidenz und Mortalität von IPD Die Mortalität in die150 8 ser Kohorte betrug insgesamt 10,3% und 6 100 wurde von einigen 4 Faktoren signifikant 50 2 beeinflusst. So starben in der Altersgruppe 0 0 <2 2–5 6–17 18–34 35–49 50–64 ≥65 unter 65 Jahren 5%, Alter (Jahre) bei den Über-65-Jährigen jedoch 12,7%. Abb.: Inzidenz v. IPD und verbundene Todesfälle im Jahr 1997 nach Auch steigende Pfle- einer bevölkerungsbezogenen Beobachtungsstudie, durchgeführt v. gebedürftigkeit und den Centers for Disease Control and Prevention. Quelle: Butler JC, Schuchat A, Drugs Aging 1999; 15 (Suppl) 1:11-9 eine höhere Punktezahl im CRB65-Score steigerten die Mortalität signifikant. Das alternde Immunsystem 14,5% der Patienten entwickelten eine Sepsis, 6,7% eine schwere Sepsis und 2% „Die als Immunoseneszenz bezeichnete Alteerlitten einen septischen Schock. rung des Immunsystems betrifft sowohl die angeborene als auch die adaptive ImmuEin Erregernachweis gelang bei 24,9% der nantwort und führt zu erhöhter Anfälligkeit Patienten, bei 45,2% gelang er nicht, und gegenüber Infektionen“, erläuterte Dr. Carbei 29,9% wurde er nicht versucht. men Giefing-Kröll, Institut für BiomediziBei den 487 Patienten, bei denen ein Er- nische Alternsforschung, Österr. Akademie reger gefunden wurde, standen Pneumo- d. Wissenschaften, Innsbruck. kokken an erster Stelle, gefolgt von Enterobakterien. Im Alter führen Funktionsdefizite von Ma„Aufgrund der Daten aus dem AGES-Jah- krophagen, Neutrophilen, dendritischen resbericht 2010 können wir sagen, dass Zellen und natürlichen Killerzellen zu ver71% der invasiven Pneumokokken-Erkran- minderter Pathogenelimination und Antikungen bei über 60-Jährigen durch vorhe- genpräsentation. Die Reduktion von naiven rige Impfung mit dem 13-valenten Impf- B-Zellen schränkt die Reaktionsmöglichstoff hätten abgedeckt werden können“, keiten auf neue Antigene ein. Das Alter ist sagte Wenisch. einer der Hauptrisikofaktoren für invasive Todesfälle pro 100.000 Österreichische Pneumoniedaten klar. Insgesamt wurden Daten von 1.957 Patienten ausgewertet. Invasive Erkrankung (Fälle pro 100.000) Schon bisher war Prevenar 13® zur Prävention invasiver Pneumokokkenerkrankungen, Otitis media und Pneumonie für Säuglinge und Kinder zwischen 6 Wochen und 5 Jahren zugelassen. Nun können auch Erwachsene ab 50 Jahren gegen invasive Pneumokokken-Erkrankungen (IPD) mit dem 13valenten Konjugatimpfstoff geimpft werden. 33 I Infektiologie 2 I 2012 Impfen, aber richtig „Allgemein ist zu sagen, dass es eine Reihe von vermeintlichen Kontraindikationen gegen Impfungen gibt, die in Wahrheit keine sind“, erklärte Dr. Rainer Gattringer, Institut für Hygiene, Mikrobiologie und Tropenmedizin, KH d. Elisabethinen, Linz. Diese vermeintlichen KIs sind im österreichischen Impfplan 2012 aufgelistet, und es gehören dazu u.a. leichte Erkrankungen mit subfebrilen Temperaturen (bis 38° C), chronische Erkrankungen von Herz, Leber, Lunge oder Nieren sowie eine Therapie mit Antibiotika oder mit niedrig dosierten Kortikosteroiden. „Seit Anfang 2012 wird im aktuellen österreichischen Impfplan eine einmalige Pneumokokkenimpfung mit einem konjugierten Impfstoff für alle Erwachsenen ab 50 empfohlen – Prevenar 13® ist der einzige dafür zugelassene Impfstoff. „Bei bestehender Vorimmunisierung mit dem Polysaccharidimpfstoff sollte eine gewünschte Nachimpfung mit dem konjugierten Impfstoff erfolgen. Nach derzeitigem Stand ist danach keine Auffrischung mehr erforderlich“, erklärte Gattringer. I 34 „Neben der guten Verträglichkeit weist der Konjugat-Impfstoff einige wichtige Vorteile gegenüber einem konventionellen Polysaccharid-Impfstoff auf. Im Besonderen ist das die Ausbildung eines immunologischen Gedächtnisses“, so Gattringer. rate bei Kindern schützt auch ältere Generationen. Hier ist eine aktive epidemiologische Surveillance weiterhin erforderlich, nicht zuletzt, um zu erkennen, ob es durch die Impfung zu einer Serotypenverschiebung kommt oder nicht“, so Gattringer. Da es sich bei den Pneumokokkenimpfstoffen um Totimpfstoffe handelt, ist die Verabreichung grundsätzlich auch bei immunsuppressiven Patienten möglich. „Es besteht allerdings die Möglichkeit, dass bei Immunsuppression die Impfung schlechter angeht“, erläutert Gattringer. Literatur beim Verfasser *Vollpublikation in Vorbereitung Quelle: Symposium 6 Launch Prevenar13® adult – „Prävention von Pneumokokkenerkrankungen“ 20. April 2012, Saalfelden l „Konjugat-Impfstoffe wirken sich günstig auf die Bakterien-Ansiedlung im Nasen-Rachen-Raum aus. Eine hohe Durchimpfungs- Bericht: Dr. Norbert Hasenöhrl inf120233 Prevenar 13® Der erste und einzige Pneumokokken-Konjugatimpfstoff für Erwachsene ab 50 Jahren zur aktiven Immunisierung zur Prävention von invasiven Pneumokokken-Erkrankungen (IPD), die durch Streptococcus pneumoniae verursacht werden.1 Zugelassen auch für Kinder im Alter von 6 Wochen bis 5 Jahren, zur aktiven Immunisierung zur Prävention von invasiven Erkrankungen, Pneumonie und akuter Otitis media, die durch Streptococcus pneumoniae verursacht werden.1 Invasive Pneumokokken-Erkrankungen gehen mit hoher Mortalität und Morbidität einher.2 Das Risiko für eine IPD erhöht sich mit dem Alter, beginnend ab 50 Jahren.1 Die 13 in Prevenar 13® enthaltenen Pneumokokken-Serotypen (1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F und 23F) sind für den Großteil der IPD bei Erwachsenen ab 60 in Österreich verantwortlich.3 einer verbesserten Immunantwort und zur Ausbildung eines „immunologischen Gedächtnisses“.4 Prevenar 13® verfügt über Sicherheitsdaten von mehr als 6.000 Erwachsenen mit 50 Jahren und darüber. Weltweit wurden mehr als 435 Millionen Dosen PCV7/Prevenar 13® an Kindern verimpft. Prevenar 13® wird bei Erwachsenen ab 50 als Einzeldosis verabreicht und kann ganzjährig angewendet werden. Referenzen: 1 2 Prevenar 13 Fachinformation, Stand Okt. 2011 CDC Active Bacterial Core Surveillance (ABCs) Report, Emerging Infectious Program Network, Streptococcus pneumoniae 2009 3 Jahresbericht 2010, Nationale Referenzzentrale für 4 Volz S et al, Monatschr. Kinderheilk. 2001; 149: Pneumokokken in Österreich Prevenar 13® basiert auf der KonjugatTechnologie, die nachweislich zu einer hohen Antikörperantwort führt. Bei konjugierten Impfstoffen sind die verschiedenen Kapselpolysaccharide jeweils an Trägerproteine gebunden. Anders als Polysaccharid-Impfstoffe induzieren Konjugat-Impfstoffe sowohl eine B- als auch eine T-Zell-Antwort und führen damit zu 394-409 Fachinformation zu Inserat siehe Seite 39 Pneumokokkenerkrankungen. Zum einen sind Kinder unter 5 Jahren und zum anderen Erwachsene ab 50 Jahren gefährdet. Während aber, relativ zur Inzidenz, die Mortalität bei Kleinkindern relativ niedrig ist, steigt sie etwa ab der sechsten Lebensdekade steil an (Abb.). So beträgt etwa die Letalität von Pneumokokken-Bakteriämien für alle Altersgruppen um die 20%. „Was Pneumokokkenimpfungen angeht, muss man auch aus immunologischer Sicht zwischen Polysaccharid- und Konjugatimpfstoffen unterscheiden“, so Giefing-Kröll. „Reine Polysaccharidimpfstoffe aktivieren zwar B-Zellen, erzeugen aber kein Immungedächtnis“, betonte die Immunologin. Koppelt man hingegen das PneumokokkenPolysaccharid an ein hochimmunogenes Trägerprotein, so kommt es durch die zusätzliche Rekrutierung von Helfer-T-Zellen zur Bildung von IgG-Antikörpern sowie Gedächtnis-B-Zellen und damit zum Entstehen eines Immungedächtnisses. „Dies ist gerade für ältere Menschen wichtig, da die durch Konjugatimpfstoffe verbesserte Immunantwort mit Bildung funktionaler Antikörper wenigstens zum Teil die Auswirkungen der Immunseneszenz ausgleichen könnte“, schloss Giefing-Kröll. Weitere Informationen: Pfizer Corporation Austria GmbH. Floridsdorfer Hauptstraße 1, Postfach 439, 1210 Wien Telefon: 01/5 21 15 0 E-Mail: [email protected] Internet: www.pfizer.at universimed.com PRE-035-12/1/21.05.2012 JATROS Österreichische Gesellschaft für Infektionskrankheiten und Tropenmedizin | 6. Österreichischer Infektionskongress Virushepatitiden Therapie der Hepatitis C H. Laferl, Wien Mit den neuen Tripeltherapien sind die SVR-Raten bei Genotyp 1 gestiegen, aber viele Probleme bleiben ungelöst. Neue Medikamente sind in Entwicklung, insbesondere die Interferon-freie Behandlung verspricht für die Zukunft Heilungsraten von über 90% nach nur zwölf Wochen. „170 Millionen Menschen sind weltweit an chronischer Hepatitis C erkrankt, etwa 280.000 Menschen sterben pro Jahr daran, und die HCV-Infektion ist auch der Hauptgrund für Lebertransplantationen in Europa und den USA“, berichtete OA Dr. Hermann Laferl, 4. Medizinische Abteilung, Kaiser-Franz-Josef-Spital, Wien. „Das wichtigste Therapieziel ist die Prävention der Leberzirrhose und damit auch des hepatozellulären Karzinoms“, ergänzte Laferl. Bisheriger Therapiestandard Bis vor Kurzem bestand die Standardtherapie der chronischen Hepatitis C in der Kombination von pegyliertem Interferon alpha und Ribavirin (P/R). Die Therapiedauer war abhängig vom HCV-Genotyp (GT) und vom Ansprechen. Während die Erfolgsaussichten bei GT 2 und 3 bei 80–90% lagen, betrugen sie bei GT 1 (der in Österreich am häufigsten vorkommt) und GT 4 lediglich 40–50%. Unter Therapieerfolg versteht man eine Sustained Virological Response (SVR), d.h. die Nichtnachweisbarkeit von HCVRNA im Blut sechs Monate nach Therapieende. Insgesamt traten unter P/R-Therapie 30–40% Rezidive auf, ca. 6% der Patienten waren primäre Non-Responder. Tripeltherapie Inzwischen sind die ersten Direct Acting Antivirals (DAA) auf den Markt gekomuniversimed.com men. Es handelt sich um die beiden NS3Proteaseinhibitoren Telaprevir und Boceprevir, die allerdings nur bei GT 1 gegeben werden können. Sie können die bisherige Standardtherapie nicht ersetzen, weil bei Gabe als Monotherapie relativ schnell Resistenzen auftreten. In Dreierkombination mit P/R hingegen steigern sie die SVR-Raten sowohl bei nicht vorbehandelten Patienten als auch bei Relapsern und vormaligen Non-Respondern. „Dabei sind bei nicht vorbehandelten Patienten und bei früheren Relapsern Ansprechraten von 70 bis 80% erreichbar, bei früheren Non-Respondern 30 bis 40%“, so Laferl. Zudem scheint bei Patienten, die früh (in Behandlungswoche 4) und dauerhaft (bis Behandlungswoche 12) ansprechen, eine Verringerung der Therapiedauer auf 24 Wochen möglich zu sein. Man spricht hier von „response-guided therapy“. Allerdings gibt es bei diesem Therapieschema auch Probleme. Patienten mit Leberzirrhose und solche nach Lebertransplantation sprechen schlechter auf die Tripeltherapie an und vertragen sie auch schlechter; zudem steht sie nur für Genotyp 1 zur Verfügung. geheilt werden können“, so Laferl kritisch. „Außerdem haben wir weiterhin keine Therapieoption für Patienten mit Kontraindikation gegen P/R.“ IFN-freie Schemata „Wir sind aber sicher erst am Anfang einer spannenden Entwicklung“, fuhr der Infektiologe fort. „Einerseits ist eine ganze Reihe von weiteren DAA mit unterschiedlichen Studienresultaten in Entwicklung und zum Teil schon in Phase III. Eine besonders spannende Sache dürfte die Interferon-freie Therapie werden. Hier gibt es Daten über SVR-Raten von an die 100% bei GT 1b und auch sehr gutes Ansprechen bei GT 2/3. Fraglich ist noch die Rolle des IL28B-Polymorphismus, der ja für das Ansprechen auf P/R und zum Teil auch auf die Tripeltherapie bedeutsam ist. Auf Ribavirin wird man bis auf Weiteres nicht verzichten können, aber die IFNfreie Therapie verspricht zumindest kürzer zu werden als bisherige Schemata – wahrscheinlich nur zwölf Wochen“, so Laferl abschließend. Quelle: „Hepatitis C“, Vortrag von OA Dr. Hermann Laferl, KFJ-Spital, Wien, „Man muss also realistischerweise sagen, dass auch mit diesen Dreierkombinationen immerhin 25 bis 30% der therapienaiven Patienten, 10 bis 25% der vormaligen Relapser, 50% der vormaligen TeilResponder, 70% der vormaligen NullResponder und sogar 86% der vormaligen Null-Responder mit Zirrhose nicht im Rahmen des Symposium 9, 21. April 2012, Saalfelden n Bericht: Dr. Norbert Hasenöhrl inf120235 35 I JATROS Infektiologie 2 I 2012 Best Papers Infektiologische Forschung in Österreich Auch heuer wurden wieder zahlreiche Abstracts und Poster für den Infektionskongress eingereicht. Die fünf besten Arbeiten konnten in einer eigenen Sitzung von den Erstautoren vorgestellt werden. „Was wurde aus den Abstracts?“ Mit dieser Frage leitete ÖGIT-Präsident Univ.Prof. Dr. Günter Weiss, Klinische Infektiologie und Immunologie, Universitätsklinik für Innere Medizin I, Innsbruck, eine Sitzung ein, die ganz der infektiologischen Forschung in Österreich gewidmet war. Von den am ÖIK 2010 präsentierten Abstracts wurde die Beschreibung von zwei Tetanusinfektionen bei sehr alten Patienten im „Journal of the American Geriatrics Society“ publiziert,1 eine Studie zur Rolle des Panton-Valentin-Leukozidins (PVL), eines MRSA-Toxins, bei der Entstehung nekrotisierender Pneumonien im „Journal of Immunology“,2 eine Arbeit über die inhibierende Wirkung von Nifedipin auf das intrazelluläre Wachstum von Salmonella typhimurium im „Journal of Infectious Diseases“,3 eine Studie über die Entstehung Rifampicin-resistenter Staphylokokken auf der Haut nach Einnahme von Rifaximin im „Journal of Infection“4 und eine tierexperimentelle Arbeit über die Wirkung von Daptomycin und Fosfomycin bei MRSAOsteomyelitis im AAC.5 Vom ÖIK 2011 wurde eine Studie über die differenziellen immunmodulatorischen Wirkungen von Erythropoetin in „Immunity“ veröffentlicht,6 eine Arbeit über die Immunogenität der Impfung gegen die pandemische H1N1-Influenza bei Transplantatempfängern in „Vaccine“,7 eine ähnliche Arbeit über Grippeimpfung bei HIV-Patienten in „PLoS One“8 und eine Studie zu Sonikationskulturen von I 36 Explantaten bei Protheseninfektionen im „Journal of Orthopaedic Research“.9 Nach dieser Einleitung präsentierten junge österreichische Forscherinnen und Forscher fünf Studien, die unter den 68 für den ÖIK 2012 eingereichten Arbeiten (46 Studien und 22 Fälle) von einer Jury als die interessantesten ausgewählt worden waren (die Reihenfolge stellt keine Wertung dar). Voriconazolspiegel messen „Ich möchte zeigen, warum es wichtig ist, bei Patienten, die Voriconazol erhalten, Blutspiegel zu messen“, so Dr. Martin Hönigl, Univ.-Klin. für Innere Medizin, Medizinische Universität Graz. Die Datenlage zeigt, dass die Plasmakonzentrationen von Voriconazol sowohl nach i.v. als auch nach p.o. Verabreichung stark variieren und dass zu niedrige Plasmaspiegel bei etwa 70% nach oraler und bei 30% nach i.v. Gabe zu erwarten sind. „Ein therapeutisches Drug-Monitoring ist bei Voriconazol essenziell, da Plasmakonzentrationen unter 1–1,5µg/ml mit Therapieversagen und schlechterem Outcome bei invasiver Aspergillose assoziiert sind, Spiegel über 5,5µg/ml hingegen mit erhöhter Toxizität wie Enzephalopathie und Transaminasenanstieg“, führte Hönigl aus. Deshalb wurden bei zwölf Patienten insgesamt 55 Voriconazol-Talspiegel gemessen; der Zielbereich lag bei 1,5–5,5µg/ ml. Der mediane Spiegel lag bei 1,3µg/ ml, also unterhalb des Zielbereichs. Bei neun Patienten fanden sich zumindest bei einigen Messungen insuffiziente Voriconazol-Spiegel, insgesamt betraf das 55% aller Messungen. Bei drei Patienten wurden toxische Spiegel gemessen. „Durch Dosiseskalation können jedoch bei manchen Patienten suffiziente Spiegel erreicht werden“, betonte Hönigl. Clostridium difficile oral behandeln Eine bereits publizierte prospektive observationelle Studie mit der Erstautorin Dr. Judith M. Wenisch, die von Prim. Univ.-Doz. Dr. Christoph Wenisch vorgestellt wurde, befasste sich mit dem Outcome von Clostridium-difficile-Infektionen (CDI) in drei verschiedenen Behandlungsregimen.10 Es wurden 265 Patienten mit leichter CDI in die Studie aufgenommen, die im Wiener KFJ-Spital durchgeführt wurde. Die verglichenen Regime waren: Metronidazol p.o. (3x 500mg/d), Metronidazol i.v. (3x 500mg/d) und Vancomycin p.o. (4x 250mg/d), jeweils für zehn Tage. „Die Wahl des Therapieregimes lag beim behandelnden Arzt“, betonte Wenisch. Die primären Endpunkte waren einerseits die 30-Tages-Mortalität, andererseits die vollständige Erholung zu Tag 30. Sekundäre Endpunkte waren schwere, nicht tödliche CDI-Verläufe sowie eine Reihe von Komplikationen. Insgesamt verstarben 56 Patienten im Krankenhaus, 209 wurden entlassen. universimed.com Österreichische Gesellschaft für Infektionskrankheiten und Tropenmedizin Männliches Geschlecht vor allem aber Komorbiditäten, waren signifikante Mortalitätsprädiktoren. Im Vergleich der Therapieregime zeigte sich unter Metronidazol i.v. mit 38,1% eine signifikant höhere Letalitätsrate als unter den beiden oralen Regimen (Metronidazol 7,4%, Vancomycin 9,5%, kein signifikanter Unterschied). Die Gründe für diese Unterschiede liegen vermutlich in der Inhibition des eigenen Metabolismus von Metronidazol durch intestinale Monooxygenasen und die exzessive Glukuronidierung mit enterohepatischer Zirkulation bei oraler Aufnahme von Metronidazol. S.-aureus-Bakteriämie: infektiologisch intervenieren Der Einfluss einer routinemäßigen infektiologischen Intervention (II) auf die Einhaltung von Managementleitlinien und die Letalität von Patienten mit S.-aureusBakteriämie (SAB) war das Thema einer von Dr. Ruzica-Rosalia Luketina, Univ.Klin. für Innere Medizin, Medizinische Universität Graz, präsentierten Studie. „Dazu wurden Datensätze von 138 SABPatienten aus einem Zeitraum von 30 Monaten vor und nach der Einführung einer routinemäßigen infektiologischen Intervention analysiert“, erläuterte Luketina. Von 129 evaluierbaren Patienten wurde bei 90 (70%) eine routinemäßige infektiologische Intervention durchgeführt. Diese führte zur signifikant häufigeren Einhaltung folgender Maßnahmen: Entfernung intravaskulärer Fremdkörper, Abnahme von Folgeblutkulturen, Verwendung parenteraler Staphylokokken-Betalaktame bei MSSA, adäquate Therapiedauer (mindestens 7 Tage i.v. bei unkomplizierter und mindestens 14 Tage i.v. bei komplizierter Bakteriämie) und Durchführung einer Echokardiografie. Die Anzahl der eingehaltenen Standards war signifikant höher und die Sterblichkeit der Patienten mit II war signifikant niedriger als ohne Intervention (p=0,028). „Unsere Arbeit zeigt, dass eine routinemäßige infektiologische Intervention das Management und die Adhärenz zu Managementleitlinien bei Patienten mit SAB verbessert und die Mortalität senkt. Eine solche infektiologische Intervention sollte universimed.com | 6. Österreichischer Infektionskongress routinemäßig für alle Patienten mit SAB etabliert werden“, schloss Luketina. Lipocalin 2 zieht Neutrophile an Aus der Medizinischen Universität Innsbruck stammt jene Studie, die von Dr. Andrea Schroll, Klinische Infektiologie und Immunologie, Univ.-Klin. für Innere Medizin I, vorgestellt wurde. Neutrophile Granulozyten haben eine ganze Reihe von Aufgaben, wie Phagozytose, Sekretion von lytischen Enzymen, Produktion von „Reactive Oxygen Intermediates“ (ROI), Produktion von Komplementfaktoren, Expression von Fc-Rezeptoren, Chemokinen/Zytokinen und antiinflammatorischen Molekülen. „Rezentere Daten haben gezeigt, dass Neutrophile auch in der Spätphase von Entzündung durch Produktion antiinflammatorischer Mediatoren eine wichtige Rolle spielen“, erklärte Schroll. Lipocalin 2 oder „neutrophil gelatinaseassociated lipocalin“ ist ein relativ kleines Protein, das nicht nur von Neutrophilen, sondern z.B. auch von Makrophagen, Hepatozyten, Nierentubulus- und Gefäßendothelzellen exprimiert wird. Lipocalin 2 hat verschiedene Funktion, u.a. wirkt es antibakteriell, indem es bakterielle Siderophore bindet und den Bakterien damit Eisen entzieht,11 es spielt aber auch eine Rolle bei malignen Tumoren, wo es einerseits Apoptose induziert, andererseits aber auch einen Marker für Metastasierung darstellt.12 „Wir konnten eine neue Funktion von Lipocalin 2 aufklären und zeigen, dass Lipocalin 2 als starkes Chemokin auf neutrophile Granulozyten wirkt. Das Fehlen dieses Chemokins verhindert das Einwandern von Neutrophilen in Infektionsherde und verschlechtert dadurch die Elimination der eingedrungenen Pathogene“, so Schroll. ging von der Hypothese aus, dass suPAR bei Patienten mit ,systemic inflammatory response syndrome‘, kurz SIRS, ein diagnostisches Potenzial hinsichtlich Bakteriämie besitzt, eventuell eine Korrelation mit dem Erreger aufweist und den herkömmlichen Markern wie CRP, Procalcitonin, PCT oder IL-6 überlegen ist“, berichtete Hönigl. 132 Patienten, welche die SIRS-Kriterien erfüllten, wurden in die Studie aufgenommen. „Das Blut zur suPAR-Bestimmung wurde jeweils gleichzeitig mit den ersten Blutkulturen abgenommen, wobei auch CRP, PCT, IL-6 und die Leukozytenzahl bestimmt wurden“, so Hönigl. Bei 55 Patienten fanden sich positive, bei den anderen 77 negative Blutkulturen. „suPAR erwies sich in der Prädiktion von Bakteriämien etwa gleich gut wie PCT und IL-6 und deutlich besser als CRP und Leukozytenzahl. Während PCT und IL-6 vor allem für Bakteriämien durch S. aureus oder Streptokokken gute Marker sind, scheint suPAR Vorteile bei der Erkennung von Bakteriämien durch gramnegative Erreger zu besitzen“, fasste Hönigl zusammen. Referenzen: 1 Helbok R et al, J Am Geriatr Soc 2011; 59(3): 552553 2 Zivkovic A et al, J Immunol 2011; 186(3): 16081617 3 Mair SM et al, J Infect Dis 2011; 204(5): 685-694 4 Valentin T et al, J Infect 2011; 62(1): 34-38 5 Poeppl W et al, Antimicrob Agents Chemother 2011; 55(11): 4999-5003 6 Nairz M et al, Immunity 2011; 34(1): 61-74 7 Lagler H et al, Vaccine 2011; 29(40): 6888-6893 8 Lagler H et al, PLoS One 2012; [in press] 9 Holinka J et al, J Orthop Res 2011; 29(4): 617-622 10 Wenisch JM et al, Antimicrob Agents Chemother 2012; 56(4): 1974-1978 11 Flo TH et al, Nature 2004; 432(7019): 917-921 12 Devireddy LR et al, Science 2001; 293(5531): 829834 n Quelle: SIRS: Wie super ist suPAR? „Best Papers: Infektiologische Forschung in Österreich“, „Die Abkürzung ,suPAR‘ steht für ,soluble urokinase plasminogen activator receptor‘. Erhöhte suPAR-Spiegel wurden bei verschiedenen Infektionskrankheiten, aber auch bei Malignomen gefunden“, erläuterte Dr. Martin Hönigl in seiner zweiten Präsentation. „Unsere Studie Symposium 5 20. April 2012 Saalfelden Bericht: Dr. Norbert Hasenöhrl inf120236 37 I JATROS | news Infektiologie 2 I 2012 Neue Waffen gegen gefährliche Infektionskrankheiten Das 9. Internationale Symposium für Molekulare Diagnostik (ISMD 2012) fand heuer von 17. bis 19. Mai in Graz statt. Eröffnet wurde die hochkarätige Veranstaltung mit dem Thema „Molekulare Diagnostik infektiöser Erkrankungen“. Namhafte Expertinnen und Experten aus aller Welt präsentierten innovative molekulare Methoden zum Erregernachweis sowie daraus resultierende Therapieverbesserungen. Bahnbrechende Fortschritte wurden beispielsweise in der Optimierung der HIVTherapie, der individualisierten Behandlung infektiöser Lebererkrankungen (Virushepatitiden) sowie in der Früherkennung von Infektionen mit dem humanen Papillomavirus (HPV) erzielt. Optimierung der HIV-Therapie Heutzutage steht eine Reihe wirksamer Medikamente für die Behandlung HIVInfizierter zur Verfügung, die eine signifikant verlängerte Lebenserwartung der Betroffenen ermöglichen. „Zur Kontrolle und Sicherung des therapeutischen Erfolgs ist allerdings eine regelmäßige Bestimmung der Virusmenge im Blut erforderlich“, erklärt Kongresspräsident Univ.Prof. Dr. Harald H. Kessler, Institut für Hygiene, Mikrobiologie und Umweltmedizin, Medizinische Universität Graz. Besonders wichtig ist in diesem Zusammenhang der Nachweis einer Medikamentenresistenz mittels genauer Analyse des HIV-Genoms, um frühzeitig auf ein wirksames Medikament wechseln zu können. Da laufend neue Medikamente auf den Markt kommen bzw. auch neue virale Mutationen auftreten, müssen diese Tests kontinuierlich weiterentwickelt werden. Im Rahmen des ISMD2012 wurden neuartige Sequenziermethoden zum Nachweis einer Medikamentenresistenz vorgestellt und die Relevanz neu gefundener Mutationen im HIV-Genom diskutiert. Individualisierte Therapie bei Hepatitiserkrankungen Behandlungsziel bei infektiösen Entzündungen der Leber (Hepatitiden) ist, durch den Einsatz antiviraler Substanzen die Vi- I 38 ruszahl im Blut zu senken. „Durch spezifische diagnostische Methoden ist es seit Kurzem möglich, bereits zu einem sehr frühen Therapiezeitpunkt abzuschätzen, ob und in welchem Ausmaß ein Patient auf eine bestimmte Behandlung anspricht“, berichtete Univ.-Prof. Dr. Peter Ferenci, Univ. Klinik für Innere Medizin III, AKH Wien. Ist etwa bei einem Patienten mit Genotyp 1 oder 4 bereits nach vier Wochen das Virus nicht mehr nachweisbar, wird er mit der Standardtherapie Peginterferon/Ribavirin nur mehr 24 anstatt 48 Wochen therapiert, ein Patient mit Genotyp 3 sogar nur noch zwölf Wochen. Bei Hepatitis B geht es hingegen nicht darum, die Therapie zu verkürzen, sondern die Effektivität einer Behandlung zu überprüfen. Ein Virusabfall ist hier Voraussetzung dafür, eine Therapie weiterzuführen. Neuer Test auf das humane Papillomavirus (HPV) Gebärmutterhalskrebs (Zervixkarzinom) ist die zweithäufigste krebsbedingte Todesursache bei jungen Frauen (<44 Jahre). Eine der wichtigsten Auslöser für die Entstehung dieses Tumors ist die Infektion mit dem humanen Papillomavirus (HPV). Wenn auch über 90% der HPV-Infektionen ausheilen, so sind doch mehr als 99% aller Zervixkarzinome mit einer HPV-Infektion vergesellschaftet. Das heißt, nicht jede HPV-Infektion führt zu einem Karzinom, aber nahezu jedes Karzinom ist mit HPV assoziert. Am häufigsten sind die HPV-Typen 16 und 18 an einer Karzinomentstehung beteiligt. Die bereits seit Jahrzehnten im Rahmen der Gesundenuntersuchung etablierte Methode ist der sogenannte Pap-Abstrich. Damit werden durch den Nachweis von Zellveränderungen Krebsvorstufen bzw. Karzinome sehr früh entdeckt und meist rechtzeitig einer Therapie zugeführt. Allerdings liegt die Sensitivität des Abstrichs bei nur etwa 60 bis 75%. „Mit neuen molekularen Nachweisverfahren kann eine HPV-Infektion nachgewiesen werden. Durch den Nachweis und die Typisierung von HPV wird die Sensitivität in der Früherkennung auf über 95% gesteigert“, betonte Dr. Hans Georg Mustafa, Leiter des Med. Chem. Laboratoriums Dr. Mustafa Dr. Richter OG. Die Stärke des HPV-Tests ist sein hoher negativer prädiktiver Wert: Liegt das Resultat „HPV-negativ“ vor, besteht für die untersuchte Frau nahezu kein Krebsrisiko. Diesbezüglich ist der neue HPV-Test dem Pap-Test überlegen. Quelle: Pressegespräch: „Gefährlichen Infektionskrankkheiten auf der Spur“, 15. Mai 2012 Wien universimed.com | fachinformation Fachinformation zu Inserat auf Seite 2 KALETRA 200 mg / 50 mg Filmtabletten. ZUSAMMENSETZUNG: Jede Filmtablette enthält 200 mg Lopinavir in Kombination mit 50 mg Ritonavir zur Verbesserung der Pharmakokinetik. ANWENDUNGSGEBIETE: Kaletra ist in Kombination mit anderen antiretroviralen Arzneimitteln zur Behandlung von mit dem humanen Immundefiziens-Virus (HIV-1)- infizierten Erwachsenen, Jugendlichen und Kindern über 2 Jahre angezeigt. Bei bereits mit Proteasehemmern vorbehandelten HIV-1-infizierten Erwachsenen sollte die Anwendung von Kaletra auf einer individuellen virologischen Resistenzuntersuchung und der Behandlungsvorgeschichte des Patienten beruhen. GEGENANZEIGEN: Überempfindlichkeit gegenüber den Wirkstoffen oder einen der sonstigen Bestandteile. Patienten mit schwerer Leberinsuffizienz. Kaletra enthält Lopinavir und Ritonavir, beide sind Hemmer des P450 Isoenzym CYP3A. Kaletra sollte nicht gleichzeitig mit Arzneimitteln verabreicht werden, deren Clearance stark von CYP3A abhängt und bei denen durch erhöhte Plasmakonzentrationen mit schweren und/oder lebensbedrohlichen Situationen zu rechnen ist. Diese Arzneimittel sind z. B. Astemizol, Terfenadin, oral verabreichtes Midazolam (besondere Vorsicht bei parenteral verabreichtem Midazolam), Triazolam, Cisaprid, Pimozid, Amiodaron, Mutterkornalkaloide (z. B. Ergotamin, Dihydroergotamin, Ergometrin und Methylergometrin), Lovastatin, Simvastatin, Sildenafil zur Behandlung der pulmonal-arteriellen Hypertonie (zur Anwendung von Sildenafil bei Patienten mit erektiler Dysfunktion siehe Fachinformation) und Vardenafil. Pflanzliche Zubereitungen, die Johanniskraut (Hypericum perforatum) enthalten, dürfen wegen des Risikos reduzierter Plasmakonzentrationen und verminderter klinischer Effekte von Lopinavir und Ritonavir nicht gleichzeitig mit Lopinavir und Ritonavir angewendet werden. SONSTIGE BESTANDTEILE: Der Tablettenkern enthält: Copovidon, Sorbitanlaurat, Hochdisperses Siliciumdioxid, Natriumstearylfumarat. Filmüberzug: Hypromellose, Titandioxid, Macrogol 400, Hyprolose, Talkum, Hochdisperses Siliciumdioxid, Macrogol 3350, Eisen(III)-hydroxid-oxid x H2O, Polysorbat 80. NAME UND ANSCHRIFT DES PHARMAZEUTISCHEN UNTERNEHMERS: Abbott Laboratories Limited, Abbott House, Vanwall Business Park, Vanwall Road, Maidenhead, Berkshire, SL6 4XE, Vereinigtes Königreich. VERTRETUNG DES ZULASSUNGSINHABERS IN ÖSTERREICH: Abbott Ges.m.b.H., 1230 Wien. VERSCHREIBUNGSPFLICHT / APOTHEKENPFLICHT: NR, Rezept- und apothekenpflichtig. PHARMAKOTHERAPEUTISCHE GRUPPE: Virostatika für die systemische Anwendung, Proteaseinhibitoren, ATC-Code: J05AE06. Informationen zu Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, zu Wechselwirkungen mit anderen Mitteln und zu Nebenwirkungen sind der veröffentlichten Fachinformation zu entnehmen. STAND DER INFORMATION: 04/2011 Fachinformation zu Inserat auf Seite 25 1. DIFICLIR 200 mg Filmtabletten. 2.QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG. Eine Tablette enthält 200 mg Fidaxomicin. 3. ANWENDUNGSGEBIETE. DIFICLIR ist indiziert bei Erwachsenen zur Behandlung von Clostridium-difficile-Infektionen (CDI), auch bekannt unter der Bezeichnung Clostridium-difficile-assoziierte Diarrhö (CDAD) (siehe Abschnitt 5.1). Offizielle Leitlinien zum angemessenen Gebrauch von Antibiotika sollten berücksichtigt werden. 4. GEGENANZEIGEN. Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. 5. PHARMAKODYNAMISCHE EIGENSCHAFTEN. Pharmakotherapeutische Gruppe: Antidiarrhoika und intestinale Antiphlogistika/Antiinfektiva, Antibiotika, ATC-Code: A07AA12. 6. LISTE DER SONSTIGEN BESTANDTEILE. Tablettenkern: Mikrokristalline Cellulose, Vorverkleisterte Stärke, Hydroxypropylcellulose, Butyliertes Hydroxytoluol, Carboxymethylstärke-Natrium, Magnesiumstearat. Umhüllung: Polyvinylalkohol, Titandioxid, Talkum, Macrogol, Lecithin (Soja). 7. INHABER DER ZULASSUNG. Astellas Pharma Europe B.V., Elisabethhof 19, 2353 EW Leiderdorp, Niederlande. Verschreibungspflicht/Apothekenpflicht. Rezept- und apothekenpflichtig. 2/2012. „Weitere Angaben zu besonderen Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation.“ Fachinformation zu Inserat auf Seite 40 und Bericht auf Seite 33 Prevenar 13 Injektionssuspension. Pneumokokkenpolysaccharid-Konjugatimpfstoff (13-valent, adsorbiert). Qualitative und quantitative Zusammensetzung: Jede 0,5 ml Dosis enthält. Pneumokokkenpolysaccharid der Serotypen 1, 3, 4, 5, 6A, 7F, 9V, 14, 18C, 19A, 19F und 23F (je 2,2 μg) und des Serotyps 6B (4,4 μg) konjugiert an das CRM197-Trägerprotein und adsorbiert an Aluminiumphosphat (0,125 mg Aluminium). Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1 der Fachinformation. Anwendungsgebiete: Aktive Immunisierung zur Prävention von invasiven Erkrankungen, Pneumonie und akuter Otitis media, die durch Streptococcus pneumoniae verursacht werden, bei Säuglingen und Kindern im Alter von 6 Wochen bis 5 Jahren. Aktive Immunisierung zur Prävention von invasiven Erkrankungen, die durch Streptococcus pneumoniae verursacht werden, bei Erwachsenen im Alter von 50 Jahren und darüber. Siehe Abschnitte 4.4 und 5.1 der Fachinformation zu Informationen über den Schutz vor bestimmten Pneumokokken-Serotypen. Die Anwendung von Prevenar 13 sollte auf Basis offizieller Empfehlungen erfolgen und das Ausmaß der invasiven Erkrankungen in den verschiedenen Altersgruppen sowie die epidemiologische Variabilität der Serotypen in den unterschiedlichen geographischen Gebieten berücksichtigen. Gegenanzeigen: Überempfindlichkeit gegen einen der Wirkstoffe, einen der sonstigen Bestandteile (siehe Abschnitt 6.1 der Fachinformation) oder gegen Diphtherie-Toxoid. Wie bei anderen Impfstoffen sollte die Verabreichung von Prevenar 13 an Säuglinge und Kinder, die an einer schweren akuten fiebrigen Erkrankung leiden, auf einen späteren Zeitpunkt verschoben werden. Bei einer leichten Infektion, z. B. einer Erkältung, sollte die Impfung jedoch nicht verschoben werden. Pharmakotherapeutische Gruppe: Impfstoffe, Pneumokokken-Impfstoffe. ATC-Code: J07AL02. Inhaber der Zulassung: Wyeth Lederle Vaccines S.A., Pleinlaan 17 Boulevard de la Plaine, 1050 Brüssel, Belgien. Stand der Information: 10/2011. Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig. Angaben zu besonderen Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Pfizer Corporation Austria Ges.m.b.H., Wien DER NEUE WEG, PATIENTEN SCHÜTZEN ZU KÖNNEN MIT DEM ERSTEN UND EINZIGEN PNEUMOKOKKENKONJUGATIMPFSTOFF FÜR ERWACHSENE AB 50. • InvasivePneumokokken-ErkrankungengehenmithoherMorbiditätundMortalitäteinher.1 • DasRisikoistaltersabhängig–essteigtab50Jahren.2 • Erwachseneab50JahrenerhalteneineEinzeldosis. 2 IN DI NEU KA E TI ON ! PRE-097-11/1/22.11.2011 Fachinformation zu Inserat siehe Seite 39 1.CDC,ActiveBacterialCoreSurveillance(ABCs)Report,EmergingInfectionsProgramNetwork,Streptococcuspneumoniae,2009 2.FachinformationPrevenar13 ®