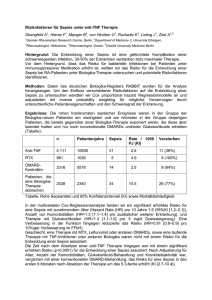
Vorkommen und Bedeutung zirkulierender dendritischer Zellen bei
Werbung

Universitätsklinik für Anästhesiologie Prof. Dr. M. Georgieff Vorkommen und Bedeutung zirkulierender dendritischer Zellen bei intensivtherapiepflichtigen, postoperativen Patienten mit schwerer Sepsis oder septischem Schock Dissertation zur Erlangung des Doktorgrades der Medizin der Medizinischen Fakultät der Universität Ulm von Michaela Maria Elfriede Appel, geboren in: Ingolstadt 2005 amtierender Dekan: Herr Prof. Dr. med. Klaus-Michael Debatin 1.Berichterstatter: Frau Prof. Dr. Marion Schneider 2.Berichterstatter: Herr Prof. Dr. med. Dietmar Abendroth Tag der Promotion: 25.11.2005 1 1.1 1.2 1.3 1.4 1.5 1.6 1.7 1.8 2 EINLEITUNG 5 SEPSIS DENDRITISCHE ZELLEN HÄMOPHAGOZYTISCHE LYMPHOHISTIOZYTOSE CD 2 CD86 SIL-2R INTERFERON GAMMA FRAGESTELLUNG MATERIAL UND METHODEN 5 9 10 12 13 13 14 15 17 2.1 PATIENTENGUT 2.2 DATENGEWINNUNG DC 2.2.1 DURCHFLUSSZYTOMETRIE 2.2.1.1 Probengewinnung 2.2.1.2 Probenaufbereitung 2.2.1.3 Messung 2.3 DATENGEWINNUNG ZYTOKINE 2.4 DATENGEWINNUNG KLINISCH-CHEMISCHE PARAMETER 2.5 STATISTISCHE AUSWERTUNG UND ETHIKKOMMISSION 17 20 20 20 20 22 25 25 26 3 27 ERGEBNISSE 3.1 VORKOMMEN DENDRITISCHER ZELLEN 3.1.1 ALLGEMEINES 3.1.2 BEI NORMALSPENDERN 3.1.3 BEI PATIENTEN 3.2 TYPISCHE HLH-PARAMETER BEI SEPSISPATIENTEN 3.2.1 SIL2-R 3.2.2 IFNG 3.2.3 LEUKOZYTEN 3.2.4 THROMBOZYTEN 3.3 FALLDARSTELLUNG DC-PATIENTEN 3.3.1 FALL 1 3.3.2 FALL 2 3.3.3 FALL 3 3.3.4 FALL 4 27 27 27 27 30 30 32 33 35 37 37 39 41 43 4 45 DISKUSSION 4.1 4.2 4.3 CD86/CD2 ALS MARKER FÜR APC DENDRITISCHE ZELLEN WERTIGKEIT DER UNTERSUCHTEN HISTIOZYTOSE-PARAMETER FÜR PATIENTEN MIT SEPTISCHEM SCHOCK 4.3.1 SIL-2R 4.3.2 IFN GAMMA 4.3.3 LEUKOZYTEN UND THROMBOZYTEN 51 51 52 53 5 55 ZUSAMMENFASSUNG 1 45 47 6 LITERATURVERZEICHNIS 57 7 LEBENSLAUF 65 2 Abkürzungsverzeichnis APC Antigen presenting cells (antigenpräsentierende Zellen) BAA Bauchaortenaneurysma BSA bovines Serumalbumin (Rinderserumalbumin) BWK Brustwirbelkörper Ca Carcinom CARS combined antiinflammatory response syndrome CD cluster of differentiation CDC centers for disease control COPD chronic obstructive pulmonary disease (chronisch obstruktive Lungenerkrankung) DC dendritische Zellen ELISA Enzyme-linked immunosorbent assay FACS Fluorescence-activated cell sorter FAS-L FAS Ligand FHL Familiäre hämophagozytische Lymphohistiozytose FITC Fluorescein-Isothiocyanat FSC forward scatter; Vorwärtsstreulicht GI gastrointestinal GM-CSF Granulozyten-Makrophagen-Kolonie-stimulierender Faktor HLH Hämophagozytische Lymphohistiozytose HPS Hämophagozytisches Syndrom IAHS infektassoziiertes hämophagozytisches Syndrom IFN g Interferon gamma IL Interleukin KM Knochenmark LDH Laktatdehydrogenase LPS Lipopolysaccharid MARS mixed antagonistic response syndrome MOF multiple organ failure (Multiorganversagen) NK-Zellen natural killer-Zellen PAF plättchenaktivierender Faktor PBMC peripheral blood mononuclear cells PHA Phythämagglutinin 3 PBS phosphate buffered saline R-PE Red-Phycoerythrin sIL-2R soluble (löslicher) IL-2 Rezeptor SIRS systemic inflammatory response syndrome SSC sideward scatter; Seitwärtsstreulicht TAA Tachyarrhythmia absoluta TH T-Helfer-Zellen TNFa tumor necrosis factor alpha 4 1 Einleitung 1 1.1 Einleitung Sepsis Epidemiologie: Sepsis ist nach wie vor eine Erkrankung mit hoher Morbidität und Mortalität. Dies betrifft vor allem ältere Menschen, Immunkompromitierte und kritisch Kranke. [15]Nach einer Untersuchung von Angus et al in den USA von 2001 gibt es schätzungsweise 751.000 Fälle von schwerer Sepsis, von denen etwa 383.000 intensivtherapiepflichtig waren. [6]In Deutschland liegt die Inzidenz für die schwere Sepsis bei etwa 90.000 Patienten/Jahr, wobei mit ca. 35.000 Todesfällen gerechnet werden muss. [23] Nach den Centers for disease control (CDC) stieg die Inzidenz für Septikämien zwischen 1979 und 1987 um 139 % und liegt damit auf Rang 13 bei den häufigsten Todesursachen in den USA. [2, 7, 79]Auch die Inzidenz des septischen Schockes ist in den letzten Jahren aufgrund verbesserter technischer Voraussetzungen und invasiver Maßnahmen auf Intensivstationen deutlich angestiegen. Der Fortschritt supportiver Maßnahmen und neue effektive Therapien führten zu einer Reduzierung der Mortalität des septischen Schockes in den letzten 10 Jahren. [32]Die Mortalität der schweren Sepsis liegt derzeit bei etwa 30 %, beim septischen Schock ca. bei 50 %. [5, 6, 32] Die schwere Sepsis immer noch die häufigste Todesursache auf nichtkardiologischen Stationen. Definitionen: Die erste Definition für Sepsis geht auf Schottmüller aus dem Jahre 1914 zurück. Dieser geht davon aus, dass eine Sepsis dann vorliegt, wenn sich innerhalb des Körpers ein Herd gebildet hat, von dem aus konstant oder periodisch pathogene Bakterien in den Blutkreislauf gelangen und zwar derart, dass durch diese Invasion subjektive und objektive Krankheitserscheinungen ausgelöst werden. Bis heute hat diese Definition mit kleinen Veränderungen Gültigkeit. [76] Analog zur Konsensus-Konferenz von 1992, die es sich zur Aufgabe gemacht hat, allgemeingültige Definitionen für Sepsis und verschiedene septische Zustandsbilder aufzustellen, wird Sepsis als systemische Reaktion des Körpers auf eine Infektion definiert. Dabei müssen zwei oder mehr der folgenden Kriterien zutreffen[1]: 5 1 Einleitung • Temperatur <36°C oder >38°C • Herzfrequenz >90/min • Atemfrequenz >20/min oder paCO2 <32 mmHg • Leukozyten <4.000 oder >12.000/mm3 • zusätzlich eine nachgewiesene Infektion Diese Kriterien wurden in einer Sepsis Definitions Conference im Jahr 2001 etwas verändert. [52a] Da es auch zu septischen Reaktionen ohne Nachweis einer Infektion, z.B. durch Trauma, Verbrennungen oder Pankreatitis, kommen kann, hat man den Begriff des systemic inflammatory response syndrome (SIRS) eingeführt. Diesem Zustand liegen zwei oder mehr der folgenden Symptome zugrunde[1]: • Temperatur <36°C oder >38°C • Herzfrequenz >90/min • Atemfrequenz >20/min oder paCO2 <32 mmHg • Leukozyten <4.000 oder >12.000/mm3 Um den Schweregrad einer Sepsis bestimmen zu können, teilt man die Sepsis in schwere Sepsis und septischen Schock ein. Unter schwerer Sepsis definiert die KonsensusKonferenz eine Sepsis, die mit Organdysfunktion, Hypoperfusion oder Hypotension assoziiert ist. [1] Der Zustand des septischen Schockes beinhaltet eine Sepsis mit Hypotension trotz ausreichender Flüssigkeitszufuhr. [1] Pathophysiologie: Im gesunden Organismus liegen pro- und antiinflammatorische Zytokine im Gleichgewicht vor. Bei Sepsis oder SIRS kommt es, als Reaktion auf das Eindringen von Mikroorganismen oder auf Trauma und Verbrennungen, zu einer unkontrollierten inflammatorischen Reaktion mit Freisetzung von proinflammatorischen Mediatoren wie TNFa, IL-1, IL-6 und platelet activating factor (PAF). [14, 15] 6 1 Einleitung Daraus resultiert ein Ungleichgewicht mit Überwiegen der proinflammatorischen Seite. Es kommt zu Gewebedefekten, die ihrerseits verantwortlich für die Aktivierung der Gerinnungskaskade sind. Durch positive Feedback-Mechanismen zwischen der inflammatorischen Antwort und den Gewebedefekten werden beide Komponenten weiterhin gefördert und es resultieren Hypoperfusion, Ischämie und Organversagen. Die Aktivierung der Entzündungs- und der Gerinnungskaskade führt schließlich zur Gegenaktivierung des fibrinolytischen Systems und somit zur Verbrauchskoagulopathie. [39] Nicht immer dominiert dieser proinflammatorische Zustand bei septischen Patienten. Immer öfter konnte festgestellt werden, dass es durch die Zunahme antiinflammatorischer Zytokine, wie IL-4, IL-5 oder auch IL-10, zur Immunsuppression und einer verminderten Anzahl von Lymphozytenpopulationen kommt. [15, 56]Dieser Zustand wird von Bone als compensatory antiinflammatory response syndrome (CARS) bezeichnet. [15]Der Verlust von Lymphozyten entsteht vor allem durch gesteigerte Apoptose dieser Zellen. Welche Mechanismen dafür verantwortlich sind, konnte noch nicht vollständig geklärt werden. Wahrscheinlich sind daran sowohl direkte als auch indirekte Mechanismen beteiligt. Es könnte durch das Eindringen der Mikroorganismen selbst zur Verminderung der zellvermittelten Immunität kommen. Andererseits könnte die Phagozytose apoptotischer Zellen durch Makrophagen und unreife dendritische Zellen zur Immunsuppression führen. [56] Ebenso gibt es Patienten, bei denen Phasen des SIRS und des CARS immer wieder abwechseln. Bei diesem Zustand wird von einem MARS, dem mixed antagonistic response syndrome, gesprochen. [15] Therapie: Zunächst galt die Aufmerksamkeit in Bezug auf die Therapie der Sepsis der Entzündungsreaktion als dominierenden Prozess. Durch weitere, umfassendere Forschung kam man zu der Erkenntnis, dass die Sepsis durch einen Verlust des Gleichgewichts zwischen Entzündung, Gerinnung und Fibrinolyse ausgelöst wird. [39] Mehr als 25 Phase-III-Studien, welche Substanzen wie Anti-Endotoxin-Antikörper, AntiTumornekrosefaktor-Antikörper, IL-1R-Antikörper, PAF-Antagonisten, Steroide und Prostaglandininhibitoren untersuchten, führten zu enttäuschenden Ergebnissen. [12, 39, 85]Dies wirft die Frage auf, warum es zu einer solchen Vielzahl an negativen Ergebnissen gekommen ist. 7 1 Einleitung Es gibt Gründe dafür, zu glauben, dass die verwendeten Substanzen nur unzureichend fähig waren, die interessierenden Mediatoren zu blockieren oder sie zielten auf Mediatoren ab, die nur eine relativ unbedeutende Rolle für das outcome der Sepsis spielten. Weiterhin fand man heraus, dass viele der immunmodulatorischen Therapien eine deutliche Effizienz in Tiermodellen zeigten, aber zu keinerlei Erfolgen in klinischen Studien führten. Möglicherweise spielt dabei die Tatsache eine Rolle, dass es Unterschiede zwischen den biochemischen und immunologischen Reaktionen von Sepsispatienten und Versuchstieren mit bekannten bakteriellen Infektionen gibt. [3] Außerdem stellt sich die Frage, ob in den bisherigen Studien nicht zu weit gefasste Definitionen für Sepsis verwendet wurden, wo sich bei Patienten mit stärker limitierten Einschlusskriterien bzw. Erkrankungen mehr positive Ergebnisse gezeigt hätten. Denn in den meisten Fällen wurden in die Studien Patienten mit dem Nachweis einer Infektion assoziiert mit der (bevorstehenden) Entwicklung eines Multiorganversagens gemäß der Konsensus-Konferenz [1]eingeschlossen. Um den frühen Einschluss in die Studie zu gewährleisten, wurde auf den mikrobiologischen Nachweis verzichtet. [3] Weiterhin wurde bei immunmodulatorischen Therapiestudien meist nicht berücksichtigt, ob bei den Patienten überhaupt erhöhte Spiegel der entsprechenden Mediatoren nachgewiesen werden konnten. [3] Ein Beispiel dafür ist die NORASEPT (North American Sepsis Trial)-II-Studie, eine Studie mit monoklonalen anti-TNF-Antikörpern. Hier konnte kein Effekt der Therapie bei Patienten ohne erhöhte TNF-Spiegel erzielt werden, während es bei Patienten mit erhöhten Spiegeln zu einer Reduktion der 28-Tage-Mortalität um 18% im Vergleich zu Placebo kam. [3] Auch war bisher immer nur ein System (Inflammation, Koagulation oder Fibrinolyse) Ziel der Therapie. Eine Phase-III-Studie, die alle drei Systeme beinhaltet, ist die PROWESS (recombinant human activated protein C worldwide evaluation in severe sepsis)-Studie. Diese beurteilt die Effektivität und Sicherheit von rekombinantem humanen Protein C (Drotrecogin alfa activated) für schwere Sepsis im Vergleich zu Placebo. Eine 4-tägige Infusion von Drotrecogin alfa führte bei 850 Patienten zu einer absoluten Reduktion der Mortalität von 6,1% gegenüber Placebo. Bei dieser Studie wurden neben Geschlecht, Alter, Voroperationen, Apache-II-Score und Anzahl der Organe beim MOF auch die Protein C-, Plasma-D-Dimer- und IL-6-Konzentration berücksichtigt. [39] Wegen der deutlichen Verbesserung der Prognose wurde diese Studie vorzeitig beendet. Seit November 2001 ist Drotrecogin alfa in Europa zur Behandlung der schweren Sepsis bei Erwachsenen mit multiplem Organversagen als Zusatzbehandlung zugelassen. 8 1 Einleitung Seit August 2002 ist Drotrecogin alfa activated (Xigris®) auch in Deutschland als Medikament zur zusätzlichen Behandlung der schweren Sepsis zugelassen. 1.2 Dendritische Zellen Dendritische Zellen (DC) stellen die wichtigste Gruppe von antigenpräsentierenden Zellen dar. Bisher wurden sie in nicht-lymphoiden Organen, wie z.B. der Epidermis, dem Herz, der Leber oder der Lunge, in lymphoiden Organen, wie z.B. den Tonsillen, den TZellregionen der peripheren lymphoiden Organe und im Thymus, und in der Zirkulation (Blut und afferente Lymphe) gefunden. Sie besitzen die Fähigkeit, die T-Zell vermittelte Immunantwort einzuleiten, indem sie den T-Zellen über MHC-Moleküle Informationen über die molekulare Identität des Pathogens und über kostimulatorische Moleküle (CD80, CD86) Botschaften über das pathogene Potential übermitteln. [48] Im Blut sind < 0,1% der Leukozyten DC. [79]Dort kann man sie aufgrund ihrer Oberflächenmoleküle durchflusszytometrisch von den anderen Leukozytenpoulationen isolieren. Charakteristisch für DC ist, dass sie für HLA-DR positiv und für andere zelllinienspezifische Marker (CD14 für Monozyten, CD16 und CD56 für NK-Zellen, CD19 und CD20 für B-Zellen und CD3 für T-Zellen) negativ sind. [31] Bisher sind zwei verschiedene Arten von DC im menschlichen Blut bekannt. [16, 58, 65, 79]Dies sind einerseits die „myeloiden“ DC (DC1) und andererseits die „lymphoiden“ DC (DC2). Über deren Ursprung besteht in der Literatur noch keine Einigkeit. Da sich die zwei DC-Subpopulationen im Blut in ihrer Morphologie, ihrem Phänotyp und ihrer antigenpräsentierenden Kapazität deutlich voneinander unterscheiden, kann man davon ausgehen, dass es sich um zwei verschiedene Zelllinien von APC handelt. [66] Die DC1 scheinen aufgrund ihrer morphologischen und funktionellen Eigenschaften entweder aus Blutmonozyten [80]oder aus CD34+-Vorläuferzellen aus dem Knochenmark (KM) [68, 72]hervorzugehen, während die DC2 wegen des plasmazytoiden Aussehens ihrer unreifen Vorstufe von CD4+ CD3- CD11c-Zellen des KM’s zu stammen scheinen. [38, 61, 65, 66]Diese Vorläuferzellen können sich in vitro durch Kultivierung in verschiedenen Medien wie z.B. GM-CSF und TNFa [66, 72]oder monocyte-conditioned medium [58, 80, 83]zu reifen dendritischen Zellen entwickeln. Dabei entstehen aus pDC1 reife DC1, die folgende charakteristische Merkmale aufweisen. Phänotypisch exprimieren sie neben den bereits erwähnten MHC-II- Antigenen noch CD11c, CD80, CD86, CD54 und CD58. An funktionellen Eigenschaften findet man bei den DC1 die Fähigkeit zu 9 1 Einleitung Antigen-Aufnahme, Prozessierung und Präsentation, was zu einer ausgeprägten Induktion der T-Zellaktivierung führt. [19, 58, 72, 80, 83] Die pDC2 differenzieren sich durch o.g. Medien weiter zu reifen DC2. Wie auch die DC1 exprimieren sie MHC-II. Man findet aber eine deutliche geringere Expression z.B. kostimulatorischer Moleküle (CD80, CD86, CD54, CD58), ebenso kein CD11c. [58, 79]Stattdessen weist die Oberfläche von DC2 eine hohe Expression von CD8α, CD123 und FasL auf. [19, 29, 53, 61, 80, 82]Dies impliziert auch ihre Funktion. Es kommt, wie auch bei DC1 zur Ag-Aufnahme (Phagozytose), jedoch in deutlich geringerem Maße zur Prozessierung und Präsentation. Typisch für DC2 ist die Fähigkeit zur Induktion des programmierten Zelltodes (Apoptose) durch die Expression des FasL. Vor allem die unreifen lymphoiden DC scheinen in der Pathophysiologie der hämophagozytischen Lymphohistiozytose eine große Rolle zu spielen. 1.3 Hämophagozytische Lymphohistiozytose Definition: Die hämophagozytische Lymphohistionzytose (HLH) ist eine Erkrankung des mononukleären phagozytischen Systems, welche auf einer Überaktivierung von T-Zellen und Histiozyten (Makrophagen und dendritischen Zellen) beruht. Man unterscheidet bei der HLH eine primäre, genetisch bedingte von einer sekundären, infekt- oder malignitätsassoziierten Form. Zusammengefasst werden diese Erkrankungen auch als Hämophagozytisches Syndrom (HPS). [28, 47] Bei der primären HLH handelt es sich um eine autosomal-rezessiv vererbte Erkrankung, die zum ersten Mal 1952 von Farquar beschrieben wurde. Ihre Häufigkeit wird auf eine von 50.000 Geburten geschätzt. [47]Typischerweise treten die ersten Symptome der HLH bereits innerhalb des ersten Lebensjahres auf und führen unbehandelt zum Tode. Die sekundäre HLH ist oft nur durch den Verlauf von der primären Form abzugrenzen und tritt häufig im Erwachsenenalter unter immunsuppressiver Therapie auf. Der Erkrankung liegt eine Infektion meist durch Viren, aber auch durch Bakterien oder Pilze zugrunde. [47] 10 1 Einleitung Klinik: Die Symptome von primärer und sekundärer HLH sind identisch. Kardinalsymptome sind Fieber, Hepatosplenomegalie und Zytopenien. Es kann auch zu Lymphknotenschwellungen, Ikterus, Lungeninfiltration, Ödemen und Hautausschlägen kommen. [44, 47]Im Blut finden sich erhöhte Transaminasen, Hypertriglyzeridämie und Hypofibrinogenämie. Zusätzlich kann es vor allem bei der sekundären HLH zu Hyperferritinämie und LDH-Anstieg kommen. [44]Im Knochenmark, in der Milz und in den Lymphknoten findet man histologisch Infiltrationen mit morphologisch benignen Histiozyten mit hoher Phagozytoseaktivität von Erythrozyten, Thrombozyten und Granulozyten. Um die Diagnose zu erleichtern wurden von Henter et al Diagnostische Richtlinien für die HLH aufgestellt. [41] Klinische und laborchemische Kriterien: • Fieber • Splenomegalie • Zytopenie • Hb < 90g/l • Neutrophile < 1.0 * 109 g/l • Hypertriglyzeridämie und/oder Hypofibrinogenämie Histopathologische Kriterien • Hämophagozytose in KM, Milz oder Lymphknoten (ohne Malignitätsnachweis) Für die HLH müssen alle der o.g. Kriterien erfüllt sein. Bei der FHL erfordert die Diagnose zusätzlich eine positive Familienananmese. Pathophysiologie: Durch eine unkontrollierte Hypersekretion von Zytokinen produziert von aktivierten TLymphozyten und Histiozyten kommt es zu den bereits erwähnten klinischen Symptomen. 11 1 Einleitung Bereits 1986 gab es Hinweise darauf, dass es sich um immunologisch unreife Elemente von Histiozyten handelt. [35] Erhöht sind vor allem Zytokine wie IFNg, IL-6 und IL-10, was zu einer weiteren Aktivierung von T-Zellen und Monozyten/Makrophagen führt. [62, 78]Ebenfalls finden sich bei HLH-Patienten erhöhte Spiegel an sIL-2R. [40, 44, 46] IFNg verursacht bei HLH vor allem eine Myelosuppression, die Induktion der Phagozytoseaktivität ist nur leicht erhöht. [44]Weitere Mechanismen sind bisher noch nicht bekannt. Einer der Hauptfaktoren der HLH scheinen extrem erhöhte Levels an sIL-2R zu sein. Es wird vermutet, dass sIL-2R als „blocking factor“ agiert und die normale Immunantwort durch Bindung von IL-2 verhindert wird. Daraus resultiert eine sekundäre Immundefizienz. [44, 45, 71] Eine typische Eigenschaft bei HLH ist der Verlust der NK-Zellfunktion. [78]Dieser Verlust ist bei der primären HLH stärker ausgeprägt als bei der sekundären. Dadurch kommt es zur Störung der zellulären Zytotoxizität, da es nicht mehr zur Produktion von Effektormolekülen, wie z.B. Granulozyten, durch NK-Zellen kommen kann. Die NK-Zell Anergie kann aber auch durch Anergie von APC, v.a. von dendritischen Zellen entstehen. Die DC verlagern ihre Tätigkeit eher auf Phagozytose von apoptotischen Zellen und nehmen ihre antigenpräsentierende Tätigkeit nicht mehr wahr. [46] Therapie: Die primäre HLH lässt sich lediglich durch Knochenmarkstransplantation kurativ behandeln. Andere Therapieoptionen sind Etoposid, Kortikoide und Ciclosporin A. Bei der sekundären HLH steht die Behandlung des Erregers durch Antibiotika, Antimykotika oder Virustatika im Vordergrund. [46, 47] 1.4 CD 2 CD 2, auch bezeichnet als LFA-2, sheep red blood cell (SRBC) receptor oder T11, ist ein transmembranes 50 kDa Glykoprotein mit 327 AS und gehört zur Ig-Superfamilie. Es wird in hohem Maße auf T- und NK-Zellen exprimiert, [10, 22, 49, 63] in geringerer Expression auch auf Thymus B-Zellen, Monozyten/Makrophagen und DC. [22, 49, 79]Es konnten drei verschiedene Epitope (T111, T112 und T113) für die Bindung an CD2 auf T-Zellen 12 1 Einleitung nachgewiesen werden. Bei Bindung an T112 und T113 resultiert eine Proliferation von TZellen sowie die Produktion von IL-2. [55]Crawford und Takamizawa konnten nachweisen, dass CD2+-Monozyten im Blut sowohl phänotypisch, morphologisch als auch funktionell zirkulierenden DC entsprechen. [22, 83]Somit könnte CD2 einen entscheidenden Marker zur Identifizierung von myeloiden DC darstellen. [22, 83] CD2 ist der Ligand für CD58(LFA-3), CD59 und CD48 auf APC und spielt eine Rolle bei der T-Zellaktivierung und der Adhäsion von T-Zellen an APC. [18] 1.5 CD86 CD86 ist ein 80 kDa Zelloberflächenprotein, das im Wesentlichen auf der Oberfläche von APC, wie B-Zellen, Monozyten/Makrophagen und DC vorkommt. Ryncarz et al konnten auf einer geringen Anzahl von CD34+ Knochenmarkszellen ebenfalls CD86 nachweisen. [72] Der Genort liegt auf Chromosom 3 (q13-23). Andere Bezeichnungen für CD86 sind FUN1, B7-2 und BU-63. [11]Die Expression von CD86 auf den verschiedenen APC ist unterschiedlich. Während das Molekül auf DC in hohem Maße exprimiert wird, findet man auf der Oberfläche von Monozyten/Makrophagen nur wenige dieser Proteine. Nach Aktivierung wird CD86 auf Monozyten/Makrophagen wie auch auf B-Zellen hochreguliert. [72] CD86 stellt neben CD80 den wichtigsten Liganden für CD28 und CTLA-4 (CD152) dar. Diese T-Zell-Proteine legen fest, ob es im Organismus zur Immunität oder zur Toleranz kommt. Neben dem T-Zell-Rezeptor (TCR), dem das Antigen im MHC-Molekül der APC präsentiert wird, sind für die Induktion der T-Zellantwort außerdem so genannte kostimulatorische Moleküle (CD86/CD80) auf der APC notwendig. Binden CD86/CD80 an CD28, kommt es zur Einleitung der T-Zell-Aktivierung. Auf den aktivierten T-Zellen wird nach 24-48h das CTLA-4-Molekül hochreguliert. Kommt es zur Interaktion von CD86 mit CTLA-4 ist dies für die T-Zelle ein negatives Signal und die Aktivierung wird beendet. So kann eine überschießende Immunantwort verhindert werden. [17] 1.6 sIL-2R sIL-2R ist die lösliche Form der α-Kette des Interleukin-2 Rezeptors (IL-2R). Der IL-2R ist ein 55 kDa membranassoziiertes Protein, welches auch als anti Tac oder CD25 bezeichnet wird. 13 1 Einleitung IL-2R wird auf der Oberfläche von aktivierten T-Zellen und B-Zellen exprimiert. Er alleine besitzt keine signalübertragenden Fähigkeiten. Nur in Verbindung mit der β- und der γ-Kette dieses Rezeptors zeigt sich eine hohe Affinität zu IL-2 und nur dann kommt es zum Wachstum und zur Differenzierung von T-Zellen. [49, 50] Nach Aktivierung der T-Zellen z.B. durch Fremdantigene kommt es zur erhöhten Expression von IL-2R auf der T-Zelloberfläche. Fehlt eine weitere Stimulation, wird der Rezeptor von der Zelle abgekoppelt und erscheint als sIL-2R im Serum. [36] Im Vergleich zum membrangebundenen IL-2R ist der lösliche IL-2R mit 40-45 kDa etwas kleiner. Es hat sich gezeigt, dass beide Formen an IL-2 binden können. [37] Auch bei gesunden Kontrollgruppen lässt sich sIL-2R nachweisen. Dieser scheint sowohl von normalen PBMC [37]als auch manchen B- und T-Zelllinien [70, 71]produziert zu werden. Die Serumspiegel beim Erwachsenen schwanken den Angaben entsprechend. Burmester schreibt von 200-1000 U/ml, bei Komp et al liegen die Normwerte zwischen 80 und 600 U/ml, bei Kindern etwas höher (je nach Alter zwischen 267 und 2337 U/ml). [17, 50] Erhöhte Spiegel für sIL-2R finden sich bei Patienten mit Asthma, HLH, Leukämien oder Lymphomen. [36, 50] 1.7 Interferon gamma Interferon gamma (IFNg) ist ein Typ II Interferon, das bereits 1965 erstmals in PHAaktivierten Lymphozyten identifiziert wurde. Es wurde ursprünglich als Molekül mit antiviraler Aktivität definiert. Biologisch aktives IFN g ist ein nicht-kovalentes 34 kDa Homodimer, das vor allem von aktivierten T-Zellen und NK-Zellen sezerniert wird. [27]In T-Zellen, vor allem in CD4+Zellen vom TH1-Typ und CD8+-Zellen vom TC1-Typ wird die IFNg-Produktion durch die Bindung des T-Zell-Rezeptors (TCR) induziert. In den NK-Zellen stimulieren makrophagentypische Zytokine wie TNFa und IL-12 die Sekretion von IFN g. [13] Neben der ursprünglichen antiviralen Aktivität wurden IFNg noch verschiedene andere Regulationsmechanismen für die Immunantwort zugeschrieben. Durch IFNg wird in B-Zellen die LPS-induzierte B-Zellproliferation, wie auch die Produktion von IgG1 und IgE unterdrückt. Dies führt zu einem Ungleichgewicht der Produktion von Ig-Subtypen. [86] 14 1 Einleitung Welcher T-Helferzell-Phänotyp im Organismus vorherrscht, wird im Wesentlichen durch zwei Zytokine bestimmt. Dies ist zum einen IFNg, zum anderen IL-4. IFNg fördert dabei die Entwicklung von IFNg und IL-2-produzierenden TH1-Zellen und blockiert gleichzeitig das Wachstum der TH2-Population. [27]Diese TH1-Antwort ist assoziiert mit der zellvermittelten Immunität und wird durch intrazelluläre Bakterien und Protozoen induziert. Durch die Sekretion von IFN γ wird eine proinflammatorische Immunantwort ausgelöst. [13]Das Gleichgewicht dieser beiden Zelltypen ist entscheidend für Rekonvaleszenz oder Fortschreiten einer Erkrankung. [86] IFNg allein kann ebenfalls die Apoptose von T-Zellen induzieren, was jedoch durch IL-2, welches normalerweise parallel mit IFNg im Organismus vorkommt, blockiert wird. Weiterhin induziert IFNg die Expression von IL-2R auf aktivierten T-Zellen. [86] In erster Reihe bei der Immunantwort stehen die Monozyten/Makrophagen. Für sie scheint IFNγ als makrophagenaktivierender Faktor in der Zirkulation zu fungieren. Dies ruft die Aktivierung verschiedener Makrophagenfunktionen hervor, wie z.B. Tumorzellzytotoxizität, antimikrobielle Aktivität, vermehrtes Abtöten intrazellulärer Pathogene und die Antigenprozessierung und-präsentierung gegenüber Lymphozyten. [86] Bei polymorphkernigen Neutrophilen (PMN) löst IFNg eine gesteigerte Phagozytose und Zytotoxizität aus. [86] 1.8 Fragestellung Bei der Sepsis werden in hohem Maße pro- und auch antiinflammatorische Zytokine freigesetzt. Diese Immundefektsyndroms Hyperzytokinämie assoziiert sein kann und mit beeinflußt der die Entwicklung Differenzierung eines von dendritischen Zellen. Analog zu dieser Situation kennt man bei Kindern die hämophagozytische Lymphohistiozytose (HLH), bei der es, genetisch oder infektbedingt, zu einer Überaktivierung von T-Zellen und vermutlich auch dendritischen Zellen kommt. Im Rahmen dieser Überaktivierung können die DC eine Anämie, eine Leukozytopenie und eine Thrombozytopenie hervorrufen, indem sie in Leber und Milz als Histiozyten hämatopoetische Zellen phagozytieren. Bei der HLH werden hohe Spiegel an lymphoiden Vorläufer-DC bereits im Blut nachgewiesen. [74] Nachdem es laut Bone et al. auch bei der Sepsis zu Hyperzytokinämien sowohl pro- als auch antiinflammatorischer Zytokine kommen kann, beschäftigt sich diese Arbeit mit der 15 1 Einleitung Frage, ob analog zur HLH auch bei der Sepsis dendritische Zellen im Blut vorkommen und ob diese eine entscheidende Rolle bei Immunantwort spielen. Dazu wurde über einen Zeitraum von 6 Monaten von Patienten der Anästhesiologischen Intensivstation im septischen Schock täglich eine Blutprobe entnommen und auf spezifische Oberflächenantigene und Zytokine untersucht. 16 2 Material und Methoden 2 2.1 Bei Material und Methoden Patientengut den untersuchten Patienten handelte es sich um postoperative, intensivtherapiepflichtige Patienten der Anästhesiologischen Intensivstation der Uniklinik Ulm, welche in Tabelle 1 aufgelistet sind. Als Einschlusskriterien galten das Vorliegen einer schweren Sepsis mit einem hohen Risiko für einen septischen Schock, eines septischen Schockes und eine Liegedauer von mehr als 3 Tagen. Ausgeschlossen wurden Patienten mit immunmodulatorischen Medikamenten wie z. B. GCSF, Zytostatika oder ein Alter unter 18 Jahre. Als Negativkontrolle wurde von 12 gesunden Probanden im Alter zwischen 20 und 52 Jahren jeweils einmal venöses Blut abgenommen und untersucht. Tabelle 1: Patientengut Nr. 1 Alter Geschlecht Outcome Messdauer Hauptdiagnose Komplikationen 58 m=männlich g=gestorben in Tagen w=weiblich ü=überlebt m g 7 frei rupturiertes hämorrhagischer BAA Schock, Massentransfusion 2 79 m ü 5 mediastinales intraoperativ Sarkom diffuse Blutung aus hinterem und unterem Mediastinum 3 72 m ü 8 Magenulcus, obere GIBlutung 17 2 Material und Methoden Nr. 4 Alter Geschlecht Outcome Messdauer Hauptdiagnose Komplikationen 69 m=männlich g=gestorben in Tagen w=weiblich ü=überlebt w g 12 COPD, art. SaO2-Abfall bei Hypertonie, Z.n. Tubusfehllage UL-Resektion bei BronchialCa 5 66 m ü 6 pulmonale Fistel 6 73 m ü 30 Mediastinitis, septischer Schock Pleuraempyem 7 72 m ü 9 Platzbauch Pneumonie, akutes Nierenversagen 8 55 m ü 9 nekrot. septische Pankreatitis, Einschwemmung respiratorische Insuffizienz 9 34 w ü 13 Ileumfistel mit respiratorische Psoasabszeß bei Insuffizienz M.Crohn 10 68 m ü 9 Rektum-Ca substitutionsbedürft ige Nachblutung 11 69 w g 16 septische Hüfte septische bds. 12 65 w g 4 Einschwemmung retroperitoneales akutes Hämatom bei intermittierender TAA 18 Nierenversagen, 2 Material und Methoden Nr. 13 Alter Geschlecht Outcome Messdauer Hauptdiagnose Komplikationen 73 m=männlich g=gestorben in Tagen w=weiblich ü=überlebt m g 9 gedeckt septischer Schock rupturiertes infra- und suprarenales BAA 14 55 m ü 11 Darmperforation 4 Qu.-Peritonitis, septische Einschwemmung 15 16 68 68 m w g ü 11 32 Sturz mit hypovolämischer Extremitäten- Schock, akutes Frakturen Nierenversagen Barrett-Ca des Ösophagus 17 47 m ü 25 Rektumperforati Becken-und on Flankenphlegmone 18 55 m ü 12 Ösophagus-Ca 19 58 w ü 21 Fraktur BWK 7, sensibler Spondylodiszitis Querschnitt, SaO2 20 64 m ü 19 , beginnender unter Raumluft: Querschnitt 88% Anastomosenin- Z.n. 4 Qu.suff. nach Peritonitis, sept. Sigmaresektion Schock mit MOF 21 23 m ü 11 Bronchial-Ca PseudomonasPneumonie 22 78 w g 15 frei rupturiertes, hämorrhagischer infrarenales BAA Geschlecht: m = männlich, w = weiblich; outcome: ü = überlebt, g = gestorben; 19 Schock, MOF 2 Material und Methoden 2.2 Datengewinnung DC 2.2.1 2.2.1.1 Durchflusszytometrie Probengewinnung Die Blutentnahme erfolgte täglich um 10 Uhr ± 1h über eine arterielle Kanüle. Zunächst wurden 2ml Blut abgezogen und verworfen, um Verdünnungsfehler auszuschließen. Anschließend wurde eine Monovette (2,7ml) der Firma Becton-Dickinson, die als Antikoagulanz K-EDTA enthielt, befüllt und mit einem Patientenaufkleber gekennzeichnet. Bis zur endgültigen Verarbeitung wurden die Proben auf Eis gelagert. 2.2.1.2 Probenaufbereitung Ziel der Analyse war es, die Leukozyten aus dem Patientenblut zu isolieren und spezifische Oberflächenantigene mittels Farbstoff-markierter Antikörper im Durchflußzytometer messbar zu machen. Materialien zur Gewinnung und Markierung der Leukozyten: • 5ml Polystyrol-Rundbodenröhrchen der Firma Becton-Dickinson • Pipetten der Firma Eppendorf • Zentrifuge: Heraeus Sepatech Megafuge 1.0 R • Vortexgerät der Firma Juchheim zum Aufschütteln der Antikörperröhrchen • FACS Lysing Solution der Firma Becton Dickinson 10fach konzentriert; Verdünnung 1:10; 1ml Lyselösung auf 10ml Aqua dest. • Waschpuffer zur Erhöhung der Probestabilität: PBS Dulbecco´s + BSA 0,1% + Acid (NaN3) 0,1% Waschvorgang: 2 ml Waschlösung zugeben, mischen, zentrifugieren, Überstand abpipettieren • verwendete Antikörper siehe Tabelle 2 20 2 Material und Methoden Tabelle 2: Angaben zu den verwendeten Antikörpern Isotypen Klon Andere Isotyp Bezeichnungen Antigen- Hersteller exprimierende Zellen IgG1 679.1Mc7 unspezifische Coulter Bindung an FcTeil IgG2a U7.27 unspezifische Coulter Bindung an FcRezeptoren FITCmarkierte Antikörper antiCD25 ACT –1 Tac, IL2- IgG1, kappa aktivierte α- Rezeptor Zellen, T- DAKO B- Zellen, Kette Monozyten antiCD86 B-T7 B7.2, FUN-1, IgG1 GR65 Monozyten, aktivierte Diaclone B- Zellen, unreife dendritische Zellen PE-markierte Antikörper antiCD2 MT 910 T11, LFA-2 IgG1, kappa T-Zellen, NK- DAKO Zellen. Thymozyten Zunächst wurde eine Kombination aus je 5 µl FITC (Fluoresceinisothiocyanat)- und R-PE (Red Phycoerythrin)-markierten Antikörpern in jedes, mit dem Namen des Patienten beschriftete, Röhrchen pipettiert, 100 µl Patientenblut zugegeben, gevortext und für 25 min in 4°C kaltem Eiswasser inkubiert. Die Erythrozytenlyse erfolgte anschließend durch Zugabe von je 1ml verdünntem Lysereagenz für 10 min. 21 2 Material und Methoden Es folgten Zentrifugation (1000U/min für 5min bei 4°C) und Absaugen des Überstandes. Um eventuelle Reste der Erythrozytenlyse zu beseitigen und das Signal-zu-RauschVerhältnis der Antikörpermarkierung zu verbessern, wurden zwei Waschvorgänge durchgeführt. Dabei wurde in jedes Röhrchen je 2ml Waschpuffer gegeben, gevortext, zentrifugiert und anschließend der Überstand abgesaugt. Nach Wiederholung dieses Vorganges wurde mit je 400 µl Waschpuffer resuspendiert. 2.2.1.3 Messung Die durch die Aufbereitung erhaltenen Proben wurden unmittelbar danach mit dem Fluorescence Activated Cell Sorter FACSCalibur der Firma Becton Dickinson gemessen. Dieses Verfahren beruht auf der simultanen Analyse von Fluoreszenzsignalen im Vorwärtsstreulicht (Zellgröße), Seitwärtsstreulicht (Zellgranularität) und bis zu vier verschiedenen Fluoreszenzsignalen hydrodynamisch fokussierter Zellen in Einzelzellsuspensionen, die sequentiell an einem Messpunkt vorbeigeführt werden. Als Fluorochrome wurden Fluorescein-Isothiocyanat (FITC) und Red-Phycoerythrin (R-PE) eingesetzt, welche bei einer Wellenlänge von 488nm angeregt werden, jedoch unterschiedliche Emissionswellenlängen aufweisen und deshalb zur Mehrfarbenanalyse geeignet sind. Als Software wurde für Analyse und Auswertung, wie von Becton Dickinson empfohlen, CellQuest™ version 3.0 für Macintosh verwendet. Vor der eigentlichen Messung wurden zur Justierung der Instrumenteneinstellung, zur Überprüfung der Instrumentenempfindlichkeit und zur Einstellung der Fluoreszenzkompensation über die Software FACSComp™ Mikropartikel („beads“), in diesem Fall CaliBRITE Beads der Firma Becton Dickinson, gemessen. An diese Qualitätssicherung anschließend wurde die Probenmessung in folgender Reihenfolge vorgenommen: • Leerwert • Isotyp • CD86 FITC/CD2 PE • CD25 FITC/CD2 PE 22 2 Material und Methoden Um die Messergebnisse richtig interpretieren zu können, wurden vor der Messung der spezifischen Antikörper so genannte Isotypen (siehe Tabelle 2) gemessen. Das sind farbmarkierte, monoklonale Antikörper, die unspezifisch an hämatopoetische Zellen binden können. Dafür wurden die Proben in der dafür vorgesehenen Halterung platziert und die Messung gestartet. Zur Überprüfung der Messung bediente man sich eines Punktehistogramms (dot plots), das die Zellen auf der x-Achse nach Größe und auf der y-Achse nach Granularität trennt. Um den Zellschrott auszugrenzen, wurde und diesen dot plot ein Fenster (gate) gelegt, das als R1 bezeichnet wurde. Die Messung wurde automatisch beendet, wenn in diesem gate 10.000 Ereignisse gezählt wurde. Abb. 1: Punktehistogramm: Vorwärtsstreulicht = x-Achse, Seitwärtsstreulicht = y-Achse, zur Ausgrenzung des Zellschrotts = R1, Lymphozyten = Lym, Monozyten = Mon, Granulozyten = GRA Auswertung der Messdaten Die Auswertung der Messergebnisse erfolgte über zweiparametrige, logarithmische Darstellungen in Punktehistogrammen, den so genannten dot plots. Bei diesen wurde die Intensität der Fluoreszenz 1 (FL-1 entspricht FITC) auf der x-Achse und die Fluoreszenz 2 (FL-2 entspricht R-PE) auf der y-Achse aufgetragen. Zunächst wurde in das Punktehistogramm des Isotypen ein Fadenkreuz gelegt, welches den Isotyp im linken unteren Quadranten gegenüber den antigenpositiven Zellen abgrenzen sollte. Dieses Fadenkreuz wurde für alle anderen Messungen für den entsprechenden Patienten nicht wieder verändert. 23 2 Material und Methoden Abb. 2: Isotyp: Punktehistogramm, FL1 = x-Achse, FL2 = y-Achse Um Aussagen über die für die Arbeit wesentlichen Zellpopulationen treffen zu können, wurden diese durch weitere „gates“ eingegrenzt und mit Rx bezeichnet. Die in diesen gates gezählten Ereignisse wurden dann von der software in die relative Anzahl bezogen auf alle gezählten Ereignisse umgerechnet. Diese Daten sind ebenfalls auf dem Messprotokoll abgebildet. Für diese Arbeit relevant war die Ak-Kombination antiCD 86FITC/antiCD 2PE und antiCD25FITC/antiCD2 PE. Abb. 3: CD86/CD2: Punktehistogramm, CD86 = x-Achse, CD2 = y-Achse, DC = CD86 und CD2 doppelt positive Zellen = dendritische Zellen 24 2 Material und Methoden Abb. 4: CD25/CD2-Punktehoistogramm: CD25 = x-Achse, CD2 = y-Achse, DC = CD25/CD2 doppelt positive Zellen = dendritische Zellen 2.3 Datengewinnung Zytokine Die Zytokinmessungen für sIL-2R und IFNγ wurden von Mitarbeitern des Labors für Experimentelle Anästhesiologie an der Universitätsklinik Ulm durch ELISA durchgeführt. Dabei wurde für sIL-2R der Testkit der Firma Immulite und für IFNg der OptEIATest für sandwich ELISA der Firma Pharmingen verwendet. Beim ELISA handelt es sich um heterogenes Testverfahren, bei dem die gegen das zu bestimmende Antigen gerichteten spezifischen Antikörper an eine Trägersubstanz gebunden vorliegen. An diese Antikörper lagern sich nach Inkubation mit der Probe die zu detektierenden Antigene an, die anschließend durch Enzym-markierte Antikörper nach Substratzugabe sichtbar gemacht werden können. Im Photometer kann so der Farbumschlag gemessen und die Konzentration des Antigens in der Probe berechnet werden. [77] 2.4 Datengewinnung klinisch-chemische Parameter Die Leukozyten- und Thrombozytenwerte wurden im Rahmen der täglichen Routineuntersuchung der Anästhesiologischen Intensivstation im Zentrallabor der Uniklinik Ulm gemessen. Normwerte: Leukozyten: 4,3 bis 10,8 G/l Thrombozyten: 150 bis 350 G/l 25 2 Material und Methoden 2.5 Statistische Auswertung und Ethikkommission Für die statistischen Analysen wurde das Programm SPSS 10.0 for Windows verwendet. Die Unterschiede zwischen den beiden Gruppen wurden über den t-Test für unabhängige Stichproben berechnet. Bei den Verlaufsdarstellungen der Gruppe DC konnten keine statistischen Tests angewendet werden, da in diesem Fall die Fallzahl zu gering war. Für die Verlaufswerte der Patienten der Gruppe DC konnte für die einzelnen Tage kein statistischer Test angewendet werden, da die Fallzahl mit n=3 bzw. n=4 zu gering war. Vor Beginn der Studie wurde das Vorhaben von der Ethikkommission genehmigt. 26 3 Ergebnisse 3 Ergebnisse 3.1 3.1.1 Vorkommen dendritischer Zellen Allgemeines Die Darstellung der Ergebnisse erfolgte zum einen durch Diagramme, bei denen auf der xAchse die Messtage und auf der y-Achse die CD86+/CD2+- Werte in % positiven aufgetragen wurde. Zum anderen wurden Vergleichs- und Verlaufswerte als boxplots dargestellt. Auf der x-Achse wurde bei Vergleichdarstellungen die Gruppe, bei Verlaufsdarstellungen die Zeit in Tagen aufgetragen und auf der y-Achse die jeweiligen Werte für CD86+/CD2+, sIL-2R, IFNg, Leukozyten und Thrombozyten in den entsprechenden Einheiten. Als Tag 1 wurde der 1. Tag der schweren Sepsis oder des septischen Schockes definiert. 3.1.2 Bei Normalspendern Bei den 12 gesunden Normalspendern lag die relative Häufigkeit CD86+/CD2+-Zellen zwischen 0,11 und 0,96%. Es ergab sich ein Mittelwert von 0,37%. 3.1.3 Bei Patienten Es wurden insgesamt 22 Patienten in die Studie mit aufgenommen, die über einen Zeitraum von 14 Tagen beobachtet wurden. Bei der Auswahl der Gruppen hat man sich an den Werten für die Normalspender orientiert. Dabei wurde festgestellt, dass man die Patienten nach ihren CD86+/CD2+-Werten in 2 Gruppen aufteilen kann. Gruppe 1 umfasst 18 Patienten, bei denen weniger als 3 Messwerte für CD86+CD2+ über 1% lagen. Diese Gruppe wird im weiteren Verlauf des Textes als nonDC bezeichnet. 27 3 Ergebnisse Verlauf von CD86/CD2 bei nonDC % pos 6 5 4 3 2 1 0 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 Tage Abb. 5: Verlauf des Anteils an CD86/CD2 doppelt positiven Zellen während der ersten 14 Tage nach Eintritt in den septischen Schock, dargestellt in Einzelverläufen, bei nicht CD86/CD2-positiven Patienten, n=18 In Gruppe 2 befinden sich 5 Patienten, bei denen mindestens 3 Messwerte über 1% lagen. Die Anzahl der Messwerte über 1% schwankt dabei zwischen 20 und 95,6%. Der Einfachheit halber wird diese Gruppe als DC bezeichnet. Verlauf von CD86/CD2 bei DC % pos 6 5 4 3 2 1 0 D1 D2 D3 D4 D5 D6 D7 D8 Tage D9 D10 D11 D12 D13 D14 Abb. 6: Verlauf des Anteils von CD86/CD2 doppelt positiven Zellen während der ersten 14 Tage nach Eintritt in den septischen Schock, dargestellt in Einzelverläufen, bei DC-positiven Patienten, n=5 28 3 Ergebnisse Vergleicht man nun die Gruppe nonDC mit der Gruppe DC, zeigt sich ein deutlicher Unterschied zwischen den beiden Gruppen. Dieser Unterschied ist auch statistisch signifikant. 6 CD86/CD2 in % pos 5 4 3 2 1 0 N= 180 57 nonDC DC Gruppe Abb. 7: Vergleich aller gemessenen Werte von CD86/CD2 von DC- und nonDC-Patienten, n=Fallzahl Betrachtet man nun die Gruppe DC im Verlauf, steigen die Werte für CD86/CD2 von Tag 1 auf Tag 4 deutlich an und fallen dann bis zum Ende des Beobachtungszeitraumes fast stetig ab. Im Vergleich zur Kontrollgruppe ist nur der Wert an Tag 1 etwas niedriger, sonst zeigen sich deutlich höhere Werte. 29 3 Ergebnisse 6 CD86/CD2 in % pos 5 4 3 2 1 0 N= 3 4 4 4 4 4 4 4 4 4 4 4 3 3 12 1 2 3 4 5 6 7 8 9 10 11 12 13 14 K Tage Abb. 8: Darstellung des Verlaufs der CD86/CD2 doppelt positiven Werte während der ersten 14 Tage nach Eintritt in den septischen Schock, n=Fallzahl 3.2 Typische HLH-Parameter bei Sepsispatienten Da es Hinweise darauf gibt, dass bei Sepsispatienten HLH-ähnliche Zytokinmuster auftreten können, wurden zusätzlich zur FACS-Messung noch sIL-2R, IFNg, Leukozyten und Thrombozyten untersucht. 3.2.1 sIL2-R Vergleicht man die sIL-2R-Werte von nonDC mit denen von DC-Patienten, zeigen sich Unterschiede, die jedoch nicht signifikant sind. 30 3 Ergebnisse 4000 sIL-2R in U/ml 3000 2000 1000 0 N= 58 50 nonDC DC Gruppe Abb. 9: Vergleich aller sIL-2R- Werte von DC- und nonDC-Patienten, n=Fallzahl Um die Bedeutung der erhöhten sIL-2R- Werte zu klären, wurde zusätzlich, mittels FACSMessung, der membrangebundene IL-2R (mCD25) auf aktivierten T-Zellen über die AkKombination CD25/CD2 untersucht. Dabei wurde festgestellt, dass mCD25 sowohl bei nonDC als auch bei DC im Vergleich zur Kontrollgruppe deutlich herunterreguliert wurde. 31 3 Ergebnisse 5 CD25/CD2 in % pos 4 3 2 1 0 N= 175 52 12 nonDC DC Kontrolle Gruppe Abb. 10: Vergleich des Anteils der CD25/CD2 doppelt positiven Zellen zwischen nonDC, DC und einer gesunden Kontrollgruppe, n = Fallzahl 3.2.2 IFNg Betrachtet man sich die Mittelwerte für IFNg, zeigt sich kein eindeutiger Unterschied zwischen der Gruppe nonDC und der Gruppe DC. 32 3 Ergebnisse 50 IFN gamma in pg/ml 40 30 20 10 0 N= 169 56 nonDC DC Gruppe Abb. 11: Vergleich der IFNg-Werte von nonDC und DC-Patienten, n=Fallzahl 3.2.3 Leukozyten Bei den Leukozytenwerten zeigt sich, dass das Niveau bei nonDC mit einem Median von 20 pg/ml (entspricht 1U/ml) höher ist als bei DC. Dieser Unterschied ist auch statistisch signifikant (p<0,05) 33 3 Ergebnisse 40 Leukozyten in G/l 30 20 10 0 N= 180 57 nonDC DC Gruppe Abb. 12: Vergleich aller Leukozytenwerte von nonDC- und DC-Patienten, n=Fallzahl Betrachtet man sich nun den Verlauf der Leukozyten bei DC, sieht man, dass die Werte zu Beginn des septischen Schockes zunächst bis Tag 3 deutlich abfallen und sich dann auf einem konstanten Niveau zwischen ca. 9 und 11 G/l bewegen. 40 Leukozyten in G/l 30 20 10 0 N= 3 4 4 4 4 4 4 4 4 4 4 4 3 3 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Tage Abb. 13: Darstellung des Verlaufs der Leukozytenwerte in G/l während der ersten 14 Tage nach Eintritt in den septischen Schock, n=Fallzahl 34 3 Ergebnisse 3.2.4 Thrombozyten Für die Thrombozytenwerte zeigten sich deutliche Unterschiede zwischen den beiden Gruppen, wobei der Mittelwert für die Gruppen nonDC höher liegt als der für DC. 600 Thrombozyten in G/l 500 400 300 200 100 0 N= 180 57 nonDC DC Gruppe Abb. 14: Vergleich aller Thrombozytenwerte der Gruppe nonDC und DC, n=Fallzahl Der Verlauf der Thrombozytenwerte beginnt mit einem Wert von etwas über 100 G/l und steigt dann langsam bis zu Tag 11 an. Es folgt ein Abfall bis Tag 14, der etwa bis zum Niveau von Tag 7 reicht. 35 3 Ergebnisse 700 Thrombozyten in G/l 600 500 400 300 200 100 0 N= 3 4 4 4 4 4 4 4 4 4 4 4 3 3 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Tage Abb. 15: Darstellung des Verlaufs der Thrombozytenwerte in G/l während der ersten 14 Tage nach Eintritt in den septischen Schock, n=Fallzahl 36 3 Ergebnisse 3.3 Falldarstellung DC-Patienten 3.3.1 Fall 1 CD86+/CD2+ % pos 86+/2+ 6 5 4 3 2 1 0 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 Tage sIL-2R und IFN gamma sIL-2R U/ml 3000 IFN gamma pg/ml 90 2500 75 2000 60 1500 45 1000 30 500 15 0 0 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 Tage Leukozyten und Thrombozyten laLemin laThmin G/l 40 G/l 800 30 600 20 400 10 200 0 0 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 Tage Abb. 16: Darstellung des Verlaufs von CD86/CD2, sIL-2R, IFNg, Leukozyten und Thrombozyten innerhalb der ersten 14 Tage des septischen Schockes bei Fall Nr.1 37 3 Ergebnisse Bei Fall 1 handelt es sich um Patient Nr.:19. Die Aufnahmediagnose war eine Fraktur von BWK 7. Im Verlauf entwickelte sich ein septischer Schock vermutlich aufgrund einer Spondylodiszitis. Die CD86+/CD2+-Werte über den gesamten Messzeitraum deutlich erhöht. Der höchste Wert von 5,69% fällt auf D1. Es folgt ein kontinuierlicher Abfall bis D5 mit anschließendem Wiederanstieg bis D11. Vergleicht man dazu den Verlauf von sIL-2R zeigen sich keine Parallelen im Vergleich zu CD86+/CD2+. Die Werte von sIL-2R bleiben relativ konstant zwischen 422 und 977 U/ml. Bei IFNg zeigt sich ein peak von 46,8 pg/ml an D7, der etwa mit dem ersten Minimalwert von CD86+/CD2+ zusammenfällt. Auch der zweite, etwas niedrigere, Anstieg von IFNγ (auf 32,9 pg/ml) am Ende der Messperiode fällt mit dem Abfall der CD86+/CD2+-Werte zusammen. Die Leukozyten- und Thrombozytenwerte beginnen parallel zueinander auf einem relativ niedrigen Niveau und steigen zum Ende des Beobachtungszeitraumes hin stetig auf Werte oberhalb des Normbereichs an. 38 3 Ergebnisse 3.3.2 Fall 2 CD86+/CD2+ 86+/2+ % pos 6 5 4 3 2 1 0 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 Tage sIL-2R und IFN gamma sIL-2R U/ml 3000 2500 2000 IFN gamma pg/ml 90 75 60 1500 1000 500 0 45 30 15 0 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 Tage Leukozyten und Thrombozyten Leukozyten Thrombozyten G/l 40 G/l 800 30 600 20 400 10 200 0 0 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 Tage Abb. 17: Darstellung des Verlaufs von CD86/CD2, sIL-2R, IFNg, Leukozyten und Thrombozyten innerhalb der ersten 14 Tage des septischen Schockes bei Fall Nr.2 39 3 Ergebnisse Fall 2 (Patient Nr.:20) ist ein 64-jähriger Mann mit Anastomoseninsuffizienz nach einer Sigmaresektion. Aufgrund einer 4-Quadranten-Peritonitis erlitt er einen septischen Schock mit Multiorgandysfunktion. Die Werte für CD86+/CD2+ befanden sich bis D11 im Normbereich und stiegen bis D14 auf einen Maximalwert von 1,89% an. Wie auch bei Fall 1 zeigen sich für sIL-2R Werte im Bereich zwischen 613 und 1036 U/ml, die im Verlauf nur geringen Schwankungen unterliegen. Die IFNg-Werte zeigen einen leichten Abfall an D5 und D6, sonst ist hier ebenfalls ein relativ konstanter Verlauf zwischen 17,2 und 31,9 pg/ml zu verzeichnen. Bei den Leukozyten- und Thrombozytenwerten zeigt sich wiederum ein paralleler Verlauf der beiden Parameter. Am Beginn des Messzeitraumes liegen die höchsten Werte (14,4 G/l bei Leukozyten und 500 G/l bei Thrombozyten). Dann fallen sie konstant ab und pendeln sich auf ein Niveau von etwa 200G/l bei Thrombozyten und 10 G/l bei Leukozyten ein. 40 3 Ergebnisse 3.3.3 Fall 3 CD86+/CD2+ % pos 86+/2+ 6 5 4 3 2 1 0 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 sIL-2R und IFN gamma sIL-2R IFN gamma U/ml pg/ml 3000 90 2500 75 2000 60 1500 45 1000 30 500 15 0 0 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 Leukozyten und Thrombozyten G/l Leukozyten Thrombozyten G/l 40 800 30 600 20 400 10 200 0 0 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 Abb. 18: Darstellung des Verlaufs von CD86/CD2, sIL-2R, IFNg, Leukozyten und Thrombozyten innerhalb der ersten 14 Tage des septischen Schockes bei Fall Nr.3 41 3 Ergebnisse Fall 3 entspricht Patient Nr. 21 und dabei handelt es sich um einen 21-jährigen Mann mit Bronchial-Ca, der an einer Pseudomonas-Pneumonie erkrankte und aufgrunddessen einen septischen Schock erlitt. Bei diesem Patienten liegen alle Werte mit Ausnahme des Wertes an D2 oberhalb des Normbereiches. Am Beginn des septischen Schockes liegen die Werte relativ knapp oberhalb der Norm und steigen dann bis D5 zum Maximalwert von 4,11% an. Es schließt sich ein kontinuierlicher Abfall der Werte bis auf den Ausgangswert an D12 an. Der Höchstwert für den sIL-2R liegt gleich zu Beginn des septischen Schockes an D2 mit 1892 U/ml. Anschließend fallen die Werte stetig bis D7 ab. IFNg beginnt wie sIL-2R mit einem Maximalwert von 61,7 pg/ml. Parallel zu sIL-2R folgt auch hier ein Absinken der Werte bis D7. Dann pendeln sich die Werte zwischen 10,4 und 13,3 pg/ml ein. Thrombozyten und Leukozyten verlaufen zu Beginn bis D6 parallel. Dabei steigen sie leicht von einem Niveau unterhalb der Norm (Leukozyten: 1,6 G/l und Thrombozyten: 81 G/l) auf Werte im Normbereich an. Während die Leukozyten dann konstant auf etwa dem gleichen Niveau bleiben, kommt es bei den Thrombozyten zu einem Anstieg ab D6 mit einem Höhepunkt an D9 (604 G/l). Es schließt sich ein Abfall der Werte bis zum Ende der Messperiode an. 42 3 Ergebnisse 3.3.4 Fall 4 CD86+/CD2+ 86+/2+ % pos 6 5 4 3 2 1 0 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 Tage sIL-2R und IFN gamma sIL-2R U/ml 3000 IFN gamma pg/ml 90 2500 75 2000 60 1500 45 1000 30 500 15 0 0 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 Tage Leukozyten und Thrombozyten Leukozyten Thrombozyten G/l 40 G/l 800 30 600 20 400 10 200 0 0 D1 D2 D3 D4 D5 D6 D7 D8 D9 D10 D11 D12 D13 D14 Tage Abb. 19: Darstellung des Verlaufs von CD86/CD2, sIL-2R, IFNg, Leukozyten und Thrombozyten innerhalb der ersten 14 Tage des septischen Schockes bei Fall Nr.4 43 3 Ergebnisse Bei Fall 4 handelt es sich um Patientin Nr. 22, bei der ein frei rupturiertes Bauchaortenaneurysma diagnostiziert wurde. Es entwickelte sich ein hämorrhagischer Schock mit Multiorganversagen. Die CD86+/CD2+-Werte sind zu Beginn des Beobachtungszeitraumes im Normbereich und steigen dann bis zu einem Wert von 2,18% an D5 an, um anschließend bis zum Ende der Messperiode wieder in den Referenzbereich abzusinken. Die Werte für sIL-2R beginnen auf einem niedrigen Niveau von 567 U/ml und steigen dann langsam bis D7 auf den Höchstwert von 1633 U/ml an. Es folgt ein Abfall auf Werte zwischen 978 und 1095 U/ml (mit Ausnahme von D10) bis zum Ende des Messzeitraumes. Bei IFNg ist zuerst ein Abfall der Werte von 30,0 pg/ml auf 19,3 pg/ml zu verzeichnen. Dieser ist gefolgt von einem Anstieg bis 78,0 pg/ml an D10. Es erfolgt ein weitere Abfall auf einen Wert von 25,8 pg/ml an D13. Die Leukozyten- und Thrombozytenwerte verlaufen annähernd parallel. Die Thrombozytenwerte liegen zu Beginn des septischen Schockes unterhalb des Normbereiches mit einem Minimalwert von 88 G/l an D2. Sie steigen dann bis zu einem Maximalwert von 327 G/l an D9 an, um anschließend wieder auf ein Niveau von etwa 200 G/l abzufallen. Bei den Leukozyten verhält es sich ähnlich. Der Beginn liegt jedoch oberhalb des Normbereiches und fällt zunächst auf einen Minimalwert von 9,5 G/l ab. Dann folgt ein starker Anstiegt auf einen Maximalwert von 32,7 G/l an D8. Es folgt ein Abfall auf Werte unterhalb des Ausgangsniveaus, die im Normbereich liegen. 44 4 Diskussion 4 4.1 Diskussion CD86/CD2 als Marker für APC Da es keinen spezifischen Marker gibt, der DC im Blut eindeutig identifizieren könnte und die DC, meist als unreife Vorläuferzellen, nur in sehr geringer Menge (0,01-1%) vorkommen, wurden in den letzten Jahren verschiedene Methoden entwickelt, um diese Probleme zu lösen. [20, 31, 59, 83] In der vorliegenden Studie kam es weniger darauf an, große Mengen an DC zu produzieren, als vielmehr Oberflächenmarker zu finden, die, allein oder in Kombination mit anderen Markern, DC eindeutig nachweisbar machen können. Außerdem ging es nicht nur darum, das Vorkommen von DC bei Patienten im septischen Schock nachzuweisen, sondern auch um den Verlauf der DC bei diesen Patienten über einen längeren Zeitraum. Man wählte daher als Messverfahren die Durchflusszytometrie, da dies ein relativ wenig aufwändiges Verfahren ist und eine leichte und schnelle Auswertung von Oberflächenmarkern in vitro zulässt. Es würde sich auch gut für einen eventuellen klinisch diagnostischen Einsatz eignen. Bisher hat man noch keinen adäquaten Marker zum Nachweis zirkulierender DC in vitro gefunden. Es wurde jedoch eine Koexpression von CD86 als Marker von dendritischen Zellen mit einer stark positiven CD 2 Expression identifiziert. [25]Aufgrund der folgenden Voraussetzungen bestand die Hypothese, dass man mit der Ak-Kombination CD86/CD2 zirkulierende dendritische Zellen mittels Durchflusszytometrie nachweisen könnte. CD86 als kostimulatorisches Molekül konnte auf DC regelmäßig nachgewiesen werden. [16, 52, 57, 64, 66, 80, 83]Dabei zeigte sich, dass CD86 sowohl auf unreifen als auch auf reifen DC vorhanden war. [20, 52, 83]Auch zwischen myeloiden und nicht-myeloiden DC zeigte sich lediglich ein Unterschied in der Quantität der Expression von CD86. Während auf myeloiden DC große Mengen an CD86 exprimiert wurden, war die Anzahl auf nichtmyeloiden DC deutlich geringer. [72] CD2 konnte neben T- und NK-Zellen auch auf Monozyten und DC nachgewiesen werden. Crawford et al konnte zeigen, dass sich frisch isolierte CD2+-Monozyten in ihrer Form und Oberfläche nicht von CD2--Monozyten unterscheiden. Nach Kultivierung zeigten die CD2+-Monozyten die typische Form dendritischer Zellen. Sie waren unregelmäßig 45 4 Diskussion - geformt mit prominenten dendritischen Fortsätzen, während CD2 -Monozyten eher rund bis oval waren und mehr wie typische Monozyten aussahen. [22] Takamizawa et al konnte bereits 1997 CD2+-DC-Vorläufer im peripheren Blut nachweisen. Er stützte sich dabei auf die Hypothese, die bereits von anderen [31, 58]verwendet wurde, nämlich, dass DC-Vorläufer in großer Menge HLA-DR exprimieren, aber zugleich für andere zelllinienspezifische Marker (siehe Kap. 1.2.) negativ sind. Er stellte fest, dass 75-95% dieser Zellen CD2 auf ihrer Oberfläche exprimieren. Wie auch bei Crawford et al waren die frisch isolierten Zellen, ob CD2+ oder CD2- rund und hatten keine dendritische Morphologie. Nach Kultivierung zeigten beide Zellpopulationen das typische Aussehen von DC wie unregelmäßige Form und dendritische Fortsätze. Bei den CD2+-Zellen waren jedoch die Fortsätze deutlich prominenter als bei CD2-. Zusätzlich konnte auch Takamizawa et al CD86 sowohl auf CD2+ als auch auf CD2- -DC nachweisen. [83]Bei Sepsis- und auch Histiozytosepatienten scheint CD2 stärker positiv zu sein als in T-Zellen. [73] In der Literatur wurden DC meist über die Eigenschaften isoliert, dass sie für HLA-DR stark positiv und für zelllinienspezifische Marker wie CD3 (T-Zellen), CD19/20 (BZellen), CD14 (Monozyten/Makrophagen) oder CD56/57 (NK-Zellen) negativ waren (im weiteren Verlauf des Textes mit lin- bezeichnet). [16, 20, 29, 31, 38, 51, 58, 66, 68, 69, 83] Wie bereits in der Einleitung erwähnt, wurden im Blut bisher zwei Subpopulationen dendritischer Zellen identifiziert, DC1 und DC2. Da für die vorliegende Arbeit nur die DCIdentifizierung aus dem peripheren Blut eine Rolle spielt, wird auf die Diskussion von Isolationsmethoden aus anderen Geweben verzichtet. Als typische Marker, um verschiedene DC-Untergruppen im peripheren Blut zu identifizieren, werden hauptsächlich CD11c und CD8α beschrieben. CD11c ist ein β2-Integrin, das auf myeloiden Zellen vorkommt. Borras et al, O’Doherty et al und Robinson et al konnten durch o.g. Isolationsmethode unter den DC zwei Subpopulationen unterscheiden, von denen die eine für CD11c positiv und die andere für CD11c negativ war. [16, 58, 66] Betrachtet man die Morphologie der frisch isolierten DC zeigte sich, dass CD11c- DC eher rund und mittelgroß mit ovalem Kern waren, CD11c+ DC dagegen waren weniger rund und leicht gewellt mit lobuliertem Kern. Nach Kultivierung mit GM-CSF und TNFα [66]oder monocyte-conditioned medium [58]kam es zur Vergrößerung der DC und es entwickelten sich dendritische Fortsätze bei CD11c+-Zellen, die wesentlich länger waren als die von CD11c--DC[58, 66]. Die Morphologie konnte also bestätigen, dass es sich bei 46 4 Diskussion - CD11c±HLA-DR+lin - Zellen um DC im peripheren Blut bzw. Nabelschnurblut handelt. [16, 58, 66] Phänotypisch exprimieren CD11c+ DC auf ihrer Oberfläche typische myeloide Marker wie CD13 und CD33. [20]Im Gegensatz dazu findet man auf der Zelloberfläche von CD11cDC keine myeloiden Marker, dafür zeigen diese eine stärkere Expression lymphoider Antigene wie CD4 und CD123 (IL-3R). [66] Aufgrund dieser morphologischen und phänotypischen Erkenntnisse stellte man die Hypothese auf, dass es sich bei den verschiedenen DC-Subpopulationen um DC aus verschiedenen Zelllinien handelt. CD11c+-DC stammen von myeloiden Vorläufern ab, während CD11c- -DC von plasmazytoiden Vorläufern abzustammen scheinen. [16, 20, 66] In Mäusen konnten zwei Subklassen von DC aufgrund ihrer CD8α-Expression differenziert werden. CD8α+-DC scheinen lymphoiden Ursprungs zu sein und exprimieren zusätzlich FasL auf ihrer Oberfläche. Dies schreibt ihnen die Fähigkeit zur Apoptose zu, was wiederum zur Toleranz des Immunsystems führt. CD8α- -DC, welche wohl myeloiden Ursprungs sind, besitzen die Fähigkeit, eine adäquate Immunantwort zu initiieren. Dies führt zur Aktivierung von T-Zellen. [53, 82] 4.2 Dendritische Zellen Im Blut kommen im Wesentlichen die unreifen Vorläuferzellen der DC vor. Deshalb ging es in der vorliegenden Studie um das Vorkommen und die Bedeutung dieser zirkulierenden precursor DC (pDC). Da myeloide und lymphoide DC von unterschiedlichen Zelllinien abzustammen scheinen, differenziert man auch verschiedene pDC im peripheren Blut. Die myeloiden pDC (pDC1) leiten sich einerseits von den myeloiden CD34+-Stammzellen des KM ab, können aber in vitro auch aus Blutmonozyten durch Zugabe von GM-CSF, IL-4 [80]bzw. TNFa [65]generiert werden. [8, 80] Vorläufer der lymphoiden pDC (pDC2) sind nach Rissoan, Grouard und Steinman CD4+CD3-CD11c- - plasmazytoide Zellen, die in ihrer Morphologie den antikörperproduzierenden Plasmazellen sehr ähnlich sind und sich von lymphoiden Stammzellen aus dem KM ableiten. Nach dem Aussehen haben sowohl pDC1 als auch pDC2 sehr viel Ähnlichkeit mit ihren Vorläufern. 47 4 Diskussion pDC1 sind morphologisch kleine runde bis ovale Zellen mit lobuliertem Kern entsprechend dem Aussehen von Monozyten. [58]Auch die Expression von bestimmten Oberflächenmarkern weist auf die Zugehörigkeit der pDC1 zur myeloiden Zelllinie hin. Sie exprimieren in hohem Maße CD11c, CD13 und CD33. [58, 80] Betrachtet man im Vergleich dazu die Morphologie und den Phänotyp von pDC2, findet man deutliche Unterschiede zwischen diesen beiden Subgruppen. pDC2 erscheinen unter dem Mikroskop als mittelgroße, runde Zellen mit ovalem, leicht eingedelltem Kern. [58, 66] Im Gegensatz zu pDC1 zeigen sich auf der Oberfläche von pDC2 keine oder nur wenige myeloide Marker. Stattdessen exprimieren pDC2 CD36 und CD123 (IL-3Rα). [20]Beide Subpopulationen exprimieren geringe Levels an CD40, CD80, CD86 und CD54 [20, 58, 80]und haben eine hohe Expression des MHC-II-Moleküls HLA-DR. Unreife DC kommen neben dem Blut auch noch in anderen Geweben, wie z.B. der Haut (Langerhans-DC), vor. In diesem unreifen Zustand besitzen DC viele Fcγ- und FcεRezeptoren zur Antigenaufnahme über Phagozytose und Endozytose, jedoch wenig akzessorische Signale für die T-Zellaktivierung, wie CD40, CD54, CD58, CD80 und CD86. Damit können sie zwar extrazelluläre Antigene aufnehmen, allerdings erfolgt keine Stimulierung von T-Zellen. Dies führt zunächst zur Toleranz und schützt den Organismus vor pathologischen Autoimmunprozessen. [54] Die Aktivierung der DC zur Reifung erfolgt über exogene (LPS, bakterielle DNA, virale dsRNA) oder endogene (Zytokine, Prostanoide, Adeninnukleotide) Stimuli. Diese Stimuli sind ausschlaggebend dafür, welche Subgruppe von DC bevorzugt an den Ort der Infektion angelockt werden. Hat die aktivierte unreife DC einmal ein Antigen aufgenommen, nehmen die antigenpräsentierenden Eigenschaften der pDC rasch ab und sie verlagern ihre Tätigkeit auf die Herstellung von MHC-II- Antigen-Komplexen, die nach der Antigenprozessierung an die Zelloberfläche transportiert und T-Zellen präsentiert werden. Dort verbleiben sie für mehrere Tage. Gleichzeitig mit der Antigenpräsentation an der Zelloberfläche von DC kommt es zur Erhöhung der Expression der kostimulatorischen Moleküle. [9] Mit der Aktivierung wandern DC vom Ort der Entzündung über das Blut und die afferente Lymphe in Milz und Lymphknoten. Aus diesem Zusammenhang ist erklärlich, warum reife DC nicht im peripheren Blut nachweisbar sind. Damit unterscheiden sie sich von Monozyten/Makrophagen, die einen Anteil von etwa 5-10 % aller zirkulierender Leukozyten ausmachen (FSC/SSC). DC binden im Lymphknoten über MHC-II-Moleküle 48 4 Diskussion an den TCR und mit ihren kostimulatorischen Molekülen an die jeweiligen Liganden (CD28/CTLA-4 für CD80/CD86, CD11a/CD18 für CD54, CD2 für CD58 und CD40L für CD40), was zur Aktivierung der T-Zellen führt. Durch MHC-II auf DC werden vor allem T-Helfer-(TH)Zellen aktiviert. Dabei unterscheidet man ebenfalls zwei Subpopulationen, TH1 und TH2. Rissoan et al konnte nachweisen, dass DC1 zu einer überwiegenden Entwicklung von TH1 führen, während DC2 für die Stimulation von TH2 verantwortlich sind. [65]Diese Tatsache scheint darauf zurückzuführen zu sein, dass DC1 in großer Menge IL-12 produzieren und damit die Entwicklung von TH1-Zellen bevorzugt auftritt. [24, 43]Für die TH2-Entwicklung scheint es laut Rissoan et al und Kalinski et al kein spezifisches Zytokin zu geben. [48, 65]Kalinski entwickelte daraus die Hypothese, dass es verschiedene Faktoren gibt, die die IL-12-Produktion reduzieren und es so zur Entwicklung von TH2 kommt. [48] Als Konsequenz müsste man bei der schweren Sepsis bzw. dem septischen Schock und einer entsprechend hohen Infektionsrate eine proinflammatorische und im Fortgang der Erkrankung eine antiinflammatorische Reaktion im lymphatischen Gewebe finden. Efron weist in diesem Zusammenhang auch darauf hin, dass es durch das Fehlen von MHC-IIRezeptoren auf DC zu einer nur geringen oder keiner Kostimulation und in der Folge zu einer anergen Immunitätslage kommt, wodurch die DC in einem unreifen Status verbleiben. Dieser Immundefekt bzw. DC-Defekt geht mit einer erhöhten Plasmakonzentration von IL10 einher. [26]Nach Untersuchungen von Cottrez et al führt dies zur Differenzierung von TH-Zellen in regulatorische T-Zellen (Tr), die für CD4 und CD25 positiv sind [21]und die Immunantwort in vivo modulieren. Bei Sepsis (Abb.10)wie auch bei HLH-Patienten [73]konnte neben der vermehrten Anzahl an CD86/CD2 positiven Zellen eine Verminderung CD25 positiver Zellen nachgewiesen werden. Bei der HLH ist der vermehrte Nachweis von CD86/CD2 positiven pDC im Blut mit einer unvollständigen Aktivierung von TH1-Zellen assoziiert. Es kommt ausschließlich zur Aktivierung von TH0-Zellen. [74]Es wäre wichtig, in diesem Patientengut die IL10Plasmakonzentration nachzuuntersuchen. Erstmalig zeigt diese Arbeit, dass DC-Differenzierungsdefekte bei Sepsis nachgewiesen werden können und mit einem neuen Phänotyp charakterisiert werden können, der für CD86/CD2 positiv, aber für CD80/CD2 negativ ist. In der gesunden Immunantwort produzieren die TH1-Zellen vor allem IFNg und IL-2. In dieser Arbeit waren nur einzelne Patienten für die IFN γ-Plasmakonzentrationen positiv (Abb.11). Eine eindeutige Zuordnung zur Prävalenz von CD86/CD2 positiven Zellen 49 4 Diskussion konnte nicht hergeleitet werden. Das Resultat der ineffizienten DC-Differenzierung bei Sepsispatienten würde nicht dazu führen, dass zytotoxische Effektorzellen (CTL, NKZellen) aktiviert werden. Auch eine B-Zell-vermittelte Produktion von IgM, IgG und IgA würde nur unzureichend unterstützt werden. [67]Von TH2-Zellen werden bevorzugt antiinflammatorische Zytokine wie IL-4, IL-5 und IL-13 freigesetzt. Romagnani konnte für TH2-Zellen nur eine geringe zytolytische Aktivität (18%) gegenüber TH1-Zellen (77%) nachweisen. Die Funktion der TH2-Zellen beruht im Wesentlichen auf der Induktion der Produktion von IgA, IgM, IgG und vor allem IgE. [67] Bei den Patienten der vorliegenden Studie kann man nach der CD86/CD2-Expression zwei Gruppen unterscheiden. Die Gruppe nonDC (n=18) umfasst drei Untergruppen, nämlich die Gruppen CD86-/CD2-, CD86+/CD2- und CD86-/CD2+. In der Gruppe der DC (n=4) waren beide Marker positiv (CD86+/CD2+). Diese Zellgruppe zeigte eine starke Intensität für CD2 (mean intensity: 968.3) und eine eher schwächere Intensität (mean intensity: 35,91) für CD86. Bei der Gruppe DC konnte diese Studie eine relative Anzahl von bis zu 5,69% der CD86+/CD2+-Zellen nachweisen. Normalspender und nonDC lagen bei < 1%. Jetzt stellt sich natürlich die Frage, um welche DC-Subgruppe es sich dabei handelt, warum gerade bei dieser Patientengruppe eine größere Anzahl dieser Zellen vorkommt und welche Konsequenz dies für die Immunantwort haben könnte. Bei den HLH-Patienten konnten Schäfer et al zeigen, dass CD86+/CD2+-Zellen dort ebenfalls vorkommen und bis zu 50% der zirkulierenden Lymphozyten ausmachen. Dabei unterscheidet sich auch das Expressionsmuster deutlich von dem der Sepsispatienten. Man kann eine höhere mittlere Intensität für CD86 feststellen, während die Intensität für CD2 ungefähr gleich bleibt. Bisher ist bekannt, dass es bei der HLH zur Defizienz der NK-Zellen gegen MHC-negative Zielzellen kommt. [46]Eine mögliche Ursache dafür könnte die Nichtexpression von Effektormolekülen der zellulären Zytotoxizität (wie z.B. Perforin[81]oder auch Granzymen) sein. Dies kann entweder vererbt (FHL) oder eine vorübergehende Störung (IAHS) sein. [46]Weiterhin könnte die NK-Zellanergie aus einem Defekt der DC resultieren. [75]Dies geschieht vor allem, wenn DC als APC sich im Wesentlichen mit der Phagozytose apoptotischer und überalterter Zellen beschäftigen und dadurch keine TZellaktivierung erfolgt. [46]Dies führt zur Toleranz der zellulären Immunantwort bzw. zur Anergie. Nimmt man letztere Theorie, so würde es bei HLH-Patienten zu einer deutlichen Vermehrung der DC kommen. Dies würde eine anerge Immunantwort zur Folge haben. Überträgt man diese Theorie auf die Studienpatienten, sieht man eine deutlich geringere 50 4 Diskussion Anzahl an DC und es ist sehr unwahrscheinlich, dass es ausschliesslich über diesen Mechanismus zu einer ausgeprägten antiinflammatorischen Immunitätslage kommt. 4.3 Wertigkeit der untersuchten Histiozytose-Parameter für Patienten mit septischem Schock Um zu überprüfen, ob es, trotz der geringen Anzahl an DC, zu ähnlichen pathophysiologischen Reaktionen kommt wie bei der HLH, hat man einzelne Parameter ausgewählt und untersucht. 4.3.1 sIL-2R In Abb. 5.2.1.1. sind die Ergebnisse der sIL2R-Plasmaspiegel zusammengefasst. Es lassen sich Unterschiede in der Höhe der Plasmaspiegel zwischen der Gruppe DC und nonDC feststellen. Die sIL-2R-Plasmaspiegel lagen bezüglich der Referenzwerte von Komp (80600 U/ml) zu 70,9% oberhalb der Norm. Trotzdem waren sie deutlich niedriger als bei HLH-Patienten. [73]Durchschnittlich fand sich bei nonDC ein Wert von 1441,79 U/ml und bei DC von 1630,82 U/ml, wobei der Maximalwert unter allen Patienten bei 3836 U/ml lag. Zwischen diesen beiden Gruppen konnte kein signifikanter Unterschied festgestellt werden. Somit kann dieser Parameter nicht zur weiteren Differenzierung zwischen DC positiven und DC negativen Patienten herangezogen werden. Komp et al stellten bei HPS-Patienten deutlich erhöhte Plasmaspiegel an sIL-2R fest. Bei unbehandelten Patienten reichten die Werte von 23.600 bis 75.200 U/ml. Mit adäquater Therapie fielen die Werte im Verlauf der Erkrankung bis zur Remission deutlich ab, lagen aber immer noch oberhalb der Norm. [50] Ursächlich liegt dieser Tatsache zugrunde, dass es bei der HLH zu einer unkontrollierten Proliferation aktivierter T-Lymphozyten und Histiozyten kommt. [47]Dies führt bei aktivierten T-Zellen zur Überproduktion verschiedener Zytokine, wobei der lösliche IL-2R eine wichtige Rolle spielt. IL-2, welches normalerweise von T-Lymphozyten, vor allem TH1-Zellen produziert wird, bindet vermutlich an sIL-2R. Dieser Komplex fungiert als „blocking factor“, indem er die normale Immunantwort unterbindet. Dies führt zu einer sekundären Immundefizienz und somit zur Anergie der T-Zellen. [44, 50]Tomaske et al 51 4 Diskussion konnten mit einer adjuvanten Gabe von αCD 25-Antikörpern bei einem Kind mit HLH eine Verbesserung des Verlaufs der Erkrankung erreichen. [84] Es könnte auch bei diesen Patienten zu einem shedding des membrangebundenen IL-2R gekommen zu sein, wenn auch nicht in so exzessivem Maße wie bei HLH-Patienten. In dieser Arbeit konnte außerdem gezeigt werden, dass, während sich die CD25Expression in der Kontrollgruppe im Referenzbereich befand, sie bei den Studienpatienten deutlich vermindert war. Dies deutet darauf hin, dass weniger regulatorische T-Zellen vorhanden sind und die APC in ihrer Funktion beeinträchtigt sind. [26] Andererseits könnte es aber auch bei Patienten im septischen Schock zu einer übermäßigen T-Zellaktivierung kommen, die aber immer noch weniger deutlich ausgeprägt ist als bei HLH und dadurch auch hier eine anerge Immunitätslage vorhanden sein könnte. 4.3.2 IFN gamma Die IFNg-Plasmaspiegel sind bei Sepsispatienten in Einzelfällen deutlich erhöht, wobei sich ein Mittelwert von 1,25 U/ml ergibt. Erhöhtes IFNg konnte bisher keiner eindeutigen klinischen Situation zugeordnet werden. (Kap 3.2.2.) Bei der Histiozytose erweist sich IFNg als guter diagnostischer und auch prognostischer Parameter. In der Literatur findet man durchweg Angaben für eine deutliche Erhöhung von IFNgWerten während der aktiven Phase der HLH mit Fieber, Hyperzytokinämie und fehlerhafter DC-Reifung. [4, 33, 42, 60]Dabei zeigt sich zwischen den Untergruppen MAHS, IAHS und FHL kein Unterschied in der Höhe der IFNg-Konzentrationen. Bei effektiver Therapie fallen die IFNg-Plasmaspiegel auf Werte unterhalb der Nachweisgrenze ab. Ohga konnte bei einem Wiederanstieg von IFNg gemeinsam mit Fieberspitzen einen frühen Nachweis für einen Rückfall zeigen. [60] Somit kann IFNg bei der Histiozytose als guter prognostischer Faktor verwendet werden. Ursächlich für die hohen IFNg-Werte beim HPS ist vermutlich eine unkontrollierte Proliferation von T-Zellen, vor allem CD8+-zytotoxischen T-Zellen und eine Verminderung der Hämatopoese sowie allgemeiner Entzündungsmarker. IFNg vermittelt auch eine vermehrte Phagozytoseaktivität von Monozyten und Histiozyten, was mit einer Hämophagozytose einhergeht. [4] 52 4 Diskussion Differentialdiagnostisch kommt es auch bei Autoimmunerkrankungen und vor allem bei viralen Infektionen zu einem Anstieg der IFNg-Plasmakonzentrationen. Dies würde für die Sepsispatienten dieser Studie bedeuten, dass es einen Anstieg der IFNg-Werte bei Nachweis oder vermuteter viraler Infektion geben könnte, weniger bei bakteriellen Infektionen. Um eine weiterführende Aussage treffen zu können, müsste bei den Studienpatienten der Hinweis auf eine Virusinfektion bzw. eine Virusreaktivierung nachuntersucht werden. 4.3.3 Leukozyten und Thrombozyten Bei den meisten Sepsispatienten kommt es zur Veränderung der Hämatopoese, die sich in einer gesteigerten Myelopoese durch bakterielle Infektionen erklären lässt. Im septischen Schock ist nicht selten eine massive Lymphopenie, aber auch Granulopenie zu beobachten, welche molekular nicht verstanden wird. Eine Beteiligung inflammatorischer Zytokine als verantwortliche Parameter für die Knochenmarksdepression ist nur für IFNg und TNFa beschrieben worden. Ein erstes Zeichen einer Histiozytose ist bei der kindlichen Erkrankung eine Thrombopenie. Von den hier untersuchten Patienten war die Beeinträchtigung der Thrombozytenzahlen nur transient und korrelierte nicht präzise mit dem Nachweis von CD86/CD2 und IFNg. (Kapitel 3.2.4) Der HLH liegt definitionsgemäß eine Anämie, eine Thrombozytopenie und eine Neutropenie zugrunde. Bei der FHL kommt es bei 82 % bzw. bei 89 % der Patienten zu einer Thrombozytopenie bzw. zu einer Anämie. Neutropenien treten nur in etwa 58 % der Fälle auf. [40] Histologisch können lymphohistiozytäre Infiltrationen v.a. von Leber, Milz und Lymphknoten nachgewiesen werden. Es handelt sich dabei um morphologisch benigne Zellen, die eine aktive Phagozytose hämatopoetischer Zellen, v.a. Erythrozyten, aber auch Thrombozyten und Neutrophilen zeigen. [40, 47] Auch die Zytopenien sind ein wertvoller diagnostischer Indikator für die Aktivität der Erkrankung. [40] In der Literatur wurden vereinzelt Fälle von schwerer Sepsis bzw. septischem Schock mit Multiorganversagen beschrieben, bei denen Hämophagozytosen als Ursache für Thrombozytopenien nachgewiesen werden konnten. [30]Dies lässt den Schluss zu, dass ein 53 4 Diskussion reaktives hämophagozytisches Syndrom einen nicht unwesentlichen Anteil zur Entwicklung einer Multiorgandysfunktion beiträgt. [34] Schlussfolgerung Durch die Ak-Kombination CD86/CD2 konnte bei einigen Patienten mit schwerer Sepsis oder septischem Schock ein erhöhter Anteil an dendritischen Zellen im Blut nachgewiesen werden, wenn auch in deutlich geringerer Anzahl als bei HLH-Patienten. Für die sIL-2R-Plasmaspiegel konnten bei diesem Patientengut nur leicht erhöhte Werte nachweisen, die nicht mit CD86/CD2 positiven Patienten assoziiert sind. Nur transient erhöht waren die gemessenen IFNg-Plasmakonzentrationen. Eine Korrelation zum Nachweis von dendritischen Zellen bei Patienten im septischen Schock konnte nicht gefunden werden. Thrombozytopenien zeigten sich lediglich vereinzelt bei wenigen Patienten, wobei keine weitere Differenzierung zwischen CD86/CD2 positiven bzw. negativen Patienten möglich war. Die untersuchten Parameter können in hohem Maße bei Histiozytosesyndromen identifiziert werden. Histiozytosen sind mit Defekten der DC-Reifung wie auch der TZellaktivierung assoziiert, welche bei einem geringen Anteil von Patienten mit septischem Schock gefunden werden. Demnach können für CARS und MARS in der Sepsis DC-Funktionsdefekte konzeptionell diskutiert werden. Eines der wichtigsten Ergebnisse scheint die fast konsequente Verminderung von CD25 auf Leukozyten zu sein. Da CD25 u.a. auch auf regulatorischen T-Zellen nachgewiesen werden kann, scheint es bei Patienten mit schwerer Sepsis bzw. septischem Schock zu einer deutlichen Verminderung dieser regulatorischen T-Zellen zu kommen. Dies weist darauf hin, dass IL-10 eine große Rolle bei der Immunantwort einer Sepsis bzw. eines SIRS zu spielen scheint. Dieser Parameter wurde in dieser Arbeit nicht bestimmt, da sich der Zusammenhang zwischen Sepsis/SIRS und IL-10 erst ergab, nachdem die Experimente dieser Arbeit bereits abgeschlossen waren. 54 5 Zusammenfassung 5 Zusammenfassung Die schwere Sepsis ist mit einer Sterblichkeit von ca. 35.000/Jahr noch immer die häufigste Todesursache auf nichtkardiologischen Stationen in Deutschland. Kritisch Kranke, Immunkompromitierte und multimorbide Patienten sind am meisten gefährdet, eine schwere Sepsis oder einen septischen Schock zu erleiden. Sepsis wird nach der Konsensus-Konferenz von 1991 als systemic inflammatory response syndrome (SIRS) assoziiert mit einer nachweisbaren bzw. wahrscheinlichen Infektion definiert. Die größte Schwierigkeit bei der Diagnose einer Sepsis besteht in einem frühzeitigen Übergang in eine schwere Sepsis oder einen septischen Schock, was mit einer zu einer deutlichen Zunahme der Sterblichkeitsrate assoziiert ist. Im gesunden Organismus liegen pro- und antiinflammatorische Zytokine im Gleichgewicht vor. Stellt sich eine Dysbalance mit Betonung der proinflammatorischen Seite ein, spricht man von SIRS. Überwiegen antiinflammatorische Zytokine wie Interleukin(IL)-4 und IL10 wird dieser Zustand als combined antiinflammatory response syndrome (CARS) bezeichnet. Wechseln sich beide Zustände innerhalb des Organismus ab, spricht man vom mixed antagonistic response syndrome (MARS). Diese hyperinflammatorische SIRS/Sepsisphase kann mit der Entwicklung eines Immundefektsyndromes, insbesondere eines Defekts der dendritischen Zellen (DC) assoziiert sein, welches zur Beeinflussung der zellulären Immunität führt und mit einer Hyperzytokinämie einhergeht. In der Pädiatrie ist analog dazu die Hämophagozytische Lymphohistiozytose (HLH) bekannt. Die HLH ist eine Erkrankung, bei welcher es, genetisch (FHL, familiäre hämophagozytische Lymphohistiozytose)oder infektbedingt (IAHS, infektassoziiertes hämophagozytisches Syndrom), zu einer Überaktivierung von T-Zellen und Histiozyten (Makrophagen, dendritische Zellen) kommt. Aus dieser vermehrten Aktivierung resultiert einerseits die bereits erwähnte Hyperzytokinämie v.a. proinflammatorischer Zytokine, insbesondere Interferon gamma (IFNγ) und löslichem Interleukin 2-Rezeptor (sIL-2R), andererseits führt die Aktivierung der Histiozyten, bei denen es sich vermutlich um dendritische Zellen lymphoiden Ursprungs handelt, zu einer deutlich gesteigerten Phagozytoseaktivität insbesondere hämatopoetischer Zellen. 55 5 Zusammenfassung Diese beiden Vorgänge führen zu den typischen Kardinalsymptomen der HLH wie Panzytopenie, Fieber und Hepatosplenomegalie. Aufgrunddessen stellte sich uns die Frage, ob es auch bei Sepsispatienten zu einem vermehrten Vorkommen dendritischer Zellen im Blut kommt und ob diese eine entscheidende Rolle bei der Immunantwort spielen. In einem Zeitraum von 6 Monaten wurde daraufhin von Patienten der Anästhesiologischen Intensivstation mit schwerer Sepsis oder septischem Schock täglich zur gleichen Zeit eine Blutprobe entnommen. Ziel war es, daraus die Leukozyten zu isolieren und bestimmte Oberflächenantigene mittels farbstoffmarkierter Antikörper im Durchflusszytometer messbar zu machen. Für die Fragestellung dieser Arbeit waren folgende Antikörperkombinationen von Bedeutung: CD86/CD2 und CD25/CD2. Um zeigen zu können, ob bei Sepsispatienten dieselben Zytokinmuster auftreten wie bei HLH-Patienten, wurden sIL-2R- und IFNg-Plasmaspiegel gemessen. Zusätzlich wurden die Leukozyten- und Thrombozytenwerte bestimmt. Es konnte festgestellt werden, dass bei 4 Patienten (Gruppe Dendritic cells, DC) eine vermehrte Anzahl CD86+/CD2+-Zellen im Vergleich zur Kontrolle und den 18 weiteren Patienten (Gruppe nonDC) (bis 1 %) aufgetreten ist. Diese konnten durch Kultivierung eindeutig der Gruppe der dendritischen Zellen zugeordnet werden. Betrachtet man sich die Plasmakonzentrationen für sIL-2R, sieht man bei Patienten mit schwerer Sepsis, dass auch hier die sIL-2R-Werte erhöht sind, jedoch nicht so deutlich wie dies bei HLH-Patienten der Fall ist. Im Vergleich dazu konnte festgestellt werden, dass der membrangebundene IL-2R in Bezug auf die Kontrollgruppe deutlich herunterreguliert wurde. Für die IFNg-Werte konnte keine eindeutige Zuordnung zu CD86+/CD2+-Zellen bei Patienten im septischen Schock nachgewiesen werden. Weiterhin konnte gezeigt werden, dass die Leukozyten- bzw. Thrombozytenwerte im Verlauf der ersten 14 Tage des septischen Schockes nicht oder nur transient erniedrigt waren und dies nicht mit dem Vorkommen CD86/CD2 positiver Zellen korreliert. Die Antikörper-Kombination CD86/CD2 könnte einen Marker zur Identifizierung zirkulierender dendritischer Zellen darstellen. Dies könnte für die in der Literatur als schwierig beschriebene Isolierung dendritischer Zellen einen Fortschritt bedeuten. Außerdem konnte gezeigt werden, dass auch bei Sepsispatienten zirkulierende dendritische Zellen vorkommen. Es konnte jedoch nicht geklärt werden, ob es bei Patienten im septischen Schock zu ähnlichen Mechanismen der Immundefizienz analog der Histiozyosen kommt 56 6 Literaturverzeichnis 6 1. Literaturverzeichnis American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference: definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit Care Med, 20: 864-874(1992) 2. From the Centers for Disease Control. Increase in National Hospital Discharge Survey rates for septicemia--United States, 1979-1987. J Am Med Assoc, 263: 937938(1990) 3. Abraham E.: Why immunomodulatory therapies have not worked in sepsis. Intensive Care Med, 25: 556-566(1999) 4. Akashi K., Hayashi S., Gondo H., Mizuno S., Harada M., Tamura K., Yamasaki K., Shibuya T., Uike N., Okamura T.: Involvement of interferon-gamma and macrophage colony-stimulating factor in pathogenesis of haemophagocytic lymphohistiocytosis in adults. Br J Haematol, 87: 243-250(1994) 5. Alberti C., Brun-Buisson C., Burchardi H., Martin C., Goodman S., Artigas A., Sicignano A., Palazzo M., Moreno R., Boulme R., Lepage E., Le Gall J.R.: Epidemiology of sepsis and infection in ICU patients from an international multicentre cohort study. Intensive Care Med, 28: 525-526(2002) 6. Angus D.C., Linde-Zwirble W.T., Lidicker J., Clermont G., Carcillo J., Pinsky M.R.: Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med, 29: 1303-1310(2001) 7. Angus D.C. ,Wax R.S.: Epidemiology of sepsis: an update. Crit Care Med, 29: 109116(2001) 8. Ardavin C., Martinez del Hoyo G., Martin P., Anjuere F., Arias C.F., Marin A.R., Ruiz S., Parrillas V., Hernandez H.: Origin and differentiation of dendritic cells. Trends Immunol, 22: 691-700.(2001) 9. Banchereau J. ,Steinman R.: Dendritic cells and the control of immunity. Nature, 392: 245-252(1998) 10. Barclay N.A., Birkeland M.L., Brown M.H., Beyers A.D., Davis S.J., Somoza C., Williams A.F.: The Leukocyte Antigen Facts Book, Academic Press, New York, S. 104-105 (1992) 11. Barclay N.A., Birkeland M.L., Brown M.H., Beyers A.D., S.J. D., Somoza C., Williams A.F.: The Leukocyte Antigen Facts Book, New York, S. 278-279 (1992) 57 6 Literaturverzeichnis 12. Bodmann K.F. ,Vogel F.: Antimikrobielle Therapie der Sepsis. Chemotherapie Journal, 10: 43-44(2001) 13. Böhm U.: Cellular response to IFN gamma. Ann Rev Immunol, 15: 749-755(1997) 14. Bone R.C.: The pathogenesis of sepsis. Ann Intern Med, 115: 457-469(1991) 15. Bone R.C.: Sir Isaac Newton, sepsis, SIRS, and CARS. Crit Care Med, 24: 11251128(1996) 16. Borras F.E., Matthews N.C., Lowdell M.W., Navarrete C.V.: Identification of both myeloid CD11c+ and lymphoid CD11- dendritic cell subsets in cord blood. British Journal of Haematology, 113: 925-931(2001) 17. Burmester G.-R. ,Pezzutto A., Taschenatlas der Immunologie, Georg Thieme Verlag: Stuttgart, New York, S. 8-19 (1998) 18. Burmester G.-R. ,Pezzutto A., Taschenatlas der Immunologie, Georg Thieme Verlag: Stuttgart, New York, S.34 (1998) 19. Caux C., Massacrier C., Vanbervliet B., Dubois B., de Saint-Vis B., DezutterDambuyant C., Jacquet C., Schmitt D., Banchereau J., CD34+ hematopoietic progenitors from human cord blood differentiate along two independent dendritic cell pathways in response to GM-CSF+TNFa in Dendritic cells in Fundamental and Clinical Immunology, Ricciardi-Castagnoli P., Plenum Press: New York, S. 2125 (1997) 20. Cella M., Jarrossay D., Facchetti F., Alebardi O., Nakajima H., Lanzavecchia A., Colonna M.: Plasmacytoid monocytes migrate to inflamed lymph nodes and produce large amounts of type I interferon. Nat Med, 5: 919-923(1999) 21. Cottrez F., Hurst S.D., Coffman L., Groux H.: T regulatory cells 1 Inhibit a Th2 Specific Response In Vivo. J Immunol, 165: 4848-4853(2000) 22. Crawford K., Gabuzda D., Pantazopoulos V., Xu J., Clement C., Reinherz E., Alper C.A.: Circulating CD2+ monocytes are dendritic cells. J Immunol, 163: 59205928.(1999) 23. Davies A., Green C., Hutton J., C. C.: Severe sepsis: A European Estimate of the Burden of Disease in ICU. Intens Care Med, 27: 284(2001) 24. de Becker G., Moulin V., van Mechelen M., Tielemans F., Urbain J., Leo O., Moser M., Dendritic cells and macrophages induce the development of distinct T helper cell populations in vivo in Dendritic cells in Fundamental and Clinical Immunology, Ricciardi-Castagnoli P., 1997, Plenum Press: New York, S. 369-373. 58 6 Literaturverzeichnis 25. Dzionek A., Fuchs A., Schmidt P., Cremer S., Zysk M., Miltenyi S., Buck D.W., Schmitz J.: BDCA-2, BDCA-3, and BDCA-4: Three Markers for Distinct Subsets of Dendritic Cells in Human Peripheral Blood. J Immunol, 165: 6037-6046(2000) 26. Efron P., Moldawer, L.L.: Sepsis and the dendritic cell. Shock, 20: 386-401(2003) 27. Farrar M.A. ,Schreiber R.D.: The molecular cell biology of inerferon-gamma and its receptor. Annu Rev Immunol, 11: 571-611(1993) 28. Favara B.E.: Hemophagocytic lymphohistiocytosis: a hemophagocytic syndrome. Semin Diagn Pathol, 9: 63-74(1992) 29. Fazekas de St Groth B.: The evolution of self-tolerance: a new cell arises to meet the challenge of self-reactivity. Immunol Today, 19: 448-454(1998) 30. Francois B., Trimoreau F., Vignon P., Fixe P., Praloran V., Gastinne H.: Thrombocytopenia in sepsis syndrome: role of hemophagocytosis and macrophage colony-stimulating factor. Am J Med, 103: 114-120(1997) 31. Freudenthal P.S. ,Steinman R.M.: The distinct surface of human blood dendritic cells, as observed after an improved isolation method. Proc Natl Acad Sci U S A, 87: 7698-7702(1990) 32. Friedman, E. S., J-L. V.: Has the mortality of septic shock changed with time? Crit Care Med, 26: 2078-2086(1998) 33. Fujiwara F., Hibi S., Imashuku S.: Hypercytokinemia in hemophagocytic syndrome. Am J Pediatr Hematol Oncol, 15: 92-98.(1993) 34. Gauvin F., Toledano B., Champagne J., Lacroix J.: Reactive hemophagocytic syndrome presenting as a component of multiple organ dysfunction syndrome. Crit Care Med, 28: 3341-3345(2000) 35. Goldberg J. ,Nezelof C.: Lymphohistiocytosis: a multifactorial syndrome of macrophage activation. Hematol Oncol, 4: 275(1987) 36. Grammer L.C., Shaugnessy M.A., Kabalin C.S., Yamold P.R., Malo J.L., Cartier A.: Immunologic aspects of isocyanate asthma: IL-1 beta, IL-3, sIL-2R and sICAM1. Allergy Asthma Proc, 19: 301-305(1998) 37. Greene W.C., Leonard W.J., Depper J.M., Nelson D.L., Waldmann T.A.: The human interleukin-2 receptor: normal and abnormal expression in T cells and in leukemias induced by the human T-lymphotropic retroviruses. Ann Intern Med, 105: 560-572.(1986) 38. Grouard G. ,Rissoan M.C.: The enigmatic plasmacytoid T cells develop into dendritic cells. J Exp Med, 185: 1101-1111(1997) 59 6 Literaturverzeichnis 39. Healy D.P.: New and emerging therapies for sepsis. Ann Pharmacother, 36: 648654(2002) 40. Henter I.-J., Arico M., Elinder G., Imashuku S., Janka G.: Familial hemophagocytic lymphohistiocytosis. Hematology/Oncology Clinics of North America, 12: 417433(1998) 41. Henter I.-J. ,Elinder G.: Diagnostic guidelines for hemophagocytic lymphohistiocytosis. Semin Oncol, 18: 29-33(1991) 42. Henter I.-J., Elinder G., Soder O., Hansson M., Andersson B., Andersson U.: Hypercytokinemia in familial hemophagocytic lymphohistiocytosis. Blood, 78: 2918(1991) 43. Hotchkiss R.S., Tinsley K.W., Swanson P.E., Grayson M.H., Osborne D.F., Wagner T.H., Cobb J.P., Coopersmith C., Karl I.E.: Depletion of dendritic cells, but not macrophages in patients with sepsis. J Immunol, 168: 2493-2500(2002) 44. Imashuku S.: Differential diagnosis of hemophagocytic syndrome: underlying disorders and selection of the most effective treatment. International Journ of Hematology, 66: 135-151(1997) 45. Imashuku S., Ikushima S., Esumi N., Todo S., Saito M.: Serum levels of interferon gamma, cytotoxic factor and soluble interleukin-2 receptor in childhood hemophagocytic syndromes. Leuk Lymphoma, 3: 287(1991) 46. Janka G., Imashuku S., Elinder, Schneider M., Henter I.-J.: Infection- and malignancy-associated hemophagocytic syndromes. Hematology/Oncology Clinics of North America, 12: 435-444(1998) 47. Janka-Schaub G.: Interdisziplinäre Diagnostik und Therapie der Histiozytosen. Klinische Onkologie `97, 36-40(1997) 48. Kalinski P., Hilkens C., Wierenga E., Kapsenberg M.: T-cell priming by type-1 and type-2 polarized dendritic cells: the concept of a third signal. Immunol Today, 20: 561-566(1999) 49. Kato K., CD2 Workshop Panel Report in Leukocyte Typing VI, T. Kishimoto, H. Kikutani, A.E.G.K. von dem Borne, S.M. Goyert, D.Y. Mason, M. Miyasaka, L. Moretta, S. Shaw, T.A. Springer, Sugamura K.H. Zola, Garland Publishing: New York, London, S. 39-43 (1996) 50. Komp D.M., McNamara J., Buckley P.: Elevated soluble interleukin-2 receptor in childhood hemophagocytic histiocytic syndromes. Blood, 73: 2128-2132(1989) 60 6 Literaturverzeichnis 51. Kronin V., Winkel K., Suss G., Kelso A., Heath W., Kirberg J., von Boehmer H., Shortman K.: A subclass of dendritic cells regulates the response of naive CD8 T cells by limiting their IL-2 production. J Immunol, 157: 3819-3827(1996) 52a. Levy M.M., Fink M.P., Marshall J.C., Abraham E., Angus D.C., Cook D., Cohen I.J., Opal S.M., Vincent J.L., Ramsay G.: 2001: SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference. Crit Care Med, 31: 1250-1256(2003) 52. Lutz M.B., Suri R.M., Niimi M., Ogilvie A.L., Kukutsch N.A., Rossner S., Schuler G., Austyn J.M.: Immature dendritic cells generated with low doses of GM-CSF in the absence of IL-4 are maturation resistant and prolong allograft survival in vivo. Eur J Immunol, 30: 1813-1822.(2000) 53. Maldonado-Lopez R., De Smedi T., Michel P., Godfroid J., Pajak B., Heirman C., Thielemanns K., Leo O., Urbain J., Moser M.: CD8alpha+ and CD8alphasubclasses of dendritic cells direct the development of distinct T helper cells in vivo. J Exp Med, 189: 587-592(1999) 54. Matzinger P.: Tolerance, danger and the extended family. Annu Rev Immunol, 12: 991-1045(1994) 55. Meuer S.C., Hussey R.E., Fabbi M., Fox D., Acuto O., Fitzgerald K.A., Hodgdon J.C., J.P. P., Schlossman S.F., Reinherz E.: An alternative pathway of T-cell activation: a functional role for the 50 kd T11 sheep erythrocyte receptor protein. Cell, 36: 897(1984) 56. Oberholzer A., Oberholzer C., Minter R.M., Moldawer L.L.: Considering immunomodulatory therapies in the septic patient: should apoptosis be a potential therapeutic target? Immunol Lett, 75: 221-224(2001) 57. O'Doherty U., Ignatius R., Bhardwaj N., Pope M.: Generation of monocyte-derived dendritic cells from precursors in rhesus macaque blood. J Immunol Methods, 207: 185-194(1997) 58. O'Doherty U., Peng M., Gezelter S., Swiggard W.J., Betjes M., Bhardwaj N., Steinman R.M.: Human blood contains two subsets of dendritic cells, one immunologically mature and the other immature. Immunology, 82: 487-493(1994) 59. O'Doherty U., Steinman R.M., Peng M., Cameron P.U., Gezelter S., Kopeloff I., Swiggard W.J., Pope M., Bhardwaj N.: Dendritic cells freshly isolated from human blood express CD4 and mature into typical immunostimulatory dendritic cells after culture in monocyte-conditioned medium. J Exp Med, 178: 1067-1076(1993) 61 6 Literaturverzeichnis 60. Ohga S., Miyazaki C., Okada K., Akazawa K., Ueda K.: The inflammatory cytokines in measles: correlation between serum interferon-gamma levels and lymphocyte subpopulations. Eur J Pediatr, 151: 492-496(1992) 61. Olweus J., Bitmansour A., Warnke R., Thompson P.A., Carballido J., Picker L.J., Lund-Johansen F.: Dendritic cell ontogeny: A human dendritic cell lineage of myeloid origin. Proc Natl Acad Sci U S A, 94: 12551-12556(1997) 62. Osugi Y., Hara J., Tagawa S., Takai K., Hosoi G., Matsuda Y., Ohta H., Fujisaki H., Kobahashi M., Sakata N., Kawa-Ha K., Okada S., Tawa A.: Cytokine Production regulating Th1 and Th2 cytokines in hemophagocytic lymphohistiocytosis. Blood, 89: 4100-4103(1997) 63. Pigott R. ,Power C., The Adhesion Molecule Facts Book, Academic Press, S. 26 (1992) 64. Pulendran B., Smith J.L., Caspary G., Brasel K., Pettit D., Marasovsky E., Mailszewski C.R.: Distinct dendritic cell subsets differentially regulate the class of immune response in vivo. Proc Natl Acad Sci U.S.A., 96: 1036-1041(1999) 65. Rissoan M.C., Soumelis V., Kadowaki N., Grouard G., Briere F., de Waal Malefyt R., Liu Y.J.: Reciprocal control of T helper cell and dendritic cell differentiation. Science, 283: 1183-1186(1999) 66. Robinson S.P., Patterson S., English N., Davies D., Knight S.C., Reid C.D.: Human peripheral blood contains two distinct lineages of dendritic cells. Eur J Immunol, 29: 2769-2778(1999) 67. Romagnani S.: Human TH1 and TH2 subsets: doubt no more. Immunol Today, 12: 256-257(1991) 68. Romani N., Gruner S., Brang D., Kämpgen E., Lenz A., Trockenbacher B., Konwalinka G., Fritsch P.O., Steinman R., Schuler G.: Proliferating dendritic cell progenitors in human blood. J Exp Med, 180: 83-93(1994) 69. Rongcun Y., Maes H., Corsi M., Dellner F., Wen T., Kiessling R.: Interferon gamma impairs the ability of monocyte-derived dendritic cells to present tumourspecific and allo-specific antigens and reduces their expression of CD1a, CD80 and CD4. Cytokine, 10: 747-755(1998) 70. Rubin L.A., Kurman C.C., Fritz M.E., Biddison W.E., Boutin B., Yarchoan R., Nelson D.L.: Soluble interleukin 2 receptors are released from activated human lymphoid cells in vitro. J Immunol, 135: 3172-3177(1985) 62 6 Literaturverzeichnis 71. Rubin L.A. ,Nelson D.L.: The soluble interleukin-2 receptor: biology, function, and clinical application. Ann Intern Med, 113: 619-627(1990) 72. Ryncarz R.E. ,Anasetti C.: Expression of CD 86 on Human Marrow CD34+ Cells Identifies Committed Precursors of Macrophages and Dendritic Cells. Blood, 91: 3892-3900(1998) 73. Schäfer E.: unveröffentlichte Befunde.(2003) 74. Schneider E.M., Lorenz I., Muller-Rosenberger M., Steinbach G., Kron M., JankaSchaub G.E.: Hemophagocytic lymphohistiocytosis is associated with deficiencies of cellular cytolysis but normal expression of transcripts relevant to killer-cellinduced apoptosis. Blood, 100: 2891-2898.(2002) 75. Schneider E.M., Lorenz, I., Walther, P., Janka-Schaub, G.: Natural Killer Deficiency: A Minor and Major Factor in the Manifestation of Hemophagocytic Lymphohistiocytosis? Journal of Pediatric Hematology/Oncology, 25: 680683(2003) 76. Schottmüller H.: Wesen und Behandlung der Sepsis. Verh Dtsch Ges Inn Med, 31: 257(1914) 77. Schwarz S.: Labordiagnostische Methoden, Studia, 1997, Innsbruck, S. 157 78. Stark B., Cohen I.J., Pecht M., Umich T., Apte R.N., Friedman E., Levin S., Vogel R., Schlesinger M., Zaizor R.: Immunologic dysregulation in a patient with familial hemophagocytic lymphohistiocytosis. Cancer, 60: 2629(1985) 79. Steinman R.: The dendritic cell system and its role in immunogenicity. Ann Rev Immunol, 9: 271-296(1991) 80. Steinman R., Pack M., Inaba K., Dendritic cell development and maturation in Dendritic cells in Fundamental and Clinical Immunology, Ricciardi-Castagnoli P., Plenum Press: New York, S. 1-6) (1997) 81. Stepp S.E., Mathew P.A., M. B.: Perforin: more than just an effector molecule. Immunol Today, 21: 254-256(2000) 82. Suss G. ,Shortman K.: A subclass of dendritic cells kills CD4 T cells via Fas/Fasligand-induced apoptosis. J Exp Med, 183: 1789-1796(1996) 83. Takamizawa M., Rivas A., Fagnnoni F., Benike C., Kosek J., Hyakawa H., Engleman E.: Dendritic cells that process and present nominal antigens to naive T lymphocytes are derived from CD2+ precursors. J Immunol, 158: 2134-2142(1997) 63 6 Literaturverzeichnis 84. Tomaske M., Amon O., Bosk A., Handgretinger R., Schneider E.M.: Alpha-CD25 antibody treatment in a child with hemophagocytic lymphohistiocytosis. Med Pediatr Oncol, 38: 141-142(2002) 85. Vincent J.L., Sun Q., Dubois M.J.: Clinical trials of immunomodulatory therapies in severe sepsis and septic shock. Clin Infect Dis, 34: 1084-1093(2002) 86. Young H.A. ,Hardy K.J.: Role of interferon gamma in immune cell regulation. J Leuk Biol, 58: 373-381(1995) 64 7 Lebenslauf 7 Lebenslauf Name: Michaela Appel Geburtsdatum: 2. Mai 1974 Geburtsort: Ingolstadt Familienstand: ledig Schulausbildung 1980-1985 Volksschule Friedrichshofen 1985-1994 Katharinen-Gymnasium Ingolstadt Abschluss: Allgemeine Hochschulreife Berufsorientierende Tätigkeit 1994-1995 Freiwilliges Soziales Jahr, chirurgische Pflegestation, Klinikum Ingolstadt Studium 1995-1998 Humanmedizin, vorklinischer Abschnitt, Universität Innsbruck 1998-2001 Humanmedizin, klinischer Abschnitt, Universität Ulm 2001-2002 Humanmedizin, Praktisches Jahr, Universität München Famulaturen: 1999: Unfallchirurgie am Klinikum Ingolstadt 1999: Anästhesie an der Universitätsklinik Ulm 2000: Praxisfamulatur HNO in Ingolstadt 2000: Herzchirurgie am Royal Prince Alfred Hospital in Sydney 65 7 Lebenslauf Praktisches Jahr: 1.Tertial: Chirurgie, Klinikum Ingolstadt 2.Tertial: Innere Medizin, Klinikum Ingolstadt 3.Tertial: Anästhesie, Zentralklinikum Augsburg Berufliche Laufbahn: 15.11.2002-14.05.2004 Ärztin im Praktikum in der Abteilung für Anästhesiologie am Klinikum Bamberg Seit 15.05.2004 Assistenzärztin in der Abteilung für Anästhesiologie am Klinikum Bamberg 66