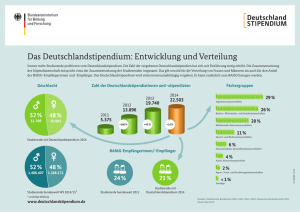
Allgemeine Chemie für Studierende der Zahnmedizin
Werbung

Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Allgemeine Chemie für Studierende der Zahnmedizin Allgemeine und Anorganische Chemie Teil 7 Dr. Ulrich Schatzschneider Institut für Anorganische und Angewandte Chemie, Universität Hamburg Lehrstuhl für Anorganische Chemie I, Ruhr-Universität Bochum [email protected] Allgemeine und Anorganische Chemie VII 1/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Inhalt • Aufbau der Materie: Atome, Elemente, Periodensystem, Radioaktivität • chemische Bindung und intermolekulare Wechselwirkungen • chemische Reaktionen • wässrige Lösungen, Säuren und Basen, Puffer • Oxidationszahlen, Redoxreaktionen, Elektrochemie • Koordinationsverbindungen und Bioanorganische Chemie "Chemie ist die Wissenschaft, die sich mit der Zusammensetzung und den Eigenschaften der Materie befasst, insbesondere aber mit Veränderungen, die diese betreffen." Allgemeine und Anorganische Chemie VII 2/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Gravimetrie ⇒ bisher besprochene Analyseverfahren: Maßanalyse (Volumenmessung des Verbrauchs an Maßlösung bekannter Konzentration) ⇒ Gravimetrie: Wägung der Substanz, die als schwerlöslicher Niederschlag ausgefällt wird (Fällungsanalyse) Voraussetzungen: • spezifische Fällung • quantitative Fällung • stöchiometrisch zusammengesetzter Niederschlag manchmal: Fällungsform → Wägeform (z.B. Trocknen oder Glühen) Allgemeine und Anorganische Chemie VII 3/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Gravimetrie Fällungsform Wägeform K+ K[B(C6H5)4] K[B(C6H5)4] Ag+/Cl- AgCl AgCl Mg2+, Zn2+ M(oxinat)2 · H2O M(oxinat)2 · H2O Ca2+ Ca(C2O4) · H2O CaCO3/CaO M = Ba2+, Pb2+ MSO4, MCrO4 MSO4, MCrO4 Ni2+ Ni(dad)2 Ni(dad)2 SO42- BaSO4 BaSO4 OH H3C N H3C Oxin 8-Hydroxychinolin O - B(C6H5)4 Tetraphenylborat N M N H3C O N OH dad (Diacetyldioxim) B Allgemeine und Anorganische Chemie VII OH N O N H O N CH3 Ni H3C N O H N O CH3 4/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Gravimetrie Löslichkeitsprodukt mA+nB [AmBn]s m n [ A ] ⋅ [B] m n KL = = [A ] ⋅ [B] [A m Bn ] Einheit: molm+n·l-(m+n) pK L = − log K L Stoff fällt aus, wenn sein Löslichkeitsprodukt überschritten wird je kleiner KL (je größer pKL), desto schwerer löslich ist eine Substanz Allgemeine und Anorganische Chemie VII 5/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Gravimetrie Löslichkeitsprodukt (pKL) Ca(C2O4) 8.1 CuCl 6.0 Sr(C2O4) 7.3 CuI 11.3 Ba(C2O4) 6.8 AgCl 10.0 Mg(C2O4) 4.1 AgBr 12.4 CaCO3 7.9 AgI 16.0 SrCO3 8.8 SrCrO4 4.4 CaCO3 8.2 BaCrO4 9.7 MgCO3 3.7 PbCrO4 13.8 CaSO4 4.3 MnS 15 SrSO4 6.6 NiS 21 BaSO4 10.0 CdS 27 PbSO4 8.0 HgS 52 In der Regel nimmt die Löslichkeit mit der Temperatur zu (Ausnahme: Calciumcitrat). Allgemeine und Anorganische Chemie VII 6/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Gravimetrie Löslichkeit bestimmt durch Differenz Gitterbildungsenergie ΔHL vs. Solvatisierungsenergie ΔHS Lösungswärme: ΔHL = ΔHS – ΔHG ΔHL < 0: gute Löslichkeit ΔHL > 0: geringe Löslichkeit (ΔHS, ΔHG < 0) Gitterenergie ~ Produkt der Ladungszahlen → Salze mehrwertiger Ionen oft schwer löslich Silberhalogenide → Dispersionskräfte durch Polarisation der großen Anionen durch das kleine Silber(I)-Kation Sulfide → kovalenter Bindungsanteil Allgemeine und Anorganische Chemie VII 7/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Gravimetrie Löslichkeit bestimmt durch Differenz Gitterbildungsenergie ΔHL vs. Solvatisierungsenergie ΔHS Lösungswärme: ΔHL = ΔHS – ΔHG ΔHL < 0: gute Löslichkeit ΔHL > 0: geringe Löslichkeit (ΔHS, ΔHG < 0) Gitterenergie ~ Produkt der Ladungszahlen → Salze mehrwertiger Ionen oft schwer löslich Silberhalogenide → Dispersionskräfte durch Polarisation der großen Anionen durch das kleine Silber(I)-Kation Sulfide → kovalenter Bindungsanteil Allgemeine und Anorganische Chemie VII 8/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Komplexometrie Komplexe/Koordinationsverbindungen: zentrales Metallatom + Liganden Donor-Akzeptor-Bindung [FeIII(CN)6]3- N N C 3 C C N Fe N C C C N N [CoIIICl2(NH3)4] Cl NH3 NH3 Cl Co Co NH3 Cl NH3 Allgemeine und Anorganische Chemie VII NH3 H3N H3N NH3 Cl 9/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Komplexometrie Komplexe/Koordinationsverbindungen: zentrales Metallatom + Liganden Koordinationszahl: Zahl der Liganden pro zentralem Metallion meisten 4 oder 6 (Kupfer auch 5) L L M L L L L L L M L L L M L L L L L L M L L Eisen(III)chlorid-Hexahydrat FeCl3 · 6 H2O ⇒ [Fe(H2O)6]3+ + 3 Cl- !!!!! 3 OH2 OH2 H2O Fe OH2 H2O OH2 Allgemeine und Anorganische Chemie VII 10/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Komplexometrie Mehrzähnige Liganden/Chelatliganden*: N N N N N N einzähnig monodentat N N zweizähnig bidentat dreizähnig tridentat besonders stabile bei fünf- oder sechsgliedrigen Ringsystemen * chele (χηελε) ⇒ gr. Schere, Klaue Allgemeine und Anorganische Chemie VII 11/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Komplexometrie Chelatliganden: O O O O O O N O N N O O O O O nta3nitrilotriacetic acid + H+ pKa1 = 2.07 O edta4ethylenediaminetetraacetic acid - H+ H4edta O H3 edta- - H+ + H+ pKa2 = 2.75 H2 edta2- - H+ + H+ pKa3 = 6.24 Hedta3- - H+ + H+ edta4- pKa4 = 10.34 ⇒ Dinatrium-EDTA (Titriplex III®) ⇒ beim Titrieren Pufferlösungen verwenden!!! Allgemeine und Anorganische Chemie VII 12/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Komplexometrie EDTA-Metallkomplexe: O n-4 O O O O O Mn N N O O mit nahezu allen zwei- und dreiwertigen Kationen 1:1-Komplexe sechsfach koordiniert wasserlöslich und nicht oder nur wenig gefärbt pseudooktaedrisch 4x O + 2x N Koordinationsumgebung Stickstoff-Atome in cis-Position Allgemeine und Anorganische Chemie VII 13/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Komplexometrie Komplexbildungskonstante: [M(H2O)6]n+ + A4- [M(A)](n-4)- + 6 H2O [ [ MA ( ) ]⋅ [H O] MA ( ) ] K= [M(H O) ]⋅ [A ] = [M(H O) ]⋅ [A ] n −4 n+ 2 n −4 6 2 n+ 4− 6 2 4− 6 pK = − log K entropisch bevorzugt (Gibbs-Helmholtz-Gleichung, ΔS > 0): ΔG = ΔH − T ⋅ ΔS Allgemeine und Anorganische Chemie VII 14/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Komplexometrie Komplexbildungskonstanten pK Cr3+ 23.0 Al3+ 16.1 Mn2+ 14.0 Ca2+ 10.7 Fe2+ 14.3 Sr2+ 8.6 Fe3+ 25.1 Ba2+ 7.8 Co2+ 16.3 Mg2+ 8.7 Ni2+ 18.6 Pb2+ 18.0 Cu2+ 18.8 Cd2+ 16.5 Zn2+ 16.5 Na+/K+/Li+ < 2.8 Allgemeine und Anorganische Chemie VII 15/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Komplexometrie direkte vs. indirekte Titration direkt: Mn+ + EDTA4- → [M(edta)]n-4 indirekt: MAn+ + EDTA4- → [MA(edta)]n-4 + EDTA4MBn+ + EDTA4- → [MB(edta)]n-4 MB: zum Beispiel Zink Allgemeine und Anorganische Chemie VII 16/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Komplexometrie H2erio- Metallindikatoren - H+ + H+ Herio2- pKa1 = 6.3 weinrot - H+ + H+ erio3- pKa2 = 11.5 tiefblau orange sind Komplexbildner, aber - mit Bindungskonstanten kleiner als die des Titranten in der Maßlösung - anderer Farbe des Komplexes als des freien Indikators - intensivere Farbe als die des Titrant-Metall-Komplexes O3S O2N O N H O3S H N + M2+ + 2 H+ O O N M N O O2N Eriochromschwarz T (Erio T) Allgemeine und Anorganische Chemie VII 17/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Photometrie Farbige Metallkomplexe 2+ N N N N N Fe2+ + 3 N Fe N N Ferroin rot A Metal-zu-Ligand-Charge Transfer (MLCT) Fe2+-phen → Fe3+-phen· ⇒ große Änderung des Dipolmomentes ⇒ starke Absorption (ε510 ~ 11000 l·mol-1·cm-1) λ Allgemeine und Anorganische Chemie VII 18/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Bioanorganische Chemie Anorganische Chemie Biochemie • "tote" Materie, z. B. Steine und Mineralien • "lebende" Materie • Anwendungen in der Katalyse oder Materialwissenschaften • typischerweise in Luft und Wasser, pH = 7.4 • organische Lösemittel • Wasser als "Lösemittel" • Kleine, relativ einfache Moleküle • hochkomplexe Moleküle (Proteine, DNA) • Festkörperchemie • Mehrkomponenten-Systeme • gut charakterisierte Molekülverbindungen • nur teilweise verstanden • in vielen Aspekten gut verstanden ... ABER • Ein Drittel aller Enzyme sind Metallo-Enzyme • Metalle sind involviert in viele wichtige Prozesse wie Sauerstofftransport (Fe) und Photosynthese (Mn) • Viele Metalle sind essentielle Spurenelemente • Metallverbindungen als Wirkstoffe (cis-Platin) Bioanorganische Chemie Allgemeine und Anorganische Chemie VII 19/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Biologisch wichtige Elemente 1 2 3 4 5 6 7 8 9 10 11 1 1H 2 3Li Be 3 11Na Mg 4 19K Ca Sc Ti V Cr Mn Fe Co Ni Cu 5 37Rb Sr Y Zr Nb Mo Tc Ru Rh Pd 6 55Cs 56Ba † 72Hf Ta W Re Os Ir 7 87Fr 88Ra ‡ 104Rf Db Sg Bh Hs † 57La Ce Pr Nd Pm Sm ‡ 89Ac Th Pa U Np Pu 12 13 14 15 16 17 für den Menschen essentiell 2He für bestimmte Mikroorganismen essentiell B C N O F 10Ne Al Si P S Cl 18Ar Zn Ga Ge As Se Br 36Kr Ag Cd In Sn Sb Te I 54Xe Pt Au Hg Tl Pb Bi Po At 86Rn Mt 110 111 112 Eu Gd Tb Dy Ho Er Tm Yb 71Lu Am Cm Bk Cf Es Fm Md No 103Lr toxisch Anwendung in Diagnostik und/oder Therapie Allgemeine und Anorganische Chemie VII 18 20/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Biologische Funktion von Metallen • Strukturfunktion – Skelett und Zähne (Ca, Mg) – Zellwände – Proteine (Mg, "strukturelles" Zn, z. B. in Zink-Fingern) – DNA (Na, Mg) • Ladungsträger für schnelle Informationsübertragung – Nervenleitung (Na, K) – second messenger (Ca) • Auf- und Abbau organischer Verbindungen – Lewis-Säure / Base-Katalyse, z. B. in Hydrolasen, Peptidasen, ... (Mg, Zn) • Redoxreaktionen und Elektronenübertragung – V, Mn, Fe, Co, Ni, Cu, Mo, W • Aktivierung kleiner Moleküle – Sauerstoff (Fe, Cu) – Stickstoff (Fe, Mo, V) – Wasserstoff (Ni, Fe) – Methan (Fe) – CO2 (Ni, Fe - Reduktion zu Methan; bzw. Zn - Carboanhydrase) • Erzeugung von Radikalen und Carbanionen ("metallorganische" Reaktivität) – Vitamin B12 (Co) Allgemeine und Anorganische Chemie VII 21/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Biologische Liganden - Aminosäuren M S CH 3 CH 2 M Methionin O M N M M M S S CH 2 CH 2 N N CH 2 Cystein, verbrückend, μ-S pKS (Cys) = 8.5 pKS (Se-Cys) = 5 Cystein O O O CH 2 CH 2 Histidin, Nδ Histidin, Nε Tyrosin pKS (His) = 6.5 M O NH M pKS (Tyr) = 10 M O O M M O O M CH 2 anti, η1 CH 2 syn, η1 CH 2 CH 2 chelatisierend, η2 verbrückend, μ- η1:η1 Carboxylate, z. B. Asp und Glu; pKS (Asp) = 3.7, pKS (Glu) = 4.3 Allgemeine und Anorganische Chemie VII 22/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Biologische Liganden - Makrozyklen zwei acide NH-Protonen maximal ungesättigt konjugiertes π-System (18 π-Elektronen!) planar NH N N NH HN N Porphyrin N HN zwei acide NH-Protonen ein Ring gesättigt konjugiertes π-System fast planar Chlorin NH HN NH HN Porphyrinogen ein acides NH-Proton kleiner als Porphyrin hochgradig gesättigt nicht planar N N N N NH N N HN Corrin Allgemeine und Anorganische Chemie VII ein acides NH-Proton Porphyrin-Gerüst hochgradig gesättigt nicht planar Corphin 23/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Biologische Liganden - Makrozyklen Häm N Chlorophyll a N N Fe N N Mg N N N O HO 2 C CO 2 H O O OCH 3 3 Allgemeine und Anorganische Chemie VII 24/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Bioanorganische Chemie - Metalloproteine Hämoglobin-Monomer Hämoglobin-Tetramer Globin (Protein) Häm-Gruppe mit Eisen (goldfarben) und gebundenem Sauerstoff (O2, rot) Allgemeine und Anorganische Chemie VII 25/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Bioanorganische Chemie - Metalloproteine Structure of deoxyhemocyanin (from Panulirus interruptus) Proposed model for dioxygen binding in deoxyhemocyanin Two X-ray structures for dioxygen binding to hemocyanin P. interruptus deoxyhemocyanin L. polyphemus oxyhemocyanin Allgemeine und Anorganische Chemie VII 26/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Bioanorganische Chemie - Metalloproteine Adenosyl-Cobalamin (Coenzym B12, Röntgenstruktur) Allgemeine und Anorganische Chemie VII 27/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Bioanorganische Chemie - FeS-Cluster FeS4 Fe2S2 Rubredoxin Ferredoxin Fe3S4 (linear) - model data - Fe + toe exist → Predicted 3+ - Allgemeine und Anorganische Chemie VII Fe3S4 (cubane) Fe2+ Ferredoxin Fe2S2N2 Rieske water-soluble domain Fe4S4 Ferredoxin, HPIP 28/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Klassen von chemotherapeutischen Wirkstoffen Cl • N Cl alkylierende Wirkstoffe Cl S Cl R O • Antimetabolite H O mustard gas aniline mustard F N N H 5-fluorouracil (5-FU) thymidylate synthase inhibitor • Anthracycline • Topoisomerase-Inhibitoren N N HO • Mikrotubuli-Blocker • Hormontherapie N F O doxorubicin O Ciprofloxacin R Paclitaxel O(CH2)2N(CH3)3 tamoxifen Allgemeine und Anorganische Chemie VII 29/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Metal-basierte Antitumorwirkstoffe H3N H3N Cl Pt Cl cis-Diammindichloroplatin(II) cDDP, Cisplatin Bedeutung von Cisplatin • seit 1983 meistverkaufter Antitumor-Wirkstoff • weltweiter Umsatz Platin-basierter Chemotherapeutika > 3 Mrd. € Allgemeine und Anorganische Chemie VII 30/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Cisplatin I. Ott, R. Gust, Pharmazie in unserer Zeit 2006, 35, 124-133. Allgemeine und Anorganische Chemie VII 31/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Cisplatin I. Ott, R. Gust, Pharmazie in unserer Zeit 2006, 35, 124-133. Allgemeine und Anorganische Chemie VII 32/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Cisplatin und Derivative H H3 N H3 N Pt Cl Cl Cisplatin H N Pt N H H Oxaliplatin O O O O O H3N H3N O Pt O O Carboplatin Nachteile Cisplatin-basierter Antitumor-Wirkstoffe • hohe allgemeine Toxizität • Entwicklung von Resistenzen • begrenztes Wirkspektrum • ganze Klasse von Verbindungen hat nur eine Zielstruktur ⇒ DNA Allgemeine und Anorganische Chemie VII 33/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Translational drug development C.G. Hartinger, P.J. Dyson, Chem. Soc. Rev. 2009, 38, 391-401. Allgemeine und Anorganische Chemie VII 34/35 Allgemeine Chemie fü für Studierende der Zahnmedizin SS 2010 Nächste Vorlesung Dienstag, 18.05.2010, Hörsaal A Chemie Wiederholungsstunde Allgemeine und Anorganische Chemie VII 35/35