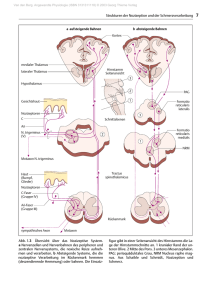
Transkraniell-sonographische Darstellung der Hirnperfusion mit
Werbung

Aus der Klinik für Neurologie der Universität zu Lübeck Direktor: Prof. Dr. med. D. Kömpf Transkraniell-sonographische Darstellung der Hirnperfusion mit dem Harmonic Imaging Verfahren bei Patienten mit akutem Hirninfarkt oder intrakraniellem Tumor Inaugural-Dissertation zur Erlangung der Doktorwürde der Universität zu Lübeck $XVGHU0HGL]LQLVFKHQ)DNXOWlW vorgelegt von Grit Berdien aus Bremerhaven Lübeck 2004 Erster Berichterstatter Prof. Dr.med. G.Seidel Zweiter Berichterstatter /Berichterstatterin Priv.-Doz. Dr.med. U.Missler Tag der mündlichen Prüfung 18. August 2005 Zum Druck genehmigt. Lübeck, den 18. August 2005 0HLQHQ(OWHUQ Inhalt ,QKDOW 1 Einleitung und Zielsetzung ..............................................................................1 2 Material und Methoden ...................................................................................4 2.1 Technische Grundlagen.....................................................................4 2.1.1 A-Mode ............................................................................................. 4 2.1.2 B-Mode ............................................................................................. 5 2.1.3 Dopplersonographie ......................................................................... 5 2.1.4 Farbduplexsonographie .................................................................... 7 2.1.5 Harmonic Imaging........................................................................... 10 2.2 Gerätetechnik und Kontrastmittel.....................................................13 2.3 Patienten und Untersuchungsgang..................................................14 2.3.1 Patienten......................................................................................... 14 2.3.2 Farbduplexsonographie der intra- und extrakraniellen Gefäße....... 15 2.3.3 Harmonic Imaging bei Patienten mit akutem Hirninfarkt nach SonoVue®-Injektion......................................................................... 15 2.3.4 Harmonic Imaging bei Patienten mit intrakraniellem Tumor nach Levovist®-Injektion .......................................................................... 16 2.3.5 Datenanalyse.................................................................................. 17 2.3.6 Auswertung der Perfusionuntersuchungen ..................................... 17 2.4 3 Statistische Verfahren......................................................................19 Ergebnisse ....................................................................................................20 3.1 Patienten mit Hirninfarkt...................................................................20 3.1.1 Allgemeines .................................................................................... 20 3.1.2 Diagnosen....................................................................................... 21 3.1.3 Ergebnisse des Bolus Harmonic Imaging (BHI).............................. 23 3.1.4 Untersuchung der Zeit-Intensitäts-Kurven ...................................... 25 3.1.5 Vergleich der Infarktausdehnung in der Referenzbildgebung (CCT / MRT) mit dem perfusionsgestörtem Areal im Harmonic Imaging ........................................................................................... 28 3.1.6 Nachbefragung ............................................................................... 32 3.1.7 Artefakte ......................................................................................... 33 3.2 Patienten mit Hirntumor ...................................................................34 -I- Inhalt 3.2.1 Allgemeines .................................................................................... 34 3.2.2 Diagnosen....................................................................................... 34 3.2.3 Ergebnisse des Harmonic Imaging ................................................. 35 3.3 4 Kasuistiken von Patienten mit Hirninfarkt ........................................39 3.3.1 Beispiel 1 ........................................................................................ 39 3.3.2 Beispiel 2 ........................................................................................ 41 Diskussion.....................................................................................................44 4.1 Patienten mit Hirninfarkt...................................................................44 4.1.1 Zielsetzung, Material und Methoden............................................... 44 4.1.2 Ergebnisse...................................................................................... 46 4.2 Patienten mit intrakraniellem Tumor ................................................47 4.2.1 Zielsetzung, Material und Methoden............................................... 47 4.2.2 Ergebnisse...................................................................................... 48 5 Zusammenfassung........................................................................................50 6 Literaturverzeichnis .......................................................................................52 7 Anhang 60 7.1 National Institutes of Health Stroke Scale (NIHSS) .........................60 7.2 Modified Rankin Score (mRS) .........................................................70 7.3 Karnofsky-Index...............................................................................70 8 Danksagung ..................................................................................................71 9 Lebenslauf.....................................................................................................72 -II- Abkürzungsverzeichnis $ENU]XQJVYHU]HLFKQLV µm Mikrometer A Arterie A_Infarkt Infarktareal in der Verlaufscomputertomographie bzw. - magnetresonanztomographie A_PPI Fläche mit Signalminderung über 50% im Pixelwise-Peak-Intensity-Bild A_TTP Fläche mit verzögerter Kontrastmittelanflutung von mindestens drei Sekunden im Time-To-Peak-Bild ACA Arteria cerebri anterior ACI Arteria carotis interna ACM Arteria cerebri media ACP Arteria cerebri posterior A-Mode Amplitude Modulation au² acoustic units zum Quadrat AV-Hypoplasie Hypoplasie der Arteria vertebralis BHI Bolus Harmonic Imaging B-Mode Brightness-Mode CCT Kranielle Computertomographie cm Zentimeter CT Computertomographie CW Continous-wave-Technik DEGUM Deutsche Gesellschaft für Ultraschall in der Medizin DWI diffusionsgewichtete Magnetresonanztomographie ECCS Extracranial color-coded sonography EKG Elektrokardiographie GB Gigabyte h Stunde HI Harmonic Imaging Hz Hertz i Intensität IBS Integrated Back Scatter -III- Abkürzungsverzeichnis KM Kontrastmittel l links m Meter M Monat M1 Hauptstamm der Arteria cerebri media M2 Anteil der Arteria cerebri media, der sich in der Fossa lateralis aufzweigt MFV Mean Flow Velocity = Mittlere Flussgeschwindigkeit MI Mechanical Index ml Milliliter MOD Magnetooptische Disc mRS Modified Rankin Score MRT Magnetresonanztomographie ms Millisekunden NIHSS National Institutes of Health Stroke Scale NYHA New York Heart Association o.p.B. Ohne pathologischen Befund p Irrtumswahrscheinlichkeit PESDA Perfluorocarbon-exposed sonicated dextrose albumin PET Positronenemissionstomographie PI Peak Intensität PPI Pixelwise Peak Intensity PRF Puls-Repetitions-Frequenz PW Pulse-wave-Technik PWI perfusionsgewichtete Magnetresonanztomographie QA Quartilsabstand (Spannweite der 50% mittleren Werte) r rechts RHI Replenishment Harmonic Imaging ROI Region Of Interest -IV- Abkürzungsverzeichnis s Sekunde SAB Subarachnoidalblutung SPECT Single-Photon-Emissions-Computertomographie t Zeit TCCS Transcranial color-coded sonography TCD Transkranielle Dopplersonographie TCS Transkranielle Sonographie TGC Time Gain Compensation TIBI-Klassifikation, -Score Thrombolysis-in-brain-ischemia-Klassifikation, - Score TTP Time To Peak UKM Ultraschallkontrastmittel UKS-H Universitätsklinikum Schleswig-Holstein V0 Arteria vertebralis in ihrem Abgang aus der Arteria subclavia VHS Video Home System W Watt -V- Einleitung (LQOHLWXQJXQG=LHOVHW]XQJ Die Rolle von Ultraschallverfahren bei der Diagnostik zerebraler Gefäßerkrankungen hat vor allem aufgrund ihrer vielseitigen Verwendbarkeit an Bedeutung gewonnen (Kaps, 1994). Bei zerebralen Gefäßerkrankungen sind vor allem Hirninfarkte zu nennen, die zu den häufigsten Krankheitsbildern in der Neurologie gehören. In Deutschland erleiden jährlich ca. 180.000 Menschen einen Hirninfarkt (Kolominsky-Rabas et al., 1998). Eine Letalität von 37,3% nach einem Jahr verdeutlicht die Bedeutung von Therapie und Prognose dieses Krankheitsbildes (Kolominsky-Rabas und Heuschmann, 2002). Für die effektive Therapie in der Frühphase des Infarktes ist vor allem die Erkennung der gefährdeten Infarktrandzone, der sogenannten Penumbra („tissueat-risk“) wichtig, bei der es sich um funktionsgestörtes Hirngewebe mit erhaltenem Strukturstoffwechsel handelt (Röther, 2001; Moonis, 2002). Hirntumore sind mit einer jährlichen Inzidenz von ca. 15.000 (Poeck und Hacke, 1998) zwar nicht so häufig wie Hirninfarkte, für die Betroffenen jedoch nicht minder bedrohlich. Als Kriterium für die Malignität eines Hirntumors gilt eine vermehrte Vaskularisation, die wiederum anhand der damit verbundenen Hyperperfusion mit verschiedenen bildgebenden Verfahren dargestellt werden kann (Pollard et al., 2002). Verschiedene sonographische Methoden wurden bereits vor mehreren Jahrzehnten zur Darstellung des Hirns bei diesen beiden Krankheitsbildern eingesetzt. Schon 1942 gelang Dussik sonographisch die eindimensionale Darstellung intrakranieller Strukturen, doch konnte sich auch die 1965 durch Galicich weiterentwickelte zweidimensionale Sonographie (Galicich, 1965) langfristig nicht gegen die Anfang der 70er Jahre entwickelte Computertomographie durchsetzen (Ambrose und Hounsfield, 1973). Lediglich in der Kinderheilkunde wurde dieses Untersuchungsverfahren aufgrund der besseren Schallbedingungen durch die offene Fontanelle nicht zuletzt wegen der geringen Belastung für den Patienten beibehalten. -1- Einleitung Seit Beginn der 90er Jahre konnte jedoch durch die Entwicklung niederfrequenter Ultraschall-B-Bild-Scanner erreicht werden, dass auch die intrakraniellen Strukturen des Erwachsenen zweidimensional und in Echtzeit darstellbar sind. Auf diese Weise erlangte die seit den 40er Jahren bekannte Vermessung der Mittellinie (Verlagerung des 3. Ventrikels) als prognostisches Merkmal neue Bedeutung (Seidel et al., 1996; Stolz et al., 1999; Gerriets et al., 2001). Mit der Entwicklung der transkraniellen Dopplersonographie (Aaslid et al., 1982) wurde es darüber hinaus möglich, die Blutflussgeschwindigkeiten der Hirnbasisarterien zu messen. Eine Weiterentwicklung erfuhr diese Methode durch die Kombination mit der BBild-Sonographie zur sogenannten transkraniellen farbkodierten Duplex- sonographie (Transcranial color-coded sonography = TCCS), bei der das helligkeitsgewichtete Brightness-(B-) Bild mit der farbkodierten Darstellung der Flussgeschwindigkeiten kombiniert wird, so dass eine leichtere räumliche Zuordnung der Strukturen im zweidimensionalen Bild gelingt. Mit dieser Methode können Stenosen und Verschlüsse der Hirnbasisarterien diagnostiziert werden (Becker et al., 1991). Als Bedside-Verfahren für das Monitoring von raumfordernden Hirninfarkten gelangte die TCCS zu einer gewissen Bedeutung, da anhand dieses Verfahrens sowohl Aussagen über die Flussgeschwindigkeiten der Hirnbasisarterien als auch über infarktbedingte Veränderungen des Parenchyms und der Ventrikel getroffen werden können (Seidel et al., 1995). Auf diese Weise ist im Gegensatz zu der kraniellen Computertomographie (CCT) und der Magnetresonanztomographie (MRT) eine kombinierte Darstellung struktureller und funktioneller Informationen möglich. Ein limitierender Faktor der transkraniellen Sonographie (TCS) ist dagegen vor allem der zu durchdringende Schädelknochen, durch den es örtlich zu einer schlechteren Auflösung kommen kann bzw. durch den bestimmte Areale nicht beurteilt werden können. Ein Vorteil der TCS gegenüber der CCT ist die fehlende Strahlenbelastung. Darüber hinaus ist die Sonographie kostengünstig und kann jederzeit am Patientenbett durchgeführt werden, so dass Wartezeiten und Anfahrtswege entfallen und der Patient kontinuierlich überwacht werden kann. -2- Einleitung Eine Weiterentwicklung erfuhr die TCS durch den Einsatz von Ultraschallkontrastmitteln (UKM), die gashaltige Mikrobläschen in wässriger Suspension enthalten. Die UKM führen zu einer Verbesserung des SignalRausch-Verhältnisses. Ihre Anwendung stellt die Grundlage für die Schnittbilddarstellung der Hirnperfusion mit Ultraschallverfahren dar und steigert die Erfolgsrate der transkraniellen Darstellung der basalen Hirnarterien bei ungenügendem Schallfenster um 80 – 95 % (Seidel et al., 2003). Ihre Eigenschaften sind die Voraussetzung für neue sonographische Verfahren wie das sogenannte Harmonic Imaging (HI). Bei diesem Verfahren werden selektiv die harmonischen Eigenschaften der UKM-Mikrobläschen analysiert. Da die UKM im Vergleich zum Hirngewebe besonders bei den niedrigen Beschallungsintensitäten des HI gut resonieren, ist dieses Verfahren sehr gut geeignet, um die Kontrastmittelbläschen in der zerebralen Mikrozirkulation nachzuweisen (Seidel und Meyer, 2001). Die vorliegende Arbeit beschäftigt sich mit der Anwendung von HI bei zwei Patientengruppen. Zum einen Patienten mit akutem Hirninfarkt, die möglicherweise Hirnareale mit Perfusionsminderung aufweisen und zum anderen Patienten mit Hirntumoren, die neben Arealen mit Perfusionsminderung auch Areale mit Perfusionssteigerung (Neovaskularisation) als Zeichen der Malignität aufweisen können. Im Einzelnen gilt es, folgende Fragen zu klären: 1. Lassen sich Areale mit Hypo- oder Hyperperfusion mit Harmonic Imaging bei beiden Patientenkollektiven darstellen ? 2. Wie korrelieren Areale mit Hypo- oder Hyperperfusion mit den entsprechenden Regionen in den Referenzschnittbildverfahren (CCT / MRT) ? 3. Korreliert der Status der zerebralen Makrozirkulation mit den Befunden der Harmonic-Imaging-Bildgebung bei Patienten mit Hirninfarkt ? 4. Wie ist die prognostische Bedeutung der Harmonic-Imaging-Bildgebung bei Patienten mit akutem Hirninfarkt ? -3- Material und Methoden 0DWHULDOXQG0HWKRGHQ 7HFKQLVFKH*UXQGODJHQ Die Sonographie ist eine nicht-invasive und beliebig oft wiederholbare Methode, um morphologische und funktionelle Informationen über das Körperinnere zu gewinnen. Durch diese Eigenschaften sowie die Tatsache, dass bei der Sonographie keine Strahlenbelastung entsteht, ist sie für die Diagnostik in vielen medizinischen Fächern essentiell. Bei der neurologischen Diagnostik sind dabei vor allem Doppler- und Farbduplexsonographie von Bedeutung (Soldner, 1998). Bei der Sonographie sendet ein piezoelektrischer Signalgeber hochfrequente Schallwellen im Megahertzbereich in den zu untersuchenden Körper, wo je nach Gewebszusammensetzung bzw. Schallwiderstand (Impedanz) eine unter- schiedliche Ausbreitung erfolgt. An Grenzflächen zwischen Geweben unterschiedlicher Impedanz wird ein Teil der Schallwellen reflektiert oder gestreut, der dann als Echosignal vom Empfänger aufgenommen und für die Bildverarbeitung weiterverarbeitet werden kann. Hohe Impedanzunterschiede wie z.B. zwischen Luft und Wasser führen dabei zur Totalreflexion. Damit diese nicht schon an der Körperoberfläche erfolgt, wird dort der Effekt der Totalreflexion durch Kontaktgel minimiert. Aufgrund der Zeitverzögerung zwischen Aussendung des Echosignals und Empfang der reflektierten Wellen wird die zwischen Grenzfläche und Empfänger zurückgelegte Entfernung ermittelt. Dabei ist jedoch zu beachten, dass die Schallwellen bei zunehmender Entfernung abgeschwächt werden. Dies schränkt vor allem die Diagnostik mit hohen Frequenzen ein. $0RGH A-Mode steht für Amplitude Modulation und beschreibt die eindimensionale Darstellung der empfangenen Signale in einem Koordinatensystem. Dabei wird die Eindringtiefe auf der Abszisse, die Intensität des Signals hingegen auf der Ordinate aufgetragen (Drese et al., 1966). Durch die hiermit mögliche Darstellung des sogenannten Mittellinienechos -4- des Hirns kann eine Material und Methoden Massenverschiebung der Hirnhälften sichtbar gemacht werden. Auf der A-ModeTechnik basieren alle zwei- und dreidimensionalen Ultraschallverfahren. %0RGH Der in der Brightness-Mode-Technik (B-Mode-Technik) verwendete elektronische Scanner verfügt über viele Einzelwandler nebeneinander, welche simultan mehrere Scanlinien darstellen können. Die Abbildung erfolgt dabei nicht als Kurve wie bei der A-Mode-Technik. Die reflektierten Signale werden statt dessen je nach ihrer Stärke durch unterschiedliche Graustufen dargestellt – je stärker das empfangene Signal, desto heller. Auf diese Weise kann ein zweidimensionales Schnittbild erzeugt werden. Darüber hinaus ist es durch hohe Wiederholungsraten von 10 - 50 Hz möglich, ein sogenanntes Echtzeitbild (Real-Time-Sonographie) zu erzeugen (Kanzer, 1970). 'RSSOHUVRQRJUDSKLH Parallel zur B-Mode-Technik wurde die Dopplersonographie entwickelt, die sich des nach dem österreichischen Physiker Christian Doppler benannten DopplerEffektes bedient (Doppler, 1842). Dieser beruht auf einer Frequenzverschiebung, die bei einer Veränderung des Abstands zwischen Sender und Empfänger entsteht. Bei der Dopplersonographie werden die korpuskulären Bestandteile des Blutes beschallt. Durch die Flussgeschwindigkeit dieser Teilchen wird eine Berechnung der Doppler-Frequenzverschiebung möglich, wobei ein Fluss auf die Sonde zu eine Frequenzerhöhung des gestreuten Schalls bewirkt und umgekehrt. Allgemein ist eine Unterscheidung zwischen Continuous-wave- und Pulse-waveDoppler möglich: Bei der Continuous-wave-Technik (CW) erfolgen Schallaussendung und - empfang kontinuierlich durch jeweils einen Kristall. Ein Problem stellt jedoch die Überlagerung aller bewegten Echos unterhalb des Schallkopfes dar, so dass eine Trennung dicht benachbarter Strukturen nur schwer möglich ist. Vorteile sind hingegen, dass Gefäße leichter gefunden und auch höhere Geschwindigkeiten bestimmt werden können. Anwendung findet diese Methode bei der extrakraniellen Dopplersonographie. -5- Material und Methoden Bei der Pulse-wave-Technik (PW) sendet ein Kristall gepulste Signale aus und empfängt diese in der Sendepause auch wieder. Der Vorteil gegenüber anderen Verfahren besteht darin, dass durch die Zeitdifferenz zwischen Aussendung und Empfang sowohl Geschwindigkeit als auch die Tiefe eines beschallten Körpers bestimmt werden können (Haerten, 1998). Allerdings können durch das Hin- und Herschalten zwischen Senden und Empfang nur Signale eines engen Zeitraumes ( = sample volume) berechnet werden. Darüber hinaus kann der Dopplershift nicht mehr genau gemessen werden, sobald die Frequenz, mit der auf Empfang umgeschaltet wird (= Puls-Repetitions-Frequenz), die Hälfte des Dopplershifts (= Nyquist-Limit) überschreitet. Dieses Phänomen wird als das Alias-Phänomen bezeichnet. Die PW-Methode wird vor allem für die Transkranielle Dopplersonographie (TCD) und die farbkodierte Duplexsonographie angewandt. Die Dopplersonographie fand seit den 70er Jahren zunächst lediglich bei extrakraniellen Gefäßen klinische Anwendung. Anfang der 80er Jahre gelang dann Aaslid und Mitarbeitern die transtemporale Darstellung der Hirnbasisarterien mit niederfrequentem Ultraschall (1-2,5 MHz), mit dem eine höhere Eindringtiefe erreicht werden kann (Aaslid et al., 1982). Heute zählt diese sogenannte transkranielle Dopplersonographie (TCD) bei der Untersuchung der basalen Hirnarterien zur Standarddiagnostik. Auf den abgeleiteten Dopplerfrequenzspektren der TCD basiert die Thrombolysisin-brain-ischemia (TIBI) Klassifikation, die typische pathologische Flusssignale der A. cerebri media im akuten Hirninfarkt unterteilt, siehe auch Tabelle 2.1 (Demchuk et al., 2001). -6- Material und Methoden TIBI-Score Kriterien Grad 0: kein Flusssignal - fehlende Flusssignale sind definiert als das Fehlen regelmäßiger, pulsatiler arterieller Signale trotz wechselnder Stärke des Hintergrundrauschens Grad 1: minimal - systolische Spikes variabler Geschwindigkeit und Ausprägung kein diastolisches Flusssignal in allen Herzzyklen, basierend auf der visuellen Interpretation von Perioden ohne Flusssignal während der Enddiastole Flussumkehr ist eine Unterform des minimalen Flusses verringerter systolischer Anstieg positive enddiastolische Geschwindigkeit und Pulsatilitätsindex < 1,2 normaler systolischer Anstieg positive enddiastolische Geschwindigkeit abgeschwächte mittlere Flussgeschwindigkeiten (MFV) von über 30% verglichen mit der Gegenseite MFV von über 80 cm/s UND Geschwindigkeitsdifferenz von mehr als 30% verglichen mit der Gegenseite wenn beide Seiten betroffen sind und infolge geringer enddiastolischer Geschwindigkeiten eine MFV von < 80 cm/s aufweisen, eine mittlere Flussgeschwindigkeit von > 30% verglichen mit der Gegenseite UND Anzeichen für Turbulenzen unter 30% Differenz der MFV verglichen mit der Gegenseite ähnliche Wellenform verglichen mit der Gegenseite - - Grad 2: schwach - Grad 3: gedämpft - Grad 4: stenotisch - - Grad 5: normal - - 7DEHOOH Beschreibung der Thrombolysis-in-brain-ischemia- (TIBI-) Klassifikation nach Demchuk; MFV = Mean Flow Velocity (mittlere Flussgeschwindigkeit); der Pulsatilitätsindex (Gosling und King, 1974) bezeichnet die Differenz aus maximaler systolischer und enddiastolischer Flussgeschwindigkeit geteilt durch die mittlere Geschwindigkeit. )DUEGXSOH[VRQRJUDSKLH Bei der Farbduplexsonographie handelt es sich um eine Kombination aus B-Bild und zweidimensionaler Darstellung der mittleren intensitätsgewichteten Flussgeschwindigkeiten, die auf das B-Bild superponiert wird (Barber et al., 1974). -7- Material und Methoden Mit Hilfe der Pulse-Wave-Sonographie kann die Blutflussgeschwindigkeit in den verschiedenen Lokalisationen des B-Bildes gemessen werden. Auf diese Weise ist die gleichzeitige Beurteilung von Parenchym und qualitativer sowie quantitativer Flussgeschwindigkeit in Echtzeit möglich. Man erhält somit das Triplex-Verfahren, mit dem die diagnostische Sicherheit bei der Zuordnung von Flusssignalen verbessert werden kann (Furuhata, 1988; Bogdahn et al., 1990; Tsuchiya et al., 1990; Haerten, 1998). Durch die Farbgebung rot wird ein Fluss auf die Sonde zu kodiert, blau hingegen bedeutet Fluss von der Sonde weg. Durch Veränderungen des darzustellenden Flussgeschwindigkeitsbereiches (Puls-Repetitions-Frequenz = PRF) können pathologische Gefäßsegmente dargestellt werden. Eingeschränkt wird dieses Verfahren dadurch, dass die Dopplersonographie ihr Optimum bei der Messung der Flussgeschwindigkeit bei einem Winkel von 0° zum Schallstrahl erreicht, der B-Mode hingegen Grenzflächen bei 90° optimal darstellt. Bei einem anderen Wert als 0° oder 180° misst die Dopp lersonographie eine falsch zu kleine Flussgeschwindigkeit. Die Dopplerformel besagt, dass Schallwellen ihre Frequenz in Abhängigkeit von der relativen Bewegung von Sender und Empfänger verändern. Dies kann auch zur Berechnung der Geschwindigkeit von Blutkörperchen dienen: 9= )G ⋅ & 2 )0 ⋅ cos α Fd = Dopplershift, also die Differenz zwischen Sende- und Empfangsfrequenz F0 = Ausgangsfrequenz V = Geschwindigkeit der Blutkörperchen :LQNHO]ZLVFKHQHPLWWLHUWHP8OWUDVFKDOOXQG6WUömungsrichtung C = Schallgeschwindigkeit im Weichteilgewebe Aus dieser Formel wird ersichtlich, dass die gemessene Geschwindigkeit der Blutkörperchen auch vom Einfallwinkel des Ultraschalls abhängt, so dass der Messfehler bei bekanntem Winkel ausgeglichen werden kann. Einen Kompromiss stellt ein Winkel von < 30° dar, da de r Messfehler bei fehlender Winkelkorrektur unter 15 % liegt. -8- Material und Methoden Die Farbduplexsonographie kann auch transkraniell erfolgen und wird seit ihrer Beschreibung 1988 als transkranielle farbkodierte Sonographie (Transcranial color-coded sonography = TCCS) bezeichnet (Furuhata, 1988). Verwendet werden hier Sektorsonden mit 2-2,5 MHz. Diese werden auch in der Echokardiographie angewendet, allerdings mit anderen Geräteparametern. Über ein transtemporales Schallfenster ist die Diagnose von intrakraniellen Gefäßverschlüssen, Stenosen, Vasospasmen nach Subarachnoidalblutung (SAB), Angiomen, Aneurysmen und Kollateralen bei proximalen Gefäßverschlüssen (Becker et al., 1991; Kaps, 1992; Seidel et al., 1995), sowie ein Monitoring bei der Lysebehandlung von Hirninfarkten möglich (Eggers et al., 2003). Darüber hinaus können anatomische Strukturen wie der I.-III. Ventrikel und transnuchal der vertebrobasiläre Kreislauf zuverlässig dargestellt werden. Der Verlagerung des III. Ventrikels kommt dabei als prognostischem Parameter bei raumforderndem Hirninfarkt und intrazerebralen Blutungen eine besondere Bedeutung zu (Seidel et al., 1996; Stolz et al., 1999; Gerriets et al., 2001). Jedoch erfährt auch die TCCS Einschränkungen in der Anwendung: Zum einen besitzen 15-20 % der Mitteleuropäer eine so kräftige Temporalschuppe, dass diese durch den Ultraschall nicht oder nur eingeschränkt durchdrungen werden kann (Grolimund, 1986; Seidel et al., 1995). Zum anderen sind beim Schädel relativ große Eindringtiefen notwendig, die nur durch niedrige Beschallungsfrequenzen erreicht werden können. Diese wiederum bedingen eine schlechtere Auflösung. Eine verbesserte Darstellung des Hirnparenchyms ist durch die Anwendung von Ultraschallkontrastmitteln (UKM) möglich (Kaps et al., 1999; Seidel et al., 2000). Die von mir verwendeten UKM bestehen aus gashaltigen Mikrobläschen in wässriger Suspension, die intravenös appliziert werden. Die gashaltigen Mikrobläschen können aufgrund ihrer Größe und Hülle den Lungenkreislauf passieren und wirken als Echoverstärker für den Ultraschall (Seidel und Meyer, 2001). Zum einen wurde Levovist® (Schering, Berlin, Deutschland) in einer Konzentration von 400 mg Mikropartikel pro Milliliter verwendet. Bei diesem Kontrastmittel, das seit 1995 zur Neurosonologie zugelassen ist, sind die Luftbläschen von Palmitinsäure umhüllt und an ein Galaktosemikrobläschen adsorbiert. Indikationen für die Verwendung von Levovist® sind die ein- und zweidimensionale dopplersonographische Blutflussdarstellung bei Patienten mit -9- Material und Methoden unzureichenden Dopplersignalintensitäten, Erkrankungen im Bereich des linken Herzens, Erkrankungen peripherer Arterien und Venen, Tumorerkrankungen zur Feststellung des Vaskularisationsausmaßes sowie zur Diagnose des vesikoureteralen Refluxes bei Kindern. Eine Anwendung ist nicht zulässig bei Galaktosämie, schwerer Herzinsuffizienz (NYHA III und IV) sowie schweren, vor allem obstruktiven Lungenerkrankungen. Während Schwangerschaft und Stillzeit sowie bis zu 14 Tage nach einem Myokardinfarkt sollte die Anwendung nur nach strenger Indikationsstellung vorgenommen werden. Zum anderen wurde das Kontrastmittel verwendet, SonoVue® das seit (Bracco 2001 International, zugelassen ist. Amsterdam, SonoVue® Niederlande) besteht aus Schwefelhexafluoridbläschen, die von einem Phospholipidmonolayer umhüllt und zu 90 % kleiner als 8 µm sind. Die Dispersion enthält bis zu 500 Millionen Mikrobläschen pro Milliliter und ist für Untersuchungen der Herzkammern, der großen Blutgefäße sowie zur Beurteilung von thorakalen und hepatischen Läsionen vorgesehen. Nicht angewandt werden darf SonoVue® bei kardialem Rechts-Links-Shunt, schwerem pulmonal-arteriellen oder dekompensiertem arteriellen Hypertonus sowie bei akutem Atemnotsyndrom. Eine strenge Indikationsstellung ist für die Anwendung bei dekompensierter Herzinsuffizienz, einer schweren pulmonalen Erkankung, bis zu drei Tage nach Myokardinfarkt oder einer fortgeschrittenen Leber- oder Nierenerkrankung erforderlich. +DUPRQLF,PDJLQJ Bei der Verwendung von UKM gibt es verschiedene Möglichkeiten der Interaktion zwischen UKM-Mikrobläschen und dem Ultraschall, u.a. Streuung, Resonanz, Fusion und Ruptur. Diese Interaktionen können neben- und nacheinander stattfinden. Die Resonanz bildet die Grundlage für das sogenannte Harmonic Imaging (HI), da die in Resonanzschwingungen versetzten Mikrobläschen selbst Ultraschall mit harmonischen Ober- und Unterschwingungen aussenden. Diese „harmonische Signatur“ kann selektiv analysiert und für die Bildgebung genutzt werden. Beim HI wird der Empfänger auf das Doppelte der emittierten Frequenz eingestellt (3 - 5 MHz). Dies entspricht der ersten harmonischen Oberschwingung. Da UKM vor allem bei diesen niedrigen Frequenzen im Vergleich zum Parenchym gut -10- Material und Methoden resonieren, ist mit dem HI eine Darstellung auch von kleinen Gefäßen (Mikrozirkulation) besonders gut möglich (Burns 1996, Seidel und Meyer, 2001). Bei einer anderen Art der Interaktion von UKM und Ultraschall, der Ruptur, macht man es sich zunutze, dass die UKM-Bläschen beim Zerplatzen ihre gesamte Ultraschallenergie auf einmal abgeben. Dieses Phänomen wird als stimulierte Emission bezeichnet. Da aber auch resonierende Mikrobläschen rupturieren können, ist für die Darstellung der Mikrozirkulation eine Verlängerung des Interpulsintervalls notwendig, damit zwischen zwei Pulsen eine Wiederauffüllung des Kapillarbetts gewährleistet wird. Das HI erfuhr bisher u.a. Anwendung in der Darstellung des myokardialen Blutflusses (Wei et al., 1998), erwies sich jedoch ebenso für die Untersuchung von Leberläsionen (Beissert et al., 2000) und malignen Neoplasien des Magens (Okanobu et al., 2002) sowie zur Verbesserung der Darstellung von Strukturen in der Kopf-Hals-Region als geeignet (Schade, 2001). Aber auch die Darstellung der Hirnperfusion bei gesunden Personen (Seidel et al., 1999; Seidel et al., 2002) sowie die Identifizierung von Perfusionsdefiziten beim akuten Hirninfarkt ist mit dem Harmonic Imaging möglich (Federlein et al., 2000; Seidel et al., 2003; Wiesmann et al., 2004). Beim sogenannten Bolus Harmonic Imaging (BHI) wird die Kontrastmittelkinetik nach UKM-Bolusinjektion minderperfundierte dargestellt. Regionen beim Auf diese Hirninfarkt Weise aufgezeigt können und Ein- z.B. und Auswaschkurven analysiert werden. Eine kontinuierliche UKM-Zufuhr mit Ausbildung eines Steady-State-Zustandes ermöglicht unter anderem die Darstellung der Auffüllkinetik nach Zerstörung des UKM in den beschallten Regionen. Beim sogenannten Flash-ReplenishmentImaging ist es dem UKM möglich, nach Zerstörung durch einen initialen starken Ultraschallpuls nachzufluten (Schlosser et al., 2001). Das in das beschallte Volumen einströmende UKM wird mit niedriger Ultraschallenergie (ohne Zerstörung) mit dem HI-Verfahren detektiert. Auf diese Weise kann die Wiederauffüllkinetik analysiert werden. Vorteil dieses Verfahrens ist, dass es binnen weniger Sekunden durchgeführt werden kann. Die Anwendung dieser Methode wird bei der Darstellung intrakranieller Strukturen jedoch durch die Schädelkalotte verhindert, da hier nur Ultraschallpulse mit maximaler Energie zur Anwendung kommen können. Um dennoch -11- die Wiederauffüllkinetik in Material und Methoden vergleichbarer Weise zur Darstellung bringen zu können, werden die Pulsabstände sukzessiv auf 2500 – 4000 ms erhöht. Dieses Verfahren wird als Replenishment Harmonic Imaging (RHI) bezeichnet (Seidel et al., 2002). Nachteil dieses Verfahrens ist, dass es durch die relativ großen Bildabstände leicht zu Bewegungsartefakten kommen kann. Im Rahmen der Zusammenarbeit mit dem Institut für Signalverarbeitung und Prozessrechentechnik der Universität zu Lübeck wurde das sogenannte BHI-ViewProgramm entwickelt (Metzler et al., 2003). Mit diesem können aus Ultraschallbildsequenzen nach Kontrastmittelinjektion Auswaschkinetiken im Hirnparenchym (s. Abb. 2.1) und mit Hilfe eines separaten Mikrocomputersystems Parameterbilder zur Beschreibung der Kontrastmittelkinetik erstellt werden. Ein sogenanntes Pixelwise-Peak-IntensityBild (PPI-Bild) enthält die normierten maximalen Intensitäten aller für die Auswertung verwendeten Grauwertbilder nach Abzug der gemittelten Werte vor dem Beginn der UKM-Wirkung. Für eine bessere Darstellung werden dann für jedes Pixel die ermittelten Maxima anhand einer Skala in Farbwerte von schwarz (0 %) über rot, orange und gelb nach weiß codiert. Die „Time To Peak“ bezeichnet das Intervall zwischen Beginn der Kontrastmittelanflutung bis zum Erreichen der maximalen Signalintensität (siehe Abbildung 2.1). Beim Time-To-Peak-Bild (TTPBild) repräsentiert jedes Pixel einen Wert, der für die Verzögerung zwischen Beginn der UKM-Wirkung und Maximum (Peak) im jeweiligen Punkt steht. Beim TTP-Bild werden die Werte anhand einer Skala in Blautönen codiert (Metzler et al., 2003). Auf diese Weise kann ein Teil der Information der Einwaschkinetik aus einer gesamten Bildschleife in einem Bild zusammengefasst werden. -12- ,QWHQVWLWlW Material und Methoden =HLW,QWHQVLWlWV.XUYH imax PI i0 t0 TTP tmax =HLW $EELOGXQJ Zeit-Intensitäts-Kurve nach Injektion eines Kontrastmittelbolus. Die Peak Intensität (PI) beschreibt die Differenz zwischen der maximalen Signalntensität imax und der basalen Intensität i0. Die Time to peak (TTP) bezeichnet die Zeit zwischen Anflutungsbeginn des Kontrastmittelbolus im Hirnparenchym t0 bis zum Erreichen der maximalen Konzentration tmax. *HUlWHWHFKQLNXQG.RQWUDVWPLWWHO Verwendet wurde ein Sonos 5500 Ultraschallsystem (Philips Medizinische Systeme, Best, Niederlande, Produktnummer 77768A), das in der Klinik für Neurologie des UKS-H, Campus Lübeck, täglich für die intra- und extrakranielle Diagnostik eingesetzt wird. Bei den Schallköpfen handelte es sich um den S4 1,8/3,6-MHz-Sektorschallkopf (Produktnummer 21330A, Philips) zur transtemporalen Untersuchung der Hirnbasisarterien und einen 7,5-MHz-Linearschallkopf (Produktnummer 21358B, Philips) zur Untersuchung der extrakraniellen Gefäße. Die Untersuchungstiefe betrug sowohl bei der TCCS als auch beim Harmonic Imaging 10 cm, mit einem Fokus auf 8 cm. Der Mechanical Index (MI) gilt als Maß für die Fähigkeit des Ultraschalls, im Gewebe Bioeffekte hervorzurufen und liegt bei dem hier verwendeten Schallkopf bei maximal 1,7. Dies entspricht einer maximalen Energiezufuhr von 366,2 W/cm². Für die vorliegenden Untersuchungen wurde ein MI von 1,6 gewählt. Die Time Gain Compensation (TGC), also die individuelle Signalverstärkung in einer definierten Eindringtiefe, wurden für jeden Patienten individuell eingestellt und für Verlaufsuntersuchungen reproduziert. Die Untersuchungen erfolgten im -13- Material und Methoden sogenannten Integrated Back Scatter (IBS) Modus, der im Gegensatz zum normalen Ultraschallverfahren die Analyse der Daten ohne die Bildnachverarbeitung (logarithmische Kompression) ermöglicht. Als Kontrastmittel für die Ultraschalluntersuchungen wurde für die Patienten mit intrakraniellem Tumor Levovist® eingesetzt, für die Patienten mit Hirninfarkt SonoVue® (siehe auch Kapitel 2.1.4). Zur Befunddokumentation dienten ein Schwarzweiß-Thermodrucker (Sony Video Graphic Printer UP 860 CE), ein VHS-Videorecorder (Panasonic MD 830) sowie ein internes magnetooptisches Laufwerk mit 2,1 GB Speichermedien (MOD; Hewlett Packard Co., Palo Alto, CA, USA). CCT- und MRT-Bilder wurden im Rahmen der üblichen Diagnostik im Institut für Radiologie des UKS-H, Campus Lübeck (Prof. Dr. H.D. Weiss), Abteilung Neuroradiologie (Prof. Dr. D. Petersen) erstellt. Dort handelt es sich um das CT-Gerät Aquillion Toshiba sowie um das MRT-Gerät Magnetom Symphony (Siemens Medizinische Systeme, Erlangen, Deutschland). Von den MRT-Bildern wurden T1- und T2-gewichtete Aufnahmen sowie diffusions(DWI) und perfusionsgewichtete MRT-Bilder (PWI) verwendet. Als MRTKontrastmittel diente Magnevist® (Schering, Berlin, Deutschland). 3DWLHQWHQXQG8QWHUVXFKXQJVJDQJ Untersucht wurden zwei Patientenkollektive von insgesamt 34 Patienten, die stationär zwischen 06/00 und 01/03 in die Kliniken für Neurologie und Neurochirurgie der Universitätsklinik Lübeck aufgenommen wurden. Für beide Untersuchungsgruppen wurde die Zustimmung der Ethik-Kommission eingeholt. Die Untersuchungen wurden nur mit Einwilligung der Patienten durchgeführt. 3DWLHQWHQ 3DWLHQWHQPLW+LUQLQIDUNW Diese Gruppe bestand aus 23 Patienten mit Hirninfarkt, die sonographische Untersuchung erfolgte geblindet, also vor Kenntnis des initialen CCT-Bildes. Einschlusskriterium war hier ein hemisphärales zerebrovaskuläres Syndrom im Versorgungsgebiet der A. carotis interna mit Symptombeginn maximal 48 h vor der Untersuchung. Ausschlusskriterien -14- waren eine intrakranielle Blutung, Material und Methoden Symptombeginn mehr als 48 h zuvor, Schwangerschaft, eine schwere Aphasie oder eine schwerwiegende Grunderkrankung sowie ein unzureichendes Knochenfenster für die TCCS. Vor der Ultraschalluntersuchung wurden diese Patienten nach der National Institutes of Health Stroke Scale (NIHSS) beurteilt (siehe Anhang 7.1). Hierbei werden Punkte vergeben, wenn Kriterien bezüglich Bewusstsein, Motorik, Sensibilität, Sprache, Neglekt und Ataxie nicht erfüllt werden, im optimalen Zustand also 0 Punkte bis schlechtestenfalls 34 (Muir et al., 1996). Außerdem wurde der modified Rankin Score (mRS; siehe Anhang 7.2) sowohl bei Aufnahme als auch telefonisch im Verlauf nach vier Monaten erhoben (Sulter et al., 1999). Darüber hinaus wurde erfasst, ob eine Thrombolyse durchgeführt wurde. 3DWLHQWHQPLWLQWUDNUDQLHOOHP7XPRU Die andere Gruppe bestand aus elf Patienten mit nicht voroperiertem intrakraniellen Tumor, die aber einwilligungsfähig und kreislaufstabil sein mussten und einen Karnofsky-Index (siehe Anhang 7.3) von mindestens 70 % aufzuweisen hatten. Der Karnofsky-Index beurteilt das Aktivitätsniveau von Patienten unter Berücksichtigung körperlicher und sozialer Faktoren. Ausschlusskriterien waren ein Karnofsky-Index unter 70 % (Karnofsky et al., 1948), eine schwere Herzinsuffizienz (NYHA III und IV), eine schwere chronisch-obstruktive Lungenerkrankung sowie eine Galaktosämie. Die Untersuchung erfolgte hier in Kenntnis der Tumorlokalisation in CCT bzw. MRT, also nicht geblindet. )DUEGXSOH[VRQRJUDSKLHGHULQWUDXQGH[WUDNUDQLHOOHQ*HIlH Extra- und intrakranielle Farbduplexsonographie wurden bei allen Patienten mit Hirninfarkt routinemäßig in Standardtechnik nach den Richtlinien der Deutschen Gesellschaft für Ultraschall in der Medizin (DEGUM) von Mitarbeitern des Neurovaskulären Labors der Klinik für Neurologie des UKS-H, Campus Lübeck durchgeführt (Kaps, 1994). +DUPRQLF ,PDJLQJ EHL 3DWLHQWHQ PLW DNXWHP +LUQLQIDUNW QDFK 6RQR9XH,QMHNWLRQ Die Darstellung der intrakraniellen Perfusion erfolgte nach SonoVue®-Injektion bei Patienten mit akutem Hirninfarkt . -15- Material und Methoden Es wurden zwei Boli von je 2,4 ml SonoVue® sowie nachfolgend jeweils 10 ml physiologischer Kochsalzlösung intravenös von mir appliziert (unter Aufsicht eines approbierten Arztes). Gleichzeitig stellte ein Untersucher (PD Dr. med. G. Seidel oder Dr. med. K. Meyer-Wiethe) die intrakranielle Perfusion mittels Harmonic Imaging dar. Die Aufnahme bei der ersten Injektion erfolgte dynamisch, um sich einen Gesamtüberblick zu verschaffen und weitere Regionen auf Perfusionsdefekte zu untersuchen. Bei diesem Untersuchungsgang konnte aufgrund der Sondenkopfbewegung und der somit wechselnden Bildebenen keine Analyse der Perfusionskinetik durchgeführt werden. Jedoch war es möglich, Regionen mit fehlender Kontrastmittelaufnahme (Minderperfusion) zu erkennen. Die zweite Injektion erfolgte nach fünf Minuten Pause, in denen das Kontrastmittel wieder abfluten konnte. Bei dieser Untersuchung wurde der Schallkopf stationär in der diencephalen Ebene gehalten, die mit der Darstellungsebene in der Referenzbildgebung (CCT / MRT) korreliert. In dieser Ebene können der dritte Ventrikel, der Thalamus sowie das Vorderhorn des ipsilateralen Seitenventrikels gesehen werden. Die Pulsabstände wurden auf ein konstantes Intervall von 1500 ms (0,67 Hz) eingestellt, um bei allen Patienten vergleichbare Kinetiken erstellen zu können. Die Systemparameter für die Kontrastmitteluntersuchung wurden digital gespeichert. Nach vier Monaten erfolgte bei den Patienten mit Hirninfarkt eine telefonische Befragung zur Erhebung des funktionellen Outcomes. Hierbei wurde wiederum der modified Rankin Score (mRS) bestimmt (Weimar et al., 2002). +DUPRQLF ,PDJLQJ EHL 3DWLHQWHQ PLW LQWUDNUDQLHOOHP 7XPRU QDFK /HYRYLVW,QMHNWLRQ Diese Untersuchung erfolgte bei Patienten mit intrakraniellem Tumor bei einer Untersuchungstiefe von 10 cm. Analog zur Untersuchung bei den Patienten mit Hirninfarkt wurden zwei Boli verwendet, im Unterschied hierzu mit Levovist® (jeweils 5 ml à 400 mg/ml) gefolgt von je 10 ml physiologischer Kochsalzlösung. Wiederum erfolgte die erste Aufnahme dynamisch, so dass mittels Durchscannen die Schnittebene gesucht werden konnte, in der der Tumor maximal zur Darstellung kam. In dieser optimalen Schnittebene wurde der Schallkopf dann während der zweiten Untersuchung fünf Minuten später stationär gehalten. -16- Material und Methoden Die Bilderhebung erfolgte EKG-getriggert, so dass alle vier Herzschläge ein Bild erzeugt wurde. Auf diese Weise sollen Herzschlag-bedingte Bewegungsartefakte (Pulsationsartefakte) minimiert werden. 'DWHQDQDO\VH Anhand des BHI-View-Programms (Metzler et al., 2003) wurden Bilder errechnet, die die maximalen Intensitäten aller verwendeten Grauwertbilder für jedes Pixel zeigen (Pixelwise-Peak-Intensity-Bilder = PPI-Bilder). Weitere Bilder stellen die Anflutungszeit des Kontrastmittels von der Bolusgabe bis zum Erreichen des maximalen Wertes (Time-to-Peak = TTP) dar. Beim BHI-Programm handelt es sich um ein Linux Kommandozeilenprogramm (siehe Abschnitt 2.1.5). Eine Perfusionsminderung wurde für Areale mit einer Signalminderung von mindestens 50 % im PPI-Bild bzw. einer Verzögerung der Kontrastmittelanflutung von mindestens drei Sekunden im TTP-Bild angenommen. Diese Areale wurden mit Scion Image Software® für Windows (Version Beta 4.0.2) ausgemessen. Für die Auswertung der Infarktarealflächen im CCT wurden diese mit einem Scanner (Scan Jet 4C/T, Hewlett Packard Co., Palo Alto, CA, USA) eingescannt und mit Microsoft Paint® für Windows so weiterverarbeitet, dass die Infarktareale ebenfalls mit der Scion-Image-Software ausgemessen werden konnten. Bei drei Patienten wurde statt der Verlaufs-CCT-Bildgebung eine MRT durchgeführt, von der die T2gewichteten Bilder verwendet wurden. Die Auswertung erfolgte entsprechend dem Vorgehen bei den CCT-Bildern. Weder mit CCT noch mit konventioneller kranieller MRT gelingt eine sichere Darstellung von Hirninfarkten in der Frühphase des Infarktes. Bei der Darstellung des definitiven Infarktareals in der Verlaufsuntersuchung hingegen liefern beide Verfahren weitgehend übereinstimmende Daten (Mohr et al., 1995; Mullins et al., 2002). Auf diese Weise konnte ein statistischer Vergleich der Infarktareale in den Parameterbildern mit denen der CCT / MRT sowie klinischen Parametern durchgeführt werden. $XVZHUWXQJGHU3HUIXVLRQXQWHUVXFKXQJHQ Die bei den Perfusionsuntersuchungen erhobenen Daten wurden auf Videoband und digital auf einem magneto-optischem Speichermedium gespeichert und später mittels der QuantiCon Software® (GE Medical Systems Ultrasound 3D Echotech) ausgewertet. Diese kann die regionale Änderung der Grauwertstufen im Verlauf -17- Material und Methoden der Bildschleife quantitativ analysieren. Dazu wurden Messareale, sogenannte Regions Of Interest (ROIs), in den zu untersuchenden Arealen platziert. Die Software gibt dann pro Bild der Sequenz einen Intensitäts-Zahlenwert in acoustic units zum Quadrat (au²) pro ROI in eine Excel-Tabelle aus. 3DWLHQWHQPLW+LUQLQIDUNW Bei den Patienten mit Infarkt wurden Areale ohne Signalanhebung nach UKMInjektion als Infarktareale und umgebende Areale mit einer im Vergleich zum Referenzgewebe verminderten Signalintensität als Periinfarktzone definiert. Auf diese Areale sowie auf den Thalamus wurden nun ROIs platziert. Der Thalamus dient hierbei als Referenzregion, die von der A. cerebri posterior (ACP) versorgt und somit von ischämischen Ereignissen im Versorgungsgebiet der A. carotis interna nicht beeinflusst wird. Für diese Regionen konnten nun mittels der QuantiCon Software® sogenannte Zeit-Intensitäts-Kurven erstellt werden, in denen die Signalintensität für jedes Areal gegen die Zeit aufgetragen wurde. Um individuelle Störgrößen auszuschalten, wurden die ermittelten absoluten Intensitätswerte durch die maximale Intensität des ipsilateralen Thalamus dividiert, so dass man auf die individuellen Schallbedingungen normierte Werte erhielt. Anhand der Zeit-Intensitäts-Kurven wurden verschiedene Parameter erhoben, jeweils für Infarktareal und Thalamus: - Time To Peak - Absolute Steigung der Zeit-Intensitäts-Kurven - Absolute Peak-Intensität - Normierte Steigung - Normierte Peak-Intensität In den unter Verwendung des BHI-View-Programms erstellten Parameterbildern wurden die Areale mit einer Signalminderung von mindestens 50 % bzw. einer Verzögerung von mindestens drei Sekunden vermessen und mit dem definitiven Infarktareal des Verlaufs-CCT-Bildes bzw. des T2-gewichteten MRT-Bildes verglichen. Anhand des Doppler-Frequenz-Spektrums in der A. cerebri media bzw. der A. cerebri anterior, je nach betroffenem Stromgebiet, wurde der TIBI-Score ermittelt. -18- Material und Methoden 3DWLHQWHQPLWLQWUDNUDQLHOOHP7XPRU Bei diesen Patienten wurden die ROIs auf dem Tumorareal, wenn möglich getrennt auf minderperfundierter Kernregion und hyperperfundierter Randregion, sowie auf dem ipsilateralen Thalamus und der A. cerebri media platziert. Entsprechend dem Vorgehen bei den Patienten mit Hirninfarkt wurden ZeitIntensitäts-Kurven erstellt. Es kamen die identischen Parameter zum Einsatz jeweils für Tumorkern, A. cerebri media, Thalamus und, wenn möglich, Tumorrand: - Time To Peak - Absolute Steigung der Zeit-Intensitäts-Kurven - Absolute Peak-Intensität - Normierte Steigung - Normierte Peak-Intensität Es wurden keine Parameterbilder erstellt. Der Vergleich mit CCT und MRT erfolgte visuell deskriptiv. 6WDWLVWLVFKH9HUIDKUHQ Zur Berechnung von Mittelwert, Median, Standardabweichung und Quartilsabstand (QA) wurde Excel 7.0® (Microsoft, Redmond, WA, USA) verwendet. Für die Berechnung der Korrelation zwischen den einzelnen Variablen (Alter, NIHSS vor BHI, mRS vor BHI sowie nach vier Monaten, Thrombolyse, TIBI-Score, über 70%ige Stenose oder Verschluss der A. carotis interna, Fläche mit Signalminderung über 50 % im PPI-Bild = A_PPI, Fläche mit verzögerter Kontrastmittelanflutung von mindestens drei Sekunden im TTP-Bild = A_TTP, Fläche des Infarktes gemessen in der diencephalen Ebene des CCT bzw. MRT = A_Infarkt) wurde die nicht-parametrische Spearman rank Korrelation gebraucht, wobei der Korrelationskoeffizient und zweiseitige p-Werte angezeigt wurden (SPSS 11.5 für Windows, SPSS Chicago, IL, USA). Der Vergleich der Zeit-Intensitäts-Kurven erfolgte mit dem Friedman ANOVA Test (SPSS 11.5 für Windows, SPSS Chicago, IL, USA). -19- Ergebnisse (UJHEQLVVH Untersucht wurden insgesamt 34 Patienten der neurologischen und neurochirurgischen Klinik der Universitätsklinik Lübeck. Sie unterteilen sich in zwei Patientenkollektive : 23 Patienten mit territorialem Hirninfarkt, elf mit intrakraniellem Tumor. 3DWLHQWHQPLW+LUQLQIDUNW $OOJHPHLQHV Von den 23 Patienten waren zehn Frauen (43,5 %) und 13 Männer (56,5 %) im Alter von 48-77Jahren, das mittlere Alter betrug dabei 63,8 ± 8,4 Jahre, Median 67 Jahre. Der mittlere NIHSS-Score betrug 13,2 ± 7,9 (Median 11,0), der mittlere modified Rankin Score (mRS) bei Aufnahme 4,1 ± 1,0 Punkte (Median 4,0). Die genaue Verteilung des Alters sowie des NIHSS-Scores können der Tabelle 3.1 entnommen werden. Frauen (n=10) Männer (n=13) gesamt (n=23) Maximum 77 75 77 Minimum 48 49 48 Lebensjahre Mittelwert 66 62 64 Median 66 64 67 QA 8 10 7 Maximum 29 28 29 Minimum 6 1 1 Mittelwert 12 15 13 Median 8,5 14 11 QA 5,25 14 12 Maximum 5 5 5 Minimum 3 1 1 Mittelwert 4 4 4 Median 4 5 4 QA 1,5 1 1 NIHSS mRS 7DEHOOH Verteilung von Alter, Geschlecht, National Institutes of Health Stroke Scale (NIHSS) sowie modified Rankin Score (mRS); QA entspricht dem Quartilsabstand -20- Ergebnisse 'LDJQRVHQ Alle 23 Patienten hatten einen akuten Hirninfarkt im Territorium der A. carotis interna. Anhand der CCT- bzw. MRT-Bilder im Verlauf konnten 22 territoriale Infarkte im Versorgungsgebiet der A. cerebri media (ACM) sowie ein Infarkt im Versorgungsgebiet der A. cerebri anterior (ACA) festgestellt werden. Bei den 22 ACM-Infarkten handelte es sich um 15 cortico-subcorticale, vier subcorticale und drei lakunäre Infarkte. Die farbduplexsonographische Untersuchung ergab 12 ACM-Verschlüsse des M1Segmentes und zwei Verschlüsse des M2-Segmentes, vier ACM-Stenosen, vier Stenosen der A. carotis interna (ACI) von mindestens 70 % sowie drei ACIVerschlüsse. Eine genaue Verteilung der Ergebnisse der extrakraniellen und transkraniellen Farduplexsonographie ist der Tabelle 3.2 zu entnehmen. -21- Ergebnisse mRS bei Patient Alter Aufnah- mRS Infarkt- nach 4 M lokalisation TCCS ECCS me HF 00 70 5 5 1 M1-Verschl. [l] 1: ACI [l] GK 01 64 5 5 1 M1-Verschl. [r] 1:ACI [r] ES 02 62 4 * 2 M1-Stenose [r] 2: V0 [r] JC 03 48 3 0 2 o.p.B. 2: ACI [r] JS 04 67 5 6 1 M1-Verschl. [r] 1:ACI [r] JH 05 69 4 * 1 M1-Verschl. [r] o.p.B CL 07 74 3 3 1 M1-Stenose [r] o.p.B. MH 08 65 4 0 1 M1-Verschl. [l] o.p.B. JL 09 49 5 0 1 Rekanal. M1 [r] 1:ACI [r] HD 10 64 5 0 3 o.p.B. 1: V0 [r] MS 11 68 4 * 3 M1-Verschl. [r] o.p.B. GD 12 75 4 0 1 M1-Verschl. [l] o.p.B. IS 13 67 5 4 1 M1-Verschl. [r] o.p.B. BF 14 57 5 4 1 M1-Verschl. [l] o.p.B. HG 15 72 5 6 1 KO 16 66 5 6 1 HT 17 62 3 2 2 M1-Stenose [l] o.p.B. GB 18 77 4 3 2 M1-Stenose [l] o.p.B. WK 19 67 3 2 1 M2-Verschl. [l] o.p.B. HH 20 55 1 0 1 M1-Verschl. [r] o.p.B. DS 21 61 5 3 2 M1-Verschl. [r] o.p.B. RG 22 63 4 2 1 M2-Verschl. [r] AV-Hypoplasie [l] RW 23 45 4 2 3 o.p.B. o.p.B. Carotis-TVerschl. [l] Carotis-TVerschl. [l] 2: ACI [l] 2: ACI [l] 7DEHOOH Patientenübersicht mit modified Rankin Score (mRS) bei Aufnahme und nach vier Monaten. Die mit * gekennzeichneten Patienten konnten telefonisch nicht erreicht werden; bei der Infarktlokalisation bedeutet 1 einen cortico-subcorticalen Infarkt, 2 einen subcorticalen und 3 einen lakunären Hirninfarkt. In der mit TCCS gekennzeichneten Spalte sind die Ergebnisse der transkraniellen Farbduplexsonographie, aufgeteilt auf die einzelnen Segmente der A. cerebri media, aufgeführt. M1 bezeichnet den Hauptstamm der A. cerebri media, M2 den sich in der Fossa lateralis aufzweigenden Anteil. [l] bedeutet links, [r] rechts. Bei den Ergebnissen der extrakraniellen -22- Ergebnisse Farbduplexuntersuchung (ECCS) steht 1 für Stenose von mindestens 70 %, 2 für Verschluss; ACI steht für A. carotis interna, V0 bezeichnet die A. vertebralis an ihrem Abgang aus der A. subclavia, o.p.B bedeutet „ohne pathologischen Befund“, Carotis-T-Verschluß bedeutet einen Verschluß der Gabelung der A. carotis interna in die A. cerebri media und anterior; AV-Hypoplasie = Hypoplasie der A. vertebralis. (UJHEQLVVHGHV%ROXV+DUPRQLF,PDJLQJ%+, Für diese Untersuchung war ein ausreichendes Knochenfenster Voraussetzung. Sie wurde im Mittel 11,3 ± 10,9 Stunden, Median 6,5 Stunden nach Symptombeginn durchgeführt (QA 9,5). Der Untersucher war gegenüber den Ergebnissen des initialen CCT-Bildes geblindet und hatte lediglich klinische Informationen bezüglich des Schlaganfalls im Stromgebiet der A. cerebri media. Bei allen untersuchten Patienten führte das Kontrastmittel SonoVue® zu einem Kontrastmitteleffekt, der eine ausreichende Qualität für weitere Analysen bot. Bei 19 der 22 Patienten mit ACM-Infarkt (86,4 %) war es möglich, ein Areal mit signifikanter Signalminderung von mindestens 50 % im PPI-Bild nachzuweisen. Von den übrigen drei Patienten wiesen zwei computertomographisch lediglich einen kleinen lentikulostriatalen Infarkt auf. Bei sieben der 19 Patienten (36,8 %) mit Signalminderungsarealen im PPI-Bild zeigte das TTP-Bild eine Verzögerung von mindestens drei Sekunden. Kein Patient zeigte eine isolierte TTP-Verzögerung ohne Kontrastminderung im PPI. Bei dem Patienten mit ACA-Infarkt konnte aufgrund der anatomischen Lokalisation der Infarkt in der diencephalen Ebene nicht dargestellt werden. Abbildung 3.1 verdeutlicht die Darstellbarkeit eines Mediainfarktes am Beispiel von Patient JS 04. -23- Ergebnisse A B C D ( ,QWHQVLWlW>DXð@ 10 Infarktkern Periinfarktzone Thalamus 5 0 1 10 19 =HLW>V@ 28 $EELOGXQJ A: Pixelwise-Peak-Intensity-Bild (PPI-Bild), die grüne Linie markiert das minderperfundierte Areal; B: Time-To-Peak-Bild (TTP-Bild), die grüne Linie umfährt das Areal mit signifikanter Perfusionsverzögerung; C: Initiales CCT-Bild drei Stunden nach Symptombeginn (die * gelbe Linie umfährt das Beschallungsfeld der BHI-Untersuchung); D: Verlaufs-CCT-Bild nach 30 Stunden; E: Zeit-Intensitäts-Kurven für das Areal ohne Signalanhebung nach UKM-Gabe (Infarktkern) und die Periinfarktzone mit relativer Signalminderung verglichen mit dem Thalamus -24- Ergebnisse als Referenzregion. Gezeigt werden die Untersuchungsergebnisse eines 67-jährigen Patienten mit Mediainfarkt rechts bei M1-Verschluss. Die BHI-Untersuchung wurde sechs Stunden nach Symptombeginn durchgeführt. Bei der initialen Untersuchung betrug der NIHSS 21 Punkte, der mRS fünf Punkte. Die im PPI-Bild gemessene Fläche des minderperfundierten Areals betrug 11,64 cm², die Fläche mit Signalverzögerung im TTP-Bild 17,59 cm². Die Fläche des Infarktareals in der diencephalen Ebene des Verlaufs-CCT-Bildes betrug 47,35 cm². Die CCT-Bilder wurden hier gespiegelt, um einen besseren Vergleich zu ermöglichen. Der Patient verstarb zwei Tage nach Symptombeginn an den Folgen der zerebralen Herniation bei raumforderndem Mediainfarkt. 8QWHUVXFKXQJGHU=HLW,QWHQVLWlWV.XUYHQ Durch Analyse der Grauwertbildschleifen können nach SonoVue® Bolusinjektion Zeit-Intensitäts-Kurven erstellt werden, die im normal durchbluteten Hirngewebe eine Zunahme der Intensität in der Kontrastmitteleinwaschphase und eine Abnahme der Intensität in der Kontrastmittelauswaschphase abbilden (siehe Abbildung 3.2). Dies gelang bei 19 der 23 Patienten, bei den übrigen vier Patienten war eine weitere Auswertung aufgrund der Qualität der Grauwertdaten in dieser Form nicht möglich. Bei der Untersuchung der Zeit-Intensitäts-Kurven ergaben sich starke interindividuelle Schwankungen der untersuchten Parameter (Steigung und Peak-Intensität der Kurven, jeweils absolut und normiert, sowie Time To Peak). =HLW,QWHQVLWlWV.XUYH ,QWHQVLWlW>DXð@ 3 2 Infarktkern Periinfarktzone Thalamus 1 0 1 10 19 =HLW>V@ $EELOGXQJ Diese Zeit-Intensitäts-Kurve zeigte ein 70-jähriger Patient mit subtotalem Mediainfarkt links in der Bolus-Harmonic-Imaging-Untersuchung (BHI) 4,5 Stunden nach Symptombeginn. „Infarktkern“ bezeichnet das Areal ohne Signalanhebung nach UKM-Bolus. Bei der Periinfarktzone handelt es sich um das Areal mit nachweisbarem Kontrasteffekt, aber einer relativen Signalminderung von mindestens 50 % verglichen mit dem Thalamus als Referenzregion. Farbduplexsonographisch zeigte sich ein Mediahauptstammverschluss links sowie eine 90%ige Abgangsstenose der A. carotis interna links. Der initiale NIHSS (National Institutes of Health Stroke Scale) betrug 25 Punkte, der mRS (modified Rankin Score) sowohl bei Aufnahme als auch bei der telefonischen Nachbefragung nach 102 Tagen fünf Punkte. Im Vergleich zur Abbildung 3.1 E werden die großen interindividuellen Schwankungen der Werte deutlich. -25- Ergebnisse Es wurden zunächst die absoluten Werte der Time To Peak, der Steigung der SonoVue®-Anflutung bis zum maximalen Wert (peak) sowie die Amplitude der Peak-Intensität für das Infarktareal (Infarktkern) und den Thalamus erhoben. Eine genaue Verteilung der jeweiligen absoluten minimalen, maximalen und Mittelwerte ist der Tabelle 3.3 zu entnehmen. TTP Infarktareal Thalamus Maximal 19,48 16,52 Minimal 4,48 4,52 9,92 ± 4,77 9,95 ± 3,61 Maximal 0,22 4,31 Minimal 0,002 0,05 0,06 ± 0,06 0,72 ± 0,95 Maximal 1,81 41,06 Minimal 0,04 0,56 0,59± 0,56 7,00 ± 9,43 Mittelwert ± Standardabweichung Steigung Mittelwert ± Standardabweichung Peak-Intensität Mittelwert ± Standardabweichung 7DEHOOHAbsolutwerte der Time To Peak (TTP) in Sekunden, der Steigung (in au² pro Sekunde) sowie der Peak-Intensität (in au²) für Infarktareal und Thalamus, jeweils aufgeteilt in maximalen, minimalen und Mittelwert. Der statistische Vergleich der TTP von Infarktareal und Thalamus mit dem Friedman-Test ergab lediglich einen diskreten, nicht signifikanten Unterschied (Irrtumswahrscheinlichkeit p = 0,67). Die Absolutwerte der Steigungen waren in der Thalamusregion verglichen mit dem Infarktareal signifikant höher (p < 0,001), jedoch mit großen interindividuellen Schwankungen. Auch die absoluten PeakIntensitäten zeigten sich im Thalamus signifikant höher (p < 0,001). Um einen besseren interindividuellen Vergleich zu erhalten, wurden die PeakIntensitäts-Werte normiert: Das jeweilige Peak-Maximum im Thalamus wurde gleich eins gesetzt und die Intensitätswerte im Infarktareal des jeweiligen Patienten hierauf bezogen. Die genaue Verteilung der normierten Werte der Steigung im Infarktareal und Thalamus gibt die Tabelle 3.4 wieder. -26- Ergebnisse Steigung Infarktareal Thalamus Maximal 0,07 0,19 Minimal 0,0001 0,05 0,02 ± 0,02 0,11± 0,04 Maximal 0,63 1 Minimal 0,001 1 0,17± 0,18 1 Mittelwert ± Standardabweichung Peak-Intensität Mittelwert ± Standardabweichung 7DEHOOH Normierte Werte der Steigung im Infarktareal und im Thalamus sowie der PeakIntensität im Infarktareal (normiert auf Peak-Intensität im Thalamus). Auch bei den normierten Werten zeigte der Thalamus signifikant höhere Steigungen (p < 0,001) sowie Peak-Intensitäten (p < 0,001). Bei der Untersuchung der Peak-Latenz, also des zeitlichen Abstands zwischen Peak im Thalamus und im Infarktareal, zeigte sich die Peak-Intensität bei acht Patienten im Infarktareal später als im Thalamus, im Mittel 5,99 ± 2,26 Sekunden. Bei fünf Patienten ergab sich kein Unterschied zwischen den Peak-Zeitpunkten, bei sechs Patienten lag die Peak-Zeit im Infarktareal im Mittel 2,77 ± 1,47 Sekunden vor der im Thalamus. Mögliche Ursachen hierfür sind eine frühe Reperfusion nach Rekanalisation des betroffenen Gefäßes, aber auch ein gestörter Blutfluss im vertebrobasilären System oder Messschwankungen. Drei der sechs Patienten wiesen einen Verschluss der A. cerebri media, ein Patient einen Carotis-T-Verschluss, aber keine Auffälligkeiten in der ECCS auf, so dass hier eine frühe Reperfusion in Betracht gezogen werden muss. Ein Patient zeigte in der ECCS eine Hypoplasie der A. vertebralis, was bei normal ausgebildeter kontralateraler A. vertebralis keinen Einfluss auf die Hämoperfusion hat. Bei einem Patienten fanden sich weder in der TCCS noch in der ECCS Auffälligkeiten, so dass die Ursache für die vorzeitige Kontrastmittelanflutung im Infarktbereich nicht sicher zugeordnet werden kann. Betrachtet man alle 19 Patienten, so betrug die mittlere Peak-Latenz 1,65 ± 4,27 Sekunden, die Peak-Intensität wurde also im Thalamus im Mittel 1,65 Sekunden vor der im Infarktareal erreicht. Eine Darstellung aller Peak-Latenzen zeigt Abbildung 3.3. -27- Ergebnisse 3HDN/DWHQ]]ZLVFKHQ7KDODPXVXQG,QIDUNW]RQH 12 8 00 09 03 04 05 'W>V@ 14 20 01 4 08 10 11 16 19 0 15 -4 21 23 13 12 -8 22 3DWLHQW $EELOGXQJ Peak-Latenz zwischen Thalamus und Infarktareal; die Zahlen der Abszisse geben die jeweilige Patientennummer wieder. 9HUJOHLFK GHU ,QIDUNWDXVGHKQXQJ LQ GHU 5HIHUHQ]ELOGJHEXQJ &&7057PLWGHPSHUIXVLRQVJHVW|UWHP$UHDOLP+DUPRQLF,PDJLQJ Im Rahmen der Routinediagnostik für Schlaganfallpatienten des UKS-H, Campus Lübeck, erfolgt eine kranielle CT-Untersuchung ohne Kontrastmittel noch in der interdisziplinären Notaufnahme, bei den Patienten dieser Studie durchschnittlich 3,3 ± 3,3 Stunden (Median 2 Stunden, QA 2,5) nach Symptombeginn. Mit diesen Bildern können allerdings bestenfalls Frühzeichen des Infarktes dargestellt werden, eine sichere Unterscheidung von infarziertem und nicht betroffenem Hirnparenchym kann erst durch das Verlaufs-CCT-Bild nach Demarkation des Infarktes (Haring et al., 1999) oder die zerebrale MRT erfolgen. Diese Verlaufsuntersuchung wurde bei den Patienten durchschnittlich 83,7 ± 79,3 Stunden (Median 52 Stunden, QA 101,5) nach Symptombeginn durchgeführt. Bei drei der 23 Patienten wurde statt des Verlaufs-CCT-Bildes eine MRT durchgeführt, von denen dann die T2-gewichteten Bilder für die Auswertung verwendet wurden. Mit dem BHI-View-Programm können anhand der Grauwertbildschleifen der BHIUntersuchung Parameterbilder berechnet werden. Anhand dieser Parameterbilder konnten die Flächen mit Signalminderung von mindestens 50 % im PPI-Bild sowie diejenigen mit verzögerter Kontrastmittelanflutung von mindestens drei Sekunden im TTP-Bild mittels der Scion Image Software für Windows® vermessen werden. -28- Ergebnisse Diese wurden dann mit den Infarktflächen der diencephalen Ebenen der Verlaufsbildgebung, die ebenfalls mit der Scion Image Software vermessen wurden, verglichen. Dabei zeigte sich, dass die Parameterbilder der Untersuchung am Aufnahmetag Perfusionsdefizite aufwiesen, die denen der späteren KontrollCCT- bzw. -MRT-Bilder entsprachen. Eine genaue Verteilung ist aus der Tabelle 3.5 zu entnehmen. -29- Ergebnisse Patient NIH SS TIBIScore Fläche (cm²) PPI Fläche (cm²) TTP Infarktfläche (cm²) Referenzbildgebung HF 00 25 0 8,15 14,65 43,12 GK 01 21 0 7,92 0 31,21 ES 02 6 4 0 0 0 JC 03 6 3 1,31 0 1,02 JS 04 21 0 11,64 17,59 47,35 JH 05 18 0 4,69 0 14,43 CL 07 8 4 3,3 0 9,18 MH 08 14 0 2,7 0 13,84 JL 09 12 3 3,04 7,05 15,56 HD 10 17 5 3,34 0 0 MS 11 8 0 0 0 n.e. GD 12 9 0 3,88 0 17,08 IS 13 11 0 11,67 0 22,06 BF 14 21 0 10,67 2,83 37,03 HG 15 29 0 17,39 0 n.e. KO 16 28 0 5,15 0 22,04 HT 17 8 4 0 0 1,21* GB 18 6 4 0 0 1,34* WK 19 5 3 4,45 0,88 3,95 HH 20 1 0 9,55 7,51 5,31* DS 21 14 0 2,6 1,55 2,41 RG 22 9 3 4,3 0 12,38 RW 23 7 5 4,37 0 4,74 7DEHOOH Patientenübersicht bezüglich der BHI- und CT-/MRT-Analysen; bei den mit „n.e.“ gekennzeichneten Patienten wurden keine Verlaufsuntersuchungen mit CT oder MRT durchgeführt; die im PPI-Bild (Pixelwise-Peak-Intensity-Bild) gemessene Fläche bezeichnet das Areal mit Signalintensitätsminderung, die im TTP-Bild (Time-to-Peak-Bild) gemessene Fläche das Areal mit Signalverzögerung. Bei den mit * gekennzeichneten Flächen in der ReferenzbildgebungsSpalte wurde die Auswertung bei T2-gewichteten MRT-Bildern vorgenommen, bei den übrigen anhand von CCT-Bildern. Sowohl der NIHSS (National Institutes of Health Stroke Scale) als auch der TIBI-Score (Thrombolysis-in-Ischemia-Score) wurden bei Aufnahme erhoben. Zwischen dem Infarktareal in der Verlaufsbildgebung (A_Infarkt) und verschiedenen Kovariablen wurde die Korrelation berechnet Dabei fand sich eine -30- Ergebnisse signifikante positive Korrelation zwischen dem Infarktareal in der Referenzbildgebung und der Schwere der Hirninfarktsymptome, ausgedrückt durch den mRS bei Aufnahme und zum Zeitpunkt der Nachbefragung nach vier Monaten sowie dem NIHSS vor der Ultraschalluntersuchung. Eine signifikant positive Korrelation fand sich auch mit dem Areal der Amplitudenminderung der BHI-Untersuchung (A_PPI; siehe Abbildung 3.4 und Tabelle 3.6). A_Infarkt korrelierte darüber hinaus positiv mit dem Vorliegen einer hochgradigen Stenose oder eines Verschlusses der ipsilateralen A. carotis interna. Eine hochgradig negative Korrelation konnte für A_Infarkt und den TIBI-Score nachgewiesen werden. Die weitere statistische Untersuchung der Ultraschallvariablen TIBI-Score, Stenose über 70 % oder Verschluss der ipsilateralen A. carotis interna, A_PPI und A_TTP ergab lediglich eine signifikant negative Korrelation zwischen dem Areal mit Amplitudenminderung in der BHI-Untersuchung (A_PPI) und dem TIBI-Score (Korrelationskoeffizient = -0,535, Irrtumswahrscheinlichkeit p = 0,009). Die weiteren Daten der statistischen Untersuchung können der Tabelle 3.6 entnommen werden. Variable Koeffizient p A_Infarkt Variable Koeffizient p mRS nach 4 Monaten Alter 0.299 0.187 0.402 0.079 NIHSS vor BHI 0.689 0.001 0.634 0.003 mRS vor BHI 0.546 0.010 0.564 0.010 Thrombolyse 0.315 0.165 -0.030 0.902 TIBI-Score -0.734 < 0.001 -0.416 0.068 Stenose oder Verschluss der ACI 0.453 0.039 0.436 0.054 mRS nach Monaten 0.605 0.006 1.0 A_PPI 0.772 < 0.001 0.572 0.008 A_TTP 0.402 0.071 0.125 0.599 A_Infarkt 1.0 - 0.605 0.006 4 - 7DEHOOH Spearman rank Korrelation zwischen dem Infarktareal in der Referenzbildgebung im Verlauf (A_Infarkt) und dem modified Rankin Score nach vier Monaten und verschiedenen -31- Ergebnisse Kovariablen: NIHSSbezeichnet den National Institutes of Health Stroke Scale, mRS den modified Rankin Score (erhoben bei Aufnahme vor der BHI-Untersuchung sowie telefonisch nach vier Monaten), TIBI = Thrombolysis-in-Ischemia-Score, A_PPI bezeichnet das Areal mit signifikanter Amplitudenminderung von mindestens 50% in der BHI-Untersuchung, A_TTP kennzeichnet das Areal mit verzögerter Kontrastmittelanflutung um mindestens drei Sekunden in der BHIUntersuchung. Koeffizient steht für Korrelationskoeffizient, p für die Irrtumswahrscheinlichkeit. Eine signifikante Korrelation wurde für ein p<0,05 angenommen. A_CCT [cm²] 40 30 20 10 0 0 2 4 6 8 10 A_PPI [cm²] $EELOGXQJScatter Plot des Infarktareals in der Referenzbildgebung im Verlauf (A_Infarkt) und der Region mit Pathologischer Kontrastmittelanreicherung im Pixelwise-Peak-Intensity-Bild (A_PPI). 1DFKEHIUDJXQJ Bei 17 der 23 Patienten konnte im Mittel nach 121,7 ± 38,8 Tagen (Median 103, QA 56,75) eine telefonische Nachbefragung durchgeführt werden. Drei Patienten waren verstorben, so dass der mRS sechs Punkte betrug. Die übrigen drei Patienten waren entweder unter der angegebenen Telefonnummer wiederholt nicht erreichbar bzw. verfügten über kein Telefon und konnten somit nicht an der Nachbefragung teilnehmen. Somit ergab sich ein mittlerer mRS von 2,7 ± 2,2 Punkten (Median 2,5, QA 1). Bei der statistischen Analyse (siehe Tabelle 3.6) ergab sich eine signifikant positive Korrelation zwischen dem mRS nach vier Monaten und den klinischen Scores vor der BHI-Untersuchung (mRS und NIHSS) sowie dem Areal mit Signalminderung in der BHI-Untersuchung und dem definitiven Infarktareal der -32- Ergebnisse Verlaufsbildgebung. Bei frühen Parametern für den Gefäßstatus (TIBI-Score, Stenose über 70 % oder Verschluss der ipsilateralen A. carotis interna) ergab sich keine signifikante Korrelation. $UWHIDNWH Bei allen 23 Patienten fanden sich Artefakte in der BHI-Untersuchung (Abbildung 3.5), wobei zwischen vorderem und hinterem Randartefakt sowie dem Streifenartefakt unterschieden werden muss. Eine Übersicht über die verschiedenen Artefakte gibt Tabelle 3.7 wieder. Personen mit vorderen Randartefakten Personen mit hinteren Randartefakten Personen mit Streifenartefakten Frauen (n=10) 8 (80,0 %) 5 (50,0 %) 7 (70,0 %) Männer (n=12) 12 (100 %) 9 (75,0 %) 8 (66,7 %) Gesamt (n=22) 20 (90,9 %) 14 (63,6 %) 15 (68,2 %) 7DEHOOHArtefaktverteilung der Patienten mit Infarkt der A. cerebri media bei der Untersuchung ® mit BHI und SonoVue B C A $EELOGXQJ Anhand dieses Beispiels lassen sich alle drei Arten von Artefakten verdeutlichen: Bei dem mit A gekennzeichneten dunklen Streifen parallel zur Ultraschallausbreitung handelt es sich um ein Streifenartefakt, B und C bezeichnen vordere und hintere Randartefakte. -33- Ergebnisse 3DWLHQWHQPLW+LUQWXPRU $OOJHPHLQHV In dieser Gruppe wurden elf Patienten untersucht, davon drei Frauen (27,3 %) und acht Männer (72,7 %) im Alter von 22 bis 62 Jahren, das mittlere Alter betrug dabei 52, 6 ± 11,5 Jahre (Median 53 Jahre, QA 11,5 Jahre). Der mittlere Karnofsky-Index betrug 83 ± 9 % (Median 80 %, QA 10 %). Die genaue Alters- und Geschlechtsverteilung ist der Tabelle 3.8 zu entnehmen. Lebensjahre Karnofsky-Index Frauen (n = 3) Männer (n = 8) gesamt (n = 11) Maximum 62 62 62 Minimum 50 22 22 Mittelwert 56,7 51,1 52,6 Median 58 52,5 53 QA 6 12 11,5 Maximum 90% 100% 100% Minimum 70% 70% 70% Mittelwert 80% 83,75% 84% Median 80% 80% 80% QA 10% 10% 10% 7DEHOOHVerteilung von Alter (in Jahren), Geschlecht und Karnofsky-Score; QA bezeichnet den Quartilsabstand. 'LDJQRVHQ Von den elf untersuchten Patienten wiesen sechs einen hirneigenen Tumor auf, bei den übrigen fünf Patienten handelte es sich um Metastasen, wobei drei von Bronchialkarzinomen stammten und zwei unklarer Herkunft waren. Eine Übersicht der elf Hirntumorpatienten nach Tumorhistologie und –lokalisation im Hirn sowie Darstellbarkeit mit dem Harmonic Imaging stellt Tabelle 3.9 dar. -34- Ergebnisse Referenzbildgebung des Tumors Metastase unscharf begrenzt, EH 001 (Bronchialkarzinom) hypodens Oligoastrozytom zweiten kräftig hyperintens in PS 002 Grades der T2-Wichtung kräftige KMUS 003 Astrozytom dritten Grades Aufnahme Metastase kräftige KMGS 004 (Bronchialkarzinom) Aufnahme Astrozytom vierten randständiges KMKP 005 Grades (Glioblastom) Enhancement Metastase randständiges KMHW 006 (Bronchialkarzinom) Enhancement randständiges KMAM 007 Metastase1 Enhancement Astrozytom vierten randständiges KMWK 008 Grades (Glioblastom) Enhancement randständiges KMKM 009 Metastase1 Enhancement Gangliogliom ersten homogene KMML 010 Grades Aufnahme Astrozytom vierten kräftige KMWS 011 Grades (Glioblastom) Aufnahme Patient Diagnose Darstellbarkeit mit BHI nein² nein³ homogene Darstellung homogene Darstellung nein² nein4 homogene Darstellung mit Kern-RandDifferenzierung mit Kern-RandDifferenzierung nein³ homogene Darstellung 7DEHOOH Zuordnung von Art und Lokalisation der Tumoren zur Darstellbarkeit. Bei den mit gekennzeichneten Metastasen konnte der Primarius nicht lokalisiert werden. Kern-RandDifferenzierung besagt, dass ein hyperperfundiertes Randareal von einem hypoperfundierten Tumorkern differenziert werden konnte; KM steht für Kontrastmittel. Eine Kennzeichnung mit ² bezeichnet eine aufgrund der anatomischen Lage des Tumors unmögliche Darstellung mit dem BHI. ³ kennzeichnet die Patienten, bei denen der Tumor trotz guter Schallbedingungen nicht 4 darstellbar war. Bei dem mit bezeichneten Patienten konnte trotz guter Schallbedingungen im gesamten Hirnparenchym kein Kontrastmitteleffekt beobachtet werden. (UJHEQLVVHGHV+DUPRQLF,PDJLQJ Einschlusskriterium war ein ausreichendes Knochenfenster. Die Untersuchung erfolgte in Kenntnis der Tumorlokalisation im CCT oder MRT, also nicht geblindet. Bei zehn Patienten konnte eine Kontrastzunahme des gesamten Hirnparenchyms festgestellt werden, ein Patient zeigte trotz guter Schallbedingungen für die TCCS keinen Kontrastmitteleffekt. Bei zwei der Patienten mit Kontrastzunahme kamen die Tumoren, eine links okzipital gelegene Metastase eines Bronchialkarzinoms und ein rechts frontales Astrozytom vierten Grades, in der sonographischen Schnittbildebene aufgrund der -35- Ergebnisse anatomischen Lage nicht zur Darstellung, so dass bei acht der zehn Patienten mit Kontrastzunahme eine Tumordarstellung anatomisch möglich war. Eine Kontrastanreicherung des Tumors verglichen mit dem umgebenden Parenchym konnte bei sechs dieser acht Patienten beobachtet werden (siehe Beispiel in Abbildung 3.6). Bei den anderen beiden Patienten, bei denen ein temporales Gangliogliom ersten Grades bzw. ein frontales Oligoastrozytom zweiten Grades diagnostiziert wurden, kam der Tumor trotz guter Schallbedingungen sonographisch nicht zur Darstellung. Bei zwei der sechs Patienten mit Tumordarstellung war sonographisch ebenso wie in der CCT- und MRT-Bildgebung eine Differenzierung zwischen Tumorkern (fehlende Kontrastmittelaufnahme) und Tumorrand (verstärkte Kontrastmittelaufnahme im Vergleich zum gesunden Hirngewebe) möglich. Die Untersuchung der Zeit-Intensitäts-Kurven ergab, dass sowohl Steigung als auch Peak-Amplitude im Tumorareal höher waren als im normalen Hirnparenchym, jedoch geringer als im arteriellen Gefäß (A. cerebri media). Eine genaue Verteilung der jeweiligen absoluten minimalen, maximalen und Mittelwerte ist der Tabelle 3.10 zu entnehmen. Tumorrand Arterie Thalamus Maximal 13,88 13,88 18,92 Minimal 4,52 3,00 4,52 9,88 ± 4,14 7,98 ± 3,73 17,77 ± 5,82 Maximal 9,25 40,72 0,57 Minimal 0,07 0,32 0,03 1,83 ± 3,64 10,36 ± 15,58 0,19 ± 0,21 Maximal 60,33 265,50 9,72 Peak- Minimal 0,60 2,13 0,37 Intensität Mittelwert ± TTP Mittelwert ± Standardabweichung Steigung Mittelwert ± Standardabweichung Standardabweichung 12,60 ± 23,44 67,80 ± 102,63 2,39 ± 3,63 7DEHOOH Absolutwerte der Time To Peak (TTP) in Sekunden, der Steigung (in au² pro Sekunde) sowie der Peak-Intensität (in au²) für Tumorareal, A. cerebri media und Thalamus als -36- Ergebnisse Referenzregion, jeweils Standardabweichung. aufgeteilt auf den maximalen, minimalen und Mittelwert mit Weder die absoluten noch die auf die jeweiligen Peak-Intensitäten des Thalamus normierten Werte (siehe Tabelle 3.11) unterschieden sich signifikant von denen der Arterie und des Thalamus. Es bestanden ebenso wie bei der Untersuchung der Hirninfarkte große interindividuelle Unterschiede zwischen den Werten. B A C 300 ,QWHQVLWlW>DXð@ 250 200 Tumorkern Tumorrand Arterie Thalamus 150 100 50 0 -50 0 20 40 60 =HLW>V@ $EELOGXQJA: Darstellung des Glioblastoms mit BHI, die Pfeile markieren die Begrenzung des Tumors mit zentraler Nekrose und kontrastmittelanreichernder Randzone; B: CCT mit Kontrastmittel; C: Zeit-Intensitäts-Kurve am Beispiel eines 49-jährigen Patienten mit links temporal gelegenem Glioblastom. „Tumorkern“ bezeichnet das zentrale Tumorareal mit verminderter Kontrastmittelanflutung, „Tumorrand“ im Gegensatz dazu das randständige Tumorareal mit Signalanstieg nach UKM-Injektion. Bei der Arterie handelt es sich um die A. cerebri media. Der Karnofsky-Index betrug bei diesem Patienten 100%; im CCT-Bild konnte nativ und mit Kontrastmittel eine links temporale, etwa drei Zentimeter im Durchmesser große Raumforderung mit randständiger Kontrastmittelaufnahme und zentralem hypodensen Anteil und perifokalem Ödem gesehen werden, das MRT zeigte eine links temporale kalottennahe ovale Raumforderung mit scharfer Begrenzung und randständiger Kontrastmittelaufnahme sowie mit kompakteren Anteilen lateral und kaudal. Der zentrale Bereich zeigte sich hier hypointens. Das beschallte Areal ist gelb umrandet. -37- Ergebnisse Tumorareal Arterie Thalamus Maximal 25,01 110,06 0,22 Minimal 0,04 0,38 0,05 4,39 ± 10,10 20,30 ± 44,1 0,10 ± 0,06 Maximal 163,05 717,57 1 Peak- Minimal 0,35 4,35 1 Intensität Mittelwert ± Steigung Mittelwert ± Standardabweichung Standardabweichung 29,36 ± 65,53 128,30 ± 288,80 1 7DEHOOHNormierte Werte der Steigung pro Sekunde im Tumorareal, im Bereich der A. cerebri media und im Thalamus sowie der Peak-Intensität im Tumorareal und im Bereich der A. cerebri media (normiert auf die jeweilige Peak-Intensität des Thalamus). -38- Ergebnisse .DVXLVWLNHQYRQ3DWLHQWHQPLW+LUQLQIDUNW %HLVSLHO 57-jähriger Patient mit subtotalem Mediainfarkt links. Die farbduplexsonographische Untersuchung ergab einen Verschluss des linken Mediahauptstammes (TIBI 0), die extrakraniellen Gefäße zeigten sich unauffällig. Die BHI-Untersuchung wurde 5,75 Stunden nach Symptombeginn durchgeführt. Der initiale NIHSS betrug 21 Punkte, der mRS fünf Punkte und nach 90 Tagen vier Punkte. Die Auswertung im PPI-Bild ergab ein perfusionsgemindertes Areal von 10,67 cm², die Fläche des Areals mit Signalverzögerung im TTP-Bild betrug 2,83 cm². Die erste CCT-Untersuchung erfolgte zwei Stunden nach Symptombeginn. In der Verlaufsuntersuchung nach 30,5 Stunden konnte ein Infarktareal in der diencephalen Ebene von 37,03 cm² gemessen werden. Eine Zusammenfassung der PPI-, TTP- und CCT-Bilder sowie der Zeit-IntensitätsKurve ist Abbildung 3.7 zu entnehmen. -39- Ergebnisse A B C D E 50 ,QWHQVLWlW>DXð@ 40 30 Infarktkern Periinfarktzone Thalamus 20 10 0 1 10 19 =HLW>V@ 28 37 $EELOGXQJA: PPI-Bild, markiert wurde das Areal mit verminderter Signalintensität; B: TTP-Bild, die grüne Linie bezeichnet das Areal mit verzögertem Signalanstieg; C: initiale CCT zwei Stunden nach Symptombeginn; D: Verlaufs-CCT nach 30,5 Stunden; E: Zeit-Intensitäts-Kurve, wobei der Infarktkern das Areal ohne * Signalsteigerung nach UKM-Injektion bezeichnet. Bei der Periinfarktzone handelt es sich um das Areal mit Kontrastmittelnachweis aber relativer Signalminderung von mindestens 50 % verglichen mit dem Thalamus als Referenzregion. -40- Ergebnisse %HLVSLHO 49-jähriger Patient mit subtotalem Mediainfarkt rechts. Die farbduplexsonographische Untersuchung ergab einen Verschluss des rechten Mediahauptstammes (TIBI 3) sowie eine 90%-ige Stenose der A.carotis interna rechts. Die BHI-Untersuchung wurde 5,0 Stunden nach Symptombeginn durchgeführt. Der initiale NIHSS betrug 12 Punkte, der mRS fünf Punkte und nach 146 Tagen 0 Punkte. Die Auswertung im PPI-Bild ergab ein perfusionsgemindertes Areal von 3,04 cm², die Fläche des Areals mit Signalverzögerung im TTP-Bild betrug 7,05 cm². Die erste CCT-Untersuchung erfolgte 1,5 Stunden nach Symptombeginn. In der Verlaufsuntersuchung nach 29 Stunden konnte ein Infarktareal in der diencephalen Ebene von 15,56 cm² gemessen werden. Eine Zusammenfassung der PPI-, TTP- und CCT-Bilder sowie der Zeit-IntensitätsKurve vom Aufnahmetag ist Abbildung 3.8 zu entnehmen. Zum Vergleich in Abbildung 3.9 die entsprechenden Bilder der Verlaufsuntersuchung, die nach der Lysetherapie mit Actilyse® mit dem Wirkstoff Alteplase (Boehringer Ingelheim Pharma KG, Ingelheim am Rhein, Deutschland) durchgeführt wurde. Diese zweite BHI-Untersuchung erfolgte 73,75 Stunden nach Symptombeginn. Im Vergleich der Zeit-Intensitäts-Kurven zeigt sich, dass sich die initial flach verlaufende ZeitIntensitäts-Kurve des Infarktareals in der Verlaufsuntersuchung nach der Lysetherapie der des Thalamus nahezu angeglichen hat. Passend dazu kann im PPI-Bild der Verlaufsuntersuchung kein Areal mit signifikanter Signalminderung ausgemacht werden, wie dies im initialen PPI-Bild deutlich abzugrenzen ist. Eine ähnliche Entwicklung zeigt sich für das Areal mit verzögerter Kontrastmittelanflutung in den TTP-Bildern. Diese Gegenüberstellung lässt den Schluss zu, dass mit der Lysetherapie die Reperfusion der A. cerebri media gelang. -41- Ergebnisse A B C ,QWHQVLWlW>DXð@ D6 Infarktkern Thalamus 3 0 1 10 19 28 37 =HLW>V@ $EELOGXQJ Abbildung A und B zeigen die Infarktareale im PPI- und TTP-Bild der BHIUntersuchung fünf Stunden nach Symptombeginn. Im CCT-Bild nach 1,5 Stunden kann das Infarktareal erwartungsgemäß noch nicht sicher abgegrenzt werden (C), Abbildung D zeigt die Zeit® Intensitäts-Kurve der initialen BHI-Untersuchung vor der Lysetherapie mit Actilyse . Eine Periinfarktzone mit relativer Signalminderung von 50 % im Vergleich zum Thalamus als Referenzregion konnte bei diesem Patienten nicht dargestellt werden. -42- Ergebnisse A B C ,QWHQVLWlW>DXð@ D 6 Infarktkern Thalamus 3 0 1 10 19 28 37 =HLW>V@ $EELOGXQJ Nach der Lyse mit Actilyse (Patient aus Abb. 3.8) können im PPI- und TTP-Bild nach 73,75 Stunden keine perfusionsgestörten Areale identifiziert werden (Abbildung A und B). Die Zeit-Intensitäts-Kurve des Infarktkerns hat sich der Kurve des Referenzareals, also des Thalamus, genähert (Abbildung D), im Verlaufs-CCT-Bild nach 29 Stunden wird das definitive Infarktareal sichtbar. ® -43- Diskussion 'LVNXVVLRQ 3DWLHQWHQPLW+LUQLQIDUNW =LHOVHW]XQJ0DWHULDOXQG0HWKRGHQ Die frühzeitige Diagnostik von Patienten mit Hirninfarkt, insbesondere die Darstellung des funktionsgestörten Hirngewebes mit erhaltenem Strukturstoffwechsel bei kritischer Minderperfusion („tissue-at-risk“) ist entscheidend für Therapieoptionen und Prognose für die Betroffenen (Röther, 2001; Moonis, 2002). Um diese Diagnostik zu optimieren, werden verschiedene Techniken gebraucht bzw. erprobt, wie CT, Positronenemissionstomographie (PET), Single-PhotonEmissions-CT (SPECT) und MRT. Die MRT ist insofern überlegen, als sie gleichzeitig Informationen über Perfusion und Funktionsstatus des Parenchyms liefern kann (Bonaffini et al., 2002), obgleich eine direkte Messung der Perfusion in Milliliter Blut pro Hirnvolumen pro Zeit auch mit diesen Methoden nicht möglich ist. Im Gegensatz zum Ultraschall sind diese Verfahren jedoch nicht am Krankenbett durchführbar, was insbesondere bei kritisch kranken oder unruhigen Patienten nachteilig ist. Schon 1991 gelang Becker mit der TCCS die Darstellung intrakranieller Gefäßstenosen und –verschlüsse, jedoch wurde die Untersuchung bei 10 % der Probanden durch eine zu starke Schallabschwächung im Schädelknochen limitiert (Becker et al., 1991). Dieses Problem schränkte auch bei nachfolgenden Studien die Darstellbarkeit ein (Seidel et al., 1995). Eine mögliche Verbesserung Echokardiographie, bei der ergab sich lungengängige durch den Kontrastmittel Blick zur auf die Kontrast- verbesserung in der Sonographie verwendet werden (Ophir und Parker, 1989, Goldberg et al., 1994). Durch die Verwendung des Transient Response Imaging konnte die Kontrastierung des myokardialen Blutflusses weiter verbessert werden. Hierbei werden Kontrastmittelmikrobläschen, in diesem Fall PESDA (perfluorocarbonexposed sonicated dextrose albumin), Ultraschallpulsen von 2,5 MHz ausgesetzt und die Empfänger auf die doppelte Frequenz (harmonische Oberschwingung) eingestellt (Porter und Xie, 1995). -44- Diskussion Es zeigte sich, dass dieses Verfahren auch dazu verwendet werden kann, die normale Hirndurchblutung darzustellen, da es in verschiedenen Hirnarealen unter Anwendung eines Ultraschallkontrastmittels zu charakteristischen An- und Abflutungskurven kommt (Postert et al., 1998). Eine quantitative Analyse der Perfusion anhand dieser Kurven schien hierbei aber nicht möglich (Seidel et al., 2000). Es lassen sich lediglich die Parameter zur Kurvenbeschreibung erfassen, die Aussagen über die Perfusion erlauben. Eine Weiterentwicklung stellt hier die Berechnung sogenannter Parameterbilder dar, bei denen verschiedene Parameter aus den Zeit-Intensitäts-Kurven jedes Bildpixels farbig codiert abgebildet werden. Diese zeigen die Maxima der ausgewählten Grauwertbilder nach Abzug der gemittelten Werte vor Beginn der UKM-Wirkung oder der Zeit zwischen Beginn der Kontrastwirkung und dem maximalen Effekt (Wiesmann und Seidel, 2000). Auf diese Weise gelingt auch die Darstellung minderperfundierter Areale beim Hirninfarkt (Wiesmann et al., 2004). Eine direkte Messung der Perfusion ist hier ebenso wenig möglich wie beim Perfusions-CT oder Stroke-MRT, doch können die Parameter der Ein- und Auswaschkurven als Surrogatmarker der Perfusion gelten. 2001 erhielt ein neues UKM, SonoVue®, die Zulassung und zeigte sich in ersten Studien vielversprechend (Kaps et al., 2001). In der vorliegenden Arbeit wurden 23 Patienten mit akutem Hirninfarkt mit dem Bolus-Harmonic-Imaging-Verfahren (BHI) unter Verwendung von SonoVue® auf Areale mit verminderter oder verzögerter Signalintensität als Hinweis auf Hypoperfusion bzw. verstärkter oder verfrühter Signalintensität aus Zeichen für eine frühe Reperfusion untersucht. Ziel war es nun herauszufinden, inwieweit Areale mit Hypo- oder Hyperperfusion mit den entsprechenden Regionen im Referenzschnittbildverfahren (CCT / MRT) korrelieren und welche prognostische Aussagekraft frühzeitige Untersuchungen mittels Harmonic Imaging unter Verwendung von SonoVue® beim Hirninfarkt haben. Hierbei ging es zum einen um die Zeit-Intensitäts-Kurven der Infarktregionen im Vergleich mit jenen der Thalamusregion. Zum anderen wurden die Areale mit Signalminderung bzw. verzögerter UKM-Anflutung der Parameterbilder den definitiven Infarktarealen der Verlaufs-CCT- / MRT-Bilder gegenübergestellt. -45- Diskussion (UJHEQLVVH In verschiedenen Studien konnte gezeigt werden, dass frühzeitige, mit der transkraniellen Farbduplexsonographie sichtbare vaskuläre Pathologie mit dem Behinderungsgrad bei Hirninfarktpatienten korreliert (Goertler et al., 1998; Labiche et al. 2003). In früheren Studien lag die Rate der erfolgreichen Harmonic-Imaging- Untersuchungen mit Levovist® bei 76,7 bis 84 % (Federlein et al., 2000; Wiesmann et al., 2004). In der vorliegenden Studie zeigten alle 23 untersuchten Patienten in der BHI-Untersuchung nach SonoVue® - Injektion einen Kontrastmitteleffekt, der es ermöglichte, weitere Analysen durchzuführen. Das im PPI-Bild in der Frühphase des Hirninfarktes ermittelte Areal mit Signalminderung von mindestens 50 % (A_PPI) korrelierte signifikant mit dem definitiven Infarktareal in der Verlaufsbildgebung sowie der Behinderung nach vier Monaten, ermittelt anhand des modified Rankin Scores. Die aufgrund der BHI-Untersuchung hergestellten Parameterbilder liefern zusätzliche Informationen über das distale zerebrale Gefäßbett in der Infarktfrühphase. Auf diese Weise gelingt nicht nur, wie bisher, die Darstellung großer Gefäße, sondern auch die Beurteilung der Mikrozirkulation. Eine signifikante Korrelation mit der Behinderung nach vier Monaten ergab sich nur für A_PPI. Für die anderen vaskulären Variablen (TIBI-Score, Stenose über 70% oder ipsilateraler Verschluss der A. carotis interna sowie Areal des pathologischen TTP [A_TTP]) ließ sich entgegen der Erwartungen keine Signifikanz nachweisen (Seidel et al., 2004). Mit dem BHI ist es somit möglich, die Territorien von A. cerebri media und A. cerebri anterior in der diencephalen Ebene zu beurteilen und dadurch Hinweise auf die Schwere einer zerebralen Durchblutungsstörung zu geben. Bisher gab es noch keine umfangreiche Studie zum Vergleich von BHI und Perfusions-CCT oder MRT, sondern lediglich Fallberichte (Meyer et al., 2003). Der Vorteil von BHI ist, dass qualitative Informationen bezüglich der Hirnperfusion am Patientenbett ermittelt werden können, so dass es eine wertvolle Erweiterung zu der routinemäßig durchgeführten Untersuchung der großen Hirnarterien mittels TCCS darstellen könnte. Eine Einschränkung erfährt das BHI dadurch, dass für jede Serie von Parameterbildern einer Untersuchungsebene ein UKM-Bolus verabreicht werden muss. -46- Diskussion Darüber hinaus kam es bei allen Untersuchungen vor allem an den Rändern des Schallfeldes zu Artefakten, die zwar leicht von den Perfusionsdefekten abgegrenzt werden können, aber eine Verkleinerung des untersuchbaren Areals bedeuten. Diese Artefakte haben ihren Ursprung in der Begrenzung des Knochenfensters und wurden bereits bei anderen Studien beobachtet (Wiesmann und Seidel, 2000). 3DWLHQWHQPLWLQWUDNUDQLHOOHP7XPRU =LHOVHW]XQJ0DWHULDOXQG0HWKRGHQ Auch bei intrakraniellen Tumoren ist die prä- und postoperative Diagnostik wichtig, insbesondere in Hinblick auf die Ausdehnung und den Malignitätsgrades, um die Therapie optimieren zu können (Becker et al., 1999). Da es sich gerade hier oft um langwierige Krankheitsverläufe handelt, ist das Interesse an alternativen bzw. ergänzenden Untersuchungsmethoden zu CCT und MRT groß. Schon in den 80er Jahren wurde die intraoperative Anwendung der Sonographie erprobt. Dabei konnte sie sowohl praktische Informationen über den Operationsstatus als auch morphologische Daten über die Tumoren liefern und dadurch die Befunde von CCT und MRT erweitern (Enzmann et al., 1985; LeRoux et al., 1989). Darüber hinaus bietet die intraoperative Sonographie im Vergleich zur CCT eine hohe Spezifität in der Unterscheidung einzelner Tumorkomponenten (Kelly et al., 1987; Greene et al., 1989). Jedoch wurde lange keine präoperative Diagnostik mittels Sonographie durch die intakte Schädeldecke vorgenommen, wie dies in ähnlicher Form in der Kinderheilkunde durch die offene Fontanelle (Pape et al., 1983; Bowerman et al., 1984) durchgeführt und unter Anwendung von UKM bei Versuchen mit Tieren erprobt wurde (D`Arrigo et al., 1991). Daraufhin führte Becker eine Studie zur Darstellung von intrakraniellen Tumoren mittels TCCS durch, allerdings ohne Ultraschallkontrastmittel. Es zeigte sich, dass die TCCS mit einer Sensitivität von 96% jener der CT unterlegen ist, jedoch wie schon die intraoperative Sonographie über eine höhere Spezifität bei der Differenzierung einzelner Tumorkomponenten verfügt (Becker et al., 1994) und somit schon im Vorfeld eines neurochirurgischen Eingriffes wichtige Informationen liefern kann (Becker et al., 1995). Anders ist es bei den postoperativen -47- Diskussion Untersuchungen: Hier ist die Sensitivität der TCCS beim Aufspüren von Residualtumoren mit 96 % denen von MRT mit 44 % und CCT mit 28 % weit überlegen. Die Spezifität liegt mit 67 % jedoch deutlich unter der 100 %igen Sicherheit von CCT und MRT (Becker et al., 1999). Auch bei der transkraniellen Sonographie zeigte sich im Vergleich mit CCT und MRT, dass die TCS zwar zusätzliche Informationen liefern kann, aber als alleinige Untersuchungsmethode zur Diagnostik von Hirntumoren nicht geeignet ist, zumal postoperative Veränderungen bei sonographischen Verlaufskontrollen zu falsch positiven Ergebnissen führen können (Becker et al., 1999; Meyer et al., 2001). Mit dem Harmonic Imaging gelingt nicht nur die Identifikation von Hirntumoren, vielmehr können auf diese Art zusätzliche Informationen über die Tumorperfusion gewonnen werden, die die Unterscheidung zwischen benignen und malignen Tumoren erleichtern kann (Harrer et al., 2003). In der vorliegenden Studie ging es um die Perfusionsdiagnostik von intrakraniellen Tumoren mittels Harmonic Imaging unter Verwendung von Levovist®. Es wurden elf Patienten auf hyperperfundierte Areale als Anzeichen für Malignität untersucht, um herauszufinden, ob bei dieser Patientengruppe die Unterscheidung von hyperperfundierten Tumor-Rand-Arealen von hypoperfundierten nekrotischen Tumorzentren gelingt. Dazu wurden die verschiedenen Zeit-Intensitäts-Kurven der Tumorregion, wenn möglich getrennt nach Tumorkern und Tumorrand, mit jenen eines arteriellen Gefäßes sowie des Thalamus als Referenzregion verglichen. (UJHEQLVVH Bei zehn der elf Patienten mit intrakraniellem Tumor konnte im Hirnparenchym der Untersuchungsebenen ein Kontrastmitteleffekt beobachtet werden, bei einem Patienten gelang dies trotz ausreichendem Schallfenster aus unbekannten Gründen nicht. Bei zwei der zehn Patienten mit Kontrastmitteleffekt gelang die Tumordarstellung aufgrund der anatomischen Lage nicht. Bei zwei weiteren kam es trotz einer anatomischen Darstellbarkeit zu keiner Kontrastmittelanreicherung in den Tumorarealen, bei denen es sich um niedrigmaligne Tumoren handelte. Somit gelang lediglich bei sechs Patienten, die alle einen hochmalignen Tumor aufwiesen, eine ausreichende Darstellung für spätere Analysen der Zeit- -48- Diskussion Intensitäts-Kurven. Nur bei zwei dieser sechs Patienten konnte die Tumorregion getrennt nach Tumorkern und –rand untersucht werden. Insofern lag die Tumordarstellbarkeit unter der vorangegangener Studien, bei denen die Darstellung bei 80% der untersuchten Patienten gelang (Harrer et al., 2003). Allerdings ist zu bemerken, dass gerade die Identifikation der hochmalignen Tumoren, bei denen eine Hyperperfusion durch vermehrte Vaskularisation zu erwarten ist, mit dem BHI-Verfahren gelang. Bei der Untersuchung der Zeit-Intensitäts-Kurven zeigte sich, dass sowohl Steigung als auch Amplitude in der Tumorregion höher waren als die des Thalamusareals als Referenzregion, aber niedriger als jene der A. cerebri media. Diese Unterschiede zeigten sich bei der statistischen Analyse unseres sehr kleinen Kollektivs jedoch nicht signifikant. Dennoch ist es ein deutlicher Hinweis darauf, dass hypervaskularisierte Areale im Hirn mit dem BHI von normalem Hirngewebe differenziert werden können. Es ließen sich also Unterschiede der Zeit-Intensitäts-Kurven im Tumorareal verglichen mit Referenzstrukturen feststellen, jedoch gelang die Darstellung des veränderten Perfusionsstatus des Tumors nur in Einzelfällen. -49- Zusammenfassung =XVDPPHQIDVVXQJ Ziel der vorliegenden Studie war es, die Möglichkeiten der transkraniellen Sonographie unter Verwendung des Harmonic Imaging bei Patienten mit Hirninfarkt oder intrakraniellem Tumor zu untersuchen. Hierbei ging es auch um die prognostische Bedeutung des Harmonic Imaging für die Langzeitergebnisse der Patienten mit Hirninfarkt. Es konnte gezeigt werden, dass die transkranielle sonographische Darstellung der Hirnperfusion durch die Anwendung von Harmonic Imaging gelingt, insbesondere bei Verwendung neuer Kontrastmittel wie SonoVue®. Bei der Gruppe der Patienten mit Hirninfarkt ergibt die Analyse der auf Basis der Grauwertbilder errechneten Zeit-Intensitäts-Kurven signifikante Unterschiede in der Peak-Amplitude sowie der Kurvensteigung zwischen Infarktareal und Referenzregion. Diese Analysen sind jedoch sehr zeitaufwendig und zeigen starke interindividuelle Schwankungen. Eine wichtige Weiterentwicklung stellen hier die ebenfalls auf Basis der Grauwertbilder erstellten Parameterbilder dar. Zwar zeigte sich entgegen der Erwartungen keine Korrelation der Langzeitergebnisse mit dem Areal der verzögerten Kontrastmittelanflutung im sogenannten TTP-Bild, doch das im PPI-Bild ermittelte Areal mit einer Signalminderung von über 50 % korrelierte signifikant mit dem definitiven Infarktareal in der Verlaufsbildgebung sowie dem Langzeitergebnis nach vier Monaten. Auf diese Weise verbessert das Harmonic Imaging als Grundlage für die Erstellung der Parameterbilder die Aussagekraft der transkraniellen Sonographie, indem zusätzliche Informationen über das distale zerebrale Gefäßbett schon in der Frühphase des Infarktes gewonnen werden können. Darüber hinaus erlaubt diese jederzeit am Patientenbett durchführbare Untersuchung prognostische Aussagen über das Langzeitergebnis des Hirninfarktes. Auch bei intrakraniellen Tumoren kann das Harmonic Imaging grundsätzlich zusätzliche Informationen über Vaskularisation und Ausdehnung des Tumors liefern, jedoch gelingt eine ausreichende Darstellung aufgrund der variablen und für die Schallebene der Sonographie zum Teil ungünstigen Lage der Tumoren nur in Einzelfällen. Daher scheint diese Art der Diagnostik für die Darstellung von Hirninfarkten geeigneter. -50- Zusammenfassung Bei allen Untersuchungen wird das Ergebnis durch Artefakte limitiert. Diese können zwar leicht von Perfusionsveränderungen abgegrenzt werden, schränken jedoch das Untersuchungsfeld ein. Insgesamt stellt die vorliegende Studie eine ermutigende Grundlage für weitere Anstrengungen auf dem Gebiet der minimalinvasiven Diagnostik der Hirnperfusion am Krankenbett dar. Gerade die Kombination von extra- und transkranieller Farbduplesxsonographie mit dem Bolus Harmonic Imaging erweitert das diagnostische Potential der Ultraschalltechniken von der Darstellung der Makroperfusion auf die der Mikrozirkulation. In weiteren Studien sollten weiterentwickelte Ultraschallkontrastmittel und neue Ultraschalltechniken ebenso berücksichtigt werden wie Vergleichsuntersuchungen von perfusionsgewichteter MRT. -51- Literatur /LWHUDWXUYHU]HLFKQLV Aaslid R, Markwalder TM, Nornes H: Noninvasive transcranial Doppler ultrasound recording of flow velocity in basal cerebral arteries -1HXURVXUJ Ambrose J, Hounsfield G: Computerized transverse axial tomography %U-5DGLRO Barber FE, Baker DW, Nation AW, Strandness DE Jr, Reid JM: Ultrasonic duplex echo-Doppler scanner ,(((7UDQV%LRPHG(QJ Becker G, Hofmann E, Woydt M, Hülsmann U, Mäurer M, Lindner A, Becker T, Krone A: Postoperative Neuroimaging of High-grade Gliomas: Comparison of Transcranial Sonography, Magnetic Resonance Imaging, and Computed Tomography 1HXURVXUJHU\ Becker G, Krone A, Koulis D, Lindner A, Hofmann E, Roggendorf W, Bogdahn U: Reliability of transcranial colour-coded real-time sonography in assessment of brain tumours: correlation of ultrasound, computed tomography and biopsy findings 1HXURUDGLRORJ\ Becker G, Krone A, Schmitt K, Woydt M, Hofmann E, Lindner A, Bogdahn U, Gahn G, Roosen K: Preoperative and Postoperative Follow-up in High-grade Gliomas: Comparison of Transcranial Colour-Coded Real-Time Sonography and Computed Tomography Findings 8OWUDVRXQG0HG%LRO Becker G, Winkler J, Bogdahn U: Transcranial color-coded duplex sonography in the adult 1: Normal findings and cerebrovascular ischemia 8OWUDVFKDOO0HG Beissert M, Jenett M, Keberle M, Kessler C, Klein D, Beer M, Hahn: Comparison of contrast harmonic imaging in B-mode with stimulated acoustic Emission, conventional B-mode US and spiral CT in the detection of focal liver lesions 5RIR)RUWVFKU*HE5RQWJHQVWU1HXHQ%LOGJHE9HUIDKU Bogdahn U, Becker G, Winkler J, Greiner K, Perez J, Meurers B: Transcranial Color-Coded Real-Time Sonography in Adults 6WURNH -52- Literatur Bonaffini N, Altieri M, Rocco A, Di Piero V: Functional neuroimaging in acute stroke &OLQ([S+\SHUWHQV Bowerman RA, Donn SM, Silver TM, Jaffe MH: Natural history of neonatal periventricular/intraventricular hemorrhage and its complications $-15$P-1HXURUDGLRO Burns PN: Harmonic Imaging with Ultrasound Contrast Agents &OLQ5DGLRO D‘ Arrigo JS, Simon RH, Ho S-Y: Lipid-Coated Uniform Microbubbles for Earlier Sonographic Detection of Brain Tumors -1HXURLPDJLQJ Demchuk AM, Burgin WS, Christou I, Felberg RA, Barber PA, Hill MD, Alexandrov AV: Thrombolysis in Brain Ischemia (TIBI) Transcranial Doppler Flow Grades Predict Clinical Severity, Early Recovery, and Mortality in Patients Treated With Intravenous Tissue Plasminogen Activator 6WURNH Doppler C: Über das farbige Licht der Doppelsterne und einiger anderer Gestirne des Himmels .E|KP*HVG:LVV9)ROJH%G3UDJ Drese MJ, Hayes GJ, Kempe LG: The value of an A-mode echoencephalogramm display 1HXURORJ\ Eggers J, Koch B, Meyer K, König I, Seidel G: Effect of ultrasound on thrombolysis of middle cerebral artery occlusion $QQ1HXURO Enzmann DR, Wheat R, Marshall WH, Bird R, Murphy-Irwin K, Karbon K, Hanberry J, Silverberg GD, Britt RH, Shuer L: Tumors of the Central Nervous System Studied by Computed Tomography and Ultrasound 5DGLRORJ\ Federlein J, Postert T, Meves S, Weber S, Przuntek H, Büttner T: Ultrasonic evaluation of pathological brain perfusion in acute stroke using second harmonic imaging -1HXURO1HXURVXUJ3V\FKLDWU\ -53- Literatur Furuhata H: Noninvasive Measurement of intracranial circulation by transcranial tomography (TCT) and transcranial Doppler tomography (TCDT) 1HXURVRQRORJ\ Galicich JH, Lombroso CT, Matson DDL Ultrasonic B-scanning of the brain -1HXURVXUJ Gerriets T, Stolz E, König S, Babacan S, Fiss I, Jauss M, Kaps M: Sonographic Monitoring of Midline Shift in Space-Occupying Stroke 6WURNH Goertler M, Kross R, Bäumer M, Jost S, Grote R, Weber S, Wallesch CW: Diagnostic impact and prognostic relevance of early contrast enhanced transcranial color-coded duplex sonography in acute stroke 6WURNH Goldberg BB, Liu JB, Forsberg F: Ultrasound agents: a review 8OWUDVRXQG0HG%LRO Gosling RG, King DH: Arterial assessment by Doppler-shift ultrasound 3URF56RF0HG Greene GM, Hitchon PW, Schelper RL, Yuh W, Dyste GN: Diagnostic yield in CT-guided stereotactic biopsy of gliomas -1HXURVXUJ Grolimund P: Transmission of Ultrasound through the Temporal Bone in: Aaslid R: Transcranial Doppler Sonography 6SULQJHU9HUODJ$XIODJHII:LHQ1HZ<RUN Haerten R: Technik der Doppler- und Farbduplex-Sonographie in: Bogdahn U, Becker G, Schlachetzki F (Hrsg.): Echosignalverstärker und transkranielle Farbduplexsonographie %ODFNZHOO:LVVHQVFKDIWVYHUODJ$XIODJH%HUOLQ:LHQ Haring HP, Dilitz E, Pallua A, Hessenberger G, Kampfl A, Pfausler B, Schmutzhard E: Attenuated corticomedullary contrast: An early cerebral computed tomography sign indicating malignant middle cerebral artery infarction. A case control study 6WURNH -54- Literatur Harrer JU, Mayfrank L, Mull M, Klötzsch C: Second harmonic imaging: a new ultrasound technique to assess human brain tumour perfusion -1HXURO1HXURVXUJ3V\FKLDWU\ Kanzer E: Echoencephalography with simultanous A- and B-mode display -1HXURO1HXURVXUJ3V\FKLDWU\ Kaps M, Legemate DA, Ries F, Ackerhoff RG, Markus H, Pezzoll C, Llull JB, Spinazzi A: SonoVue in transcranial Doppler investigations of the cerebral arteries -1HXURLPDJLQJ Kaps M, Seidel G, Bokor D, Modrau B, Algermissen C: Safety and ultrasound-enhancing potentials of a new sulfur hexafluoridecontaining agent in the cerebral circulation -1HXURLPDJLQJ Kaps M: Transcranial color-coded sonography: A new non-invasive tool in acute stroke -RXUQDOGHFKRJUDSKLHHWGHPpGLFLQHXOWUDVRQRUH Kaps M: Extra- und intrakranielle Farbduplexsonographie 6SULQJHU9HUODJ$XIODJHIIIIII%HUOLQ Karnofsky DA, Abelmann WH, Craver LF, Burchenal JM: The use of the nitogen mustards in the palliative treatment of carcinoma: With particular reference to bronchogenic carcinoma &DQFHU Kelly PJ, Daumas-Duport C, Kispert DB, Kall BA, Scheithauer BW, Illig JJ: Imaging based stereotaxic serial biopsies in untreated intracranial glial neoplasms -1HXURVXUJ Kolominsky-Rabas P, Sarti C, Heuschmann P, Graf C, Siemonsen S, Neundörfer B, Katalinic A, Lang E, Gassmann KG, Stockert TR: A prospective community–based study of stroke in Germany - The Erlangen Stroke Project (ESPro) 6WURNH Kolominsky-Rabas PL, Heuschmann PU: Incidence, etiology and long-term prognosis of stroke )RUWVFKU1HXURO3V\FKLDWU Labiche LA, Al-Senani F, Wojner AW, Grotta JC, Malkoff M, Alexandrov AV: Is the benefit of early recanalization sustained at 3 months? A prospective cohort study 6WURNH -55- Literatur LeRoux PD, Berger MS, Ojemann GA, Wang K, Mack LA: Correlation of intraoperative ultrasound tumor volumes and margins with preoperative computerized tomography scans -1HXURVXUJ Metzler V, Seidel G, Wiesmann M, Meyer K, Aach T: Perfusion Harmonic Imaging of the Human Brain 3URF63,(,QW6RF2SW(QJ Meyer K, Seidel G, Knopp U: Transcranial sonography of brain tumors in the adult: an in vitro and in vivo study -1HXURLPDJLQJ Meyer K, Wiesmann M, Albers T, Seidel G: Harmonic Imaging in Acute Stroke: Detection of a Cerebral Perfusion Deficit With Ultrasound and Perfusion MRI -1HXURLPDJLQJ Mohr JP, Biller J, Hilal SK, Yuh WT, Tatemichi TK, Hedges S, Tali E, Nguyen H, Mun I, Adams HP Jr, et al.: Magnetic resonance versus computed tomographic imaging in acute stroke. 6WURNH Moonis M: Imaging in acute ischemic stroke: relevance to managment 1HXURO,QGLD Muir KW, Weir CJ, Murray GD, Povey C, Lees KR: Comparison of neurological scales and scoring systems for acute stroke prognosis 6WURNH Mullins ME, Schaefer PW, Sorensen AG, Halpern EF, Ay H, He J, Koroshetz WJ, Gonzalez RG: CT and Conventional and Diffusion-weighted MR Imaging in Acute Stroke: Study in 691 Patients at Presentation to the Emergency Department 5DGLRORJ\ Okanobu H, Hata J, Haruma K, Matsumura S, Yoshida S, Kitadai Y, Tanaka S, Chayama K: Preoperative assessment of gastric cancer vascularity by flash echo imaging 6FDQG-*DVWURHQWHURO Ophir J, Parker KJ: Contrast agents in diagnostic ultrasound 8OWUDVRXQG0HG%LRO -56- Literatur Pape KE, Bennett-Britton S, Szymonovicz W, Martin DJ, Fitz CR, Becker L: Diagnostic accuracy of neonatal brain imaging: a postmortem correlation of computed tomography and ultrasound scans -3HGLDWU Poeck K, Hacke W: Neurologie 6SULQJHU9HUODJ$XIODJH%HUOLQ Pollard RE, Sadlowski AR, Bloch SH, Murray L, Wisner ER, Griffey S, Ferrara KW: Contrast-assisted destruction-replenishment ultrasound for the assessment of tumor microvasculature in a rat model 7HFKQRO&DQFHU5HV7UHDW Porter TR, Xie F: Transient myocardial contrast after exposure to diagnostic ultrasound pressures with minute doses of intravenously injected microbubbles: Demonstration and potential mechanisms &LUFXODWLRQ Postert T, Muhs A, Meves S, Federlein J, Przuntek H, Büttner T: Transient response harmonic imaging: An ultrasound technique related to brain perfusion 6WURNH Röther J: CT and MRI in the diagnosis of acute stroke and their role in thrombolysis 7KURPE5HV Schade G: Use of Ensemble tissue harmonic imaging to improve the resolution in ultrasound investigations of the head and neck area /DU\QJRUKLQRRWRORJLH Schlosser T, Pohl C, Veltmann C, Lohmaier S, Goenechea J, Ehlgen , Koster J, Bimmel D, Kuntz-Hehner S, Becher H, Tiemann K: Feasibility of the flash-replenishment concept in renal tissue: which parameters affect the assessment of the contrast replenishment? 8OWUDVRXQG0HG%LRO Seidel G, Albers T, Meyer K, Wiesmann M: Perfusion harmonic imaging in acute middle cerebral artery infarction 8OWUDVRXQG0HG%LRO Seidel G, Algermissen C, Christoph A, Claassen L, Vidal-Langwasser M, Katzer T: Harmonic Imaging of the Human Brain Visualization of Brain Perfusion With Ultrasound 6WURNH -57- Literatur Seidel G, Gerriets T, Kaps M, Missler U: Dislocation of the third ventricle due to space occupying stroke evaluated by Transcranial duplex sonography -1HXURLPDJLQJ Seidel G, Greis C, Sonne J, Kaps M: Harmonic grey scale imaging of the human brain -1HXURLPDJLQJ Seidel G, Kaps M, Gerriets T: Potential and Limitations of Transcranial Color-Coded Sonography in Stroke Patients 6WURNH Seidel G, Meyer K, Metzler V, Toth D, Vidal-Langwasser M, Aach T: Human Cerebral Perfusion Analysis with Ultrasound Contrast Agent Constant Infusion: A Pilot Study on Healthy Volunteers 8OWUDVRXQG0HG%LRO Seidel G, Meyer K: Harmonic Imaging: Eine neue Methode zur sonographischen Darstellung der Hirnperfusion 1HUYHQDU]W Seidel G, Meyer-Wiethe K, Berdien G, Hollstein, Toth, Aach T: Ultrasound Perfusion Imaging in Acute Middle Cerebral Artery Infarction Predicts Outcome 6WURNH Soldner R: Physikalische Grundlagen sonographischer Bildgebung, Ultraschall-GewebeInteraktion und Sicherheitsaspekte in: Bogdahn U, Becker G, Schlachetzki F (Hrsg.): Echosignalverstärker und transkranielle Farbduplexsonographie %ODFNZHOO:LVVHQVFKDIWVYHUODJ$XIODJH%HUOLQ:LHQ Stolz E, Gerriets T, Fiss I, Babacan SS, Seidel G, Kaps M: Comparison of transcranial color-coded duplex sonography: cranial CT measurements for determining third ventricle midline shift in space-occupying stroke $-15$P-1HXURUDGLRO Sulter G, Stehen C, De Keyser J: Use of the Barthel Index and Modified Rankin Scale in Acute Stroke Trials 6WURNH Tsuchiya T, Yasaka M, Yamaguchi T, Hasegawa Y, Kimura K, Omae T: Transcranial Real-Time Color-Flow Doppler Ultrasonography 6WURNH -58- Literatur Wei K, Jayaweera AR, Firoozan S, Linka A, Skyba DM, Kaul S: Quantification of Myocardial Blood Flow With Ultrasound-Induced Destruction of Microbubbles Administered as a Constant Venous Infusion &LUFXODWLRQ Weimar C, Kurth T, Kraywinkel K, Wagner M, Busse O, Haberl RL, Diener HC; German Stroke Data Bank Collaborators: Assessment of functioning and disability after ischemic stroke 6WURNH Wiesmann M, Meyer K, Albers T, Seidel G: Parametric Perfusion Imaging With Contrast-Enhanced Ultrasound in Acute Ischemic Stroke 6WURNH Wiesmann M, Seidel G: Ultrasound Perfusion Imaging of the Human Brain 6WURNH -59- Anhang $QKDQJ 1DWLRQDO,QVWLWXWHVRI+HDOWK6WURNH6FDOH1,+66 Der Untersucher muss eine Antwort D%HZXVVWVHLQV]XVWDQG wählen, auch wenn eine vollständige • Wach, unmittelbar antwortend 0 Untersuchung durch Hindernisse wie • Benommen, aber durch einen endotrachealen Sprachbarrieren, Tubus, 1 geringe Stimulation zum orotracheales Befolgen von Aufforderungen, Trauma oder Verbände beeinträchtigt Antworten oder Reaktionen zu sind. Ein Score von 3 ist nur dann bewegen erreicht, wenn sich der Patient auf • Stuporös, bedarf wiederholter Schmerzreize (außer reflexbedingte Stimulation um aufmerksam Lageveränderungen) nicht bewegt zu sein, oder ist somnolent 2 und bedarf starker oder schmerzhafter Stimuli zum Erzielen von Bewegungen (keine Stereotypien) • 3 Koma, antwortet nur mit motorischen oder vegetativen Reflexen, oder reagiert gar nicht, ist schlaff und ohne Reflexe Der Patient wird nach dem Monat und E)UDJHQ]XP %HZXVVWVHLQV]X Alter gefragt. Die Antwort korrekt sein – es gibt keinen Punkt für fast zutreffende VWDQG muss • Antworten. Beantwortet beide Fragen 0 richtig Aphasische und stuporöse Patienten, • Beantwortet eine Frage richtig 1 die • Beantwortet die Antwort nicht verstehen, erhalten den Score 2. Patienten, die aufgrund einer orotrachealen Intubation, Traumas, richtig eines einer schweren Dysarthrie jeglicher Gense, Sprachbarriere oder irgendeines -60- keine Frage 2 Anhang anderen Problems, das unabhängig von der Aphasie besteht, nicht sprechen können, erhalten den Score 1. Es ist wichtig, dass nur die zuerst gegebene Antwort bewertet wird und dass der Untersucher dem Patienten nicht mit verbalen oder non-verbalen Hinweisen „hilft“. Der Patient wird gebeten, die Augen F $XIIRUGHUXQJHQ zur Ermittlung zu öffnen und zu schließen und danach die nicht-paretische Hand zu des Bewusstseinszustandes • schließen und zu öffnen. Können die Führt beide Aufgaben richtig 0 aus Hände nicht benutzt werden, kann • Führt eine Aufgabe richtig aus 1 ersatzweise eine andere einschrittige • Führt keine Aufgabe richtig 2 Aufforderung gegeben werden. aus Eindeutige Versuche, die aufgrund einer Schwäche nicht vollständig ausgeführt werden können, werden als erfolgreich bewertet. Falls der Patient auf die Aufforderung nicht reagiert, soll die Bewegung vorgemacht (Pantomime) und das Ergebnis notiert werden (d.h. befolgt keine, ein oder zwei Anweisungen). Patienten mit Trauma, Amputation oder anderen körperlichen Beeinträchtigungen sollen passende einschrittige Aufgaben erhalten. Nur der erste Versuch wird bewertet. Es werden nur die Augenbewegungen Willkürliche (okulozephale) oder horizontalen %OLFNEHZHJXQJHQ untersucht. • Normal 0 reflektorische • Partielle Blickparese. Dieser 1 Augenbewegungen Punktwert wird vergeben, werden bewertet, aber es findet keine -61- Anhang werden bewertet, aber es findet keine wenn die Blickrichtung von kalorische Prüfung statt. Wenn der einem oder beiden Augen Patient eine konjugierte Blickdeviation abnormal ist, jedoch keine zeigt, die durch willkürliche oder forcierte Blickdeviation oder reflektorische Aktivität überwunden komplette Blickparese besteht. werden kann, beträgt der Score 1. Patienten mit • isolierter peripherer Forcierte Blickdeviation oder komplette Blickparese, die Augenmuskelparese (III:, IV: oder VI. durch Ausführen des Hirnnerv) okulozephalen Reflexes nicht erhalten den Score 1. Blickbewegungen können bei allen aphasischen Patienten werden. 2 überwunden werden kann. untersucht Patienten Augenverletzung, mit -verband, vorbestehender Blindheit oder einer anderen Erkrankung des Visus oder des Gesichtsfeldes sollen anhand von reflektorischen Bewegungen und einer vom Untersucher zu treffenden Auswahl untersucht werden. Das Herstellen eines Blickkontaktes und nachfolgenden Bewegungen im Gesichtsfeld des Patienten können gelegentlich helfen, eine partielle Blickparese abzuklären. Die Gesichtsfelder (obere und untere *HVLFKWVIHOG Quadranten) werden Gegenüberstellung getestet, in • wobei Keine Gesichtsfeld- 0 einschränkung Fingerzählen oder visuelle Gesten • Partielle Hemianopsie 1 verwendet werden sollen. Patienten • Komplette Hemianopsie 2 sollen zur Durchführung ermuntert • Bilaterale Hemianopsie 3 werden; wenn sie korrekt auf die sich (Blindheit inklusive kortikaler bewegende Hand blicken, wird dies Blindheit) als normal bewertet. Bei unilateraler -62- Anhang Blindheit oder Z.n. Enukleation wird das Gesichtsfeld anhand des verbliebenen Auges bewertet. Der Score 1 wird nur dann vergeben, wenn eine eindeutige Asymmetrie, Quadrantenanopsie eingeschlossen, vorliegt. Wenn ein Patient aus irgendeinem Grund blind ist, so wird dies als Score 3 bewertet. Anschließend wird eine Untersuchung beider Seiten simultan durchgeführt. Wenn eine unilaterale Auslöschung besteht, erhält der Patient den Score 1 und das Ergebnis wird bei der Beantwortung der Frage 11 benutzt. Fordern Sie den Patienten verbal oder )D]LDOLVSDUHVH • durch Pantomime auf, die Zähne zu zeigen, die Augenbrauen Normale symmetrische 0 Bewegungen • hochzuziehen und die Augen zu Geringe Parese (abgeflachte schließen. Bei wenig reagierenden Nasolabialfalte, Asymmetrie oder verständnisunfähigen Patienten beim Lächeln) • wird die Symmetrie der Gesichtszüge Partielle Parese (vollständige auf schmerzhafte Stimuli bewertet. oder fast vollständige Parese Falls des unteren Gesichts) Gesichtsverletzungen, • - verbände, ein orotrachealer Tubus, 1 2 Vollständige Parese von einer 3 Pflaster oder andere physikalische oder zwei Seiten (Fehlen von Hindernisse das Gesicht verdecken, Bewegungen im oberen und sollen diese soweit möglich entfernt unteren Teil des Gesichts) werden. Die Extremität wird in die passende X0RWRULNYRQ$UPHQX Lage gebracht: ausgestreckte Arme l r %HLQHQ (Handflächen nach unten) in 90° $UPH Position (sitzender Patient) oder in • 45° Position (liegender Patient) und -63- Kein Absinken, die Extremität 0 0 Anhang 45° Position (liegender Patient) und wird über 10 Sekunden in der gestreckte Beine in 30° Position 90° (oder 45°) Position (Beine stets am liegenden Patienten gehalten untersuchen). Ein Absinken liegt vor, • Absinken, Extremität wird wenn ein Arm vor Ablauf von 10 zunächst bei 90° (oder 45°) Sekunden oder ein Bein vor Ablauf gehalten, sinkt aber vor Ablauf von der 10 Sekunden ab; das Bett 5 Sekunden aphasischer Patient absinkt. wird Ein durch (oder eine andere Unterlage) Nachdrücklichkeit in der Stimme und Pantomime unterstützt, jedoch sollen keine werden. Schmerzstimuli wird nicht berührt • angewendet Anheben gegen Schwerkraft 90° (oder 45°) Position nicht nacheinander getestet, wobei mit dem erreichen oder halten, sinkt nicht-paretischen Arm begonnen wird, auf das Bett ab bei Amputation oder 2 2 möglich, Extremität kann die Extremitäten werden Nur Die 1 1 • Gelenkversteifung an Schulter oder Kein (aktives) Anheben gegen 3 3 Schwerkraft, Extremität fällt Hüfte darf der Score 9 vergeben • Keine Bewegung 4 4 werden und der Untersucher muss • Amputation, 9 9 dies schriftlich begründen. Gelenkversteifung; bitte erklären: %HLQH l r • 0 0 Kein Absinken, Bein bleibt über 5 Sekunden in der 30° Position • Absinken, Bein sinkt am Ende 1 1 der 5-Sekundenperiode, berührt das Bett jedoch nicht • Aktive Bewegung gegen Schwerkraft; das Bein sinkt binnen 5 Sekunden auf das Bett ab, kann aber gegen Schwerkraft gehoben werden -64- 2 2 Anhang • Kein Anheben gegen die 3 3 Schwerkraft, Bein fällt sofort auf das Bett • Keine Bewegung 4 4 • Amputation, 9 9 Gelenkversteifung, bitte erklären: Mit diesem Item sollen Hinweise für ([WUHPLWlWHQ$WD[LH Kleinhirnläsion • Fehlend gefunden werden. Untersuchen Sie • In einer Extremität vorhanden 1 bei geöffneten Augen. Sollte ein • In zwei Extremitäten eine unilaterale Gesichtsfeldausfall vorliegen, stellen 0 2 vorhanden Sie sicher, dass die Untersuchung im Falls vorhanden, besteht die Ataxie intakten Bereich des Gesichtsfeldes in durchgeführt wird. Der Finger-Nase- 5HFKWHP$UP Seiten • Nein 1 durchgeführt; eine Ataxie wird nur • Ja 2 dann festgestellt, wenn sie über eine • Amputation, 9 Versuch wird muskuläre auf beiden Schwäche hinaus Gelenkversteifung; bitte vorhanden ist. Eine Ataxie wird bei Patienten erklären: mit oder /LQNHP$UP Plegie als fehlend gewertet. Nur im • Nein 1 Falle Verständnisschwierigkeiten einer Amputation oder • Ja 2 Gelenkversteifung kann dieses Item • Amputation, 9 als 9 gewertet werden, und der Untersucher muss begründen. Bei dies schriftlich Vorliegen erklären: einer Blindheit lassen Sie den Patienten einen einfachen Finger-Nase-Versuch durchführen. Gelenkversteigung; bitte 5HFKWHP%HLQ • Nein 1 • Ja 2 • Amputation, 9 -65- Anhang Gelenkversteifung; bitte erklären: /LQNHP%HLQ • Nein 1 • Ja 2 • Amputation, 9 Gelenkversteifung; bitte erklären: Wahrnehmung von Grimassieren auf 6HQVLELOLWlW Nadelreize, oder Abwehrreaktion auf • Schmerzreize beim somnolenten oder aphasischen Patienten. Nur Normal, kein Sensibilitätsverlust • Leichter bis mittelschwerer Sensibilitätsstörungen, die auf einen Sensibilitätsverlust; Patient Schlaganfall empfindet Nadelstiche auf der zurückgeführt werden können, werden als abnorm bewertet; betroffenen Seite als weniger der scharf oder stumpf, oder es Untersucher sollte so viele Körperregionen untersuchen (Arme – besteht ein Verlust des nicht Hände, Beine, Stamm, Gesicht) Oberflächenschmerzes für wie Nadelstiche, doch nimmt der zur akkuraten halbseitiger Feststellung Sensibilitätsstörungen erforderlich sind. Ein Punktwert von 2 • Schwerer bis vollständiger Sensibilitätsverlust; Patient vergeben werden, wenn ein schwerer nimmt die Berührung von oder vollständiger Sensibilitätsverlust Gesicht, Arm und Bein nicht deutlich nachgewiesen werden kann. wahr Stuporöse und aphasische Patienten werden deshalb wahrscheinlich mit einer 1 oder 0 bewertet werden. Ein mit Hirnstamminsult 1 Patient die Berührung wahr („schwer“ oder „vollständig“) sollte nur Patient 0 und beidseitigem Sensibilitätsverlust wird mit einer 2 bewertet. Ein Patient, der nicht antwortet und tetraplegisch ist, -66- 2 Anhang wird mit 2 bewertet. Komatöse Patienten (Item 1a = 3) werden bei diesem Item als 2 eingestuft. Die meisten Informationen über das 6SUDFKH Sprachverständnis werden bereits in • Keine Aphasie, normal 0 den • Leichte bis mittelschwere 1 vorhergehenden Untersuchungsabschnitten Aphasie; deutliche gewonnen. Der Patient wird gebeten Einschränkung der zu Wortflüssigkeit oder des beschreiben, beigefügten was Bild auf geschieht, Gegenstände auf dem die Sprachverständnisses, keine dem relevante Einschränkung von Erkennungsbogen zu benennen und Umfang oder Art des die Ausdruckes. Die Satzliste vorzulesen. Das Verständnis wird sowohl anhand der Einschränkung des hierbei auch gegebenen durch alle Anforderungen in Antworten als Sprachvermögens und/oder Antworten auf des Sprachverständnisses der bisherigen macht die Unterhaltung über allgemein-neurologischen Untersuchung Visusverlust beurteilt. die die vorgelegten Falls ein Untersuchungsmaterialien Ausführung der jedoch schwierig bis Aufgaben behindert, bitten Sie den unmöglich. Beispielsweise Patienten, Gegenstände, die in seine kann der Untersucher in einer Hand gelegt werden, zu identifizieren, Unterhaltung über die Gesprochenes nachzusprechen und vorgelegten Materialien eigenständige Sätze zu formulieren. anhand der Antwort des Der intubierte Patient wird gebeten, Patienten ein Bild oder eine schriftlich zu antworten. Komatöse Wortkarte zuordnen. Patienten (Item 1a = 3) werden bei • Schwere Aphasie, die diesem Item als 3 eingestuft. Bei gesamte Kommunikation stuporösen oder findet über fragmentierte kooperativen Patienten Untersucher einen festlegen, jedoch eingeschränkt sollte muss der Ausdrucksformen statt: Der Punktwert nur Zuhörer muss das Gesagte in ein großem Umfang Punktwert von 3 vergeben werden, -67- 2 Anhang Punktwert von 3 vergeben werden, interpretieren, nachfragen wenn der Patient stumm ist und keine oder erraten. Der Umfang an einzelne Aufforderung befolgt. Information, der ausgetauscht werden kann, ist begrenzt; der Zuhörer trägt im Wesentlichen die Kommunikation. Der Untersucher kann die vorgelegten Materialien anhand der Antworten des Patienten nicht zuordnen. • Stumm, globale Aphasie; 3 keine verwertbare Sprachproduktion oder kein Sprachverständnis Auch wenn der Eindruck eines '\VDUWKULH Normalbefundes besteht, sollte der • Normal 0 Patient aufgefordert werden aus der • Leicht bis mittelschwer; der 1 beigefügten Liste Wörter vorzulesen Patient spricht zumindest oder zu wiederholen, um eine einige Wörter verwaschen und adäquate Sprachprobe zu erhalten. kann, schlimmstenfalls, nur Im Falle einer schweren Aphasie kann mit Schwierigkeiten die Artikulation von Spontansprache verstanden werden bewertet werden. Nur im Falle einer • Schwer; die verwaschene Intubation oder anderer mechanischer Sprache des Patienten ist Behinderungen der Sprachproduktion unverständlich und beruht sollte dieses Item als 9 bewertet nicht auf einer Aphasie oder werden, und der Untersucher muss übersteigt das auf eine dies schriftlich begründen. Dem Aphasie zurückzuführende Patienten soll nicht mitgeteilt werden, Maß oder Patient ist warum er/sie getestet wird. stumm/anarthrisch • Intubation oder andere mechanische Behinderungen; bitte erklären: -68- 2 9 Anhang Ausreichende Informationen um einen $XVO|VFKXQJXQG Neglect erkennen zu können sollten bereits während der 1LFKWEHDFKWXQJIUKHU 1HJOHFW vorangegangenen Untersuchungen • Keine Abnormalität 0 erhalten worden sein. Sollte der • Visuelle, taktile, auditive, 1 Patient einen schweren Visusverlust räumliche oder haben, der eine gleichzeitige visuelle personenbezogene Reizung beider Seiten unmöglich Unaufmerksamkeit oder macht und die Reizung der Haut Auslöschung bei der normal sein, so ist der Punktwert Überprüfung von gleichzeitiger normal. Sollte ein Patient eine bilateraler Stimulation in einer Aphasie haben, aber beide Seiten zu der sensiblen Qualitäten beachten scheinen, so ist der • Schwere halbseitige 2 Punktwert normal. Das Vorliegen Unaufmerksamkeit oder eines räumlich-visuellen Neglects halbseitige Unaufmerksamkeit oder einer Anosognosie sollte in mehr als einer Qualität. ebenfalls als Hinweis auf eine Kein Erkennen der eigenen Abnormalität gewertet werden. Da Hand oder Orientierung nur zu eine Abnormalität nur bei einer Seite des Raumes Vorhandensein gewertet wird, kann dieser Punkt immer untersucht werden. Bitte addieren Sie alle Punktewerte. Gesamtpunktwert: Bitte beachten: Fragen 5 u. 6: Eine Bewertung mit 9 = Amputation bitte als 0 zählen. Frage 10: Eine Bewertung mit 9 = Intubation oder andere mechanische Behinderung bitte als 0 zählen. -69- Anhang 0RGLILHG5DQNLQ6FRUHP56 0. keine Symptome 1. keine wesentliche Funktionseinschränkung trotz Symptomen: kann alle gewohnten Aufgaben und Aktivitäten verrichten 2. geringgradige Funktionseinschränkung: unfähig, alle früheren Aktivitäten zu verrichten, ist aber in der Lage, die eigenen Angelegenheiten ohne Hilfe zu erledigen 3. mäßiggradige Funktionseinschränkung: bedarf einiger Unterstützung, ist aber in der Lage, ohne Hilfe zu gehen 4. mittelschwere Funktionseinschränkung: unfähig, ohne Hilfe zu gehen und unfähig, ohne Hilfe für die eigenen körperlichen Bedürfnisse zu sorgen 5. schwere Funktionseinschränkung: bettlägerig, inkontinent, bedarf ständiger Pflege und Aufmerksamkeit .DUQRIVN\,QGH[ 100% Normal, keine Beschwerden, kein Hinweis auf eine Erkrankung 90% Normale Aktivität möglich, geringe Krankheitssymptome 80% Normale Aktivität nur mit Anstrengung, mäßige Krankheitssymptome 70% Selbstversorgung, aber unfähig zu normaler Aktivität oder Arbeit 60% Gelegentliche Hilfe, aber noch weitgehende Selbstversorgung 50% Häufige Unterstützung und medizinische Versorgung erforderlich 40% Überwiegend bettlägerig, spezielle Hilfe und Pflege erforderlich 30% Dauernd bettlägerig, evtl. Krankenhauseinweisung, jedoch keine akute Lebensgefahr 20% Schwerkrank, aktive unterstützende Therapie, evtl. Krankenhauseinweisung 10% Moribund, rasches Fortschreiten der Erkrankung 0% Tod -70- Danksagung 'DQNVDJXQJ Danken möchte ich zunächst Herrn Prof. Dr. med. D. Kömpf für die Möglichkeit, diese Arbeit an der Klinik für Neurologie des Universitätsklinikums SchleswigHolstein, Campus Lübeck durchführen zu können. Herrn Priv.-Doz. Dr. med. G. Seidel möchte ich für die Überlassung des Themas ebenso danken wie für die hervorragende Betreuung. Diesbezüglich gilt mein Dank auch Dr. med. K. Meyer-Wiethe, der mir stets ein engagierter Ansprechpartner war. Darüber hinaus danke ich den Mitarbeitern des Neurovaskulären Labors für ihre Geduld sowie ihre fachliche und organisatorische Unterstützung der Arbeit. Für die unkomplizierte Zusammenarbeit danke ich Herrn Prof. Dr. med. H. Arnold und den Mitarbeitern der Klinik für Neurochirurgie des UKS-H, insbesondere Herrn Dr. med. U. Knopp, der mir bei der Überwindung von organisatorischen Hindernissen stets zur Seite stand. Mein Dank gebührt auch den Mitarbeitern des neurochirurgischen Archivs, die sich für mich immer wieder bereitwillig auf die Suche nach Patientenakten machten. Herrn Prof. Dr. med. H. D. Weiss danke ich für die Überlassung des radiologischen Bildmaterials. Danken möchte ich auch Herrn Prof. Dr. Ing. T. Aach und Herrn Dipl.- Phys. D. Toth des Institutes für Signalverarbeitung und Prozessrechentechnik für die gute Zusammenarbeit und die Bereitstellung des BHI-View-Programmes sowie Herrn Dipl.-Ing.-Phys. T. Schnelle für seine Unterstützung bei meiner Suche nach seltener Literatur. Außerdem gilt mein besonderer Dank dem Pflegepersonal der Klinik für Neurologie des UKS-H, auf dessen Geduld und tatkräftige Unterstützung ich mich jederzeit verlassen konnte. Für die Förderung des UMEDS-Projektes (QLG1-CT-2002-01518) danke ich der Europäischen Union. Vor allem möchte ich aber meinen Eltern und M. Sünner danken. -71- Lebenslauf /HEHQVODXI $QJDEHQ]XU3HUVRQ Name Grit Berdien Wohnort Hudtwalcker Strasse 24 22299 Hamburg Geburtstag und –ort 07.11.1978 in Bremerhaven Familienstand ledig Nationalität deutsch 6FKXOELOGXQJ 07.1985 – 07.1989 Grundschule Basbeck / Hemmoor 07.1989 – 07.1991 Orientierungsstufe Hemmoor 07.1991 – 07.1998 Gymnasium Warstade / Hemmoor 03.07.1998 Abitur +RFKVFKXODXVELOGXQJ 10.1998 – 09.2000 10.2000 – 09.2003 10.2003 – 09.2004 vorklinisches Studium / Universität Lübeck klinisches Studium / UKS-H, Campus Lübeck Praktisches Jahr: 1. Tertial: HNO, UKS-H, Campus Lübeck 2. Tertial: Innere, UKS-H, Campus Lübeck 3. Tertial: Chirurgie, Universitätsspital Zürich -72- Lebenslauf 12.2004 seit 03.2005 Promotionsbeginn 3. Staatsexamen Assistenzärztin HNO, Krankenhaus Winsen / Luhe November 2000 6WXGLHQEHJOHLWHQGH7lWLJNHLWHQ Famulaturen: 02.2001 Neurologie / UKS-H, Campus Lübeck 03.2001 Chirurgie / KKH Otterndorf 09.2001 Pädiatrie / Kinderarztpraxis Hemmoor 03.2002 HNO / UKS-H, Campus Lübeck 09.2002 HNO / Klinikum Mannheim -73- Rahn,