Individuelle Vorhersage
Werbung

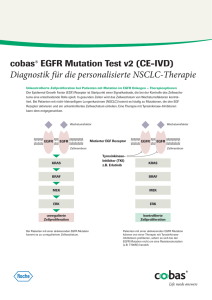
18 akademie Fast 90 Prozent aller Lungenkarzinome sind tabakassoziiert. Molekulare Onkologie Individuelle Vorhersage Der EGFR-Mutationsstatus ist ein entscheidender prädiktiver Biomarker für die personalisierte Erstlinientherapie des fortgeschrittenen nicht-kleinzelligen Lungenkarzinoms. Das Bronchialkarzinom gehört zu den häufigsten Tumorerkrankungen in den westlichen Industrienationen. Bei Männern tritt das Lungenkarzinom mit einer durchschnittlichen Häufigkeit von 80 pro 100.000, bei Frauen mit 35 pro 100.000 auf. Wesentlicher Risikofaktor ist das inhalative Rauchen – etwa 85 bis 90 Prozent aller Lungenkarzinome sind als tabakassoziiert anzusehen. Mittleres Erkrankungsalter liegt für Männer und Frauen bei etwa 69 Jahren. 75 bis 80 Prozent aller Lungenkarzinome gehören zum nicht-kleinzelligen Typ. Sie entstehen ausschließlich aus dem Epithel, das die Bronchien auskleidet, und wachsen im Vergleich zum kleinzelligen Lungenkarzinom langsamer, weshalb die Prognose etwas günstiger ist. Allerdings sind die nicht-kleinzelligen Lungenkarzinome weniger empfindlich gegenüber Chemotherapeutika. Da bei über der Hälfte der Patienten bei Diagnosestellung schon Metastasen vorliegen, beträgt das Fünf-Jahres-Überleben lediglich 15 Prozent. Die Therapie hängt vor allem vom Stadium der Erkrankung ab. Neben der Strahlen- und Chemotherapie kommen auch neue Therapieansätze zur Anwendung. Zu den aktuellen Therapieoptionen, die auf molekularer Ebene direkter an der Zielstuktur wirken („Target-Therapie“), zählen die Inhibitoren des „Epidermal growth factor receptor“ (EGFR). 6_2010 Tyrosinkinase-Hemmer EGFR ist eine Rezeptor-Tyrosinkinase, die als Bindungsstelle für Wachstums- beziehungsweise Botenstoffe dient. Bei Bindung wird über eine Signalkette das Zellwachstum angeregt. Löst sich die Bindung, so wird die Signalkette nicht weiter stimuliert und die Aktivität der Zelle einschließlich der Zellteilung wird verlangsamt. EGFR ist bei 40 bis 80 Prozent der nicht-kleinzelligen Bronchialkarzinome überexprimiert. Diese Überexpression resultiert in einer erhöhten Zellproliferation, verminderter Apoptose und erhöhter Angiogenese. Man geht davon aus, dass damit auch eine schnellere Metastasierungsrate verbunden ist. Ziel der neuen therapeutischen Ansätze ist, die Aktivität der Rezeptor-Tyrosinkinasen und damit Zellwachstum und -proliferation zu unterbinden. Die Blockade des EGFR kann durch monoklonale Antikörper wie Cetuximab (Erbitux) oder durch Tyrosinkinasehemmer (TKI) wie Erlotinib (Tarceva) und Gefitinib (Iressa) erfolgen. Die Tyrosinkinaseinhibitoren hemmen spezifisch die ATP-Bindungsstelle der intrazellulären Tyrosinkinase, wodurch die Autophosphorylierung unterbleibt. Das EGFR-vermittelte Wachstumssignal wird unterbrochen. akademie 19 Patienten mit aktivierenden Mutationen im EGFR-Gen profitieren besonders von einer Therapie mit Tyrosinkinase-Hemmern. Prädiktive Bedeutung Fotos: Gina Sanders, Dmitry Sunagatov (Fotolia) Patienten mit aktivierenden Mutationen im EGFR-Gen profitieren besonders von einer Therapie mit Tyrosinkinase-Hemmern. In verschiedenen, nicht randomisierten und randomisierten, Studien wurden ein verbessertes Tumoransprechen sowie ein verlängertes progressionsfreies Überleben gezeigt. Die Mutationsfrequenz im EGFR-Gen beim NSCLC ist vom ethnischen Hintergrund und weiteren Faktoren abhängig. Höhere Mutationsraten (40 bis 50 Prozent) werden vor allem bei Nichtrauchern, Patienten asiatischer Herkunft und weiblichen Patienten beobachtet. Rückschlüsse auf den Therapieerfolg aufgrund bestimmter ethnischer oder klinischer Faktoren allein sind jedoch nicht zuverlässig und können die molekularbiologische Analyse nicht ersetzen. Dies bedeutet, dass generell vor Beginn der First-Line Therapie beim fortgeschrittenen NSCLC auf die EGFR-Mutationen getestet werden sollte, um allen Patienten einen optimalen Therapieerfolg zu ermöglichen. Nach DNA-Isolation und PCR-Amplifikation der EGFR-Exons 18,19 und 21 folgt die DNA-Sequenzierung. Das Ergebnis der Mutationsanalyse wird anschließend unter Berücksichtigung aktueller klinischer Daten zum prädiktiven Therapieansprechen befundet. Unser Labor hat sich erfolgreich an Ringversuchen der Qualitätssicherungsinitiative Pathologie (QuIP) beteiligt und kann eine qualitätsgesicherte Testdurchführung garantieren. Fazit: Zielgerichtete Therapie Prädiktive Biomarker erlauben eine individuelle Vorhersage zum Ansprechen oder Nichtansprechen von Therapeutika in der zielgerichteten Behandlung von Patienten. Beim nicht-kleinzelligen Lungenkarzinom ist der molekularpathologische Nachweis von aktivierenden Mutationen im EGFR-Gen als Voraussetzung für Therapien mit Tyrosinkinase-Inhibitoren obligatorisch. Kennt der Arzt den Mutationsstatus, kann er die Behandlung optimal auf den Patienten abstimmen. EGFR-Mutationsanalyse Der EGFR-Mutationsstatus kann an Formalin-fixiertem, Paraffin-eingebettetem Gewebe ermittelt werden, was auch die retrospektive Untersuchung älterer Archivproben ermöglicht. Mit Hilfe eines gefärbten Schnittpräparats wird das Tumorgewebe lokalisiert und durch Makrodissektion selektiv aus dem Paraffinblock entnommen. Häufig stehen aber auch nur Biopsien zur Verfügung, was eine optimale Nutzung von sehr wenig Tumormaterial erfordert. Kontakt Dr. rer. nat. Jörg Schickel synlab/Oncoscreen Löbstedter Straße 93, 07749 Jena Tel: 0 36 41 – 5 07 40 E-Mail: [email protected] 6_2010