Personalisierte Therapie des Lungenkarzinoms
Werbung
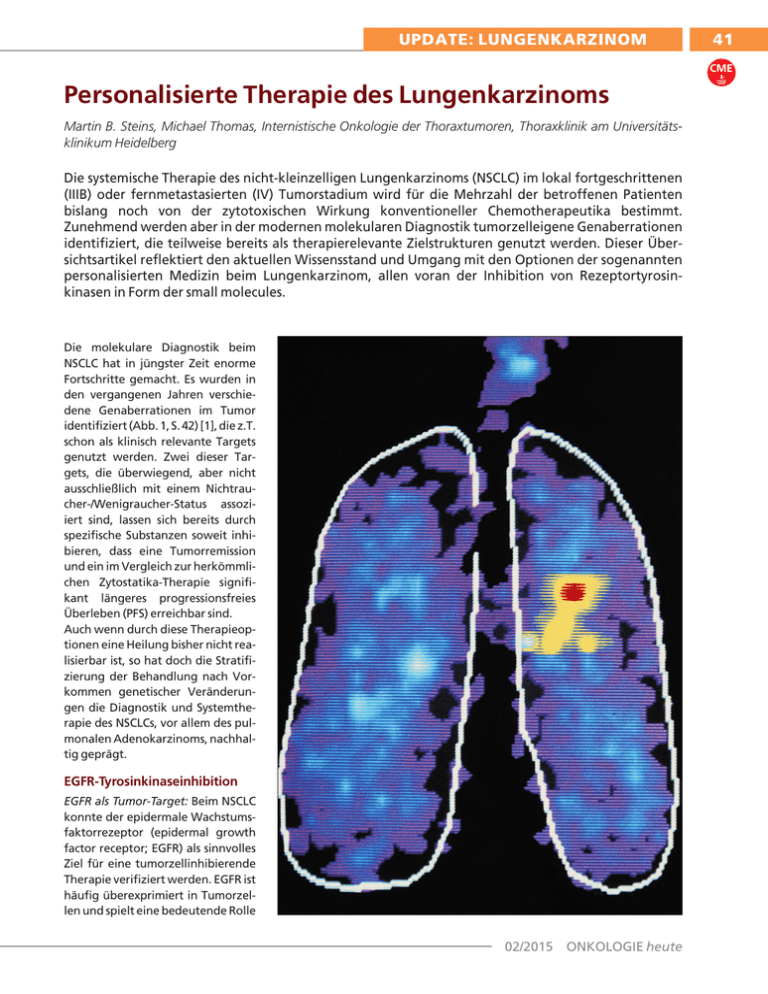
UPDATE: LUNGENKARZINOM 41 CME Personalisierte Therapie des Lungenkarzinoms Martin B. Steins, Michael Thomas, Internistische Onkologie der Thoraxtumoren, Thoraxklinik am Universitätsklinikum Heidelberg Die systemische Therapie des nicht-kleinzelligen Lungenkarzinoms (NSCLC) im lokal fortgeschrittenen (IIIB) oder fernmetastasierten (IV) Tumorstadium wird für die Mehrzahl der betroffenen Patienten bislang noch von der zytotoxischen Wirkung konventioneller Chemotherapeutika bestimmt. Zunehmend werden aber in der modernen molekularen Diagnostik tumorzelleigene Genaberrationen identifiziert, die teilweise bereits als therapierelevante Zielstrukturen genutzt werden. Dieser Übersichtsartikel reflektiert den aktuellen Wissensstand und Umgang mit den Optionen der sogenannten personalisierten Medizin beim Lungenkarzinom, allen voran der Inhibition von Rezeptortyrosinkinasen in Form der small molecules. Die molekulare Diagnostik beim NSCLC hat in jüngster Zeit enorme Fortschritte gemacht. Es wurden in den vergangenen Jahren verschiedene Genaberrationen im Tumor identifiziert (Abb. 1, S. 42) [1], die z.T. schon als klinisch relevante Targets genutzt werden. Zwei dieser Targets, die überwiegend, aber nicht ausschließlich mit einem Nichtraucher-/Wenigraucher-Status assoziiert sind, lassen sich bereits durch spezifische Substanzen soweit inhibieren, dass eine Tumorremission und ein im Vergleich zur herkömmlichen Zytostatika-Therapie signifikant längeres progressionsfreies Überleben (PFS) erreichbar sind. Auch wenn durch diese Therapieoptionen eine Heilung bisher nicht realisierbar ist, so hat doch die Stratifizierung der Behandlung nach Vorkommen genetischer Veränderungen die Diagnostik und Systemtherapie des NSCLCs, vor allem des pulmonalen Adenokarzinoms, nachhaltig geprägt. EGFR-Tyrosinkinaseinhibition EGFR als Tumor-Target: Beim NSCLC konnte der epidermale Wachstumsfaktorrezeptor (epidermal growth factor receptor; EGFR) als sinnvolles Ziel für eine tumorzellinhibierende Therapie verifiziert werden. EGFR ist häufig überexprimiert in Tumorzellen und spielt eine bedeutende Rolle 02/2015 ONKOLOGIE heute 42 UPDATE: LUNGENKARZINOM CME wodurch eine Signalkaskade für Tumorwachstum und -progression induziert wird. Eine pathophysiologisch besondere Krankheitssituation beim NSCLC liegt vor, wenn die TyrosinkinaseAktivität des EGFR mutationsbedingt gesteigert ist. Solche vermeintlich aktivierenden Mutationen in der Tyrosinkinase-Domäne des EGFRGens konnten in den Exonen 18 - 21 mit einer Häufigkeit von etwa 10% detektiert werden [1]. Diese EGFR-Mutationen, die überwiegend die Exone 19 (Deletion [Del] 19) und 21 (L858R-Punktmutation) betreffen, stellen die bisher bedeutendsten Biomarker für das NSCLC dar, die prädiktiv mit einem verbesserten Therapieansprechen einhergehen, falls Tyrosinkinaseinhibitoren (TKI) des EGFR eingesetzt werden (Abb. 2). Zugelassene EGFR-TKI: Die Landmark-Studie zur Effektivität von EGFR-TKI einschließlich des Nachweises eines deutlich verlängerten PFS stellt IPASS (Iressa Pan ASia Study) mit Verwendung von Gefitinib dar [4]. Diese Studie randomisierte ein selektioniertes, asiatisches Patientenkollektiv von 1.217 Nie- bzw. nach [1] in Signaltransduktionswegen für Zellproliferation, -migration und adhäsion wie auch für Tumorneoangiogenese und Apoptosehemmung [2]. Seine Überexpression korreliert in einigen Tumorentitäten mit Krankheitsprogression und ungünstiger Prognose [3]. EGFR selbst zählt zur humanen epidermalen Wachstumsfaktor-Rezeptor (HER)-Familie, die auch als ErbB klassifiziert wird. Die Struktur dieses 170 kDa umfassenden, transmembranösen Glykoproteins besteht aus einer extrazellulären Cystein-reichen Ligandenbindungsregion, einem transmembranösen Anteil und einer zytoplasmatischen Tyrosinkinase-Domäne. Die extrazelluläre Bindung eines endogenen Liganden wie des epidermalen Wachstumsfaktors (EGF) oder des Transforming growth factor-beta (TGF-?) überführt den Rezeptor von seiner inaktiven Monomerstruktur in den aktiven Homo- oder Heterodimer-Zustand. Dabei kommt es zu konfirmatorischen Änderungen mit nachfolgender Phosphorylation von Tyrosinresten. Diese phosphorylierten Tyrosinreste wiederum fungieren anschließend als Bindungsstellen für signalübertragende Substanzen, Abb. 1: Resultate der Biomarker-Analyse (Mutationen [Mut. ] u. Rearrangement) der French Platforms Networks auf Basis von 9.911 Patienten ONKOLOGIE heute 02/2015 Wenigrauchern im Verhältnis 1:1 zwischen einem herkömmlichen Chemotherapie-Arm (Carboplatin/Paclitaxel) vs. dem TKI-Arm mit Gefitinib (250 mg p.o./Tag). Bereits für das Gesamtkollektiv ergab sich mit 43% eine hohe Ansprechrate bei Einsatz von Gefitinib gegenüber 32% in der Chemotherapie-Gruppe. Das für die klinische Praxis wichtigste Resultat wurde allerdings erst offenkundig, als zwischen Patienten mit Vorliegen einer EGFR-Mutation und denjenigen mit Wildtyp differenziert worden war. Hier zeigten die EGFR-mutationspositiven Patienten bezüglich ihres PFS einen signifikanten Benefit, wenn sie mit dem TKI anstelle des konventionellen Chemotherapie-Protokolls behandelt worden waren (p<0,0001). Die Wildtyp-Patienten profitierten demgegenüber mit ihrem PFS signifikant mehr von der Standard-Chemotherapie (p<0,0001). Die Ergebnisse fanden Eingang in die interdisziplinäre S3-Leitlinie für das Lungenkarzinom, indem mit Empfehlungsgrad B eine Erstlinientherapie mit Gefitinib bei Patienten mit EGFR-aktivierenden Mutationen, insbesondere Del 19oder L858R-Mutation, gegenüber einer Chemotherapie bezüglich Remissionsrate und PFS als signifikant überlegen bewertet wurde [5]. Im Weiteren wurden diese Ergebnisse auch für den TKI Erlotinib sowohl bei einem asiatischen wie auch kaukasischen Patientenkollektiv bestätigt [6, 7]. Als dritter TKI ist Ende 2013 Afatinib von der Europäischen Arzneimittelbehörde ab der ersten Therapielinie für EGFR-mutationspositive Patienten im Stadium IIIb/IV zugelassen worden [8, 9]. Letzterer weist als pan-ErbB-TKI neben EGFR auch Aktivitäten gegen HER2 sowie ErbB3 und 4 auf. Des Weiteren führt seine kovalente Bindung an den jeweiligen TKDomänen im Unterschied zu den Erstgenerations-Inhibitoren Gefitinib oder Erlotinib zu einer irreversi- UPDATE: LUNGENKARZINOM 43 CME blen Blockade. Inwieweit hierdurch eine bessere Therapieeffektivität bei EGFR-mutierten Patienten erreicht werden kann, lässt sich nur durch Studien mit einem direkten Vergleich der EGFR-TKIs untereinander weiter klären. In den beiden Phase-III-Studien LUXLung 3 (Afatinib vs. Cisplatin/Pemetrexed) und LUX-Lung 6 (Afatinib vs. Cisplatin/Gemcitabin) ließ sich mittels einer gepoolten Post-hoc-Analyse ein statistisch signifikanter Vorteil hinsichtlich des Gesamtüberlebens (OS) beim First-Line-Einsatz von Afatanib für Del 19-Patienten errechnen [10]. Im Fall von Gefitinib oder Erlotinib konnte diesbezüglich bisher kein Vorteil für das Gesamtüberleben konstatiert werden. Ein Unterschied ließ sich hier nicht feststellen, ob Patienten mit vermeintlich aktivierenden EGFR-Mutationen in der Erstlinientherapie zunächst mit einem EGFR-TKI oder mit einer herkömmlichen platinhaltigen Chemotherapie behandelt werden und anschließend bei Tumorprogredienz in der zweiten Therapielinie auf das jeweils andere Therapieprinzip eingestellt werden [7, 11]. Entscheidend für das Gesamtüberleben bei EGFR-mutierten Patienten ist, dass diese Patientengruppe auf jeden Fall einen EGFR-TKI während ihres Krankheitsverlaufes erhält. Von daher ist das Risiko zu berücksichtigen, dass initial chemotherapierte Patienten aufgrund von therapie- und tumorassoziierten oder anderweitigen Komplikationen nicht mehr zu einer Second-LineTherapie kommen. Generell liegt das mediane OS bei mutationspositiven Patienten im Stadium IV in den bisherigen Studien deutlich über 20 Monate und damit weit höher als die bekannten 12 Monate bei EGFRWildtyp-Patienten, was neben der prädiktiven Bedeutung zusätzlich für den auch positiven prognostischen Wert der EGFR-Mutationen spricht [7, 10, 11]. Abb. 2: Partielle Remission von Primarius u. Leberfiliae (→) unter EGFR-TKI bei Deletion 19 (links prätherapeutisch, rechts Kontroll-CTs nach 3 Monaten) Nebenwirkungen der TKI-Therapie: Im Gegensatz zum Nebenwirkungsprofil konventioneller Chemotherapeutika wie Hämatotoxizität, Nausea, Emesis und Alopezie umfasst das TKI-typische Bild Paronychien, Mukositiden sowie vorrangig ein akneiformes Exanthem der Haut, dem bereits prophylaktisch in Form einer konsequenten Hautpflege und Sonnenprotektion gegengesteuert werden sollte. Im Weiteren sind topisch steroid- und antibiotikahaltige Externa oder systemisch AntibiotikaTherapien mit Doxy- oder Minocyclin gegen auftretende Hauterscheinungen indiziert. Als weiteres Symptom können Diarrhöen auftreten, die ein vorausschauendes Nebenwirkungsmanagement besonders mit Loperamid erforderlich machen. Seltener werden unter TKI-Anwendung Anstiege der Transaminasen, Pruritus oder Appetitlosigkeit beobachtet. Grundsätzlich besteht im Falle von schwergradigeren Nebenwirkungen angesichts unterschiedlich verfügbarer Tablettendosierungen bei Erlotinib und Afatinib die Option der Dosisreduktion. EGFR-Resistenzmutationen: Die überwiegende Mehrheit der EGFRmutationspositiven Patienten entwickelt im Laufe der TKI-Therapie unvermeidlich Resistenzmechanismen, meist auf dem Boden von Sekundärmutationen wie der T790MPunktmutation, die eine gesteigerte ATP-Affinität in der katalytischen TK-Domäne bewirkt [12]. Auch HER2- bzw. Met-Amplifikationen bis hin zu kleinzelligen Transformationen wurden bei Re-Biopsien beschrieben [13]. Dies führte zu Kombinationsstudien von EGFR-TKI mit Cetuximab oder Inhibitoren des c-MetRezeptors [14, 15]. Auch der Einsatz konventioneller Chemotherapeutika mit Fortführung der TKI-Gabe in chemotherapiefreien Intervallen wird versucht, um den TKI-resistenten Klon im Tumor zu reduzieren. ALK-Inhibition Als weitere Zielstruktur in der Signaltransduktion von NSCLC-Tumorzel- 02/2015 ONKOLOGIE heute 44 UPDATE: LUNGENKARZINOM CME Zielstruktur Zielgerichtete Therapieoptionen EGFR (ErbB1) ErbB-Gruppe EML4/ALK HER2/neu (ErbB2) Braf PI3K MEK c-MET Gefitinib, Erlotinib Afatinib, Dacomitinib Crizotinib, Ceritinib Trastuzumab, Lapatinib Vemurafenib Idelalisib Selumetinib MetMAb, Tivantinib Tab. 1: Optionen für stratifizierte Therapien (von der Europäischen Arzneimittelkommission für das metastasierte Lungenkarzinom aktuell zugelassene Substanzen sind fett gedruckt) len konnte die Tyrosinkinase des Anaplastic Lymphoma Kinase (ALK)Rezeptors identifiziert werden, dessen Struktur und Vorkommen initial aus Zellen des anaplastisch-großzelligen Non-Hodkin-Lymphoms bekannt ist. Eine gesteigerte Rezeptoraktivität beim NSCLC geht mit einem ALK-Rearrangement auf dem Boden eines Fusiongens, dem EML4 (echinoderm microtubule-associated protein-like 4) / ALK-Onkogen bei etwa 3 – 4% der Adenokarzinom-Patienten einher [1, 16]. EML4/ALK-Translokation: Vergleichbar mit den aktivierenden EGFR-Mutationen findet sich dieses Rearrangement gehäuft bei Patienten mit Nichtraucher-Status und Adenokarzinom-Diagnose. Diagnostisch wird die EML4/ALK-Translokation mittels Fluoreszenz-in-situ-Hybridisierung über den Nachweis der DNA-Bruchstelle am ALK-Genlocus detektiert. Therapeutisch gewinnt dieser Nachweis durch die Verfügbarkeit des spezifischen ALK-TKIs Crizotinib an Bedeutung. Dieser TKI erwies sich bei 143 z.T. erheblich vorbehandelten, EML4/ALK-positiven Patienten in einer Phase-I-Studie als sehr effektiv mit Ansprechraten von 61%, einem medianen PFS von 9,7 Monaten und einem geschätzten 1-Jahres-OS von 75% [17]. In den USA hat die dortige Gesundheitsbehörde die Sub- ONKOLOGIE heute 02/2015 stanz im August 2011 für die Therapie ALK-translozierter, metastasierter NSCLC-Patienten auf Basis dieser Daten zugelassen, die Europäische Arzneimittelagentur folgte ein Jahr später im Oktober 2012 nach Vorlage einer Phase-III-Studie in der zweiten Therapielinie [18]. Die Erweiterung auf die Erstlinientherapie für ALK-positive Patienten steht an [19]. Allerdings ist auch bei diesem Wirkmechanismus bereits eine Resistenzmutation (L1196M) mit Inaktivierung des Crizotinibs beschrieben [20]. Die Entwicklung von strukturell unterschiedlichen ALK-Inhibitoren mit In-vitro-Aktivität gegenüber Crizotinib-resistenten Zellen und mit der Zulassung des TKIs Ceritinib in den USA als Zweitgenerations-ALKTKI erweitert auch bei diesen Aberrationen die Therapieoptionen. Diesbezüglich zeigt eine erweiterte Phase-I-Studie mit 114 ALK-positiven Patienten, u.a. mit Crizotinib-Vorbehandlung, für Ceritinib ResponseRaten von 58%, Krankheitskontrollraten bis 80% und ein medianes PFS von 7,0 Monaten [21]. Weitere onkogene Aberrationen beim NSCLC Auf der Jahrestagung der American Society for Clinical Oncology 2013 haben die French Platforms Networks ihre bisherigen Resultate zur Häufigkeit von genetischen Aberrationen beim pulmonalen Adenokarzinom vorgestellt (Abb. 1, S. 42) [1]. Auffällig war, dass bei einem großen Teil (46%) der untersuchten Tumorproben aus einem Panel von 6 GenAberrationen spezifische solitäre Mutationen oder Rearrangements detektiert werden konnten. Diese umfassten neben den bisher bekannten (Kras, EGFR, EML4/ALK) auch seltene Mutationen mit Inzidenzen um 1 - 2%. Von therapeutischer Relevanz ist vor allem, dass für eine Reihe dieser Mutationen bereits zielgerichtete Therapeutika aus anderen Tumorentitäten bekannt sind bzw. derzeit neu entwickelt werden (Tab. 1). Auch beim Plattenepithel- und kleinzelligen Karzinom der Lunge sind zwischenzeitlich genetische Aberrationen identifiziert worden, die mehrheitlich therapeutisch potenziell beeinflussbare Targets aufweisen könnten [22, 23]. Fazit: Der Nachweis molekularer Biomarker gewinnt für die Systemtherapie des Lungenkarzinoms zunehmend an Bedeutung. Zwar kann mit der Detektion einer EGFR-Mutation oder EML4/ALK-Translokation bisher nur eine Minderheit von Patienten von stratifizierten Therapien profitieren, die Daten aus multizentrischen Genomprojekten bereichern aber die Suche nach weiteren Biomarkern, um den behandelnden Klinikern therapeutische Targets für ihre Patienten aufzuzeigen. Der Befund des (Molekular-)Pathologen ist nicht nur für die Diagnosesicherung, sondern in zunehmendem Maße auch für die Therapieauswahl entscheidend. Auch unterstützt die Dynamik der Medikamentenentwicklung und -neuzulassungen die Beratung und Behandlung betroffener Patienten in zertifizierten Lungenkrebszentren. Korrespondenzadresse: PD. Dr. med. Martin B. Steins Prof. Dr. med. Michael Thomas Thoraxklinik am Universitätsklinikum Heidelberg, Internistische Onkologie der Thoraxtumoren Amalienstraße 5, 69126 Heidelberg [email protected] [email protected] Literatur: www.onkologie-heute.info PD Dr. med. Martin B. Steins Thoraxklinik am Universitätsklinikum Heidelberg