GPH2_Thermodynamik_M..
Werbung

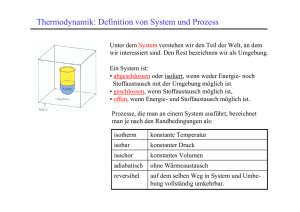
GPH2 Thermodynamik Dieser Entwurf ist weder vollständig oder fehlerfrei noch ein offizielles Script zur Vorlesung. Für Anregungen und Kritik: [email protected] 27. September 2004 1 GPH2 Thermodynamik Seite 2 von 11 Inhaltsverzeichnis 1 2 3 4 Definition der Begriffe 1.1 Thermodynamisches System . 1.2 Temperatur und Gleichgewicht 1.3 Energie, Arbeit und Wärme . . 1.4 Größen und Einheiten . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Erster Hauptsatz 2.1 1. HS für geschlossene Systeme (innere Energie) 2.2 1. HS für offene Systeme (Enthalpie) . . . . . . . 2.3 Anwendungsbeispiele . . . . . . . . . . . . . . . 2.4 Messung von Wärmemengen (Kalorimetrie) . . . Ideales Gas 3.1 Thermische Zustandsgleichung . . . . . . . . . 3.2 Kalorische Zustandsgleichung . . . . . . . . . 3.3 Zustandsgleichung von Gemischen idealer Gase 3.4 Einfache Zustandsänderungen . . . . . . . . . 3.5 Kreisprozesse, Carnot-Prozess . . . . . . . . . . . . . . . . . . . . . . . . . . . Zweiter Hauptsatz 4.1 Reversible und irreversible Zustandsänderungen . . 4.2 Allgemeine Formulierung des zweiten Hauptsatzes 4.3 Entropie . . . . . . . . . . . . . . . . . . . . . . . 4.4 Entropie idealer Gase . . . . . . . . . . . . . . . . 4.5 Exergie und Anergie . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3 3 3 4 4 . . . . 4 4 5 6 6 . . . . . 9 9 9 10 11 11 . . . . . 11 11 11 11 11 11 5 Mehrphasige Systeme, reale Fluide 11 6 Technische Kreisprozesse mit Gasen 6.1 Otto . . . . . . . . . . . . . . . 6.2 Diesel . . . . . . . . . . . . . . 6.3 Seilinger . . . . . . . . . . . . . 6.4 Joule . . . . . . . . . . . . . . . . . . . 11 11 11 11 11 Kreisprozesse mit Phasenänderung (Dämpfe) 7.1 Clausius-Rankin-Prozeß . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.2 Költe-Prozeß mit Dämpfen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 11 11 11 7 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . GPH2 Thermodynamik 1 Seite 3 von 11 Definition der Begriffe Thermodynamik ist die Lehre von den Zustandsänderungen thermodynamischer Systeme unter dem Einfluß von Wärme und Arbeit. 1.1 Thermodynamisches System Ein thermodynamisches System ist ein Kontrollraum oder eine Stoffmenge beliebiger Zusammensetzung, deren Zustand durch Parameter (=Zustandsgrößen) eindeutig bestimmbar ist und die mit der Umgebung Wärme und Arbeit austauschenh kann. Es werden drei Systemarten definiert: abgeschlossenes System: kein Austausch von Masse, Wärme und Arbeit geschlossenen System: kein Massenaustausch, nur Austausch von Wärme und Arbeit offenes System: Austausch von Masse, Wärme und Arbeit möglich Ein System ist durch extensive und intensive Zustandsgrößen gekennzeichnet. Extensive Zustandsgrößen sind proportional zur Masse. Intensive Zustandsgrößen sind unabhängig von der Masse. Bezeichnung Symbol Einheit Typ Masse m kg extensiv Volumen V kg3 extensiv Stoffmenge n mol extensiv kg intensiv Dichte ρ m3 N 5 N , 1 bar = 10 intensiv Druck p m3 m3 Temperatur T, ϑ K intensiv 1.2 Temperatur und Gleichgewicht Zwei Systeme A und B seien abgeschlossen, weiter seien A und B unterschiedlich warm. Beobachtung: Treten A und B in Kontakt, so sind beide Systeme nach einiger Zeit gleich warm. Folgerung: Es muss eine intensive Zustandsgröße existieren, die den Ausgleich hervorruft, Temperatur genannt. Thermisches Gleichgewicht: Nach langer Zeit wird System A im Gleichgewicht mit System B stehen. Sie haben die gleiche Temperatur. (“Nullter Hauptsatz der Thermodynamik” Messung der Temperatur 1. Benutzung eines Temperaturmeßgeräts als zweites System 2. Physikalische Größe des Thermometers, z.B. • Volumenausdehnung des Quecksilbers • elektrischer Widerstand • Thermospannung eines Thermoelements 3. Einstellung des thermischen Gleichgewichts, d.h. das Thermometer hat die gleiche Temperatur wie das System. • Messwerte: “empirische” Temperatur (empirisch = aus Erfahrung, experimentell) • Wenn verdünnte Gase (z.B. Wasserstoff H2 oder Helium He) als Thermosubstanz verwendet werden, so erhält man eine stoffunabhängige GPH2 Thermodynamik Seite 4 von 11 • Thermodynamische Temperatur T , [T ] = K = Kelvin • Vergleich mit anderen Temperaturskalen – Kelvin T ↔ Celsius ϑ T = ϑ + 273, 15 K ∆T = ∆ϑ – Celsius ↔ Fahrenheit ϑ = 59 (ϑF − 32) ϑF = 95 ϑ + 32 1.3 Energie, Arbeit und Wärme U = innere Energie Gesamtenergie des Systems: E = Ekin + Epot + U Da Ekin ∼ m und Epot ∼ m sind, muß auch U ∼ m sein. W = Arbeit = Kraft · Weg Volumenarbeit (Volumenänderungsarbeit) dW = −F ds = −pAds = −pdV Z2 W12 = − pdV 1 Arbeitszufuhr: dV < 0:W12 > 0 Arbeitsabfuhr: dV > 0:W12 < 0 technisch nutzbare Arbeit Z2 Wt12 = V dp 1 Q = Wärme = Wärmeübertragung allein durch Temperaturunterschiede ϑ = Systemtemperatur ϑu = Umgebungstemperatur Wärmezufuhr: ϑ < ϑu :Q12 > 0 Wärmeabfuhr: ϑ > ϑu :Q12 < 0 1.4 2 2.1 Größen und Einheiten Erster Hauptsatz 1. HS für geschlossene Systeme (innere Energie) U2 − U1 = Q12 + W12 GPH2 Thermodynamik Seite 5 von 11 1. HS, spezifisch: Q12 W12 U2 U1 − = + m m m m u2 − u1 = q12 + w12 1. HS, differentiell: du = dq + dw bei V = const: U2 − U1 = Q12 bei p = const: H2 − H1 = Q12 2.2 1. HS für offene Systeme (Enthalpie) Enthalpie: H =U +p·V spezifische Enthalpie: U V H = +p· m m m h=u+p·v 1. HS: U2 − U1 = Q12 + W12 mit der gesamten Arbeit (über das gesamte Kontrollvolumen): W12 = Wt12 + p1 V1 − p2 V2 U2 − U1 = Q12 + Wt12 + p1 V1 − p2 V2 (U2 + p2 V2 ) − (U1 + p1 V1 ) = Q12 + Wt12 H2 − H1 = Q12 + Wt12 1. HS für offene Systeme: Ḣ2 − Ḣ1 = Q̇12 + Ẇt12 Division duch Massenstrom ṁ: Ḣ2 Ḣ1 Q̇12 Ẇt12 − = + ṁ ṁ ṁ ṁ 1. HS für offene Systeme, spezifisch: h2 − h1 = q12 + wt12 1. HS für offene Systeme, differentiell: dh = dq + dwt 1. HS für offene Systeme, allgemein (wenn Epot und Ekin berücksichtigt werden): 1 Ḣ − Ḣ + ṁ c22 − c21 + ṁg (z2 − z1 ) = Q̇12 + Ẇt12 2 (h2 − h1 ) + 1 2 c2 − c21 + g (z2 − z1 ) = q12 + wt12 2 GPH2 Thermodynamik 2.3 Seite 6 von 11 Anwendungsbeispiele Beispiel 1: Verdichter, Turbine 1. HS für offene Systeme (h2 − h1 ) + 1 2 c2 − c21 +g (z2 − z1 ) = q12 +wt12 | {z } |{z} 2 | {z } =0 =0 =0 Beim Verdichter kann man (c22 − c21 ) und (z2 − z1 ) vernachlässigen. q12 = 0 weil die Zustandsänderung adiabatisch erfolgt. wt12 = h2 − h1 Leistung des Verdichters: Ẇt12 = ṁ (h2 − h1 ) Beispiel 2: adiabate Rohrströmung 1. HS für offene Systeme (h2 − h1 ) + 1 2 c2 − c21 + g (z2 − z1 ) = q12 + wt12 |{z} |{z} 2 =0 =0 1 1 h2 + c22 + gz2 = h1 + c21 + gz1 2 2 1 h + c2 + gz = const 2 1 u + pv + c2 + gz = const 2 Medium = Wasser = inkompressible Flüssigkeit, d.h. du = 0, d.h. u = const. v = 1 1 p + c2 + gz = const ρ 2 1 p + ρc2 + ρgz = const 2 Diese Gleichung wird Bernoulli-Gleichung genannt. 2.4 Messung von Wärmemengen (Kalorimetrie) Erster Hauptsatz für geschlossene Systeme mit konstantem Volumen, V = const: U2 − U1 = Q12 dU = dQ Wärmekapazität bei konstantem Volumen: Cv = dU dT = v [Cv ] = kJ K dQ dT v V 1 = m ρ GPH2 Thermodynamik Seite 7 von 11 spezifsiche Wärmekapazität bei konstantem Volumen: 1 1 dU 1 dQ · Cv = · = · m m dT v m dT v du dq cv = = dT v dT v kJ kgK [cv ] = molare Wärmekapazität bei konstantem Volumen: 1 1 dU 1 dQ · Cv = · = · n n dT v n dT v 1 dU 1 dQ cv,n = · = · n dT v n dT v kJ kmolK [cv,n ] = Erster Hauptsatz für geschlossene Systeme mit konstantem Druck, p = const: H2 − H1 = Q12 dH = dQ Wärmekapazität bei konstantem Druck: Cp = dH dT = p dQ dT p kJ K [Cp ] = spezifsiche Wärmekapazität bei konstantem Druck: 1 1 1 dH dQ · Cp = · = · m m dT p m dT p cp = dh dT = p dq dT p kJ kgK [cp ] = molare Wärmekapazität bei konstantem Druck: 1 1 dH 1 dQ · Cp = · = · n n dT p n dT p cp,n 1 = · n dH dT [cp,n ] = Allgemeine Eigenschaften von cv und cp p 1 = · n kJ kmolK dQ dT p GPH2 Thermodynamik Seite 8 von 11 Für Feststoffe gilt: cv ≈ cp → c Für Gase gilt: cv > c p cp − cv = R R = Gaskonstante du cv = dT du = cv dT Z 2 Z 2 cv dT du = 1 1 u2 − u1 = cv (T2 − T1 ) U2 − U1 = m · cv (T2 − T1 ) analog gilt: dh cp = dT dh = cp dT Z 2 Z 2 cp dT dh = 1 1 h2 − h1 = cp (T2 − T1 ) H2 − H1 = m · cp (T2 − T1 ) 2.4.1 Stoffgemisch, Mischungsgleichung Es gilt der 1. HS für abgeschlossene Systeme U2 − U1 = Q12 + W12 |{z} |{z} =0 U2 − U1 m · c · (T2 − T1 ) m · c · T1 mA cA TA + mB cB TB TM TM = = = = =0 0 0 m · c · T2 mA cA TM + mB cB TM mA cA TA + mB cB TB = mA cA + m B cB Σmi ci Ti = Σmi ci GPH2 Thermodynamik 3 3.1 Seite 9 von 11 Ideales Gas Thermische Zustandsgleichung p·V V p m p·v 1 p ρ p p·V = m·R·T = R·T = R·T = R·T = ρ·R·T = n · R0 · T kJ R = Gaskonstante, R0 = allgemeine Gaskonstante, R0 = 8, 314 kmolK 3.2 Kalorische Zustandsgleichung Für die spezifische innere Energie gilt: du u − u0 u − u0 u = = = = cv dT cv (T − T0 ) cv (ϑ − ϑ0 ) cv ϑ = = = = cp dT cp (T − T0 ) cp (ϑ − ϑ0 ) cp ϑ Für die spezifische Enthalpie gilt analog: dh h − h0 h − h0 h Definition der Enthalpie: h = u + pv Für ideale Gase gilt: pV = mRT bzw. pv = RT Daraus folgt: h = u + RT Ableitung nach der Temperatur: du dh = +R dt dT cp = cv + R Cp = Cv + R · m Das Verhältnis der Wärmekapazitäten κ= cp cv GPH2 Thermodynamik Seite 10 von 11 Folgende Beziehungen können abgeleitet werden: cp = κ · cv cv + R = κ · cv (κ − 1) cv = R R cv = κ−1 κ cp = R κ−1 3.3 Zustandsgleichung von Gemischen idealer Gase Für Gemische können die selben Gleichungen wie für reine Gase angewandt werden. p·v =m·R·T p · v = n · R0 · T u = cv · T h = cp · T Mit den folgenden Mischungsregeln R= P ξi · Ri i cv = P ξi cv,i i cp = P ξi cp,i i Molmasse m M= n P M = γi Mi i [M ] = kg kmol GPH2 Thermodynamik 3.4 Einfache Zustandsänderungen 3.5 Kreisprozesse, Carnot-Prozess 4 Zweiter Hauptsatz 4.1 Reversible und irreversible Zustandsänderungen 4.2 Allgemeine Formulierung des zweiten Hauptsatzes 4.3 Entropie 4.4 Entropie idealer Gase 4.5 Exergie und Anergie 5 Mehrphasige Systeme, reale Fluide 6 Technische Kreisprozesse mit Gasen 6.1 Otto 6.2 Diesel 6.3 Seilinger 6.4 Joule 7 Kreisprozesse mit Phasenänderung (Dämpfe) 7.1 Clausius-Rankin-Prozeß 7.2 Költe-Prozeß mit Dämpfen Seite 11 von 11