4.6 Hauptsätze der Thermodynamik
Werbung

4 Thermodynamik
4.6 Hauptsätze der Thermodynamik
4.6.1 Erster Hauptsatz: Energieerhaltungssatz
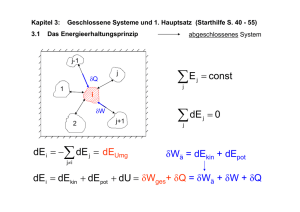
In einem abgeschlossenen System bleibt der gesamte Energievorrat, also die Summe aus Wärmeenergie, mechanischer Energie und anderer Energie stets konstant.
- oder Es existiert kein perpetuum mobile 1. Art. (Maschine die Arbeit verrichtet ohne
Energie von außen aufzunehmen).
Innere Energie U : Kalorische Zustandsgröße, die den Energieinhalt als Funktion von p, V, T
beschreibt.
dU = dQ + dW
(4.41)
dQ: Wärme,
dW : Arbeit; positives Vorzeichen: zugeführte Wärme bzw. Arbeit.
Ausdehnungsarbeit (ideales Gas):
F
ds
A
Abbildung 4.2: Kraft auf Fläche A, Ausdehnung um ds.
W =−
=−
=−
Z
s2
Zs1s2
Zs1s2
F ds
(4.42)
pAds
(4.43)
pdV
(4.44)
s1
⇒ dU = dQ − pdV
innere Energie
(4.45)
Ersetzen von dQ durch Wärmekapazität:
1
1 dQ
=
c=
n dT
n
98
dV
dU
+p
dT
dT
(4.46)
4.6 Hauptsätze der Thermodynamik
Spezifische Wärme bei konstantem Volumen:
1 dU
1 dQ
=
⇒ cV =
n dT V =const. n dT
⇒ dU = ncV dT
⇒ dQ = ncV dT + pdV
(4.47)
(4.48)
(4.49)
Zugeführte Wärme dient der Erhöhung der Temperatur oder der Volumenvergrößerung.
1 dQ
1 dU
dV
cp =
=
+p
(4.50)
n dT p=const. n dT
dT p=const.
Mit pV = nRT → pdV = nRdT folgt für die spezifische Wärmekapazität bei konstantem
Druck:
1 dU
cp =
+ nR = cV + R
(4.51)
n dT
4.6.2 Spezielle Zustandsänderungen idealer Gase:
isotherm: T = const.
p
T2
T1
V
Abbildung 4.3: Isotherme Zustandsänderung.
Arbeit:
pV = nRT = const.
Z V2
W12 = −
p(V )dV
⇔ W12 = −
V1
Z V2
V1
nRT
V1
dV = nRT ln
V
V2
(4.52)
(4.53)
(4.54)
99
4 Thermodynamik
Wärme:
Keine Änderung der inneren Energie.
dU = dQ + dW = 0
⇒ Q12 = −W12
(4.55)
(4.56)
isobar: p = const.
p
T2
T1
V
Abbildung 4.4: Isobare Zuständsänderung.
V
nR
=
= const.
T
p
(4.57)
W12 = p (V1 − V2 )
Q12 = nCmp (T2 − T1 )
Arbeit:
Wärme:
adiabatisch/isentrop: Q = const.
Vorgang so schnell, daß kein Wärmeaustausch stattfindet.
p
Adiabate
T2
T1
V
Abbildung 4.5: Adiabatische Zustandsänderung.
100
(4.58)
(4.59)
4.6 Hauptsätze der Thermodynamik
dU = −pdV = dW
dU = nCmV dT
mit
pV = nRT ⇒ dT =
(4.60)
(4.61)
(pdV + V dp)
nR
Cmv
(pdV + V dp) = −pdV
R
mit R = cp − cV folgt
dp
cp dV
+
=0
⇒
cV V
p
⇒ dU =
(4.62)
(4.63)
(4.64)
Poissonsche Adiabatengleichung:
pV κ = const.
T V κ−1 = const.
Tp
mit
1−κ
κ
= const.
cp
Adiabatenexponent
κ=
cv
(4.65)
(4.66)
(4.67)
(4.68)
Arbeit:
W12
⇔ W12
p1 V1 V1 κ−1
=
−1
κ − 1 V2
= nCmV (T2 − T1 )
(4.69)
(4.70)
101
Tabelle 4.1: Übersicht der Zustandsänderungen idealer Gase.
Zustandsänderung
Bedingung
p−V−
Diagramm
thermische
Zustandsgrößen
erster
Hauptsatz
Wärme
Volumenänderungsarbeit
pV =const.
Boyle-Mariotte
dQ + dW = 0
Q12 + W12 = 0
dQ = −dW
Q12 = nRT ln(V2 /V1 )
dW = −pdV
W12 = nRT ln(V1 /V2 )
p
T
= const.
Charles
dU = dQ
U2 − U1 = Q12
dQ = nCmV dT
dW = 0
Q12 = nCmV (T2 − T1 ) W12 = 0
= mcp (T2 − T1 )
V
T
= const.
Gay-Lussac
dU = dQ + dW
U2 − U1 = Q12 + W12
dQ = nCmp dT
Q12 = nCmp (T2 − T1 )
= mcp (T2 − T1 )
dW = pdV
W12 = p(V1 − V2 )
pV κ = const.
T V κ−1 = const.
p1−κ T κ = const.
dU = dW
U2 − U1 = W12
dQ = 0
Q12 = 0
dW = nCmV dT
W12 = nCmV (T2 − T1 )
2 −p1 V1
= p2 Vκ−1
p
isotherm
dT = 0
V = const.
V
isochor
dV = 0
V = const.
p
V
p
isobar
dp = 0
p = const.
V
isentrop
dS = 0
dQ = 0
S = const.
V
102
4 Thermodynamik
p
4.6 Hauptsätze der Thermodynamik
4.6.3 Kreisprozesse
Anfangs- und Endzustand des Systems stimmen überein. Die je Umlauf nach außen abgegebene Nutzarbeit entspricht dem Flächeninhalt der vom Prozeß eingeschlossenen Figur im
p-V-Diagramm.
I
I
W = dW = − pdV
(4.71)
Carnotscher Kreisprozeß (rechtsläufig)
p
Adiabaten
3
4
2
1
Isothermen
T3
T1
V
Abbildung 4.6: Carnotscher Kreisprozeß (rechtsläufig).
1 → 2: isotherme Kompression von V1 nach V2 bei T1 .
V1
zugeführte Arbeit
V2
V1
abgegebene Wärme
= −nRT1 ln
V2
W12 = nRT1 ln
(4.72)
Q12
(4.73)
2 → 3: adiabatische Kompression von V2 nach V3 ; Temperatur steigt von T1 nach T3 .
W23 = nCmV (T3 − T1 ) zugeführte Arbeit
Q23 = 0 adiabatisch
(4.74)
(4.75)
3 → 4: isotherme Expansion von V3 nach V4 bei T3
W34 = −nRT3 ln
Q34 = nRT3 ln
V4
abgegebene Arbeit
V3
V4
zugeführte Wärme
V3
(4.76)
(4.77)
4 → 1: adiabatische Expansion von V4 nach V1 ; Temperatur fällt von T3 nach T1
W41 = −nCmV (T3 − T1 ) abgegebene Arbeit
Q41 = 0 adiabatisch
(4.78)
(4.79)
103
4 Thermodynamik
⇒W =
I
dW = W12 + W23 + W34 + W41
W23 =−W41
⇒W
↓
=
W12 + W34
V4
V1
= −nR T3 ln
− T1 ln
V3
V2
(4.80)
(4.81)
mit den Adiabatengleichungen:
T3 V3κ−1 = T1 V2κ−1
T3 V4κ−1 = T1 V1κ−1
(4.82)
(4.83)
folgt für die Arbeit insgesamt:
W = −nR ln
V4
(T3 − T1 )
V3
(4.84)
Da W negativ ist wird Arbeit nach außen abgegeben.
Thermischer Wirkungsgrad η:
Quotient aus nach außen abgegebener Arbeit und zugeführter Wärme.
η=
|W |
Q34
(4.85)
mit
|W | = Qzugeführt − |Qabgeführt |
⇔ Q12 + Q34 + W = 0
(4.86)
(4.87)
folgt für den Wirkungsgrad des Carnotschen Kreisprozesses (rechtsläufig):
η =1−
T1
T3
(4.88)
Der Wirkungsgrad hängt nur von den Temperaturen der Wärmebäder ab.
Linksläufiger Carnotscher Kreisprozess:
Arbeit wird in Wärme umgesetzt; Wärme wird von kaltem Reservoir in warmes Reervoir
überführt.
⇒ Wärmepumpe, Kältemaschine
104
4.6 Hauptsätze der Thermodynamik
Leistungszahl ǫ:
ǫ=
Q12
T3
=
W
T1 − T3
(4.89)
4.6.4 Zweiter Hauptsatz der Thermodynamik
Reversibel/irreversibel:
Ein Vorgang ist irreversibel, wenn er nicht in umgekehrte Richtung ohne Arbeitsverrichtung
ablaufen kann. Technische Prozesse sind irreversibel.
⇒ Es gibt keine periodisch arbeitenden Maschinen, die Wärme vollständig in mechanische
Arbeit umwandeln.
Der Wirkungsgrad beliebiger Kreisprozesse ist kleiner oder gleich (irreversible bzw. reversible
Kreisprozesse) dem Wirkungsgrad des Carnotschen Kreisprozesses.
ηirr < ηrev = ηCarnot =
T1 − T3
T1
(4.90)
allgemein gilt:
Q12
T3
≤1−
Q34
T1
Q12 Q34
+
≤0
T1
T3
η =1+
(4.91)
(4.92)
Kreisprozeß
Reversibel:
⇒
I
Irreversibel:
X Qi
Ti
i
dQrev
=0
T }
| {z
(4.93)
(4.94)
dS
X Qi
i
=0
Ti
<0
(4.95)
(4.96)
105
4 Thermodynamik
Tabelle 4.2: Technische Kreisprozesse.
Prozeß
p–VDiagramm
p
Einzelprozesse
thermischer
Wirkungsgrad
2 Isentropen,
2 Isochoren,
1 Isobare
ηth = 1 −
2 Isentropen,
2 Isochoren
ηth = 1 − V1 1κ−1
Qzu
3
4
Qzu
2
Verbrennungsmotoren
Kolbenmaschinen
SeiligerProzeß
|W|
5
Qab
1
V
T5 −T1
T3 −T2 +κ(T4 −T3 )
p
3
OttoProzeß
Qzu
4
|W|
2
Qab
V2
1
V
p
Qzu
V κ
3
2
DieselProzeß
|W|
4
Qab
1
3
V2
2 Isentropen,
1 Isochore,
1 Isobare
ηth = 1 − V3
2 Isothermen,
2 Isochoren
ηth = 1 −
2 Isentropen,
2 Isobaren
ηth = 1 − TT12
κ−1
κ
= 1 − pp21
2 Isothermen,
2 Isobaren
ηth = 1 −
2 Isentropen,
2 Isobaren
ηth =
κ
V2
−1
V κ−1
−1
1
V2
Heißluftmotor
V
p
3
StirlingProzeß
Qzu
Qzu
T3
|W|
2
Qab T1
4
T1
T3
= ηth,C
Qab
1
offene
Gasturbine
p
Qzu
3
2
JouleProzeß
|W|
1
Qab
4
V
geschlossene
Gasturbine
Strömungsmaschinen
V
p
Qzu
2
EricssonProzeß
3
|W|
T3
Qzu
T1
Qab
4
1
T1
T3
= ηth,C
Qab
V
Dampfkraftanlagen
p
106
Qzu
2
ClausiusRankineProzeß
3
|W|
1
Qab
4
Koexistenzgebiet
V
h3 −h4
h3 −h1
≈1−
h4
h3