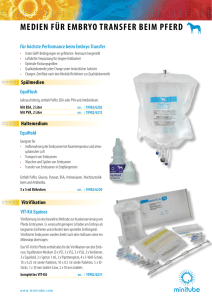
vts_6063_8154. - oparu
Werbung

Isolierung und Charakterisierung von Forkhead Transkriptionsfaktoren der Subklasse N in Xenopus laevis Dissertation zur Erlangung des Grades Doktor der Naturwissenschaften (Dr. rer. nat.) der Fakultät für Naturwissenschaften der Universität Ulm vorgelegt von Maximilian François Schuff aus Lindau/Bodensee 2007 Amtierender Dekan: Prof. Dr. Klaus-Dieter Spindler 1. Gutachter: Prof. Dr. Dr. Walter Knöchel 2. Gutachter: Tag der Promotion: Inhaltsverzeichnis 1 1.1 1.2 1.3 1.4 1.5 2 2.1 2.1.1 2.1.2 2.2 2.3 2.4 2.4.1 2.4.2 2.4.3 2.5 2.6 2.6.1 2.6.2 2.6.3 2.7 2.7.1 2.7.2 2.7.3 2.8 2.8.1 2.8.1.1 2.8.1.1.1 2.8.1.1.2 2.8.1.1.3 2.8.1.1.4 2.8.1.1.5 2.8.1.1.5.1 2.8.1.1.5.2 2.8.1.1.5.3 2.8.1.1.5.4 2.8.1.1.6 2.8.1.1.7 2.8.1.1.7.1 2.8.1.1.7.2 2.8.1.1.7.3 2.8.1.1.8 2.8.1.1.9 2.8.1.1.10 Einleitung Xenopus als Modellorganismus zur Untersuchung der Embryogenese Die Neuralleistenentwicklung in Vertebraten Das Chondrocranium in der Kaulquappe von Xenopus laevis: Von der Neuralleiste zum Kiefer Die Forkhead Transkriptionsfaktoren Aufgabenstellung Material und Methoden Bezugsquellen und Geräte Geräte Sonstige Gebrauchsartikel verwendete Software zur Protein und Nukleinsäureanalyse Chemikalien und Radiochemikalien Antikörper, Enzyme und Hormone Antikörper Enzyme Hormone Kits Nukleinsäuren Vektoren cDNA-Klone Oligonukleotide und Morpholino-Oligonukleotide Organismen Bakterienstämme Phagen Versuchstiere Methoden Arbeiten mit Nukleinsäuren Arbeiten mit DNA Isolierung von Plasmid-DNA aus Bakterien mittels Telt-Methode Plasmidisolation aus Bakterien mit Qiagen Plasmid Midi/Mini Kit Aufreinigung von DNA aus wässrigen Lösungen mittels des Qiagen PCR Purification Kit Isolierung von genomischer DNA aus Phagen Manuelle Aufreinigung von DNA Aufreinigung von DNA mittels Phenol/Chloroform-Extraktion Ethanolfällung von DNA aus wässrigen Lösungen Isopropanolfällung von DNA aus wässrigen Lösungen Reinigung über Agarosegelelektrophorese Konzentrationsbestimmungen von wässrigen Nukleinsäurelösungen Enzymatische Modifikation von DNA Restriktionsspaltung Ligation Radioaktive Markierung von DNA PCR (Polymerase chain reaction) Kolonie-PCR RT-PCR 1 1 3 6 10 14 15 15 15 16 16 17 17 17 17 18 18 18 18 19 19 21 21 21 21 21 21 22 22 22 23 23 23 23 24 25 25 26 26 26 27 28 29 31 31 I 2.8.1.1.11 2.8.1.1.12 2.8.1.1.13 2.7.1.1.14 2.8.1.2 2.8.1.2.1 2.8.1.2.2 2.8.1.2.3 2.8.1.3 2.8.1.3.1 2.8.1.3.2 2.8.1.3.3 2.8.1.3.4 2.8.2 2.8.2.1 2.8.2.1.1 2.8.2.1.2 2.8.2.1.3 2.8.2.1.4 2.8.2.1.5 2.8.2.2 2.8.2.2.1 2.8.2.2.1.1 2.8.2.2.1.2 2.8.2.2.1.3 2.8.2.2.1.4 2.8.2.3 2.8.2.3.1 2.8.2.3.2 2.8.2.3.3 2.8.2.3.4 2.8.2.3.5 2.8.2.3.6 2.8.2.4 2.8.2.4.1 2.8.2.4.2 2.8.2.4.3 2.8.2.4.4 2.8.2.4.5 2.8.2.4.6 2.8.2.4.7 2.8.2.4.8 Semiquantitative RT-PCR DNA-Sequenzierung Schnelle Amplifizierung von 5´ cDNA-Enden (5´ RACE) Amplifizierung von cDNA Enden aus einer Lambda ZAP® II Phagenbank Arbeiten mit RNA Aufreinigung von RNA aus embryonalem Gewebe von Xenopus laevis Reinigung von RNA In vitro Transkription von RNA Arbeiten mit Proteinen In vitro Translation von Proteinen SDS-PAGE Aufreinigung von GST-Fusionsproteinen mit Glutathion Sepharose Pulldown Assay Arbeiten mit Organismen Arbeiten mit Bakterien Herstellung chemokompetenter Zellen nach der RbCl-Methode Transformation von Bakterien Blau-Weiß Selektion von Bakterien Anlegen von Gefrierkulturen transformierter Bakterien Herstellung von Bakterien für Phageninfektion Arbeiten mit Phagen Screenen einer Phagen-Bank Transfer der Phagen-DNA auf Nitrocellulose Filter Nitrocellulose Filter Hybridisierung In vivo Excision Nitrocellulose-Filter strippen Arbeiten mit Xenopus laevis Stimulation der Eiablage zur Gewinnung von Froschembryonen In vitro Befruchtung von Xenopus laevis Eiern Entfernen der Gallerthülle und Mikroinjektionen von Xenopus laevis Eiern Betäuben von Embryonen Fixieren von Embryonen Luciferase Assay Histologische und immunohistologische Methoden (Whole Mount) in situ Hybridisierung Antikörperfärbung BrdU Assay TUNEL Assay Alcianblau Färbung an ganzen Embryonen und Gewebeschnitten Hämatoxilin/Eosin (HE) Färbung Anfertigung von histologischen Schnitten von Xenopus laevis Transparenzvisualisierung von Embryonen mit Benzylbenzoat/Benzylalkohollösung 32 32 33 35 35 36 36 37 38 38 38 40 41 42 42 42 43 43 44 44 44 45 46 46 47 48 49 49 49 50 51 51 51 52 52 55 55 56 57 57 58 58 II 3 3.1 3.1.1 3.1.2 3.1.3 3.1.4 3.1.5 3.2 3.3 3.4 3.4.1 3.4.1.1 3.4.1.2 3.4.1.3 3.4.1.4 3.4.1.5 3.4.1.6 3.4.1.7 3.4.1.8 3.4.1.9 3.4.2 3.4.3 3.5 3.5.1 Ergebnisse Identifizierung von Forkhead Genen der Subklasse N in Xenopus laevis Die Sequenzanalyse des FoxN1 Gens in Xenopus Die Isolierung des FoxN2 Gens Die Identifizierung von FoxN3a und FoxN3b Die Aufklärung der Struktur des FoxN4 Gens Das FoxN5 Gen von Xenopus laevis Untersuchung der temporalen Expression der FoxN Gene in Xenopus laevis Embryonen Untersuchung der räumlichen Expression der FoxN Gene in Xenopus laevis Embryonen Funktionelle Analyse des FoxN3 Gens in Xenopus laevis Untersuchung des FoxN3 Gens über Funktionsverlustanalyse Morpholinobindungstest in vivo Untersuchung des bei Funktionsverlust von FoxN3 auftretenden Phänotyps bei Xenopus laeevis Histologische Untersuchung und Markeranalyse des AugenPhänotyps Untersuchung der craniofacialen Strukturen bei FoxN3 Verlust Analyse der Hirnnerven in FoxN3 Funktionsverlustphänotypen FoxN3 Funktionsverlust hat keinen Einfluss auf die Expression von Neuralleistenmarkergenen, jedoch auf den Mandibularmarker Xbap Der Funktionsverlust von FoxN3 hat keine Auswirkungen auf die Migration der cranialen Neuralleistenzellen Ein Funktionsverlust von FoxN3 führt zu vermehrter Apoptose FoxN3 interagiert mit dem Histondeacetylasekomplex (HDAC) Die Überexpression von FoxN3 zeigt keinen Einfluss auf die Embryogenese von Xenopus laevis Der Wildtyp kann bei FoxN3 Funktionsverlust durch Koinjektion von FoxN3 mRNA nicht wiederhergestellt werden. Funktionelle Analyse von FoxN2, FoxN4 und FoxN5 Untersuchung des FoxN4 Promotors 59 59 59 60 60 61 61 68 69 73 73 74 76 78 80 83 85 88 90 92 95 95 95 96 98 98 99 4.6 4.7 Diskussion Die FoxN Subklasse Das räumliche und zeitliche Expressionsmuster FoxN3 reguliert die korrekte Ausbildung des Auges und craniofacialen Elementen während der späten Embryogenese FoxN3 ist notwendig für das Überleben retinaler Zellen Ansätze eines Erklärungsmodells: FoxN3 als Repressor durch Vermittlung der HDAC Funktion? Six3 und xRX regulieren den Promotor von FoxN4 Aussichten 5 .1 5.2 Zusammenfassung Summary 110 111 6 Literaturverzeichnis 112 4. 4.1 4.2 4.3 4.4 4.5 100 104 105 108 109 III 7 7.1 7.2 7.3 Anhang Vollständige Nukleotidsequenzen der FoxN Transkripte Nukleotidsequenz der genomischen Sequenz des FoxN4 Gens aus der λ-Zap Phagenbank Vektoren Lebenslauf Danksagung IV Abkürzungsverzeichnis Abb. AP APS ATP bp BCIP BMP BrdU °C cDNA CHAPS CHES1 CIP CMZ Co-MO dATP dCTP ddNTP DIG Dlx DMPC DNA DNase dNTP dpf dUTP E.coli EDTA EGTA EST et al. FAB FBS Fox FGF fkh g GFP GST h HCG HDAC HE HEPES Hox HTLF INT IPTG kb Abbildung Alkalische Phosphatase Ammoniumpersulfat Adenosin-5'-Triphosphat base pairs (Basenpaare) 5-Bromo-4-chloro-3-Indoyl-Phosphat-p-Tuloidinsalz Bone morphogenetic protein 5-Bromo-2`-deoxy-uridin Grad Celsius copy DNA 3-[(3-Cholamidopropyl)dimethylammonio] -l-Propansulfonsäure checkpoint suppressor 1 calf intestine phosphatase Ciliary Marginal Zone Control-MO (Kontrollmorpholino-Oligonukleotid) 2’Desoxyadenosin-5’-triphosphat 2’Desoxycytidin-5’-triphosphat Didesoyribonukleosid-5´-triphosphat Digoxygenin distal-less homeobox Dimethyl Pyrocarbonat Deoxyribonucleic Acid (Desoxyribonukleinsäure) Desoxyribonuklease 2’Desoxynukleosid-5’-triphosphat day post fertilization (Tag nach der Befruchtung) 2’Desoxyuridin-5’-triphosphat Escherichia coli Ethylendiamintetraessigsäure Ethylenglycol-bis (2-aminoethyl ether)-N,N,N',N'-tetraessigsäure expressed sequence tag et alii Fragment antigen binding Fetal Bovine Serum (Fötales Rinderserum) Forkhead box Fibroblast Growth Factor Forkhead Gravitationskonstante (9,81 m/s2) Green Fluorescent Protein Glutathion-S-Transferase hora (Stunde) humanes Choriongonadotropin Histone Deacetylase Complex (Histon Deacetylase Komplex) Hämatoxilin-Eosin N-2-Hydroxyethylpiperazin-N'-2-ethansulfonsäure Homöobox Human T-cell Leukemia Enhancer Factor Iodonitrotetrazolium Isopropyl-ß-D-thiogalactopyranosid Kilo Basen V l lac LB LTR M mA MAB MBT MBSH mec1 MEM(P)FA MLL mM mm min mg ml MNF MOPS MO mRNA NAD+ NBT ng nl nm OCM OD ODC ORF PAGE PAH Pax PCR PBS PBT pfu pg Pou RACE Rb RLU RNA RNase RPD3 rpm RT RT-PCR s SDS Sin3 Liter Lactose Luria-Bertani Longterm Repeat Mol Milliampere maleic acid buffer (Maleinsäure Puffer) Midblastula Transition modified Barth's saline solution/ HEPES Mitosis entry checkpoint MOPS/ EGTA/MgSO4/(Para)Formaldehyd Mixed lineage leukemia millimolar (mMol/l) Millimeter Minuten Milligramm Milliliter Myocyte nuclear factor N-Morpholino-Propansulfonsäure Morpholino-Oligonukleotid messenger RNA (Boten RNA) Nicotinamid-adenin-dinukleotid Nitroblau Tetrazoliumchlorid Nanogramm Nanoliter Nanometer Oocyte Culture Medium Optische Dichte Ornithin-Decarboxylase Open reading frame (Offener Leserahmen) Polyacrylamid-Gelelektrophorese Paired amphipathic helix Paired box polymerase chain reaction (Polymerasekettenreaktion) Phosphate-buffered saline Phosphate-buffered saline/Tween plaque forming units (Plaque bildende Einheiten) Picogramm (Pit-Oct-UnPc) Rapid Amplification of cDNA Ends Retinoblastom relative light units (relative Lichteinheiten) Ribonucleic acid (Ribonukleinsäure) Ribonuklease reduced potassium dependency yeast homolog 3 revolutions per minute (Umdrehungen pro Minute) Raumtemperatur Reverse Transkriptase-Polymerase Chain Reaction secunda (Sekunde) sodium dodecyl sulfate (Natrium-dodecylsulfat) switch independent protein 3 VI Six SKIP Sox TAE Tap Taq TdT TE TEMED Tm TNF TUNEL ü.N. U UTR UV V Vol whn WMISH % v/v % w/v Xbap XBF-2 X-Gal xRX zax sine oculis homeobox Ski-interacting protein Sry box Tris-Acetat/EDTA tobacco acid pyrophosphatase Thermus aquaticus terminal deoxynucleotidyl transferase Tris-HCl/EDTA N,N,N´,N´-Tetramethylethylendiamin Melting Temperature (Schmelztemperatur) Tumor Nekrose Faktor TdT-mediated dUTP-biotin nick end labeling über Nacht Unit (Enzymaktivität) Untranslated Region (Untranslatierter Breich der Boten RNA) Ultraviolett Volt Volumen winged-helix nude Whole mount in situ Hybridisierung Volumenprozent in Lösung Gewichtsprozent in Lösung Xenopus bagpipe Xenopus brain factor-2 5-Brom-4chlor-3-indolyl-ß-D-galaktosid Xenopus Retinal homeobox zampogna homeobox VII 1 Einleitung 1.1 Xenopus laevis als Modellorganismus zur Untersuchung der Embryogenese Mit dem Auftreten von vielzelligen Lebewesen während der Evolution wurde der Grundstein für die Zellspezialisierung gelegt und damit die zahlreiche Vielfalt verschiedener Zelltypen, Geweben und Organen. Wie aus einer einzelnen (befruchteten) Zelle so unterschiedliche Zelltypen, wie Haut-, Muskel- oder etwa Nervenzellen entstehen können und dies in der korrekten Positionierung der Zelle im Organismus ist wohl eine der interessantesten Fragestellungen überhaupt. Deren Aufklärung die Basis der heutigen Entwicklungsbiologie. Inzwischen ist allgemein anerkannt, dass fast alle Zellen eines Organismus das gleiche Erbgut, d.h. den gleichen Gensatz besitzen. Umso faszinierender ist es heraus zu finden, was die Grundlage dafür ist, dass aus einer totipotenten Zygote differenzierte Zellen mit komplett unterschiedlichem Aussehen und Funktionen entstehen können. Diese Entwicklungsvorgänge setzen eine Vielzahl von intra- als auch extrazellulären Signalen voraus, die so hoch komplexe Prozesse wie die Information der Zellposition, Zellwanderung, Zellproliferation und Zelldifferenzierung steuern. Die Signalvermittlung wird dabei in der Regel durch Proteine übernommen. Jedoch spielen auch andere Signale aus verschiedensten Stoffklassen wie Steroide, Ionen, Nukleinsäuren, etc. eine essentielle Rolle. Zur Untersuchung dieser hochkomplexen Interaktionsprozesse während der Vertebratenembryogenese stehen zurzeit vier Modellorganismen im Interesse der Forschung: die Maus (Mus musculus), das Huhn (Gallus gallus), der Zebrafisch (Danio rerio) und der Südafrikanische Krallenfrosch (Xenopus laevis). Amphibien sind dabei wohl die ältesten Studienobjekte der Embryogenese. Bereits Mitte des vorletzten und Anfang des letzten Jahrhunderts setzte eine ausgiebige Untersuchung der Embryogenese von Fröschen und Lurchen ein, die allerdings zu diesem Zeitpunkt noch eher beschreibender und vor allem taxonomischer Natur war (Vogt, 1842; Gutzeit 1889; Dreyer 1915; Edgeworth, 1930). Dies hat sich mittlerweile mit der Etablierung der Molekulargenetik als Wissenschaft geändert. Die Vorzüge von Amphibien als Modellorganismen liegen dabei klar auf der Hand. Zum einen stehen meist eine große Anzahl von Nachkommen zur Analyse zur Verfügung, zum anderen entwickeln sich diese außerhalb des Körpers des Muttertieres 1 und sind darüber hinaus durch die durchsichtige Eihülle leicht für Manipulationen und Beobachtungen zugänglich. Bereits im ersten Drittel des letzten Jahrhunderts Transplantationsexperimente an Embryonen verschiedener Triturus-Arten durchgeführt (Spemann und Mangold, 1924), die erste Schlüsse auf induktive Prozesse während des Gastrulationsprozesses zuließ. Mit der Entdeckung der DNA als Erbgutträger und Entschlüsselung des genetischen Codes (Watson and Crick; 1953; Nirenberg et al., 1963), sowie der Verwendung neuer Untersuchungsmethoden, der Ende des letzten Jahrhunderts sich rasant entwickelnden Molekularbiologie, ist das Wissen in diesem Bereich enorm angewachsen. Bis zum heutigen Tage hin, hat sich der Südafrikanische Krallenfrosch (Xenopus laevis) dabei als nützliches Modell, nicht zuletzt wegen seiner relativ anspruchslosen Kultivierbarkeit und seinem kurzen Regenerationsintervall zwischen zwei Eiablagen, bewährt. Während die Maus (Mus musculus) den Vorteil bietet, dass sie als Säuger evolutionär dem Mensch (Homo sapiens) eher vergleichbar ist, steht die intrauterine Embryonalentwicklung und damit fast unmögliche Manipulation, die geringe Embryonenzahl und das aufwendige und zeitintensive Gen-Targeting, das darüber hinaus bei Genredundanzen und der Letalität bei einigen Gen-Knockouts für die Embryogenese essentieller Gene zu unzureichenden Antworten führt, dem als Nachteile gegenüber. Das Huhn (Gallus gallus) bietet aufgrund der guten Zugänglichkeit des Embryos einen guten Ansatz zur Durchführung von Transplatationsexperimenten, jedoch erweist es sich bei der Inaktivierung einzelner Gene als nicht optimal. Der Zebrafisch (Danio rerio), als relativ junger Modellorganismus bietet ähnliche Vorteile wie Xenopus laevis und hatte lange Zeit den Vorteil gegenüber dem pseudotetraploiden Xenopus laevis, mit ihm genetische Screenings oder leichter Funktionsverlustanalysen mittels Morpholino antisense Oligonukleotidnukleotide durchführen zu können. Dies kann bei Xenopus laevis aufgrund eines „Rescueeffektes“ (Überlagerungseffekt) durch das mitunter Funktions- jedoch nicht immer sequenzspezifische Pseudoallel zu Problemen bei Morpholino-Oligonukleotid vermittelten Funktionsverlustanalysen und damit zu Fehlinterpretationen führen. Der Vorteil der Verwendung des Zebrafisches als Modellorganismus hat sich jedoch durch die Entdeckung seiner partiellen Tetraploidie relativiert. 2 1.2 Die Neuralleistenentwicklung in Vertebraten Die Neuralleistenzellen sind wahrscheinlich eine der komplexesten und faszinierendsten Zelltypen des frühen Embryos. Die Neuralleisten werden beidseitig lateral des Neuralrohres angelegt, delaminieren und wandern von dort aus in verschiedenste Bereiche des embryonalen Körpers. Viele, durchaus unterschiedliche Organe und Gewebe der Vertebraten sind Derivate der Neuralleisten wie z. B. Teile des Neurocraniums, das Kopfmesenchym, Neurone und Gliazellen des peripheren Nervensystems, Gewebe des Auges wie die Sclera und die Cornea, die Choroidea und die Melanozyten. Seit Erstbeschreibung der Neuralleiste im Hühnchen vor über 140 Jahren (His, 1868) wurde viel experimentiert, um die komplexen Prozesse der Entwicklung, Determinierung, Migration und Differenzierung dieser Zellen zu verstehen. Dennoch sind viele Details dieser hoch komplexen molekularen Mechanismen weiterhin unverstanden. Eine erstmalige Untersuchung der Migration von Neuralleistenzellen in Amphibien erfolgte Mitte des letzen Jahrhunderts mit Hilfe von Vitalfarbstoffen (Landacre 1921; Raven 1935; Hörstasius 1950). Transplantationsexperimente in Hühnchenembryonen mit Wachtelgewebestücke (Le Douarin, 1980) und in Amphibien mit Einstückexperimenten von Xenopus borealis Gewebe in Xenopus laevis (Thiebaud, 1983) halfen die Migrationsbewegungen während der Embryogenese der Vertebraten zu verstehen. Neue Mikroskopietechniken, verbesserte und persistentere Vitalfarbstoffe mit geringerer Toxizität, sowie Verwendung von Fluoreszenzproteinen erleichterten und verbesserten diese Experimente. Die Entdeckung und Verwendung von photokonvertierbaren Fluoreszenzproteinen (Wiedenmann et al.,2004; Wacker et al., 2006) erlaubt inzwischen Zellwanderungsbewegungen ohne Transplantationen und damit mit einem geringeren Arbeitaufwand, einer geringeren Mortalitätsrate und einer höheren Verlässlichkeit der Ergebnisse in Organismen wie Xenopus laevis durchzuführen. In Kontrast zu den weit reichend untersuchten Migrationsbewegungen der Neuralleistenzellen, ist das Wissen um die verursachenden molekularen Prozesse und Signalwege immer noch unzureichend. Sowohl die induktiven Prozesse, die die Bildung von Neuralleistengewebe ermöglichen, als auch die späteren Differenzierungsprozesse sind bisher unzureichend erforscht und somit weitgehend unbekannt. So kann zwar durch das Zusammenfügen von Zellen des Neuralrohres und epidermalen Zellen Neuralleistengewebe induziert werden (LaBonne und Bronner-Fraser, 1999), aber die induktive Signalgebung blieb bisher unklar. 3 Für mehre Signalgebende Faktoren und Genfamilien konnte gezeigt werden, dass sie an den Determinierungs-, Differenzierungs-und Migrationsprozessen der Neuralleistenzellen beteiligt sind so zum Beispiel der FGF-Signalweg (Mayor und Aybar, 1997), die Wnt-Proteine (Chang et al., 1998), der BMP-Signalweg, (Nguyen et al., 2000; die Pax Gene (Pax3; Bang et al., 1999), die Zink Finger Proteine (Zic3; slug; Nakata et al., 1997; LaBonne and Bronner-Fraser 1998), die Sox Gene ( Sox9, Sox 10; Spokony et al., 2002; Aoki et al., 2003), die Forkhead Transkriptionsfaktoren (FoxD3, XBF2; Pohl und Knöchel, 2001; Gomez-Skarmeta et al., 1999) und viele andere mehr. Erschwert wird jedoch das Verständnis um die Rolle dieser Gene, dass es kein allgemein gültiges Muster für alle Wirbeltiere gibt. So ist der Transkriptionsfaktor slug essentiell für die korrekte Wanderung von Neuralleistenzellen im Huhn und in Xenopus laevis, das Maushomologe konnte jedoch deletiert werden ohne entsprechender Auswirkung auf das Migrationsverhalten (Nieto et al., 1994; Jiang et al., 1998; Carl et al., 1999). Die Migrationsfähigkeit der Neuralleistenzellen wird unter anderem durch eine weitere Genklasse gesteuert, den Cadherinen, die für die Zelladhäsion verantwortlich sind (Nakagawa und Takeichi, 1995; Borchers et al., 2001). Deren Regulation ist jedoch noch immer nur unzureichend untersucht und teilweise unverstanden. Der Ablauf der Migrationsbewegungen der Neuralleistenzellen erfolgt nicht gleichmäßig im Embryo. Im Kopfbereich, den so genannten cranialen Neuralleistenzellen, erfolgt die Auswanderung aus der Neuralleiste in drei bzw. vier kompakten Segmenten (Abb. 1), dem mandibularen, dem hyoidalen und dem branchialen Segment, da sich wiederum in zwei Bereiche während den Wanderungsbewegungen der Neuralleistenzellen spaltet, dem anterioren und dem posterioren branchialen Segment (Baltzinger et al., 2005). Die mandibularen Neuralleistenzellen bilden dabei das vorderste Segment (1. Kiefer- bzw. Neuralleistenbogen). Ab Stadium 21 der Embryogenese von Xenopus laevis bewegen sich diese ventral und dorsal um das Auge und wandern dort in den ersten Kieferbogen ein. Das Hyoidalsegment (2. Kieferbogen) löst sich aus dem Bereich des anterioren Teils des Rhombencephalon ab und wandert ventral, in den Pharynx ein. Aus dem branchialen Neuralleistensegment migrieren die Neuralleistenzellen in den 3. und 4. Kieferbogen ein. Im Rumpfbereich des Embryos bewegen sich die Neuralleistenzellen zwar ebenso auf festgelegten Wegen, jedoch sind diese über verschiedene Organismen hinweg teilweise sehr divergent. Im Gegensatz zu den cranialen wandern diese Zellen nicht in kompakten Strömen, sondern nur sporadisch. Einer dieser Routen ist der dorsolaterale Weg, über den z. B. die Vorläuferzellen der Melanozyten sich fortbewegen, während auf dem ventralen Weg jene 4 Zellen wandern, die am Aufbau der sympathischen und parasymphatischen Ganglien sowie der Rückenmarksganglien beteiligt sind. (Beauvais-Jouneau et al., 1999). __________________________________________________________________________________ Abb. 1: (A) Schematische dorsale Ansicht eines Embryos von Xenopus laevis im Stadium 20 und laterale Ansicht des Kopfes im Stadium 23. Die Neuralleistenzellen sind farbig markiert. Rosa: Mandibularneuralleistenzellen; Gelb: Hyoidbogen; Grün: Anteriorer Kiemenbogen; Orange: Posteriorer Kiemenbogen; Grau: Rumpfneuralleisten. Verändert nach modifiziert nach Sadaghiani und Thiebaud, 1987. m: Mandibularsegment; h: Hyoidsegment; a: anteriores Kiemenbogensegment; p: posteriores Kiemenbogensegment. 5 1.2 Das Chondrocranium in der Kaulquappe von Xenopus laevis: Von der Neuralleiste zum Kiefer Die Funktion des Chondrocranium besteht schematisch vereinfacht aus drei Hauptaufgaben: Dem Schutz des Gehirns durch die Schädelkapsel, der Nahrungsaufnahme durch den Kieferapparat und seiner Derivate und der Respiration mittels der Kiemen. Im Kontrast dazu stehen die hoch komplexe morphologische Strukturen des Chondrocraniums der Kaulquappe, die der unterschiedlichen Lebensbedingungen der Amphibienlarve im Vergleich zum adulten Amphibium Rechnung trägt. Die chondrocranialen Elemente der Kaulquappe zeichnen sich durch einen einzigartigen Aufbau des Nahrungsaufnahmeapparates aus, verbunden mit einer stark divergenten Anordnung und Funktion der dazu gehörenden Muskeln im Vergleich zum adulten Amphibium. Der durch die Metamorphose bedingte morphologische Umbau dieser Strukturen, der mit Fusion, Resorption, Auf- und Abbau der Elemente des chondrocranialen Apparates einhergeht, stellt dabei einen hoch komplexen Prozess dar. Erschwert wird die Analyse dieser Strukturen und ontogentischer Prozesse durch die anatomische Divergenz der Kaulquappen verschiedener Anuren und die darüber hinaus uneinheitliche Nomenklatur der beschriebenen Muskel und Knorpelelemente (Haas et al., 2001). Trotz dieser genannten Probleme bedeutet die Untersuchung des Chondrocraniums der Kaulquappe und an dessen Strukturbildung beteiligten Gene eine große Chance. Zum einen sind es die bereits angesprochenen Vorzüge des Xenopus laevis als Modellorganismus. Zum anderen eröffnet das molekulare Verständnis dieser Entwicklungsprozesse in Xenopus laevis die Möglichkeit, mittels vergleichender Anatomie und vergleichender Genetik auch in anderen Vertebraten, beispielsweise der Maus, ein verbessertes Verständnis dieser Prozesse zu erhalten, nicht zuletzt auch im Hinblick auf die chondrocraniale Entwicklung während der humanen Embryogenese. Das Cranium der Vertebraten wird allgemein unterteilt in ein Neurocranium, das das Gehirn und die Sinnesorgane schützt, und das ventral gelegene Viscerocranium. Letzteres wird wiederum in vier Regionen aufgeteilt: die Regio occiopitalis (Hinterhauptsregion); die Regio otica (Ohrregion); die Regio orbitalis (Augengrubenregion) und die Regio nasalis bzw. ethmoidalis. Gebildet wird das Viscerocranium dabei hauptsächlich aus den Branchialbögen, die aus den Neuralleisten entstammen und dabei auch die Kiefer bilden. Die Kieferstrukturen der Anurenkaulquappe sind, wie bereits erwähnt, einzigartig unter den Wirbeltieren hinsichtlich des Besitzes eines suprarostralen Knorpels, der dem Oberkiefer zuzuordnen ist, und einem infrarostralen Knorpels, der dem Unterkiefer zugerechnet werden 6 kann. Beides sind Kieferelemente die der besonderen Lebensweise des juvilen Embryos angepasst sind. Während der Metamorphose der Kaulquappe zum adulten Tier verschwinden diese. Dabei wird der suprarostrale Knorpel vollkommen resorbiert und der infrarostrale Knorpel wird dabei in den Meckel`schen Knorpel integriert (siehe Abb. 2B) (Svensson und Haas, 2005). Gemeinsam ist diesen genannten Elementen, dass sie Neuralleistenderivate sind und aus dem ersten Kiemenbogen (Mandibularbogen) entspringen. Die Teile des Unterkiefers der Kaulquappe sind dabei paarweise angelegt, bestehend aus zwei Meckel`schen Knorpeln, die eine V-förmige Struktur bilden, und den Infrarostralen Knorpeln, die mehr zu Mittellinie gerichtet sind (siehe Abb. 2A). Beide Infrarostrale sind durch Gewebe miteinander verknüpft und darüber hinaus bei Xenopus laevis direkt mit dem Meckel`schen Knorpel verbunden (McDiarmid und Altig, 1999). Ebenfalls aus dem Mandibularbogen entspringt der Palatoquadrate, der direkt an den Meckel`schen Knorpel anschließt. Bei den frühen Gnathostomen (Kiefermünder) bildet der Palatoquadrate mit dem Mandibulare das primäre Kiefergelenk. Bei den meisten Anurenlarven verschwindet der Palatoquadrate mit der Metamorphose zum adulten Organismus. Seine Funktion wird von mehreren anderen verknöcherten Strukturen übernommen, der Maxilla und Premaxilla, dem Quadrate und anderen. Aus dem zweiten Neuralleistenbogen (Hyoid- oder Zungenbeinbogen) und dem anterioren und posterioren Bogen (Kiemenbogen) bildet sich der Hyobranchiale Apparat. Dieser besteht aus den ceratohyalen und basobranchialen Elementen. Die Ceratohyalen sind ebenfalls paarig, aufeinander zulaufend angeordnet und liegen anterior von den Kiemenbögen. Zusammen mit dem Basohyalen (Basobranchialen), einer knorpeligen Struktur, die aus dem Mesoderm entspringt, bilden die Ceratohyalen im Querschnitt eine schmetterlingsförmige Figur. Aus den Neuralleisten entstammende Knorpel und Knochenelemente des Oberkiefers sind die suprarostralen Knorpel, die bei Xenopus laevis mit dem ebenfalls der Neuralleiste entspringendem Trabecularhorn fusioniert sind. Das Trabecularhorn selber erstreckt sich ventral und anterolateral vom Ethmoid (Trabecularplatte). Das Ethmoid dient dabei als Aufhängung für die Kiefer und die Nasenkapsel. 7 _________________________________________________________________________________________ Abb. 2: (A) Schematisierte dorsale Ansicht des Chondrocranium einer Kaulquappe von Rana temporaria. (B) Generalisiertes Schema der Kieferstruktur einer Kaulquappe (laterale Ansicht). Der Pfeil deutet die Verschiebung und Veränderung der Unterkieferelemente während der Metamorphose an. Der infrarostrale Knorpel wird dabei vollkommen vom Meckel´schen Knorpel bzw. Knochen resorbiert (modifiziert nach McDiarmid und Altig, 1999). Die Kieferelemente in (A) sind dunkelgrau hinterlegt. f: foramen; fen: fenestra; K: Knorpel; med: medialis; Ocul: Oculomotor; tec: tecti; T.t. : Taenia tecti 8 Die Kiemenbögen, Derivate des dritten und vierten Neuralleistenbogens, enthalten die Kiemenlamellen der Kaulquappe. Diese sind essentiell für Nahrungsaufnahme und Respiration des Froschembryos. Die molekularen Mechanismen der Craniofacialentwicklung sind bisher nur unzureichend erforscht, obwohl einige Gene und Genklassen in Vertebraten bekannt sind, die offensichtlich essentiell für die ontogenetische Kieferentwicklung sind und interessante Ansätze für die phylogenetische Kieferentwicklung liefern. Besonders erwähnt seien hierbei die Hox- und die Dlx Gene. Die Hox Gene sind dafür bekannt, dass sie die Musterbildung des Embryos steuern (Gruss und Kessel, 1991). Interessanterweise zeigt der Mandibularbogen keinerlei Hox Expression. Für mehrere Modellorganismen wurde gezeigt, dass eine Inaktivierung von HoxA2, welches unter anderem den Hyoidbogen markiert, zu einer Ausbildung von mandibularen Strukturen in diesem Bereich führt (Baltzinger et al., 2005). Man spricht von einer so genannten homöotischen Transformation. Das bedeutet, dass durch eine ektopische HoxA2 Expression im ersten Neuralleistenbogen hyoide Knochenelemente entstehen können. Ein ähnliches homöotisches Potential zeigen die Dlx5 und Dlx6 Gene. Deren simultane Inaktivierung führt zu einer Ausbildung von Oberkieferstrukturen im Bereich des Unterkiefers (Depew et al., 2002; Schilling, 2003). Das Wissen um diese Genfunktionen, der Vergleich von Genfamilien unterschiedlicher Spezies hinsichtlich Zielgene, Genduplikationen und Geninaktivierungen sowie der unterschiedlich temporären und räumlichen Expression, könnte das Verständnis um die evolutionär konservierten embryonalen Entwicklungsprozesse liefern. 9 1.4 Die Forkhead Transkriptionsfaktoren Die Genexpression in Eukaryoten unterliegt einer exakten räumlichen und zeitlichen Kontrolle. Neben dem RNA-Processing und der Translation erfolgt die primäre Regulation der Genexpression bei der Transkription. Hierbei spielen die Transkriptionsfaktoren eine essentielle Rolle. Viele dieser Transkriptionsfaktoren sind Multigenfamilien zugeordnet, die über verschiedene Organismen hinweg ein oder mehrere konservierte Strukturelemente aufweisen. Beispiele hierfür wären die Hox Gene, die Zic-, die Paired-box (Pax) Gene, die POU- oder eben die Forkhead-box (Fox) Transkriptionsfaktoren, um nur einige zu nennen. Gemeinsam ist den Fox Genen, dass sie entscheidend an so vielfältigen Prozessen wie der embryonalen Musterbildung, der Organogenese, aber auch der Homöostase im adulten Organismus beteiligt sind. Sie sind bei Zellproliferationsprozessen ebenso erforderlich, wie bei der Apoptose (dem programmierten Zelltod) (Lee et al., 2005; Martynoga et al., 2005; You et al., 2006; Stewart et al., 2006). Alle Forkhead Transkriptionsfaktoren zeichnen sich durch ein gemeinsames DNABindungsmotiv aus, die Forkhead Domäne, die sich über 110 Aminosäuren erstreckt. Seit der Erstbeschreibung einer Mutation eines Mitgliedes dieser Genfamilie in Drosophila (fkh), bei der Vorder- und Hinterdarm durch ektopische Kopfstrukturen ersetzt sind und damit zur Namensbildung dieser Genfamilie beitrug (Weigel et al., 1989), konnten mehrere hundert Forkhead Gene in verschiedenen eukaryotischen Organismen von der Hefe bis zum Menschen identifiziert werden. Alleine die Anzahl der bekannten humanen Forkhead Gene beläuft sich zurzeit auf 43. Mit Hilfe der Röntgenkristallanalyse (Clark et al., 1993) konnte die Struktur der Forkhead Domäne von HNF-3γ bestimmt werden. Danach setzt sich die DNA-Bindungsdomäne aus drei α-Helices zusammen, wobei eine davon sich in die große Grube der DNA legt, und zwei dazugehörigen Schleifen (wings), die dem Protein eine flügelförmige Gestalt verleihen und dieser Genklasse auch den Namen winged helix Faktoren eingebracht haben (Brennan, 1993). Nach anfänglicher teilweiser willkürlicher Benennung von Forkhead Genen, wie z.B. HNF-3 (hepatocyte. nuclear factor 3), Trident oder whn (winged-helix nude gene) existiert inzwischen eine einheitliche allgemein verbindliche Nomenklatur (Kaestner et al., 2000; http://www.biology.pomona.edu/fox.html). Danach werden die Fox Gene anhand der Diversität ihrer DNA-Bindungsdomäne in Subklassen eingeteilt (A-S). Des Weiteren erfolgt eine Unterscheidung von Homologen in unterschiedlichen Spezies anhand von Groß- und Kleinschreibung, z.B. FOXA1 (Homo sapiens); Foxa1 (Mus musculus); foxa1 (Danio rerio). Während innerhalb dieser Subklassen 10 die Forkhead Domäne eine mehr oder minder starke Konservierung aufweist, zeigen die außerhalb dieser Domäne liegenden Bereiche eine teilweise hohe Divergenz zueinander. In den letzten Jahren konnten nicht nur zahlreiche neue Fox Gene identifiziert werden, sondern teilweise auch deren biologische Funktion aufgeklärt werden. So werden zahlreiche humane Krankheiten vor allem in karzinogenen Prozessen direkt oder indirekt mit Mutationen, Translokationen oder Fehlregulationen von Fox Genen in Verbindung gebracht. Es zeigt sich beispielsweise eine erhöhte Transkription von FOXA1 in Ösophagus- und Lungenadenokarzinomen, ebenso wie FOXM1 bei Bauchspeicheldrüsenkrebs, oder FOXN5 bei Brustkrebs, während FOXN3 in diversen malignen Geweben einen erniedrigten Transkriptionslevel aufweist (Katoh und Katoh, 2004d; Chang et al., 2005). Mutationen im humanen FOXN1 Gen führen zu einer T- Zell- Immunodefizienz und einer Fehlsteuerung bei der Hautbildung. Eine chromosomale Translokation des FOXO1 Gens ist in Tumorzellen bei Rhabdomyosarcomen zu finden (Barr, 1997; Barr, 2001). Ebenso sind Translokationen des FOXO3- bzw. FOXO4 Gens bei der Mixed Lineage Leukemia (MLL) beschrieben (So und Cleary, 2003). Darüber hinaus werden die FOXO Gene, durch deren Interaktion mit den Sirtuinen (einer Klasse von NAD+-abhängigen Histondeacetylasen), als einer der Schlüsselfaktoren im Alterungsprozess angesehen (Greer und Brunet, 2005; Morris, 2005; Lehtinen et al., 2006). Als weitere, im Mittelpunkt der Forschung stehende Forkhead Gene gelten FOXP2, das offensichtlich eine entscheidende Rolle bei der Sprachentwicklung hat (White et al., 2006), und FOXP3, ein essentieller Faktor der T-Zellentwicklung (Ramsdell, 2003; Kim und Rudensky, 2006; Li et al., 2006; Wang et al., 2006). Zahlreiche Homologe konnten mittlerweile in den Modellorganismen Maus, Zebrafisch und Xenopus laevis identifiziert und deren Funktion und Regulation analysiert werden. Die Rolle von Forkhead Genen ist vielfältig, sie spielen bei den verschiedensten zellulären Prozessen, wie z.B. der Aufrechterhaltung der Pluripotenz von Zellen, der Zellproliferation und der Differenzierung eine Rolle (Carlsson und Mahlapuu, 2002). Zahlreiche Aktivierungs- und Repressordomänen sind zwischenzeitlich in zahlreichen Forkhead Proteinen beschrieben, auch von Xenopus laevis (Pohl und Knöchel, 2005). Diese können sowohl trankriptionsaktivierend, als auch inhibierend wirken. Während einige Subklassen, wie z.B. die A, D, O und P Subklassen inzwischen hinsichtlich Funktion, Regulation, Interaktionpartnern und Zielgenen intensiv charakterisiert worden sind, ist die Funktions- und Wirkungsweise der NSubklasse mit Ausnahme der FoxN1 Orthologen in Maus und Zebrafisch nahezu unbekannt. Einige Gene dieser Subklasse, wie FOXN5/R1 und FOXN6/R2 wurden sogar erst kürzlich identifiziert (Katoh and Katoh, 2004a; Katoh and Katoh, 2004b; Katoh and Katoh, 2004c). 11 Beim Menschen und der Maus sind sechs Gene der FoxN Subklasse bekannt. Das bekannteste FoxN Orthologe ist das Foxn1 (whn) der Maus. Whn (winged-helix nude) wurde erstmals in Maus und Ratte im Zusammenhang mit einer Mutation beschrieben, die zu einem verkürzten inaktiven Protein führt und in einem Fehlen des Thymus, wie auch einer gestörten Haarfollikelentwicklung resultiert (Nehls et al., 1994). Inzwischen wurde die Rolle von Foxn1 in Maus bzw. deren Homologe in Mensch und Zebrafisch in der Thymus-, Haut sowie T-Zellentwicklung hinreichend untersucht (Schorpp et al., 2000; Chatterjea-Matthes et al., 2003; Bleul et al., 2006). Für Foxn1 ist sogar gezeigt, dass es über den Wnt Signalweg reguliert wird. Hoxc-13 des Schafs, welches dort die Haarfollikel steuert, ist als putatives Zielgen identifiziert (Sander und Powell, 2004), (Balciunaite et al., 2002) und eine Transaktivierungsdomäne in Foxn1 als essentieller Bestandteil der Foxn1 Proteine in verschiedenen Spezies charakterisiert (Schuddekopf et al., 1996). In Kontrast dazu ist über die Funktion der anderen Mitglieder der FoxN Subklasse so gut wie nichts bekannt. FOXN2/HTLF (Human T-cell Leukemia Enhancer Factor) wurde erstmals 1992 bei der Suche nach Transkriptionsfaktoren, die in der Lage sind an den Longterm Repeat (LTR) des humanen T-Zellen Leukemia Virus zu binden, identifiziert (Li et al., 1992). Das räumliche Expressionsmuster des Mausgens während der Embryogenese ist inzwischen beschrieben (Tribioli et al., 2002), dessen Funktion ist bisher dennoch ungeklärt. FOXN3/CHES1 (checkpoint supressor1) wurde als Zellzyklus Suppressor in einem Screening nach humanen Genen gefunden, die in der Lage sind, einen G2 Zellzyklusdefekt in einer mec1 Nullmutation in Saccharomyces cervisiae Stämmen zu überdecken, ein Hinweis darauf, dass FOXN3 essentiell in der Regulation des Zellzyklus, speziell am G2 Kontrollpunkt, involviert sein könnte (Pati et al., 1997; Scott und Plon, 2003). Ebenso ergaben Realtime PCR Studien eine verminderte Expression von FOXN3 in Tumorzellen des basalen Zellkarzinoms (Chang et al. 2005). Interessanterweise sind die bisher identifizierten Bindungspartner von FOXN3, Sin3 und SKIP (Scott and Plon 2003; Scott and Plon 2006) auch als repressorische Komponenten in Histon Deacetylase Komplexen bekannt. Von Foxn4, dessen räumliches Expressionsmuster erstmals während der Embryogenese der Maus erstmals 2001 beschrieben wurde (Gouge et al., 2001), konnte über eine Knockout Studie gezeigt werden, dass es die Entwicklung von Amakrinen- und Horizontalen Zellen, während der Retinogenese im Mausembryo steuert (Li et al, 2004; Li et al., 2005; Fujitani et al., 2006). 12 Die FOXN5 und FOXN6 Gene im Menschen bzw. deren Orthologe in Maus und Ratte wurden, wie bereits erwähnt, erst kürzlich in silico identifiziert (Katoh und Katoh, 2004a; Katoh und Katoh, 2004b; Katoh und Katoh, 2004c). Über deren Funktion ist bisher nichts bekannt. 13 1.5 Aufgabenstellung Im Rahmen dieser Arbeit sollten die Mitglieder der FoxN Subklasse in Xenopus laevis identifiziert werden. Die dabei über EST- und genomische Sequenzanalysen sowie Screening von genomischen und cDNA-Bibliotheken isolierten Forkhead Gene sollten auf ihre räumliche und zeitliche Expression im Verlauf der Embryonalentwicklung mittels RT-PCR und Whole mount in situ Hybridisierung untersucht werden. Darüber hinaus sollten durch Überexpressions- bzw. über Funktionsverluststudien deren Rolle während der Embryogenese geklärt werden. Mittels Zellmarkierungsexperimenten in vivo, in situ Hybridisierungen, Pulldown und histologischen Analysen, sowie Proliferations- und Apoptose Assays und Promotorstudien sollten die Wirkungsweisen und Regulation der genannten Gene näher charakterisiert und die Identifizierung von potentiellen Zielgenen ermöglicht werden. 14 2 Material und Methoden 2.1 Bezugsquellen und Geräte 2.1.1 Geräte Gerät Binokular Brutschränke (für Xenopus laevis) Dokumentationsanlage für Embryonen und histologische Schnitte Eismaschine Gefrierschrank -20 °C Gefrierschrank -70 °C Gefriertruhe -70 °C Gelelektrophoresekammern Geltrockner Heizblock Heizrührer Injektionsanlage Modell WB22K DP 11 (Digitalkamera) SZH 10 (Binokular) BH-2 (Mikroskop) AF-10 Hersteller Saur mytron Olympus Scotman Liebherr Herafreeze Heraeus Instruments GmbH E80-360 T Colora GmbH (Lorch) GNA 100 und 200 Pharmacia Pherotemp40 Biotec Fischer HBT130 HLC MR3000 Heidoplph Pneumatic Picopump PV (Bachhofer, Reutlingen) 820 Inkubationsschrank (für Xenopus BK-600 Heraeus Instruments GmbH laevis) Kaltlichtquelle EK-1 Euromex Kapillaren Borosilicatglas mit H. Saur Laborbedarf Filament 0,1 mm Konfokales Lasermikroskop Leica TCS 40 Leica Kühlschränke FKS 5000 Type 2000 Liebherr Kühlzentrifuge Biofuge primoR Heraeus Kryostat Frigomix Braun Luminometer LB 9507 Berthold Mikrowelle Micromat AEG N2-Flaschen EG-Nr 231-783-9 MTI Industriegase Netzgerät P25 Biometra PCR-Gerät Gene Amp PCR System Perkin Elmer 2400 und DNA-Cycler 480 pH-Meter CG837 Schott Phospho-Imager Fujix BAS 1000 Fuji Photometer Lambda Bio Perkin Elmer Pipetten 2er; 10er; 20er; 200er; Gilson 1000er Puller (f. Injektionsnadeln) PN-30 Narishige, Japan Schüttler (Rotat.) Rocky Fröbel Labortechnik Sequenziergerät ABI PRISM 377 Perkin-Elmer Corporation Screen (Phosphoimager) Fuji BAS III S Fuji Software (Sequenzer) ABI PRISM Applied Biosystems Inc. Software (Phosphoimager) MacBas 3.0 Fuji Spektralphotometer Lamda Bio Perkin-Elmer Tischzentrifuge Biofuge pico Heraeus UV-Tisch UV-Transilluminator 312 Bachofer nm Schüttler (Bakterien) Certomat B.Braun Szintillationszähler LS 1701 Beckman 15 Vibratom Vortexer Waage Feinwaage Wasserbäder Zentrifuge, Ausschwingrotor Serie 1000 Vortex Genie 2 PE360 Explorer Universal 16 A Technical Products Internat. Scientific Mettler Ohaus Köttermann Labortechnik Hettich 2.1.2 Sonstige Gebrauchsartikel Produkt Alufolie Einwegspritzen Falcongefäße Whatmanpapier Glasmaterialien: Flaschen, Pasteurpipetten, Erlenmeyerkolben usw. Haushaltsfolie Kanülen Kunststoff-Einwegmaterial: Spitzen, Pipetten, Reaktionsgefäße, Petrischalen usw. Nylon Membran Quarz-Küvette 6-und 24-well Platten Parafilm PCR-Gefäße Dumont Pinzetten Hersteller Gut & Billig HeukeSassWolf GmbH Corning Schleicher & Schuell Brand, Schott Gut & Billig Braun Eppendorf, Brand, Greiner, Sarstedt Hybond Hellma Greiner Pechiney Biozym Merck 2.2 Verwendete Software zur Protein und Nukleinsäureanalyse Genomische Analysen und Vergleiche, Proteinsuche und BLAST- und EST Analysen erfolgten über NCBI (http://www.ncbi.nlm.nih.gov/blast/), ENSMBL (http://www. ensembl.org/index.html) und Xenbase (http://www.xenbase.org/). Die Bestimmung des offenen Leserrahmens, Bestimmung der Proteinsequenz und Gewichtes, sowie DNA- und Protein Alignments erfolgten mittels MacMolly Tetra (Mac Molly ® Tetra Version 3.9 © Soft-Gene-GmbH). Phylogenetische Stammbäume wurden mit CLUSTALW (http://www.ebi.ac.uk/clustalw/) erstellt. 16 2.3 Chemikalien und Radiochemikalien Alle Chemikalien wurden, soweit nicht anders erwähnt, von den folgenden Firmen in p.A. Qualität bezogen: Aldrich, Steinheim Amersham Life Science, Braunschweig Bio-Rad, München Böhringer Mannheim, Mannheim Fluka, Buchs, Schweiz Gibco BRL, Eggenstein Invitrogen, Karlsruhe Merck, Darmstadt NEM, Bad Homburg Pharmacia, Freiburg Promega, Heidelberg Roche, Basel, Schweiz Roth, Karlsruhe Schering, Berlin Serva, Heidelberg Sigma, München 32P-markiertes dCTP und 35S-Methionin wurden von Amersham (Braunschweig) bezogen. 2.4 Antikörper, Enzyme und Hormone 2.4.1 Antikörper Primäre Antikörper Anti-Digoxigenin-AP, FAB-Fragment; Roche Anti-Flourescein-AP, FAB-Fragment; Roche Monoklonaler Antikörper 3A10 (Developmental Studies Hybridoma Bank, University of Iowa, USA) Sekundäre Antikörper Anti-Rabbit Cy3; Jackson Immuno Research (USA) 2.4.2 Enzyme Alle Enzyme werden von den folgenden Firmen bezogen: DNaseI RNase-frei (Boehringer, Mannheim) Klenow Fragment (Boehringer, Mannheim) Phusion Polymerase (Finnzymes, Finnland; Espoo) Proteinase K (Merck, Darmstadt) Restriktionsendonukleasen (Life Technologies, Karlsruhe; Fermentas, Vilnius, Litauen Gibco BRL, Eggenstein; New England Biolabs) RNasen (Boehringer, Mannheim; Qiagen, Hilden) SP6, T3, T7 RNA-Polymerasen (Boehringer, Mannheim) Taq-Polymerase (Abgene) T4 DNA Ligase (Life Technologies, Karlsruhe) 17 2.4.3 Hormone Humanes Choriongonatropin (Sigma, München) 2.5 Kits 5-Bromo-2´-deoxy-uridine Labeling and Detection Kit II; Roche DIG RNA Labeling Mix 10x; Roche, Basel, Schweiz DYEnamic ET Terminator Cycle Sequencing Kit, Amersham, Braunschweig Endofree Plasmid Kit; Qiagen, Hilden GeneRacer Kit; Invitrogen, Karlsruhe mMessage machine Kit (SP6; T3; T7); Ambion, Austin, USA PCR Purification Kit; Qiagen, Hilden Plasmid Midi Kit; Qiagen, Hilden Plasmid Mini Kit; Qiagen, Hilden Purescript RNA Isolation Kit; Gentra Systems Qiaquick Gel Extraction Kit; Qiagen, Hilden Qiaquick Spin PCR Purification Kit; Qiagen, Hilden Random-Prime-Labelling Kit; Gibco, Eggenstein Revert AidTM First Strand cDNA Synthesis Kit; Fermentas, Vilnius (Litauen) RNeasy-RNA Purifikation Kit; Qiagen, Hilden T7 TNT Quick Coupled Transcription/Translation Systems; Promega Superscript II RT; Invitrogen, Karlsruhe Thermisequenase Kit; Amersham, Braunschweig Trizol Reagent, Gibco, Eggenstein 2.6 Nukleinsäuren 2.6.1 Vektoren p-Drive Cloning Vector , Qiagen, Hilden pGL3-Basic, Promega, Heidelberg pCS2, Rupp et al., 1994 Die Vektorkarten befinden sich im Anhang. 18 2.6.2 cDNA-Klone Soweit nicht anders aufgeführt entstammen die cDNA Klone der Plasmid-Bibliotheken der AG Prof. Knöchel (Abteilung Biochemie, Universität Ulm) und der AG Prof. Kühl (Abteilung Biochemie und Molekulare Biologie) Gen HoxA2 (Xenopus laevis) Herkunft M. Ori, Laboratori di Biologia Cellulare e dello Sviluppo, Dipartimento di Fisiologia e Biochimica, Universita di Pisa (Italien) HoxA3 (Xenopus laevis) HoxB4 (Xenopus laevis) RPD3 (Xenopus laevis) H. Jansen, IBL Leiden (Niederlande) H. Jansen, IBL Leiden (Niederlande) P.L. Jones, Department of Cell and Developmental Biology, University of Illinois at Urbana-Champaign, Urbana, (USA). Xbap (Xenopus laevis) M. Jamrich, Department of Molecular and Cellular Biology, Baylor College of Medicine, Houston, Texas (USA) 2.6.3 Oligonukleotide und Morpholino-Oligonukleotide Oligonukleotide wurden von Thermo Scientific (Ulm) bezogen RT-Primer Gen FoxN2/f FoxN2/rev FoxN3/f FoxN3/rev FoxN4/f FoxN4/rev FoxN5/f FoxN5/rev ODC/f ODC/rev Sequenz 5´-TCTCTGACATCTTCTTGCCCGTT-3´ 5´-GTGCAGCCAGTTCAAGTTGGTCA-3´ 5´-GGCAAAGGTTCTCTGTGGTGC-3´ 5´-CTGAGGCAGCCATTGCTCCAATA-3´ 5´-AGGGCACTGTGTTCTCTCCTTTG-3´ 5´-CCAGGAGAGTGTACATTATTTGA-3´ 5´-TCTCCTACAGCACTTGAAGACTG-3´ 5´-CATTGGCAGCATCTTCTTCA-3´ 5´-GGGCAAAGGAGCTTAATGTG-3´ 5´-CATTGGCAGCATCTTCTTCA-3´ 19 Klonierungsprimer Gen FoxN2/f FoxN2/rev FoxN3/f FoxN3/rev FoxN4/forw FoxN4/rev FoxN4/gen/f FoxN4/gen/r Sequenz 5´-cgggatcccgATGGGGTCCAGCAACTGGAATGAC-3´ 5´-ccgctcgagcggTTGTGAGATTGTGCCTTTGCAGT-3´ 5´-ccgctcgagcggATGGGTCCAGTCATGCCTCCTAG-3´ 5´-gcctatgtaCATTAGAATTCACCTGACGTGCTG-3´ 5´-ccgctcgagcggAATGATAGACAGTGACATCTCTGC-3´ 5´-gcctatgtaATACATAGAGAAGTCATCACAGT-3´ 5´-ggcgctagcCTGTGCGATAGAGTTCGCTGCT-3´ 5´-ttgctcgaGGATTTCTCTGTCCCCAAACCGTT-3´ RACE- bzw. Sequenzier- und Amplifikationprimer für die λ-ZAP Banken Gen FoxN2/r1 FoxN2/r2 FoxN3/r1 FoxN3/r2 FoxN4/r1 FoxN4/r2 FoxN5/r1 FoxN5/r2 T3 T7 Sequenz 5´-CTGCCCATGTTCTCTGTTTGACTT-3´ 5´-TCCAGTTGCTGGACCCATATAAT-3´ 5´-GATTATGCCTGACAGAGTTCTTCCAG-3´ 5´-GCAAGTTCTTGTTCTCATGCAACCA-3´ 5´-CTGGGAAGTGTGGCTGTAGTCCAT-3´ 5´-GTAGGTCTCTGGTATGATTAGTG-3´ 5´-GACAGTTCTGTACTATGCTGACG-3´ 5´-AGTACTGATCCGCTGTGATGGAT-3´ 5´-AATTAACCCTCACTAAAGGG-3´ 5´-TAATACGACTCACTATAGGG-3´ Sonstige Primer: SP6-Primer 5´- GATTTAGGTGACACT -3´ Morpholino-antisense-Oligonukleotide Morpholinos wurden lyophilisiert von der Firma Gene Tools, LLC, Philomath, USA bezogen. Die Aufnahme erfolgt in autoklaviertem H2O zu einer Konzentration von 10 ng/nl. Direkt nach der Aufnahme in H2O werden die Morpholinos aliquotiert und bei -70°C gelagert. Vor der Mikroinjektion werden Morpholinos mit H2O auf eine gewünschte Konzentration verdünnt. Gen Sequenz FoxN2 5´-AGTTCCTGGACCCATATAATTCTAA-3´ FoxN3 5´-TACTAGGAGGCATGACTGGACCCAT-3´ FoxN4 5´-TAGCAGAGATGTCACTGTCTATCAT-3´ FoxN5 5´-TCCTATTTGCAAACCGCAAATACAT-3´ humanes ß-Globin (Co-MO) 5´-CCTCTTACCTCAGTTACAATTTATA-3´ 20 2.7 Organismen 2.7.1 Bakterienstämme Stamm Genotyp Escherichia coli One Shot TOP10 (Invitrogen) F-mcrA ∆(mrr-hsdRMS-mcrBC) PHI80lacZ ∆M15 ∆ lacX74 deoR recA1 araD139 ∆(ara-leu)7697 galU galK rpsL (StrR) endA1 nupG Escherichia coli Xl 1 blue recA1, endA1, gyrA96, thi-1, hsdR17/rk-mk-, supE44, relA1, F´(proA, lacIqZ M15, Tn10 tetr) Escherichia coli XL 1 blue MRF´ eI4-(mcrA)183 (mcrCB-hsdSMR-mrr)173 endA1 supE44 lac F´proAB lacIqZ M15 Tn10(Tetr) thi-1 recA1 gyrA96 relA1 Escherichia coli LE392 eI4-(mcrA), galK2, galT22, metB1, trpR55, hsdR514, ∆(lacIZY)6, supE44, supF58 Escherichia coli JM110 RpsL (Strr ) thr leu thi-1 lacY galK galT ara tonA tsx dam dcm supE44 ∆(lac-proAB) [F´traD36 proAB lacqZ∆M15] hsdS, gal (∆cIts857 ind1, Sam7, nin5, lacUV5-T7 gene1 Escherichia coli BL21 (DE3) 2.7.2 Phagen Lambda ZAP® II, Stratagene, La Jolla, USA R408, ExAssist Helfer Phage, Stratagene, La Jolla, USA Lambda Fix® II, Stratagene, La Jolla, USA 2.7.3 Versuchstiere Die verwendeten Frösche der Gattung Xenopus laevis werden bei der Firmen Nasco, Wisconsin, USA und Xenopus express, Vernassal, Frankreich bezogen. Haltung der Tiere erfolgt durch das Tierforschungszentrum Oberberghof, Universität Ulm. 2.8 Methoden 2.8.1 Arbeiten mit Nukleinsäuren 21 2.8.1.1 Arbeiten mit DNA 2.8.1.1.1 Isolierung von Plasmid-DNA aus Bakterien mittels Telt-Methode Die Telt-Methode stellt eine effiziente und schnelle Methode zur Gewinnung kleinerer Mengen DNA dar, die für Testrestriktionen, Umklonierungen und auch für Sequenzierungen oder ähnliches ausreichende Mengen zur Verfügung stehen. Teltlösung: 62,5 mM EDTA 50 mM Tris-HCl pH 7,5 0,4 % (v/v) Triton X-100 1 mM EDTA Dazu werden die Bakterien, die mit der zu untersuchenden DNA transformiert werden, in 3 ml Medium über Nacht angezogen. 1,5 ml der Kultur werden in einem Eppendorfgefäß abzentrifugiert, der Überstand verworfen und die Bakterien in 150 µl Telt und 15 µl Lysozym-Lösung (10 mg/ml in H2O) durch vortexen resuspendiert. Nach kurzer Inkubation bei Raumtemperatur werden die Proben 2 min auf 95°C im Wasserbad erhitzt und 30 min auf Eis gestellt. Anschließend werden die Zelltrümmer abzentrifugiert (12000 g, 15 min) und können mit einem sterilen Zahnstocher oder Pipettenspitze entfernt werden. Durch Zugabe von 150 µl Isopropanol und Zentrifugation (12000 g, 10 min) wird die DNA aus der Lösung ausgefällt. Mit 70% Ethanol werden die Salze ausgewaschen. Die präzipitierte DNA wird getrocknet und abschließend in 30-40 µl Wasser oder TE-Puffer (10 mM Tris-HCl pH 8,0/1 mM EDTA) gelöst werden. Bei Bedarf kann die mit aufgereinigte RNA durch Zugabe von 2 µl RNase-Stammlösung (200 µg/ml in H2O) beseitigt werden. 2.8.1.1.2 Plasmidisolation aus Bakterien mit Qiagen Plasmid Midi/Mini Kit Das Verfahren beruht auf dem Prinzip der alkalischen Lyse (Birnboim und Doly, 1979). Bei der alkalischen Lyse werden die Bakterien durch Inkubation in einem alkalischen Lysepuffer, welcher zumeist NaOH und SDS enthält, aufgeschlossen. Der niedrige pH-Wert und das Detergenz SDS bewirken eine Denaturierung der chromosomalen DNA und der PlasmidDNA und der bakteriellen Proteine. Durch Zugabe von saurem Kaliumacetatpuffer wird die 22 Lösung neutralisiert, was zu einer Renaturierung der kovalent geschlossenen Plasmid-DNA führt, während die hochmolekulare, chromosomale DNA und die Proteine in einem Komplex mit Kalium und SDS ausgefällt und herausgefiltert werden. Die DNA-Suspension wird über eine Affinitätssäule weiter aufgereinigt und eluiert. Das Eluat mit der gelösten Plasmid-DNA lässt sich durch Zugabe und Durchmischen mit Isopropanol über anschließende Zentrifugation präzipitieren. Die Plasmid-DNA kann durch Ethanolfällung weiter aufgereinigt werden. Das Präzipitat kann in H2O oder TE-Puffer resuspendiert werden. Das Herstellerprotokoll (www.qiagen.de) wird exakt befolgt. Die Menge an Bakteriensuspension bzw. an gewünschter DNA entscheidet ob eine „Midioder Minipräparation“ durchgeführt wird. 2.8.1.1.3 Aufreinigung von DNA aus wässrigen Lösungen mittels des Qiagen PCR Purification Kit Die Aufreinigung bei diesem Kit erfolgt über eine QIAGEN DNA-Affinitätssäule. Nach den Waschschritten wird die DNA in 30 µl Tris/HCl-Puffer pH 8,5 eluiert. Das Vorgehen folgt dem Protokoll des Herstellers (www.qiagen.de). 2.8.1.1.4 Isolierung von genomischer DNA aus Phagen Die Aufreinigung der Lambda-Fix DNA erfolgt mittels des Lambda Midi Kit (Qiagen). Das Herstellerprotokoll (www.qiagen.de) wird exakt befolgt. 2.8.1.1.5 Manuelle Aufreinigung von DNA 2.8.1.5.1 Aufreinigung von DNA mittels Phenol/Chloroform-Extraktion Bei der Phenol/Chloroform-Extraktion (Kirby, 1956) wird zu einem Volumen einer wässrigen DNA-Lösung ein Volumen einer Mischung aus Phenol, Choloroform und Isoamylalkohol gegeben (Mengenverhältnis 25:24:1). Nach intensivem Mischen auf dem Vortexer wird die Emulsion zur Phasentrennung bei Raumtemperatur in einer Tischzentrifuge mit 13000 rpm für ca. 3 Minuten zentrifugiert. Nach Mischen und Zentrifugieren befinden sich durch Phenol und Chloroform denaturierte Proteine, Membranbestandteile und organisch lösliche Moleküle 23 in der unteren Phenol/Chloroform-Phase und in der Interphase. Isoamylalkohol verhindert ein starkes Schäumen der Interphase. Die DNA befindet sich in der oberen wässrigen Phase. Nach dem Zentrifugieren wird die obere, wässrige Phase vorsichtig abgenommen und in ein neues Röhrchen überführt. Um Phenolspuren zu beseitigen, schließt sich nach obigem Schema eine weitere Extraktion mit Chloroform/Isoamylalkohol (24:1) an. Je nach dem anstehenden Problem kann die DNA-Lösung mehrmals extrahiert werden. Nach der Chloroform/Isoamylalkoholextraktion wird die obere, wässrige Phase in ein neues Röhrchen gefüllt. Um Phenol- und Chloroformspuren zu entfernen, wird die DNA in der Regel nach der Extraktion mit Ethanol gefällt. 2.8.1.1.5.2 Ethanolfällung von DNA aus wässrigen Lösungen Die Ethanolfällung von DNA erfolgt in Gegenwart eines Alkohols und hohen Salzkonzentrationen. Sie beruht auf dem physikalischen Effekt des Lösungsmittelentzuges der DNA durch Ethanol (Geiduschek und Gray, 1956). Zugleich bewirkt die Zugabe von Kationen eine Ladungsneutralisierung der negativen Ladungen des DNA-Moleküls, so dass die DNA-Moleküle ihre Hydrathülle verlieren und eine kompakte Packung bilden (Eickbush und Mondriakis, 1978), und die DNA dadurch ausfällt (Aussalzeffekt). Zunächst wird das Volumen der DNA-Lösung bestimmt, sofern es nicht bekannt ist. Dann wird ein Zehntel des Volumens der DNA-Lösung an 3M Natriumacetat, pH 5,2, oder Ammoniumacetat zugegeben (Bei Lösungen, in denen der Salzgehalt hoch ist, kann die Zugabe von Natriumacetat auch unterbleiben). Danach werden 3 Volumina des jetzigen Volumens absoluten (oder 96%igen) Ethanols zugegeben und gemischt. Wenn die Konzentration der DNA hoch ist, kann auch mit weniger Ethanol (2 bis 2,5faches Volumen) eine effiziente Fällung erreicht werden. Zur Fällung wird für ca. 30 Minuten bei 4°C oder 20 Minuten bei -20°C inkubiert. Das Gemisch wird dann zum Sedimentieren der DNA für 15 bis 30 Minuten bei 4°C in einer Tischzentrifuge bei maximaler Geschwindigkeit zentrifugiert. Nach der Zentrifugation wird der Überstand abgenommen. Um die DNA zu waschen, z.B. um Salz- oder Phenolreste zu entfernen, wird in ein Eppendorfgefäß mit gefällter DNA 1 ml 70% Ethanols gegeben und kräftig gemischt. Es folgt ein weiterer Zentrifugationschritt für 3 bis 5 Minuten. Der Überstand wird vorsichtig entfernt. Nachdem das Pellet getrocknet ist, kann die DNA in Puffer oder H2O aufgenommen werden. 24 2.8.1.1.5.3 Isopropanolfällung von DNA aus wässrigen Lösungen Die Isopropanolfällung beruht auf dem gleichen Prinzip wie die Ethanolfällung. Die Isopropanolfällung hat den Vorteil, dass zur Fällung nur 0,7 Volumina der DNA-Lösung Isopropanol zugegeben werden müssen und dass weniger Salz mit ausfällt. Nachteile der Isopropanolfällung sind die geringere Flüchtigkeit des Isopropanols und das weniger feste und durchsichtige Pellet nach der Zentrifugation. Meist erfolgt deshalb nach einer Isopropanolfällung ein Waschschritt mit 70% Ethanol (siehe oben). 2.8.1.1.5.4 Reinigung über Agarosegelelektrophorese Bei der Agarosegelelektrophorese (Thorne et al., 1966; Helling et al., 1974; McDonell et al., 1976; Johnson und Grossmann, 1977; Southern et al., 1979) werden DNA-Fragmente ihrer Größe nach aufgetrennt. DNA wandert aufgrund der negativen Ladungen der Phosphatgruppen in einem elektrischen Feld zur Anode. Zur Trennung von DNA-Fragmenten d.h. liearisierter DNA unterschiedlicher Größe werden diese in einem Agarosegel durch Anlegen einer elektrischen Spannung voneinander getrennt. Die Auftrennung der DNA-Fragmente erfolgt durch die Agarosematrix. In Abhängigkeit von der erwarteten Größe der Fragmente kann die Agarosekonzentration zwischen 0,8 und 3% variieren. Zur Auftrennung von kleinen DNA Fragmenten wird eine größere Agarosekonzentration eingesetzt, was eine dichtere Gelmatrix zur Folge hat. Bei großen DNA Fragmenten wird umgekehrt verfahren. Die Agarose wird in 1x TAE-Puffer (50x TAE: 2 M Tris, pH 8,0; 1 M Eisessig; 50 mM EDTA) durch Aufkochen gelöst, nach Abkühlen auf ca. 60°C mit 10 µl Ethidiumbromid (10 mg/ml) versetzt und in die Gelapparatur gegossen. Nach vollständigem Erkalten wird das Gel mit 1x TAE überschichtet und die zu untersuchenden Proben können aufgetragen werden. Diese werden zur Erhöhung der Dichte und zur besseren Lokalisation mit 2-5 µl Ladungspuffer (Bromphenolblau/Xylenxyanol, 40% Saccharose in H2O) versetzt. Die Trennung erfolgt durch Anlegen einer konstanten Stromstärke zwischen 20 und 200 mA. Durch die Interkalation des Ethidiumbromids in die DNA während des Laufes durch das Agarosegel kann im Anschluss die DNA unter UV-Licht bei 302 nm sichtbar gemacht (UVTisch) und die gewünschten Fragmente ausgeschnitten werden. Für die Reinigung der DNA aus dem Agarose-Block wird der Qiaquick Gel Extraction Kit von Qiagen verwendet. Das Vorgehen folgt dem Protokoll des Herstellers (www.qiagen.de). 25 2.8.1.1.6 Konzentrationsbestimmungen von wässrigen Nukleinsäurelösungen Die Bestimmung der Konzentration und Reinheit von wässrigen DNA und RNA-Lösungen erfolgte durch Messungen der Absorbtionswerte der jeweiligen Lösungen bei zwei verschiedenen Wellenlängen (260 und 280 nm) in einem Photometer. Das Absorbtionsmaximum von Nukleinsäuren liegt bei 260 nm und von Proteinen bei 280 nm. Die Konzentrationsberechnung erfolgt nach Lambert-Beer. Der Quotient A260/A280 wird dabei zur Bestimmung der Reinheit der Nukleinsäurelösung herangezogen. Dieser Wert entspricht bei reinen DNA bzw. RNA-Lösungen etwa 1,8 bis 2,0. 2.8.1.1.7 Enzymatische Modifikation von DNA 2.8.1.1.7.1 Restriktionsspaltung Restriktionsendonukleasen vom Typ II spalten Phosphodiester-Bindungen doppelsträngiger DNA an spezifischen Basensequenzen (Smith und Wilcox, 1970). Es gibt eine große Anzahl verschiedener Restriktionsendonukleasen, die jeweils bestimmte Erkennungssequenzen haben (Roberts, 1985). Je nach Enzym entstehen glatte DNA-Enden ("blunt ends") oder 5´- bzw. 3´überhängende Enden ("sticky ends"). Die zur Restriktionsspaltung eingesetzte DNA sollte frei von Kontaminationen wie hohen Salzkonzentrationen, Komplexbildner wie z.B. EDTA oder organischen Lösungsmitteln sein, um die Enzyme nicht zu inaktivieren oder ihre Aktivität herabzusetzen. Die Reaktionen finden in einem Puffer mit definierter Ionenkonzentration und definiertem pH-Wert und Temperatur statt. Restriktionsanalysen werden in 20-50 µl-Ansätzen in Eppendorf Gefäßen durchgeführt. Für die Hydrolyse von 1 µg DNA werden 5-10 U Enzym eingesetzt, wobei darauf zu achten ist, dass die Enzymmenge 10 Vol% des Gesamtansatzes nicht überschreitet, da das im Lagerungspuffer enthaltene Glycerin die Aktivität des Enzyms stört. Außerdem kann durch übermäßige Enzymzugabe eine so genannte „Staraktivität“ erfolgen, d.h. eine unspezifische Spaltung der DNA durch das Restriktionsenzym. Die optimalen Bedingungen werden mit dem vom Hersteller mitgelieferten Restriktionspuffer eingestellt, die Hydrolysebedingungen erfolgen, in Abhängigkeit von dem gewählten Enzym. Für Testrestriktionen, mit denen nur bestimmt werden soll, ob z.B. ein DNA Fragment erfolgreich in den dafür bestimmten Vektor integriert wurde, ist eine Inkubationszeit von 1,52 h durchaus ausreichend. Wird dagegen für den Einsatz in eine Klonierung eine vollständige 26 Restriktion benötigt, kann die Hydrolyse auch über Nacht inkubiert werden, um eine möglichst vollständige Aufspaltung der DNA zu gewährleisten. Die Analyse der Restriktionsprodukte erfolgt mittels Agarosegelelektrophorese (siehe 2.8.1.1.5.4). 2.8.1.1.7.2 Ligation Zur Vermehrung und weiteren Untersuchung rekombinanter DNA-Fragmente werden diese in Plasmidvektoren kloniert (Dugaiczyk et al., 1975). Voraussetzung für die Ligation sind kompatible Enden der zu ligierenden Fragmente, die durch Restriktion (s. 2.8.1.1.7.2) erzeugt und mit den nachfolgend aufgeführten Methoden optimiert werden können. Eine Ausnahme stellt hierbei die Klonierung von PCR-Fragmenten da. Die T4-DNA-Ligase benötigt für die Verknüpfung der offenen Enden ATP, das im Puffer supplementiert werden muss. Die Bedingungen für eine optimale Ligation sind vom Hersteller vorgegeben. Das Reaktionsvolumen sollte möglichst gering gehalten werden, die Temperatur sollte zwischen 14°C und 20°C liegen. Die Reaktionsdauer von 2 h bis 24 h richtet sich nach der Art der Ligation, je nachdem „glatte“ oder überhängende“ Enden (siehe 2.2.1.17.1) ligiert werden. Es wird zwischen 20 und 100 ng linearisierter Vektor-DNA mit dem 3-10fachen molaren Überschuss an Insert-DNA gemischt und der Ansatz mit dem entsprechenden Volumen Ligase-Puffer des entsprechenden Herstellers versetzt. Durch Zugabe von 1 U Ligase kann die Ligation erfolgen. Bei der Klonierung von PCR-Fragmenten, die mit einer Taq-DNA-Polymerase synthetisiert werden, findet der PCR Cloning Kit der Firma Qiagen Verwendung. Grundlage hierfür ist die von Taq-DNA-Polymerasen an den 3´-Enden angefügte Nukleotide der neu synthetisierten DNA-Stränge. Meist handelt es sich hierbei meist um Adenosinbasen. Der p-Drive Vektor von Qiagen liegt in linearisierter Form vor. Er besitzt an den 3´-Enden überhängende Thymidinbasen. Diese können mit den überhängenden Adenosinbasen eines PCR-Fragmentes hybridisieren und so die Ligationseffizienz merklich steigern. Zusätzlich dazu können Kolonien die diesen Vektor besitzen Blau-Weiß selektiert werden (siehe 2.8.2.1.3). Das Vorgehen folgt dem Protokoll des Herstellers (www.qiagen.de). 27 2.8.1.1.7.3 Radioaktive Markierung von DNA Diese Methode beruht auf dem Einbau eines radioaktiv markierten Nukleotids (32P-dCTP oder 32 P-dATP) in einen neu zu synthetisierenden DNA-Strang. Dazu wird zunächst 25 ng DNA in 5-20 µl Wasser gelöst und durch Kochen (10min) denaturiert. Durch sofortiges Kühlen auf Eis wird eine Renaturierung der DNA-Stränge verhindert. Anschließend wird eine Mischung aus Hexamer-Primern, sowie den unmarkierten und dem radioaktiv markierten Nukleotid zugegeben, entsprechende Pufferbedingungen eingestellt und das KlenowFragment der DNA-Polymerase I zugegeben. Alle zugehörigen Lösungen sind in dem Nonaprimer-Labelling-Kit der Firma Appligene enthalten und werden nach Angaben des Herstellers verwendet. Die Abtrennung der freien Nukleotide erfolgt über den Nonaprimer Purification Kit der Firma Appligene, auch hier wird entsprechend der Herstellerangaben verfahren. Die aufgereinigte, radioaktiv markierte DNA kann als Sonde bei vielen radiochemischen Methoden verwendet werden, beispielsweise beim Screening einer Phagenbank (siehe 2.8.2.2.1) 28 2.8.1.1.8 PCR (Polymerase chain reaction) Für die gezielte Amplifizierung von DNA-Fragmenten wird die PCR (Saiki et al.,1985; Saiki et al., 1986; Mullis et al., 1986) verwendet. Das Prinzip beruht auf der Verwendung einer hitzestabilen DNA-Polymerase, die in einer zyklischen Reaktion von Aufschmelzen der DNA, Anlagerung des Oligonukleotid-Primers und Amplifizierung das gewünschte Fragment vielfach vermehrt. Darüber hinaus ermöglicht die PCR-Reaktion über Auswahl der Primer gezielt Mutationen oder Restriktionsstellen einzufügen. Die PCR-Bedingungen müssen für jedes zu amplifizierende DNA-Fragment neu bestimmt werden. Alle PCR-Anwendungen erfolgten nach Anleitung (Phusion DNA Polymerase, Finnzymes; Thermoprime Plus DNA Polymerase, Abgene), sowie nach Anlehnung an die Protokolle des Buches „PCR1“, „PCR2“ aus der Practical Approach Serie (Mc Pherson et al. 1991, 1995) und der Kapitel Nukleinsäureanalytik aus Bioanalytik, F. Lottspeich/H. Zorbas, Heidelberg, Berlin, Spektrum, Akad. Verlag 1998. Ein beispielhafter PCR-Ansatz ist im Folgenden aufgeführt: 5 ng Template-DNA 1/10 Volumen 10x Reaktionspuffer 5 mM dNTP-Mix 25 pmol Primer 1 25 pmol Primer 2 3 mM MgCl 5 U Taq-Polymerase auf 50 µl auffüllen mit H2O Die Polymerase ist Magnesium-abhängig. Je nach Anbieter ist MgCl bereits im Reaktionspuffer vorhanden oder muss separat zugegeben werden. Eine Taq-Polymerase kann in der Regel pro Minute ca. 1000 Nukleotide einbauen. Die Elongationszeiten sind danach zu richten. Die PCR Bedingungen richten sich nach der Größe des amplifizierten Fragmentes, der eingesetzten DNA Polymerase, den Primern und der vorhandenen Menge der zu amplifierenden Matrix (Template). 29 Im Folgenden sei eine Standard PCR dargestellt: Denaturierung: 94°C 1 min Annealen der Primer 53°C 0,5 min Elongation 72°C 0,5 min (richtet sich nach der Länge des Amplifikats) Nach 25 bis 40 Zyklen wird der Ansatz für 10 min bei 72°C inkubiert, um der DNA Polymerase Zeit für die Synthese der noch unvollständigen DNA-Fragente zu geben. Primer Design Das Design von Primern ist für eine optimale PCR-Reaktion entscheidend und hängt von vielen Faktoren ab. Bei der Primerwahl sind folgende Grundregeln zu beachten: - eine Länge von mindestens 17 Oligonukleotiden - ausgeglichener G/C zu A/T-Gehalt - ein Schmelzpunkt zwischen 55° und 80° C - möglichst gleicher Schmelzpunkt für beide Primer - keine Haarnadelstruktur (Vermeidung der Ausbildung von Sekundärstrukturen) - keine Dimerbildung, weder mit sich selbst noch mit den zweiten Primern - möglichst keine G/C-Nukleotide am 3‘-Ende (erhöhte „mispriming“ Gefahr) - Vermeidung „ungewöhnlicher“ Basenabfolgen wie Poly-A oder lange G/C-Abschnitte. - Die Berechnung der Schmelztemperatur (Tm) erfolgte nach der Formel Tm = 4 x (G + C) + 2 x (A+T) Die Primer-Anlagerungstemperatur wurde durch Abzug von 0–10°C von der Schmelztemperatur bestimmt und durch einen PCR-Temperaturgradienten optimiert. 30 2.8.1.1.9 Kolonie-PCR Bei der Kolonie-PCR wird eine Kolonie mit einer Pipettenspitze angestochen und diese Spitze kurz in einem Standard-PCR Reaktionsansatz mit Primern aber ohne DNA-Matrize inkubiert. Diese Methode erlaubt ein schnelles Durchmustern vieler Bakterienkolonien auf das gewünschte Insert hin. Positive Kolonien werden, zu DNA-Gewinnung in einem Antibiotikahaltigen Selektionsmedium ü.N. kultiviert. 2.8.1.1.10 RT-PCR Die Reverse Transkriptase-Polymerase-Kettenreaktion (RT-PCR) ist eine empfindliche Methode zum Nachweis spezifischer m-RNA’s als auch zur Synthese gewünschter cDNA`s für weitere Analysen. Sie beruht auf der Fähigkeit RNA-abhängiger DNA-Polymerasen mRNA’s als Matrize zu nutzen und komplementär dazu einen DNA-Strang zu synthetisieren (cDNA-Erststrang-Synthese) der wiederum für DNA-abhängige Polymerasen als Matrize genutzt werden kann. Die Umschreibung von RNA zu cDNA erfolgt durch die Reverse Transkriptase des murinen Moloney Leukämie-Virus, die gentechnisch so verändert wurde, dass sie keine RNase Aktivität mehr aufweist. Für die Transkription werden 1-5 µg gereinigter RNA eingesetzt. Je nach gewünschtem Produkt können genspezifische, Zufallsprimer oder Oligo dT-Primer eingesetzt werden. Verwendet wird hierbei der Revert AidTM First Strand cDNA Synthesis Kit (Fermentas). Die RT-Reaktion erfolgt nach Herstelleranweisung. 31 2.8.1.1.11 Semiquantitative RT-PCR Um eine maximale Vergleichbarkeit zu erreichen, wird bei Versuchen, bei denen die Expression eines Gens in mehreren verschiedenen Embryonalstadien oder Geweben bzw. Organen verglichen wird, grundsätzlich mit einem Mastermix gearbeitet, der alle Komponenten bis auf die Matrize enthält. Nach Aufspaltung des Mastermix in die zu untersuchende Anzahl von Geweben bzw. zu untersuchenden Embryonalstadien wird jeweils die entsprechende cDNA zugegeben. Dieser cDNA-Mastermix wird wiederum auf PCRGefäße aufgeteilt und mit den jeweiligen Primern versetzt. Es wird grundsätzlich bei jedem cDNA-Ansatz eine RT-PCR auf ein Haushaltsgen z.B. ODC (Ornithin-Decarboxylase) oder Histon H4 als Positivkontrolle und Negativkontrollen (cDNA-Synthese-Ansatz ohne Reverse Transkriptase bzw. ein Ansatz ohne cDNA, um eine Kontamination mit Fremd-DNA auszuschließen) durchgeführt. Unterscheidet sich die Stärke der ODC- bzw. H4-Bande nach der RT-PCR bei den zu vergleichenden Embryonalstadien bzw. Gewebeproben nicht signifikant und ist bei der Negativkontrolle kein Signal zu beobachten, so lassen sich die getesteten Markergene hinsichtlich ihrer Expressionsstärke vergleichen. 2.8.1.1.12 DNA-Sequenzierung Zum Sequenzieren der DNA wird ein Verfahren benutzt, das auf der kontrollierten Unterbrechung der DNA-Synthese beruht (Sanger et al, 1977). Die einzelsträngige DNA dient als Matrize für die Synthese eines neuen Stranges. Es wird ein Primer zugegeben, der mit der DNA hybridisieren kann. DNA-Polymerasen benötigen für ihre Syntheseaktivität einen kurzen Abschnitt doppelsträngiger DNA. Zusätzlich zu den Desoxyribonukleotiden werden auch Didesoyribonukleotide (ddNTPs) in den Reaktionsansatz gegeben. Diesen fehlt die Hydroxlgruppe am 3´-C-Atom des C5 Zuckers. Werden die ddNTPs in den neuen DNAStrang eingebaut, so bricht das Kettenwachstum ab, da keine neue Phosphodiesterbindung geknüpft werden kann. Über die unterschiedliche Länge der neu entstandenen DNA-Stränge lässt sich die Basenabfolge nach einer gelelektrophoretischen Auftrennung ermitteln. Längenunterschiede von einem Basenpaar können aufgelöst werden. Die ddNTPs sind je nach Base unterschiedlich Fluoreszenz-markiert, so dass nach einer Gel-Elektrophorese jedes DNA-Fragment mit einer Laserapparatur detektiert werden kann. Die Bestimmung der Nukleotidsequenzen wird auf einem ABI PRISM-377 DNA Sequencer durchgeführt. Im Reaktionsansatz werden 300-400 ng DNA, 10 pmol Primer und 4 µl Sequenzier-Premix 32 zugegeben. Die Reaktion findet in einem Gesamtvolumen von 10 µl statt. Das Cycle sequencing-Programm (15s 94°C, 30s 50°C, 1min 60°C, 25 Zyklen) wird in einem Perkin Elmer DNA-Cycler 480 durchgeführt. Nach der Reaktion wird der Ansatz mit Ethanol gefällt und im Formamid-Auftragspuffer aufgenommen. Die Reaktion wird dann auf das Sequenziergel aufgetragen. 2.8.1.1.13 Schnelle Amplifizierung von 5´ cDNA-Enden (5’ RACE) "Rapid Amplification of cDNA Ends" (RACE) ist ein Verfahren zur Vervielfachung einer teilweise unbekannten Nukleinsäuresequenz einer mRNA zwischen einer definierten internen Sequenz und einer unbekannten Sequenz am 5´- oder 3´- Ende (Frohman et al., 1988). Diese Methode ist unerlässlich bei der Feststellung des Transkriptionstarts eines Gens bzw. zur Vervollständigung einer nur teilweise bekannten Nukleinsäuresequenz eines Transkriptes. Normalerweise benötigt man für eine PCR zwei sequenzspezifische Primer, die die zu amplifizierende Sequenz flankieren (Saiki et al., 1985; Saiki et al., 1988). Sofern nur für einen Primer die Sequenz bekannt ist, kann mit der RACE-Methode versucht werden, die unbekannte Sequenz zu amplifizieren. Der verwendete Gene Racer Kit der Firma Invitrogen ist eine sehr effiziente Variante des RACE-Verfahrens, um die vollständige Sequenz einer mRNA zu erhalten (Maruyama und Sugano, 1994; Schaefer, 1995; Volloch et al., 1994). Zunächst wird das 5’-Ende der mRNA enzymatisch (tobacco acid pyrophosphatase (TAP) von der Cap-Struktur befreit. Eine zuvor durchgeführte Behandlung des mRNA-Gemisches mit CIP (calf intestine phosphatase) stellt sicher, dass degradierte und unvollständige mRNA-Moleküle am 5’-Ende keine Verwendung finden. Mit Hilfe der T4 RNA-Ligase lässt sich nun an das phosphorylierte 5’-Ende der mRNA ein RNA-Oligo ligieren. Nach Umschreiben der mRNA in cDNA (Oligo dT-Primer) befinden sich nun am sowohl am 5’-Ende (RNA-Oligosequenz) als auch am 3’-Ende (Oligo dT-Primer-Sequenz) des Moleküls bekannte Sequenzen, die als Hybridisierungsstellen für Primer dienen können. Auf der Basis der teilweise bekannten Sequenz einer mRNA lassen sich genspezifische Primer entwerfen, die für die selektive Amplifizierung einer speziellen mRNA benutzt werden können. Für eine 5’-RACE bindet der unspezifische Primer an die RNA-Oligo Sequenz (Gene Racer 5’-Primer). Bei sämtlichen enzymatischen Schritten wird exakt nach Angaben des Herstellers vorgegangen. Die eingesetzte RNA wird nach 3.4.20 gewonnen. Für die Reverse Transkription wird die Superscript II RT (Invitrogen) eingesetzt. Für die PCR und die 33 „nested“ PCR wird die Thermoprime Plus DNA Polymerase (Abgene) bzw. Phusion DNAPolymerase von Finnzymes verwendet. Bei der Verwendung der Phusion DNA-Polymerase wurde eine Denaturierungstemperatur von 98°C verwendet wie vom Hersteller empfohlen. Verwendetes PCR-Protokoll: 1.PCR: 1) 94°C 2 min 2) 94°C 0,5 min 3) 72° 6 min 4) 94°C 0,5 min 5) 70°C 6 min 6) 94°C 0,5 min 7) 65°C 0,5 min 8) 72°C 6 min 9) 72°C 10 min 5x (Schritt 2-3) 5x (Schritt 4-5) 25x (Schritt 6-8) Für die 2. PCR wird 0,5-1µl des 1.PCR-Ansatzes als Matrize eingesetzt. 2. PCR („nested“ PCR) 1) 94°C 2 min 2) 94°C 0,5 min 3) 65°C 0,5 min 4) 72°C 6 min 5) 72°C 10 min 25x (Schritt 2-4) 6) 4°C 34 2.7.1.1.14 Amplifizierung von cDNA Enden aus einer Lambda ZAP® II Phagenbank Diese Methode stellt eine schnelle und billige, wenn auch etwas ungenauere Alternative zur RACE-Methode dar. Da die Lambda ZAP® II Phagenbanken über T3 bzw. T7- Polymerase Erkennungsstellen verfügen, können diese auch als bekannte Oligonukleotidsequenz für eine PCR genutzt werden. Von einer bekannten mRNA Sequenz können ähnlich wie beim RACE genspezifische Primer generiert werden und mit Hilfe einer semi-nested PCR die gewünschte Sequenz amplifiziert werden. Das amplifizierte Fragment kann über ein Agarosegel aufgereinigt (siehe 2.8.1.1.9) und sequenziert werden. Zur Spezifitätserhöhung ist es empfehlenswert wie beim RACE mit zwei PCR Schritten zu arbeiten. Der Nachteil der Methode ist, dass auch an den 5´ bzw. an 3´ Enden unvollständige cDNA Sequenzen, da auch degradierte und unvollständige mRNA-Moleküle als Matrix für Generierung der Phagenbank dienen amplifiziert werden. Des Weiteren können durch die niedrige Schmelztemperatur des T3 und T7 Primers falsch positive DNA Fragmente amplifiziert werden. Folgende PCR Bedingungen werden verwendet: 1.PCR: 1) 94°C 2 min 2) 94°C 0,5 min 3) 58°C 0,5 min 4) 72°C 0,5-2,5 min 5) 72°C 10 min 35x (Schritt 2-4) 2.8.1.2 Arbeiten mit RNA Das Arbeiten mit RNA erfordert höchste Sorgfalt und sterile Bedingungen, da diese wesentlich instabiler als DNA und des Weiteren anfällig gegenüber RNasen sind. Für alle Arbeitschritte sind daher Handschuhe zu benutzen und mit dem RNase-Inhibitor DMPC/H2O (1:1000 verdünnt) behandelte und autoklavierte Arbeitsmaterialien obligat. 35 2.8.1.2.1 Aufreinigung von RNA aus embryonalem Gewebe von Xenopus laevis Zur Aufreinigung von RNA aus ganzen Embryonen oder embryonalen Geweben werden diese zuvor in mit DMPC/H2O behandelten Eppendorfgefäßen in flüssigem Stickstoff schock gefroren um eine Degradation zu verhindern. Für die anschließende RNA Isolation werden entweder der Purescript RNA Isolation Kit; Gentra Systems oder das Trizol Reagent von Gibco, Eggenstein eingesetzt. Die eingesetzte Menge an Ausgangmaterialien richtet sich nach dem Alter der Embryonen, sowie nach der Sensitivität der unterschiedlichen verwendeten Kits. Generell wird für die RNA Isolation aus ganzen Embryonen eine Anzahl von 2-10 herangezogen. Um DNAKontaminationen zu vermeiden, erfolgt im Anschluss an die Isolierung der RNA ein DNaseVerdau durch Zugabe von 2 U DNase I und Inkubation bei 37°C über 30 min. Anschließend wird die DNase durch einen Reinigungsschritt (s. 2.8.1.2.2) wieder entfernt. 2.8.1.2.2 Reinigung von RNA Die Reinigung von RNA erfolgt über RNeasy-Ionenaustauschersäulen der Firma Qiagen, Hilden. Dazu wird zunächst das Volumen der zu reinigenden Probe mit DMPCbehandeltemWasser auf 100 µl eingestellt und mit 350 µl des im Kit enthaltenen Lysispuffer sowie 250 µl 100% EtOH versetzt. Nach Mischen des Ansatzes wird dieser durch das Säulenmaterial zentrifugiert, der Durchfluss verworfen und die Säule zweimal mit dem mitgelieferten Waschpuffer gewaschen. Die RNA wird mit einem adäquaten Volumen DMPC-H2O eluiert, aliquotiert und bei -80°C gelagert. Zur Bestimmung der Konzentration wird ein Aliquot im Spektralphotometer vermessen (siehe 2.8.1.1.10) und ein weiteres Aliquot auf einem Agarosegel analysiert, um Menge und Qualität der RNA abzuschätzen. 36 2.8.1.2.3 In vitro Transkription von RNA Die in vitro Transkription stellt eine unabdingbare Verfahrensweise zur synthetischen Herstellung von mRNAs dar. Diese wird zum einen als antisense-RNA als Sonde in der in situ Technik (siehe 2.8.2.4.1) benötigt, ist aber auch als Injektions-RNA bei der Mikroinjektion von Embryonen zur Untersuchung ektopischer Expression unerlässlich. Für die in vitro Transkription wird die gewünschte Plasmid-DNA zunächst mit einem geeigneten Restriktionsenzym linearisiert und unter RNase-freien Bedingungen mittels Phenol-Extraktion und Präzipitation (s. 2.5.3) gereinigt. Durch die Linearisierung werden so genannte "Run-off"-Transkripte erzielt, die die Ausbeute erheblich steigern. Für die Transkription werden 0,5-1,5 µg linearisierter DNA eingesetzt. Die Synthese der erfolgt mittels mMessage machine Kit (SP6; T3; T7); Ambion, Austin, USA. Die Synthese der mRNA erfolgt nach Angaben des Herstellers. Injektions-RNA, muss eine größere Stabilität gegenüber dem zellinternen Abbau besitzen. Deshalb werden solche RNAs entweder aus dem Plasmidvektor pCS2 transkribiert, das hinter der multiplen Klonierungsstelle einen PolyA-Schwanz mitliefert, oder aus dem Plasmidvektor pSP64T3, der Anteile des humanen Globin Gens trägt, die mit dem klonierten Gen zusammen transkribiert werden und der entstehenden RNA hohe Stabilität und Translationseffizienz verleihen. Bei der Synthese von antisense RNA für in situ Hybridisierungen ist dies nicht unbedingt notwendig. Die RNA wird unter Verwendung der jeweils passenden DNA-abhängigen RNA Polymerase mit Hilfe des Dig-Kits der Firma Boehringer (Mannheim) synthetisiert. Die in den Kits enthaltene Polymerase werden in die synthetisierte RNA Digoxygenin oder Fluorescein markierte Nukleotide eingebaut, so dass diese RNA über einen Antikörper gegen Digoxygenin oder Fluorescein und eine daran gekoppelte Farbreaktion (s. 2.14) nachgewiesen werden kann. Im Anschluss an den Abbau des DNA-Matrize erfolgt auch hier eine Reinigung der RNA über RNeasy-Säulen der Firma Qiagen, Hilden (s. 2.10.3). 37 2.8.1.3 Arbeiten mit Proteinen 2.8.1.3.1 In vitro Translation Die in vitro Translation wird mittels des T7 „TNT Quick Coupled Transcription/Translation Systems“ Kit der Firma Promega durchgeführt. Es wird exakt das Protokoll des Herstellers befolgt (www.promega.com). Die radioaktive Markierung der Proteine erfolgt über [35S]Methionin. 2.8.1.3.2 SDS-PAGE Verwendete Lösungen: Resolving Puffer: SDS-Elekrophoresepuffer (5x): - 1,5 M Tris - 125 mM Tris pH 8,8 - 960 mM Glycin SDS- Probenpuffer SDS- Elektrophoresepuffer - 0,5 M Tris-HCl pH 6,8 - 5x SDS Elektrophoresepuffer - 0,025 % Bromphenolblau - 10% SDS - 10% SDS auf 1 Liter auffüllen - 20% (v/v) Glycerin -25% β-Mercaptoethanol Die elektrophoretische Auftrennung von Proteinen in Polyacrylamidgelen erfolgt im diskontinuierlichen Gelsystem (Laemmli, 1970). Dabei wird das anionische Detergens SDS verwendet, um Proteine zu denaturieren und gleichzeitig ihre Eigenladung zu maskieren. Dadurch ist eine Auftrennung der Proteine alleine nach derem Molekulargewicht gewährleistet. Die Proteinprobe wird im Verhältnis 5:1 mit SDS Probenpuffer versetzt, 5 min erhitzt (98ºC) und danach auf Eis inkubiert. Dabei richtet sich die zu verwendende Acrylamidkonzentration der Gele, die eine Aussage über die Porengröße der PAGE gibt, nach dem zu erwarteten Molekulargewicht der aufzutrennenden Proteine. 38 Ansatz für Proteingele: Trenngele (für 10 ml) H2O 4XResolving Puffer 30% AcrylamidBisacrylamid (29:1) 10% SDS 10% APS TEMED 8% 4,6 ml 2,5 ml 10% 4,0 ml 2,5 ml 15% 2,3 ml 2,5 ml 2,7 ml 3,3 ml 5,0 ml 0,1 ml 62,5 μl 6,25 μl 0,1 ml 0,1 ml 62,5 μl 62,5 μl 6,25 μl 6,25 μl Sammelgel ( 5 %) für 2,5 ml H2O 1,74 ml 1 M Tris, pH 0,315 ml 6,8 30% 0,415 ml AcrylamidBisacrylamid (29:1) 10% SDS 0,025 ml 10% APS 10 μl TEMED 4 μl für 5 ml 3,4 ml 0,63 ml 0,83 ml 0,05 ml 20 μl 8 μl Die Elektrophorese erfolgt bei 60V (Einlauf ins Sammelgel), die Auftrennung im Trenngel bei 100-120 V in Minigelapparaturen der Firma BioRad. 39 2.8.1.3.3 Aufreinigung von GST-Fusionsproteinen mit Glutathion-Sepharose Verwendete Lösungen: Lysispuffer: 50 mM Tris-HCl 50 mM NaCl mM EDTA Protease Inhibitor (1 Tablette Complete von Roche/ 50ml) Waschpuffer: Elutionpuffer 50 mM 50 mM Tris- HCl pH 8,0 500 mM NaCl 10 mM Glutathion (reduziert) 1 mM EDTA (aliquotiert und gelagert bei -20°C) 1% Triton X-100 Dialysepuffer 50 mM Tris-HCl pH 8,0 1 mM EDTA 1 mM DTT 20% Glycerin Zur Untersuchung von Protein-Protein Interaktionen in vitro wurden die cDNAs von FoxN3 und FoxN2 als GST Fusionsprotein im E.coli BL21 (DE3) exprimiert und aufgereinigt. Dazu wurden 15 ml einer ü.N. Kultur in 200 ml mit Ampicilin-haltigem LB- Medium bei 37°C bis zur OD600 von 1,0 kultiviert. Die Induktion der Proteinsynthese erfolgt mittels 0,61,0 mM IPTG (2-4h bei 30°C). Die Bakterien werden bei 5500 rpm und 4°C im GSA-Rotor abzentrifugiert. 500 ml der Glutathion-Sepharose werden abzentrifugiert und mit 1 ml Lysispuffer gewaschen. Das Bakterienpellet wird mit 10 ml Lysispuffer resuspendiert und 4x 15 Sekunden durch Ultraschallbehandlung aufgeschlossen. Die Zellreste werden durch 30 minütige Zentrifugation bei 11000 rpm präzipitiert und der Überstand abgenommen, in 1% Triton X100 (1 ml) gelöst und 500 µl Glutathion Sepharose dazu gegeben. 40 Das Gemisch wird bei 4°C auf dem Schüttler mindestens 3h inkubiert und danach in 4x 10 ml Waschpuffer gewaschen, in 10 ml Lysispuffer inkubiert und mit 2-4 x 500 µl Elutionspuffer eluiert. Danach wird das Eluat nochmals für 15 Minuten bei 4°C inkubiert. Die Dialyse erfolgt ü. N. bei 4°C. 2.8.1.3.2 Pulldown Assay Benötigte Lösungen: PBS: 37 mM NaCl, 2,7 mM KCl, 8,5 mM Na2HPO4, 1,5 mM KH2PO4 PBT: PBS/Tween Puffer A: Puffer B: 40 mM HEPES pH 7,5 40 mM HEPES pH 7,5 5 mM MgCl2 5 mM MgCl2 0,2 mM EDTA 0,2 mM EDTA 1 mM DTT 1 mM DTT 0,5% NP-40 0,5% NP-40 100 mM KCl 300 mM KCl Vor dem Interaktionstest wurden die Proteine Sin3 und RPD3 mit Hilfe des TNT T7 Coupled Reticulocyte Lysate System von Promega als 35S markierte Proteine hergestellt. Vor der eigentlichen Interaktion erfolgt ein so genanntes „Preclearing“. Die an die Sepharose gebundenen Proteine werden 4x mit PBT gewaschen. Die Interaktionsanalyse der Proteine erfolgte nach Cao et al., 2006. Der Überstand des Inkubationsmixes wird auf ein SDS-PAGE aufgetragen, das Gel wird fixiert, getrocknet und eine Imaging Plate aufgelegt. Diese wird anschließend im Phospho-Imager ausgewertet. 41 2.8.2 Arbeiten mit Organismen 2.8.2.1 Arbeiten mit Bakterien Folgende Medien wurden für die Anzucht von Bakterien verwendet: 2 TY: LB: 1,6 % Trypton NZ-Medium: 1% Casein 1 % Hefeextrakt 0,5 % Hefeextrakt 1 % NaCl 0,5 % NaCl 1 % NaCl 1 % Tryptone 0,5 % Hefeextrakt Für die Herstellung von Agarplatten werden dem gewünschten Medium 15 g/l Agar zugesetzt. Bei benutzten Selektionsmedien wird das Antibiotikum Ampicillin in einer Konzentration von 1mg/ml in H2O gelöst, steril filtriert, aliquotiert und bei -20°C gelagert und in einer Endkonzentration von 100 µg/ml dem Medium zugesetzt. 2.8.2.1.1 Herstellung chemokompetenter Zellen nach der RbCl-Methode Für die Transformation von Bakterien benötigt man Zellen, die die Fähigkeit zur Aufnahme von Plasmid-DNA besitzen. Zur Steigerung der Transformationseffizienz empfiehlt sich die Behandlung der Zellen mit Rubidiumchlorid. Von einer auf einer Tetracyclin-Platte selektionierten Bakterienkolonie des XL1-blueStammes wird zunächst eine gesättigte Vorkultur hergestellt. 1 ml der Vorkultur wird auf 100 ml Kulturmedium überimpft und diese bei 37°C bis zu einer OD600 von 0,3 bis 0,5 kultiviert. Die Bakterienkultur wird auf Eis abgekühlt, in zwei 50 ml Falcons überführt und bei 4°C für 5 min bei 3000 rpm abzentrifugiert. Das überstehende Medium wird verworfen, das Bakterienpellet in 20 ml Tbf1-Lösung resuspendiert und für 5 min auf Eis gestellt. Nach erneutem Zentrifugieren bei 2500 rpm und 4°C wird der Überstand erneut verworfen und die Zellen in 2 ml Tfb2-Lösung gelöst. Die Bakterien werden für 20 min auf Eis gestellt, in Eppendorf-Reaktionsgefäße à 125 μl aliquotiert, in flüssigem Stickstoff schockgefroren und bei -80°C gelagert. 42 Tbf-1: 100 mM RbCl Tbf-2: 75 mM CaCl2 30 mM Kaliumacetat 10 mM MOPS 50 mM MnCl2 10 mM RbCl 10 mM CaCl2 15 % Glycerin 15 % Glycerin pH 6,5 mit KOH einstellen pH 5,8 mit Essigsäure einstellen Beide Lösungen werden aliquotiert bei -70°C gelagert und vor Gebrauch aufgetaut und steril filtriert. Tetracyclin: 5mg/ml in Ethanol, aliquotiert und bei -70°C gelagert. Die eingesetzte Endkonzentration beträgt 10 µg/ml 2.8.2.1.2 Transformation von Bakterien RbCl-kompetente Zellen werden auf Eis aufgetaut, mit 5-20 µl Ligationsansatz oder 50-200 ng zirkulärer Plasmid-DNA vermischt und 30-60 min auf Eis inkubiert. Anschließend wird der Ansatz 90 s einem Hitzeschock bei 42°C ausgesetzt und für ca. 30 min auf Eis gestellt. Der Ansatz auf einer Antibioika-haltigen Agarplatte ausgestrichen. 2.8.2.1.3 Blau-Weiß- Selektion von Bakterien Dieses Verfahren erleichtert die Selektion der Kolonien mit rekombinanten Plasmiden (Sambrook et al., 1989). Es beruht auf der α-Komplementation der β-Galaktosidase. Wird die Plasmidsequenz, die für das α-Peptid kodiert, wie es beispielsweise beim p-Drive Vektor der Fall ist, durch den Einbau von fremder DNA unterbrochen, so bleiben die Bakterienkolonien weiß. Bakterienklone, die kein rekombinantes Plasmid aufgenommen haben und somit das α-Peptid synthetisieren, sind an ihrer blauen Färbung zu erkennen. Zellen, die kein rekombinantes Plasmid aufgenommen haben, sind durch die Selektion eines Antibiotikums nicht in der Lage zu wachsen. Die Selektiv-Platten, auf denen eine Blau-Weiß-Selektion durchgeführt wird, werden vor dem Ausplattieren der Bakterien mit 80 µl X-Gal (50 mg/ml) bestrichen. Nach einer halben Stunde Einziehen der Substanz in den Agar, können die Bakterien, denen 4 µl IPTG (100 mM) zugegeben wird, ausgestrichen werden. Die Inkubation erfolgt bei 37°C über Nacht. 43 2.8.2.1.4 Anlegen von Gefrierkulturen transformierter Bakterien 0,7 ml einer dicht gewachsenen Flüssigkultur wird mit 300 ml Glycerin versetzt und gemischt. Die Gefrierkultur wird bei -70°C gelagert. 2.8.2.1.5 Herstellung von Bakterien für Phageninfektion Für das Screenen von Phagen-Banken werden die dafür verwendeten Lamda-Phagen in E.coli-Zellen vermehrt. Dazu werden die Bakterien in NZ-Medium gezogen, dem 10 mM MgSO4 sowie 0,2% Maltose zugesetzt sind, da die Phagen über den Maltose-Rezeptor in die Zellen eindringen. Von einer frischen ü.N.-Kultur werden ca. 100 µl in 100 ml frisches Medium überimpft und bis zu einer OD600 von 0,5- 0,8 gezogen. Anschließend werden die Zellen durch Zentrifugation bei 2800 g sedimentiert. Nach Verwerfen des Überstandes werden die Bakterien in sterilem 10 mM MgSO4 vorsichtig suspendiert ohne die Bakterien zu zerstören, so dass eine Konzentration erreicht wird, die einer OD600 von ungefähr 1,0 entspricht. Die „Phagen-kompetenten“ Bakterien können bei 4°C ca. zwei Wochen gelagert werden. 2.8.2.2 Arbeiten mit Phagen Für die Isolierung von cDNA Klonen wurden zwei Xenopus laevis cDNA Bänke verwendet. Bei einer der Bänke handelt es sich um eine von der Firma Stratagene hergestellte Oligo dT und "random geprimte" cDNA Bank aus Stadium 30 von Xenopus laevis Embryonen. Die Inserts sind über EcoRI/XhoI Erkennungsstellen in einem pBluescript-Vektor und anschließend in die λ-Phagen-DNA kloniert. Der vollständige Vektor einschließlich des Inserts kann mit einem Helferphagen herausgeschnitten, religiert und in entsprechenden Bakterienzellen vermehrt werden (siehe 2.8.2.1.2). Die andere Bank ist aus Xenopus laevis Embryonen des Gastrulastadiums hergestellt, hier handelt es sich ebenfalls um eine λ-ZAP Bank, die von D. Melton zur Verfügung gestellt wurde. Für die Isolierung der Gensequenz und des Promotors von FoxN4 wurde eine genomische Lambda Fix Bank von Xenopus laevis (Stratagene) gescreent. 44 Verwendete Lösungen und Medien: SM-Puffer: 5,8 g NaCl Topagar: NZ-Medium 2 g MgSO4 + 0,7 % Agarose 50 ml 1 M Tris/HCl pH 7,5 durch Kochen lösen auffüllen auf 1 l mit H2O lagern bei 4°C Beide Lösungen werden vor Gebrauch autoklaviert. Zunächst wird der Gesamttiter der Bank durch Ausplattieren einer Verdünnungsreihe bestimmt. Dies ist nötig, da der Phagentiter nach langer Lagerung sinkt. Dazu werden Bakterien von XL1 Blue-MRF´ für das Screening einer Lambda ZAP® bzw. LE392 für das Screening einer Lambda Fix Bank, nach der unter 2.8.2.1.5 beschriebenen Methode für die Phageninfektion vorbereitet. Die Phagen werden in SM-Puffer verdünnt, wobei die Reihe sollte über mehrere Zehnerpotenzen reichen sollte. Es werden jeweils 1 µl der Phagenverdünnung mit 500 µl der Bakterien-Suspension gemischt und 15 min bei 37°C inkubiert, um den Phagen die Möglichkeit zu geben, sich an die Maltoserezeptoren der Bakterienzellen anzuheften. Anschließend werden zu der Mischung 5 ml Topagar (auf 48°C abkühlen) gegeben, kurz gemischt und sofort auf NZ-Agarschalen (150 mm) gegossen. Nach Inkubation über Nacht bei 37°C können die Plaques gezählt und so die "plaque forming units" pro Milliliter (pfu/ml) bestimmt werden. Dieser Wert sollte für die Suche nach cDNAs bei über 109 liegen, damit eine ausreichende Anzahl Klone gescreent werden kann. Bei dem Screening nach genomischen DNA-Fragmenten reicht ein um zwei Zehnerpotenzen geringerer Wert, da bei genomischer DNA im Gegensatz zu deren Transkripten eine „hypothetische“ Gleichverteilung vorherrschen sollte. 2.8.2.2.1 Screenen einer Phagen-Bank Verwendete Lösungen: SM-Puffer: 5,8 g/l NaCl, 2 g/l MgSO4 50 ml/l 1 M Tris-HCl, pH 7,5 45 Es werden jeweils etwa 50000 Phagen der cDNA Banken ausplattiert, bzw. 20000-30000 Phagen der genomischen Bank. Nach Inkubation der Platten über Nacht bei 37°C, wenn die Phagenplaques ausreichend groß sind, werden diese für 2 Stunden auf 4°C gekühlt, wodurch ein späteres Anhaften des Topagars an die Nitrocellulose Filter verhindert wird. 2.8.2.2.1.1 Transfer der Phagen-DNA auf Nitrocellulose Filter Die Filter werden trocken auf die gekühlten Platten aufgelegt und die Orientierung durch Einstechen mit einer Tinte gefüllten Kanüle in dem Agar markiert. Zur Vermeidung von „Falschpositiven“ Signalen nach der Hybridisierung wird auf jeder Phagenplatte ein Duplikatfilter aufgelegt. Nach einer Minute wird der erste Filter, nach 4 min der Duplikatfilter vorsichtig mit einer Pinzette abgezogen und die daran haftenden Phagen werden durch Eintauchen in eine Lösung aus 1,5 M NaCl und 0,5 M NaOH für 2 min denaturiert. Anschließend werden die Filter für 4 min in 1,5 M NaCl, 0,5 M Tris/HCl pH 8,0 neutralisiert und kurz in 2 x SSC-Puffer (20 x SSC: 3 M NaCl, 0,3 M Natriumcitrat pH 7,0) äquilibriert. Nach kurzem Trocknen wird die Phagen-DNA entweder durch Backen für 2 Stunden bei 80°C oder durch UV- Crosslinking, mit dem Filter vernetzt. 2.8.2.2.1.2 Nitrocellulose Filter Hybridisierung Die Hybridisierungsstärke ist abhängig von der Hybridisierungstemperatur, der Ionenstärke des Hybridisierungspuffers und der Waschstringenz. Die Filter werden nach dem Crosslinken einzeln in Hybridisierungspuffer (6 x SSC, 20 mM NaH2PO4, 0,4% (w/v) SDS, 5 x Denhardt´s, 1 mg/ml Lachssperma-DNA) übereinander gelegt, so dass die Filter durchgehend benetzt und nicht untereinander verkleben. Die Filter werden zusammen mit ausreichend Hybridisierungspuffer in einer dichten Kammer verschweißt und mindestens 2 Stunden bei 60°C vorhybridisiert. Anschließend wird der Puffer durch frischen Hybridisierungspuffer ersetzt, dem nun die radioaktive Sonde (siehe 2.8.1.1.14) zugegeben ist. Die Kammer wird wieder sorgfältig verschweißt und über Nacht bei ca. 60°C inkubiert. Die Hybridisierungstemperatur richtet sich nach der verwendeten Sonde und liegt, je nach erwarteter Homologie meist zwischen 55°C und 65°C. 46 Im Anschluss an die Hybridisierung werden die Filter solange mit aufsteigender Stringenz gewaschen, bis nur noch Signale mit der gewünschten Homologie zu erwarten sind. Dies geschieht mit folgenden Puffern unter verschiedenen Temperaturbedingungen (zwischen 50°C und 60°C): 2 x SSC, 0,5% SDS 1 x SSC, 0,5% SDS 1 x SSC, 0,1% SDS Zwischen den Waschschritten sollte die Gesamtstrahlung der Filter bestimmt werden. Diese kann knapp über dem Hintergrund liegen, wenn spezifische Signale erwünscht sind. Generell kann auch weniger stringent gewaschen werden, wenn die zu erwartende Homologie nicht allzu groß ist. Die gewaschenen Filter werden leicht getrocknet und in Klarsichtfolie verpackt in eine Filmkassette gelegt, in der dann eine Exposition der Imaging plate über Nacht erfolgt. Die Auswertung des Screenings erfolgt mit dem Bio Imaging System Fuji Bas 1000. Bei vermeintlich positiven Phagenklonen wird Phagenplaque von der Agarplatte ausgestochen und in 1 ml SM-Puffer unter Zusatz von 40 µl Chloroform für 1-2 Stunden geschüttelt, um die Phagen freizusetzen. Ist der Phagenklon schon vereinzelt wird nach 2.8.2.2.1.3 weiter verfahren. Ist kein vereinzelner Phagenplaque erkennbar, wird großzügig ausgestochen, damit der gesuchte Phagenplaque nicht verloren geht und in einem zweiten Screening bzw. dritten Screening kann dann der gewünschte Phagenklon vereinzelt werden. 2.8.2.2.1.3 In vivo Excision Durch Koinfektion von Bakterien mit λ-Zap- und filamentösen Helferphagen sind die Helferphagen in der Lage, den pBluescript-Anteil einschließlich des Xenopus laevis cDNA Inserts aus dem λ-Phagen herauszuschneiden und zu rezirkularisieren. Dies ermöglicht, dass die weitere Isolierung des gescreenten Inserts sozusagen wie eine Plasmidpräparation behandelt werden kann. Hierzu wird der nach dem Screenen isolierte Phagenplaque von der Agarplatte ausgestochen und nach 2.8.2.2.1.2 weiterbehandelt. Wichtig dabei ist, dass der gewünschte Phagenklon bereits vereinzelt ist, um keine Mischklone zu erhalten. 200 µl dieser Phagen-Lösung werden mit 200 µl Plating-Bakterien gemischt und mit 1 x 10 6 pfu des Helferphagen RU408 versetzt. Zur Infektion wird die Mischung 15 min bei 37°C inkubiert. 47 Anschließend werden die Bakterien mit 3 ml LB-Medium versetzt und über 6 Stunden wachsen gelassen. In diesem Zeitraum erfolgt das Ausschneiden des pBluescript-Anteils aus dem λ-Phagen und dessen Verpackung und Ausschleusung in Form von filamentösen Phagenpartikeln. Durch Erhitzen auf 70°C für 10 min im Wasserbad werden die Bakterien und Phagen inaktiviert, so dass anschließend durch Zentrifugation die Bakterienzellen pelletiert werden. Die Phagenpartikel bleiben im Überstand erhalten und können dekantiert werden. Wichtig dabei ist eine vollständige Inaktivierung der Phagen, da sonst bei der Inkubation mit den Plating-Bakterien diese anschließend durch Lyse zerstört werden können. Mit 100 µl des Überstandes werden erneut 200 µl Plating-Bakterien infiziert (15 min, 37°C), auf Ampicillin-haltigen Agarplatten ausgestrichen und über Nacht bei 37°C inkubiert. Auf dem Ampicillin-haltigen Medium können nur die Bakterien wachsen, die die Resistenz gegen Ampicillin mit dem pBluescript Vektor aufgenommen haben, also auch die gewünschten cDNA-Inserts von Xenopus laevis tragen. Von den gewachsenen Kolonien wird eine ü.N.-Kultur angesetzt und eine DNA-Präparation nach 2.8.1.1.2 durchgeführt. 2.8.2.2.1.4 Nitrocellulose-Filter strippen Nitrocellulose-Filter können mehrmals verwendet werden, so dass mit demselben Filtersatz z.B. nach verschiedenen cDNA`s gesucht werden kann. Dazu müssen allerdings alle bisherigen Signale sozusagen gelöscht werden, d.h. die hybridisierte Sonde herunter gewaschen werden, ohne die an den Filtern haftende Phagen-DNA zu beeinträchtigen. Dies wird erreicht, indem eine Lösung aus 0,1 x SSC und 0,1% SDS zum Kochen gebracht und gerade nicht mehr siedend über die Filter gegossen wird. Die Filter werden in der Lösung frei schwimmend, 20 min auf einem Schüttler zum Abkühlen gelassen, und können nach anschließendem Trocknen leicht in Folie eingeschlagen bei 4°C mehrere Wochen gelagert und wieder verwendet werden. Diese Behandlung lässt sich mit den Filtern etwa zwei- bis dreimal wiederholen. 48 2.8.2.3 Arbeiten mit Xenopus laevis Der adulte Xenopus laevis wird in temperierten (20°C) und mit gefiltertem Wasser versorgten Glasbecken gehalten. Wichtig bei der Haltung ist auf hygienische Bedingungen zu achten, um eine Pilzinfektion oder eine Kontamination mit anderen Frosch-pathogenen Keimen zu vermeiden. Zwischen zwei mittels HCG-induzierten Ablaichprozessen wird für die Weibchen eine mindestens drei Monate währende Regenerationspause eingehalten. 2.8.2.3.1 Stimulation der Eiablage zur Gewinnung von Froschembryonen 12 bis 18 h vor der geplanten Eiablage, d.h. idealerweise am Nachmittag vor der geplanten Injektion, wird den weiblichen Fröschen humanes Choriongonadotropin (HCG) subkutan in den dorsalen Lymphsack injiziert, um die Eiablage einzuleiten. Das HCG wird in 0,5% (w/v) steriler Kochsalzlösung gelöst, so dass die Konzentration 330 U/100 µl. beträgt. Den Fröschen wird, in Abhängigkeit von ihrer Größe, ein Volumen zwischen 150 µl und 220 µl injiziert. Am darauf folgenden Tag kann durch vorsichtige Massage des Weibchens die Eiablage stimuliert werden. 2.8.2.3.2 In vitro Befruchtung von Xenopus laevis Eiern Verwendete Lösungen: OCM: 15 mM HEPES, pH 7,8 10x MBSH: 880 mM NaCl 1 mM L-Glutamin 200 mM HEPES 50 µg/ml Gentamycinsulfat 100 mM KCl 0,4 µg/ml BSA 24 mM NaHCO3 50 U/ml Nystatin 8 mM MgSO4 50 % Leibowitz L15 4 mM CaCl2 10 % FBS 3,3 mM CaNO3 pH 7,8 mit NaOH einstellen steril filtrieren pH 7,3 49 Um eine gleichzeitige Entwicklung zu gewährleisten, werden die Eier künstlich befruchtet. Einem zuvor getötetem Männchen werden die Testis entnommen, die in OCM Medium bei 4°C gelagert und über mindestens eine Woche verwendet werden können. Zur Fertilisation wird der Hoden kurz in 1 x MBSH gereinigt und in einem geringen Volumen, abhängig von der Größe des mazerierten Hodengewebes, in 1 x MBSH suspendiert. Durch Verdünnen auf 0,1 x MBSH (d.h. zu 100 µl Hodenhomogenates werden 900 µl H2O zugefügt) werden die Spermien aktiviert und sofort mit den abgelaichten Eiern gemischt. Durch das Absinken der Salzkonzentration erlangen die Spermien ihre natürlich-einsetzenden Beweglichkeit. Ca. 20-30 min nach der Befruchtung wird die Petrischale mit 0,1 x MBSH aufgefüllt und bei 15°C gelagert. Nach etwa 30 min zeigt sich eine erfolgreiche Befruchtung die Rotation der Eier, die dann mit der pigmentierten Seite zeigen. Die Embryonen werden in vor und nach dem Injizieren in 0,1 x MBSH kultiviert. Um den Wundschluss im Embryo nach der Injektion zu ermöglichen und eine Ausbildung von Injektionsblasen zu vermeiden, werden die Embryonen in 0,5 x MBSH, dem 4% Ficoll zugesetzt werden, injiziert und nach der Injektion in diesem Medium für mindestens 3 h, idealerweise ü.N. bei 14° C dort belassen. Ab Stadium 46 werden die Xenopus laevis Embryonen mit Algenpulver gefüttert. 2.8.2.3.3 Entfernen der Gallerthülle und Mikroinjektionen von Xenopus laevis Eiern Zur Mikroinjektion in Xenopus laevis Embryonen muss die Gallerthülle, die die Eier umgibt, entfernt werden. Dazu schwenkt man die Eier in Cysteinchloridlösung (2% in 0,1 x MBSH pH 8,2-8,5), bis sie eng aneinander zu liegen kommen und wäscht diese mehrmals mit 0,1 x MBSH. Nukleinsäure- oder Protein-Lösungen bzw. Vitalfarbstoffe können in Embryonen injiziert werden. Sie werden an einer Injektionsanlage, über eine Glasnadel mittels Stickstoffdruck mit einem Maximalvolumen von 10 nl in die Blastomeren injiziert. Die Injektionsnadeln werden mittels eines Mikropipetten Pullers hergestellt, um einen, für die Injektion ausreichend feinen Kapillardurchmesser zu erhalten. Die manipulierten Embryonen verbleiben für mehrere Stunden in einer 4% Ficolllösung (siehe: 2.8.2.3.2) 50 2.8.2.3.4 Betäuben von Embryonen Zur intensiven Untersuchung und Dokumentationszwecken ist es oft erforderlich, die Embryonen größerer Stadien (ab ca. Stadium 26) ruhig zu stellen, ohne ihre Entwicklung zu beeinträchtigen. Dies geschieht mit dem Fischbetäubungsmittel MS 222 (3- Aminobenzoesäuremethylester Methansulfonat). Es wird eine 20 x Stammlösung mit 4 mg/ml in 0,1 x MBSH (PH 7-8) angesetzt. Die Embryonen verlieren nach kurzer Zeit ihre Bewegungsfähigkeit in einer 1:20-Verdünnung dieser Lösung, die sie jedoch nach Zurücksetzen in 0,1 x MBSH schnell wiedererlangen. In Abhängigkeit von den Stadien können die Embryonen bis zu 5 h in dem Betäubungsmittel verweilen ohne Schaden zu nehmen. Gelöst ist MS 222 nur wenige Tage haltbar, aliquotiert und bei -20ºC gelagert, ist es jedoch für einen längeren Zeitraum verwendbar. 2.8.2.3.5 Fixieren von Embryonen Für eine Vielzahl histologischer Experimente werden Embryonen in MEM(P)FA (0,1 M MOPS, pH 7,4, 2 M EGTA, 1 mM MgSO4, 4% (Para-)Formaldehyd) oder 4% Paraformaldehyd/PBS Lösung bei 4°C über Nacht fixiert und anschließend schrittweise in Ethanol überführt und für in situ Hybridisierung, Gewebeschnitte, immunohistochemischen oder histologischen Färbungen verwendet. 2.8.2.3.6 Luciferase Assay Es gibt eine Vielzahl qualitativer Reportersysteme mit denen sich eine Promotoraktivität räumlich erfassen lässt, beispielsweise über GFP- oder β-Galaktosidase Reportervektoren. Der Luciferase Assay erlaubt dagegen als etabliertes Reportergensystem die quantitative Aktivitätsanalyse eines Promotors zu untersuchen. Das zu untersuchende Promotorfragment wird vor das Luciferase Gen (pGL3-Basic Vektor, Promega) kloniert und damit die Transkription des Luciferase Reportergens reguliert. Dieser Vektor enthält an sich keinen Promotor und zeigt daher alleine faktisch keinerlei Aktivität. Verwendet wurde dabei das Luciferase Assay System von Promega (Heidelberg). 51 Xenopus laevis Embryonen, die mit pGL3-Promoterkonstrukten injiziert wurden, werden in flüssigem Stickstoff schockgefroren und bei -70°C bis zur weiteren Aufarbeitung aufbewahrt. Je Embryo werden 30 µl Lysepuffer (5 x Lysepuffer: 125 mM Tris/H3PO4 pH 7,8, 10 mM EDTA, 10 mM DTT, 50% (v/v) Glycerin,Triton X-100) zugegeben und die Embryonen mit einem Homogenisator aufgeschlossen. Nach einer zehnminütigen Inkubation auf Eis wird bei 12800 rpm für 5 min abzentrifugiert. Der Überstand abgenommen und nochmals 10 min. inkubiert. 20 µl des klaren Überstandes werden im Lumat LB 9507 (Berthold) vermessen. Dabei wird über das zugeführtes Luciferin (Luciferase Assay: 20 mM Tricine, 1,07 M (MgCO3) 4Mg(OH)2 x 5 H2O, 2,67 mM MgSO4, 0,1 mM EDTA, 33,3 mM DTT, 270 µM Koenzym A, 470 µM Luciferin, 530 µM ATP, pH 7,8) durch die Luciferase enzymatisch umgesetzt. Die dabei entstehenden Lichtquanten werden im Luminometer LB 9507 gemessen. Die angegebenen Werte werden in RLU (relative Lichteinheit) ausgedruckt. 2.8.2.4 Histologische und immunohistologische Methoden 2.8.2.4.1 (Whole Mount) in situ Hybridisierung Die Whole Mount in situ Hybridisierung wurde nach dem Protokoll von Harland (1991) durchgeführt. Dieses Verfahren stellt eine allgemein etablierte und bewährte Methode dar, um die räumliche Expression eines Gens im gesamten Embryo oder in Gewebeschnitten im Embryo sichtbar zu machen. Die fixierten Embryonen werden hierzu mit einer genspezifischen, mit Digoxygenin oder Fluorescein markierten RNA-antisense Sonde hybridisiert (siehe 2.8.1.2.3). In Geweben, in denen eine zur Sonde komplementäre mRNA exprimiert ist, erfolgt eine Hybridisierung. Anschließend folgt der Nachweis über antiDigoxygenin/Flourescein-Fab-Fragmente, die kovalent an Alkalische Phosphatase (AP) gekoppelt sind. Je nach Substratzugabe (z.B. NBT/BCIP; BM Purple; INT/BCIP oder Fast Red) setzt die AP diese Farbstoffe um, was abhängig vom Substrat zu einer türkisblauen, violetten oder orangeroten Färbung führt. Durch die Farbreaktion kann daher die räumliche Expression eines oder, bei einer Doppel-in situ Hybridisierung, zweier Gene zu einem bestimmten Zeitpunkt der Entwicklung eines Embryos nachgewiesen werden. 52 Lösungen für in situ Hybridisierung: AP-Puffer: 1 ml 1 M Tris pH 9,5, 500 µl 1 M MgCl2, 100 µl 5 M NaCl, 100 µl 10% Tween 20, auf 10 ml mit DMPC-H2O auffüllen Hybridisierlösung: 50% (v/v) Formamid deionisiert, 5 x SSC, 1mg/ml Torula-RNA, 0,1% (v/v) Tween 20, 1 x Denhardt´s. 0,1% (w/v) CHAPS, 5 mM EDTA, 100 µg/ml Heparin MAB-Puffer: 100 mM Maleinsäure, 150 mM NaCl, pH 7,5 PBS: 37 mM NaCl, 2,7 mM KCl, 8,5 mM Na2HPO4, 1,5 mM KH2PO4 PBT: 37 mM NaCl, 2,7 mM KCl, 8,5 mM Na2HPO4, 1,5 mM KH2PO4, 0,1% Tween-20, pH 7,3 Proteinase-K Lösungen: Proteinase-K Lösung I: 0,2% Proteinase-K (10 µg/ml) in PBT Proteinase-K Lösung II: 5 µg/ml Proteinase-K in 1/10 MBSH 20x SSC: 3 M NaCl, 0,3 M Natriumcitrat Torula RNA: 50 mg/ml in DMPC-H2O lösen, in 1 ml Aliquots bei -20ºC lagern Die Whole-mount in situ Hybridisierung wird in DMPC (0,1% in H2O) behandelten 5ml Gläschen durchgeführt. Das verwendete Protokoll dauert vier Tage. An den ersten beiden Tagen muss RNase-frei gearbeitet werden. Erster Tag: Die in Ethanol befindlichen Embryonen werden schrittweise mit PBS und PBT rehydratisiert. Die Vitellinmembran wird durch die Behandlung mit Proteinase-K Lösung I durchlässig gemacht und eine unspezifische Färbung durch Wechselwirkung mit der markierten RNA verringert. Die Embryonen werden mit Triethanolamin gewaschen und schrittweise Essigsäureanhydrid hinzugefügt. Es wird zweimal mit PBT gewaschen und die Embryonen in MEMFA refixiert. Fünf Waschschritte mit PBT schließen sich an. Zur Vorhybridisierung werden die Embryonen in Hybridisierungspuffer versetzt und ü.N. bei 60°C im Wasserbad geschwenkt. 53 Zweiter Tag: 20 µl der DIG- bzw. Flourescein markierten antisense-RNA-Sonde werden mit 20 µl deionisiertem Formamid vermischt. Die Inkubation bei 96°C für 30 sec und die sofortige Abkühlung auf Eis minimiert die Bildung von störenden Sekundär- und Tertiärstrukturen. Nach der Zugabe von 460 µl Hybridisierpuffer werden die Sonden auf die Embryonen gegeben. Die Inkubation erfolgt über Nacht bei 60°C im Wasserbad. Dritter Tag: Die Sonde wird abgenommen und kann wieder verwendet werden (bei -20°C lagern). Um überschüssige markierte RNA zu entfernen, wird zuerst mit Hybridisierungspuffer und anschließend mit 2 x SSC gewaschen. Die einzelsträngigen RNA-Formen und DNA-RNAHybride werden mit RNase-A, RNase-T1 und RNase-H abgebaut. Nach mehreren Waschschritten mit 2 x SSC werden die Embryonen für die Antikörperreaktion mit MABPuffer, Boehringer Mannheim Blocking Reagenz und Lammserum vorbereitet. Die Inkubation mit dem AK beträgt etwa 4 h bei RT. Nicht gebundene Antikörper werden durch Waschen mit MAB-Puffer über Nacht entfernt. Vierter Tag: Die Embryonen werden noch zweimal mit MAB-Puffer gewaschen und in AP-Puffer geschwenkt. Die Färbung erfolgt durch Zugabe des AP-Substrates. Bei ausreichender Färbung werden die Embryonen in PBT gewaschen mit MEMFA fixiert und in Ethanol überführt. Anschließend daran kann eine Depigmentierung der natürlichen Hautpigmentierung des Embryos durchgeführt werden, um die in situ Färbung hervorzuheben. Die Depigmentierung erfolgt mit einem 2:1-Gemisch aus Ethanol und 30% H2O2. Je nach Stärke der Pigmentierung, die von Gelege zu Gelege schwankt, dauert die vollständige Bleichung der Pigmente zwischen 24 und 48 Stunden. 54 2.8.2.4.2 Antikörperfärbung Zur Darstellung der cranialen Nerven von Xenopus laevis Embryonen wurden diese im Stadium 48 mit 4% PFA (in PBS) bzw. MEMPFA fixiert und eine immunohistologische Färbung mit dem Antikörper 3A10 durchgeführt. Dieser ist gegen ein Neurofilament Protein gerichtet (Developmental Studies Hybridoma Bank, University of Iowa). Das Procedere erfolgte leicht modifiziert nach Serafini et al., 1996. Nach der Fixierung der Embryonen werden diese in PBS (5 x 5 min) gewaschen und durch anschließende Inkubation mit PBS+0,3% Triton X-100 (2 x 30 min) permeabilisiert. Danach werden diese 1-4 h mit PBS/3% Lammserum geblockt und mit dem primären AK (1:100) ü. N. inkubiert. Nach waschen mit PBS/20% Lammserum (6 x 30 min), erfolgt die Inkubation mit dem sekundären AK (1:250) für 4 1/2 h. Danach werden die Embryonen mehrmals mit PBS gewaschen. Die Färbung bleibt mehrere Tage stabil. 2.8.2.4.3 BrdU Assay Die Durchführung des BrdU Assays erfolgte am ganzen Embryo im Wesentlichen nach Hardcastle und Papalopulu, 2000. Dabei wurde der 5 Bromo-2´-deoxy-uridine Labeling and Detection Kit II (Roche) eingesetzt. Bei jüngeren Stadien (bis Stadium 41) erfolgt die Verabreichung des BrdU-Reagens über Injektion (10 nl) in den gewünschten Bereich des Embryos und anschließender Inkubation (1 bis 2 h). Bei älteren Stadien wurden die Embryonen für 4 h in 250 µl 0,1 x MBSH inkubiert, dem 20 µl des BrdU-Reagenz zugesetzt wurden Bei proliferierenden Geweben, inkooperieren sich teilende Zellen das angebotene Desoxythymidin Analog 5-Bromo-2´-deoxy-Uridin (BrdU) und kann nach Fixierung des Embryos bzw. des Gewebeschnittes mittels eines BrdU-Antikörpers nachgewiesen werden. Eine intensive Färbung korreliert mit daher mit einer verstärkten Proliferation. Nach der unilateralen Injektion des Morpholino Oligonukleotids wurden die Embryonen bis zum gewünschten Stadium kultiviert, je nach Bedarf mittels MS222 betäubt und das BrdUReagens in den Kopf injiziert. Nach der Fixierung erfolgte der BrdU Assay entweder am ganzen Embryo oder an Kryoschnitten. Der BrdU Assay an histologischen Schnitten erfolgte dabei nach Anweisung des Herstellers. 55 TUNEL Assay Der TUNEL Assay dient zur Visualisierung von Zellen, die in die Apoptose (Programmierter Zelltod) übergehen. Er gehört wie der BrdU Assay zum Stadardrepertoire bei der Analyse des Zellzyklus. Der TUNEL Assay wurde dabei nach Standardprotokollen durchgeführt (Hensey und Gautier, 1998). Die Grundlage des TUNELs (TdT-mediatet dUTP-biotin nick end labeling) beruht auf den, für die Apoptose charakteristischen Fragmentierung des DNAStranges durch Endonukleasen. Diese DNA-Stücke besitzen an den Enden freie Hydroxylgruppen (3´OH-Enden). Diese Enden können mit markierten Nukleotiden mittels des Enzyms TdT (Terminale deoxynucleotidyl Transferase) markiert werden, die dann aufgrund von Fluoreszenz oder Farbstoffkopplung sichtbar gemacht werden können. Für die Analyse auf histologischen Schnitten wurde folgendes Protokoll etabliert: - Anfertigung von OCT-Schnitten (siehe 2.8.2.4.7) - Waschen der Kryoschnitte in PBT (PBS + 0,1% Tween) (2 x 10 Minuten) und 4 minütige Inkubation in PBS mit 10 µg/ml Proteinase-K. - Waschen der Schnitte in PBS/ 0,2% Glycin (7 Minuten) und anschließend in PBT (2 x 5 Minuten). - Erneute Fixierung der Gewebeschnitte in 4% Paraformaldehyd/PBS (1 h) und anschließender Inkubation in PBT (4 x 5 Minuten). - Die Kryoschnitte werden 2 h im TdT Puffer inkubiert und danach nochmals über Nacht im TdT Puffer mit 0,1 µl Digoxygenin markiertes dUTP (Roche) und 10 µl des Enzyms TdT (150 U; Invitrogen) pro Milliliter Pufferlösung. - Die Schnitte werden mit einer PBS/EDTA Lösung (1 mM EDTA) gewaschen, und nochmals bei 65 ºC in der PBS/EDTA Lösung 2 h inkubiert. Die Inkubation des APAntikörpers (1:2000; Roche), sowie das Blocken und anschließende Färben mit BM Purple erfolgte nach Standardprotokollen. Es erfolgte am Ende der Prozedur eine Refixierung der Schnitte in MEMFA. 56 2.8.2.4.5 Alcianblau Färbung an ganzen Embryonen und Gewebeschnitten Mit der Alcianblau Färbung werden spezifisch saure Polysaccharide angefärbt. Dies erlaubt die bessere Darstellung und Bestimmung von Knorpeln und noch nicht ossifizierten Knochen im Xenopus laevis Embryo ab dem Embryonalstadium 48. Folgendes Protokoll wurde dabei verwendet: - Fixierung der Embryonen im Stadium 48 in MEMFA (0,1 M MOPS, pH 7,4, 2 mM EGTA, 1 mM MgSO4, 4% Formaldehyd). - Überführung der Embryonen in 1% Alcianblau-Lösung mit 0,5% Essigsäure - Inkubation in Ethanol/Eisessigsäure (80%/20%) - Waschen der Embryonen in 1%KOH/3% H2 O2 und in gesättigte Natriumtetraborat Lösung überführen mit 0,05% Trypsin für zwei Stunden, danach ein weiterer Waschschritt in PBT (PBS+ 0,1% Tween) - 1-3 stündige Inkubation in PBT mit 6 µl/ml Proteinase-K (20 mg/ml) - Waschen in PBT und nochmalige Fixierung in MEMFA. Für Gewebeschnitte wurden Embryonen in OCT eingebettet und 10-15µm dicke Schnitte angefertigt. Diese wurden eine Minute in Eisessig, danach 10 Minuten in Alcianblaulösung (1% Alcianblau, 0,15% Eisessig in H2 O) überführt Die Schnitte wurden je 1 Minute in 96% Ethanol, 2 Minuten in 100% Ethanol, 2 Minuten in Isopropanol und 6 Minuten in Xylol inkubiert. Die Schnitte wurden mit Deckgläschen und dem Histo Kitt II (Roth) eingedeckelt. 2.8.2.4.6 Hämatoxilin/Eosin (HE) Färbung Diese Methode dient zur kontrastreichen Visualisierung von Zell-und Gewebestrukturen. Die Hämatoxilin und Eosin Doppelfärbung erfolgte nach Standardprotokollen. Verwendete Chemikalien sind dabei saures Hämatoxylin nach Ehrlich oder Mayer. Je nach Wahl des Kations. und Eosin sowie Essigsäure und Natriumhydrogencarbonat. Dabei färbt die saure Hämatoxylin-haltige Lösung anionische Strukturen an, wie z.B. die Phosphatgruppen der DNA im Zellkern blau. Klassischerweise wird eine Gegenfärbung mit Eosin durchgeführt, bei der kationische Strukturen wie beispielsweise Proteine rot angefärbt werden. 57 2.8.2.4.7 Anfertigung von histologischen Schnitten von Xenopus laevis Gelatinelösung: - 2,2 g Gelatine in 450 ml unter Rühren vorsichtig bis zur vollständigen Lösung erwärmen - 135 g BSA hinzugeben - 90 g Saccharose zugeben, nach vollständiger Lösung aliquotieren und bei -20ºC lagern Zu den oben genannten histologischen Methoden war es notwendig histologische Schnitte von Xenopus laevis Embryonen anzufertigen. Für Embryonen deren Expressionsdomänen nach einer Whole mount in situ Hybridisierung untersucht werden sollten, wurden zumeist Vibratomschnitte angefertigt. Dazu wird der Embryo für mehrere Stunden in Gelatinelösung gelegt. In einer Gussform wird eine zuvor auf Eis durchmischte Gelatine/Glutaraldehydlösung (1 ml Gelantinelösung + 140 µl Glutaraldehyd) gegossen, die schnell verfestigt. Danach wird der Embryo auf diesem Gußsockel ausgerichtet und Gelatine/Glutaraldehydlösung über den Embryo gegossen. Nach dem Verfestigen kann die Gussform entfernt und der Block mittels Sekundenkleber auf einen Metallträger geklebt werden. Dieser Metallträger wird im Vibratom eingespannt und in einer Schichtdicke von 30-80 µm geschnitten. Die Vibratomschnitte werden in der Regel mit Glycerin eingedeckelt. Diese Methode ist schnell und effizient. Der Nachteil ist, dass diese Schnitte nicht für immunohistologische Methoden geeignet sind. Dafür werden Embryonen fixiert und in das Kryomedium OCT resin (Sakura Finetek, USA) eingebettet. Die Schnitte wurden im Kryotom bei -20ºC in einer Schnittdicke von 10-20 µm angefertigt. 2.8.2.4.8 Transparenzvisualisierung von Embryonen mit Benzylbenzoat/Benzylalkohollösung Um eine in situ Färbung von innen gelegenen Expressionsmustern im ganzen Embryo sichtbar zu machen, wird diese Methode angewendet bei der der Embryo durchsichtig wird, die histologische Färbung jedoch erhalten bleibt. Die Embryonen werden zunächst in 100% Methanol transferiert und darin mindestens 5 Minuten inkubiert, danach erfolgt eine Überführung in ein Benzylbenzoat/Benzylalkoholgemisch (2:1). Die Transparenz erfolgt nach etwa 5 Minuten. Die Inkubation im Benzylbenzoat/Benzylalkoholgemisch muss in Glasschälchen durchgeführt werden, da diese bestimmte Kunststoffe aufzulösen vermag. 58 3 Ergebnisse 3.1 Identifizierung von Forkhead Genen der Subklasse N in Xenopus laevis 3.1.1 Die Sequenzanalyse des FoxN1 Gens in Xenopus Der Vergleich des humanen FOXN1 Gens bzw. des Maus- und Zebrafischhomologen mit EST-Klonen von Xenopus laevis mittels NCBI/BLAST führte zu ESTs, die nur geringe Homologie zu den FOXN1 Orthologen aufwiesen. Da diese zumeist innerhalb der Forkhead Domäne zu finden war, konnten diese ESTs nicht dem hypothetischen FoxN1 Gen zugeordnet werden. Dennoch kann davon ausgegangen werden, dass das FoxN1 Gen im Krallenfrosch tatsächlich existiert, so wurden zwei nicht überlappende ESTs von Xenopus tropicalis identifiziert, die eine relativ hohe Homologie zu den FoxN1 Genen der bereits genannten Spezies aufweisen. Der eine, DN049598, ist ein 798 bp langer EST-Klon aus adulter Niere und der andere, DT425724, ist ein 899 bp langer, aus adultem Hautgewebe von Xenopus tropicalis isolierter, cDNA Klon. Dies ist ein wichtiges Indiz das es sich hierbei um eine Teilsequenz des FoxN1 Gens von Xenopus tropicalis handelt, da für die FoxN1 Homologen in Mensch und Maus eine essentielle Rolle bei der Entwicklung von Keratinozyten und Haarfollikeln der Haut beschrieben ist (Mecklenburg et al., 2001; Adriani et al., 2004). Der Vergleich dieser ESTs mit dem Genom von Xenopus tropicalis (http://www.ensembl.org/index.html) führten zum hypothetisch existierenden FoxN1 Gen im Scaffold 50 (Xenbase v.3.0). Die genannten ESTs wiesen eine Sequenzidentität von 88% bzw. 91% zur genomischen Sequenz auf. Eine Amplifizierung von DNA Fragmenten mit Oligonukleotiden (deren Sequenz von den ESTs abgeleitet wurden unter Verwendung von Xenopus tropicalis cDNA, die aus dem Embryonen Stadium 25 (Nieuwkoop and Faber, 1967) hergestellt wurde), führte jedoch nicht zum Erfolg. Ebenso wenig gelang es mit degenerierten Oligonukleotiden, abgeleitet aus den EST Sequenzen, ein PCR-Produkt aus einer Tadpole cDNA Bank von Xenopus laevis mittels PCR ein Amplifikat unter wenig strigenten PCR-Bedingungen zu erhalten. Es ist anzunehmen, dass ein funktionsfähiges FoxN1 Gen sowohl in Xenopus tropicalis als auch in Xenopus laevis existiert, jedoch wahrscheinlich erst in späteren Embryonalsstadien auch transkribiert wird, wenn die Differenzierung der Keratinozyten einsetzt. Ein Anhaltspunkt dafür ist, das beide gefundenen ESTs von Xenopus tropicalis aus adultem Gewebe entstammen. 59 3.1.2 Die Isolierung des FoxN2 Gens Das FoxN2 Gen in Xenopus konnte über eine Reihe von EST Klonen identifiziert werden. Dabei handelt es sich um die Klone BU909915, CA988030, CF27159, die für den Cterminalen Bereich des FoxN2 Proteins von Xenopus laevis codieren und die überlappenden EST Klone von Xenopus tropicalis CX795231 bzw. CX800360, die für den N-terminalen Bereich des Xenopus tropicalis Proteins kodieren. Eine weitere EST Suche mittels dieser Sequenzen führte zu einem cDNA Klon von Xenopus laevis (BC081030) (Klein et al., 2002) mit einem offenen Leserahmen von 430 Aminosäuren, die eine Homologie von 67% zum humanen FOXN2 Protein aufwiesen (siehe Tabelle 1). Mittels PCR und aus der Sequenz abgeleiteten Oligonukleotiden, sowie cDNA aus verschiedenen Embryonalstadien von Xenopus laevis konnte der gesamte offene Leserahmen amplifiziert und zur weiteren Analyse in den pCS2 Expressionsvektor kloniert werden. 3.1.3 Die Identifizierung von FoxN3a und FoxN3b Der Vergleich der Nukleinsäuresequenz des Maus bzw. humanen FOXN3 Gens mit ESTs von Xenopus führte zu den Klonen BJ046265, der den 5´ Bereich des Gens repräsentiert, bzw. CX855631, einem cDNA Klon von Xenopus tropicalis, der den 3´Bereich des Homologen von Xenopus tropicalis entspricht. Oligonukleotide, die von dem 5´UTR von X. laevis und 3´UTR von X. tropicalis abgeleitet wurden, ermöglichten eine Amplifizierung einer ca. 1550 bp großen DNA Bande, die in den pCS2 Expressionsvektor kloniert wurde. Eine anschließende Sequenzierung einer Reihe positiver Klone zeigte zwei unterschiedliche Formen des FoxN3 Gens auf, die sich durch eine Länge von 66 bp unterschieden. Ein Sequenzvergleich mit dem Xenopus tropicalis Genom zeigte dass es sich hierbei um ein zusätzliches kodierendes Exon handelt. Interessanterweise ist auch diese alternative Spleißvariante hoch konserviert und sowohl beim Menschen (U68723), als auch im putativen Foxn3 EST Klon der Maus (BG0823499), zu finden, was eine essentielle Rolle beider Isoformen vermuten lässt. Beide Isoformen des FoxN3 Proteins zeigen eine relativ hohe Aminosäureidentität zu beiden humanen FOXN3 Proteinen (CHES1) (74 bzw. 80%, siehe Tabelle 1). Ein 5´RACE der FoxN3 Transkripte erbrachte die Existenz zweier unterschiedlicher Leaderexons (siehe Abb. 6), die auch auf genomischer Ebene von Xenopus tropicalis verifiziert werden konnten und im dessen Genom 1,2 kb voneinander entfernt liegen (Scaffold 60 22, Xenbase v.3.0). Eine PCR Analyse zeigte dass alle vier daraus resultierenden möglichen Transkripte von FoxN3 tatsächlich existieren. Die beiden unterschiedlichen FoxN3 Proteine wurden als FoxN3a und FoxN3b bei EMBL hinterlegt (Schuff et al., 2006) (AM114794 bzw. AM114795), wobei FoxN3a für die längere Variante mit dem zusätzlichen Exon VI kodiert (siehe 7.1). 3.1.4 Die Aufklärung der Struktur des FoxN4 Gens Der Sequenzvergleich von Foxn4 der Maus mit ESTs von Xenopus führte zu einem EST Klon von Xenopus tropicalis (CX964167) und zwei nicht überlappenden EST Klonen (BJ061286 and DR724233), die den 5´Bereich des FoxN4 Gens repräsentieren. Oligonukleotide, die von diesen beiden ESTs abgeleitet wurden, sowie eine Tadpole cDNA Phagen Bank von Xenopus laevis ermöglichten, es ein etwa 900 bp großes DNA Fragment mittels PCR zu amplifizieren, das jedoch keinen vollständigen offenen Leserahmen aufwies. Dieses Fragment wurde darauf hin für ein Screening jener, bei der Fragment Amplifizierung benutzten Tadpole cDNA Phagen Bank, verwendet. Dadurch konnte ein cDNA Klon isoliert werden, der einen PolyA Schwanz enthielt, d.h. ein vollständiges 3´-Ende aufwies, jedoch im 5´-Bereich unvollständig war. Dieser cDNA Klon ermöglichte es ein Oligonukleotid mit revers komplementärer Sequenz abzuleiten und den gesamten kodierenden Bereich mittels PCR von cDNA aus dem Embryonalstadium 32 von Xenopus laevis zu amplifizieren und zu klonieren. Auf Proteinebene zeigt der erhaltene FoxN4 eine Homologie von 43% zu FOXN4 (Homo sapiens) (siehe Tabelle 1). Die Sequenz von FoxN4 wurde bei EMBL unter der Nummer AM114796 hinterlegt. Zur weiteren Analyse des FoxN4 Gens, zu denen die Untersuchung der genomischen Organisation und Promotorstudien gehören, wurde eine genomische Phagenbank mit dem amplifiziertem ORF Klon gescreent und zwei sich im Exon IX nicht überlappende Klone isoliert. Davon wurden bisher etwa 1 kb des putativen FoxN4 Promotors sequenziert, sowie alle Introns mit Ausnahme zweier Bereiche im Intron II und IX. Die Region + 31 bis - 974 wurde des weiteren für Promotorstudien in den pGL3-Basic Vektor kloniert (siehe 3.5.1). 3.1.5 Das FoxN5 Gen von Xenopus laevis FoxN5 wurde über den EST Klon CA791267 durch den Sequenzvergleich von humanen und Maus FoxN Genen mittels NCBI/BLAST gefunden. Da zu diesem Zeitpunkt weder in Homo 61 sapiens, noch in anderen Spezies FOXN5 bzw. FOXN6 Gene beschrieben waren, konnte dieses Transkript zunächst nicht eindeutig zugeordnet werden. Ausgehend von dem genannten EST Klon wurde ein Amplifikat zum Screening einer Gastrula cDNA Phagen Bank verwendet. Dies führte zu einer Isolierung von vier sequenzidentischen cDNA Klonen, die einen ORF von 885 Basen aufwiesen. Mit den wenig später beschriebenen FOXN5 bzw. FOXN6 Genen (Katoh und Katoh, 2004a; Katoh und Katoh, 2004b) in Maus, Mensch und Ratte zeigt FoxN5 zwar nur geringe Homologie (23% zu FOXN5/R1 bzw. 31% zu FOXN6/R2 auf Proteinebene; siehe Tabelle 1), die außerhalb der Forkhead Domäne noch geringer ist, jedoch hat es taxonomisch noch die größte Übereinstimmung zu diesen Genen (Tabelle 1, sowie Abb.4 und 5). Obwohl FoxN5 eine höhere Homologie zum Xchromosomalen humanen FOXN6 aufweist, wird das monoexonale FOXN6 in Säugern als ehemaliges Retrotransposon des FOXN5 Gens angesehen (Katoh und Katoh, 2004c). Dem gegenüber steht das FoxN5 des Xenopus tropicalis, das wie die Homologen in Maus und Mensch in 6 Exons aufgegliedert ist (hier nicht gezeigt). Ein weiteres FoxN Gen konnte in Xenopus bisher nicht identifiziert werden. Ein weiteres Indiz, dass es sich bei dem gefundenen Gen um FoxN5 handelt, zeigte sich durch Nachbarschaftsanalyse von 5´ und 3´ liegenden Genen des auf Chromosom 11 lokalisierten humanen FOXN5 und den im Scaffold 75 (Xenbase v. 3.0) identifiziertem FoxN5 Gen des Xenopus tropicalis. Das Homologe, des in unmittelbarer Nachbarschaft zum FOXN5 Gen liegende Archain Gen, konnte ebenso in Nachbarschaft zum FoxN5 Gen des Xenopus tropicalis identifiziert werden. Inzwischen konnten eine Reihe von weiteren Genen, die in der Umgebung des humanen FOXN5 Gens auf dem Chromosomenabschnitt 15 q23 liegen, die dazu homologen Gene in Xenopus laevis in der Nähe des FoxN5 Gens gefunden werden (siehe Abb. 5). Der offene Leserahmen von FoxN5 ist kurz, was im Vergleich zu den anderen FoxN Genen in Xenopus laevis zu einem relativ kleinen Protein führt. Das dieser ORF jedoch komplett ist, d.h. sich keine weitere kodierende Nukleinsäuresequenz im 5´Bereiches des Transkriptes befindet, lässt sich durch Sequenzvergleich mit anderen FoxN5 Homologen annehmen, da diese für ähnlich große Proteine kodieren (hier nicht gezeigt). Außerdem brachte eine „seminested“ PCR mit T3 und T7 Oligonukleotiden und zwei genspezifischen Oligonukleotiden, abgeleitet von der cDNA von FoxN5 (siehe 2.7.1.1.21), keine außerdem keine weitere zusätzliche transkribierte Sequenz im 5´ Bereich. Die Sequenz von FoxN5 wurde bei EMBL unter der Nummer AM114797 hinterlegt (Schuff et al., 2006). 62 __________________________________________________________________________________________ Abb. 3: Vergleich des genomischen Locus von FoxN5 in Xenopus tropicalis (scaffold 124; Xenbase v. 4.1) und FOXN5 (FOXR1) (Chromosom 15 q23) von Homo sapiens. In beiden Spezies liegen eine Reihe homologer Gene in unmittelbarer Nachbarschaft zu FoxN5 bzw. FOXN5, wie etwa das archain Gen (arcn). Die Abstände zwischen den einzelnen Genen sind in Kilobasen (kb) angegeben. Ein Aminosäuresequenzvergleich der in Xenopus laevis gefundenen Forkhead Proteine der N Subklasse zeigt, dass FoxN5 relativ geringe Homologie zu seinen Orthologen aufweist, sogar innerhalb der Forkhead Domäne, während FoxN2 und FoxN3 auch außerhalb der Forkhead Domäne konservierte Elemente besitzen (Abb.4). 63 __________________________________________________________________________________________ Abb. 4: Proteinsequenzvergleich aller in Xenopus laevis gefundenen FoxN Proteine. Identische Aminosäuren sind rot markiert, Deletionen sind durch Striche markiert. Die Forkhead Domäne ist türkisblau hinterlegt. Die Aminosäuren die für das zusätzliche Exon VI der Spleißvariante FoxN3a kodieren sind gelb hinterlegt. Auffällig ist die hohe Sequenzidentität von FoxN3, besonders von FoxN3a und FoxN2, während FoxN5 auch innerhalb, der in einer Subklasse normalerweise konservierten DNA Bindungsdomäne eine teilweise alternierte Aminosäuresequenz aufzeigt. Angefertigt wurde das ProteinAlignment über Mac Molly ® Tetra Version 3.9. Eine Stammbaum Analyse der FoxN Proteine von Maus, Mensch und Zebrafisch lässt eine Aufgliederung dieser Subklasse in drei Hauptäste erkennen, den FoxN1/4, den FoxN2/3 und den FoxN5/6 Paralogen (siehe Abb. 5). Während FoxN1/4 und FoxN2/3 noch relativ nahe bei einander liegen, ist FoxN5/6 evolutionär weit von den anderen Paralogen entfernt. Dabei ist auch die Distanz und damit geringe Konservierung von FoxN5 zu den mammalen FoxN5/6 Proteinen erkennbar, was den Schluss einer relativ frühen Abspaltung dieser Gene aus einem gemeinsamen FoxN Vorläufergen zulässt (siehe 4.1). 64 Für die meisten FoxN Gene von Mensch, Maus und Zebrafisch konnten, soweit noch nicht beschrieben, über ESTs verschiedene Spleißvarianten gefunden werden. Für Xenopus konnten nur die bereits oben genannten Isoformen des FoxN3 Gens identifiziert werden. __________________________________________________________________________________________ Abb. 5: Phylogenetischer Stammbaum der FoxN Proteine von Mensch (Homo sapiens), Maus (Mus musculus), Zebrafisch (Danio rerio) und Südafrikanischem Krallenfrosch (Xenopus laevis) unter Einbeziehung aller isolierten und verifizierten Spleißvarianten, die einen vollständigen Leserahmen und eine Ac. Nummer besitzen. Alle Proteine wurden durch Sequenzvergleiche mittels http://www.ncbi.nlm.nih.gov/blast/ oder www.pubmed.gov gefunden. Der Stammbaum teilt sich in drei Hauptäste auf, den FoxN1/4, FoxN2/3 und den FoxN5/6 Paralogen. Die Ac. Nummer ist hinter den Gennamen gestellt. Erstellt wurde der Stammbaum mit Hilfe des Programms CLUSTALW. Die genomische Struktur des FoxN4 Gens des Xenopus laevis wurde wie bereits beschrieben aufgeklärt. Die genomische Organisation von Genen in Xenopus tropicalis lässt sich inzwischen weitgehend vollständig bestimmen, da dessen Genom weitgehend sequenziert ist und nur noch geringe unsequenzierte Bereiche aufweist. Die Zahl der Exons der FoxN Gene variiert teilweise sehr stark, ebenso die Länge der dazwischen liegenden Introns. Während FoxN2 und FoxN3 relativ große Introns besitzen, sind die Intronlängen von FoxN4 und FoxN5 relativ kurz und zumeist unter einer Kilobase (Abb. 6). 65 __________________________________________________________________________________________ Abb. 6: Genomische Organisation der FoxN Gene in Xenopus tropicalis und Xenopus laevis. Die genomische Kartierung der FOXN Gene von Xenopus tropicalis erfolgte über ENSEMBL. (http://www.ensembl.org/index.html). Die Struktur des FoxN4 Gens von Xenopus laevis ergibt sich aus zwei isolierten Phagenklonen einer genomischen λ-Fix Bank (Die Nukleotidsequenz dazu befindet sich unter 7.2 im Anhang). Exons sind durch dicke Balken gekennzeichnet und mit Römischen Zahlen nummeriert. Die Linien geben die Intronbereiche wieder. Die Abstände sind maßstabsgetreu. Eine Unterbrechung der Linien kennzeichnet nicht sequenzierte Bereiche oder Bereiche, die außerhalb des Maßstabes liegen. Die Identifizierung der Gene FoxN2 (scaffold 111), FoxN3 (scaffold 22), FoxN4 (scaffold 9) und FoxN5 ergibt sich aus Xenbase 3.0. Mit Ausnahme von FoxN5 besitzen alle FoxN Gene des Krallenfroschs ein Leaderexon. Mit Ausnahme von FoxN5, enthalten alle FoxN Gene ein Leaderexon. Die Anzahl der Exons ist über Spezies hinweg für die einzelnen Homologen konserviert (Daten nicht gezeigt). Um sicher zu gehen, dass die Transkripte am 5` Ende vollständig sind, wurde eine 5`RACE Analyse oder wahlweise eine semi-nested PCR (wie oben für FoxN5 beschrieben) mit zwei versetzten genspezifischen Oligonukleotid- bzw. T3 und T7 Primern auf einer λ-Zap Phagen Bank durchgeführt (siehe 2.8.1.1.13 bzw. 2.8.1.1.14). 66 Aminosäureidentität in % von Xenopus laevis zu Homo sapiens FOXN1 (WHN) (NM_003593) FOXN2 (HTLF) FoxN2 FoxN3a FoxN3b FoxN4 (BC081030) (AM114794) (AM114795) (AM114796) (AM114797) 6% 9% 9% 21% 4% 67% 40% 38% 10% 4% 38% 79% 74% 10% 4% 36% 76% 79% 11% 4% 10% 11% 11% 43% 4% 5% 4% 4% 8% 23% 3% 2% 2% 7% 31% FoxN5 (NM_002158) FOXN3 (CHES1) (U68723) FOXN3 (CHES1) (NM_005197) FOXN4 (NM_213596) FOXN5 (FOXR1) (NM_181721) FOXN6 (FOXR1) (NM_198451) __________________________________________________________________________________________ Tabelle 1: Angabe der Aminosäureidentität der FoxN Proteine von Xenopus laevis und Homo sapiens in Prozent. Anmerkung: Fett gedruckte Zahlen zeigen die höchste Homologie zwischen dem Protein des Südafrikanischen Krallenfrosches und des Menschen. Die Ac. Nummern sind in Klammern angegeben. FoxN5 zeigt die höchste Sequenzübereinstimmung zu FOXN6 (FOXR1). Jedoch existiert vermutlich kein homologes Gen zu FOXN6 in Amphibien. Die Isoform FoxN3a, die im Vergleich ein zusätzliches kodierendes Exon enthält entspricht der Isoform des humanen CHES1 mit der Ac. Nummer (U68723). 67 3.2 Untersuchung der temporalen Expression der FoxN Gene in Xenopus laevis Die zeitliche Expression der FoxN Subklasse wurde mittels RT-PCR in den Stadien 1 bis 45 untersucht (Nieuwkoop und Faber, 1967). Dabei wurde das Haushaltsgen Ornithin Decarboxylase (ODC) als interne Kontrolle verwendet. FoxN2 ist bereits maternal vorhanden. Nach der Gastrulation verringert sich die Anzahl der Transkripte, steigt ab Stadium 30 aber wieder an und ist ebenso im Stadium 45 nachweisbar (Abb. 7). FoxN3 zeigt ein ähnliches Expressionsmuster wie FoxN2. Die für FoxN3 verwendeten Oligonukleotide wurden dabei so gewählt, dass die Isoformen FoxN3a und 3b als Duplex erkennbar, d.h. durch zwei diskriminierte Banden unterscheidbar sind. Bei der oberen Bande handelt sich es dabei um FoxN3a, die das zusätzliche Exon VI beinhaltet und daher in der Gelmatrix langsamer mobilisiert wird. FoxN4 ist maternal nicht transkribiert und erst nach der Midblastula Transition (MBT), d. h. mit Einsetzen der Transkription im Embryo, im Stadium 9 nachweisbar. Zwischen Stadium 11 und 15 ist im Vergleich zu späteren Stadien die Anzahl der Transkripte erniedrigt. Ab Stadium 15 ist der Transkriptionslevel von FoxN4 wieder erhöht und bleibt bis zum Stadium 45 stabil. Im Gegensatz dazu ist FoxN5 fast nur maternal exprimiert. Die Anzahl der Transkripte wird mit Beginn der Gastrulation stark reduziert (Abb. 7). Im Stadium 9 ist FoxN5 noch nachweisbar, wohingegen im Stadium 15 (Neurulastadium) FoxN5 bereits nicht mehr über RT-PCR detektierbar ist. __________________________________________________________________________________________ Abb. 7: Temporale Expressionsanalyse der FoxN Gene in Xenopus laevis. Die Analyse erfolgte über semiquantitative RT-PCR. Die PCR Produkte wurden über ein Ethidiumbromid-haltiges Agarosegel ausgewertet. Oben gezeigte Zahlen geben die Embryonalstadien an. Bestimmt wurden diese nach Nieukoop und Faber, 1967. Die rechte Spalte, durch – markiert, zeigen die Negativkontrollen unter Ausschluss von cDNA. Die unteren Banden zeigen die interne Kontrolle über das Haushaltsgen Ornithin Decarboxylase (ODC). Für die beiden Isoformen des FoxN3 Gens wurden die Oligonukleotid Primer so gewählt, das sie über dem Exon VI liegen. Damit kann zwischen einem größeren PCR-Produkt (FoxN3a) und einem kleineren (FoxN3b) unterschieden werden. Für die PCR der ODC wurde eine Zyklenzahl von 26, für die FoxN Gene eine Anzahl von 36 Zyklen gewählt. 68 3.3 Untersuchung der räumlichen Expression der FoxN Gene in Xenopus laevis Die räumliche Expression der FoxN Gene wurde mittel Whole Mount in situ Hybridisierung ermittelt (Harland 1991). Dabei wurden von allen FoxN Genen Digoxigenin markierte antisense Transkripte eingesetzt (siehe 2.8.1.2.3). Die frühste eindeutig nachweisbare Expression von FoxN2 ist in den Augenanlagen zu finden (hier nicht gezeigt). Im Stadium 26 ist bereits eine sehr intensive Färbung in dem sich entwickelnden Auge sichtbar (Abb. 8A). Im Stadium 29 sind darüber hinaus Transkripte in den Branchialbögen und im Gehirn erkennbar (Abb. 8B und 8C). Im Stadium 33/34 ist außerdem das unter der Ohrplacode liegende Vagalganglion angefärbt (Abb. 8B). Transversale Schnitte durch den Embryo zeigen, dass die Färbung im sich entwickelnden Auge auf die retinalen Vorläuferzellen beschränkt, jedoch keine Färbung im Linsenektoderm nachweisbar ist (Abb. 8D-G). Mit dem Beginn der Differenzierung der Retinazellen (siehe Abb. 8G, Transversaler Schnitt durch den Kopf eines Embryos im Stadium 36) ist nur noch eine schwache FoxN2 Expression in den lateralen Bereichen der Retina zu beobachten. Eine weitere Expressionsdomäne ist in transversalen Schnitten im Embryonalstadium 29 zu beobachten, in einer bisher nicht näher charakterisierten Zellschicht, die lateral zur ventrikulären Zone liegt (Abb. 8E). Diese Expressionsdomäne ist ebenso für das Maushomolog beschrieben, ebenso die Expression in den Branchialbögen (Triboli et al., 2002), was auf ähnliche Funktion der beiden Gene schließen lässt. Jedoch zeigt das homologe Gen der Maus keine Expression in der sich entwickelnden Retina. Da es sich bei dem beschriebenen Foxn2 um eine bisher nur in Maus beschriebene Spleißvariante handelt die zu einem C-terminalen verkürztes Protein führt (Ac. Nummer NM_180974, siehe 4.1), wäre es möglich das diese Variante nicht im retinalen Gewebe exprimiert wird. 69 __________________________________________________________________________________________ Abb. 8: Embryonales Expressionsmuster von FoxN2. (A) Im Stadium 26 lässt sich eine starke Expression im Auge nachweisen. (B) Vergrößerung des Kopfes eines Embryos im Stadium 33/34 zeigt ein spezifisches Expressionsmuster im Auge und im Vagalganglion (Pfeil). (C) Im Stadium 29 zeigt sich eine Anhäufung von FoxN2 Transkripten in den Neuralleistenbögen (Pfeile). (D-G) Transversale Schnitte durch die Kopfregion verschiedener Embryonalstadien. (D) Stadium 26. (E) Stadium 29. Der fette Pfeil zeigt FoxN2 positive Zellen nahe der Ventrikulären Zone, ähnlich den Expressionsmuster des Maushomologen (Triboli et al., 2002). (F) Stadium 33/34. (G) Stadium 36 zeigt FoxN2 Expression in den lateralen Bereichen der Retina. Die rote Linien in (B) und (C) zeigen die Schnittebenen der Schnitte (E) und (F). Kb: Kiemenbögen; L: Linse; R: Retina; Rh: Rhombencephalon; Retinale Schicht; Vg: Vagalganglion 70 In frühen Teilungsstadien sind FoxN3 Transkripte in der animalen Hälfte lokalisiert (Abb.9A) und während der Gastrulation über den gesamten Embryo mit Ausnahme der Zellen des Blastoporus verteilt (hier nicht gezeigt). Während der Neurulation ist die Hauptexpressionsdomäne in den Augenanlagen zu finden, und darüber hinaus, in zwei Streifen entlang des Neuralrohrs, in den Neuralleistenzellen (Abb. 9A und 9B). Ähnlich dem Expressionsmuster von FoxN2 sind FoxN3 Transkripte in den Branchialbögen, im Auge und im Vagalganglion zu finden (Abb. 9D). Ab Stadium 38 ist die Expression diffus über den ganzen Kopf verteilt (Abb. 9F). Der tranversale Schnitt durch den Kopf zeigt hierbei jedoch, dass sich die Expression besonders stark im Kopfmesenchym, welches haupsächlich den Neuralleisten entstammt, und in der sich entwickelnden Linse zu finden ist (Abb. 9F). __________________________________________________________________________________________ Abb. 9: Embryonales Expressionsmuster von FoxN3. (A) Transversaler Schnitt durch einen 8-zelligen Embryo zeigt eine Transkriptverteilung in der animalen Hälfte. (B) Dorsale Ansicht eines Embryos im Stadium 23. Eine intensive Färbung ist im Auge, und etwas schwächer in den Neuralleisten sichtbar, die als zwei Streifen entlang des Neuralrohrs liegen. (C) Seitenansicht eines Embryos im Stadium 26. (D) Laterale Ansicht zeigt FoxN3 spezifische Transkriptverteilung in den Neuralleistenbögen und im Vagalganglion im Stadium 29 (Pfeile). (D) Stadium 38 zeigt eine diffuse Färbung im Kopf. Jedoch zeigt der Transversale Schnitt eine Anhäufung von FoxN3 Transkripten in der Linse und dem Kopfmesenchym (F) (siehe Pfeile). Die rote Linie in (E) zeigt die Schnittebene des Schnittes (F). Kb: Kiemenbögen; Km: Kopfmesenchym; L: Linse; R: Retina; Vg: Vagalganglion 71 FoxN4 ist ähnlich dem beschriebenen Expressionsmuster des Foxn4 Gens der Maus vor allem in dem sich entwickelnden Auge zu finden (Gouge et al., 2001), und ebenso wie das Maushomologe beschränkt sich die Transkription im Auge deutlich auf retinales Gewebe (Abb. 10). Eine schwache Färbung als Nachweis von FoxN4 Transkripten ist im Stadium 18 in der Augenanlage sichtbar (Abb. 10A und 10B). Zwischen Stadium 21 und 26 ist die Expression im sich entwickelndem Auge verstärkt (Abb. 10C; D). Im Stadium 29/30 ist FoxN4 im Augenvesikel, im Mittelhirn und in den Nephrostomen des Pronephros zu finden (Abb.10E). Im sich entwickelnden Auge beschränkt ist die Expression auf die retinalen Vorläuferzellen begrenzt und ist in der Linsenplacode nicht feststellbar (Abb. 10H; I). Nach Stadium 30 verringert sich die Expression in den Nephrostomen und ist ab Stadium 33/34 dort fast nicht mehr sichtbar (Abb. 10F). In diesem Stadium beschränkt sich die Expression in der Retina auf die lateralen Bereiche. Im Stadium 38 der Embryonalentwicklung begrenzt sich diese dann auf einige wenige Zellen in der Peripherie der Retina. Dieser Bereich ist als „Ciliary Marginal Zone“ (CMZ) bekannt. Die CMZ stellt dabei einen retinalen Stammzellpool in Amphibien, Reptilien und Vögeln dar, jedoch nicht in Säugetieren (Perron und Harris, 2000). 72 ____________________________________________________________________________ Abb. 10: Räumliches Expressionsmuster von FoxN4. (A) Frontale Ansicht eines Xenopus laevis Embryos im Stadium 18. Eine schwache Expression von FoxN4 ist in den sich während der Augenentwicklung aufspaltenden Augenfeldern sichtbar. (B) Anteriorer Blick auf einen Embryo im Stadium 21 und im Stadium 23 (C). (D) Halblaterale Ansicht eines Embryos im Stadium 26. Es ist weiterhin eine intensive Färbung und damit starke Expression im Augenbecher zu beobachten. (E) Im Stadium 29/30 (Lateraler Blich auf den Embryo) ist die Expression im sich entwickelnden Auge weiterhin vorhanden. Zusätzlich zeigen sich noch zusätzliche FoxN4 Expressionsdomänen in den Nephrostomen des Pronephros (Urniere) und im Mittelhirn (siehe Pfeile). (F) Im Stadium 33/34 zeigt sich die Transkriptverteilung im Auge ringförmig um die Linse, d.h. in der sich differenzierenden Retina. Darüber hinaus zeigen mehrere Expressionsbereiche im Kopf. Die Expression in der sich entwickelnden Niere ist hingegen nahezu verschwunden. (G-I) Transversale Schnitte durch Embryonen im Stadium 26 (G), Stadium 33/34 (H) und Stadium 38 (I). (G) Die Expression erstreckt sich über den gesamten Augenbecher, der zukünftigen Retina. (H) Die Expression von FoxN4 erstreckt sich nur noch auf die lateralen Bereiche der Retina. Das Linsenektoderm zeigt keine Expression. (I) FoxN4 Transkripte sind nur noch in einem kleinem Zellbereich der Retina sichtbar, oberhalb und unterhalb der Linse gelegen, der so genannten „Ciliary Marginal Zone“. Die rote Linie kennzeichnet die Schnittebene in (H). CMZ: Ciliary Marginal Zone; L: Linse; Mh: Mittelhirn; N: Nephrostomen; RS: Retinale Schicht FoxN5 zeigt in der Whole Mount in situ Hybridisierung während frühen Teilungs- und Gastrulastadien ein ubiquitäres Expressionsmuster (hier nicht gezeigt). Postgastrulär ist keine Färbung mehr sichtbar, was mit dem zuvor untersuchten temporären Expressionsmuster korreliert. 3.4 Funktionelle Analyse des FoxN3 Gens in Xenopus laevis 3.4.1 Untersuchung des FoxN3 Gens über Funktionsverlustanalyse Die Injektion von sequenzspezifischem antisense Morpholino ist eine sehr effiziente und spezifische Technik, um einzelne Gene durch Funktionsverlust zu analysieren. So kann eine Fehlpaarung von vier Basenpaaren oder weniger in der 25 bp langen MorpholinoOligonukleotidsequenz (MO) bereits zum Verlust der Inhibierung führen. Dies bedeutet, dass auch in einer Genfamilie mit ähnlichen Sequenzen in der Regel selektiv die Translation einzelner Gene inhibiert werden kann. Ein weiterer Vorteil des MO ist dessen Persistenz. So wurde gezeigt, dass wenige Nanogramm eines Morpholinos bereits ausreichend sind, die Proteinsynthese von GFP-transgenen Xenopus tropicalis Embryonen bis im Stadium 40 komplett zu unterbinden (Nutt et al., 2001) 73 3.4.1.1 Morpholinobindungstest in vitro Um zu gewährleisten, dass die Translationshemmung alle Transkripte von FoxN3 erfasst, wurde die MO-Bindungsstelle so gewählt, dass sie mit dem Startcodon beginnt, was dem zweiten Exon entspricht. Die sequenzspezifische Wirkung des MO wurde durch ein GFPFusionskonstrukt gezeigt (Carl et al., 2002). Dabei wurden die ersten 300 bp der FoxN3 cDNA zur Erstellung eines Fusionskonstruktes in ein GFP/pCS2 Vektor kloniert. Eine Injektion von 0,5 ng RNA dieses FoxN3/ GFP-Fusionskonstruktes (FoxN3/GFP) wurde in beide Blastomeren im Zweizellstadium durchgeführt. Die Fluoreszenz wurde im Stadium 29-31 unter UV-Licht überprüft (Abb. 11). Eine Koinjektion dieser RNA mit 13 ng KontrollMorpholino-Oligonukleotid (Co-MO), abgeleitet von der Sequenz des humanen ß-Globin Gens, zeigt keine Verminderung der Fluoreszenz (Abb. 11D). Eine Injektion der gleichen Menge RNA mit 13 ng FoxN3-MO führt zu einer kompletten Translationsinhibierung wodurch die injizierten Embryonen keinerlei Fluoreszenz zeigten (Abb. 11F). Zur Kontrolle der Sequenzspezifität des Morpholino-Oligonukleotids wurde über PCR und Oligonukleotiden, die zu sieben stillen Nukleotid-Austauschen in der MO-Bindungsstelle führen, ein verändertes FoxN3/ GFP- Fusionskonstrukt (FoxN3Res/GFP) generiert, das jedoch zu einem identischen Protein führt (Abb. 11A). Eine Injektion von 0,5 ng RNA dieses Konstruktes führt ebenfalls zu einer starken Fluoreszenz (Abb. 11C), ebenso die Koinjektion mit Co-MO (Abb. 11E). Koinjektionen von 13 ng FoxN3-MO mit 0,5 ng RNA des FoxN3Res/GFP- Konstrukts zeigten jedoch keine Reduktion in der Intensität der Fluoreszenz (Abb. 11G). Durch die zusätzlichen Fehlpaarungen der Transkripte ist das MorpholinoOligonukleotid nicht mehr in der Lage sich an diese anzulagern. Dieses Ergebnis unterstreicht die Funktionalität und Selektivität des FoxN3-MO. 74 __________________________________________________________________________________________ Abb. 11: Untersuchung der Spezifität des FoxN3-Morpholino Oligonukleotids durch in vivo Translationsinhibierung eines FoxN3/GFP Fusionskonstruktes. 300 bp des kodierenden 5´Bereiches von FoxN3, beginnend mit dem Translationsstart, wurden vor ein GFP Plasmidkonstrukt kloniert (FoxN3/GFP). Als Kontrolle dazu wurden sieben stille Mutationen in die zur FoxN3-MO revers komplementären FoxN3 Sequenz eingefügt (FoxN3RES/GFP). Die RNA dieser Konstrukte wurde entweder alleine, oder mit FoxN3- bzw. Co-Mo in beide Blastomeren des Zweizellstadiums koinjiziert. Die Analyse der Embryonen erfolgte im Stadium 31 unter UV-Licht. (A) Die ersten 25 bp des translatierten Bereiches von FoxN3, die über das FoxN3-MO erkannt werden, darunter die mutierten Basen (rot) des FoxN3RES/GFP Konstrukts. (B, D, F) Laterale Ansicht der Embryonen, die mit 0,5 ng FoxN3/GFP RNA injiziert wurden. Links: normale Ansicht, rechts unter UV-Licht. (B) Die nur mit RNA injizierten Embryonen zeigen eine starke Fluoreszenz. (D) Die Koinjektion mit 13 ng Co-MO zeigt keinerlei Reduktion der Fluoreszenz. (F) Die Koinjektion mit 13 ng FoxN3-MO führt zu einer kompletten Translationsinhibierung der FoxN3/GFP RNA und damit zeigen diese Embryonen keine Fluoreszenz. (C, E, G) Laterale Ansicht der Embryonen Stadium 31, die mit 0,5 ng FoxN3 RES/GFP RNA injiziert wurden. (C) Injektion der FoxN3 RES/GFP RNA führt zu einer Fluoresenz der Embryonen. Die Koinjektion des CoMO führt erwartungsgemäß wie bei (D) zu keiner reduzierten Fluoreszenz, ebenso die Koinjektion von 13 75 ng FoxN3-MO, da die Translation des mutierten FoxN3/GFP Konstruktes nicht mehr durch das FoxN3MO inhibiert werden kann. 3.4.1.2 Untersuchung des bei Funktionsverlust von FoxN3 auftretenden Phänotyps bei Xenopus laevis Zur Untersuchung eines möglichen Phänotyps wurde FoxN3-MO dosisabhängig in eine oder beide Blastomeren des 2-Zellstadiums injiziert. Dabei diente bei unilateralen Injektionen die uninjizierte Seite als interne Kontrolle. Da die erste Zellteilung die Links-Rechts Achse festlegt, führen unilaterale Injektionen zu einem einseitigen Phänotyp. Die Verteilung der injizierten Moleküle lässt sich dabei durch Koinjektionen mit mRNA eines Fluoreszenzproteins oder eines Vitalfarbstoffes überprüfen. Als externe Kontrolle wurde vor allem bei bilateralen Injektionen eine Injektion von Co-MO in der gleichen Dosis, in Embryonen aus dem gleichen Gelege um etwaige unspezifische Missbildungen auszuschließen. Die Embryonen wurden dabei bis zum Stadium 48/49 kultiviert und ab Stadium 47 teilweise mit Algenpulver gefüttert. Die Überlebensrate der injizierten Embryos korrelierte dabei mit der verwendeten Dosis des FoxN3-MO (Abb. 12E). Während bei 1 ng pro Blastomere 91% der Embryonen überlebten, waren es bei 17 ng nur noch 31%. Bei 20 ng verstarben bis zum Stadium 48/49 alle Embryonen, die meisten während der Gastrulation, während über 90% der mit Co-MO injizierten Embryonen überlebten (nicht gezeigt). Bei der Injektion von 1ng FoxN3-MO konnten nahezu keine morphologischen Auffälligkeiten beobachtet werden (siehe Abb. 12E), die größte Anzahl von Embryonen mit morphologischen Besonderheiten konnte bei 13 ng FoxN3-MO beobachtet werden (siehe unten). Interessanterweise konnte dabei bis zum Stadium 39 keine Abweichung in der Entwicklung der FoxN3-MO injizierten Embryonen, gegenüber Co-MO injizierten Embryonen beobachtet werden. Die erste phänotypische Veränderung zeigt sich in einer Verkleinerung des Auges ab Stadium 39 (Abb. 12A, Stadium 41). Ab Stadium 43 sind darüber hinaus eine Reihe von schwereren Deformationen im Bereich des Kopfes sichtbar (Abb. 12B). Bis zum Stadium 48 zeigten sich des weiteren mehrere schwerere craniofaciale Missbildungen, einer teilweisen Fehlstellung der Augen, eine Verkleinerung des Gehirns und Ödeme in Kopf- und Rumpfbereich Abb. 12C). Eine unilaterale Injektion des FoxN3-MO führt zu einer einseitigen Deformation des Kopfskelettes mit einem verkleinerten Auge auf der injizierten Seite (Abb. 12D).Das Auszählen des Phänotyps erfolgte durch äußerliche Betrachtung der zuvor in MEMFA fixierten Embryonen. Dabei wurde der auftretende Phänotyp nach einem Augen- und einem craniofacialen 76 Phänotyp eingeteilt. Bei 13 ng pro Blastomere FoxN3-MO ist bei 89% der Embryonen im Stadium 48 eine Fehlbildung des Kopfskelettes festzustellen, während eine Reduktion des Auges nur in etwa 62% zu beobachten ist. Sowohl die Ausprägung des Augenphänotyps, als auch die Anzahl der betroffenen Individuen, konnte durch eine erhöhte Injektionskonzentration des Morpholinos nicht gesteigert werden. Die Anzahl der affektierten Embryonen nahm im Gegenteil sogar noch ab, vermutlich hervorgerufen durch die erhöhte Mortalitätsrate (Abb. 12E). Die parallel dazu durchgeführte Injektion mit KontrollMorpholino zeigte bei jeder verwendeten Dosis keinerlei Phänotyp. __________________________________________________________________________________________ Abb. 12: Qualitative und quantitative Analyse des FoxN3 Funktionsverlustes. Die Embryonen wurden entweder uni- oder bilateral mit Morpholino Oligonukleotid (13 ng/Blastomere) injiziert. (A) Vergleich von FoxN3-MO (rechte Seite) und Co-MO injizierten (linke Seite) Embryonen im Stadium 41. (Laterale Ansicht). Die Embryonen mit FoxN3 Funktionsverlust zeigen kleinere Augen, während der Rumpf keinerlei Veränderung aufweist. (B) Analyse der gleichen Embryonen im Stadium 43. Die mit KontrollMorpholino injizierten Embryonen entwickeln sich normal, während die mit FoxN3-MO injizierten Embryonen schwere Defekte aufweisen. So ist eine Endophtalmie der Augen sichtbar. Der Kopf ist teilweise deformiert. Teilweise haben die Embryonen Ödeme. (C) Vergrößerung des Kopfes eines bilateral mit je 13 ng FoxN3-MO injizierten Embryos (rechts) und eines Co-MO injizierten Embryos im Stadium 45 (dorsale Sicht). Der FoxN3-MO injizierte Embryo ist kleiner als der Kontrollembryo. Nasen-und Mundregion sind nach innen gestülpt. (D) Unilateral mit FoxN3-MO injizierter Embryo (Stadium 45, dorsale Sicht). Die linke Seite des Embryos entspricht dabei der injizierten Seite. Sowohl das Auge auch die Kopfskelettstruktur zeigt auf der betroffenen Seite eine klar sichtbare Reduktion. (E) 77 Balkendiagramm mit der Anzahl von Augen- und Kopfskelett Phänotypen im Verhältnis zur injizierten Menge von FoxN3-MO. Die angegebene Menge in Nanogramm entspricht der Menge pro Blastomere. Injiziert wurde bilateral in Zweizellstadien. Der Augen Phänotyp wird durch rote, der Kopfskelett Phänotyp durch blaue Balken angegeben. Die Nummern in den Klammern repräsentieren die Gesamtzahl der injizierten Embryonen, die Prozentzahlen die Überlebensrate. Ausgewertet wurden die Embryonen im Stadium 48. 3.4.1.3 Histologische Untersuchung und Markeranalyse des Augen-Phänotyps Um den beobachteten Augenphänotyp und dessen frühstes Auftreten auf molekularer Ebene zu charakterisieren, wurden die Expression der Augenmarkergene Pax6 und xRX in unilateralen FoxN3-MO injizierten Embryonen untersucht. Diese beiden Gene sind essentiell für die Augenbildung und sind bereits im frühen Augenfeld ab Stadium 12,5 exprimiert (Mathers et al., 1997; Chow et al., 1999). Die Injektion erfolgte zusammen mit 200 pg GFP mRNA um den Nachweis einer korrekten Injektion und eine Links/Rechts Selektion zu gewährleisten, die im Stadium 15 unter UV-Licht durchgeführt wurde. Die Fixierung der Embryonen wurde im Stadium 16 und 30 durchgeführt. Das räumliche Expressionsmuster der untersuchten Gene wurde mittels der Whole mount in situ Hybridisierung (WMISH) visualisiert. Die analysierten Embryonen zeigten weder im Stadium 16, noch im Stadium 30 eine Reduktion der xRX Expressionsdomäne im Auge (Abb. 13A; B). Ebenso konnte im Vergleich zur uninjizierten Seite keine Veränderung der Pax6 Expression im Auge, weder in der Expressionsstärke als auch in der Größe beobachtet werden (hier nicht gezeigt). Da die beiden genannten Markergene das frühe Augenfeld in Vertebraten festlegen und auch im Stadium 30, wenn bereits Differenzierungsprozesse im Auge stattfinden, keine Veränderungen der Expression dieser essentiellen Gene festzustellen war, kann davon ausgegangen werden, dass es sich bei dem Augenphänotyp um spätere Entwicklungsfehlsteuerungen handelt. Tatsächlich zeigte eine intensive visuelle Untersuchung von uni- oder bilateral injizierten Embryonen im Stadium 35, die bereits eine intensive Pigmentierung des dorsalen Auges aufweisen und daher hier leicht die Größe des sich entwickelnden Auges abschätzen lässt, keinerlei unterschiede zum Wildtyp (Abb. 13C). Erst ab etwa Stadium 39 lässt sich die Reduktion des Auges erkennen (Abb. 13D). Zur genauen Charakterisierung des Augenphänotyps in FoxN3 translationsinhibierten Embryonen wurden histologische Schnitte angefertigt. Dazu wurden Co-MO und FoxN3-MO injizierte Embryonen im Stadium 48 fixiert, geschnitten und mit Alcianblau/Kernechtrot bzw. H/E gefärbt. Die FoxN3-MO injizierten Embryonen zeigen dabei hinsichtlich ihres Aufbaus keinerlei morphologischen Unterschiede im Vergleich zu den Kontrollen (Abb. 13E; F). Zwar weisen Linse und Retina eine klare Reduktion auf, jedoch sind die retinalen Zellschichten, die 78 für die visuelle Wahrnehmung über ein Dutzend unterschiedlicher Zelltypen enthalten, klar erkennbar. Bei einer Quantifizierung der über die durch das Kernechtrot gefärbten Zellkerne (erfolgte durch einfaches Auszählen) zeigt sich eine Verminderung der Zellzahl in den einzelnen retinalen Schichten. Dies lässt den Schluss zu, dass FoxN3 nicht für die spezifische Differenzierung einzelner Zelltypen in der Retina verantwortlich ist, wie es beispielsweise für das Foxn4 Gen der Maus beschrieben ist (Li et al., 2004). Zu vermuten ist das FoxN3 in der Proliferation und/oder Apoptose von im Auge angesiedelten Zellen eine Rolle spielt (siehe 3.4.1.8). __________________________________________________________________________________________ Abb. 13: Histologische und molekularbiologische Untersuchung des Augenphänotyps in FoxN3 Funktionsverlust-Embryonen. 13 ng des FoxN3-MO wurden zusammen mit 200 pg uni- oder bilateral im Zweizellstadium injiziert. (A-B) Whole mount in situ Hybridisierung mit einer xRX Sonde. (A) Frontale Ansicht eines Embryos im Stadium 16. (B) Dorsale Ansicht eines Embryos im Stadium 30 mit vergrößerter Ansicht des linken und rechen Auges. Die injizierte Seite ist durch einen Stern gekennzeichnet. Es ist kein Unterschied in der Größe der xRX Expressionsdomäne zwischen injizierter und uninjizierter Seite erkennbar. (C, C´) Der Vergleich der sich entwickelnden Augen eines FoxN3-MO unilateral injizierten Embryos im Stadium 35 zeigt morphologisch keinerlei Auffälligkeiten. C zeigt die 79 Kontroll-, C´ die injizierte Seite. (D, D´) Der Vergleich der sich entwickelnden Augen eines FoxN3-MO unilateral injizierten Embryos im Stadium 39 zeigt eine klare Reduktion des Auges auf der FoxN3-MO injizierten Seite (D´). (E und F) Schnitte durch die Augen eines Alcianblau gefärbten Embryos im Stadium 48. Die Zellerne sind durch Kernechtrot rot gefärbt. (E) zeigt das Auge der uninjizierte Seite, (F) das der injizierten Seite. (F) Das durch denFoxN3 Funktionsverlust betroffene Auge ist kleiner als das der nicht injizierten Seite, zeigt aber einen normalen Aufbau. Die einzelnen Retinaschichten sind klar erkennbar und zeigen nur eine verringerte Zellzahl. Der schwarze Pfeil zeigt den Austritt des optischen Nervs aus dem Auge und zeigt damit die identische Schnittebene von (E) und (F) an. 3.4.1.4 Untersuchung der craniofacialen Strukturen bei FoxN3 Verlust Die Entwicklung von craniofacialen Elementen ist einer der komplexesten Prozesse in Vertebraten. Die Vielzahl von verschiedenen Knochen-und Knorpelelementen, Muskulatur innervierende Nerven sowie Blutgefäßen, die alle unterschiedlichen Ursprungs sind, setzt eine korrekte Signalgebung und Verarbeitung mannigfaltiger Signale voraus. Zur Analyse der Wirkungsweise von FoxN3 in diesen Prozessen war es notwendig, die bei FoxN3 Funktionsverlust betroffenen Strukturen zu bestimmen. Zur Untersuchung der sich entwickelnden Kiefer- und Kopfskelettstrukturen wurden Alcianblaufärbungen am ganzen Embryo oder an Gewebeschnitten durchgeführt. Die ab etwa Stadium 43 einsetzende Chondrofizierung des Craniums kann mittels Alcianblaufärbung sichtbar dargestellt werden. Dabei werden durch das Alcianbblau saure Polysaccharide, wie sie im Knorpelgewebe vorkommen, angefärbt. Zur Kontrastfärbung wird zumeist mit Kernechtrot gegen gefärbt. Diese histologische Analyse wurde an Embryonen Stadium 48 durchgeführt, da zu diesem Zeitpunkt die Verknorpelung bereits das gesamte Kopfskelett umfasst. Darüber hinaus sind im Stadium 48 die meisten Kieferelemente komplett ausgebildet, was deren Bestimmung und Analyse erleichtert. Verwendet wurden dazu im 2-Zellstadium uni- und bilateral mit Co-MO und FoxN3-MO injizierte Embryonen. Es zeigte sich dabei, dass der durch Morpholino induzierte FoxN3 Funktionsverlust dosisabhänig eine gravierende Auswirkung auf die Kieferentwicklung hat. Abbildung 14A zeigt einen bilateral mit CO-MO injizierten Embryo, und darunter (Abb. 14B) einen FoxN3-MO injizierten Embryo. Jeweils rechts davon das ist dazugehörige Schema mit den wichtigsten craniofacialen Knochenelementen zu sehen (Abb. 14B; C). Der durch FoxN3-MO Funktionsverlust hervorgerufene Phänotyp zeigt eine Reduktion des Meckel´schen Knorpels und des Infrarostralen, beides Skelettelemente, die aus dem ersten Neuralleistenbogen (Mandibularbogen) entspringen. Ebenso sind Kieferstrukturen betroffen, die aus dem Hyoidbogen, dem zweiten Neuralleistenbogen abgeleitet sind. Der Ceratohyale ist stark reduziert und deformiert, ebenso der Palatoquadrate. Die Augen, die normalerweise in das Kopfskelett eingebettet sind, sind bei Embryonen, die den Craniofacialphänotyp 80 zeigen, durch das reduzierte Kopfskelett über einen klar sichtbare Spalt von diesem getrennt und liegen frei. Die Kiemembögen, die aus dem dritten Neuralleistenbogen hervorgehen, sind ebenso leicht reduziert. Aber im Gegensatz zu den anterior gelegenen Strukturen sind diese nur leicht deformiert, und weisen in allen histologisch untersuchten Embryonen eine korrekte Lokalisation auf. Um diese Beobachtung zu verifizieren und die Deformationen der einzelnen Knochenelemente näher zu charakterisieren, was im 3-dimensionalen Embryo nahezu unmöglich ist, wurden histologische Schnitte desselben Stadiums angefertigt und mit Alcianblau gefärbt. Dabei ließ sich die zuvor an ganzen Embryonen beobachtete Invagination im Mund- und Nasenraum bestätigen (Abb. 14H), was offensichtlich mit einem Verlust der gesamten Nasenstruktur einhergeht. Beide Teile des Ceratohyalen sind durch einen breiten Spalt voneinander separiert und zeigen eine deutliche Fehlstellung. Meckel´scher Knorpel und Palatoquadrate weisen deutliche Reduktionen auf. Dieser Befund impliziert, dass FoxN3 eine essentielle Rolle bei der korrekten Ausrichtung und Ausbildung von jenen craniofacialen Knochenelementen spielt, die aus den Neuralleisten gebildet werden. Darüber hinaus zeigt sich ein Gradient in der Ausprägung des zu beobachtenden Phänotyps, der von anterior nach posterior abnimmt. So sind die Elemente des Mandibularbogens erheblich reduziert, während die Kiemenbögen, die aus dem dritten und vierten Neuralleistenbogens hervorgehen nur geringfügige Reduktionen aufweisen. 81 __________________________________________________________________________________________ Abb. 14: Histologische Analyse des craniofacialen Kopfskeletts von FoxN3 defizienten Embryonen. (A) Dorsale Ansicht eines Alcianblau gefärbten Embryos im Stadium 48. (B) Dazugehörige schematische Ansicht des craniofacialen Kopfskeletts. (C) Dorsale Ansicht eines bilateral FoxN3-MO injizierten und Alcianblau gefärbten Embryos im Stadium 48. (D) Dazugehörige schematische Ansicht des craniofacialen Kopfskeletts mit veränderten Knochenelementen. Frontale Sicht (E, G) und histologische Schnitte (F; H) von Co-MO (E, F) bzw. FoxN3-MO injizierten (G, H) und Alcianblau gefärbten Embryonen im Stadium 48. (F, H) Die FoxN3-MO injizierten Embryonen zeigen eine Einstülpung der olfaktorischen Region. Eine Reihe von craniofacialen Knochenelementen zeigen Deformationen oder sind reduziert. Die weißen Linien in den Abb. 14E und 14G zeigen die Schnittebene der Abb. 14F und 14H an. APS: Anteriores parachordales Skelett des Kopfes; Bh: Basohyale; C: Ceratohyale; D: Darm; Fo:Foramen olfactorium; G: Gehirn; I: Infrarostraler Knorpel; Kb: Kiemenbögen; M: Meckel´scher Knorpel; No: Notochord; P: Palatoquadrate; Ok: Ohrkapsel; PCQM: Processus cornu quadratus medialis; SBP: Suboculare Bügel des Palatoquadrate; Sf: Suboular fenestra; SP: Suprarostrale Platte; T: Trabecular; Ta: Tectum anterior; Te: Tentacular; VfP: Ventrolateralfortsatz des Palatoquadrate. 82 3.4.1.5 Analyse der Hirnnerven in FoxN3 Funktionsverlustphänotypen Die Hirnnerven, auch als Nervi craniales bezeichnet, entspringen paarweise dem Gehirn. In Säugern liegen zwölf dieser Nerven vor, die von rostral nach caudal mit römischen Ziffern bezeichnet werden. In Amphibien dagegen sind nur zehn craniale Nerven vorhanden. Der Nervus trochlearis (IV) und der Nervus accessorius (XI) fehlen. Die Hirnnerven innervieren überwiegend Teile des Kopfes und werden ihrer Natur nach sieben verschiedene Funktionen zugeordnet: Somatoefferent, allgemein viszoefferent (parasympathisch), speziell visceroefferent (branchiomotorisch), allgemein viszeroafferent, speziell viszeroafferent, allgemein somatoafferent und speziell somatoafferent. Eine Visualisierung der Hirnnerven von Xenopus laevis im Stadium 48 erfolgte mittels einer Antikörperfärbung durch den monoklonalen Neurofilament Antikörper 3A10 am ganzen Embryo (Speziale et al., 1995). Die FoxN3-MO injizierten Embryonen zeigten den kompletten Verlust des Nervus hypoglossus (XII), der in Säugern die Zunge innerviert, dessen Funktion aber im zungenlosen Xenopus laevis bisher unbekannt ist (Abb. 15B, ventrale Ansicht). Darüber hinaus sind mehrere Äste des Nervus trigeminus nicht vorhanden, wie der Nervus frontalis, oder reduziert, wie der Nervus maxillaris, der N. mandibularis und der N. nasocilliaris, die den Unterkiefer, das Antrum maxilliare, die Nasenhöhle und die Augen innervieren (Abb. 15C). Bei den Kontrollembryonen konnten dergleichen morphologische Abnormalitäten nicht beobachtet werden (Abb. 15B, D). 83 __________________________________________________________________________________________ Abb. 15: Untersuchung der Hirnnerven in FoxN3 defizienten Embryonen mittels Antikörperfärbung. Dreizehn Nanogramm FoxN3-MO wurden bilateral im Zweizellstadium injiziert. Die Analyse der Nerven erfolgte in ganzen Embryonen im Stadium 48 mittels eines gegen ein Neurofilamentprotein gerichteten monoklonalen Antikörper 3A10. (A) Ventrale Sicht auf einen FoxN3-MO injizierten Embryo. Der Nervus hypoglossus fehlt auf beiden Körperhälften. (B) Ventrale Ansicht auf einen Wildtyp Embryo. (C) Dorsale Sicht auf einen FoxN3-MO injizierten Embryo. Im Gegensatz zum Wildtyp Embryo ((D) dorsale Ansicht) sind eine Reihe cranialer Nerven fehlgeleitet oder reduziert. So fehlt der Nervus frontalis völlig, der N. maxilliaris und N. nasociliaris sind verkürzt. Die römischen Ziffern geben die cranialen Nerven von rostral nach caudal wieder. II: Nervus opticus; III: Nervus oculomotoris; V: Nervus trigeminus; fa: Nervus facialis; fo: Nervus frontalis; hg: Nervus hypoglossus; max: Nervus maxillare; md: Nervus mandibulare; nc: Nervus nasociliaris. 84 3.4.1.6 FoxN3 Funktionsverlust hat keinen Einfluss auf die Expression von Neuralleistenmarkergenen, jedoch auf den Mandibularmarker Xbap Um den genauen Zeitpunkt des beginnenden Defektes der Craniofacialentwicklung und damit den molekularen Mechanismus von FoxN3 aufzuklären, wurde eine Markeranalyse an uniund bilateralen FoxN3-MO injizierten Embryonen unterschiedlicher Entwicklungsstadien durchgeführt. Als Kontrolle dienten dabei Co-MO Injektionen (wie oben beschrieben). Bei allen Injektionen wurde GFP-mRNA koinjiziert. Da die beobachteten Craniofacialdefekte in Embryonen mit FoxN3 Funktionsverlust auffällig solche Elemente betreffen, die der Neuralleiste entstammen, wurden Whole mount in situ Hybridisierungen mit den Neuralleisten-spezifischen Transkriptionfaktoren FoxD3 (XFD6), AP2α, snail und slug durchgeführt. Für FoxD3 ist eine wichtige Rolle in der Neuralleistenentwicklung beschrieben (Pohl et al., 2001). Darüber hinaus zeigt der antisense Morpholino-Oligonukleotid vermittelte Funktionsverlust im Zebrafisch eine Missbildung von cranialen Knochenelementen (Lister et al., 2006). Snail und slug sind ebenso dafür bekannt, dass sie in der Migration und Spezifizierung von Neuralleistenzellen involviert sind. AP2α ist als essentieller Faktor für die Induktion von Neuralleistenzellen charakterisiert (Luo et al., 2003) und bei der Maus ist gezeigt, dass eine Inaktivierung des AP2α Gens zu craniofacialen Defekten führt (Schorle et al., 1996). Die Untersuchung der Embryonen erfolgte in den Stadien 23-32, in denen die Expression der genannten Neuralleistenmarkergene beobachtet werden konnte. Dabei zeigte sich jedoch, dass in allen untersuchten, unilateral FoxN3-MO injizierten Embryonen keine räumliche Veränderung der Expressionsdomänen der untersuchten Markergene zu beobachten war (Abb. 16 A-E). Um die Neuralleistenzellen in späteren Stadien zu analysieren, wurde Sox3 und mehrere Hox Gene zur in situ Hybridisierung verwendet. Dabei konnte ebenso keinerlei Veränderung der Expressionsdomänen von HoxB1 und HoxB3, die die posterioren Neuralleistenbögen markieren, festgestellt werden (hier nicht gezeigt). Erstaunlicherweise ist für HoxA2, das den Hyoidbogen markiert, ebenfalls keine Veränderung zu beobachten (Abb. 16F). Für HoxA2 ist, wie bereits erwähnt, beschrieben, dass eine Alternierung des Expressionsmusters in der Maus und Xenopus laevis so genannte homöotische Transformationen, d.h. eine Änderung des Hyoid- zum Hox- defizienten Mandibularbogen und umgekehrt, verursacht, je nachdem ein Funktionsverlust oder eine ektopische Expression des HoxA2 Gens vorliegt (Rijli et al., 1993; 85 Pasqualetti et al., 2000; Baltzinger et al., 2005). Eine solche Alternierung von Kieferelementen kann jedoch für FoxN3 anhand dieses Ergebnisses ausgeschlossen werden. Eine Missexpression von Sox3 konnte weder im Auge noch in den Neuralleistenbögen für FoxN3-MO injizierte Embryonen gezeigt werden (Abb. 16G). Jedoch zeigen diese Embryonen im Stadium 38 eine deutliche Reduktion der Expression von Xbap, einem Nkx Transkriptionsfaktor und Homologen des Drosophila Gens bagpipe. Ebenso ist die Expression des Xbap Paralogs zampogna (zax) stark reduziert (hier nicht gezeigt). Xbap ist posterior im Bereich des Magens und anterior in den Vorläuferzellen des Palatoquadrate sowie im lateralen Bereich des sich bildenden Meckel´schen Knorpels exprimiert. Zampogna (zax) hingegen ist in den Zellen zu finden, die den Infrarostralknochen bilden (Newman und Krieg, 2002). Die Expression von Xbap im Stadium 38 in FoxN3-MO injizierten Embryonen ist in der anterioren Kopfregion stark verkleinert (Abb. 16I). Im Stadium 43 ist die normale Expression im lateralen Bereich des sich entwickelnden Meckel`schen Knorpels der mit Co-MO injizierten Embryonen sichtbar, während die Expression in FoxN3-MO injizierten Embryonen punktuell beschränkt bleibt (Abb. 16K). Das Gleiche konnte auch für die Expressionsmuster von zax und goosecoid, die ein ähnliches Expressionsmuster im Kieferbereich wie Xbap besitzen (Newman et al. 2001), beobachtet werden (hier nicht gezeigt). Dies deutet darauf hin, dass FoxN3 nicht in die frühe Neuralleistenentwicklung involviert ist. Wahrscheinlich steuert FoxN3 aber sehr wohl die späte Wanderung einiger cranialer Neuralleistenzellen und/oder deren Zelldifferenzierung. 86 __________________________________________________________________________________________ Abb. 16: Untersuchung des FoxN3 Funktionverlustes auf die Neuralleistenzellen und frühen Kieferstrukturen. Embryonen wurden wie oben angegeben mit FoxN3-MO bzw. Co-MO und GFP RNA injiziert, nach links/rechts Injektion unter UV-Licht aussortiert und in den gewünschten Stadien mittels WMISH analysiert. Die Sterne markieren die Seite der FoxN3-MO Injektion. (A) Embryo im Stadium 23 mit FoxD3 Sonde hybridisiert. (B) mit AP2α, (C) mit snail in situ hybridisiert. (D und E) WMISH Analyse im Stadium 29. (D) AP2α. (E) snail. Die Expressionsdomänen der gezeigten Neuralleistenmarker zeigen weder einen Unterschied in der Größe der Expressionsdomäne, noch in ihrer Intensität. (F und G) WMISH Analyse unilateral FoxN3-MO injizierter Embryonen im Stadium 33/34 zeigt keinerlei Veränderung zwischen Kontroll- und FoxN3 Funktionsverlust Seite. (F) HoxA2. (G) Sox3. Die rechte Seite des Embryos entspricht der Injektionsseite. (H-K) WMISH Analyse des Kiefermarkers Xbap von bilateral FoxN3-MO Co-MO injizierten Embryonen der Stadien 38 und 43. (H) Xbap. Laterale Ansicht eines Co-MO injizierten Embryos im Stadium 38. (I) Xbap. Laterale Ansicht eines FoxN3-MO injizierten Embryos im Stadium 30. Die Expressionsdomäne in den Vorläuferzellen des Kiefers ist stark reduziert. (J) Expression von Xbap im Meckel´schen Knorpel (Pfeile). Ventrale Ansicht eines Co-MO injizierten Embryos im Stadium 43. (K) Xbap. Ventrale Ansicht eines FoxN3-MO injizierten Embryos im Stadium 43. Die Expression von Xbap beschränkt sich auf die lateralen Bereiche (siehe Pfeile). 87 3.4.1.7 Der Funktionsverlust von FoxN3 hat keine Auswirkungen auf die Neuralleistenzellwanderung Um die Möglichkeit einer eventuellen Fehlleitung von cranialen Neuralleistenzellen zu untersuchen, wurde ein so genanntes Zellmarkierungsexperiment durchgeführt. Dazu wurden Embryonen bilateral entweder mit Co-MO oder FoxN3-MO zusammen mit 200 pg mRNA des photokonvertierbaren Fluoreszenzprotein Eos-FP injiziert. Das unkonvertierte EosProtein fluoresziert grün. Wird energiereiches Licht ab einer Wellenlänge von etwa 395 nm auf einzelne Bereiche des grün fluoreszierenden Embryos geleitet, erfolgt eine dauerhafte Konformationsänderung des Proteins, was mit einer Emissionsänderung von grün nach rot einhergeht (Wiedenmann et al., 2005; Wacker et al., 2006). Diese konvertierten Zellen können nun hinsichtlich möglicher Wanderungsbewegungen untersucht werden. Die Embryonen wurden von der Injektion bis zur Photokonversion und danach bis zur endgültigen Analyse im Dunkeln gehalten um unerwünschte und unspezifische Photokonversion zu minimieren. Im Stadium 26 wurde ein Bereich des Mandibularbogens konvertiert (Abb. 17A; B) und anschließend im Stadium 46 untersucht (Abb. 17D; E. Abbildung 17C zeigt das Schema der wandernden Neuralleistenströme, 17D die resultierenden Knochenelemente). Die Kontrollembryonen zeigten dabei im Stadium 48 die zu erwartende rote Fluoreszenz im gesamten Meckel`schen Knorpel und in einigen „mitkonvertierten“ epidermalen Zellen (Abb. 17E). In den Embryonen mit Funktionsverlust von FoxN3 zeigt sich eine rot fluoreszierende Zellmasse, die dem lateralen Bereich des Meckel´schen Knorpels entspricht (Abb. 17D). Dies lässt den Schluss zu, dass die Migrationsbewegungen der betroffenen Neuralleistenzellen normal verlaufen, zumindest was die frühe und mittlere Migrationsphase betrifft. Des Weiteren kann auch über diese Experiment eine mögliche homöotische Zelltransformation ausgeschlossen werden, da die untersuchten Zellen die richtige Position im lateralen Bereich des Meckel´schen Knorpels erreichen und nicht anterior oder posterior davon zu finden sind. Dieses Ergebnis korreliert mit der zuvor durchgeführten Markergenanalyse (siehe Abb. 16). 88 ___________________________________________________________________________________________ Abb. 17: Analyse der Neuralleistenzellmigration in FoxN3 defizienten Embryonen. Embryonen wurden bilateral entweder mit FoxN3-oder Co-MO (13 ng) injiziert. Gleichzeitig wurde 200 pg RNA des photokonvertierbaren Eos-FP koinjiziert. Im Stadium 26 wurden Zellen des Mandibularbogens konvertiert. (A) Laterale Ansicht eines FoxN3-MO injizierten und konvertierten Embryo im Stadium 26. (B) Laterale Ansicht eines Co-MO injizierten und konvertierten Embryo im Stadium 26. Die konvertierten Zellen leuchten rot. (C) Schema der Neuralleistenzellwanderung im Stadium 26. Der angedeutete Ring zeigt das Gebiet der durchgeführten Photokonversion. (D) Ventrale Ansicht des konvertierten Embryos aus (A) im Stadium 46. Der FoxN3-MO injizierte Embryo zeigt einen unförmig deformierten Meckel´schen Knochen (rot fluoreszierende Zellen). (E) Ventrale Ansicht des konvertierten, Co-Mo injizierten Embryos aus (B) im Stadium 46. Der Meckel´sche Knorpel weist eine normale Struktur auf. Einzelne leuchtende Zellen in (D) und (E) in den anterioren Bereichen der Embryonen zeigen konvertierte epidermale Zellen. (F) Knochenskelettschema mit farbiger Kennzeichnung des Neuralleistenursprungs korrespondierend zu (C) (modifiziert nach Sadaghiani und Thiebaud, 1987; Balzinger et al., 2005). Mandibularbogen: rot; Hyoidbogen: gelb; anteriorer Kiemenbogen: grün; posteriorer Kiemenbogen: braun. Das schwarz umrandete Kästchen entspricht den in (D) und (E) sichtbaren Bereichen. C: Ceratohyale; K: Kiemenbögen; L: Linse; M: Meckel´scher Knorpel; P: Palatoquadrate. 89 3.4.1.8 Ein Funktionsverlust von FoxN3 führt zu vermehrter Apoptose Es sind mehrere Forkhead Gene beschrieben, die direkt oder indirekt in Zellzyklusprozesse wie Apoptose oder Zellproliferation involviert sind. Dies gilt insbesondere für FOXM1 und der FOXO Subklasse (Furukawa-Hibi et al., 2005; Luscher-Firzlaff et al., 2006; Costa, 2006;). Das humane FOXN3 Gen wurde dabei erstmals als Faktor entdeckt, der G2 Kontrollpunktdefekte in Zellzyklusmutanten von Saccharomyces cerevisiae überdecken kann und deren Letalität und übermäßige UV Sensitivität unterdrückt (Pati et al., 1997). Um zu testen, ob der bei dem Funktionsverlust von FoxN3 auftretende Phänotyp des kleinen Auges (siehe 3.4.1.3) durch einen eventuellen Zellzyklusdefekt hervorgerufen wird, sei es durch eine verminderte Proliferation oder einer Zunahme der Apoptose, wurde ein BrdU bzw. TUNEL Assay an unilateral Co-MO bzw. FoxN3-MO injizierten Embryonen durchgeführt, die mittels Koinjektion von GFP mRNA nach links/rechts aussortiert wurden. Im Stadium 24 konnte keine erhöhte Anzahl an apoptotischen Zellen in der FoxN3-MO injizierten Seite festgestellt werden (Abb. 18A, A’). Jedoch ist im Stadium 32 die Apoptoserate im Kopfbereich der FoxN3-MO injizierten Seite stark erhöht (Abb. 18B’). Da in späteren Stadien die tieferen Zellschichten für TUNEL bzw. Apoptose am ganzen Embryo unzugänglich sind, wurden die Untersuchungen an histologischen Schnitten durchgeführt. Im den Stadien 41 und 43 konnte in der sich entwickelnden Retina der FoxN3-MO injizierten Seite vermehrt Zellen detektiert werden, die in die Apoptose übergingen (Abb. 18C, E). Die quantitative Bestimmung erfolgte durch Auszählung apoptotischer Zellen aus 14 Gewebeschnitten von vier unilateral- FoxN3MO injizierten Embryonen im Stadium 41, respektive zehn Gewebeschnitte von vier Embryonen im Stadium 43. Dabei lag die Apoptoserate in den Augen der FoxN3-MO injizierten um 64% (Stadium 41) bzw. 65% (Stadium 43) höher als auf der uninjizierten Seite. Die unilateral mit der gleichen Menge Co-MO injizierten Embryonen zeigten keinen signifikanten Unterschied in der Apoptoserate im Vergleich zur uninjizierten Seite (hier nicht gezeigt). Zur Untersuchung der Proliferation wurden Gewebeschnitte von unilateral Co-MO bzw. FoxN3-MO injizierten Embryonen der Stadien 36-45 analysiert. Dabei konnten weder in frühen noch in späten Stadien der Kaulquappe signifikante Unterschiede in der Proliferation festgestellt werden (Abb. 18F-H). Im Stadium 45 sind die meisten Zellen der Retina bereits differenziert und zeigen keinerlei Zellteilung mehr. Eine Ausnahme davon stellt die Cilliary Marginal Zone (CMZ) dar. Dieser Zellbereich beinhaltet, wie bereits erwähnt, in Amphibien, Reptilien und Vögeln eine Art retinaler Stammzellen. Diese befindet sich im lateralen Bereich 90 um die Linse gelegen (Abb. 18G, H, lila Pfeile). Da jedoch sowohl in dem Auge der Kontrollseite als auch in dem der FoxN3-MO injizierten Seite BrdU-positive Zellen in diesem Bereich sichtbar sind, ist anzunehmen, dass es sich bei dem Augenphänotyp nicht um einen degenerativen Effekt handelt, der von einem Mangel an retinalen Stammzellen herrührt. Ob der zu beobachtende Kieferphänotyp in FoxN3-Funktionsverlust Embryonen ebenso seine Ursache in einer vermehrten Apoptose hat, konnte jedoch noch nicht geklärt werden, da zum einem ein TUNEL Assay an ganzen Embryonen später Stadien nicht möglich ist und zum anderen die Knorpelelemente in histologischen Schnitten in dieser Prozedur oft nicht stabil waren. Anhand dieser Resultate kann davon ausgegangen werden, das FoxN3 während der Embryogenese von Xenopus laevis das Überleben von Zellen steuert, jedoch keinen Einfluss auf deren Proliferation hat. __________________________________________________________________________________________ Abb. 18: FoxN3 Funktionsverlust führt zu einer erhöhten Apoptoserate. Embryonen wurden unilateral mit 13 ng FoxN3-MO oder Co-MO zusammen mit 200 ng GFP RNA injiziert und nach links/rechts selektiert. Die injizierte Seite ist durch einen Stern markiert. (A, A´) TUNEL Assay. Die linke, uninjizierte und rechte, FoxN3-MO injizierte Seite eines Embryos im Stadium 24 zeigen keinerlei Unterschiede hinsichtlich der Anzahl apoptotischer Zellen. (B, B´) TUNEL Assay eines unilateral FoxN3-MO injizierten 91 Embryos im Stadium 32 (laterale Ansicht des Kopfes). Die injizierte Seite zeigt eine erhöhte Anzahl apoptotischer Zellen, vor allem im Auge. (C, D und E) Im TUNEl Assay analysierte Gewebeschnitte eines unilateral- FoxN3-MO injizierten Embryos im Stadium 41. (C) Schnitt durch den Kopf. (D) Das Auge der uninjizierten Seite zeigt wenige apoptotische Zellen in der sich bildenden Retina. (E) Im Gegensatz dazu zeigt das Auge der FoxN3-MO injizierten Seite vermehrt apoptotische Zellen innerhalb und außerhalb der Retina. (F-H) Gewebeschnitte von unilateral mit FoxN3-MO injizierten und im BrdU Assay analysierten Embryonen. (F) Schnitt durch den Kopf eines unilateral FoxN3-MO injizierten Embryos im Stadium 39/40. Die Kontrollseite (links) zeigt keinen Unterschied in der Proliferationsrate im Vergleich zur injizierten Seite (rechts). (G und H) Gewebeschnitte durch das Auge eines unilateral FoxN3-MO injizierten Embryos. Die BrdU markierten Zellen zeigen die CMZ der Retina (rosa Pfeile). (G) Auge der uninjizierten Kontrollseite. (H) Das Auge der FoxN3-MO injizierten Seite ist im Vergleich zur Kontrollseite stark verkleinert. Jedoch zeigen sich ebenso BrdU positive Zellen in der CMZ. Ein verkleinertes Auge, hervorgerufen durch degenerativer Effekt mangels retinaler Stammzellen ist daher unwahrscheinlich. Die injizierte Seite ist mit einem Stern markiert. 3.4.1.9 FoxN3 interagiert mit dem Histondeacetylasekomplex (HDAC) Aktuell ist über die Regulationsmechanismen von FoxN3 wenig bekannt. Der erste Hinweis über die Funktion von FOXN3 (Ches1) lieferte die nachgewiesene Interaktion mit dem Sin3 Protein der Hefe (Scott und Plon, 2003). Sin3 ist ein hoch konserviertes eukaryotisches Gen, und wurde als Korepressor in vielen repressorischen Komplexen nachgewiesen, wie dem p53/Sin3 Komplex (Zilfou et al., 2001) oder in Verbindung mit Histondeacetylasen (Wolffe, 1996). Für die Histondeacetylasekomplexe I und II ist der Kofaktor Sin3 essentiell. Die HDACs katalysieren als Teil dieser Multienzymkomplexe die Abspaltung von Acetylgruppen insbesondere an Histonen (Verdone et al., 2006). Diese Deacetylierung führt zu einer Veränderung von Chromatinstrukturen, ein Prozess, der auch als Chromatinremodelling bezeichnet wird. Meist wird der Vorgang der Deacetylierung dabei mit Transkriptionsinaktivierung in Verbindung gebracht, da die Acetylabspaltung der positiv geladenen Lysinreste des Histons eine verstärkte Wechselwirkung mit den Phosphatgruppen der DNA ermöglicht und damit diese für die Transkriptionsmaschinerie unzugänglich macht. Es sollte hierbei die Frage geklärt werden, ob und in wie weit FoxN3 mit Komponenten der HDACs interagiert. Dazu wurde die Methode des Pulldown Assays angewendet (siehe 3.4.1.4), mit der Proteininteraktionen in vitro nachweisbar sind. FoxN3 und FoxN2 wurden zunächst als GST-Fusionsproteine rekombinant hergestellt. Zuerst wurde dabei eine Interaktion der beiden Isoformen von FoxN3 mit Sin3 von Xenopus laevis, das immerhin eine Übereinstimmung von 21% auf Aminosäureebene zum Hefehomologen aufweist, getestet. Ebenso wurde eine mögliche Interaktion mit dem Paralogen FoxN2 untersucht. Dabei zeigte sich, dass sowohl FoxN3a und FoxN3b, als auch FoxN2 in der Lage sind, an Sin3 zu binden (Abb. 19B). Da für mehrere Proteine der Mad Familie ein Bindungsmotiv für Sin3 beschrieben wurde (Van Ingen et al., 2003), wurden von FoxN3 N92 und C-terminale Bereiche als GST-Fusionsproteine hergestellt, d.h. Deletionsfusionskonstrukte generiert (Abb. 19A). Dabei konnte der Nachweis einer Interaktion von Sin3 an die C-terminalen Konstrukte erbracht werden, nicht jedoch für die Nterminalen Fusionsproteine (Abb. 19C). Ein Vergleich der Aminosäuresequenz von FoxN2 und FoxN3 zeigt sieben konservierte Sequenzbereiche, von denen sechs C-terminal von der Forkhead Domäne liegen. Der vorletzte Sequenzblock weist eine gewisse Homologie zu der für die Mad Proteine beschriebene Sin3 Bindungsstelle auf, und enthält ein EAAXXL Motiv, wobei X für eine beliebige Aminosäure steht (Abb. 19E). Tatsächlich zeigt ein ΔEAA Deletionsprotein von FoxN3b, dem 43 Aminosäuren am C-Terminus fehlen, keinerlei Bindung mehr im GST-Pulldown Assay (Abb. 19C). Da Sin3, wie bereits erwähnt, ein Korepressor in dem HDAC I darstellt, wurde ebenso eine mögliche Interaktion von FoxN3 bzw. FoxN2 mit der im HDAC I vorkommenden Histondeacetylase RPD3 untersucht. Dazu wurde versucht, eine mögliche Bindungsstelle für RPD3 im FoxN3 Protein zu lokalisieren. Dies geschah mit dem Ziel ein FoxN3 Deletionskonstrukt für die Injektion in Xenopus laevis Embryonen zu schaffen, dem diese Bindungsstelle fehlt. Interessanterweise erbrachte die Pulldown Analyse eine Interaktion der FoxN2/N3 Paraloge mit RPD3 (Abb. 15D). Ein mögliches Bindungsmotiv in dem für die Bindung verantwortlichen Nterminalen Bereiches von FoxN3 konnte jedoch nicht ermittelt werden. Es ist bekannt, dass Histondeacetylase Komplexe nicht direkt an die DNA binden können, sondern dies mittels Transkriptionsfaktoren geschieht. Die dem FoxN3 zugeschriebene Funktion als Suppressor könnte durch eine Rekrutierung von Komponenten des HDAC durch FoxN3 erfolgen, dieser Komplex wiederum an den Promotoren von FoxN3 Zielgenen binden und dort die Transkription unterdrücken. 93 ___________________________________________________________________________________________ Abb. 19: FoxN3 interagiert mit Komponenten des HDAC. (A) Schema der für die im GST-Pulldown verwendeten FoxN3 Deletionskonstrukte. Die schwarzen Rechtecke repräsentieren die Forkhead Domäne. Die Zahlen geben die Aminosäuren des Proteins an, ausgehend vom FoxN3b. (B) [35S] Methionin markiertes Sin3 Protein wurde mit GST-Fusionsproteinen von FoxN2 bzw. den beiden FoxN3 Isoformen inkubiert Der Pulldown Ansatz wurde auf einem 10%igen SDS-PAGE analysiert. Sowohl FoxN2 als auch FoxN3a und FoxN3b binden an Sin3. Pulldown Analyse von GST-FoxN3 Deletionsmutanten mit [ 35S] Methionin markiertem Sin3 Protein. Sin3 benötigt zur Bindung von FoxN3 dessen C-Terminus, nicht aber den N-Terminus. (D) RPD3 bindet an den N-Terminus von FoxN3. [ 35S] Methionin markiertes RPD3 Protein wurde mit GST-FoxN3 Deletionsproteinen inkubiert. Die ersten 134 Aminosäuren von FoxN3 sind ausreichend für die Bindung des RPD3. (E) Alignment von Aminosäuren der putativen Sin3 Bindungsstelle von FoxN2, FoxN3 und humanen Mad1 Protein zeigen ein konserviertes Aminosäuremotiv (siehe van Ingen et al., 2004). Konservierte Aminosäuren sind rot markiert. GST: GST-Protein als Negativkontrolle, der Input zeigt nur radioaktiv markiertes Protein als Kontrolle der gelungenen in vitro Translation. 94 3.4.2 Die Überexpression von FoxN3 zeigt keinen Einfluss auf die Embryogenese von Xenopus laevis Zur weiteren Untersuchung der Funktion des FoxN3 Gens wurden uni- bzw. bilaterale Injektionen von mRNA der beiden FoxN3 Isoformen im Zweizellstadium von Xenopus laevis durchgeführt. Dabei wurden bis zu 800 pg mRNA pro Blastomere injiziert. Weder die Überexpression von FoxN3a und FoxN3b alleine, noch in Kombination führten zu morphologischen Veränderungen während der Embryogenese. 3.4.3 Der Wildtyp kann bei FoxN3 Funktionsverlust durch Koinjektion von FoxN3 mRNA nicht wiederhergestellt werden Zur weiteren Spezifitätsanalyse des Funktionverlustes von FoxN3 wurde durch Koinjektion von FoxN3 mRNA versucht, den Wildtyp-Phänotyp wiederherzustellen, d.h. den Funktionsverlustphänotyp dadurch zu eliminieren. Dazu wurden stille Mutationen in die Morpholino-Bindungssequenz der FoxN3 Konstrukte eingefügt (siehe 3.4.1.1), so dass deren Translation durch das Morpholino-Oligonukleotid nicht inhibiert werden kann. Eine Injektion von 13 ng FoxN3-MO mit bis zu 1 ng FoxN3RES mRNA brachte nicht den gewünschten Erfolg, den Wildttyp-Phänotyp herzustellen. Eine mögliche Erklärung dürfte in dem späten Auftreten des FoxN3 Funktionsverlust Phänotyps ab Stadium 38 und in der geringen Halbwertszeit von mRNA liegen. Es ist anzunehmen, dass ein großer Teil der Injektions-RNA bis dahin degradiert ist. Im Kontrast dazu steht die bereits erwähnte Stabilität der Morpholinos. Dieses Problem könnte durch eine gezielte Lipofektion von FoxN3RES mRNA in spätere Embryonalsstadien eventuell behoben werden. 3.5 Funktionelle Analyse von FoxN2, FoxN4 und FoxN5 Alle Überexpressionsexperimente von FoxN2, FoxN4 und FoxN5 führten, wie die Injektion von FoxN3, zu keinerlei morphologischen Auffälligkeiten, und wurden daher nicht weiter analysiert. Funktionsverlustexperimente mittels Morpholino-Oligonukleotid des FoxN2 und Foxn4 Gens in Xenopus laevis brachte ebenfalls keinen Erfolg. Möglicherweise existieren noch weitere Isoformen dieser Gene, oder die Translation der entsprechenden Pseudoallele wird durch die Morpholinos nicht inhibiert. Denkbar wäre auch eine ungünstige Wahl der Sequenzen der Morpholinos. Eine Ausbildung möglicher Sekundärstrukturen kann die Effizienz des Morpholinos herabsetzen. Ein erneutes Funktionsverlustexperiment mit 95 eventuell 5´-bzw. 3´-„ansetzenden“ Morpholino-Oligonukleotiden könnte mehr Erfolg versprechen. Die Funktionsverlustanalyse des FoxN5 Gens erfolgt zurzeit. 3.5.1 Untersuchung des Promotors von FoxN4 FoxN4 ist während der Embryogenese neben weiten Teilen des sich entwickelnden Gehirns und den Nephrostomen des Pronephros vor allem in den retinalen Vorläuferzellen des Auges exprimiert. Nachweisbar sind FoxN4 Transkripte mittels WMISH ab Stadium 18. In diesem Stadium ist die Festlegung des Augenfeldes durch die frühen Homöoboxgene Pax6, Six3 und xRX bereits erfolgt. Diese Faktoren stellen die frühe Gen-Gruppe der Augenentwicklung dar. Sie determinieren die Zellen innerhalb des Augenfeldes, und legen damit deren weitere Entwicklung fest. Ein Verlust dieser Faktoren während der Embryonalentwicklung geht mit einem nahezu kompletten Ausbleiben von Augenstrukturen einher (Tsonis und Fuentes, 2006). FoxN4 ist aufgrund seiner vermeintlich späten Expression im Augenfeld (Pax6 ist dort ab Stadium 12,5 exprimiert, Chow et al., 1999) eher als spätes Augengen anzusehen. Mit der Funktionsanalyse des Foxn4 Gens in der Maus (Li et al., 2005, Li et al., 2006) konzentrierte sich die Untersuchung in dieser Arbeit auf die Analyse von Faktoren, die FoxN4 regulieren. Dazu wurde die Region –974/+31 des putativen FoxN4 Promotors in ein LuciferaseReportervektor (pGL3-Basic) kloniert (siehe 31.1.4). Im Zweizellstadium wurden bilateral je 50 pg DNA des FoxN4/pGL3 Konstruktes injiziert und die Embryonen im Stadium 25 in flüssigen Stickstoff schockgefroren. Als Kontrolle diente eine Injektion des pGL3-Basic Vektors, der mangels eines Minimalpromotors nur einen geringen Luciferaseumsatz aufweisen sollte. Es sollte untersucht werden, ob dieser von FoxN4 stromaufwärts gelegene DNA Abschnitt über die frühen Augenmarkergene Pax6, Six3 und xRX reguliert wird. Dazu erfolgte eine Koinjektion von je 400 pg mRNA und 50 pg Promotorkonstrukt pro Blastomere in Embryonen des gleichen Geleges. 96 __________________________________________________________________________________________ Abb. 20: Untersuchung des FoxN4 Promotors mittels Luciferase Assay. Die Promotorregion -974 bis +31 wurde in den pGl3-Basic Vektor kloniert. Hundert Picogramm DNA wurden entweder alleine oder mit 800 pg mRNA von Six3, xRX oder Pax6 koinjiziert. Als Kontrolle diente die Injektion des pGL3-Basic Vektors, der mangels eines eigenen Promotors nur einen geringen Transkriptionslevel aufweist. Die Analyse erfolgte im Embryonalstadium 25. Während Koinjektionen von Six3 bzw. xRX mRNA den Luciferaseumsatz mehr als verdoppeln, zeigt die Koinjektion von Pax6 keine Veränderung der Luciferaseaktivität. Im Luciferase Assay zeigte sich bei der Koinjektion von xRX und Six3 eine nahezu zweieinhalbfache Aktivität des FoxN4 Promotors im Vergleich zur Injektion ohne mRNA. Dies gilt nicht jedoch bei mRNA Koinjektion von Pax6 (siehe Abb. 20). Dieses Ergebnis ist ein Indiz dafür, dass Six3 und xRX die Transkription von FoxN4 positiv regulieren. Für Pax6 scheint dieser Promotorbereich keine responsiven Elemente zu enthalten. 97 4 Diskussion 4.1 Die FoxN Subklasse Die Forkhead Transkriptionsfaktoren entstammen einer umfangreichen Genfamilie, die in niederen eukaryotischen Organismen, wie der Hefe, ebenso zu finden sind wie auch im Menschen. Sie werden anhand der Konservierung ihrer DNA-Bindungsdomäne (Forkhead Domäne) in zahlreiche Unterklassen unterteilt. Gegenwärtig sind es neunzehn (A-S). In Wirbeltieren sind aktuell sechs Gene der Subklasse N der Forkhead Transkriptionsfaktoren bekannt. Im Rahmen dieser Arbeit konnten vier Gene dieser Subklasse in Xenopus laevis mittels Sequenzvergleichen, EST-Analysen, RACE und Screening von genomischen und cDNA Banken identifiziert werden. Die Mitglieder der Subklasse N lassen sich dabei in drei Untergruppen aufteilen: den FoxN1/4, den FoxN2/3 und den FoxN5/6 Paralogen (Katoh und Katoh, 2004b; Schuff et al., 2006). Wie bereits eingangs erwähnt, liegen die FoxN1/4 und die FoxN2/3 Paralogen phylogenetisch relativ eng beieinander. Im Gegensatz dazu stehen die FoxN5/6 Gene, die evolutionär so weit von den anderen Mitgliedern dieser Subklasse entfernt sind, dass sie zum Teil als eigene Subklasse geführt werden (FOXR1/2). Von FoxN3 konnten vier verschiedene Spleißvarianten gefunden werden, die zu zwei unterschiedlichen Proteinen führen, FoxN3a und FoxN3b. Beide besitzen eine große Homologie zu den humanen FOXN3 Proteinen und besitzen mehrere konservierte Bereiche außerhalb der Forkhead Domäne. Sogar das für FoxN3 gefundene Spleiß-Schema der beiden unterschiedlichen untranslatierten Leaderexons und des differenziell gespleißten Exon VI konnte in Mensch und Maus verifiziert werden. Die hohe Konservierung auf Gen- und Proteinebene lassen auf eine hohe Funktionsidentität zwischen dem humanen und dem Xenopus Gen schließen. Für ein hypothetisches FoxN1 Gen in Xenopus tropicalis konnten wichtige Anhaltspunkte für dessen Existenz gefunden werden, obwohl es nicht gelang, Transkripte davon zu isolieren. Keinen Hinweis für ein FoxN6 Gen in Xenopus erbrachten hingegen die EST- und Genomanalysen von Xenopus tropicalis. Interessanterweise scheint es sich bei dem monoexonalen FOXN6 um ein Retrotransposon des FOXN5 Gens zu handeln (Katoh and Katoh, 2004c; Schuff et al., 2006). Bei EST Vergleichen und genomischen Analysen konnten FOXN6 Homologe nur in den genannten Spezies gefunden werden, die der Klasse der Säugetiere angehören (Homo sapiens, Sus scrofa, Canis familiaris, Mus musculus, Rattus norvegicus). 98 Der Vergleich der Genloci von FOXN6/Foxn6 sowie Vergleiche von 5’- und 3’-gelegenen Genen in Maus und Mensch mit Danio rerio, Fugu rupides und Xenopus tropicalis, deren Genome nahezu vollständig sequenziert sind, lassen annehmen, dass sich das FOXN6 Gen möglicherweise evolutionär mit der Entwicklung der Säugetiere aus dem FOXN5 Gen bildete. 4.2 Das räumliche und zeitliche Expressionsmuster Mit Ausnahme von FOXN1 Homologen in Maus und Ratte ist diese Subklasse bisher unzureichend charakterisiert. Die vorliegende Arbeit sollte einen Beitrag liefern, ein besseres Verständnis der Funktion und der Regulationsmechanismen dieser Gene zu erlangen. Mittels RT-PCR konnte die zeitliche Expression dieser Gene während der Embryogenese von Xenopus laevis bestimmt werden. Dabei zeigte sich eine teilweise divergente zeitliche Expression. Während FoxN2 und FoxN3 während aller analysierten Stadien transkribiert werden, wird FoxN4 erst ab der MBT exprimiert. Konträr dazu ist die Expression von FoxN5, die fast ausschließlich maternal vorhanden ist und mit Beginn der Neurulation nicht mehr nachgewiesen werden kann. Durch Whole mount in situ Hybridisierung wurde die räumliche Expression der untersuchten Gene visualisiert. Außer FoxN5, das in prägastrulären Embryonen ubiquitär verteilt scheint, besitzen alle anderen FoxN Gene ein distinktes Transkriptverteilungsmuster. Jedoch zeigen die FoxN Gene dabei durchaus Überlappungen in ihren Hauptexpressionsdomänen (siehe Tabelle 2), was eventuell auch eine teilweise Funktionsredundanz bedeuten könnte. So weisen beispielsweise sowohl FoxN2 als auch FoxN4 eine starke retinale Genexpression während der Augenentwicklung auf. Interessanterweise fehlt die retinale Expressionsdomäne von Foxn2 bei dem Maushomologen ganz (Triboli et al., 2002). Ansonsten zeigt das Foxn2 Gen der Maus eine ähnliche räumliche Expression wie das Xenopus Homologe auf. Bei dem Sequenzvergleich von Maus zu Xenopus laevis konnte eine Differenz der Transkriptsequenz im 3’-Bereich nach der Forkhead Domäne festgestellt werden. Daraufhin durchgeführte EST Analysen führten zu zwei, durch alternatives Spleißen gebildeten unterschiedlichen Transkripten von Foxn2, wobei das zusätzliche gefundene Foxn2 Transkript eher dem FoxN2 des Xenopus laevis ähnelt. Möglicherweise zeigen beide Isoformen unterschiedliche Expression. Interessant ist vor allem, dass die beschriebene Isoform zu einem C-terminal verkürzten Protein führt, das wohl keine Interaktion mehr mit dem Korepressor Sin3 eingehen 99 kann, da die Bindungsstelle für Sin3 im C-terminalen Bereich der FoxN2/3 Paralogen liegen (siehe 3.4.1.9). Für FoxN3 wurde erstmalig die räumliche Expression eines FoxN3 Gens beschrieben. Vergleiche zu den Homologen in Mus musculus und Danio rerio sind daher nicht möglich. Die FoxN2/3 Gene zeigen neben den bereits erwähnten Ähnlichkeiten des temporären Profils auch ein ähnliches räumliches Expressionsmuster. FoxN4 Transkripte sind hauptsächlich im retinalen Ektoderm der sich entwickelnden Retina vorhanden, ähnlich der beschriebenen Homologen in Mus musculus und Danio rerio (Gouge et al., 2001). Eine weiteres, zeitlich wie räumlich klar abgegrenztes Expressionsfeld erstreckt sich auf die Nephrostomen des sich entwickelnden Pronephros, eine Exxpressionsdomäne, die bisher nur in Xenopus laevis beschrieben wurde (Schuff et al., 2006). Eine detaillierte Untersuchung der Rolle von FoxN4 in der Nierenentwicklung steht bisher jedoch noch aus. Tabelle 2: Wichtige Expressionsdomänen der FoxN Gene während der Embryogenese von Xenopus laevis. Gen Räumliches Expressionsmuster FoxN2 Auge (nur Retina); Gehirn; Kiemenbögen; Vagalganglion FoxN3 Animale Hälfte; Auge (v.a. Linse); Neuralleisten; Gehirn; Kiemenbögen; Vagalganglion; später diffus im ganzen Kopfbereich FoxN4 Auge (nur Retina); Pronephros; Gehirn FoxN5 Diffus, nur bis Ende Gastrulation 4.3 FoxN3 reguliert die korrekte Ausbildung des Auges und craniofacialen Elementen während der späten Embryogenese Die funktionellen Studien des humanen FOXN3 (CHES1) zeigen, dass dieses Gen eine noch nicht genau beschriebene Rolle als Zellzyklusregulator inne hat. Dennoch geben die gewonnenen funktionellen Ergebnisse nur einen geringen Einblick in die Wirkungsweise von FOXN3. Zwar konnten im Rahmen dieser Arbeit bei der FoxN3 Überexpression in Xenopus laevis keine phänotypischen Veränderungen festgestellt werden, jedoch konnte bei der 100 Injektion eines antisense Morpholino-Oligonukleotides eine Analyse der Wirkungsweise von FoxN3 über einen Funktionsverlust durch Translationsinhibierung erreicht werden. Mit FoxN3/GFP Fusionskonstrukten, sowie der Verwendung eines Kontrollmorpholinos konnte die Spezifität des verwendeten antisense Morpholino-Oligonukleotids dokumentiert werden. Während hohe Dosen (ab 20 ng/Blastomere im Zweizellstadium) ein Absterben der Embryonen vor und während der Gastrulation zur Folge hat, zeigen niedere Dosen bis in späte Entwicklungsstadien keine offensichtlichen Defekte. Danach scheint jedoch bei FoxN3 Funktionsverlust-Embryonen eine rapide Fehlentwicklung einzusetzen. So zeigen sich neben verkleinerten Augen, kleineren Gehirnen, massive Ödeme, die wahrscheinlich mit ein Grund für das Absterben aller FoxN3-MO injizierten Embryonen bis zum Stadium 49 sind. Ein gravierender Entwicklungsdefekt konnte in der Kieferentwicklung durch Reduktion und/ oder Fehlstellung von Kieferelementen festgestellt werden. Diese wurden über zahlreiche histologische Methoden detailliert beschrieben. Die Untersuchungen zeigten hinsichtlich der Kieferdeformationen eine Abstufung des Phänotyps. So konnte in den anterior gelegenen Knochenelementen (Meckel´scher Knorpel, Infrarostrale und Palatoquadrate) schwerwiegende Defekte ausgemacht werden. Die posterior gelegenen Kiemenbögen weisen dagegen nur eine geringe Reduktion auf. Da die meisten Anteile des Craniofacialskelettes ihren Ursprung in den Neuralleistenzellen haben und darüber hinaus FoxN3 im Neurulastadium von Xenopus laevis seine Expression hauptsächlich in den Augenanlagen zeigt, wurde eine eventuelle Auswirkung des FoxN3 Funktionsverlustes auf die Neuralleistenzellen durch eine Whole mount in situ Hybridisierung mit Neuralleistenspezifischen Markergenen (FoxD3, snail, slug, AP2α) im Stadium 23-32 untersucht. Überraschenderweise zeigten sich dabei weder Reduktionen noch Verlagerungen der Expression, ein wichtiges Indiz, für die bis dahin normale Entwicklung des Embryos. Ebenso zeigte sich in späteren Stadien keine Veränderung der Neuralleistenbögen. Dies wurde durch WMISH Analyse mehrerer anterior exprimierter Hox Gene sowie durch Sox3 bestätigt. Das Gleiche konnte ebenso für den Augenphänotyp in FoxN3 Funktionsverlustembryonen beobachtet werden. Markeranalysen mit xRX und Pax6, zweier für die Augenentwicklung essentieller Transkriptionsfaktoren, die ab Stadium 12,5 in der anterioren Neuralplatte das Augenfeld festlegen (Zuber et al., 2003), zeigen bis Stadium 30 keinerlei Reduktion des Augenfeldes. Dennoch ist ab Stadium 39 eine klare Reduktion der sich zu pigmentieren beginnenden Augen erkennbar. Der Craniofacialphänotyp konnte mittels einer in situ Hybridisierung auf die Nkx3 Gene Xbap und zax, sowie über goosecoid näher charakterisiert werden. Das zum Drosophila Gen 101 bagpipe homologe Xbap, sowie dessen Paraloges zax zeigen eine Expression in den sich entwickelnden Kieferstrukturen. Während zax überwiegend im Bereich des Infrarostralen exprimiert ist, kennzeichnet die Expression von Xbap im Kopfbereich vor allem den sich entwickelnden Meckel´schen Knorpel. Im Stadium 39 ist die vordere Expressionsdomäne von Xbap in FoxN3 defizienten Embryonen stark reduziert. Ebenso konnte für das Stadium 43 eine Reduktion der Expression auf laterale Bereiche beobachtet werden, d.h. der Meckel´schen Knorpel zeigt sich als unförmige Masse und wächst nicht mehr zur Mittellinie hin. Eine Reduktion der Expression der Kiefermarkergene goosecoid und zax konnte ebenfalls beobachtet werden. Dass die beobachteten Kieferabnormalitäten nicht aus aus einem Neuralleistenwanderungsdefekt resultieren, konnte schon über Markeranalysen gezeigt werden. Bestätigt wurde diese Ansicht durch Zellmarkierungsexperimente mit dem Fluoreszenzprotein Eos-FP, die beweisen, das die mandibularen Neuralleistenzellen bis zum Erreichen der Position des zukünftigen Unterkiefers normal migrieren. Mittels dieser Experimente konnte deutlich gemacht werden, dass FoxN3 unmittelbar und spezifisch in die späte Augenentwicklung bzw. frühe Kieferentwicklung eingreift. Inwieweit FoxN3 direkt die für die Kieferbildung obligaten Gene steuert oder indirekt auf die entsprechenden Zellen einwirkt, etwa über Apoptose (wie es wahrscheinlich im Auge der Fall ist, siehe 4.3), muss noch eingehend untersucht werden. Während es sich bei dem Augen- und Kieferphänotyp jedoch mit großer Sicherheit um primäre Effekte handelt, sind die beobachteten Teilverluste cranialer Nerven wahrscheinlich eher sekundäre Effekte, die aus dem Verlust bzw. der Fehlstellung der Kieferelemente resultieren. Ein Anhaltspunkt hierfür ist zum einen die doch unterschiedliche Qualität (Aufbau) der betroffenen Hirnnerven (siehe 3.4.1.5). Zum anderen sind vor allem die Hirnnerven betroffen, deren innervierte Bereiche ebenso deformiert sind. So sind der Nervus mandibularis, der den Unterkiefer innerviert, und der Nervus maxilliaris (Oberkiefer) ebenso reduziert wie Teile des Nervus ophtalmicus (Linse und Auge), während beispielsweise der Nervus facialis, der in Anuren den Musculus interhyoideus innerviert (Gradwell et al., 1972), nicht beeinträchtigt ist. Die RT-PCR Analyse von FoxN3 verdeutlicht die bereits früh vorhandene Expression. Dennoch bleibt die Rolle von FoxN3 in der frühen Embryogenese unklar. Zwar konnte gezeigt werden, dass hohe Dosen des Morpholino-Oligonukleotids bereits prägastrular letal sind, jedoch lassen sich unter diesem Schwellenwert keine weiteren und früher einsetzenden Entwicklungsstörungen generieren. Möglicherweise kann maternal gebildetes FoxN3 Protein, das bereits vor der Injektion des Morpholinos vorhanden ist, zumindest in der ganz frühen Entwicklung für eine relativ normale Entwicklung sorgen, bis der Proteinlevel durch 102 Degradation und Zellteilung unter einen für die Embryogenese kritischen Schwellenwert fällt. Vielleicht können in der frühen Embryogenese aber auch andere Faktoren die Funktion von FoxN3 übernehmen. Denkbar wären hierbei andere FoxN Gene. Vor allem das zu FoxN3 stark konservierte FoxN2 kommt hierzu in Betracht. Zu klären wäre diese Frage mit einem Funktionsverlust von FoxN2 durch ein antisense Morpholino-Oligonukleotid für FoxN2, bzw. einem Doppelfunktionsverlust beider Gene. 103 4.4 FoxN3 ist notwendig für das Überleben retinaler Zellen Der in FoxN3 Funktionsverlustanalysen vorliegende Augenphänotyp zeigt eine Reduktion der Augengröße ohne Verlust von Teilstrukturen des Auges. Es sind sowohl Linse als auch die Zellschichten der Retina vorhanden. Jedoch ist die Anzahl retinaler Zellen in Embryonen mit FoxN3 Funktionsverlust stark reduziert. Die Retina des Vertebraten Auges besteht aus Zellschichtungen, die ihrerseits zum Teil eine Vielzahl von Signal-verarbeitenden Zellen beinhalten. Diese sind nötig, um eine adäquate Aufnahme des photochemischen Reizes und der Signalverarbeitung zu gewährleisten. Knockout Studien des Foxn4 Gens in der Maus zeigten einen Verlust der Signal vermittelnden Amakrinen und Horizontalen Zellen (Li et al., 2004). Beide Zelltypen sind an der Verschaltung von den Signal empfangenden Photorezeptoren mit den Ganglienzellen beteiligt und bilden zusammen mit den Bipolaren Zellen die innere nukleäre Zellschicht. Diese ist bei Foxn4 -/- Mäusen stark reduziert. Dies lässt den Schluss zu, das Foxn4 essentiell für die Differenzierung einer weniger Zelltypen ist. Umgekehrt zeigen die histologischen Schnitte der Augenregion von FoxN3-MO injizierten Embryonen eindeutig eine Reduktion der Zellzahl in der Retina, jedoch ohne sichtbare Diskrepanz der Größe der einzelnen retinalen Zellschichten zueinander. Des Weiteren konnte über TUNEL Assays eine Steigerung der Apoptose im Auge, vor allem in der Retina festgestellt werden (Schuff et al., 2007). Die Auszählung apoptotischer Zellen in Augen von unilateral FoxN3-MO injizierten Embryonen ergab eine Steigerung von über 60% gegenüber der uninjizierten Kontrollseite. Dies könnte eine Erklärung für die Augenreduktion und die verminderte Anzahl retinaler Zellen sein. Die Verteilung apoptotischer Zellen erstreckt sich dabei über die gesamte Retina und ist nicht auf eine einzelne Zellschicht begrenzt, wie etwa für den Foxn4 Knockout beschrieben (Li et al., 2004). Als Schlussfolgerung daraus steuert FoxN3 vermutlich nicht nur die Genese eines Zelltyps, wie bei Foxn4, sondern generell das Überleben retinaler Zellen. Die TUNEL Analyse an ganzen Embryonen zeigt im Stadium 27 eine beträchtliche Zunahme der Apoptose im Auge von FoxN3-Funktionsverlust Embryonen, während in früheren Stadien keine erkennbare Veränderung zu sehen ist. Dieser Zeitpunkt der Veränderung ist insoweit spektakulär, als dass mit der Expression von Crystallinen, xProx1 und anderen Augengenen, der Zeitpunkt der Differenzierung des Auges festgelegt ist (Walter et al., 2004). Denkbar wäre, dass FoxN3 direkt oder indirekt Signale vermittelt. die entscheidend für den Differenzierungsprozess sind (siehe 4.4). Ein Verlust dieser Signale könnte für die Zellen bedeuten, nicht richtig differenzieren zu können und damit das Schicksal des programmierten 104 Zelltodes zu erleiden. Während für FoxN3 Funktionsverlust ein signifikanter Anstieg der Apoptoserate in der sich entwickelnden Retina festzustellen ist, zeigte sich bei der Untersuchung der Zellproliferation keine Veränderung in der Proliferationsrate. Da eine Zunahme der Apoptose auch in anderen Bereichen von Whole mount TUNEL Embryonen festzustellen war, könnte es durchaus sein, dass Apoptose auch eine Rolle bei der beobachteten Missbildung von Kieferelementen von FoxN3 Funktionsverlust betroffenen Embryonen spielt. Denkbar wäre, dass im Rahmen der Differenzierungsprozesse von Kieferbildenden Zellen, ähnlich den Retinazellen vermehrt Apoptose einsetzt. Ob dies tatsächlich der Fall ist und warum die anterioren Craniofacialelemente (Meckel´scher Knorpel, Infrarostraler Knochen) stärker betroffen sind als die posterioren (Kiemenbögen), sollte der Gegenstand weiterer Forschungsarbeit sein. 4.5 Ansätze eines Erklärungsmodells: FoxN3 als Repressor durch Vermittlung der HDAC Funktion? Wie bereits erwähnt, ist Sin3 aus Saccharomyces cervisiae in der Lage, humanes CHES1 zu binden. Das Sin3 Protein der Hefe weist eine relativ hohe Konservierung zu Sin3 in Xenopus und zu Sin3A und Sin3B Proteinen aus Mammaliern auf. Sin3 spielt bei der Transkriptionsinhibierung mittels Histondeacetylierung eine essentielle Rolle (Korhonen et al., 1998). Dabei nimmt Sin3 die Funktion als Korepressor in den HDACs ein. Dies geschieht über die PAH Domänen (paired amphipathic helix) von Sin3 (Le Guezennec, 2006). Über diese werden zahlreiche Proteine an den Histon Deacetylase Komplex rekrutiert (Ayer, 1999). Beispiele für diese Proteine sind SAP18 und SAP30, als auch RbAp46 bzw. 48. Für Sin3 ist eine Interaktion mit der Histondeacetylase RPD3, der Hauptkomponente des HDAC I und II bekannt. Eine Interaktion von Sin3 mit Forkhead Transkriptionsfaktoren wurde bereits für ein anderes Forkhead Gen, dem Foxk1 (MNF) in Maus beschrieben, das die Differenzierung von Myoblasten steuert (Yang et al., 2000). Für FoxN2/N3 konnte eine Bindung von Sin3 und ein dazugehöriges Bindungsmotiv im C-terminalen Bereich der Proteine gefunden werden. Die in dieser Arbeit gezeigte Bindung der N-terminalen Region von FoxN2/3 mit RPD3 in vitro ist ein wichtiges Indiz für die Interaktion von FoxN3 mit dem HDAC. Die Identifizierung von RPD3 als möglichem Interaktionspartner erlaubt es erstmals, eine Hypothese über die Funktion von FoxN3 zu erstellen. Tatsächlich ist es hinlänglich bekannt, 105 dass HDACs nicht direkt an DNA oder den korrespondierenden Histonproteinen binden können, sondern dafür Transkriptionsfaktoren benötigen (Wade, 2001). Denkbar wäre, dass FoxN3 einer der Modulatoren der Histondeacetylase Komplexe ist und diese an die Promotoren der bisher noch nicht identifizierten Zielgene von FoxN3 führt (siehe Abb. 21). Dabei wäre der C-terminale Bereich des Proteins für die Bindung des Sin3 verantwortlich, der N-terminale für die Bindung der Histondeacetylase RPD3. Ein weiteres erst kürzlich gefundenes Protein, das mit CHES1 interagiert, ist SKIP. Die Funktion von SKIP ist bisher nicht vollkommen geklärt. Bekannt ist, dass es im Notch Signalweg eine Rolle spielt (Zhou et al., 2000). Interessanterweise ist auch für SKIP, das als ein Bindeglied zwischen DNAbindenden Proteinen und aktivatorischen bzw. repressorischen Proteinen fungiert, eine Interaktion mit HDAC I beschrieben (Laduron et al., 2004). Eine Analyse von SKIP während der Embryogenese von Xenopus laevis erfolgt zurzeit. In den meisten Organismen ist ein Funktionsverlust der Histondeacetylase RPD3 früh letal (Mannervik und Levine, 1999; Lagger et al., 2002). Jedoch zeigen Studien einer RPD3 Mutation (hl1618, add) bzw. mit eines gegen RPD3 gerichteten antisense MorpholinoOligonukleotids im Zebrafisch trotz schwerer Defekte ein Überleben bis zum Tag 14 dpf (Yamaguchi et al., 2005; Pillai et al., 2004). __________________________________________________________________________________________ Abb. 21: Modell der Wirkungsweise des Transkriptionsfaktors FoxN3 auf die Genregulation. Dieser rekrutiert die Histondeacetylase RPD3 sowie dessen Korepressor Sin3, der seinerseits eine Reihe von HDAC-essentiellen Proteinen bindet. FoxN3 lagert sich mit dem HDAC an Promotoren Die Deacetylierung der Histonproteine durch RPD3 bedeutet eine Transkriptionsinhibition durch die stärkere Wechselwirkung von unmodifizierten Lysinresten der Histone und Phosphatgruppen der DNA. Ac: Acetylrest. 106 Unter anderem äußern sich die beschriebenen phänotypischen Defekte in einen Retina- und einem Skelettphänotyp. So fehlen diesen Embryonen der Meckel´sche Knorpel, Palatoquadrate, Ceratohyale, Kiemenbögen und die Brustflosse. Dabei sind Knochenelemente, die ebenso in FoxN3-MO injizierten Embryonen stark betroffen sind. Außerdem sind in der Retina Differenzierungsdefekte zu beobachten. Dies könnte ein weiteres Indiz für die Interaktion von RPD3 mit FoxN3 sein. Einen Erlärungsansatz für die erhöhte Apoptoserate in FoxN3-MO injizierten Embryonen liefert die Tatsache, das HDAC Inhibitoren, die unter anderem auch als Anti-Tumormittel bei der Krebsbekämpfung eine Rolle spielen, Apoptose induzieren (Lipinski und Jacks, 1999; Weidle und Grossmann, 2000). Zwar sind die genauen molekularen Vorgänge dabei bisher nur unzureichend erforscht, jedoch arretieren „normale Zellen“ im G2 Kontrollpunkt unter Applikation von HDAC Inhibitoren, während manche Krebszellen mitunter in der G1 Phase bleiben und differenzieren. Als gesichert kann jedoch gelten, dass die Inhibition des HDACs zu einer Aktivierung des CDK-Inhibitors WAF1 und letztendlich zu einer Signalkaskade führen, bei der zahlreiche Cycline inhibiert werden und das Tumorsuppressorprotein Rb hyperphosphoryliert wird und so verhindert, dass die Zellen in die S Phase eintreten. Die Zellen, bei denen keine Arretierung eintritt, gehen in die DNA Replikation (S Phase) über und erleiden das Schicksal des programmierten Zelltodes (Sandor et al., 2000). Dabei werden sowohl der extrinsinische Weg, d.h. durch Ligandenbindung an die so genannten Todesrezeptoren aus der Familie der TNF (Tumor Nekrose Faktoren, z.B. CD95), als auch der intrinsinische Weg der Apoptose (Freisetzung von mitochondralen Faktoren) eingeschlagen. Dass humanes FOXN3 (CHES1) in der Lage ist, in den Zellzyklus einzugreifen, zeigte sich bereits durch die Rekonstruktion G2 defizienter Hefestämme (Pati et al., 1997) und lässt damit den Schluss zu, dass FOXN3 in die Zellzyklusregulation über den G2 Kontrollpunkt involviert ist. 107 Daraus lässt sich ein hypothetisches Modell einer dualen Funktion von FoxN3 zeichnen. Sollte FoxN3 tatsächlich HDACs zu bisher noch nicht identifizierten Zielgenen transportieren, würde der Funktionverlust von FoxN3 in einigen Zellen einer Inhibition der HDAC Funktion gleichkommen (Abb. 22). Möglicherweise erhalten diese Zellen außerdem kein Signal zur G2 Arretierung, d.h. sie verhalten sich nicht wie eine „normale“ Zelle, sondern ähnlich einer Krebszelle. Denkbar wäre eine frühzeitige Differenzierung oder ein Übergang in die S Phase mit der Folge, dass diese Zellen das Schicksal des programmierten Zelltodes erleiden. Dies würde die Beobachtung einer erhöhten Apoptoserate in Embryonen mit FoxN3 Funktionsverlust erklären. __________________________________________________________________________________________ Abb. 22: Modell der möglichen dualen Wirkungsweise des Transkriptionsfaktors FoxN3 auf den Zellzyklus. Die Inhibierung der HDAC Funktion leitet bei einer normalen Zelle einen G2 Arrest ein (A). (B) Eine mögliche Interaktion von FoxN3 am G2 Kontrollpunkt (Pati et al., 1997) führt bei FoxN3-MO Applikation eventuell zu einem Zellzyklusstopp im G1 oder zum Einleiten der S-Phase mit anschließender Apoptose, ähnlich dem Verhalten von Krebszellen (modifiziert nach Biel et al., 2005). Die bei FoxN3 postulierte HDAC Inhibition resultiert daraus, dass HDAC ohne FoxN3 nicht mehr an die DNA binden kann. Der Doppelverlust der HDAC Funktion und der Kontrolle des G2 Kontrollpunktes lässt die Zelle in die Apoptose übergehen. 4.6 Six3 und xRX regulieren den Promotor von FoxN4 In der jüngsten Zeit konnte über Knockout Analysen in Mus musculus die Notwendigkeit des Foxn4 Gens für die Entwicklung von Amakrinen und Horizontalen Zellen gezeigt werden (Li et al., 2004; Li et al., 2005; Fujitani et al., 2006). Diese Zellen sind essentiell für die Erregungsleitung und Verschaltung von den Photorezeptoren hin zu den Ganglienzellen. 108 Neben Foxn4 sind einige Faktoren bereits bekannt, die notwendig für deren Genese sind. So zeigt der Verlust der beiden Faktoren Math3 und NeuroD über Knockout Studien einen kompletten Verlust an Amakrinen Zellen. Jedoch sind diese Faktoren allein nicht ausreichend, so bedarf es zusätzlicher Faktoren wie Pax6 und Six3 (Inoue et al., 2002), die offensichtlich nicht nur die frühe Augenentwicklung, sondern auch eben die Differenzierung dieser Zellen steuern. Ebenso spielen Prox1, Pax6 und Six3, eine wichtige Rolle bei der Entwicklung Horizontaler Zellen (Markitantova et al., 2004). Über die Regulation der FoxN4 Gene ist bisher nichts beschrieben. Die im Rahmen dieser Arbeit durchgeführte Untersuchung des FoxN4 Promotors zeigt eine Stimulation des Bereiches von –974 bis +31 des FoxN4 Gens durch Koinjektion von Six3 mRNA bzw. xRX mRNA, jedoch nicht durch Pax6. Dass Six3 positiv den FoxN4 Promotor reguliert, korreliert mit der oben erwähnten Notwendigkeit von Six3 zur Entwicklung jener Zelltypen in der Maus, deren Entwicklung auch durch Foxn4 positiv gesteuert wird. Dies ist ein erster Ansatz zur Untersuchung der Regulation von FoxN4. Jedoch sind noch weitere Experimente nötig, um die putativen Six3 und xRX responsiven Elemente des FoxN4 Promotors näher zu charakterisieren. 4.7 Aussichten Für FoxN3 sind für die Zukunft Untersuchungen geplant, die dessen Rolle im Zellzyklus und bei der Aufrechterhaltung der Zellhomöostase aufklären sollen. Dazu sollen über Funktionsverlust von FoxN3 mittels RT-PCR eine Reihe von Zellzyklusgenen analysiert werden. Nach Möglichkeit sollen direkte Zielgene von FoxN3 bestimmt werden. Besonderes Augenmerk gilt dabei der Interaktion von FoxN3 mit den Histondeacetylasen. Über ein GAL4 Reporter/Vektorsystem oder Promotorstudien, Chromatin-Immunopräzipitationen, sowie über weitere Pulldown Experimente sollen die Interaktion von Komponenten des HDACs mit FoxN3 näher charakterisiert werden. Im Vergleich dazu sollen Funktionsanalysen der anderen Mitglieder dieser Subklasse erfolgen, und dabei gezielt Unterschiede und Gemeinsamkeiten in Funktion und Wirkungsweise dieser Gene ermittelt werden. 109 5.1 Zusammenfassung Die vorliegende Arbeit beschreibt die Identifizierung und Charakterisierung von Forkhead Transkriptionsfaktoren der Subklasse N in Xenopus laevis. Es wurden vier Gene dieser Subklasse identifiziert und deren räumliches und temporäres Expressionsmuster während der Embryogenese bestimmt. Für FoxN3, dem Homologen zum humanen CHES1, konnte über eine antisense MorpholinoOligonukleotid vermittelte Translationsinhibierung in vivo die Funktion während der Embryonalentwicklung untersucht werden. Der Funktionsverlustphänotyp zeigte Verkleinerungen der Augen und des Gehirnes, einen teilweisen Verlust von Hirnnerven, ein ödemisches Erscheinungsbild, sowie eine weit reichende Missbildung des craniofacialen Skelettes, die mit Reduktion und Fehlstellung von Kieferelementen einhergeht. Diese auftretenden Defekte wurden mittels histologischer und immunohistologischer Techniken detailliert analysiert. Über Markergenanalysen und Untersuchungen der Zellwanderung mittels Zellmarkierungsexperimente konnte gezeigt werden, dass die craniofaciale Missbildung spezifisch ist und nicht durch Fehlsteuerung der Neuralleistenzellen, welche die Kiefer ausbilden, verursacht ist, sondern die beschriebenen Defekte erst bei der Ausbildung der craniofacialen Elemente einsetzt. Inwieweit FoxN3 in die Regulation des Zellzyklus involviert ist, wurde mittels BrdU-und TUNEL Assays untersucht. Während ein FoxN3 Funktionsverlust keinen sichtbaren Einfluss auf die Zellproliferation hatte, konnte, besonders im sich entwickelnden Auge, ein erheblicher Anstieg der Apoptose festgestellt werden. In Pulldown Analysen wurde gezeigt, dass FoxN2 bzw. FoxN3 mit dem Korepressor Sin3 und der Histondeacetylase RPD3 eine Wechselbeziehung eingehen. Die putative Bindungsstelle von Sin3 an das FoxN3 Protein konnte über entsprechende Deletionsmutanten von FoxN3 identifiziert werden. Die in der vorliegenden Arbeit erzielten Ergebnisse weisen darauf hin, dass FoxN3 neben Sin3 und RPD3 als Bestandteil der Histondeacetylase Komplexe I und II dient. Eine Funktionsanalyse von weiteren Genen der FoxSubklasse N soll mögliche gemeinsame Regulationsmechanismen offenlegen und damit zu einer weiteren Aufklärung ihrer Funktion während der Embryonalentwicklung beitragen. 110 5.2. Summary This present report describes the identification und characterisation of Xenopus forkhead transcription factors of subclass N. Four genes of this subclass were identified and their temporal and spatial expression patterns were examined during the embryogenesis of Xenopus laevis. FoxN3, the homologue of the human CHES1 gene, was analysed during embryogenesis by blocking the translation process of its mRNA by using an antisense morpholino olignucleotide. The loss of function phenotype shows reduced eyes and brain, a partial loss of cranial nerves, an oedemic appearance and, moreover, severe defects of the craniofacial skeleton. The craniofacial defects imply a reduction and delocalisation of jaw elements. These defects were analysed in great details by using histological and immunohistologicals methods. By in situ hybridisation of marker genes and by cell lineage labelling assays it was shown that the craniofacial abnormalities were not due to misregulation of neural crest migration, but to a failure of jaw formation. The role of FoxN3 in the regulation of cell cycle was investigated by BrdU-and TUNEL assays. While the loss of FoxN3 function did not reveal any difference in the rate of cell proliferation, an increase of apoptotic cells, especially in the developing eye, was observed. Pull-down assays revealed that FoxN2 and FoxN3 can interact with the corepressor Sin3 and the histonedeacetylase RPD3. The putative Sin3 binding site of FoxN2/3 proteins was identified by using FoxN3 deletion mutants. These results indicate that not only Sin3 and RPD3 but also FoxN3 might be a component of the histonedeacetylase complexes I and II. Functional analysis of additional FoxN genes might reveal common regulatory mechanisms. Such a comparison will be useful for a better understanding of their function during embryogenesis. 111 6 Literaturverzeichnis Adriani, M., Martinez-Mir, A., Fusco, F., Busiello, R., Frank, J., Telese, S., Matrecano, E., Ursini, M.V., Christiano A.M. und Pignata C. (2004). Ancestral founder mutation of the nude (FOXN1) gene in congenital severe combined immunodeficiency associated with alopecia in southern Italy population. Ann. Hum. Genet. 68 (Pt 3): 265-268 Aoki, Y., Saint-Germain, N., Gyda, M., Magner-Fink, E., Lee, Y.H., Credidio, C. und SaintJeannet, J.P. (2003). Sox10 regulates the development of neural crest-derived melanocytes in Xenopus. Dev. Biol. 259 (1): 19-33 Ayer, D.E. (1999). Histone deacetylases: transcriptional repression with SINers and NuRDs. Trends Cell Biol. 9 (5): 193-198 Balciunaite, G., Keller, M.P., Balciunaite, E., Piali, L., Zuklys, S., Mathieu, Y.D., Gill, J., Boyd, R., Sussman, D.J. und Hollander, G.A. (2002). Wnt glycoproteins regulate the expression of FoxN1, the gene defective in nude mice. Nat. Immunol. 3 (11): 1102-1108 Baltzinger, M., Ori, M., Pasqualetti, M., Nardi, I. und Rijli, F.M. (2005). Hoxa2 knockdown in Xenopus results in hyoid to mandibular homeosis. Dev. Dyn. 234 (4):858-867 Bang, A.G., Papalopulu, N., Goulding, M.D., Kintner, C. (.1999).Expression of Pax-3 in the lateral neural plate is dependent on a Wnt-mediated signal from posterior nonaxial mesoderm. Dev. Biol. 212 (2): 366-380 Barr, F.G. (1997). Fusions involving paired box and fork head family transcription factors in the pediatric cancer alveolar rhabdomyosarcoma. Curr. Top. Microbiol. Immunol. 220: 113-129 Barr, F.G. (2001). Gene fusions involving PAX and FOX family members in alveolar rhabdomyosarcoma. Oncogene 20 (40): 5736-5746 Beauvais-Jouneau, A., Pla, P., Bernex, F., Dufour, S., Salamero, J., Fassler, R., Panthier, J.J., Thiery, J.P. und Larue, L. (1999). A novel model to study the dorsolateral migration of melanoblasts. Mech. Dev. 89 (1-2): 3-14 Biel, M., Wascholowski, V. und Giannis, A. (2005). Epigenetik – ein Epizentrum der Genregulation: Histone und histonmodifizierende Enzyme. Angewandte Chemie, Wiley-VHC Verlag. 117 (21): 3248-3280 Birnboim, H.C. und Doly, J. (1979). A rapid alkaline extraction procedure for screening recombinant plasmid DNA. Nucleic Acids Res. 7 (6): 1513-1523 Bleul, C.C., Corbeaux, T., Reuter, A., Fisch, P., Monting, J.S. und Boehm, T. (2006). Formation of a functional thymus initiated by a postnatal epithelial progenitor cell. Nature 441 (7096): 992-996 112 Borchers, A., David, R. und Wedlich, D. (2001). Xenopus cadherin-11 restrains cranial neural crest migration and influences neural crest specification. Development 128 (16): 3049-3060 Brennan, R.G. (1993). The winged-helix DNA-binding motif: another helix-turn-helix takeoff. Cell 74 (5): 773-776 Cao, Y., Knöchel, S., Oswald, F., Donow, C., Zhao H. und Knöchel W. (2006). XBP1 forms a regulatory loop with BMP-4 and suppresses mesodermal and neural differentiation in Xenopus embryos. Mech. Dev. 123 (1): 84-96 Carl, M., Loosli, F. und Wittbrodt, J. (2002). Six3 inactivation reveals its essential role for the formation and patterning of the vertebrate eye. Development 129 (17): 4057-4063 Carl T.F., Dufton, C., Hanken, J. und Klymkowsky, M.W.(1999). Inhibition of neural crest migration in Xenopus using antisense slug RNA. Dev. Biol. 213 (1): 101-115. Carlsson, P. und Mahlapuu, M. (2002). Forkhead transcription factors: key players in development and metabolism. Dev. Biol. 250 (1): 1-23 Chang, C., Hemmati-Brivanlou, A. (1998). Neural crest induction by Xwnt7B in Xenopus. Dev. Biol. 194 (1): 129-134 Chang, J.T., Wang, H.M., Chang, K.W., Chen, W.H., Wen, M.C., Hsu, Y.M., Yung, B.Y., Chen, I.H., Liao, C.T., Hsieh, L.L. und Cheng, A.J. (2005). Identification of differentially expressed genes in oral squamous cell carcinoma (OSCC): overexpression of NPM, CDK1 and NDRG1 and underexpression of CHES1. Int. J. Cancer 114 (6): 942-949 Chatterjea-Matthes, D., Garcia-Ojeda, M.E., Dejbakhsh-Jones, S., Jerabek, L., Manz, M.G., Weissman, I.L. und Strober, S. (2003). Early defect prethymic in bone marrow T cell progenitors in athymic nu/nu mice. J. Immunol. 171 (3): 1207-1215 Chow, R.L., Altmann, C.R., Lang, R.A., Hemmati-Brivanlou, A. (1999). Pax6 induces ectopic eyes in a vertebrate. Development 126 (19): 4213-4222 Clark, K.,L., Halay, E.,D., Lai, E., und Burley, S.K. (1993). Cocrystal structure of HNF3/forkhead DNA recognition motif resembles histone H5. Nature 364: 412-420 Costa, R.H. FoxM1 dances with mitosis. (2005). Nat. Cell Biol. 7(2): 108-110 Depew, M.J., Lufkin, T. und Rubenstein, J.L. (2002). Specification of jaw subdivisions by Dlx genes. Science. 298 (5592): 381-385 Dreyer, T.F. (1915). The morphology of tadpole of Xenopus laevis. Trans. Roy. Soc. South Africa 4: 241-258 Dugaiczyk, A., Boyer, H.W. und Goodman, H.M. (1975). Ligation of Eco RI endonucleasegenerated DNA fragments into linear and circular structures. J. Mol. Biol. 96: 171-176 113 Edgeworth, F.H. (1930). On the masticatory and hyoid muscles of larvae of Xenopus laevis. J. Anat. 64: 184-188 Eickbush, T.H. und Moudrianakis, E.N. (1978). The compaction of DNA helices into either continuous supercoils or folded-fiber rods and toroids. Cell 13 (2): 295-306 Frohman, M.A., Dush, M.K. und Martin G.R. (1988). Rapid production of full-length cDNAs from rare transcripts: amplification using a single gene-specific oligonucleotide primer. Proc. Natl. Acad. Sci. U S A 85 (23): 8998-9002 Fujitani, Y., Fujitani, S., Luo, H., Qiu, F., Burlison, J., Long, Q., Kawaguchi, Y., Edlund, H., Macdonald, R.J., Furukawa, T., Fujikado, T., Magnuson, M.A., Xiang, M., und Wright, C.V. (2006). Ptf1a determines horizontal and amacrine cell fates during mouse retinal development. Development 133 (22): 4439-4450 Furukawa-Hibi, Y., Kobayashi, Y., Chen, C. und Motoyama, N. (2005). FOXO transcription factors in cell-cycle regulation and the response to oxidative stress. Antioxid. Redox. Signal. 7 (5-6): 752-760 Geiduschek, E.P. und Gray I. (1956). Non-aqueous solutions of sodium deoxyribose-nucleate. J. Am. Chem. Soc. 78: 879-880 Gomez-Skarmeta, J.L., de la Calle-Mustienes, E., Modolell, J. und Mayor, R. (1999). Xenopus brain factor-2 controls mesoderm, forebrain and neural crest development. Mech Dev. 80 (1): 15-27 Gouge, A., Holt, J., Hardy, A.P. und Sowden, J.C. und Smith, H.K. (2001). Foxn4--a new member of the forkhead gene family is expressed in the retina. Mech. Dev. 107(12): 203-206 Gradwell, N. (1972) Gill irrigation in Rana catesbeiana. I. On the anatomical basis. Can. J. Zool. 50 (5): 481-499 Greer, E.L. und Brunet A. (2005). FOXO transcription factors at the interface between longevity and tumor suppression. Oncogene 24 (50): 7410-7425 Gruss, P. und Kessel, M. (1991) Axial specification in higher vertebrates. Curr. Opin. Genet. Dev. 1 (2): 204-210 Gutzeit, E. (1889). Die Hornzähne der Batrachierlarven. Diss. Innaug. Zool. Univ. Albertina, Wilhelm Engelmann, Leipzig Haas, A. (2001) Mandibular arch musculature of anuran tadpoles, with comments on homologies of amphibian jaw muscles. J. Morphol. 247 (1): 1-33 Hardcastle, Z. und Papalopulu, N. (2000). Distinct effects of XBF-1 in regulating the cell cycle inhibitor p27(XIC1) and imparting a neural fate. Development 127 (6): 1303-1314 114 Harland R.M. (1991) In situ hybridization: an improved whole-mount method for Xenopus embryos. Methods Cell Biol. 36: 685-695 Helling, R.B., Goodman, H.M. und Boyer, H.W. (1974) Analysis of endonuclease R-EcoRI fragments of DNA from lambdoid bacteriophages and other viruses by agarosegel electrophoresis. J. Virol. 14 (5): 1235-1244 Hensey, C. und Gautier, J. (1998) Programmed cell death during Xenopus development: a spatio-temporal analysis. Dev. Biol. 203 (1): 36-48 His, N. (1868). "Untersuchungen über die erste Anlage des Wirbeltierleibes", Die erste Entwicklung des Hühnchens im Ei. F.C.W. Vogel, Leipzig Hörstadius, S. (1950). The neural crest: his properties and derivatives in the light of experimental research. London: Oxford University Press Inoue, T., Hojo, M., Bessho, Y., Tano, Y., Lee, J.E. und Kageyama, R. (2002). Math3 and NeuroD regulate amacrine cell fate specification in the retina. Development 129 (4): 831-842 Jiang, R., Lan, Y., Norton, C.R., Sundberg, J.P. und Gridley T. (1998). The Slug gene is not essential for mesoderm or neural crest development in mice. Dev. Biol. 198 (2): 277-285 Johnson, P.H. und Grossman, L.I. (1977). Electrophoresis of DNA in agarose gels. Optimizing separations of conformational isomers of double- and single-stranded DNAs. Biochemistry 16 (19): 4217-4225 Kaestner, K.H., Knöchel, W. und Martinez, D.E. (2000). Unified nomenclature for the winged helix/forkhead transcription factors. Genes Dev. 14 (2): 142-146 Katoh, M. und Katoh, M. (2004a).Identification and characterization of human FOXN5 and rat Foxn5 genes in silico. Int. J. Oncol. 24 (5): 1339-1344 Katoh, M. und Katoh M. (2004b). Identification and characterization of human FOXN6, mouse Foxn6, and rat Foxn6 genes in silico. Int. J. Oncol. 25 (1): 219-223 Katoh, M. und Katoh, M. (2004c) Germ-line mutation of Foxn5 gene in mouse lineage. Int. J. Mol. Med. 14 (3): 463-467 Katoh, M. und Katoh, M. (2004d) Human FOX gene family. Int J. Oncol. 25(5): 1495-1500 Kim, J.M. und Rudensky, A.(2006). The role of the transcription factor Foxp3 in the development of regulatory T cells. Immunol. Rev. 212: 86-98 Kirby, K.S. (1956). A new method for the isolation of ribonucleic acids from mammalian tissues. Biochem. J. 64 (3): 405-408 Klein, S.L., Strausberg, R.L., Wagner, L., Pontius, J., Clifton, S.W. und Richardson, P. (2002). Genetic and genomic tools for Xenopus research: The NIH Xenopus initiative. Dev. Dyn. 225 (4): 384-391 115 Korhonen, P., Tapiola, T., Suuronen, T. und Salminen, A. (1998). Expression of transcriptional repressor protein mSin3A but not mSin3B is induced during neuronal apoptosis. Biochem. Biophys. Res. Commun. 252 (1): 274-277 LaBonne, C. und Bronner-Fraser, M. (1998). Neural crest induction in Xenopus: evidence for a two-signal model. Development 125 (13): 2403-2414 LaBonne, C. und Bronner-Fraser M. (1999). Molecular mechanisms of neural crest formation. Annu. Rev. Cell Dev. Biol. 15: 81-112 Laduron, S., Deplus, R., Zhou, S., Kholmanskikh, O., Godelaine, D., De Smet, C., Hayward, S.D., Fuks, F., Boon, T. und De Plaen, E. (2004). MAGE-A1 interacts with adaptor SKIP and the deacetylase HDAC1 to repress transcription. Nucleic Acids Res. 32 (14): 4340-4350 Laemmli, U.K. (1970). Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227 (5259): 680-685 Lagger, G., O'Carroll, D., Rembold, M., Khier, H., Tischler, J., Weitzer, G., Schuettengruber, B., Hauser, C., Brunmeir, R., Jenuwein und T., Seiser, C. (2002). Essential function of histone deacetylase 1 in proliferation control and CDK inhibitor repression. EMBO J. 21 (11): 2672-2681 Landacre, F.L. (1921). The fate of the neural crest in the head of the urodeles. J. Comp. Neurol. 33: 1–43 Le Douarin, N.M. (1980).The ontogeny of the neural crest in avian embryo chimaeras. Nature 286: 663-669 Le Guezennec, X., Vermeulen, M. und Stunnenberg, H.G. (2006). Molecular characterization of Sin3 PAH-domain interactor specificity and identification of PAH partners. Nucleic Acids Res. 34 (14): 3929-3937 Lee, K., Pisarska, M.D., Ko, J.J., Kang, Y., Yoon, S., Ryou, S.M., Cha, K.Y. und Bae, J. (2005). Transcriptional factor FOXL2 interacts with DP103 and induces apoptosis. Biochem. Biophys. Res. Commun. 336 (3): 876-881 Lehtinen, M.K., Yuan, Z., Boag, P.R., Yang, Y., Villen, J., Becker, E.B., DiBacco, S., de la Iglesia, N., Gygi, S., Blackwell, T.K. und Bonni, A. (2006). A conserved MSTFOXO signaling pathway mediates oxidative-stress responses and extends life span. Cell 125 (5): 987-1001 Li, B., Samanta, A., Song, X., Furuuchi, K., Iacono, K.T., Kennedy, S., Katsumata, M., Saouaf, S.J. und Greene, M.I. (2006). FOXP3 ensembles in T-cell regulation. Immunol. Rev. 212: 99-113 Li, C., Lusis, A.J., Sparkes, R., Tran, S.M. und Gaynor, R. (1992) Characterization and chromosomal mapping of the gene encoding the cellular DNA binding protein HTLF. Genomics 13 (3): 658-64 116 Li, S., Mo, Z., Yang, X., Price, S.M., Shen, M.M. und Xiang, M.(2004). Foxn4 controls the genesis of amacrine and horizontal cells by retinal progenitors. Neuron 43 (6): 795-807 Li, S., Misra, K., Matise, M.P. und Xiang, M. (2005). Foxn4 acts synergistically with Mash1 to specify subtype identity of V2 interneurons in the spinal cord. Proc. Natl. Acad. Sci. U S A 102 (30): 10688-10693 Lipinski, M.M., Jacks, T. (1999). The retinoblastoma gene family in differentiation and development. Oncogene 18 (55): 7873-7882 Lister, J.A., Cooper, C., Nguyen, K., Modrell, M. Grant, K. und Raible, D.W. (2006). Zebrafish Foxd3 is required for development of a subset of neural crest derivatives. Dev. Biol. 290 (1): 92-104 Lottspeich, F. und Zorbas, H. (1998). Bioanalytik. Spektrum Akademischer Verlag. Heidelberg. Berlin Luo, T., Lee, Y.H., Saint-Jeannet, J.P. und Sargent, T.D. (2003). Induction of neural crest in Xenopus by transcription factor AP2alpha. Proc. Natl. Acad. Sci. USA 100 (2): 532-537 Luscher-Firzlaff, J.M., Lilischkis, R. und Luscher, B. (2006). Regulation of the transcription factor FOXM1c by Cyclin E/CDK2. FEBS Lett. 580 (7): 1716-1722 Mannervik, M. und Levine, M. .(1999). The Rpd3 histone deacetylase is required for segmentation of the Drosophila embryo. Proc. Natl. Acad. Sci. USA 96 (12): 6797-6801 Markitantova, IuV., Makar'ev E.O., Smirnova, IuA., Zinov'eva, R.D. und Mitashov, V.I. (2004). Analysis of the expression pattern of regulatory genes Pax6, Prox1, and Six3 during regeneration of eye structures in the newt. Izv. Akad. Nauk. Ser. Biol. 13 (5): 522-531 Maruyama, K. und Sugano, S. (1994). Oligo-capping: a simple method to replace the cap structure of eukaryotic mRNAs with oligoribonucleotides. Gene 138 (1-2): 171174 Martynoga, B., Morrison, H., Price, D.J. und Mason, J.O. (2005). Foxg1 is required for specification of ventral telencephalon and region-specific regulation of dorsal telencephalic precursor proliferation and apoptosis. Dev. Biol. 283 (1): 113-127 Mayor, R. und Aybar, M.J. (2001). Induction and development of neural crest in Xenopus laevis. Cell Tissue Res. 305(2): 203-209 McDiarmid, R.W. und Altig, R. (1999). Tadpoles. The Biology of Anuran Larvae. The Univerity of Chicago Press McDonell, M.W., Simon, M.N. und Studier, F.W. (1977). Analysis of restriction fragments of T7 DNA and determination of molecular weights by electrophoresis in neutral and alkaline gels. J. Mol. Biol. 110 (1): 119-146 117 McPherson, M.J., Quirke, .P und Taylor, G.R. (1991). PCR 1- A Practical Approach. IRL Press at Oxford University Press, Oxford McPherson MJ, Hames BD, Taylor GR. (1995). PCR 2- A Practical Approach. IRL Press at Oxford University Press, Oxford Mecklenburg, L., Nakamura, M., Sundberg, J.P. und Paus, R. (2001). The nude mouse skin phenotype: the role of Foxn1 in hair follicle development and cycling. Exp. Mol. Pathol. 71 (2): 171-178 Morris, B.J. (2005). A forkhead in the road to longevity: the molecular basis of lifespan becomes clearer. J. Hypertens. 23 (7): 1285-1309 Mullis, K.B. und Faloona, F.A. (1987). Specific synthesis of DNA in vitro via a polymerasecatalyzed chain reaction. Methods Enzymol. 155: 335-350 Nakagawa, S. und Takeichi, M. (1995). Neural crest cell-cell adhesion controlled by sequential and subpopulation-specific expression of novel cadherins. Development 121 (5): 1321-1332 Nakata, K., Nagai, T., Aruga, J. und Mikoshiba, K. (1997). Xenopus Zic3, a primary regulator both in neural and neural crest development. Proc. Natl. Acad. Sci. USA 94 (22): 11980-11985 Nehls, M., Pfeifer, D., Schorpp, M., Hedrich, H. und Boehm, T. (1994). New member of the winged-helix protein family disrupted in mouse and rat nude mutations. Nature 372 (6501): 103-107 Newman, C.S., Grow, M.W., Cleaver, O., Chia, F. und Krieg, P. (1997). Xbap, a vertebrate gene related to bagpipe, is expressed in developing craniofacial structures and in anterior gut muscle. Dev. Biol. 181 (2): 223-233 Newman, C.S. und Krieg, P.A. (1999). The Xenopus bagpipe-related homeobox gene zampogna is expressed in the pharyngeal endoderm and the visceral musculature of the midgut. Dev. Genes Evol. 209 (2): 132-134 Nguyen, V.H., Trout, J., Connors, S.A., Andermann, P., Weinberg, E. und Mullins, M.C. (2000). Dorsal and intermediate neuronal cell types of the spinal cord are established by a BMP signaling pathway. Development 127 (6): 1209-1220 Nieuwkoop, P.D. und Faber J. (1967). Normal Table of Xenopus laevis (Daudin), 2nd ed. Elsevier/North Holland, Amsterdam Nieto, M.A., Sargent, M.G., Wilkinson, D.G. und Cook,e J. (1994). Control of cell behavior during vertebrate development by Slug, a zinc finger gene. Science 264 (5160): 835-839 Nirenberg, M.W. (1963). The genetic code. II. Sci Am. 208: 80-94 118 Nutt, S.L., Bronchain, O.J., Hartley, K.O. und Amaya, E. (2001). Comparison of morpholino based translational inhibition during the development of Xenopus laevis and Xenopus tropicalis. Genesis 30 (3): 110-113 Pasqualetti, M., Ori, M., Nardi, I. und Rijli, F.M. (2000). Ectopic Hoxa2 induction after neural crest migration results in homeosis of jaw elements in Xenopus. Development 127 (24): 5367-5378 Pati, D., Keller, C., Groudine, M. und Plon, S.E. (1997). Reconstitution of a MEC1independent checkpoint in yeast by expression of a novel human fork head cDNA. Mol. Cell Biol. 17 (6): 3037-3046 Perron, M. und Harris, W.A. (2000). Retinal stem cells in vertebrates. Bioessays 22 (8):685688. Pillai, R., Coverdale, L.E., Dubey, G. und Martin, C.C. (2004). Histone deacetylase 1 (HDAC-1) required for the normal formation of craniofacial cartilage and pectoral fins of the zebrafish. Dev. Dyn. 231 (3): 647-654 Pohl, B.S. und Knöchel W. (2001). Overexpression of the transcriptional repressor FoxD3 prevents neural crest formation in Xenopus embryos. Mech. Dev. 103 (1-2): 93106 Pohl, B.S. und Knöchel W. (2005). Of Fox and Frogs: Fox (fork head/winged helix) transcription factors in Xenopus development. Gene 344: 21-32 Ramsdell, F. (2003). Foxp3 and natural regulatory T cells: key to a cell lineage? Immunity 19 (2): 165-168 Raven, C. (1935). Zur Entwicklung der Ganglienleiste. IV. Untersuchungen über Zeipunkt und Verlauf der „materiellen Determination des präsumptiven Kopfganglienleistenmaterials der Urodelen. Roux Archiv Entwicklungsmechanik Organismen 132: 510-575 Rijli, F.M., Mark, M., Lakkaraju, S., Dierich, A., Dolle, P. und Chambon, P. (1993). A homeotic transformation is generated in the rostral branchial region of the head by disruption of Hoxa-2, which acts as a selector gene. Cell 75 (7): 1333-1349 Roberts, R.J. (1985). Restriction and modification enzymes and their recognition sequences. Nucleic Acids Res. 13: 65-200 Rupp, R.A., Snider, L. und Weintraub, H. (1994). Xenopus embryos regulate the nuclear localization of XMyoD. Genes Dev. 8 (11): 1311-1323 Sadaghiani, B. und Thiebaud, C.H.( 1987). Neural crest development in the Xenopus laevis embryo, studied by interspecific transplantation and scanning electron microscopy. Dev. Biol. 124 (1): 91-110 Schaefer, B.C. (1995). Revolutions in rapid amplification of cDNA ends: new strategies for polymerase chain reaction cloning of full-length cDNA ends. Anal. Biochem. 227 (2): 255-273 119 Saiki, R.K., Scharf, S., Faloona, F., Mullis, K.B., Horn, G.T., Erlich, H.A. und Arnheim, N. (1985). Enzymatic amplification of beta-globin genomic sequences and restriction site analysis for diagnosis of sickle cell anemia. Science 230 (4732): 1350-1354 Saiki, R.K., Bugawan, T.L., Horn, G.T., Mullis, K.B. und Erlich, H.A. (1986). Analysis of enzymatically amplified beta-globin and HLA-DQ alpha DNA with allele-specific oligonucleotide probes. Nature 324 (6093): 163-166 Saiki, R.K., Chang, C.A., Levenson, C.H., Warren, T.C., Boehm, C.D., Kazazian, H.H. J.R. und Erlich, H.A. (1988). Diagnosis of sickle cell anemia and beta-thalassemia with enzymatically amplified DNA and nonradioactive allele-specific oligonucleotide probes. New Engl. J. Med. 319 (9):537-541 Sambrook, J., Fritsch, E.F. und Maniatis, T. (1989). Molecular Cloning – A Laboratory Manual. Cold Spring Harbor Laboratory Press Sander, G.R. und Powell, B.C. (2004). Structure and expression of the ovine Hoxc-13 gene. Gene 327 (1): 107-116 Sandor, V., Robbins, A.R., Robey, R., Myers, T., Sausville, E., Bates, S.E. und Sackett, D.L. (2000). FR901228 causes mitotic arrest but does not alter microtubule polymerization. Anticancer Drugs 11(6): 445-454 Sanger, F., Nicklen, S. und Coulson, A.R. (1977). DNA sequencing with chain terminating inhibitors. Proc. Nat. Acad. Sci. USA 74 5463-5467 Schilling, T. (2003). Evolution and development. Making jaws. Heredity 90 (1):3-5 Schorle, H., Meier, P., Buchert, M., Jaenisch, R. und Mitchell, P.J. (1996). Transcription factor AP-2 essential for cranial closure and craniofacial development. Nature 381 (6579): 235-238 Schorpp, M., Wiest, W., Egger, C., Hammerschmidt, M., Schlake, T. und Boehm, T. (2000). Genetic dissection of thymus development. Curr. Top. Microbiol. Immunol. 251: 119-1124 Southern, E. (1979). Gel electrophoresis of restriction fragments. Methods Enzymol. 68: 152176 Schuddekopf, K., Schorpp und M., Boehm, T. (1996). The whn transcription factor encoded by the nude locus contains an evolutionarily conserved and functionally indispensable activation domain. Proc. Natl. Acad. Sci. USA 93 (18): 9661-9664 Schuff, M., Rößner, A., Donow, C. und Knöchel, W. (2006). Temporal and spatial expression patterns of FoxN genes in Xenopus laevis embryos. Int. J. Dev. Biol. 50 (4): 429434 Schuff, M., Rößner, A., Wacker S.A., Donow, C., Gessert S. und Knöchel, W. (2007). FoxN3 is required for Craniofacial and Eye Development of Xenopus laevis. Dev. Dyn. 236 (1): 226-239 120 Scott, K.L. und Plon, S.E. (2003). Loss of Sin3/Rpd3 histone deacetylase restores the DNA damage response in checkpoint-deficient strains of Saccharomyces cerevisiae. Mol. Cell. Biol. 23 (13): 4522-4531 Scott, K.L. und Plon, S.E. (2005). CHES1/FOXN3 interacts with Ski-interacting protein and acts as a transcriptional repressor. Gene 10: 359: 119-126 Smith, H.O. und Wilcox, K.W. (1970). A restriction enzyme from Hemophilus influenzae. I. Purification and general properties. J. Mol. Biol. 51 (2): 379-391 So, C.W. und Cleary, M.L. (2004). Dimerization: a versatile switch for oncogenesis. Blood, 104 (4): 919-922 Spemann, H. und Mangold, H. (1924). Über die Induktion von Embryonalanlagen durch Implantation artfremder Organisatoren. Roux´s Arch. Entw. Mech. 100: 599-638 Serafini, T., Colamarino, S.A., Leonardo, E.D., Wang, H., Beddington, R., Skarnes, W.C. und Tessier-Lavigne, M. (1996). Netrin-1 is required for commissural axon guidance in the developing vertebrate nervous system. Cell 87 (6): 1001-1014 Speziale, P., Joh, D., Visai, L., Bozzini, S., House-Pompeo, K., Lindberg, M. und Hook, M. (1996). A. monoclonal antibody enhances ligand binding of fibronectin MSCRAMM (adhesin) from Streptococcus dysgalactiae. J. Biol. Chem. 271 (3): 1371-138 Spokony, R.F., Aoki, Y., Saint-Germain, N., Magner-Fink, E. und Saint-Jeannet. J.P. (2002). The transcription factor Sox9 is required for cranial neural crest development in Xenopus. Development 129 (2): 421-432 Stewart, R.A., Arduini, B.L., Berghmans, S., George, R.E., Kanki, J.P., Henion, P.D. und Look A.T. (2006). Zebrafish foxd3 is selectively required for neural crest specification, migration and survival. Dev. Biol. 292 (1): 174-188 Svensson, M.E. und Haas, A. (2005). Evolutionary innovation in the vertebrate jaw: A derived morphology in anuran tadpoles and its possible developmental origin. Bioessays 27 (5): 526-532 Thiebaud, C.H. (1983). A reliable new cell marker in Xenopus. Dev. Biol. 98 (1): 245-249 Thorne, H.V. (1966). Electrophoretic characterization and fractionation of polyoma virus DNA. J. Mol. Biol. 24: 203-211 Tribioli, C., Robledo, R.F. und Lufkin, T. (2002). The murine fork head gene Foxn2 is expressed in craniofacial, limb, CNS and somitic tissues during embryogenesis. Mech. Dev. 118 (1-2): 161-163 Tsonis, P.A. und Fuentes, E.J. (2006). Focus on molecules: Pax-6, the eye master. Exp. Eye Res. 83 (2): 233-234 121 van Ingen, H., Lasonder, E., Jansen, J.F., Kaan, A.M., Spronk, C.A., Stunnenberg, H.G. und Vuister, G.W. (2004). Extension of the binding motif of the Sin3 interacting domain of the Mad family proteins. Biochemistry 43 (1): 46-54 Verdone, L., Agricola, E., Caserta, M. und Di Mauro, E. (2006). Histone acetylation in gene regulation. Brief. Funct. Genomic Proteomic 5 (3): 209-221 Vogt, C.C. (1842) Untersuchungen über die Entwicklungsgeschichte der Geburtshelferkröte. (Alytes obstetricians) Solothurn: Jent und Gassmann, pp 130 Volloch, V., Schweitzer, B. und Rits, S. (1994). Ligation-mediated amplification of RNA from murine erythroid cells reveals a novel class of beta globin mRNA with an extended 5'-untranslated region. Nucleic Acids Res. 22 (13): 2507-2511 Wacker, S.A., Oswald, F., Wiedenmann, J. und Knöchel, W. (2007) A green to red photoconvertible protein as an analyzing tool for early vertebrate development. Dev. Dyn. In press Wade, P.A. (2001). Transcriptional control at regulatory checkpoints by histone deacetylases: molecular connections between cancer and chromatin. Hum. Mol. Genet. 10 (7): 693-698 Walter, B.E., Tian, Y., Garlisch, A.K., Carinato, M.E., Elkins, M.B., Wolfe, A.D., Schaefer, J.J., Perry, K.J. und Henry, J.J. (2004). Molecular profiling: gene expression reveals discrete phases of lens induction and development in Xenopus laevis. Mol. Vis. 10: 186-198 Wang, Z., Hong, J., Sun, W., Xu, G., Li, N., Chen, X., Liu, A., Xu, L., Sun, B. und Zhang, J.Z. (2006). Role of IFN-gamma in induction of Foxp3 and conversion of CD4+ CD25- T cells to CD4+ Tregs. J. Clin. Invest. 116 (9): 2434-2441 Watson, J.D. und Crick, F.H. (1953). Genetical implications of the structure of deoxyribonucleic acid. Nature 171 (4361): 964-967 Weidle, U.H. und Grossmann, A.( 2000). Inhibition of histone deacetylases: a new strategy to target epigenetic modifications for anticancer treatment. Anticancer Res. 20 (3A): 1471-1485 Weigel, D. und Jäckle, H. (1989). The fork head domain: a novel DNA binding motif of eukaryotic transcription factors. Cell 63: 455-456 White, S.A., Fisher, S.E., Geschwind, D.H., Scharff, C. und Holy, T.E. (2006). Singing mice, songbirds, and more: models for FOXP2 function and dysfunction in human speech and language. J. Neurosci. 26 (41): 10376-10379 Wiedenmann, J., Ivanchenko, S., Oswald, F., Schmitt, F., Rocker, C., Salih, A., Spindler, K.D. und Nienhaus, G.U. (2004). EosFP, a fluorescent marker protein with UVinducible green-to-red fluorescence conversion. Proc. Natl. Acad. Sci. USA 101 (45): 15905-15910 122 Wolffe, A.P. (1996). Histone deacetylase: a regulator of transcription. Science, 272 (5260): 371-372 Yamaguchi, M., Tonou-Fujimori, N., Komori, A., Maeda, R., Nojima, Y., Li, H., Okamoto, H. und Masai, I. (2005). Histone deacetylase 1 regulates retinal neurogenesis in zebrafish by suppressing Wnt and Notch signaling pathways. Development 132 (13): 3027-3043 Yang, Q., Kong, Y., Rothermel, B., Garry, D.J., Bassel-Duby, R. und Williams, R.S. (2000). The winged-helix/forkhead protein myocyte nuclear factor beta (MNF-beta) forms a co-repressor complex with mammalian sin3B. Biochem. J. 345 Pt 2: 335-343 You, H., Yamamoto, K. und Mak, T.W. (2006). Regulation of transactivation-independent proapoptotic activity of p53 by FOXO3a. Proc. Natl. Acad. Sci. USA 103 (24): 9051-9056 Zhou, S., Fujimuro, M., Hsieh, J.J., Chen, L., Miyamoto, A., Weinmaster, G. und Hayward, S.D. (2000). SKIP, a CBF1-associated protein, interacts with the ankyrin repeat domain of NotchIC to facilitate NotchIC function. Mol. Cell Biol. 20 (7): 24002410 Zilfou, J.T., Hoffman, W.H., Sank, M., George, D.L. und Murphy, M. (2001). The corepressor mSin3a interacts with the proline-rich domain of p53 and protects p53 from proteasome-mediated degradation. Mol. Cell Biol. 21 (12): 3974-3985 Zuber, M.E., Gestri, G., Viczian, A.S., Barsacchi, G. und Harris, W.A. (2003). Specification of the vertebrate eye by a network of eye field transcription factors. Development 130 (21): 5155-5167 123 7.Anhang 7.1Vollständige Nukleotidsequenzen der FoxN Transkripte FoxN2: ..1 .61 121 181 241 301 361 421 481 541 601 661 721 781 841 901 961 1021 1081 1141 1201 1261 1321 1381 1441 1501 1561 1621 1681 1741 1801 1861 1921 1981 2041 2101 2161 2221 2281 2341 2401 2461 2521 2581 2641 2701 2761 2821 2881 2941 3001 3061 3121 3181 cgttcccatggcaacttggcggagggggcggaactggtggcgttgctcgtacgcggatgg agggagctgcaacagctgctgatctctgacatcttctcgcccgttgttacagccgccgct gccatattgtaccgggacgcggttcatgccgagtattagaattatatgggtccagcaact ggaatgactccagacaagaacatagaaagcccaacagcggagaaagtcccgggattaagt caaacagagaacatgggcagcttgccggaggaggtgggcgcagccaggcccaaggcctcc atggtggataatggtgctacggacgaagagttgaccaacttgaactggctgcacgagagc acaaacttactgaataacttcagtctggggagtgagggggtctcggcggggagcccactg tatgacattgaaggtgatctttctccatcaggctgccagacgccagaaaaactgtctgcc tcttccaagcctccgtactcattcagcctcctcatttacatggccatcgagcactcccct aacaaatgcctgcccgttaaagacatatacagctggatactggacagattcccctatttc tccactgcgcccactggatggaagaattccgtcaggcacaacctctcgctcaataaatat tttcagaaggttgaaagaagtcacggaaaggtgaatggaaaaggttccctgtggtgtgtt gatccagagtataaaccaagtcttattcaagcgttgaagaaacagccattttcttcagca cttgccttatacacccctcccacttccccgacaagtgtatcatcccgcccgtatgtttta acttctgcatcgagacggaagcagatccattatgtaaaagactctgacattgatgctgct acagcaatgatgttattgaacagctctatcaaggaagaagctttagatcgccagaaacct cagcctctgaaggtggtgttacccaagaaacgcagctatgccagtgctttcaagcattgc cctcctctcagcctacaggaaaatgatggtgaagtgattaacattgaccccaaggaggat cacaactacagcgccagcggcggcgactctcagcgatgtgaatcccgctccagcgtgtct tccttgtcatccgttgaagaagtgtacgagttcatcccgaagaacagccggacgggaagt gacggcagcgagggctttcacagcgaggacgatacggatattgactatgaagaggacacg ctcggggataatggctacgtaccccagccctccggcaatgatttgcatggcagcaagctg cgcaaagaagcaagccaagatatcgatgaggagctgaaagaagccgctggctccctgctc catctggccggaatacgcacctgtctagattcccttttaaaaactgcaaaggcacaatct cacaagcacagaaaatagtgcaatggccagcatttttgttttcttctcctatccatcccc tccttttccagaagcgtggcaatactctacaactgtttatccccacgtaggagatcagag ccataaaggactaaaggcttgttactttctgctcgcttgctctgcttttatttttctatt ctaagatcgctgccttagaataatccagttttcagtacagccccaatgcatgacaggata atgccccaacttaagctactaaggatcttcaaacgtgataagggaagacccaacgtttgc tgacatcttcttccctctattattattggatactgccgtgatgcaacatggactgttgtg tttgtgtgtatatcggggtgccactgtccagtggaatgagaaaatagcagtattacccat acatttgccaactgtttcttgacaaattaagtgagaaaaattgcaaactgcacctgaaaa tttcatgaaacgtcgcccttcatgtgtaaaattgaaaggatggtcgtgcagactgccatg taatgtctccagttgattccacttagaataatggacattcagggtttcctattgccagag ttcccctgctacagaataaggggaaatattggtcagatgttgccttccattggggtcgag gcttgtctttcctttgacccctatttctaatcctcaatcagccagagattcggattctgt gatttcattttgggttacgttcgctcatgtgattatgttgaatgtcttgcgtttttgcct caacgtgaggcatgttttcctgcgctgcctccggtttggtgtcattgccgtgaattccgg taatgtatcacaagaacaaatgtgtgtctgtgtcatattcatcttgatattgtttgtgga ttttttaaagcaccgttattttccttatcactgccagagatttacatttgcctggaaata atccccccatgtttttagacaatattgttagacaaatctacacatcagatccactgcgac cacaacagcgctttcctgtacctgctgtgaatgtgtagctgcacgagaaccagtttcctt atgtcgtatagtgtgtatgatttgtaaagcacttttcagtttagtgatatgtagtttgac ccaagtaagaggaacacattgtacctgtatctaaaaggggaaatcccttcacttggggca tttttgcaacaggaatttaatacaaaatataggtggccatacgatctttccctgatatgc ccaccaacggcagggtgatatccgggtaaatccgaacgttgggccctagggccaaatgat cggattatactaaggaaatgggcgccgactgatcgtaggaccgcttcaactatctgcagc agtccttgatcgcaggaaaagatcaaacctgcccaatcaatatctggtcaattattgccc agatatcgatcgtggagacccgttggattcccccgtgcatgggcagataagctgccgaat cagtctaaaggaccaatattggcagctttaatttgcccaagtatgggcacctttaatcaa ctgtagccaacctttaaaggaaaactataccccatgtaggtctctataaacggatattgc ataaaacagctaatatgtgaaaccctgcttcatgtaaataaaccattttcataattatat atatttttttagtagtatgtgccattgggtaatcataaatagaaaattgaaaatttaaaa aaaaaaaaaaaaaaaaa FoxN3a: 1 .61 121 181 tggggtcaatgttgtttcaatggacgggcttctttctcctctctgccttctcgtccagct cggatctgcgcgcttggacctggccttttcccaagggatcagcggaaggacttagagtct ttagcttcagtggaacgtttggaatcagtgctgaagggagttgtgccacatagggatata cctgtcctggaggagtctcaggagttgcccgccacttccgggatagttggcttagcgctt 241 301 361 421 481 541 601 661 721 781 841 901 961 1021 1081 1141 1201 1261 1321 1381 1441 1501 1561 1621 1681 1741 1801 ataccaggagtctttgcctaaatgggtccagtcatgcctcctagtaagaagcctgagggc acaggaatcagtgtttctagccagtgttacaggagtagcacattatccaacccactccaa gatgatgatgacttggacttcccaccaccccctgtgaaaatccataaagagaaaggtgga atggaagatgaggaactaacaaatttgaactggttgcatgaaaacaagaacttgcttaaa agttttggggacactgtcttacgaagtgtcagccctgttcaggacattgatgatgacacc ccgccttcacctgctcagtcagacatgccctatgatgctaagcagaacccaaactgcaaa cctccatattctttcagttgtctcatatttatggccgttgaggattctcccaccaagaga ctgccagtaaaggatatatacaactggatcctagaacactttccttactttgccaatgct ccaacaggctggaagaactctgtcaggcataatctatcattaaataaatgttttaagaaa gtggataaagacagaagtcagagcattggcaaaggttctctgtggtgcatagatcctgaa tatagacaaaacctgatacaagccttgaaaaagaccccctatcatccctactcacatgtt ttcaacaccccacccacatctcctcaggcatatcaaagcacatcagtcccacccctttgg ccaggaagcaccttctttaagaaaaatggagccttacttcaagatcccgacattgatgct gcttctgccatgatgctattgaattctgcccatgagttacaagcaggtttttctccgggt gtgatacaaaatggagccagagtgttgaacagaggaatcttcccaggtgtccgacctttg ccaattaatcctattggagcaatggctgcctcagtcagaaatgggattgcaaattgccga acgagaatggagagtgagccgtcgtgtggatctcccttagttagcagtgatcccaaagat gaccacaattacagcagcgccaaatctgctaacaagaggagctcatcgcccagtgactcc atctcatcgtctgccgacgatcactacgaatttgcagccaaagtctgcagagaaggcagt gatatcagcttccagagccacgagagcttcagcgagacagaggaagaggacaagaaacag ataaagaaagagttgaaggagccccttgttgagagtggctactcttcccaacacaagaaa aagcagcatttactaaaacttcggaggatccccagtgatgcccttcctctgaaaaagaga cgcacagaaaaaccacctgagagtgatgatgaagagatgaaagaggcagctgggtctctc ttgcatttggcaggaattcgctcttgtttgaataacatcaccaatcggacggcaaaggga cagaaagagcaaaaggacaaagagaccacaaaaaattagtgcaaatccgatagaaatggt tttaaaatccaaacatttcagcacgtcaggtgaattcaaatgatcttgtggcaatatcaa catatttttcccctttatttttattttggtgtttttttgtttgtttttttttt FoxN3b: 1 61 121 181 241 301 361 421 481 541 601 661 721 781 841 901 961 1021 1081 1141 1201 1261 1321 1381 1441 1501 1561 1621 tttagcttcccaggctgcccctcctccccctccgggctggcacaagtccacgtgtccggt gcccgcgggctgctaaaactttggaggatcatgacggtcagggaaggggtgaagttcttc gctctaggagtctttgcctaaatgggtccagtcatgcctcctagtaagaagcctgagggc acaggaatcagtgtttctagccagtgttacaggagtagcacattatccaacccactccaa gatgatgatgacttggacttcccaccaccccctgtgaaaatccataaagagaaaggtgga atggaagatgaggaactaacaaatttgaactggttgcatgaaaacaagaacttgcttaaa agttttggggacactgtcttacgaagtgtcagccctgttcaggacattgatgatgacacc ccgccttcacctgctcagtcagacatgccctatgatgctaagcagaacccaaactgcaaa cctccatattctttcagttgtctcatatttatggccgttgaggattctcccaccaagaga ctgccagtaaaggatatatacaactggatcctagaacactttccttactttgccaatgct ccaacaggctggaagaactctgtcaggcataatctatcattaaataaatgttttaagaaa gtggataaagacagaagtcagagcattggcaaaggttctctgtggtgcatagatcctgaa tatagacaaaacctgatacaagccttgaaaaagaccccctatcatccctactcacatgtt ttcaacaccccacccacatctcctcaggcatatcaaagcacatcagtcccacccctttgg ccaggaagcaccttctttaagaaaaatggagccttacttcaagtttctccgggtgtgata caaaatggagccagagtgttgaacagaggaatcttcccaggtgtccgacctttgccaatt aatcctattggagcaatggctgcctcagtcagaaatgggattgcaaattgccgaacgaga atggagagtgagccgtcgtgtggatctcccttagttagcagtgatcccaaagatgaccac aattacagcagcgccaaatctgctaacaagaggagctcatcgcccagtgactccatctca tcgtctgccgacgatcactacgaatttgcagccaaagtctgcagagaaggcagtgatatc agcttccagagccacgagagcttcagcgagacagaggaagaggacaagaaacagataaag aaagagttgaaggagccccttgttgagagtggctactcttcccaacacaagaaaaagcag catttactaaaacttcggaggatccccagtgatgcccttcctctgaaaaagagacgcaca gaaaaaccacctgagagtgatgatgaagagatgaaagaggcagctgggtctctcttgcat ttggcaggaattcgctcttgtttgaataacatcaccaatcggacggcaaagggacagaaa gagcaaaaggacaaagagaccacaaaaaattagtgcaaatccgatagaaatggttttaaa atccaaacatttcagcacgtcaggtgaattcaaatgatcttgtggcaatatcaacatatt tttcccctttatttttattttggtgtttttttgtttgttttttttttt FoxN4: 1 61 121 181 241 301 361 421 481 tttaaaaacggtttggggacagagaaatcccattacaaaggagagaacacagtgccctgg aagcacagagctgctcaatcactgcagcttccctgctcactaatcataccagagacctac gcctgggacatttaggagatgatagacagtgacatctctgctataatgtctgggataata aggacatcagagcagaatcatcatccacaaagccaagaatacaggcatatgaacccctct caaatgggagccgaggagcttcctaatgacctgcagtctctgtcatggctgacttctgtg gatgtccccaggttgcagcagatgaccaatacaaggatggactacagccacacttcccag aatcctttgatgcagcagtcaggacatttatcaaataatgtacactctcctggatctatg atccacgttccgacaagcatgcaacaggggatcctgggtctgagtacgttaacatcacat gggtccaatatgagccaatacagtatggcagggcacgtgtctcctagtttgcaggctcag 541 601 661 721 781 841 901 961 1021 1081 1141 1201 1261 1321 1381 1441 1501 1561 1621 1681 1741 1801 1861 1921 1981 cagcctgtgtaccaaactcattcacagcaaatctatggactgtcccaggggtcacagtgt tcctctgccaatttgtacaacagctcatacagggcacaagcccagttcacacagccacat cttgcagctcatcctacacaggaactgcagcccaagagctaccccaaacccatctattca tacagttgccttattgcaatggccttgaagaacagcaaaactggaagcctgccagtgagt gaaatctacagttttatgaaggatcattttctatattttaagacagctccagatggctgg aagaactcagttcgacacaacctttccctaaacaagtgctttgagaaggtagaaaacaga ttaagtggatcttcacgcaaagggtgcttgtgggccctgaacccagctaagattgataaa atggaagaggagatgcagaaatggaaaaggaaggatcttccagcaatacgaaggagcatg gctaacccagatgagctggacaaacttatcatggacagaccagagaattgtaaagctcca agtaaattggtggaatcagaagttcaagctatgacgaccataggaaacctcccaggcagg attcctcagcaccagccacaccgtgtcatgactttgtcgttacaatccattcctttgcac catcagatccagacccaggccaggatagcttcaggttctccagccccagcacagagtcct ccaattcactctgttccagacatgacccacagtccccttcaacagcacatcatgagcagg gcagcttctgactttctcagcctcacctcagatatgaacacagaggttgatgcccttgat ccaagcatcatggactttgcgctacaaggaaacatatgggaggccatgaaggatgagagc ttcagtctggacacattaggtgccttcagcagttcccctctacaactctcagactgtgat ttgggaaccataggtctgacccctgtgtctagcagcggggatcattctttctcagacttt caggttaccagcctgtacactacatatccaactctggaaaatgtggcaccttcccagtgt gtgcctggctcaggaaccaagcctattgctttgctttaatagcgggacatcattcaattc aaacccactgtgatgacttctctatgtatattggcactgtactgaaagaggtgaacacga gcaactgacagggtttaggatgccttattgatactgggaaacaaacttgcacaatttact ctgccgccaactatctgcaaaacaagaagcctgtttaacaacacaaagcattatttttac tgtacgattattattgccattgctgcctctagacccagtttttcggttggaaaaaaaagt taaatattgcagtgaaatcagtgttgcatattcagggtaaaatcaatattccatggatga agactttgcatcaaaaaacattttctactgaagaagacaattattgcactgtaaagacac 2041 aacttctgttgtcaacaaaaaaaaaaaaaaaaaa FoxN5: ..1 61 121 181 241 301 361 421 481 541 601 661 721 781 841 901 961 1021 1081 ggcacgagtgatagtactacatttgtagcaacaatgtatttgcggtttgcaaataggaaa ccgtatgagaaacttcatctctctacagcacttgaagactgggatatgagtgaggaacta aaattatccatcacagcggatcagtactttgctggtgctgatgacaaagttgaacggtac accctgagacgtcagcatagtacagaactgtcccctacaaggtcagaggaaggtgacttt caagaatgcaaattccgccccagcctgtggcttgttgtggaccccaacttggtgattcca tgccctgagtggatcaaccgtatcccccctgcacctgaattgacctctccacccttgcag cttcagaggcagctatctgttgaatattctactgtggaggattcggaggatgaagcacca acctcctgcagtgatctgatgactgatgatgacaatgatgattcttataacccttgccaa cccaaaaacaagcacaagagagccaagtgtctgggtaaaaagatgagggtccaaaaaggc ttaaccgaactggaatcatgggctcgccccccacttaattactgcaacttaatctcgctt gcactgagaaatagtgaggatggatgcctaaatgtgcagcaaatctatagttttgtcaga gaccactttccatttttccggattgctccagatggctggaagaacactgttcgccataac ctttgtttcagtagtagctttgaaaagagttctggttgggtttgtgcagatggacacaga cgttcttgcttgtggaaactaactcgtcaagggcgcagaaaattcagaaatgagatgcat gcactatctgatgatttgctgcatgtgctaaggagaagcatgaaaaaaccagctctcatg gaattgatgtttggtatgtaatggtccctgttatctgcacttatctcattgataatggct gacatactacactctgaaaataaatggttgccccagcacttcactgaatagtggacatat gaatctacaattctgtcacctggaccttggtctatttgtttcacgtgtaataaaggattt tttcccaccaaaaaaaaaaaaaaaaaa Für FoxN3a wurde die Isoform gewählt, die für Exon I kodiert. Für FoxN3b wurde die Isoform gewählt die für das alternative Leaderexon II enthält. 7.2 Genomische Sequenz des FoxN4 Gens in Xenopus laevis gaacctctgggttttatagcagatacagccttagttcagagccacatatccaaacaaaaaaaacctgaaaaacaa gcttgctagtaagcttcaaatatacagtacctactatacttactatacttactgtacgtactgacttggaaactt tagaaacttggcagactctagttcaaattcaaattttcacaattttttttaaaatcaagagtttgctaattgaaa tatattcaagattttttgatattattttcttgaattatggcaaaatcttgaaatgttttcccgcacaagtttgtg acagattgtggaaaattagaatataaagatcctgataattttgccaatgtttttttcaccatgctgtgaacaaaa atcatactatcaacttaaatgacttttcaacaattggaatatatatttttatagaatgaagaaaggagcagaaaa ctgccctgacctggtgctcttctcagtgagcacaatggagtgaaaacctgaaccttatccaaaaaaaagtctttt ccactttactgcgcctgcatcgaagaaagacgaagtgcaagaaaaggatcgctctgtggtgcacactgagaagaa ccccaggctggtgcagttttctactagcaggaccactggcctgagctaacaggtaaatgagtacaatcggggggg gtgcctaacttttggcacctcagtgatttcatgtttacttctcctttaaaaccagaatatgtgaaatttaagttt cactgtattaaaatatgttgtaatggttaactattgaatatttgaataaatactggaaaaaaaactttactcgtg tttttttcatcactttctctactactggtaggtctgtagttgccataatcctccctttatgatgtagtactacaa aggctgttcaccactcataagaaactattccttttaacaacagcaagcagttcagatactgtttatgttaaatat atgcagtgcttaaattgggatataaaaggtggagggatggtcgaattgaaaatgttgaatttttttaggccacgc ccacaattattggccacaccccttttaatatgcctcgcccaccagctaattccatgtttattaaaaaaaaatttt gaaataaaaaaaacacaaataataaaaaattaaaaccaattacaaattgtctcagaatattgctttcttaatcat acaaaaatttaactcaaaggtgaacaacccctttaatatttatgtttttccaattaattggcacatcaaaagata caattaacacattgtttaaggcatttgtgttaaaattcaaatcaatgcatggttgcttgggtaactgggacccta gcaaccagatagctgaaactgcaaactggagagttcgcgaataaaaaagccaacaactcacacaaaacaactcct tacatcagcaggaggcgaggcagggaaggtaaatagaatagggtgcagcagggcaaagggtctggtgctttgcca aactagttacaacgattgcaagccctcaagcaagcccctttatctctatctctctttctatctatcatctaataa tcctctatccatctgtctgtctatctcgctattctcttcttctttctttctttctatctatttagtaatctatca gctatctagatgatagataaatagagataaagagatagatgatagatagataatagacagatagaaagagataaa gaatagatagatagatagagatgacagatggataaaggattattatatgataaatagaaagagagctagatcgat gaagatagataaaggggcttgcaatcataactagactgagaagcattggcactataacagacagaagttgtagtt tttagaacagcattaggcatataagaggggccggaatgacagctttgctttagtggcttagatcttcgtgagcac ctgctggtgccactgtgcgcggtactgtnnngagtcgtgtgacagaaatgacatcantacntcaccgtttattaa cctgatgaccatcagaattcaccgttaataaggaatataattttacaagatattcatggcttntgtaanggaaat ccctagctcgtgtgtatatatacacagtgtagagaactttgtgggcaggcggcagaagcacttgtagagaaacag ttgtgattgtataatgtggatttaatggtgttctacagatgtgggacacaatacaacgtaaacagtggccttagg atcagatacggaagccctggagctccacggcaatgataaaagtaaaagcccagggggctccgagtattgaggagg attctgtgcgatagagttcgctgtcagaaacaatggcacaggcaggtttgtttgtttttccctctcatcttgtcc ctgtgtgagcgccgtgtctgtccctccctctcctctccccccactggtgccgccatcccagctgcctttcccggg ctgaggcgcgggccgagcggcgggcatggacagcgcgagccgggcgggctcaatgagttgccaacggctggtgcc tagtgtgttggagagaagcagagcgagagacaagcaggacacggacacacagggctcccccgacaaactgaatgt gacacaggagcacaacagagcggcttcagtattgcaggaagccacagacacaaactgcctcactggaactcacgg cccgtctcccaatcccgcctcgctatcttggacccaactttcaaacaaccacgggcacgtaccatccgccgcgct tgccaggggtgttcacaaatgtttcagactcgcggctgaaattgcaagtcgtctttttaaacaagtaactggagg acagaggacatttcaccctccccatcagctttgggtgcaggtgtcccggcccagctaatgaaccttatgattttt cttagcgcccactaaccccatatgctgattttacatcctaaaatcaggtgccagaatagcgcctgacaaacgaga aacccccgttcttaccctaatatactacaacattttactactactatagtcattttatagttagtatttgttccc taagctcccccagtgcttgtagttgcagtgttccgatggcactgagtgtcactgaggcctgtcaggagcaattgt gagtgggcacaaagacgggctgctgttgggggtagggaacatcatcttgtctctaatgggaacagctcagtactc agcagctctgccctatcagtgacccagcgaggcagagtgtgcgcatgcgctgcgctggacagctcctgagaggga aatttaaaaacggtttggggacagagaaatcccattacaaaggagagaacacagtgccctggaagcacagagctg ctcaatcactgcagcttccctgctcactaatcataccagagacctacgcctgggacatttaggtattgcatttac tccttatcttgctaatatatatatataatgtttttccataaagtggagtgtgcttatacctatgcacatgttatt ctttataaccccacttgtttgtgggcatcatcactggcaataagggggtgaattccctccttctaaacatccctt catatgtgcagattgtcagtgccttaataatcacttgagattcttatcaatattttaacctcaatgtacctgttt gtcttcactaacatttgctaagcacctttatataatagtatatgcttgcgttgttcatatttgaagtcctgcaca tctatagagatattcaaacagggagtggggacaacagttattaaacgctcatagaaagctttcaagttaaatgat gctgatttgttttttaacttgggcttgtacatttctgtaaataaatatattcagtgctacgcaatatgttggcgc tatataaatacatgttaataataatatttgtattcattattattaaatatttttatttcttaaaaatagcttcaa gaaggggttggttgtttgaggagatacagggttattgaaaatagctcatattccagggactggtccgattgcctt ttggagtcagggaggaattttcttcaccgctttttcatcgagagatcagaaggggatttaggcaggttttagata gacctaaaaaggctgaacttgatggacatgtgttttcttcaaccttacttactactgtatgtagacatactggtg ctaataaatgcaaacggcttaaataataatatgtatatttcccccatgcactatgcattacatatctgtaactct gtgtgacatgctagggacgttacactcaccctaattcatgccattgacatttctagtacataaaatcacacccct ccctcccatttatataccatgtccattatactttcctttaagacaaatctggcaaatgccaattaggggccactc tttcaattctaaatctttgcatcacagtattgactgataccatattttctcctctcccccaaaggagatgataga cagtgacatctctgctataatgtctgggataataaggacatcagagcagaatcatcatccacaaagccaagaata caggtattgttttgttttcattttggtacatgggattaagcactggaagtcagaggggtcttctttatgcttgat accataggacattttctatagtggagtttactgtttgcaaaactcagatttaccacttgattgtggtggtctctc ttctataaagctttcaccctattaagtgcatacccacatgcagcataaactgtatgtgcatacacatacaattag caggatagggtttcctatgcagggaaattgtttctagttttatggatttcacagagattcacagaccctctgtaa agcaaagtaatgtcattgtttcattttgcacattgcgctgcttgttgtgctctgtggtacacctagttgtgctcc tagaatggattgccggactctttatgcagcactgcaagtgctagattcagaagagacaggaggtgggcaacacct ggatgtctcctggaatgacagaaaactgtgtagtgcaaggtgctactgagccctgaacttaatacctgcttaggg tgcaagatgtagagtgcaagttacacactaaatggcagtttcattaactgagaaggatctaggggtttttgtgga taatacattgtctaattccgggcagtttcattctgtggctgctaaagcaaataaaaaaaggcagaaactcaaggg atgaaaacataatttggcctctttataggtccctggtaagccctcacctgaagtatgcagtgcagttttggactc cagtccttaagagggatataaatgagctggagagagtgcagagacgtgcaactgaactggtttgcaggatgtaag ccaaattatgagggtagactgtcacggttggggttgttttctctggaaaaaaggcgcttgcgaggggacatgatt acactttacaagtacatagaggacattattagggatgcaccgaatccactattttggatttggccgaacccccga atcctttgcgaaagattcggccaaataccaaaccaaatttgaatcctaatttgcatattcaaattaggggtggga aggggaaaacattttttacttccttgttttctgacaaaaagtcgcgtgatttccctcccgcccctaatttgcata tgcaaattaggattcagattcggttctgctgggcagaaggattcggccgaatcctgctgaaaaaggctgaatccc gaactgaatcctggattcggtacatccctagacattatagacaaatagcaggggacctttttacccataaagagg atcaccacaccagaggcctccccttaggctagaggaaaagattcttcatttcaagcagcgtagtggttctttgca atgaggttatgatgggctggattaatattaaagtggcctttaacattagaaaacnttacccaagtaaagtttatg gttannngggacctaggttattccggataacggatctttccgtaatttgggtcttcataccttaggtctactaga aaatcatgtaaacattaaacccaacagactggttttgcttccaataaggattaattatattttagttgggatcaa gtacaaggtacagttttattatcacagagaaaagggaaatcatttttaagatttggattatttggatggagtcta taggagacagccatcccgtaatttgaagctttctggataacaggtttccaggtaacagatcccatactgtatatg atcaaggttctacatgcatacaagctttgtatgtaacaagaatggattgtggcccatataaataagattttattt aacctaaaagattcattctaaagggtgtggggttgggtttaaatacagtcatttgagattatcattctttcagtt tgcttttcctgaagagggcacagctgtaatgggtctgatcctgaaacagcacaactgaacagtagcagactgtta cacaagtgttaacacaagggtttgaggtttggaagttgctcaatgagtttgccctgtgacaggaggtgtgcgcag aggctttgactcttagcactccccattcgacctttccatttgtgaaacaaaaagcccccaaactcttcatttcag accagtaggcatcaggcgggtggcagatggcactctttttgtgctcctcttgtctgctgtcattcagctagatta atgaagggtctgcaaagggaagaaggggggaaagaggtcttgtgggggtagagaaatagaaacaattaatcctcc cccaaaaacaatggagacacgtgtcagttggctttagccgttttctaagtacaatagggcagtggtctctgaata acacaaccaactgttgcaaatgagcctggtctgcccagcttttaaatcattttgtttgattgtgtttgtttatga tttggccaatggcagagctggaagaagggtcagctgagtatcccccctcccttaaccctacattatccaaatggg gcattgtgagaagtcactggtaaagctactaattactgggtgacaatagcagaatcagagcaccaaatgtattgt agaatttaaaaataacatttgcactgaaatggttaaatacgttcattgcttactaaatagaaatgcaccccagct tggatacagtcttataaagaagtgtgtcctatacaggtatggcctgataaatattagaatttatagaaatacatt tgtagtgacaggtgcacagagctgactattgccatggattataatataacactggaacagtgaaaacagtgaaat agttatatccatgttaaaccatgttcttctgatttctttgtaaatagtttctttgtaaatagttttgttttggat aaagattgaatgcagaatatataacaagcttacttttgccctttagccacgttacaatttttgtgcacagatgtc tattatctcagctatttggcaatacaattgtcacattcataaaagtaaaaaaatatagaggggttttcaaaacct catggggaatggtattattctaccattatgtgccttatcaattgttctttcttatgattgttttttcttatggtt ttgttatggtttttagcattgcatgtccctatatcctaagaaaacctgtatgtgttccttgctgtttagattccc ccttgatattttgttgattttagttcaaaaacctgaataatagtgtaataatgcataatactgaccttttcttgg cactgaccacaggcatatgaacccctctcaaatgggagccgaggagcttcctaatgacctgcagtctctgtcatg gctgacttctgtggatgtccccaggttgcagcagatgaccaatacaaggatggactacagccacacttcccagaa tcctttgatgcagcagtcaggtaggttgagtcttttacatttcacatagtatttttatggtttatctatctatgt gccatttttcatgtatatttttctttccacaggacatttatcaaataatgtacactctcctggatctatgatcca cgttccgacaagcatgcaacaggggattctgggtctgaatacgttaacatcacatgggtccaatgtaagtaatcc catattaatcttacagctgctgtatgttatagtagacaaagaagtttatttccacagtgaggaagttattgtgtt aggaatgttgccactgtataaatacaatgatgaaataacatccgtttctctttcttttcattagatgagccaata cagtatggcagggcacgtgtctcctagtttgcaggctcagcagcctgtgtaccaaactcattcacagcaaatcta tggactgtcccaggggtcacaggtaatacacttttccagtttataaagcaaatgtgtttagaaagttaaaaggaa tctgtcatgatttttatgatgtggtttttgtttctaaattacactgtttacactgcaaataattcactttactat ataaaatgtaattcctgaaccagcaagtgtattttttttagttgtaatatttgcgtgtaggcagccatctcaggt aattttgcctggtcatgtgctttcagaaagagccagcactataggatggaactgctttctggcaggcttttgttt cttctactcaatgtaactgaatgagtctcagtgtgacctggaacattactattgagtgctgttcttagatctacc aggcagctgttatcttgtgttagtgagctgctatctggttaccttcccattgttctgttgttaggctgatgggag gggaagggagggggtgatatcacttcaaaacttgcagtacagcagtaaagagtgactgaagttcatcagagcaca tgacttgggggcagctgggaaactgacaatatgtctagccccatgtcagagcagcacaattaactgatgcatttt gaaaaaaacatttttttcccatgacggtatccctttaagctagatggagtagctgggggggggggggtagttacc agtcagtaggatgagtatatgctaatagaataaaaatgtaaactgaaagaaatgtaggattaagatggagtttaa tctaatctttttgtcaggtaattaaatctgtttttcaatatttctcttttctccagtgttcctctgccaatttgt acaacagctcatacagggcacaagcccagttcacacagccacatcttgcagctcatcctacacaggaactgcagc ccaagagataccccaaacccatctattcatacaggtacattcaattatttgatgattatactttatgatttaaat gatcatattaccagtgaaacaggcagatctatatgggtaccaatacaggatgcacagctgtcttttccagtgtac actacaccattacagggtctaaagatttacactttatttatttgtaatagttgccttattgcaatggccttgaag aacagcaaaactggaagcctgccagtgagtgaaatctacagttttatgaaggatcattttccatattttaaggta cggcataagcactgtattggtgatatctagaattgtgttttcctagcaatttagatatgatgcatgttctgatgt tcacagttctttttccgttttcactttacagacagctccagatggctggaagaactcagttcgacacaacctttc cctaaacaagtgctttgagaaggtagaaaacaaattaagtggatcttcacgcaaagggtgcttgtgggccctgaa cccagctaagattgataaaatggaagaggagatgcagaaatggaaaaggaaggatcttccagcaatacgaaggag catggctaacccaggtaataacaaaatgtattattatgtgggtaccaataaaacctaatacgtggataaactgaa atactttaaaatgggtgggccttcaatgctgtaaaaagctttatcattaacttctgtcgttgttgtatgcaagac gaaatattcaggtgtaaaatgccactgcttttgacaaacttgacttgaactgaagtttaagctttcagtgttctt atttacatcatgtatctctttgcagatgagctggacaaacttatcatggacagaccagagaattgtaaagctcca agtaaattggtggaatcagaagttcaagctatgacgaccataggaaacctcccaggcaggattcctcagcaccag ccacaccgtgtcatgactttgtcgttacaatccattcctttgcaccatcagatccagacccaggccaggatagct tcaggttctccagccccagcacagagtcctccaattcactctgttccagacatgacccacagtccccttcaacag cacatcatgagcagggcagcttctgactttctcagcctcacctcagatatgaacacagaggttgatgcccttgat ccaagcatcatggactttgcgctacaaggtgagtaggcaataaggataagtaaatgcaaaatagattttttcagt tattgagttattctaagaatttttgcaatgtacactgattatattttttattccaagatattaaaggatacatga actgttaatataaattcattgtgttacaacatcaccacctgcaagtcagtttctgaccattctgaccaccaagta gccaaggaagttgtcaggaaaaagaaagaggctgctctnnnttggactanntggggtggtcagaatggtcagaaa ctgaccagcaggtggtgctgttgtaacaaaattaatttatattaatagtaaatatatcctttaatatcttggaat taaaaaaatataaataatcaatgaacattgcaaaaaatcttagaatagcactctcatcaattttacattcactta ttttaaaggtttacttatcctttaacttancgggggtataaaaagggccattcatggtgaatccaatgtttgacg ataacattgacatagtgataagttctcaaataaattaaataaatatccactgtatcttatttcattatggggctg cctctgtatattattctcaatgcattccaatattggcttttaactccagtctctcttatgctttatgttaaagga aacatatgggaggccatgaaggatgagagcttcagtctggacacattaggtgccttcagcagttcccctctacaa ctctcagactgtgatttgggaaccataggtctgacccctgtgtctagcagcggggatcattctttgtcagacttt caggttaccagcctgtacactacatatccaactctggaaaatttggcaccttcccagtgtgtgcctggctcagga accaagcctattgctttgctttaatagcgggacatcattcaattcaaacccactgtgatgacttctctatgtata ttggcactgtactgaaagaggtgaacacgagcaactgacagggtttaggatgccttattgatactgggaaacaaa caaacttgcacaatttactctgccgccaactatctgcaaaataagaagcctgtttaacaacacaaagcattattt ttactgtacgattattattgccattgctgcctctagacccagtttttcggttggaaaaaaaagttaaatattgca gtgaaatcagtgttgcatattcagggtaaaatcaatattccatggatgaagactttgcatcaaaaaacattttct actgaagaagacaattattgcactgtaaagacacaacttctgttgtcaacaaaaaaaaaaagacacttattttgc ttgcatagggaggtactattcaatacccttgactgcacggtttttctgtagcctgcccacaaatctaagttacag atactgtatatacaaatattggattgcttgttctgctgtagttctattagtatctacaacagtaaataagtattc accccaaatcttacaaacactcatgcattcccaatatgggaaccgttgctgtatctgaagggcttatttacatta ctgcactgctgtgtgtaggcgcctgtgattatattttctctatcttacacatggtctaatcaatcaattaacact gcacctcccaagaaaatgcatccacaaatgttggctttagaatgttccagatctaatctgcataaagcaccccaa aatacgtatatcgtgtgttagcagtgcctcctgtccttaacacactgaacaacactaaagaggcacaagctgccc aatagctttggaaccctagcaagcagaagaagacactgcgatgaaatcgaggtagtgctatataaaaggtatagg gtaattttgagtgctttattctcacctgtttctcaaattgagagcttcattttcctttggaatttccaccttttg aaaccggcaacaagtattccaactagcaaatgcaattcgctacaatttcacataaaatttggtattggtatacag caactcattcaaaacctgggagcctttcattacttttttgacctaattttaatttcaagatgaaaaaaaatcact gtacaaatggtannncacaatgaaacataatttgcatactcatttttcttgcataattcttgcctggagtccgtt ataacttcccggacatatttgctgcattagcatagccttggcctcttccatccttgatatcaatgccatctgctt gtaaaatttctgccgctaagccactccagttttctctttggtgtggatgaagtctacaaagttttcttcaactgt caacttcccttcaacaacactgacattacatatgattttactcctttgctcttgatggtacacatctggtgtaca gtcaaagatcacagagtaatactagcttcttttattttgcccantaatctcagattgcactctcttccccaggat gctgataaactcattttgagtctaatgtgagaagtaatttgtagaacgcttttggtgcgtttcaatattttcttt aagtgccatgttatggtggcttattacttctataatatcctgaaatatgccagcatgtgggctaccaatagcatc cgttgagcctctaatgccaagttataccttgcacagaataagatggcacttaaaatgcactttaaaacattacgc cacttctgcttttaagtcatgataattttttctagctcacactgaataaactttccttctttcattcttttttcc atgagtttccactttgaatggtcgcgatgctctgcagaattttcatgagttggaatgtgtgggttcaacttcttc cagttctttttcgggttgatcagtgaaaaggtatgcttgccaaacaaaatacatggaaaacaaaacaatgcattt gatgttttggagtatattaaccatgttctttcaatctttctaccactgggtatttgtttggtgaaccacatagag ttaaaggagcgctcctcatgtgactgggactttccaaaatccccatctttaccttgatcagggccctgatgtaca aggtatcttttgattttttctggccatgagggtggatcatttagattatctctatttaaggactgtcttcagtca gagtatcttctgatatagtgtcaccctgtatcaaacttttactggcaataggagagcgggtggcatctatttcat tgacactttcctcactgtctgattctgcacagattttacttttctctttttctgggattatttctaaatcttgct caggttcacagatttcaggagctgtttccatgatgccgataccctcaccactcaaaccaatgccaatttcttctg aagtggaaggtgtttctgcttctgtacttttgcttggtttaagccatttttgaaaatgctgtgaaagtttacttg cttcatcttcccttatctttcttctttttctgaattctgcaccagaagtttttttggatgacattccttacaaga taaagttaaaaaaattaaattcagtgtggtcaggccatttagaccacgcataaagcacctataattcactttccc aatgtntanaaggaccattantgtnatnnaaggcangtgacttnaactgatcacttatgaggaangntgtccagc ttgggatnggntacantgnnttacaggnantgaaggctggggtatgatatgatatatatatatatagggagacca tatnntnantcncngcccttcnagtagncatnaaagntttgnttacagnnccagatntgtgganagnccacctag ncccgggcttagggtggcaggattttaggggggtggcatactgcccaaccatagccacattggttcaaaaacact gtgcgccaatccccattgctccagtccagatgatgaaaaaggggaggggacaggggcaacgaacggcagtgggcc taaaggcgcccactatgtaaatccggccctgtttgttacagccagaatattttaagtaaatacgagcttactaat atanacacttttagcntaaggantaagccattttgtgggtcagtaaaaattaccctggccctcccagctcagaca aactggaggcagattcacgttattttaccttttctggatcacatagactattatttaattaagcacacttaaagg accagtaacatcaaatttttttttcaaaaattcgttagtacataacgaaaaaataacaccaacacaaattaaaat ttaaaatagcaaagcctttattaagaaataacttacagatactccacttcctgtcctcttcagaaacggcgaaaa ggcgaccatccttcctgcagcgctcgatttgtcc Anmerkung: Die nicht sequenzierten Bereiche sind durch nnn markiert. 7.3 Vektoren p-Drive Vektorkarte pCS2+ Vektorkarte pGEX Vektorkarte pGL3-Basic Vektorkarte Lebenslauf Name: Anschrift: Geburtsdatum: Familienstand: Staatsangehörigkeit: Maximilian François Schuff Juraweg 1 89134 Blaustein 25.12.1975 in Lindau/Bodensee ledig deutsch Schulausbildung: 1982-1986 1986-1995 1995 Besuch der Grundschule in Opfenbach Besuch des Bodensee-Gymnasiums in Lindau/Bodensee Abitur Zivildienst: 9/1995-8/1996 LRA (Untere Naturschutzbehörde) Lindau/Bodensee Hochschulausbildung: 10/96-9/2001 Studium der Biochemie an der MartinLuther-Universität Halle-Wittenberg in Halle/Saale 11/2000- 7/2001 Diplomarbeit: „Untersuchung der Myostatinexpression in der Skelettmuskulatur der Maus“. (Angefertigt am Institut für Physiologische Chemie, Abt. Prof. Dr. Dr. T. Braun) 26.09.2001 Diplomprüfung (Prädikat: Sehr Gut) Diplom (Gesamtprädikat: Gut) Berufstätigkeit: Seit 9/2002 wissenschaftlicher Mitarbeiter der AG Prof. Dr. Dr. W. Knöchel, Abteilung Biochemie der Universität Ulm, experimentelle Arbeiten zur Dissertation Publikationen: Schuff, M., Rössner, A., Donow, C. und Knöchel, W. (2006). Temporal and spatial expression patterns of FoxN genes in Xenopus laevis embryos. Int. J. Dev. Biol. 50: 429-434. Schuff, M., Rössner, A., Wacker, S.A., Donow, C., Gessert, S. und Knöchel, W. (2007). FoxN3 is required for Craniofacial and Eye Development of Xenopus laevis. Dev. Dyn. 236(1):226-39 Danksagung An dieser Stelle möchte ich mich bei allen jenen bedanken, die zum Gelingen dieser Arbeitbeigetragen haben. Mein besonderer Dank gilt Herrn Prof. Dr. Dr. W. Knöchel für die interessante Themenstellung und die aufmerksame Betreuung. Ebenso möchte ich im Besonderen Frau Antje Rößner und Frau Cornelia Donow für ihre tatkräftige Hilfe und Unterstützung Bei den histologischen und Proteininteraktionsanalysen meinen Dank aussprechen. Namentlich möchte ich Frau Dr. S. Knöchel, Herrn Dr. S. A.Wacker, Herrn Dr. D. Maurus, Dr. Christian. Schön, Frau Dipl. biol. Doreen. Siegel für ihre Anregungen, ihre große Hilfsbereitschaft, moralische und seelische Unterstützung und den überaus nützlichen Diskussionsbeiträgen danken. Allen anderen Kollegen und Mitgliedern der Abteilung Biochemie möchte ich ebenso meinen herzlichen Dank aussprechen. Ich danke Prof. Dr. M. Kühl und den Mitgliedern der Abteilung Biochemie und Molekulare Biologie für die anregenden Diskussionen und die großzügigen Plasmid- und Antikörpergaben. Erklärung Hiermit erkläre ich, dass die von mir vorgelegte Dissertation selbständig angefertigt und die aufgeführten Hilfsmittel und Quellen vollständig aufgeführt worden sind.