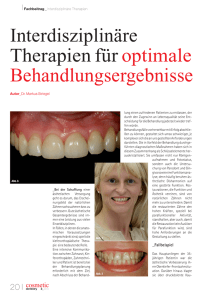
Untitled - TiHo Bibliothek elib - Stiftung Tierärztliche Hochschule
Werbung

Bibliografische Informationen der Deutschen Bibliothek Die Deutsche Bibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; Detaillierte bibliografische Daten sind im Internet über http://dnb.ddb.de abrufbar. 1. Auflage 2009 © 2009 by Verlag: Deutsche Veterinärmedizinische Gesellschaft Service GmbH, Gießen Printed in Germany ISBN 978-3-941703-50-6 Verlag: DVG Service GmbH Friedrichstraße 17 35392 Gießen 0641/24466 [email protected] www.dvg.net Institut für Pharmakologie, Toxikologie und Pharmazie Tierärztliche Hochschule Hannover Untersuchungen zu Verhaltensänderungen und Lern- und Gedächtnisdefiziten im Pilocarpinmodell für chronische Epilepsie bei der NMRI- und C57BL/6-Maus THESE Zur Erlangung des Grades eines DOCTOR OF PHILOSOPHY (Ph.D.) im Fachgebiet Pharmakologie durch die Tierärztliche Hochschule Hannover und dem Zentrum für Systemische Neurowissenschaften (ZSN) vorgelegt von Christine Julia Müller aus Köln Hannover 2009 Supervisor: Univ.-Prof. Dr. W. Löscher Wissenschaftliche Betreuung: Univ.-Prof. Dr. W. Löscher Univ.-Prof. Dr. D. Dietrich Univ.-Prof. Dr. H. Hildebrandt 1. Gutachter: Univ.-Prof. Dr. W. Löscher (Institut für Pharmakologie, Toxikologie und Pharmazie der Stiftung Tierärztliche Hochschule Hannover) 2. Gutachter: Univ.-Prof. Dr. D. Dietrich (Abteilung Klinische Psychiatrie und Psychotherapie der Medizinischen Hochschule Hannover) 3. Gutachter: Univ.-Prof. Dr. H. Hildebrandt (Institut für Zelluläre Chemie der Medizinischen Hochschule Hannover) 4. Gutachter: Univ.-Prof. Dr. A. Richter (Institut für Pharmakologie und Toxikologie des Fachbereichs Veterinärmedizin der Freien Universität Berlin) Tag der mündlichen Prüfung: 24.10.2009 Gefördert durch ein Promotionsstipendium der Konrad-Adenauer-Stiftung, Sankt Augustin. Für meine Mama Inhaltsverzeichnis 1. Einleitung……………………..…...…………………………...………........... S. 1 2. Literaturübersicht……….……………….…………………………………… S. 3 2.1 Epilepsien……………………………………………………………………… S. 3 2.2 Einordnung der Epilepsien……………………………………………...…… S. 4 2.3 Temporallappenepilepsie……………………………………………...…….. S. 7 2.4 Epilepsie-assoziierte Komorbiditäten………………………………...…….. S. 9 2.4.1 Depressionen……………………………………………………………….. S. 11 2.4.2 Angsterkrankungen………………………………………………...………. S. 14 2.4.3 Psychosen…………………………………………………………………… S. 15 2.4.4 Kognitive Defizite…………………………………………………………… S. 16 2.4.5 Weitere Epilepsie-assoziierte Komorbiditäten………...………………… S. 17 2.5 Tiermodelle für Epilepsien…………………………………………………… S. 18 2.5.1 Pilocarpin…………………………………………………………...……….. S. 19 2.5.2 Weitere Epilepsiemodelle………………………………………………….. S. 26 2.5.2.1 Kainat………………………………………………………...……………. S. 26 2.5.2.2 Elektroschock…………………………………………...………………... S. 26 2.5.2.3 Elektrische Stimulierung…………………………………………………. S. 27 2.5.2.4 Kindling…………………………………………………………………….. S. 27 2.5.2.5 Genetische Epilepsiemodelle…………………………………………… S. 27 2.6 Verhaltenstests für psychische und kognitive Veränderungen………….. S. 28 2.6.1 Eingangscharakterisierung und Überprüfung von Katalepsie…………. S. 28 2.6.2 Überprüfung von Exploration, Lokomotion und Angst-assoziiertem Verhalten………………………….……………………………………………….. S. 29 2.6.3 Überprüfung der motorischen Fähigkeiten………………………………. S. 31 2.6.4 Überprüfung der räumlichen Lern- und Gedächtnisleistung…………… S. 32 2.6.5 Untersuchung von Depressions-assoziiertem Verhalten………………. S. 33 2.6.6 Verhaltensphysiologische Charakterisierung von chronisch epileptischen Mäusen…………………………………….………………………. S. 34 2.6.7 Bedeutung der verwendeten Mausstämme……………………………… S. 35 3. Zielsetzung…………………………………………………………………….. S. 37 V 4. Material und Methoden………………………………………………………. S. 39 4.1 Haltung und Zucht der Versuchstiere……………………………………… S. 39 4.2 Dauerhafte Kennzeichnung der Versuchstiere……………………………. S. 42 4.3 Klassifizierung der Krampfintensität………………………………...……… S. 42 4.4 Chronisches Epilepsiemodell: Pilocarpin (Studien 1-3)………………….. S. 43 4.5 Akutes Epilepsiemodell: Elektroschock (Studie 2)……………………….. S. 44 4.6 Implantation corticaler Elektroden zur EEG-Ableitung…………………… S. 45 4.7 EEG-Ableitungen während Pilocarpin-Applikation………………………… S. 48 4.8 Überwachung spontaner epileptischer Anfälle……………………………. S. 48 4.9 Verhaltensbatterie……………………………………………………………. S. 50 4.9.1 Eingangscharakterisierung und Überprüfung von Katalepsie………… S. 52 4.9.2 Überprüfung von Exploration, Lokomotion und Angst-assoziiertem Verhalten…………………………………………………………………………… S. 54 4.9.3 Überprüfung der motorischen Fähigkeiten………………………………. S. 60 4.9.4 Überprüfung der räumlichen Lern- und Gedächtnisleistung…………… S. 63 4.9.5 Untersuchung von Depressions-assoziiertem Verhalten………………. S. 67 4.10 Histologie…………………………………………………………………….. S. 70 4.10.1 Gewinnung und Aufarbeitung der Gehirne…………………………….. S. 70 4.10.2 Thionin-Färbung…………………………………………………………… S. 71 4.10.3 Fluoro-Jade-C-Färbung………………………………………………….. S. 72 4.10.4 GFAP-Färbung……………………………………………………………. S. 72 4.10.5 Histologische Auswertung……………………………………………….. S. 73 4.10.5.1 Bewertung nach Scoring-System……………………………………... S. 73 4.10.5.2 Auswertung des Hilus des Gyrus dentatus….……………………….. S. 73 4.10.5.3 Auszählen von Neuronen innerhalb definierter Fenster……………. S. 74 4.11 Korrelationen zwischen Neurodegeneration und Verhaltensauffälligkeiten………………………………………………………...……………. S. 75 4.12 Statistische Berechnungen……………………………………………….... S. 75 5. Ergebnisse……………………………………………………………………... S. 77 5.1 Verhaltenscharakterisierung und histologische Untersuchung von (LiCl)-Pilocarpin-behandelten NMRI-Mäusen (Studie 1)……………………. S. 77 VI 5.1.1 Konsequenzen der Applikation von Pilocarpin, sowohl mit als auch ohne LiCl-Vorbehandlung………………………………………………………… S. 77 5.1.2 Detektion von spontanen Anfällen………………………………………... S. 79 5.1.3 Resultate der Verhaltensbatterie………….....…………………….……... S. 79 5.1.3.1 Überprüfung von Katalepsie…………………………………………….. S. 80 5.1.3.2 Überprüfung von Exploration, Lokomotion und Angst-assoziiertem Verhalten…………………………………………………………………………… S. 80 5.1.3.3 Überprüfung der räumlichen Lern- und Gedächtnisleistung………… S. 84 5.1.3.4 Untersuchung von Depressions-assoziiertem Verhalten…………….. S. 87 5.1.4 Resultate der histologischen Auswertung……………………………….. S. 88 5.1.4.1 Histologische Auswertung in Thionin-Färbung……………………….. S. 89 5.1.4.2 Histologische Auswertung von repräsentativen Tieren in FJC………. S. 93 5.1.4.3 Auswertung in FJC- und GFAP-Markierung…………………………… S. 95 5.1.5 Korrelationen zwischen Neurodegeneration und Verhaltensauffälligkeiten…………………………………………………………. S. 98 5.2 Etablierung des Pilocarpin-Modells sowie Unterschiede in der Sensitivität bei Substämmen und Sublinien von B6-Mäusen (Studie 2)…….. S. 100 5.2.1.1 Etablierung des Pilocarpin-Modells für die B6-Maus………………… S. 100 5.2.1.2 EEG-Aufzeichnungen während Pilocarpin-Applikation.…...………… S. 102 5.2.2 Untersuchung von Tieren der Barrieren 8 und 9 im Pilocarpin-Modell.. S. 103 5.2.2.1 Reproduzierung der Sensitivitätsunterschiede im Pilocarpin-Modell.. S. 103 5.2.2.2 Absolvierung des Open-Fields von Tieren der Barrieren 8 und 9….. S. 107 5.2.2.3 Untersuchung von Tieren aus Barriere 8 und 9 im MEST….…….…. S. 107 5.2.3 Untersuchung weiterer B6-Barrieren im Pilocarpin-Modell.……...…….. S. 108 5.2.4 Überprüfung der F1-Generation im Pilocarpin-Modell………………….. S. 109 5.2.5 Detektion von spontanen Anfällen bei der F1-Generation……………... S. 110 5.2.6 Erneute Untersuchung von Tieren aus Barriere 9 sowie von B6J im Pilocarpin-Modell…………………………………………………………...…. S. 111 5.2.7 Generierung der F2-Generation………………………………………….. S. 112 5.2.8 Untersuchung der F3-Generation im Pilocarpin-Modell……………….. S. 112 VII 5.3 Verhaltenscharakterisierung und histologische Untersuchung von Pilocarpin-behandelten B6-Mäusen (Studie 3)…..…………………………….. S. 114 5.3.1 Detektion von spontanen Anfällen………….…………………………….. S. 114 5.3.2 Resultate der Verhaltensbatterie………….………………………………. S. 115 5.3.2.1 Eingangscharakterisierung………………………………………………. S. 115 5.3.2.2 Überprüfungen von Exploration, Lokomotion und Angst-assoziiertem Verhalten…………………………………………………………………………… S. 116 5.3.2.3 Überprüfung der motorischen Fähigkeiten…………………………….. S. 123 5.3.2.4 Überprüfung der räumlichen Lern- und Gedächtnisleistung…………. S. 124 5.3.2.5 Untersuchung von Depressions-assoziiertem Verhalten…………….. S. 127 5.3.3 Resultate der histologischen Auswertung………………………………... S. 127 5.3.3.1 Histologische Auswertung 4 Wochen nach SE……………………….. S. 128 5.3.3.2 Histologische Auswertung 9 Monate nach SE………………………… S. 130 5.3.3.3 Vergleich der Zeitpunkte – 4 Wochen versus 9 Monate nach SE…... S. 133 5.3.3.4 Histologische Auswertung in FJC- und GFAP-Markierung…………... S. 134 6. Diskussion……………………………………………………………………… S. 137 6.1 Vergleich des LiCl-Pilocarpin- mit dem Pilocarpin-Modell (Studie 1).…... S. 137 6.2 Verhaltensphysiologische und histologische Charakterisierung von (LiCl-) Pilocarpin-behandelten NMRI- (Studie 1) sowie B6-Mäusen (Studie 3) ohne SE….……………………………………………………….. S. 139 6.3 FJC-Färbung der histologischen Schnitte der Pilocarpin-behandelten NMRI- (Studie 1) sowie B6-Mäuse (Studie 3) mit SE…………………….. S. 141 6.4 Bewertung der histologischen Schnitte der chronisch epileptischen NMRI- (Studie 1) sowie B6-Mäusen (Studie 3) in Thionin-Färbung…….. S. 143 6.5 Detektierung von spontanen Anfällen……………….……………………… S. 144 6.6 Vergleich der Verhaltensabweichungen von epileptischen B6- (Studie 3) zu NMRI-Mäusen aus Studie 1 sowie aus GRÖTICKE et al. (2007).…… S. 144 6.7 Substammes- sowie Sublinienunterschiede bei B6-Mäusen im Pilocarpin-Modell (Studie 2)………………………………………..……….. S. 152 7. Zusammenfassung…………………………………………………………… S. 159 8. Summary……………………………………………………………………….. S. 163 VIII 9. Literaturverzeichnis………………………………………………………….. S. 166 10. Anhang………………………………………………………………………… S. 183 10.1 Untersuchungsgang des Irwin-Tests..…………………………………….. S. 183 10.2 Protokoll der Thionin-Färbung……………………………………………… S. 189 10.3 Protokoll der FJC-Färbung…………………………………………………. S. 190 10.4 Protokoll der GFAP-Färbung……………………………………………….. S. 191 IX Abkürzungsverzeichnis: Abb. = Abbildung ANOVA = Analysis of variance (Varianzanalyse) Aqua dest. = Aqua destillata bzw. = beziehungsweise B6 = C57BL/6 CA = Cornu Ammonis (Ammonshorn des Hippocampus) CC50 = Convulsive Current bei 50% der Tiere cm = Zentimeter CV = Cued-Version des Morris-Water-Maze DAB = 3,3'-Diaminobenzidin d.h. = das heißt EEG = Elektroencephalogramm EPM = Elevated-Plus-Maze FJC = Fluoro-Jade-C GABA = Gamma-Amino-Buttersäure GFAP = Glial fibrillary acidic protein HB = Hole-Board-Test Hz = Hertz i.m. = intramuskulär i.p. = intraperitoneal JAX = Jackson Laboratory kg = Kilogramm LiCl = Lithiumchlorid LDB = Light-Dark-Box log = Logarithmus m = männlich mA = Milliampere mEq = Milliequivalent MEST = Maximal electroshock seizure threshold mg = Milligramm X Min. = Minute(n) ml = Milliliter mm = Millimeter MWM = Morris-Water-Maze µl = Mikroliter M1 = Subtyp muscarinerger Rezeptoren M1P = Myo-Inositol-1-Phosphat N = Norden NaCl = Natriumchlorid NMDA = N-Methyl-D-Aspartat NOE = Novel-Object-Exploration-Test O = Osten OP = Operation OF = Open-Field Pilo = Pilocarpin QTL = Quantitative Trait Loci RT = Retention-Test des Morris-Water-Maze s = Sekunden S = Süden s.c. = subcutan SE = Status epilepticus SEM = Standard error of the mean (Mittelwertfehler) SNP = Single Nucleotid Polymorphismen Tab. = Tabelle TLE = Temporallappenepilepsie w = weiblich W = Westen z. B. = zum Beispiel °C = Grad Celsius % = Prozent # = Barriere XI XII Einleitung 1. Einleitung Epilepsien zählen zu den häufigsten neurologischen Erkrankungen. Sie stellen eine Gruppe von heterogenen Syndromen dar und betreffen mehr als fünfzig Millionen Menschen weltweit (STABLES et al. 2002). Epilepsien werden als Krankheiten des Gehirns definiert, welche sich durch eine bestehende Prädisposition, spontan epileptische Krampfanfälle entstehen zu lassen, sowie durch neurobiologische, kognitive sowie psychosoziale Folgen dieser Anfallsgeschehen auszeichnen (FISHER et al. 2005). Die Definition Epilepsie erfordert die Ausprägung von mehr als einem epileptischen Anfall (FISHER et al. 2005). Jedoch schränken nicht nur die direkten klinischen Auswirkungen der Krampfanfälle die Lebensqualität der Epilepsiepatienten erheblich ein. Etwa 28 bis 58% der Epilepsiekranken sind zusätzlich von Epilepsie-assoziierten Komorbiditäten betroffen (POHLMANN-EDEN 2000). Die höchste Prävalenz haben die psychischen Begleiterkrankungen, insbesondere Depressionen, Angsterkrankungen und Psychosen (BORO u. HAUT 2003). Zudem erleiden 70% der Patienten mit Temporallappenepilepsie (TLE) erhebliche Einbußen im Lern- und Gedächtnisvermögen (HELMSTAEDTER u. KOCKELMANN 2006). Infolgedessen ergibt sich die Notwendigkeit, Tiermodelle zu generieren, welche nicht nur ein Modell für chronische Epilepsie darstellen, sondern auch psychische sowie kognitive Verhaltensänderungen zeigen, welche sich in einer Verhaltensbatterie detektieren lassen. Denn bislang werden die Mechanismen, die der Assoziation Epilepsie/psychische Störungen zugrunde liegen, noch nicht hinreichend verstanden (HERMANN et al. 2000). In der Arbeitsgruppe Löscher konnte anhand von zwei Studien (GRÖTICKE et al. 2007, 2008) dargestellt Auszuchtstammes NMRI werden, dass in Epilepsiemodellen zwei chronisch epileptische (Pilocarpin, Mäuse Kainat) des in verhaltensphysiologischen Untersuchungen im Vergleich zu gesunden Kontrolltieren Abweichungen zeigen. Als Untersuchungsparameter sind eine Überprüfung von Exploration und Lokomotion, von Angst-assoziiertem Verhalten, von motorischen Fähigkeiten, von Depressions-assoziiertem Verhalten sowie von räumlicher Lernund Gedächtnisleistung zu nennen. 1 Einleitung Im Rahmen der Auszuchtmausstamm PhD-Arbeit NMRI wurde weitergehend das Pilocarpin-Modell charakterisiert sowie für den für den Inzuchtmausstamm C57BL/6 (B6) etabliert. Der Mausstamm B6 wurde in der vorliegenden Arbeit – analog zu GRÖTICKE et al. (2007) – im Pilocarpin-Modell verhaltensphysiologisch sowie histologisch untersucht. Das Ziel der Studie bildet die Erfassung von Verhaltensänderungen bei epileptischen B6-Mäusen, um dieses Modell anschließend langfristig gesehen zur Untersuchung der Mechanismen von Komorbiditäten einsetzen zu können. 2 Literaturübersicht 2. Literaturübersicht 2.1. Epilepsien Der Begriff Epilepsie leitet sich vom griechischen Wort epilambánein (anfassen, befallen) ab und stellt hiermit bereits sprachlich das offensichtlichste klinische Merkmal dieser Erkrankung dar: den epileptischen Krampfanfall (ELGER 2002). Von epileptischen Anfällen können alle Funktionssysteme im Gehirn betroffen sein. Als klinische Symptome sind Zuckungen, Krämpfe oder Stürze zu nennen, aber auch Sinnessysteme können betroffen sein. Letzteres spiegelt sich in der Wahrnehmung von epigastrischen oder olfaktorischen Auren sowie visuellen Halluzinationen wider. Ferner können während eines epileptischen Anfalls Veränderungen des Bewusstseins, der Sprache, des Gedächtnisses oder auch der Befindlichkeit existieren. Bisweilen werden komplexe Handlungen wie automatisch weitergeführt (ELGER 2002). Das Risiko, einmal im Leben einen epileptischen Anfall zu erleiden, ist nicht gering: 10% der 80-jährigen erleiden während ihres Lebens einen einzelnen Krampfanfall (ELGER 2002). Von der Erkrankung Epilepsie spricht man jedoch erst, wenn mehr als ein epileptischer Anfall auftritt (FISHER et al. 2005). Je nach geographischer Lokalisation haben Epilepsien eine Prävalenz zwischen 0,5 und 1 %, die Inzidenz beträgt 40 bis 200 pro 100000 Menschen (SANDER u. SHORVON 1996). In Minnesota (USA) betrug die Inzidenz von Epilepsien in den Jahren 1935 bis 1984 44 pro 100000 Personen, von welchen signifikant mehr Männer als Frauen betroffen waren (HAUSER et al. 1993). In der Bundesrepublik Deutschland liegt die Prävalenz von Epilepsien bei etwa 800000 Betroffenen, jährlich erkranken 40000 Menschen neu (ELGER 2002). Bei Säuglingen unter 12 Monaten ergibt sich eine Inzidenz von 145,8 Neuerkrankungen pro 100000 Kindern (FREITAG et al. 2001). Epilepsien zählen infolgedessen zu den häufigsten neurologischen Erkrankungen (ELGER 2002). Auch bei verschiedenen Tierarten, vor allem bei Hund und Katze, gelten Epilepsien als häufig, wobei sie hinsichtlich Symptomatik und Häufigkeit vergleichbar mit denen des Menschen sind (LÖSCHER 2003). Epilepsien stellen in der Veterinärmedizin die 3 Literaturübersicht wichtigste chronische Hirnerkrankung dar, welche pharmakotherapeutisch behandelt wird (LÖSCHER 2003). 2.2 Einordnung der Epilepsien In der Humanmedizin werden epileptische Anfälle und Epilepsien nach der „Kommission der Internationalen Liga gegen Epilepsie“ (ILAE) international klassifiziert. Wie SCHMIDT (1992a) ausführt, werden epileptische Anfälle in fokale (partielle) und generalisierte Anfälle unterteilt. Fokale Anfälle haben ihren Ursprung in einer umschriebenen Hirnregion, von welcher sie sich über weitere Gehirnareale ausbreiten können. Infolge der Ausbreitung können schließlich beide Hemisphären betroffen sein, dies bezeichnet man als sekundäre Generalisierung. Als besonders epileptogen gelten der motorische Cortex sowie die Hippocampus-Amygdala-Region. Bei fokalen Anfällen werden einfach fokale (ohne Bewusstseinsstörung) und komplex fokale (mit Bewusstseinsstörung) unterschieden (SCHMIDT 1992a). Bei primär generalisierten Anfällen sind von Beginn an beide Hemisphären des Gehirns von epileptischer Aktivität betroffen, infolgedessen kann das Bewusstsein gestört sein. Motorische Erscheinungen treten bilateral auf (INTERNATIONALE LIGA GEGEN EPILEPSIE). Diagnose und Klassifikation von epileptischen Anfällen und Epilepsien werden üblicherweise anhand eines Elektroencephalogramms (EEG) ermittelt. Das EEG zeichnet im Zeitverlauf Differenzen zwischen den elektrischen Potenzialen an Lokalisationen des Schädels auf, welche gepaart angeordnet sind (FISHER 1989). Iktale (während des Anfalls) Veränderungen im EEG bei primär generalisierten Anfällen sind bilateral zu beobachten (INTERNATIONALE LIGA GEGEN EPILEPSIE). Eine Übersicht über die EEG-Veränderungen bei verschiedenen Anfallstypen stellt Tabelle 2.1 dar: 4 Literaturübersicht Klinischer Anfallstyp Iktale EEG-Charakteristik A. 1. Absencen a) mit Bewusstseinsstörung b) mit milden Komponenten myoklonischen c) mit atonischen Komponenten Gewöhnlich reguläre und symmetrische 3/sec oder auch 2-4/sec Spike-andslow-wave-Komplexe, evtl. Poly-spike-and-slow-waveKomplexe. Die Abnormitäten sind bilateral. d) mit tonischen Komponenten Interiktale Charakteristik EEG- Gewöhnlich normale Hintergrundaktivität, wobei paroxysmale Aktivität auftreten kann (wie Spikes oder Spike-and-slow-waveKomplexe). Diese Aktivität ist gewöhnlich regelmässig und symmetrisch. e) mit Automatismen f) mit vegetativen Komponenten (b bis f können allein oder in Kombination auftreten) 2. Atypische Absencen Stärker heterogenes EEG; es kann irreguläre Spikeand-slow-wave-Komplexe einschliessen, schnelle Aktivität oder andere paroxysmale Aktivität. Die Abnormitäten sind beidseitig, aber oft irregulär und asymmetrisch. Gewöhnlich abnorme Hintergrundaktivität; die paroxysmale Aktivität (z.B. Spikes und Spike-and-slowwave-Komplexe) ist häufig irregulär und asymmetrisch. Poly-spikes-and-wavesKomplexe, in anderen Fällen Spikes-and-waves oder Sharp-and-slowwaves. Wie iktal. C. Klonische Anfälle Schnelle Aktivität (10/sec oder schneller, sharp wave) und langsame Wellen (wave); gelegentlich Spikeand-wave-Muster. Spike-and-wave- oder Polyspike-and-waveEntladungen D. Tonische Anfälle Kleinamplitudige schnelle Aktivität oder ein schneller Rhythmus von 9-10/sec (sharp wave) oder darüber, der in der Frequenz abnimmt und in der Amplitude zunimmt. Mehr oder weniger rhythmische Entladungen von Sharp-and-slow-waves manchmal asymmetrisch. Die Hintergrundaktivität ist oft nicht altersentsprechend. Möglich sind: a) ausgeprägtere Tonusveränderungen als in A.1. b) kein Schluss abrupter Anfang oder B. Myoklonische Anfälle Myoklonische Zuckungen (einzeln oder multipel) 5 Literaturübersicht E. Tonisch-klonische Anfälle Rhythmus von 10/sec (sharp wave) oder schneller, der während der tonischen Phase in der Frequenz abund in der Amplitude zunimmt und während der klonischen Phase durch langsame Wellen (wave) unterbrochen wird. Poly-spikes-and-waves oder Spike-and-waveoder manchmal Sharp-and-slowwave-Entladungen. F. Atonische (astatische) Anfälle Poly-spikes-and-waves oder Abflachung oder kleinamplitudige schnelle Aktivität. Poly-spikes-and-slowwaves. (Kombinationen sind möglich, z.B. B und F, B und D) Tab. 2.1: Übersicht über EEG-Veränderungen bei verschiedenen klinischen Anfallstypen (modifiziert nach der INTERNATIONALEN LIGA GEGEN EPILEPSIE) Laut SCHMIDT (1992b) werden Epilepsien und epileptische Syndrome vier Klassen zugeordnet: 1. Fokale (lokalisationsbezogene, lokale, partielle) Epilepsien und Syndrome 2. Generalisierte Epilepsien 3. Epilepsien und Syndrome, die nicht als fokal oder generalisiert bestimmt werden können (z.B. Neugeborenenkrämpfe) 4. Spezielle Syndrome (z.B. Fieberkrämpfe, akuter metabolischer oder toxischer Anlass wie Alkohol, Medikamente, Eklampsie oder nichtketonische Hyperglykämie) In der Veterinärmedizin wird üblicherweise nur zwischen generalisierten und fokalen Epilepsien differenziert. Generalisierte Anfälle werden lediglich als generalisierte, tonisch-klonische (Grand mal) Anfälle diagnostiziert. Diese können die einzige Anfallsform einer generalisierten Epilepsie darstellen, oder sekundär nach fokalen Anfällen bei einer partiellen Epilepsie auftreten. In der Humanmedizin gelten komplex fokale Anfälle als die mit Abstand häufigste Epilepsieform (rund 40% aller Epilepsiepatienten). Bei Haustieren scheinen fokale Anfälle (häufig in Kombination mit sekundär generalisierten tonisch-klonischen Anfällen) ebenfalls häufiger aufzutreten als rein primär generalisierte Anfälle, wenn auch zu sagen ist, dass der fokale Anfallsbeginn oft nicht erkannt oder diagnostiziert wird (LÖSCHER 2003). 6 Literaturübersicht Nach SCHMIDT (1992b) wird in ätiologischer Hinsicht zwischen idiopathischen, symptomatischen sowie kryptogenen Epilepsien differenziert. Der Begriff idiopathisch bedeutet, dass keine andere Grunderkrankung der Epilepsie vorangeht oder diese auslöst. Der Beginn idiopathischer Epilepsien ist üblicherweise altersgebunden, ferner zeichnen sie sich durch klinische Symptome und charakteristische EEGVeränderungen sowie eine vermutete genetische Ätiologie aus. Symptomatische Epilepsien treten als Folge einer bekannten oder vermuteten Erkrankung des zentralen Nervensystems auf. Sie haben in der Regel keinen altersgebundenen Beginn, ihr Verlauf, sowie die elektroklinischen Charakteristika werden von der Grunderkrankung mitbestimmt. Alle übrigen Epilepsien, deren Ursache verborgen oder nicht zu ergründen ist, werden mit dem Begriff kryptogen bezeichnet. Kryptogene Epilepsien werden zwar als symptomatisch angesehen, ihre Ätiologie ist jedoch nicht bekannt. Sie haben häufig einen altersgebundenen Beginn, jedoch sind keine charakteristischen EEG-Veränderungen und klinischen Symptome vorhanden (SCHMIDT 1992b). Nach NOE und MANNO (2005) wird ein Status epilepticus (SE) als Zustand anhaltender oder wiederkehrender Anfallsaktivität für mindestens 30 Minuten (Min.) definiert und stellt einen medizinischen Notfall dar. Betroffene Patienten müssen unmittelbar notärztlich behandelt werden, dennoch sterben 20% der sich im SE befindenden Patienten, da der SE medikamentös nicht beendet werden kann. Ein SE kann spontan auftreten oder durch Absetzen von antikonvulsiven Medikamenten ausgelöst werden. Dies geschieht oft in Kombination mit Schlafentzug, Fieber, Alkohol oder Alkoholentzug und tritt bei jedem zehnten Patienten mit Epilepsie auf (SCHMIDT 1992b). 2.3 Temporallappenepilepsie Die Temporallappenepilepsie (TLE) gilt als die häufigste Epilepsieform beim Menschen (ENGEL 2001). Fokale Epilepsien treten bei 58,3% der Epilepsiepatienten auf; der Anteil der Temporal-, Frontal-, Parietal- und Okzipitallappenepilepsien beträgt bei den symptomatischen Epilepsien 11,1% sowie bei den kryptogenen Epilepsien 25% (FREITAG et al. 2001). 7 Literaturübersicht Als Hauptcharakeristika der TLE sind folgende zu nennen: Die Lokalisation der Anfallsfoki befindet sich im limbischen System, insbesondere im Hippocampus, im entorhinalen Cortex sowie in der Amygdala (CURIA et al. 2008). Die Darstellung des Ablaufs der Epileptogenese findet sich in Abbildung 2.1 wieder (LÖSCHER et al. 2008). Häufig geht der Entwicklung einer chronischen Epilepsie ein initialer Gehirninsult voraus, beispielsweise Fieberkrämpfe im Kindesalter, ein Gehirntumor, ein Schlaganfall, eine Entzündung des Gehirns oder ein SE. An diesen Insult schließt sich eine beim Menschen Jahre dauernde Latenzzeit an, in welcher keine klinischen Symptome zu beobachten sind. Es folgt schließlich die chronische Phase der Epilepsie mit dem spontanen und wiederkehrenden Auftreten von epileptischen Anfällen. Ein hoher Prozentsatz der Epilepsiepatienten ist von einer mesialen oder Cornu-Ammonis (CA)-Sklerose betroffen. Dies bedeutet, dass eine unilaterale Läsion des Hippocampus zu Atrophie führt, typischerweise verursacht aufgrund eines Verlusts an Neuronen wie auch einer Gliose im sogenannten Sommer’s-Sektor (die Subiculum-CA 1-Übergangszone) und im Hilus des Gyrus dentatus (CURIA et al. 2008). Abb. 2.1: Darstellung des Ablaufs der Epileptogenese (LÖSCHER et al. 2008). 8 Literaturübersicht 2.4. Epilepsie-assoziierte Komorbiditäten Mehr als 50% aller erwachsenen Epilepsiepatienten sind von psychischen Komorbiditäten betroffen (MACHLEIDT 2004). Bei der nicht-epileptischen USamerikanischen Bevölkerung lag im Jahre 2008 der Anteil von psychisch erkrankten Personen bei 26,2% (NIMH 2008), also deutlich niedriger als bei Epilepsiepatienten. Eine hohe Anfallsfrequenz bei Therapieresistenz geht häufig einher mit einem geringeren Ausbildungs- und beruflichen Leistungsniveau, weniger guten Ergebnissen in neuropsychologischen Tests sowie einem vermehrten Bestehen von Schwierigkeiten im psychischen und sozialen Bereich (MACHLEIDT 2004). Ferner besteht auch in heutiger Zeit eine gewisse gesellschaftliche Neigung zur Stigmatisierung Epilepsiekranker, so dass eine Behinderung bei der beruflichen und sozialen Eingliederung in die Gesellschaft zu diversen Verstimmungszuständen führen kann (MACHLEIDT 2004). Diskutiert wird eine Wechselbeziehung zwischen Epilepsie und psychischen Komorbiditäten (POHLMANN-EDEN 2000). Treten epileptische Anfälle als Komplikation einer psychiatrischen Erkrankung auf, oder gelten psychische Störungen als Komplikation eines epileptischen Geschehens? Für die erste Aussage spricht, dass epileptische Anfälle den Verlauf psychischer Grunderkrankungen komplizieren können und gehäuft bei älteren Patienten mit demenzieller Grunderkrankung auftreten (MCAREAVEY et al. 1992). 9,1 % der Patienten mit einer Demenzerkrankung sind von epileptischen Anfällen betroffen (MCAREAVEY et al. 1992). Nicht selten können epileptische Anfälle zudem bei psychopharmakologisch behandelten Patienten mit Schizophrenien und affektiven Psychosen als Komplikation einer Neuro- bzw. Thymoleptikagabe beobachtet werden (POHLMANNEDEN 2000). Die zweite Hypothese befürwortend, lässt sich sagen, dass psychische Auffälligkeiten bei Epilepsiepatienten infolge der epileptischen Anfälle selbst, der cerebralen Grunderkrankung, der antikonvulsiven Medikation, der psychosozialen Reaktionsmuster, oder infolge einer Kombination aus diesen Faktoren entstehen können (POHLMANN-EDEN 2000). In einer Studie (THAPAR et al. 2005) konnte gezeigt werden, dass depressive Symptome die Anfallshäufigkeit beeinflussen 9 Literaturübersicht können und umgekehrt, so dass auf eine bidirektionale Korrelation zwischen dem Auftreten von Depressionen und Epilepsien geschlossen wurde. Grundsätzlich lässt sich also feststellen, dass die Grundlagen für diese Funktionsstörungen sehr vielfältig sind. Aufgrund eines Fehlens an Kontrolle über potenziell signifikante Variable, wie den fokalen Ursprung des Anfalls und der unterschiedlichen Anamnese der Patienten (beispielsweise Vorbehandlung mit Medikamenten), ist es schwierig, diese Grundlagen in den Patienten selbst zu untersuchen. Infolgedessen wird ein passendes Tiermodell benötigt, um mögliche Grundlagen für Verhaltensänderungen bei der TLE zu identifizieren (HANNESSON et al. 2005). Derzeit besteht lediglich ein präliminäres Verständnis über die zusätzlichen Belastungen, welche durch psychische Komorbiditäten bei chronischer Epilepsie entstehen, obwohl die Prävalenz der Komorbiditäten signifikant erhöht ist (HERMANN et al. 2000). Es gibt in der gegenwärtigen Literatur lediglich rudimentäre Informationen bezüglich der Anwendung von Therapeutika bei depressiv erkrankten Epilepsiepatienten, sowie bezüglich der generellen Folgen einer Depression, welche als Komorbidität auftritt (HERMANN et al. 2000). Weitere Forschung ist notwendig, um das Verständnis über die Mechanismen der psychiatrischen Erkrankungen bei Epilepsien zu steigern. Ein Zuwachs an Wissen und Erkenntnis der nachteiligen Wirkungen der Komorbiditäten hat das Ziel, die mechanismen- und patientenorientierte Forschung sowie die klinische Behandlung zu verbessern (GILLIAM et al. 2003). Der Fokus der Forschung richtete sich in der Vergangenheit vorwiegend auf die klinischen Folgen der Anfälle (beispielsweise Dauer der Erkrankung, Frequenz und Schwere der Anfälle) oder auf die Wirkungsweise der Behandlung (wie Medikation, operative Behandlung, Stimulation des Vagusnervs) und deren Auswirkungen auf die Lebensqualität der Epilepsiepatienten (JOHNSON et al. 2004). Demgegenüber sind der Grad, in welchem Komorbiditäten die Lebensqualität beeinflussen und die relative Bedeutung der psychiatrischen Morbidität verglichen mit traditionellen klinischen Parametern der Epilepsie neu (JOHNSON et al. 2004). 10 aufkommende Forschungsgebiete Literaturübersicht Es wurde eine Studie an Patienten durchgeführt, welche in den letzten sechs Monaten mindestens einen epileptischen Anfall erlitten (GILLIAM et al. 2003). Abbildung 2.2 verdeutlicht anhand der Ergebnisse der Studie, welch immense Auswirkungen Epilepsie auf das tägliche Leben der Patienten hat, denn über 60% der untersuchten Patienten fürchten um ihren Führerschein, 55% um ihre Unabhängigkeit sowie über 50% der Epilepsiepatienten sorgen sich um ihren Arbeitsplatz. Abb. 2.2: Besorgnisse von Epilepsiepatienten (GILLIAM et al. 2003) 2.4.1 Depressionen Die höchste Prävalenz der psychischen Komorbiditäten bei Epilepsiepatienten haben depressive Symptome (GILLIAM u. KANNER 2002). So beträgt die Häufigkeit von Depressionen bei Patienten mit TLE je nach Studie 30 (VICTOROFF et al. 1994) bis 39% (ALTSHULER et al. 1999), bei Epilepsiepatienten mit komplex partiellen Anfällen sogar 57% (BLUMER et al. 1998). In einer weiteren Studie (THAPAR et al. 2005) galten 11,6% der Epilepsiepatienten als depressiv, 50,7% der untersuchten Patienten waren mehr als ein Jahr anfallsfrei. Analog galten in der USamerikanischen Bevölkerung im Jahre 2008 9,5% der Erwachsenen als depressiv erkrankt (NIMH 2008). In einer weiteren Studie (LEHRNER et al. 1999) unternahmen 36% der Patienten Aktivitäten mit der Familie zu Hause, jedoch nur 13% berichteten von sozialen und nur 7% von kulturellen Aktivitäten außerhalb der eigenen Wohnung. 44,6% der untersuchten TLE-Patienten galten als depressiv erkrankt, zwischen der Lokalisation 11 Literaturübersicht des Anfallsursprungs im Gehirn und dem Auftreten von Depressionen konnte kein signifikanter Unterschied detektiert werden (LEHRNER et al. 1999). Depressionen werden unterteilt in schwere depressive Episoden mit psychotischen Symptomen (einschließlich majorer Depressionen), Dysthymien sowie leichte depressive Episoden aufgrund von Anzahl, Schwere und Chronizität der folgenden Symptome: Deprimiertheit, Anhedonie, Wortlosigkeit, Schuldgefühle, herabgesetzte Konzentrationsfähigkeit, wiederkehrende Todesgedanken wie auch neurovegetative Symptome, insbesondere Gewichtsverlust oder Schlaflosigkeit (KANNER 2003). TLE stellt einen Risikofaktor für das Auftreten von Depressionen bei Epilepsiepatienten dar (BORO u. HAUT 2003). Es werden gemeinsame pathogenetische Mechanismen zwischen Epilepsien, Suizid und Depressionen vermutet (KANNER 2006). Eine Studie (HESDORFFER et al. 2000) stellt dar, dass majore Depressionen mit einem um den Faktor 6 erhöhten Risiko zur Ausprägung epidemiologischen Studie von Krampfanfällen von FORSGREN assoziiert und sind. NYSTRÖM Nach einer (1990) treten Depressionen signifikant häufiger bei Epilepsiepatienten im Vergleich zu gesunden Kontrollen auf. Überdies zeigt eine weitere Studie (HESDORFFER et al. 2006), dass eine Anamnese von majoren Depressionen oder versuchtem Suizid unabhängig voneinander das Risiko von unprovozierten Anfällen und Epilepsie steigert. Strukturelle und funktionelle Abnormalitäten und abnormale Gehirnsekretion von Neurotransmittern, wie beispielsweise Serotonin, zählen zu den gemeinsamen pathogenetischen Mechanismen von Epilepsien, Suizid sowie majore Depressionen (KANNER 2006). So wird auf eine Beziehung zwischen abnormaler Serotoninaktivität und suizidalem Verhalten zu verschiedenen psychiatrischen Erkrankungen geschlossen (KANNER 2006). Bei depressiv erkrankten Patienten können strukturelle Abnormalitäten oder Volumenverlust der Temporal- und Frontallappen nachgewiesen werden (SHELINE 2003). Diskutiert werden als Ursachen die neurotoxische Wirkung von Glukokortikoiden, eine geringere Konzentration des Brain-derived-growth-factors, eine verminderte Neurogenese sowie ein Verlust der neuronalen Plastizität (SHELINE 2003). Ferner dokumentiert eine neuropathologische Studie, dass an majoren Depressionen erkrankte Patienten im 12 Literaturübersicht präfrontalen Cortex eine verminderte Dichte und Größe von Neuronen sowie von Gliazellen aufweisen (RAJKOWSKA et al. 1999). Aufgrund dieser Daten ist es nicht überraschend, dass Depressionen häufiger bei Patienten mit TLE auftreten als bei gesunden Individuen (KANNER 2006). Die Hypothese, welche es für die Zukunft zu klären gilt, lautet, dass eine rechtzeitige Behandlung der Depression das Risiko der Entwicklung von unprovozierten epileptischen Anfällen oder sogar von Epilepsien mindert (KANNER 2006). Die Suizidrate liegt bei Epilepsiepatienten etwa um das Drei- bis Fünffache höher als in der Normalbevölkerung (1,5-2%) (MACHLEIDT 2004). Nach einer Fallkontrollierten Studie (FUKUCHI et al. 2002) tritt Suizid bei 14% der verstorbenen TLE-Patienten auf. Die Korrelation zwischen Suizid und TLE ist statistisch signifikant (FUKUCHI et al. 2002). MAINIO et al. (2007) setzen in ihrer Studie die Daten des Zeitpunkts der Diagnose Epilepsie, die Prävalenz von Depressionen sowie von Suizid in Verhältnis zueinander (Abb. 2.3). 13 Literaturübersicht Abb. 2.3: Korrelation zwischen der Komorbidität Depression, dem Auftreten von Suizid sowie dem Zeitpunkt der Diagnose Epilepsie in einer Studie, welche im Norden Finnlands durchgeführt wurde (MAINIO et al. 2007). 2.4.2 Angsterkrankungen Auch Angsterkrankungen stellen eine nicht zu unterschätzende Komorbidität bei Epilepsiepatienten dar. Nach einer epidemiologischen Studie ist die Anfallshäufigkeit mit dem Auftreten von Angstzuständen positiv korreliert, denn nur 13% der Patienten ohne derzeitige Anfallsaktivität, jedoch 29% mit weniger als einem Krampfanfall 14 Literaturübersicht sowie 44% mit mehr als einem Krampfanfall pro Monat litten an Angstzuständen (JACOBY et al. 1996). In einer weiteren Studie (PIAZZINI et al. 2001) konnte ein signifikanter Unterschied zwischen dem Auftreten von Angststörungen bei Epilepsiepatienten zu gesunden Kontrollen festgestellt werden. Ferner ergab sich eine erhöhte Prävalenz von Angsterkrankungen bei Patienten mit fokalen Anfällen im Vergleich zu Patienten mit idiopathischer generalisierter Epilepsie. Patienten der TLE waren am häufigsten von Angststörungen betroffen, insbesondere solche mit einem Anfallsfokus im linken Temporallappen (PIAZZINI et al. 2001). In der nicht-epileptischen Bevölkerung lag im Jahre 2008 die Prävalenz von Angsterkrankungen bei 18,1% der erwachsenen US-Amerikaner (NIMH 2008). Angsterkrankungen können präiktal (mehrere Stunden bis Tage vor dem Anfall), iktal, interiktal (zwischen den Anfällen) sowie postiktal (Stunden bis Tage nach dem Anfall andauernd) auftreten (VAZQUEZ u. DEVINSKY 2003). Die iktalen Angststörungen stellen sich üblicherweise als Angst, Furcht oder Besorgnis dar. Sie treten bei Patienten mit TLE am häufigsten auf (VAZQUEZ u. DEVINSKY 2003). Innerhalb der iktalen Angsterkrankungen wird zwischen Panikstörungen (wiederkehrende unerwartete Panikattacken), generalisierten Angsterkrankungen (fast täglich ausgeprägte Angst und Besorgnis über viele Angelegenheiten seit mindestens 6 Monaten), Zwangsstörungen (wiederkehrende Zwangshandlungen, treten nur selten bei Epilepsie auf) oder posttraumatischen Belastungsstörungen (wiederkehrendes Trauma in Träumen oder Gedanken, emotionale Betäubung, autonome Übererregung) differenziert. Letztere treten am häufigsten bei Patienten mit limbischer Epilepsie auf, hierzu zählt auch TLE (VAZQUEZ u. DEVINSKY 2003). 2.4.3 Psychosen Schließlich möchte ich an dieser Stelle auf eine weitere bedeutende Komorbidität, die Psychosen, hinweisen, welche gleichfalls die Lebensqualität der Epilepsiepatienten stark beeinträchtigen. Analog zu Angsterkrankungen können auch Psychosen in allen drei Stadien auftreten: iktal (d.h. ein Ausdruck der Anfallsaktivität), postiktal (Auftreten innerhalb von 7 Tagen nach dem Anfall) sowie interiktal (Vorkommen von Psychosen 15 Literaturübersicht unabhängig von Anfällen) (KANNER 2000). Die interiktalen Psychosen haben bei Epilepsiepatienten eine Häufigkeit von 9% (MENDEZ et al. 1993), die postiktalen Psychosen eine Prävalenz von 6% (KANNER et al. 1996). Klinische Beobachtungen zeigen bei TLE-Patienten einen erhöhten prozentualen Anteil an interiktalen Psychosen, auch das Volumen der Amygdala bei Patienten mit TLE und Psychosen ist erhöht (TRIMBLE u. VAN ELST 2003). Bei TLE-Patienten sowohl mit interiktalen, als auch postiktalen Psychosen können psychomotorische Erregung, Feindlichkeit, Misstrauen sowie Halluzinationen beobachtet werden (ADACHI et al. 2000). Eine weitere Studie (KANEMOTO et al. 2001) stellt die enge Korrelation zwischen TLE und interiktalen Psychosen dar. Es ergibt sich eine signifikante Korrelation zwischen einem frühen Beginn der Epilepsie sowie einer Anamnese von anhaltenden Fieberkrämpfen mit interiktalen Psychosen (KANEMOTO et al. 2001). Insbesondere bei medialer TLE treten Psychosen häufig auf (KANEMOTO et al. 2001). Sowohl Frontal- als auch Temporallappen können in die Pathophysiologie von postiktalen Psychosen involviert sein (BORO u. HAUT 2003). 2.4.4 Kognitive Defizite Zu den weitreichenden Konsequenzen von Epilepsien zählen auch Beeinträchtigungen von Lern- und Gedächtnisvermögen, denn das Gedächtnis ist eine Funktion, welche unmittelbar von Temporallappenläsionen und funktionalen Störungen beeinflusst wird (MOTAMEDI u. MEADOR 2003). TLE betrifft typischerweise das deklarative Gedächtnis (HELMSTAEDTER 2002), infolgedessen haben fast 70% der TLE-Patienten große Schwierigkeiten, sich an Ereignisse und persönliche Erfahrungen zu erinnern, es ist also insbesondere das episodische Gedächtnis beeinträchtigt (HELMSTAEDTER u. KOCKELMANN 2006). Ferner weisen etwa 30% der Patienten eine niedrige Intelligenz auf, welche sich in einem Intelligenzquotienten von unter 85 widerspiegelt (HELMSTAEDTER u. KOCKELMANN 2006). Eine weitere Studie (BEGHI et al. 2006) stellt dar, dass die Prävalenz von Lerndefiziten in der gesunden Bevölkerung 2-10% sowie bei Epilepsiepatienten 25% beträgt. 16 Literaturübersicht Nach BROWN (2006) werden folgende Ursachen für die Defizite bei Lern- und Gedächtnisvermögen von Epilepsiepatienten diskutiert: Die Grunderkrankung, welche der Epilepsie zugrunde liegt, die direkten Auswirkungen der Krampfanfälle sowie der paroxysmalen EEG-Veränderungen selbst, der Einfluss von Antiepileptika oder auch die psychosozialen Folgen der Diagnose Epilepsie. Epilepsiechirurgische Eingriffe haben oft einen erheblichen Einfluss auf die kognitive Leistung (HELMSTAEDTER 2002). Während nach Resektion eines Teiles des Temporallappens als Ursprungsort für die Krampfanfälle die epileptischen Anfälle sehr erfolgreich kontrolliert werden können, erfolgt eine Verschlechterung der Gedächtnisleistung, wenn Gehirngewebe entfernt wird, welches in Gedächtnisfunktionen involviert ist (HELMSTAEDTER u. KURTHEN 2001). Ferner gibt es Hinweise, dass bei Patienten nach einer linken Amygdalo-Hippocampektomie rechte mesiale Strukturen verbale Gedächtnisfunktionen kompensieren können, welche vor der Durchführung des chirurgischen Eingriffs mit dem linken mesialen Gehirnlappen assoziiert waren (GRUNWALD et al. 1998). Vermutlich liegt eine positive Korrelation zwischen der Anfallshäufigkeit und dem Auftreten von Gedächtnisschwierigkeiten vor, denn nur 17% der anfallsfreien Epilepsiepatienten zeigen im Gegensatz zu 21% mit 2-12 Anfällen pro Jahr, sowie zu 38% mit mehr als 12 Anfällen pro Jahr eine signifikante Verschlechterung der Gedächtnisleistung (HELMSTAEDTER 2002). 2.4.5 Weitere Epilepsie-assoziierte Komorbiditäten Sowohl Migräne als auch Epilepsien stellen chronische Erkrankungen dar, welche sich aufgrund von wiederkehrenden neurologischen Attacken (Kopfschmerzen bzw. Krampfanfällen) charakterisieren lassen (BIGAL et al. 2003). Die Prävalenz von Migräne ist bei Epilepsiepatienten um den Faktor 2,4 höher als bei nichtepileptischen Personen (BIGAL et al. 2003). Als Risikofaktoren für das Auftreten von Migräne bei Epilepsiepatienten gelten eine familiäre Anamnese von Migräne (Erhöhung des Risikos um den Faktor 1,5) oder Epilepsien sowie weibliches Geschlecht (OTTMAN u. LIPTON 1996). 17 Literaturübersicht Als weitere Komorbidität von Epilepsien gelten Schlafstörungen (BAZIL 2003). Sie können sowohl aufgrund der Krampfanfälle selbst als auch durch Antiepileptika induziert werden (BAZIL 2003). Etwa ein Drittel bis 50% der Patienten, welche von Epilepsien mit schwerem und langwierigem Verlauf betroffen sind, zeigen charakteristische Persönlichkeitsveränderungen (POHLMANN-EDEN 2000). Insbesondere bei Patienten der treten eine labile Emotionalität oder Tendenzen zum Haftenden TLE (penible Ordentlichkeit, Starrigkeit, Detailverliebtheit, Umständlichkeit) sowie Hyposexualität auf (POHLMANN-EDEN 2000). Zu letzterem führt eine Unterbrechung von Funktionssystemen, welche das Sexualverhalten steuern. Hier ist insbesondere das limbische System zu nennen. Als Ursachen gelten epileptiforme Entladungen wie auch hypothalamisch-hypophysäre Dysbalancen, welche teilweise aufgrund von Antiepileptika induziert werden können (POHLMANN-EDEN 2000). Die Fruchtbarkeitsrate bei Frauen mit Epilepsien beträgt 60-80% im Vergleich zu gesunden Frauen, bei Männern ist die Fruchtbarkeit nach einem Anfall reduziert, insbesondere wenn es sich um eine komplex-partielle Epilepsie handelt (PENOVICH 2000). 2.5 Tiermodelle für Epilepsien In der präklinischen Forschung von Epilepsien spielen Tiermodelle bei der Suche nach neuen antiepileptischen Medikamenten, bei der Einschätzung von möglichen spezifischen Wirksamkeiten von Substanzen gegen verschiedene Typen von Anfällen oder Epilepsien, sowie schließlich bei der Definition der präklinischen Wirksamkeit von neuen Antiepileptika während chronischer Anwendung eine wichtige Rolle. Ein ideales Tiermodell für Epilepsie sollte laut LÖSCHER (1999) folgende Voraussetzungen erfüllen: (1) Entwicklung von spontanen wiederkehrenden Anfällen (2) Anfallstyp(en), die in der klinischen Ausprägung denen beim Menschen ähneln (3) Paroxysmale EEG-Veränderungen ähnlich zu denen beim Menschen 18 Literaturübersicht (4) Eine hohe Anfallsfrequenz für akute wie auch chronische Medikamentenwirksamkeitsstudien (5) Die Phamakokinetik der Antiepileptika (v. a. die Eliminationsrate) sollte eine Aufrechterhaltung von wirksamen Medikamentenspiegeln während chronischer Behandlung gewährleisten. (6) Wirksame Plasma- (und Gehirn-) Konzentrationen von Antiepileptika ähnlich zu denen beim Menschen 2.5.1 Pilocarpin Pilocarpin, ein Alkaloid, welches in den Blättern des Jaborandistrauches vorkommt (AVANCINI et al. 2003), stellt einen Agonisten des Acetylcholinrezeptors dar, welcher den M1-Muscarinrezeptorsubtyp aktiviert (HAMILTON et al. 1997). Dass dieser maßgeblich an der Entwicklung von Anfallsgeschehen beteiligt ist, zeigt eine Studie (HAMILTON et al. 1997), nach welcher M1-Rezeptor-knock-out-Mäuse auch nach hohen Dosen von Pilocarpin keine Anfälle entwickeln, dagegen alle getesteten Wildtyp-Mäuse. Es lässt sich ableiten, dass die M1-Rezeptor-knock-out-Mäuse gegenüber Pilocarpin-induzierten Anfällen resistent sind. Dies verdeutlicht die Bedeutung der M1-Rezeptoren für die Induzierung von Anfällen mittels Pilocarpin. Ein Pilocarpin-induzierter SE kann ferner nach vorheriger systemischer Applikation von Atropin, einem muscarinergen Antagonisten, unterdrückt werden (CLIFFORD et al. 1987). Sind Anfälle allerdings bereits erfolgt, vermag Atropin diese nicht zu beenden (CLIFFORD et al. 1987). Eine in-vitro-Studie (PRIEL u. ALBUQUERQUE 2002) verdeutlicht, dass Pilocarpin bei kultivierten hippocampalen Neuronen eine Imbalance zwischen exzitatorischer und inhibitorischer Transmission verursacht, welche in der Generierung eines SE bei Nagern resultieren kann. Mittels einer in-vivo-Mikrodialyse-Studie zeigen SMOLDERS et al. (1997), dass Pilocarpin initial zu einem Absinken der extrazellulären hippocampalen Glutamat- und Gammaaminobuttersäure- (GABA-) Konzentration führt. Während der Anfälle jedoch steigen die extrazellulären Glutamat-, GABA- und Dopaminkonzentrationen signifikant an. Diese Studie verstärkt die Vermutung, dass Pilocarpin-induzierte Anfälle nach Initiation durch M1- 19 Literaturübersicht Rezeptoren im Folgenden über N-Methyl-D-Aspartat (NMDA)-Rezeptoren aufrechterhalten werden. Auch GOODMAN (1998) stellt dar, dass die Initiation des Anfalls auf der Aktivierung des cholinergen Systems beruht, während die histopathologischen Veränderungen, Neuronenverlust und spontane wiederkehrende Anfälle sekundär zur anfallsinduzierten Glutamatfreisetzung auftreten. Das Pilocarpin-Modell wird bereits seit den achtziger Jahren bei Ratten (TURSKI et al. 1983a; TURSKI et al. 1983b) wie auch Mäusen (TURSKI et al. 1984) als Epilepsiemodell eingesetzt. Nach CURIA et al. (2008) stellen sich die wichtigsten Eigenschaften des Pilocarpin-Modells wie folgt dar: Mittels systemischer, üblicherweise intraperitonealer (i.p.) Applikation wird in kurzer Zeit ein akuter SE induziert. Anschließend erfolgt eine mehrwöchige Latenzzeit, nach welcher sich das Auftreten von spontanen wiederkehrenden Anfällen anschließt, welche die chronische Phase der Epilepsie markieren. Ferner treten weitläufige Läsionen im Gehirn auf, von welchen einige in den gleichen Gehirnregionen lokalisiert sind wie bei TLE-Patienten. Diese Läsionen sind assoziiert mit einer Reorganisation des neuronalen Netzwerks in hippocampalen und parahippocampalen Regionen, beispielsweise Mossy-Fiber-Sprouting, Verlust an Interneuronen sowie ektopische Zellproliferation des Gyrus dentatus, welche Charakteristika sowohl für TLEPatienten als auch für Pilocarpin-behandelte epileptische Nager darstellen (WIESER 2004). TURSKI et al. (1984) beschrieben bei Mäusen, dass konvulsive Dosierungen von Pilocarpin (300 und 325 mg/kg) zu verschiedenen Verhaltensauffälligkeiten führen: Initial treten eine Akinesie, Tremor am gesamten Körper, ein taumelnder, ataktischer Gang sowie limbische, gustatorische Automatismen mit Salivation auf. Dieses präkonvulsive Verhalten zeigt sich 5-10 Min. nach Pilocarpin-Injektion und leitet in motorische limbische Anfälle mit Vorderextremitätenklonus, Aufrichten, teilweise mit Umfallen und starker Salivation über. Während dieser Periode von motorischen limbischen Anfällen weisen die Tiere zusätzlich stereotype Verhaltensweisen, wie beispielsweise wiederholtes Kopfzucken, Putzen und Aufrichten, sowie bisweilen Hochspringen auf. Motorische limbische Anfälle beginnen nach 10-18 Min., kehren etwa alle 5-10 Min. wieder und erreichen ein maximales Auftreten von 6-8 20 Literaturübersicht Krampfanfällen pro 30 Min. Die Periode limbischer Konvulsionen dauert bis zu 30-45 Min. nach Pilocarpinapplikation an und leitet rasch in einen SE über, welcher manchmal jedoch zum Tode des Tieres führt (TURSKI et al. 1984) Wie CURIA et al. (2008) darstellt, zeigen EEG-Aufzeichnungen während eines Pilocarpin-induzierten SE, dass Pilocarpin sowohl iktale, als auch interiktale epileptische Veränderungen auslösen kann. Ferner scheinen paroxysmale EEGVeränderungen mit Verhaltensänderungen korreliert zu sein. Zu beobachten sind zu Beginn der EEG-Aufzeichnungen eine niedrige Amplitude sowie eine hohe Frequenz in Neocortex und Amygdala. Ein deutliches Theta-Rhythmus-Muster ist im Hippocampus zu erkennen. Mit zunehmender Ausprägung der Krampfanfälle ist die elektrographische Anfallsaktivität durch hohe Spannung, schnelle EEG-Aktivität und hervortretender Hoch-Spannungs-Spikes charaktierisiert, welche den Krampfanfällen vorangehen (CURIA et al. 2008). Pilocarpin-injizierte Mäuse lassen im EEG für etwa 10 Stunden eine hohe Frequenz sowie hohe Amplitudenspikes erkennen. Das EEGMuster normalisiert sich erst nach bis zu drei Tagen wieder (BORGES et al. 2003). In der Latenzphase nach dem SE, welche zwischen 5 und 54 Tagen andauert, zeigen die Tiere ihr arttypisches Normalverhalten, ohne dass spontane Anfälle auftreten (SHIBLEY u. SMITH 2002). In der sich bei den Versuchstieren analog zur Epileptogenese beim Menschen anschließenden chronischen Phase treten spontane wiederkehrende Anfälle auf (CURIA et al. 2008). So kann das Pilocarpin-Modell aufgrund der Existenz der für die Epileptogenese charakteristischen drei Phasen (akuter SE, Latenzphase, sowie das Auftreten von spontanen wiederkehrenden Anfällen) als chronisches Epilepsiemodell eingesetzt werden (CAVALHEIRO et al. 2006). Üblicherweise wird für das Pilocarpin-Modell ein Bolus-Applikationsregime verwendet, um einen SE auszulösen. Ferner werden üblicherweise männliche Tiere eingesetzt. Tabelle 2.1 stellt eine Literaturübersicht über das Pilocarpin-Modell bei verschiedenen Mausstämmen sowie über die unterschiedlichen verwendeten Pilocarpin-Dosierungen wie auch der prozentualen SE-Induktions- und Mortalitätsrate dar, sofern diese Werte angegeben wurden. Auch wenn zwei Arbeitsgruppen (CHEN et al. 2005; TU et al. 2006) für B6-Mäuse eine hohe SE- 21 Literaturübersicht Induktionsrate von über 80% angeben, ist die Auslösung eines SE bei B6-Mäusen mittels Pilocarpin nicht trivial. Bei anderen Arbeitsgruppen liegt sie zwischen 12-58% (SHIBLEY u. SMITH 2002; BORGES et al. 2003) bei einer Mortalitätsrate bis zu 64% (BORGES et al. 2003). Oft wird die SE-Induktionsrate in der Literatur nicht genannt. Auch die Definition eines SE in den verschiedenen Arbeitsgruppen stellt sich sehr unterschiedlich dar. Bei TU et al. (2006), welche eine SE-Induktionsrate von über 90% bei B6-Mäusen beschreiben, wird ein SE als kontinuierliche motorische Krampfaktivität ab Stadium 2 (RACINE 1972) gewertet. BORGES et al. (2003) beschreiben eine SE-Induktionsrate von 12-58% bei B6-Mäusen und definierten einen SE erst ab Stadium 3,5 (RACINE 1972). In der Arbeitsgruppe Löscher ergaben Vorversuche mit verschiedenen Dosierungen von Pilocarpin bei B6-Mäusen, welche vor Jahren von Frau Prof. H. Potschka sowie von der ehemaligen PhD-Studentin Ina Gröticke durchgeführt wurden, eine nur geringe SE-Induktions- und hohe Mortalitätsrate. 22 Nicht angegeben (Albino) CD-1 (Harlan) B6 (Harlan) CF1 (Charles River, CR) B6 (Jackson Laboratory, JAX) B6 (CR) CD-1 (Harlan) B6NHsd (Harlan) CF1 (CR) B6 (Harlan) B6 (JAX) FVB/N (JAX) B6 (CR) CD1 (CR) FVB/N (CR) B6 (Harlan) Swiss 129Sv B6 B6 (Harlan) CF1 129(AB2.1) 129/SvTac B6 (Harlan) NMRI (HarlanWinkelmann) CAVALHEIRO et al. 1996 SHIBLEY u. SMITH 2002 ZHANG et al. 2007 GRÖTICKE et al. 2007 320-340 mg/kg 200 mg/kg (Swiss) 250 mg/kg (129Sv) 300 mg/kg (B6) 265 mg/kg 275-310 mg/kg (CF1) 270-310 mg/kg (129(AB2.1)) 240 mg/kg (129/SvTac) 340 mg/kg 100 mg/kg fraktioniert 272-340 mg/kg 254-290 mg/kg 320-340 mg/kg 270-300 mg/kg 280-290 mg/kg 254-290 mg/kg (CF1) 247-335 mg/kg (B6JAX) 300-315 mg/kg (B6CR) 340 mg/kg 280-290 mg/kg Pilocarpin-dosis 100, 200, 300, 325, 350 und 400 mg/kg Nicht angegeben 89 % > 90% 30% (CF1) 91% (129(AB2.1)) 38% (129/SvTac) Nicht angegeben Nicht angegeben > 80% in jedem Stamm 30% Nicht angegeben Nicht angegeben Nicht angegeben Nicht angegeben 38% (CD-1) 53% (B6) 33% (CF1) 12% (B6JAX) 58% (B6CR) SE-Induktionsrate 75% (325 mg/kg) Nicht angegeben 36 % Nicht angegeben Nicht angegeben Nicht angegeben Nicht angegeben Nicht angegeben (bei B6 „höher“) 19% 29,4% 59,3% Nicht angegeben Nicht angegeben 26% (CF1) 64% (B6JAX) Für B6CR nicht angegeben Nicht angegeben Mortalitätsrate 25% (325 mg/kg) > 50% (350 mg/kg) 93% (400 mg/kg) 36% 21% (beide Stämme) 23 Tab. 2.1: Literaturübersicht über verschiedene Dosierungen sowie über die SE-Induktions- und Mortalitätsraten im Pilocarpin-Modell bei der Maus. TU et al. 2006 BORGES et al. 2006 PENG u. HOUSER 2005 CARNEVALLI et al. 2006 CHEN et al. 2005 BORGES et al. 2004 PENG et al. 2004 SHIKHANOV et al. 2005 WINOKUR et al. 2004 BORGES et al. 2003 Mausstamm Swiss Literaturzitat TURSKI et al. 1984 Literaturübersicht Literaturübersicht GLIEN et al. (2001) entwickelten in der Arbeitsgruppe Löscher ein fraktioniertes Applikationsregime von Pilocarpin (10 mg/kg in 30-minütigen Intervallen) für Ratten mit der Intention, die Mortalitätsrate zu senken sowie die SE-Induktionsrate zu erhöhen. Der Prozentsatz an Ratten, welche einen SE entwickeln, unterscheidet sich im fraktionierten Modell nicht signifikant von Ratten, welche Pilocarpin als Bolus erhalten (GLIEN et al. 2001). Die Mortalität jedoch kann laut GLIEN et al. (2001) bei einem 90-minütigen SE mittels fraktionierter Applikation von 45% (Bolus) auf 10% gesenkt werden. GRÖTICKE et al. (2007) etablierten in der Arbeitsgruppe Löscher das fraktionierte Applikationsregime von Pilocarpin für die NMRI-Maus. Die Dosierung von Pilocarpin beträgt 100 mg/kg. In Vorversuchen konnte gezeigt werden, dass es für die Entwicklung eines SE nicht ausreicht, bis zum 1. Krampfanfall Pilocarpin zu applizieren. Pilocarpin muss in 20-minütigen Intervallen bis zur Erlangung eines SE injiziert werden. Bei Ratten wird Pilocarpin häufig in Kombination mit Lithiumchlorid (LiCl) eingesetzt (CLIFFORD et al. 1987), welches üblicherweise in einer Konzentration von 3 mEq/kg 12-24 Stunden vor Injektion von Pilocarpin appliziert wird. Eine Vorbehandlung mit LiCl resultiert bei Ratten in einer fast 20-fachen Verschiebung der Pilocarpin-DosisWirkungskurve, um Krampfanfälle auszulösen (CLIFFORD et al. 1987). JOPE et al. (1986) merken an, dass eine Verabreichung von LiCl den prokonvulsiven Effekt von Pilocarpin potenziert, so dass die erforderliche Dosis an Pilocarpin, um Anfälle auszulösen, verringert werden kann. Hierfür könnten sich folgende Wirkungsmechanismen von LiCl als bedeutsam zeigen: LiCl verringert die Freisetzung von Noradrenalin und Dopamin an stimulierten Nervenendigungen (CLIFFORD et al. 1987). Eine Studie von ARNOLD et al. (1973) stellt dar, dass den permanenten Veränderungen in der Anfallsempfindlichkeit nach wiederholter elektrischer Stimulierung im limbischen System cholinerge und catecholaminerge neuronale Netzwerke zugrunde liegen. So wird vermutet, dass cholinerge Netzwerke im limbischen System eine wichtige Rolle bei der Ausbreitung von epileptiformen Entladungen innerhalb des limbischen Systems spielen und die Wahrscheinlichkeit erhöhen, dass noradrenerge oder dopaminerge Netzwerke antagonstisch zu cholinerg induzierten Krampfanfällen wirken (ARNOLD et al. 1973). LiCl scheint 24 Literaturübersicht ebenso einen direkten Einfluss auf die cholinerge Funktion zu haben: Es steigert die Freisetzung von Acetylcholin in-vitro, jedoch nicht in-vivo bei Ratten nach 35minütigem SE (JOPE u. MORRISETT 1986). Ferner kann LiCl Veränderungen in der muscarinergen Bindung hervorrufen (CLIFFORD et al. 1987) sowie Wirkungen auf die Konzentrationen von Myo-Inositol im frontalen cerebralen Cortex, im Cerebellum sowie im Corpus callosum bei Ratten haben (ALLISON et al. 1980). In das InositolPhospholipid-Second-Messenger-System vermag es einzugreifen, indem es die freie Inositol-Konzentration verringert und das Myo-Inositol-1-Phosphat (M1P) im cerebralen Cortex von Ratten steigert. Letzteres geschieht vermutlich aufgrund von einer Inhibition der Myo-Inositol-1-Phosphatase (CLIFFORD et al. 1987). Pilocarpin alleine führt lediglich zu einem vierfachen Anstieg von M1P, die Kombination aus LiCl und Pilocarpin dagegen verursacht einen 40-fachen Anstieg von M1P (CLIFFORD et al. 1987). Bei Mäusen wird die Kombination aus LiCl und Pilocarpin nur selten verwendet. MAZARATI (2004) injizierten Galanin-Rezeptor-knock-out-Mäusen mit B6- Hintergrund zur SE-Induzierung 3 mEq/kg LiCl sowie 16-24 Stunden später Pilocarpin in einer Dosierung von 150 mg/kg. In einer weiteren Studie (LI et al. 2008) wurde Balb/c-Mäusen ebenfalls 3 mEq/kg LiCl bei einer 24 Stunden später folgenden Pilocarpin-Dosierung von 280-340 mg/kg verabreicht. SHALDUBINA et al. (2007) applizierten knock-out-Mäusen 3 oder 10 mEq/kg LiCl bei einer Pilocarpin-Dosierung von 100 mg/kg. Limbische Krampfaktivität entstand nur bei Mäusen, welche die höhere Dosierung von LiCl erhielten. Die Sensitivität hinsichtlich der Wirkungen von Pilocarpin scheint bei Mäusen im Vergleich zu Ratten höher zu sein, denn die konvulsive Pilocarpindosis liegt nah an der letalen Dosis (TURSKI et al. 1983a; TURSKI et al. 1984). Um die peripheren Wirkungen von Pilocarpin zu unterbinden, wird üblicherweise 30 Min. vor Pilocarpin-Injektion die antimuscarinerg wirkende Substanz Methylscopolamin appliziert, da diese die Blut-Hirn-Schranke nicht passiert und infolgedessen mit den zentralen Wirkungen Pilocarpins nicht interferieren kann. Ohne diese Vorbehandlung mit Methylscopolamin zeigen die Tiere nach Injektion von Pilocarpin klassische Zeichen einer peripheren cholinergen Stimulation, 25 Literaturübersicht einschließlich Piloerection, Salivation, Tremor, Chromodacryorrhoe (Sekretion aus den Harderschen Drüsen bei Nagern) und Diarrhoe (CLIFFORD et al. 1987). 2.5.2 Weitere Epilepsiemodelle 2.5.2.1 Kainat Kainat wurde ursprünglich aus dem Seetang Digenea simplex extrahiert (GOODMAN 1998). Es ist ein Analogon des Glutamat, einem exzitatorischen Neurotransmitter, und bindet an einen Teil der Glutamatrezeptoren (GOODMAN 1998). Ähnlich zum Pilocarpin-Modell stellt das Kainat-Modell ebenfalls sowohl ein akutes (SE) als auch ein chronisches Modell für Epilepsie dar, indem es gleichfalls zu spontanen wiederkehrenden Anfällen (WILLIAMS et al. 2007) sowie Neuronenverlust führt (FISHER 1989). Nach systemischer Applikation von Kainat tritt Neurodegeneration bei Mäusen der Stämme FVB/N sowie 129/SvEMS, jedoch nicht bei B6- oder BALB/c-Mäusen auf (SCHAUWECKER u. STEWARD 1997). Im Gegensatz hierzu tritt nach fokaler intrahippocampaler Kainat-Applikation auch bei B6-Mäusen Neuronenverlust auf (SCHAUWECKER 2002b). In der Arbeitsgruppe Löscher wurde das intrahippocampale Kainat-Modell für die NMRI-Maus etabliert (GRÖTICKE et al. 2008). 2.5.2.2 Elektroschock Als Elektroschock wird die generalisierte elektrische Stimulation des Gehirns bezeichnet (PETERSON 1998). Experimentelle Techniken, welche bei Nagern verwendet werden, leiten elektrischen Strom zwischen den Augen oder den Ohren von der rechten zur linken Seite in kürzester Zeitdauer (YANG et al. 2003). Diese generalisierte Stimulation induziert Neuronen, wiederholt und synchronisiert zu feuern, welches das Charakteristikum von Neuronen im epileptischen Netzwerk sowie von Epilepsien bildet (PETERSON 1998). Das Tier entwickelt motorische Konvulsionen, dessen Stärke abhängig von der Intensität des elektrischen Stimulationsstromes ist (PETERSON 1998). Niedrige Stromstärken (unter 20 mA bei Ratten bzw. unter 5 mA bei Mäusen) aktivieren lediglich das Vorderhirn und verursachen ein ausschließlich klonisches Anfallsgeschehen, höhere corneale 26 Literaturübersicht Elektroschock-Ströme hingegen aktivieren Mechanismen des Hirnstammes und führen beim Versuchstier zu tonisch-klonischen Konvulsionen (PETERSON 1998). 2.5.2.3 Elektrische Stimulierung Der Tractus perforans enthält Axone von glutamatergen Neuronen und verbindet im Gehirn den entorhinalen Cortex mit dem Gyrus dentatus im Hippocampus. Elektrische Stimulierung des Tractus perforans mittels bipolarer Elektroden kann hippocampale Anfälle induzieren (GOODMAN 1998). Die Amygdala liegt im medialen Teil des Temporallappens im Gehirn. Versuche der Arbeitsgruppe Löscher bei Ratten zeigen, dass anhaltende elektrische Stimulation der basolateralen Amygdala zur Ausprägung eines SE sowie darauf folgenden spontanen Anfällen führt (BRANDT et al. 2003). 2.5.2.4 Kindling Beim Kindling führt eine wiederholte elektrische Stimulierung in verschiedenen Gehirnarealen zu einer gesteigerten elektrischen Erregung im Gehirn (FISHER 1989). Nach einigen Tagen der Stimulation ergeben sich aus den Stimulierungen elektrische Nachentladungen, welche stufenweise mit jedem Kindlingstimulus komplexer und anhaltender werden. Zu diesem Zeitpunkt bezeichnet man das Tier als „gekindelt“ (FISHER 1989). Wenn dies für einige Wochen fortgesetzt wird, entwickeln die Tiere spontane wiederkehrende Anfälle und infolgedessen eine chronische Epilepsie (PINEL u. ROVNER 1978). 2.5.2.5 Genetische Epilepsiemodelle Es gibt verschiedene Epilepsie-anfällige Mausstämme, welche aus spontanen Mutationen entstanden sind. Einige dieser Syndrome sind einzelnen Genmutationen zuzuordnen, einschließlich der Tottering-, Stargazer- und Lethargic-Stämme (NOEBELS 2001). Im Gegensatz hierzu unterliegen den audiogenen Krämpfen der DBA/2-Mäuse und den Handling-induzierten Anfällen der EL-Mäuse komplexe Erbgänge (TECOTT 1998). Anhand von genetischen Epilepsiemodellen können antikonvulsive Substanzen getestet werden (TECOTT 1998). Ferner bieten sie die 27 Literaturübersicht Möglichkeit, Mechanismen zu untersuchen, worüber Gene Anfallsempfänglichkeit verursachen können (TECOTT 1998). 2.6 Verhaltenstests für psychische und kognitive Veränderungen Diverse verhaltensphysiologische Untersuchungsmethoden dienen der Messung von psychischen und kognitiven Verhaltensweisen bei Nagern. Nachfolgend werden alle Verhaltenstests beschrieben, welche in dieser Arbeit eingesetzt werden. Die Gesamtheit der Verhaltenstests wird als Verhaltensbatterie bezeichnet. Die Verhaltensbatterie umfasst eine Eingangscharakterisierung, Tests zur Überprüfung von Katalepsie, von Exploration und Lokomotion, von Angst-assoziiertem Verhalten, von motorischen Fähigkeiten, von räumlicher Lern- und Gedächtnisleistung sowie von Depressions-assoziiertem Verhalten. 2.6.1 Eingangscharakterisierung und Überprüfung von Katalepsie Eingangscharakterisierung: Irwin-Test IRWIN (1968) entwickelte eine systematische Beobachtungsmethode zur umfassenden Bewertung und Quantifizierung von Verhaltensmerkmalen sowie des physiologischen Status einer Maus. Ferner dient der Irwin-Test der Erfassung der Reaktionen von Mäusen auf verschiedene Substanzen. Irwin brachte die Prozedur in eine standardisierte Form, so dass definierte Scores für bestimmte Verhaltensweisen vergeben werden. Es erfolgt eine Messung von verhaltensphysiologischen Parametern wie der Spontanaktivität sowie von motorisch-emotionalen Reaktionen der Tiere. Ferner werden neurologische Untersuchungsparameter wie Haltung, Gang, Gleichgewicht oder ZNS-Exzitation bewertet. Einen weiteren Parameter stellt die mögliche Toxizität der applizierten Substanzen dar, hier ist insbesondere die Mortalität zu nennen. Überprüfung von Katalepsie: Bar-Test Mittels des Bar-Tests wird Katalepsie von Nagern überprüft (SANBERG 1980; JOHNSON u. STEVENS 1983). Wird ein gesundes Labortier in eine unnatürliche Haltung verbracht, so korrigiert es seine Position innerhalb von wenigen Sekunden. 28 Literaturübersicht Ein kataleptisches Tier hingegen verbleibt in dieser Haltung für einige Min. oder sogar länger (SANBERG et al. 1988). Induziert werden kann Katalepsie durch dopaminerge Antagonisten, wie beispielsweise den D2-Antagonisten Haloperidol (SANBERG 1980). Nach Applikation von Haloperidol verharren Tiere nach Platzierung der Vorderpfoten auf einem erhöht liegenden Gegenstand (SILVA et al. 1995). 2.6.2 Überprüfung von Exploration, Lokomotion und Angst-assoziiertem Verhalten Open-Field Seitdem das Open-Field vor 70 Jahren entwickelt wurde (HALL u. BALLECHEY 1932), hat es den Status eines der am meisten benutzten Tests in der psychologischen Überprüfung von Tieren erreicht (WALSH u. CUMMINS 1976). Seine Popularität entstammt größtenteils aus der Einfachheit der Versuchsapparatur, der leichten und schnellen Messung von klar definierten Verhaltensmerkmalen sowie einer generell akzeptierten Interpretation dieser Verhaltensweisen. Ferner reagieren die meisten dieser messbaren Verhaltensmerkmale hinsichtlich vieler genetischer, physiologischer und pharmakologischer Beeinflussungen sensitiv (WALSH u. CUMMINS 1976). Es wird Explorations- und Lokomotionsverhalten sowie nach heller Beleuchtung der Apparatur Angst-assoziiertes Verhalten gemessen, da aufgrund der stärkeren Lichtintensität die Aversivität der offenen Arena erhöht wird (WALSH u. CUMMINS 1976). Im Open-Field wird das Allgemeinverhalten der Tiere bewertet. Das Open-Field besteht aus einer quadratischen oder runden Arena mit hohen umgebenden Wänden, so dass die Tiere aus dieser nicht entfliehen können. Die Tiere werden behutsam in die Mitte der für sie neuen Arena gesetzt und über einige Min. beobachtet (WLÁZ 1998). Novel-Object-Exploration-Test Um sich auf eine stetig verändernde Umwelt einzustellen, ist es für Nager essenziell, neue Stimuli zu erkunden (POWELL et al. 2004). Infolgedessen erzeugen neue 29 Literaturübersicht Stimulationsparameter einen Konflikt zwischen der Annäherung an sowie der Vermeidung von neuen Objekten bei Nagetieren, indem sowohl die Exploration stimuliert wird, welche notwendig Nahrungsbeschaffungsverhalten), als zum auch Überleben die ist Vermeidung (beispielsweise von potenziell bedrohlichen Situationen (POWELL et al. 2004). Gewöhnung entweder an das Objekt oder den Experimentator aufgrund von Handling verringert das Meidungsverhalten und steigert die Exploration von neuen Stimuli (POWELL et al. 2004). Verschiedene Mausstämme reagieren in unterschiedlicher Art auf die Präsentation eines neuen Objektes (VAN GAALEN u. STECKLER 2000). Die Reaktion variiert von Vermeidungsverhalten (A/J-Stamm) bis hin zur Annäherung an das unbekannte Objekt (SW/J-Stamm). Zwei B6-Stämme von unterschiedlichen Züchtern (Harlan-Winkelmann und Charles River) differieren ebenfalls in ihrer Reaktion auf die Präsentation eines neuen Objekts (VAN GAALEN u. STECKLER 2000). Hole-Board-Test Der Hole-Board-Test wurde zu Beginn der sechziger Jahre entwickelt (BOISSIER 1964) und bietet eine einfache Möglichkeit, die Reaktion eines Nagetieres auf eine unbekannte Umgebung zu untersuchen. Mittels der Frequenz des Erkundens der Löcher der Apparatur (Head-Dips) wird bei den Tieren Exploration und Lokomotion gemessen (FILE u. WARDILL 1975). Einen Vorteil bietet, dass diese Reaktionen nicht nur beobachtet, sondern auch quantifiziert werden können (TAKEDA et al. 1998). Die Versuchsapparatur besteht aus einer Box mit einer definierten Anzahl von Löchern in der Bodenfläche, welche die Tiere über eine definierte Versuchsdauer erkunden können (TAKEDA et al. 1998). Elevated-Plus-Maze Das Elevated-Plus-Maze basiert auf dem natürlichen Konflikt von Nagern, einerseits eine neue Umwelt zu explorieren (Suche nach Futter, Lebensräumen, Sexualpartnern), andererseits aber auch offene, helle Flächen zu meiden, da diese für Nager aufgrund der Angst vor Beutegreifern eine Gefahr darstellen (LAMBERTY 30 Literaturübersicht u. GOWER 1996). Mittels der Versuchsapparatur wird diese Situation nachgeahmt, da sie aus zwei offenen, erhöht gelegenen Armen und zwei rechtwinklig angeschlossenen, von Wänden umrandeten, geschlossenen Armen besteht, welche die Tiere über eine definierte Versuchsdauer frei explorieren können (HOLMES et al. 2003). Anxiolytisch wirkende Substanzen erhöhen die in den offenen Armen verbrachte Zeitdauer, anxiogene Substanzen haben den gegenteiligen Effekt (LISTER 1987). Light-Dark-Box CRAWLEY und GOODWIN (1980) entwickelten die Light-Dark-Box als einfaches System, mit welchem sie gesteigertes Explorationsverhalten bei Nagern als Reaktion auf die anxiolytische Wirkung von Benzodiazepinen nachweisen konnten. Die LightDark-Box stellt infolgedessen einen wichtigen Test dar, um Angst-assoziiertes Spontanverhalten zu untersuchen. Ähnlich zum Elevated-Plus-Maze bietet sich Nagern in der Light-Dark-Box einerseits die Möglichkeit, eine neue Umwelt zu explorieren, andererseits jedoch haben offene, helle Flächen für die Tiere aversive Eigenschaften. Die Light-Dark-Box besteht aus zwei Kompartments, von welchen eines offen und hell, sowie das andere dunkel und geschlossen ist (CRAWLEY u. GOODWIN 1980). Verschiedene anxiolytische Substanzen steigern das Explorationsverhalten von Mäusen in der Light-Dark-Box, anxiogene Substanzen dagegen vermindern dies (COSTALL et al. 1989). 2.6.3 Überprüfung der motorischen Fähigkeiten Rotarod-Test DUNHAM und MIYA (1957) entwickelten das Rotarod als Neurotoxizitätstest. Im Rotarod-Test wird bei Mäusen die Fähigkeit bewertet, auf einem rotierenden Stab zu balancieren (BARLOW et al. 1996). Mäuse mit intakter motorischer Koordination können diesen Test über eine Versuchsdauer von 60 s erfolgreich absolvieren (CARTER et al. 1999). Um Unterschiede in Motivation und Lernvermögen bei den Tieren auszuschließen, absolvieren die Tiere vor der Versuchsdurchführung mehrere Probedurchläufe (KARL et al. 2003). Mäuse mit ausgeprägtem Defizit bezüglich 31 Literaturübersicht motorischer Koordinationsfähigkeit haben Schwierigkeiten, auf dem rotierenden Stab zu verbleiben (KARL et al. 2003). Hanging-Wire-Test Der Hanging-Wire-Test wurde von COUGHENOUR (1977) in den siebziger Jahren entwickelt. Gemessen wird die neuromuskuläre Kraft von Mäusen (PAYLOR et al. 1998; MIYAKAWA et al. 2001a; MIYAKAWA et al. 2001b). Die Maus wird auf ein Drahtgitter platziert, welches angehoben und umgedreht wird, so dass das Tier sich am Gitter festhalten muss (KARL et al. 2003). Einen Vorteil des Hanging-Wire-Tests stellt die Zeitersparnis dar, da der Test im Gegensatz zum Rotarod-Test an untrainierten Mäusen durchgeführt werden kann. Ferner ist der Anteil an Kontrolltieren, welche im Test versagen, geringer und der Hanging-Wire-Test zeigt eine geringere Variabilität als der Rotarod-Test (COUGHENOUR et al. 1977). Häufig wird der Test für Substanz-Screeningverfahren verwendet (WLÁZ 1998). Chimney-Test Beim Chimney-Test wird die Fähigkeit eines Tieres ermittelt, in einer Plastik- oder Glasröhre innerhalb einer definierten Zeit rückwärts hochzuklettern. Kann ein Tier diese Aufgabe nicht bewältigen, wird dies als Indikation für neurologische Defizite gewertet. Ein gesundes Tier braucht üblicherweise 10 bis 20 s für die Absolvierung des Chimney-Tests und benötigt hierfür kein vorangegangenes Training (WLÁZ 1998). Die hohe Variabilität der Zeitdauer, in welcher die Tiere das obere Ende der Röhre erklettern, ermöglicht keine quantitative Messung der Zeit. Es wird lediglich bewertet, ob das Tier innerhalb der vorgegebenen Zeit (z. B. 60 s) den Test besteht oder nicht (WLÁZ 1998). 2.6.4. Überprüfung der räumlichen Lern- und Gedächtnisleistung: MorrisWater-Maze Der Morris-Water-Maze-Test wurde zu Beginn der achtziger Jahre von MORRIS (1984) entwickelt, um bei Ratten räumliche Lern- und Gedächtnisleistungen zu überprüfen. Der Test ist für die Untersuchung von Arbeits- (veränderliche Inhalte) wie 32 Literaturübersicht auch Referenzgedächtnis (feste Inhalte) geeignet. Erforderlich für eine erfolgreiche Absolvierung des Morris-Water-Mazes ist die Integrität eines intakten Hippocampus (STAFSTROM 2002). Ratten (EICHENBAUM et al. 1990) sowie Mäuse (LOGUE et al. 1997) mit hippocampalen Läsionen absolvieren den Morris-Water-Maze schlechter als Kontrolltiere. Dies verdeutlicht die Sensitivität des Tests hinsichtlich hippocampaler Schädigung. Der Hippocampus scheint für Akquisition (Lernen von neuen Inhalten) und Retrieval (Wiederabrufen von gelernten Inhalten) von räumlicher Information sowie für Konsolidierung und Speicherung notwendig zu sein (D'HOOGE u. DE DEYN 2001). Im Morris-Water-Maze nutzt das Tier außerhalb eines Beckens befindliche Hinweisreize, um schwimmend die Lokalisation einer Plattform zu orten, welche unter der Wasseroberfläche versteckt liegt. Die Latenzzeit, welche das Tier benötigt, um die Plattform aufzufinden, wird als Parameter für die erfolgreiche Absolvierung des Tests gewertet (STAFSTROM 2002). Mäuse lernen im Morris-Water-Maze-Test langsamer als Ratten, obwohl sie im Radial-Arm-Maze, einer Lernaufgabe, welche nicht im Wasser stattfindet, zu Ratten vergleichbare Testergebnisse aufweisen (WHISHAW u. TOMIE 1996). 2.6.5 Untersuchung von Depressions-assoziiertem Verhalten Tail-Suspension-Test Der Tail-Suspension-Test existiert seit den achtziger Jahren (TRULLAS et al. 1989). Er wurde entwickelt, um mögliche antidepressive Verhaltensmerkmale von Nagern zu messen. Der unausweichliche Stress, welchem die Tiere in diesem Test ausgesetzt sind, gibt Auskünfte darüber, wie die Fähigkeit des Tieres ausgeprägt ist, eine stressige Situation zu bewältigen (CRYAN et al. 2005). Dies kann mittels pharmakologischer oder genetischer Manipulationen verändert werden (CRYAN et al. 2005). Der Tail-Suspension-Test basiert auf der Beobachtung, dass Nager nach Verbringung in eine Stresssituation, von welcher sie nicht entfliehen können, nach initialen Fluchtbewegungen eine regungslose Körperhaltung einnehmen, welche als Immobilität gewertet wird. Vorher applizierte antidepressiv wirkende Substanzen 33 Literaturübersicht induzieren eine Verlängerung der aktiven Fluchtphase der Tiere (RIPOLL et al. 2003; BOURIN et al. 2005). Porsolt-Test PORSOLT et al. (1977) entwickelten einen weiteren Screening-Test für antidepressiv wirkende Substanzen bei Mäusen. Die Tiere werden in ein Behältnis mit Wasser verbracht, aus welchem sie nicht entkommen können. Wie bereits beim TailSuspension-Test beschrieben, zeigen die Tiere in dieser unausweichlichen Situation zunächst initiale Fluchtbewegungen. Nach einiger Zeit jedoch nehmen sie eine regungslose Körperhaltung ein, welche analog zum Tail-Suspension-Test als Immobilität beurteilt wird (PORSOLT et al. 1977, 1978). Eine Vorbehandlung mit antidepressiv wirkenden Substanzen führt zu einer Verlängerung der Aktivitätsphase der Tiere (PORSOLT et al. 1977, 1978; BAI et al. 2001; BOURIN et al. 2005; CERVO et al. 2005). Mäuse zeigen bereits nach einmaligem Durchlauf des Porsolt-Test eine stabile immobile Körperhaltung, Ratten hingegen benötigen hierfür zwei Versuchsdurchgänge (CRYAN et al. 2005). 2.6.6 Verhaltensphysiologische Charakterisierung von chronisch epileptischen Mäusen Es existieren nur wenige Literaturangaben zu Verhaltenscharakterisierungen von Mäusen in Epilepsiemodellen. IKEGAYA et al. (2000) verabreichten juvenilen Mäusen an Tag 14 Pilocarpin und stellen dar, dass Pilocarpin-behandelte Tiere in einem an Tag 40 begonnenem Morris-Water-Maze-Test eine signifikant schlechtere Lern- und Gedächtnisleistung präsentieren als gesunde Kontrolltiere. In zwei Studien von MOHAJERI et al. (2003; 2004) wurden adulte B6-Mäuse bzw. die adulte F1-Generation aus B6 x FVB-Hybriden 14 Tage nach Pilocarpin-Injektion im Morris-Water-Maze getestet, in welchem sie gleichfalls eine schlechtere Lernleistung als Kontrollen zeigten. Ferner präsentierte die Pilocarpin-injizierte Gruppe im Open-Field-Test eine geringer ausgeprägte Exploration im Vergleich zu Kontrollen (MOHAJERI et al. 2004). 34 Literaturübersicht Eine umfassende verhaltensphysiologische Charakterisierung von NMRI-Mäusen in der chronischen Phase ihrer Epilepsie fertigten in der Arbeitsgruppe Löscher GRÖTICKE et al. im Pilocarpin- (2007), sowie im Kainat-Modell mit intrahippocampaler Kainat-Applikation (2008) an. Im Pilocarpin-Modell ergaben sich für die untersuchten epileptischen NMRI-Mäuse verschiedene Verhaltensauffälligkeiten im Vergleich zu gesunden Kontrolltieren. Zu nennen ist Angst-assoziiertes Verhalten im Irwin-Test, im Open-Field, im Hole-Board-Test, im Novel-Object-Exploration-Test sowie in der Light-Dark-Box. Ferner zeigte sich eine reduzierte Lokomotion im Irwin-Screen und in der Light-Dark-Box sowie ein reduziertes Explorationsverhalten im Irwin-Screen, im Open-Field, im Hole-BoardTest, im Novel-Object-Exploration-Test und in der Light-Dark-Box. Im TailSuspension-Test sowie im Porsolt-Test war die kumulative Immobilitätszeit bei epileptischen NMRI-Mäusen im Vergleich zu den Kontrollen reduziert. Im MorrisWater-Maze waren bei den epileptischen NMRI-Mäusen räumliche Lern- und Gedächtnisdefizite nachzuweisen. Histologisch zeigten die epileptischen Tiere eine ausgeprägte Neurodegeneration (GRÖTICKE et al. 2007). Im Kainat-Modell ergaben sich für die untersuchten epileptischen NMRI-Mäuse lediglich diskrete Verhaltensänderungen, wie beispielsweise eine geringere Immobilitätszeit im Porsolt-Test, oder Lern- und Gedächtniseinbußen im Probe-Trial, im Retention-Test sowie an Tag 2 der Cued-Version im Morris-Water-Maze. Histologisch weist die ipsilaterale Seite des Gehirns in den Regionen CA 1, CA 3c sowie im Hilus bei den Kainat-injizierten Tieren Neurodegeneration auf (GRÖTICKE et al. 2008). 2.6.7 Bedeutung der verwendeten Mausstämme Die Maus gewinnt als Tiermodell zunehmend an Bedeutung, da sie im Gegensatz zur Ratte leicht gentechnisch manipuliert werden kann (DENNIS 2005). Es ist wichtig, die Frage zu klären, warum Versuchstiere, bei denen als gesunde Individuen Epilepsie ausgelöst wird, Verhaltensstörungen entwickeln, während bei Epilepsiepatienten nur rund 50% von Komorbiditäten betroffen sind (MACHLEIDT 2004). In der Vergangenheit konnten einige Gene identifiziert werden, welche mit 35 Literaturübersicht Epilepsien assoziiert sind (NOEBELS 2001), die genetische Prädisposition für Epilepsien stellt sich jedoch komplex dar (SCHAUWECKER 2002a). Die NMRI-Maus gilt als weit verbreiteter Auszuchtstamm mit einer großen Streuung des genetischen Hintergrundes. B6-Mäuse dagegen bilden einen Inzuchtstamm. Inzucht bedeutet, dass über mindestens 20 Generationen jeweils Vollgeschwister miteinander verpaart werden, so dass dieser Stamm als genetisch identisch (isogenetisch) bezeichnet werden kann (WOLFER et al. 2002). Die geschichtliche Entwicklung von Inzuchtstämmen ist eng mit der Entwicklung von Krebs- sowie immunologischer Forschung verbunden. Ursprünglich wurden Inzuchtmausstämme entwickelt, um die genetische Basis für verschiedene Formen von Krebs nachzuweisen. Inzuchtstämme spielen eine entscheidende Rolle in allen Bereichen der biomedizinischen Forschung, da sie Forschern aus aller Welt ermöglichen, reproduzierbare Experimente mit demselben genetischen Material durchzuführen (MEKADA et al. 2009). Transgene Mäuse, welchen ein endogenes Gen entfernt (knock-out-Mäuse) oder ein exogenes Gen hinzugefügt wird, bieten vielfältige Möglichkeiten für die Untersuchung von biologischen Funktionen (CRAWLEY et al. 1997). Mäuse des Stammes B6 stellen für die Genetik eine sehr große Bedeutung dar, da sie häufig für Verpaarung und als Hintergrundstamm für spontane Mutationen verwendet werden (CRAWLEY et al. 1997). Als Quantitative-Trait-Loci (QTL) werden Abschnitte eines Chromosoms bezeichnet, welche Einfluss auf die Ausprägung eines quantitativen phänotypischen Merkmals des betreffenden Organismus haben (FERRARO et al. 2004). Mittels des Einsatzes von rekombinanten Inzuchtstämmen können Assoziationen zwischen Verhaltensmerkmalen und QTL identifiziert werden (PLOMIN et al. 1991) 36 Zielsetzung 3. Zielsetzung Bis zu 60% der Epilepsiepatienten leiden an mindestens zwei chronischen Komorbiditäten, ein Drittel der Epilepsiekranken ist von mindestens drei Komorbiditäten betroffen (WIEBE u. HESDORFFER 2007). Die Diagnose Epilepsie bedeutet ein erhöhtes Risiko für Störungen der Emotionalität, des Verhaltens, der kognitiven sowie der Wahrnehmungsfunktionen (DEVINSKY 2003). Doch trotz der hohen Prävalenz von Epilepsie-assoziierten psychischen Begleiterkrankungen, fehlt es derzeit an systematischer Forschung in diesem Gebiet (DEVINSKY 2003). Infolgedessen besteht die Notwendigkeit, ein Tiermodell zu generieren, welches nicht nur ein Modell für chronische Epilepsie darstellt, sondern auch Verhaltensänderungen aufweist, welche sich in einer Verhaltensbatterie detektieren lassen und Analogien zu epileptischen Patienten bilden. In der Arbeitsgruppe Löscher wurden am Auszuchtmausstamm NMRI verhaltensphysiologische Untersuchungen in zwei chronischen Epilepsiemodellen (Pilocarpin und Kainat) durchgeführt, welche die Hypothese bestätigen konnten, dass sich für chronisch epileptische Tiere in einer Verhaltensbatterie zur Untersuchung von psychischen Merkmalen und kognitiven Fähigkeiten Abweichungen von gesunden Kontrolltieren ergeben (GRÖTICKE et al. 2007, 2008). In der vorliegenden Arbeit soll nun ebenfalls das Pilocarpin-Modell für chronische Epilepsie verwendet werden. In der ersten Studie sollen Pilocarpin-behandelte Mäuse des Auszuchtmausstammes NMRI, bei welchen mit Pilocarpin oder LiCl-Pilocarpin ein SE induziert wurde, weitergehend verhaltensphysiologisch sowie histologisch untersucht werden, um herauszufinden, ob die Vorbehandlung mit LiCl einen Einfluss auf Verhaltensmerkmale oder histologische Veränderungen hat. Es ist bekannt, dass LiCl unmittelbar mit Pilocarpin interagiert, wenn diese beiden Substanzen in Kombination als SE-Modell verwendet werden (CLIFFORD et al. 1987). Insbesondere die Depletion von Inositol aufgrund von LiCl ist hier zu nennen (O'DONNELL u. GOULD 2007). Ferner verursacht LiCl einen raschen Anstieg der Permeabilität der Blut-Hirnschranke und hat pro-inflammatorische Wirkungen, beispielsweise aufgrund eines Anstiegs von Interleukin-1β (MARCHI et al. 2009). 37 Zielsetzung Doch ob LiCl in Kombination mit Pilocarpin als Modell für TLE auch Langzeiteffekte aufweist und ob es sich bezüglich verhaltensphysiologischer Untersuchungen sowie neuropathologischer Veränderungen von Pilocarpin alleine als SE-Auslöser unterscheidet, wurde bisher noch nicht untersucht. Ferner ist neu in meiner Arbeit, dass Mäuse sowohl in einer Verhaltensbatterie, als auch histologisch charakterisiert werden sollen, welche Pilocarpin erhalten haben, jedoch keinen akuten SE erreichten. Es soll ermittelt werden, ob Pilocarpin per se schon einen Einfluss auf Verhaltensmerkmale oder histologische Veränderungen hat oder ob ein SE hierfür erforderlich ist. Bei Ratten ist bekannt, dass sich das LiClPilocarpin-Modell vom Pilocarpin-Modell in höherer Dosierung weder verhaltensphysiologisch, noch metabolisch, im EEG oder neuropathologisch unterscheiden lässt (CLIFFORD et al. 1987). Bei Mäusen existiert dieser Vergleich unseres Wissens nicht. In einer zweiten Studie soll das Pilocarpin-Modell für B6-Mäuse etabliert werden. B6 ist ein Inzuchtmausstamm, welcher für genetische Untersuchungen eine große Bedeutung darstellt, da er häufig für Verpaarungen sowie als Hintergrundstamm für spontane Mutationen eingesetzt wird (CRAWLEY et al. 1997). Epileptische Mäuse des Stammes B6 sowie Pilocarpin-behandelte Tiere ohne SE sollen verhaltensphysiologisch wie auch histologisch charakterisiert werden und die Resultate mit den Ergebnissen der NMRI-Mäuse verglichen werden. Langfristig gesehen soll mittels des Pilocarpin-Modells der B6-Maus ein Modell für die Untersuchung von Epilepsie-assoziierten Komorbiditäten entstehen. 38 Material und Methoden 4. Material und Methoden Es wurden in der vorliegenden Arbeit drei Studien durchgeführt: In Studie 1 wurden NMRI-Mäuse sowohl im LiCl-Pilocarpin-, als auch im Pilocarpin-Modell mittels verhaltensphysiologischer Untersuchungen charakterisiert sowie auf histologische Veränderungen im Gehirn überprüft. In Studie 2 wurde das Pilocarpin-Modell für die B6-Maus etabliert, sowie Unterschiede zwischen zwei Barrieren des Züchters Charles River detektiert. Die verhaltensphysiologische sowie histologische Charakterisierung von B6-Mäusen erfolgte in Studie 3. 4.1 Haltung und Zucht der Versuchstiere Eine Übersicht über die verwendeten Tiere für die einzelnen Studien gibt Tabelle 4.1. Für Studie 1 wurden Mäuse des Auszuchtstammes NMRI verwendet. Sie waren weiblichen Geschlechts und wurden im Alter von 5 Wochen mit einem Gewicht von 26-30 g von Harlan/Winkelmann (Borchen, Deutschland) angeliefert. Für die Studien 2 und 3 wurden Mäuse des Inzuchtstammes B6 eingesetzt. Sie waren ebenfalls weiblichen Geschlechts mit Ausnahme der männlichen Mäuse aus Barriere 9 in Studie 2 und wurden im Alter von 5 Wochen mit einem Gewicht von 1517 g angeliefert. Für die Vorversuche (Studie 2) wurden die Sublinien B6JOlaHsd sowie B6NHsd verwendet, welche wir von Harlan/Winkelmann bezogen. Von Charles River (Sulzfeld, Deutschland) stammten die Sublinien B6NCrl sowie B6J, welche in den Studien 2 bzw. 3 verwendet wurden. Die eigene Zucht, welche in Studie 2 von Parentalzuchtpaaren aus den Barrieren 8 und 9 des Stammes B6 des Züchters Charles River ausging, erfolgte im Institut für Pharmakologie, Toxikologie und Pharmazie der Tierärztlichen Hochschule Hannover in einem separaten Maushaltungsraum. Wie Abbildung 4.1 darstellt, erfolgte zunächst die Generierung einer F1-Generation aus Barriere 8-Weibchen mit Barriere 9-Männchen. Dieselben Barriere 8-Weibchen wurden mit den Männchen aus der F1Generation verpaart, um eine F2-Generation zu erzeugen. Die beiden Zuchtpaare aus der F2-Generation wurden verpaart, um eine F3-Generation entstehen zu lassen. 39 Material und Methoden Übersicht über den Ablauf der B6NCrl-Zucht B6NCrl # 8 ♀ x B6NCrl # 9 ♂ → F1-Generation B6NCrl # 8 ♀ x B6NCrl F1 ♂ → F2-Generation B6NCrl F2 ♀ x B6NCrl F2 ♂ → F3-Generation Abb. 4.1: Übersicht über den Ablauf der eigenen B6NCrl-Zucht. Die Haltung der angelieferten Mäuse erfolgte ebenfalls in einem separaten Tierhaltungsraum, welcher ausschließlich für Mäuse verwendet wird. Die Tiere lebten in Gruppen in einer Größenordnung von maximal 10 Mäusen, welche in Makrolonkäfigen des Typs III gehalten wurden. Es bestand ein 12 Stunden HellDunkel-Lichtzyklus mit einer Lichtphase von 06:00-18:00 Uhr (Leuchtstärke in den Makrolonkäfigen 19-30 Lux). Die Lufttemperatur betrug 23°C und es herrschte eine Luftfeuchtigkeit von 50-60 Prozent. Als Einstreu wurde Weichholzgranulat (Rettenmaier+Söhne GmbH und Co KG, Rosenberg, Deutschland) verwendet. Den Tieren stand als Futter eine pelletierte Alleindiät (Altromin 1324 Standarddiät, Altromin GmbH, Lage, Deutschland) sowie Leitungswasser ad libitum zur Verfügung. Die Mäuse wurden mindestens einmal wöchentlich in einen frischen Käfig umgesetzt. Zu diesem Zeitpunkt erfolgte ferner auch ein Auswechseln von Futter und Wasser. Dies geschah jedoch immer in Absprache mit den Tierpflegern, um Unruhe und Stress der Tiere unmittelbar vor den Experimenten zu vermeiden. Nach Anlieferung wurde den Tieren eine Eingewöhnungszeit von mindestens 7 Tagen gewährt, bis mit den Experimenten begonnen wurde. 40 Herkunft Harlan-Winkelmann Harlan-Winkelmann Harlan-Winkelmann Harlan-Winkelmann Charles River Charles River Charles River Charles River Charles River Charles River Charles River Charles River Charles River Eigene Zucht Eigene Zucht Charles River Charles River Charles River (Jackson Laboratories) Eigene Zucht Eigene Zucht 18 14 Anzahl (n) 52 17 54 32 30 23 17 17 20 20 20 20 20 28 32 20 20 20 w m Geschlecht w w w w w w w w w w w m w w m w m w 7-8 Wochen 7-8 Wochen Alter bei Pilocarpin-Applikation 6-7 Wochen 6 Wochen 7-8 Wochen 7-8 Wochen 7-8 Wochen 8 Wochen 6 Wochen 6 Wochen 7 Wochen 7 Wochen 7 Wochen 7 Wochen 6 Wochen 7-8 Wochen 7-8 Wochen 6 Wochen 6 Wochen 7 Wochen 41 Tab. 4.1: Übersicht über die eingesetzten Mäuse in der Reihenfolge der Verwendung in den Studien. w = weiblich, m = männlich B6NCrl, F3-Generation B6NCrl, F3-Generation Studie Stamm 1 NMRI NMRI 2 B6JOlaHsd B6NHsd 2, 3 B6NCrl, Barriere 8 B6NCrl, Barriere 9 2 B6NCrl, Barriere 8 B6NCrl, Barriere 9 B6NCrl, Barriere 4 B6NCrl, Barriere 7 B6NCrl, Barriere 9 B6NCrl, Barriere 9 B6NCrl, Barriere 11 B6NCrl, F1-Generation B6NCrl, F1-Generation B6NCrl, Barriere 9 B6NCrl, Barriere 9 B6J Material und Methoden Material und Methoden 4.2 Dauerhafte Kennzeichnung der Versuchstiere Die Ohren der Versuchstiere wurden mittels Lochzange (Faust Medizintechnik, Berlin, Deutschland) markiert, um die Tiere auch über einen langen Versuchszeitraum eindeutig identifizieren zu können. Verwendet wurde ein Schema, welches Abbildung 4.2 darstellt. Kennzeichnung von Mäusen durch Ohrlochung ohne Loch Maus-Nr. 1 links ein Loch Maus-Nr. 2 rechts 1 Loch Maus-Nr. 3 beide 1 Loch Maus-Nr. 4 links 2 Löcher Maus-Nr. 5 rechts 2 Löcher Maus-Nr. 6 links 2 Löcher, rechts 1 Loch Maus-Nr. 7 links 1 Loch, rechts 2 Löcher Maus-Nr. 8 beide 2 Löcher Maus-Nr. 9 links 3 Löcher Maus-Nr. 10 rechts 3 Löcher Maus-Nr. 11 links/rechts Abb. 4.2: Dauerhafte Kennzeichnung von Mäusen durch Ohrlochung 4.3 Klassifizierung der Krampfintensität Die Einteilung der Krämpfe, welche sowohl unmittelbar nach Pilocarpin-Applikation, als auch in den nachfolgenden Wochen und Monaten spontan auftraten, erfolgte in Stadien 1-5 nach RACINE (1972). Ursprünglich wurde diese Klassifizierung entwickelt, um die Krampfintensität von Ratten beim Kindling zu bewerten, sie wird jedoch üblicherweise auch bei anderen Epilepsiemodellen sowie bei Mäusen verwendet. Die Stadien 1-3 beschreiben fokale Krampfaktivität. Stadium 1 bezeichnet das Auftreten von Immobilität und schwachem Fazialklonus, welcher sich im Schließen von einem oder beiden Augen, Zittern der Tasthaare oder stereotypem Schnüffeln widerspiegeln kann. Schwere Fazialklonien in Form von klonischen Kaubewegungen sowie Nicken des Kopfes werden mit Stadium 2 beschrieben. In Stadium 3 zeigen die Tiere einen unilateralen Klonus der Vorderextremität. Ab 42 Material und Methoden Stadium 4 präsentieren die Tiere ein generalisiertes klonisches Anfallsgeschehen: Stadium 4 wird vergeben, wenn die Tiere sich aufrichten und einen bilateralen Vorderextremitätenklonus aufweisen. Stadium 5 entspricht dem Stadium 4 mit einem zusätzlichen Verlust der Stellreflexe, infolgedessen die Tiere nach hinten oder zur Seite überfallen. Abruptes Renn- und Hochspringverhalten kann ebenfalls eintreten und wurde in dieser Arbeit gleichfalls Stadium 5 zugeordnet. In anderen Arbeitsgruppen wird das abrupte Hochspringen von Tieren nach Pilocarpinapplikation teilweise als zusätzliches Stadium 6 bewertet (BORGES et al. 2003). 4.4 Chronisches Epilepsiemodell: Pilocarpin (Studien 1-3) Die Mäuse waren 6-8 Wochen alt, als die Pilocarpinapplikation erfolgte. Am Abend vor der Versuchsdurchführung wurden die Tiere gewogen und die Schwänze der Tiere zur temporären Kennzeichnung mit einer Nummerierung versehen. Mindestens eine Stunde vor Injektion von Pilocarpin wurden die Tiere in den Vorraum des Mausverhaltenslabors verbracht, in welchem der Versuch stattfand. Für die Pilocarpin-Applikation wurden die Tiere einzeln in Makrolonkäfige des Typs II gesetzt. Das Applikationsvolumen für alle verwendeten Substanzen betrug 10 ml/kg. Für Studie 1 wurde einem Teil der Tiere 15-19 Stunden vor Pilocarpin-Applikation in Natriumchlorid (NaCl) gelöstes LiCl (Sigma-Aldrich, München, Deutschland) in einer Dosierung von 3 mEq, dies entspricht 127 mg/kg, i.p. injiziert. Die i.p.-Applikation von Methylscopolamin (Sigma-Aldrich, München, Deutschland), welches in Aqua destillata (Aqua dest.) gelöst wurde, erfolgte in einer Dosierung von 1 mg/kg 30 Min. vor Injektion von Pilocarpin. Pilocarpin (Sigma-Aldrich, München, Deutschland) wurde in der je nach Studie angegebenen Dosierung in Aqua ad injectabilia gelöst, sowie entweder als Bolus oder fraktioniert in 20-minütigen Intervallen bis zum Erreichen eines SE i.p. appliziert. Nach Ablauf eines SE von 90 Min. bzw. bei überlebenden Tieren ohne SE etwa 2 Stunden nach Bolus-Applikation oder üblicherweise nach der maximal 10. Pilocarpin-Injektion bei Einsatz des fraktionierten Applikationsregimes wurde Diazepam in einer Dosierung von 10 mg/kg i.p. zur 43 Material und Methoden Unterbrechung des SE verabreicht. Diazepam wurde als Fertigampullen (Faustan®, Temmler Pharma, Marburg, Deutschland) in einer Menge von 5 mg/ml Injektionslösung bezogen und in einem Verhältnis von 1:5 mit einer Stammlösung (6,56 ml unvergälltes Ethanol mit NaCl auf 50 ml aufgefüllt) vermischt. Tiere, welche einen SE erlangten, erhielten eine Flüssigkeitssubstitution von 0,5 ml NaCl subcutan (s.c.) am Tag des Versuchs, sowie je nach Verfassung des Tieres am darauffolgenden Tag erneut. 4.5 Akutes Epilepsiemodell: Elektroschock (Studie 2) Die Anfallsempfindlichkeit von B6-Mäusen der Barrieren 8 und 9 des Züchters Charles River wurde für Studie 2 hinsichtlich ihrer maximalen elektrischen Krampfschwelle (Maximal-Elektroshock-Seizure-Threshold, MEST) verglichen und nach der in einer vorherigen Studie (LÖSCHER u. LEHMANN 1996) beschriebenen Weise durchgeführt. Es wurden Cornea-Kupferelektroden verwendet, welche mit Leder bezogen und mit NaCl angefeuchtet wurden. Der Stimulator (Witt GmbH, Berlin, Deutschland) lieferte einen konstanten Stromfluss, welcher von 1-200 mA regulierbar war. Die Stimulationsspannung betrug maximal 7000 Volt. Der konstante Stromfluss lieferte sinusoidale Impulse (50/s) über 0,2 s. Während des Momentes der Stimulation über die Cornea-Elektroden wurde das Tier lediglich per Hand festgehalten und unmittelbar nach der Stimulation losgelassen, um beobachten zu können, ob das Tier eine positive Reaktion zeigt, welche aus einem tonischen Krampf mit vollständig durchgestreckten Hinterbeinen bestand. Aufgrund der Erfahrungswerte von vorherigen Versuchen an NMRI-Mäusen wurde mit der Stromstärke 20,0 mA begonnen. Zeigte die Maus einen Streckkrampf, wurde der Logarithmus (log) der Stromstärke um 0,06 Einheiten für das nächste getestete Tier verringert. Erlangte das Tier keinen Streckkrampf, so wurde in umgekehrter Weise verfahren, d.h. der Logarithmus der Stromstärke wurde für das folgende Tier um 0,06 Einheiten erhöht. Dieses „up-and-down“-Verfahren wurde nach KIMBALL et al. (1957) modifiziert. Pro Barriere 8 und 9 wurden jeweils 8 naive Mäuse verwendet, wobei jede Maus nur einmal für die Schwellenbestimmung verwendet wurde. Zusätzlich wurden 13 44 Material und Methoden Pilocarpin-behandelte Mäuse aus Barriere 8 (12 Tiere mit SE, 1 Tier ohne SE) sowie 8 Pilocarpin-behandelte Mäuse aus Barriere 9 (5 Tiere mit SE, 3 Tiere ohne SE) bezüglich ihrer Krampfempfindlichkeit getestet. Es wurde die Krampfschwelle errechnet, nach welcher 50% der untersuchten Mäuse einen vollständigen tonischen Streckkrampf der Hinterextremitäten zeigten. Dieser Wert wird als Convulsive Current bei 50% der Mäuse (CC50) bezeichnet. CC50 wurde nach der Methode von KIMBALL et al. (1957) berechnet: CC50 = antilog m. Dabei gilt m = y + [d (A/N ± ½)]. Der Wert y bezeichnete den niedrigsten mA-Wert bei welchem die Tiere ein positives Resultat (Streckkrampf), bzw. den höchsten mA-Wert, bei welchem die Tiere ein negatives Resultat (keinen Streckkrampf) zeigten. Der Wert d maß das Intervall zwischen den Logarithmen. Der Wert ½ wurde addiert, wenn mit einem negativen Resultat gerechnet wurde bzw. subtrahiert, wenn mit positivem Resultat bezüglich des tonischen Streckkrampfes der Hinterextremitäten gerechnet wurde. Die Bestimmung der maximalen elektrischen Krampfschwelle mittels Elektroschock diente in Studie 2 dem Vergleich der Krampfemfindlichkeit der Barrieren 8 und 9 des Stammes B6NCrl des Züchters Charles River in einem weiteren Anfallsmodell. 4.6 Implantation corticaler Elektroden zur EEG-Ableitung (Studie 2) Um bei Mäusen ein EEG ableiten zu können, wurden drei kleine rostfreie Stahlschrauben in den frontalen Cortex des Tieres implantiert. Für die Implantation wurden die Mäuse des Stammes B6 mit einer Initialdosierung von 350-400 mg/kg Chloralhydrat (Roth®, Karlsruhe, Deutschland) i.p., welches in 0,9% NaCl gelöst wurde, narkotisiert. Das Applikationsvolumen betrug 10 ml/kg. Die Tiefe der Narkose wurde anhand des Zwischenzehenreflexes überprüft. Je nach Erforderlichkeit erfolgten während der Operation eine oder mehrere Nachdosierungen von jeweils 1,5 mg Chloralhydrat pro Maus. Vor Beginn der eigentlichen Operation (OP) wurde am Stereotakten (Kopf, Tujunga, Kalifornien, USA oder Stölting, Illinois, USA) Interaural-Null bestimmt und die Werte notiert. Beim zu operierenden Tier wurde mit einer Schere die Kopfhaut geschoren und die über der Schädelkalotte liegende Haut mit 70% Ethanol desinfiziert. Die 45 Material und Methoden Maus wurde anhand von zwei Ohrstiften sowie mittels eines Schneidezahnbalkens in den Stereotakten eingespannt, so dass das Schädelplateau gerade lag und die Maus nach lateral keinen Bewegungsspielraum mehr zeigte. Die OP der Tiere im Stereotakten diente einer exakten Platzierung der Corticalschrauben. Für die OP wurde die Maus auf ein Wärmepad (Fine Science Tools Inc., Vancouver, Kanada) gelegt, welches sich durch Absinken der Körpertemperatur der Maus erwärmt, so dass die Maus über die Dauer der OP nicht auskühlte. Mittels eines Skalpells erfolgte entlang der Medianen der Kopfoberfläche ein Hautschnitt in der Länge der Oberfläche des Mausschädels. Die entstehenden Lappen der Kopfhaut wurden von den darunter liegenden Faszien abgehoben und mit vier Klemmen jeweils seitlich des Kopfes fixiert. Das Periost des Schädels wurde mittels Schaber manuell entfernt. Um die Knochennähte des Schädels deutlicher darzustellen, erfolgte eine Nachbehandlung des Periost des Schädels mit 35% Wasserstoffperoxid-Lösung. Wie Abbildung 4.3 darstellt, wurde nach PAXINOS und FRANKLIN (2001) Bregma als Referenzpunkt mittels einer am Stereotakten fixierten Nadel bestimmt, auf dem Schädel farbig markiert, und die Werte notiert. Die Bohrpunkte lagen jeweils lateral von Bregma bei +2 mm und -2 mm, der rostrocaudale Wert betrug jeweils -2 mm. Für die Erdungsschraube wurde caudal vom zuerst markierten Bohrloch noch eine weitere Stelle für die Bohrung farbig markiert. Abb. 4.3: Aufsicht auf einen Mausschädel. Dargestellt sind die Knochennähte sowie die Lokalisation von Bregma (PAXINOS u. FRANKLIN 2001). 46 Material und Methoden Die Bohrung durch das Schädeldach erfolgte mittels eines Zahnbohrers (Dremel, Wisconsin, USA). Die Dura mater wurde bei der Bohrung intakt gelassen, um eine Schonung des darunter liegenden Gewebes zu gewährleisten, und mit einer Pinzette eröffnet. Mit vier halben Umdrehungen wurden die Schrauben in den Bohrlöchern versenkt, so dass diese fest verankert waren. Eine Elektrode mit drei Drähten von jeweils 2 cm-Länge wurde für den Elektrodenaufbau verwendet. Jeder Draht der Elektrode wurde um jeweils eine Schraube gewickelt, so dass jede Schraube zu dem verbundenen Draht einen guten Kontakt hatte, sich jedoch die Drähte untereinander nicht berührten. Der linke Draht wurde um die Erdungsschraube gewickelt. Um die Schrauben sowie die Elektrode zu fixieren, wurde eine erste Schicht Dentalzement (Kunststoff, Kaltpolymerisat, Heraeus Kulzer GmbH, Wehrheim, Deutschland) direkt auf den Schädelknochen bis zur Höhe der Schraubenköpfe aufgetragen, so dass die Schrauben von allen Seiten von Dentalzement bedeckt waren. Um einer Wundinfektion vorzubeugen, wurde dem direkt auf den Schädel aufgetragenen Dentalzement zuvor 2,1% Gentamicinsulfat zugegeben. Es wurde eine Trocknungsphase von 10 Min. gewährt, nach deren Ablauf das Elektrodenkonstrukt um ca. 45° nach caudal abgeknickt wurde. Eine zweite Schicht Dentalzement erfolgte, um eine Art Hutaufsatz auf dem Kopf des Tieres zu modellieren und die Schrauben sowie den Elektrodenstecker vollständig zu bedecken. Wieder erfolgte eine Trocknungsphase von 10 Min. Anschließend wurde das Tier aus dem Stereotakten ausgespannt, die Hautklemmen entfernt, die Wundränder mit Ethacridinlactat-Lösung (Konzentration 0,1%, Chinosol, Hannover, Deutschland) gereinigt und die rostral und caudal der Implantationsstelle befindliche Hautwunde mit 2-3 Knopfheften genäht. Als postoperative Schmerztherapie wurde den Mäusen Buprenorphinhydrochlorid intramusculär (i.m.) appliziert, welches als Fertigampullen (Temgesic® Ampullen, Essex Pharma, München) bezogen wurde. Die Dosierung betrug 0,1 mg/kg bei einem Applikationsvolumen von 10 ml/kg, d.h. 167 µl der Fertigampulle wurden mit 5 ml NaCl vermischt. Um einer Atemdepression durch Buprenorphin vorzubeugen, erfolgte die Injektion erst, wenn die Tiere sich bereits in der Aufwachphase befanden. 47 Material und Methoden Nach der Operation wurden die Tiere in mit Zellstoff ausgelegte Käfige verbracht, in denen sich nur Tiere befanden, welche am gleichen Tag operiert wurden. 4.7 EEG-Ableitungen während Pilocarpin-Applikation (Studie 2, Kapitel 5.2.1.2) Um detektieren zu können, ob die beobachtete epileptische Krampfaktivität mit EEGVeränderungen korreliert, erhielten in Studie 2 vier Mäuse des Stammes B6JOlaHsd sowie vier Mäuse des Stammes B6NCrl in der nach Kapitel 4.5 beschriebenen Weise Corticalelektroden. Während der fraktionierten Injektion von Pilocarpin wurde ein EEG abgeleitet. Zur EEG-Anlage Instruments Inc., zählten Foster acht City, Ein-Kanal-Verstärker Kalifornien, USA), (Cyber-Amp-380, ein Axon Analog-Digitalwandler (PowerLab/8s, ADInstruments Ltd, Hastings, England) sowie ein angeschlossener Computer (Dell GmbH, Frankfurt am Main, Deutschland) mit der Software Chart4. Die Aufzeichnung erfolgte in einer Rate von 200 Hz. Die Einstellungen des LowPass-Filters betrugen 60 Hz, die des High-Pass-Filters 0,1 Hz. Ein Notch-Filter diente dem Ausschluss von Störsignalen innerhalb des Frequenzbereichs des Netzstroms von 50 Hz. Die Verbindung vom Tier zu einem der Ein-Kanal-Verstärker erfolgte mittels EEG-Aufzeichnungskabel, welche von der ehemaligen PhD-Studentin Ina Gröticke angefertigt wurden und aus einem zweiadrigen abgeschirmten ummantelten Kabel bestanden. Jedes Kabel wurde mittels einer Krokodilklemme geerdet, um etwaiges Hintergrundrauschen zu reduzieren. 4.8 Überwachung spontaner epileptischer Anfälle Alle Mäuse aus Studie 1 wurden über die Dauer von 6 Wochen der verhaltensphysiologischen Tests auf das Auftreten von spontanen Krampfanfällen beobachtet, um zu ermitteln, wie viele der Pilocarpin-behandelten Tiere eine chronische Epilepsie entwickelten. Tiere, bei welchen während der Absolvierung der Verhaltensbatterie keine spontanen Anfälle notiert wurden, wurden 13-14 Wochen nach SE über 4-7 aufeinanderfolgende Tage 24 Stunden pro Tag mittels einer Schwarz-Weiß-Kamera (CCD-Kamera-Modul, Conrad Elektronik, Hannover, Deutschland) videoüberwacht, bis jedes Tier mit SE mindestens einen spontanen 48 Material und Methoden Anfall zeigte. Es wurden insgesamt 8 Tiere gleichzeitig überwacht, jeweils 2 Tiere von einer Kamera aufgenommen. Für die Nachtaufnahmen wurden Infrarotstrahler (Conrad Electronic GmbH, Hannover, Deutschland) verwendet. Insgesamt 4 Kameras wurden mit einem Multiplexer (EcoLine Quad, Conrad Electronic GmbH, Hannover, Deutschland) verbunden und an einen Langzeitvideorecorder (Sanyo TLS-9924P, Monacor, Bremen, Deutschland) sowie einen Fernsehmonitor (Mitsubishi, Deutschland) angeschlossen. Die Aufzeichnung der Videos erfolgte in einer um den Faktor 12 erhöhten Aufnahmegeschwindigkeit. Infolgedessen war es möglich, handelsübliche Videokassetten (Kodak HS E-240, Kodak GmbH, Stuttgart, Deutschland) mit vierstündiger Laufzeit einzusetzen, welche an den Überwachungstagen jeweils morgens und abends ausgewechselt wurden. Während der Videoüberwachung erfolgte die Haltung der Mäuse einzeln in Makrolonkäfigen des Typs II. Für die Überwachung der Mäuse des Stammes NMRI aus Studie 1 wurde jeder Käfig an den Seitenwänden sowie der Rückwand mit schwarzem Papier versehen, um einen besseren Bildkontrast der weißen Mäuse zur Umgebung zu gewährleisten. Für die schwarzen B6-Mäuse aus den Studien 2 und 3 war eine Verstärkung des Kontrastes nicht notwendig. Die Auswertung der Videobänder erfolgte in vierfacher Abspielgeschwindigkeit. Bei Bedarf konnten einzelne Abschnitte der Videoaufzeichnung verlangsamt abgespielt werden. Aus Studie 2 wurden 12 weibliche Tiere über 6-9 Tage sowie alle männlichen Tiere der F1-Generation über 2-9 Tage zu einem Zeitpunkt von etwa 6 Monaten nach SE videoüberwacht. Das Ziel war, alle Tiere, welche spontane Anfälle zeigten, mittels Videoüberwachung zu detektieren. Alle Mäuse aus Studie 3 wurden über 4 Monate beobachtet, um nachzuweisen, dass alle Tiere, welche einen SE erlangten, auch eine chronische Epilepsie entwickelten. Zusätzlich wurden die Tiere zu einem Zeitpunkt von 7-11 Wochen nach SE über 48 Stunden durchgängig videoüberwacht, um nachzuweisen, dass die Entwicklung von spontanen Anfällen bereits vor Beginn der Absolvierung der Verhaltensbatterie eingesetzt hat. Tiere, welche während dieser Videoaufzeichnung sowie während der verhaltensphysiologischen Untersuchungen keine spontanen Anfälle zeigten, wurden analog zu den Tieren aus Studie 1 zu einem Zeitpunkt von 26-29 Wochen nach SE 49 Material und Methoden über bis zu 14 fortlaufende Tage videoüberwacht. Zwei Mäusen, welche in dieser Zeit keine spontanen Anfälle zeigten, wurden Corticalschrauben in der in Kapitel 4.6 beschriebenen Weise implantiert und diese Tiere ein- bis zweimal über 2-3 Tage EEG- und videoüberwacht, bis auch diese Tiere mindestens einen spontanen epileptischen Krampfanfall zeigten. Die Pilocarpin-behandelten Tiere aus den Studien 1 und 3, welche keinen SE erlangten, wurden während des Handlings der verhaltensphysiologischen Untersuchungen beobachtet, ob sie spontane Anfälle entwickelten. Die Pilocarpinbehandelten Mäuse ohne SE aus Studie 3 wurden ferner analog zu den chronisch epileptischen Tieren zum gleichen Zeitpunkt über 48 Stunden durchgängig videoüberwacht. 4.9 Verhaltensbatterie Es existiert eine Reihe an Verhaltenstests, welche üblicherweise eingesetzt werden, um verhaltensphysiologische Auffälligkeiten bei Versuchstieren darzustellen. Für die Studien 1 und 3 wurde die in Tabelle 4.2 dargestellte Verhaltensbatterie verwendet, um etwaige Verhaltensabweichungen bei Pilocarpin-behandelten Tieren sowohl mit, als auch ohne SE, zu detektieren. Die Verhaltensbatterie umfasste eine Eingangscharakterisierung der Mäuse, sowie Tests zur Überprüfung von Exploration und Lokomotion, von Angst-assoziiertem Verhalten, von motorischen Fähigkeiten, von Depressions-assoziiertem Verhalten sowie der räumlichen Lern- und Gedächtnisleistung. Eingangs- Irwin-Test Charakterisierung Open-Field-Test Hole-Board-Test Angst-assoziiertes Elevated- Black-White-Box Verhalten Plus-Maze Gleichgewicht, Rotarod-Test Exploration, Lokomotion (Angst-assoz. Verhalten) Novel-ObjectExploration-Test Hanging-Wire-Test Chimney-Test motorische Fähigkeiten 50 Material und Methoden Depressions-assoziiertes Porsolt-Test Tail-Suspension- Verhalten Test Räumliche Lern- und Morris- Gedächtnisleistung Water-Maze Tab. 4.2: Einzelne Testdomänen der Verhaltensbatterie. Verhaltensexperimente mit der höchsten Belastung für die Tiere (die Depressionsassoziierten Tests) wurden am Ende der Verhaltensbatterie durchgeführt. Die Gesamtheit der durchgeführten Verhaltenstests wurde in Studie 1 (nur Durchführung des Open-Field-Tests, des Elevated-Plus-Mazes, des Morris-Water-Mazes, des TailSuspension-Tests sowie des Porsolt-Tests) über 6 Wochen, in Studie 3 (die gesamte Verhaltensbatterie) über 17 Wochen absolviert. Zwischen den einzelnen Tests bestand üblicherweise ein Intervall von 1 Woche. Sämtliche verhaltensphysiologischen Untersuchungen fanden in einem Labor statt, welches ausschließlich für Mäuse verwendet wurde. Im Verhaltenslabor existierten kontrollierte Bedingungen hinsichtlich Temperatur (22 ± 0,5°C) sowie Luftfeuchtigkeit (55 ± 5%). Um eine ausreichende Adaptation der Tiere an die Umgebung vor der Absolvierung der Verhaltenstests zu gewährleisten, wurden die Tiere mindestens eine Stunde vor Beginn der Experimente in den Vorraum des Verhaltenslabors verbracht. Ferner wurden die Tiere am Versuchstag vor Beginn der Experimente nicht in neue Käfige umgesetzt, um etwaigen Stress aufgrund des Umsetzens zu vermeiden. Mit Ausnahme der Versuche zur Überprüfung von Depressionsassoziiertem Verhalten, fanden die Verhaltenstests innerhalb eines quadratischen, mit einem weißen Vorhang von der Umgebung abgetrennten Areals statt. Dies diente zur Minimierung der Aversivität und des Ablenkungspotenzials des großen Verhaltenslaborraumes während der Absolvierung der Versuche. Um die Tiere durch die Anwesenheit eines Experimentators bei der Durchführung der Verhaltenstests nicht zu beeinflussen, befand sich die Experimentatorin während der Versuche im Vorraum des Verhaltenslabors. Die Tiere wurden mit einer SchwarzWeiß-Kamera (Panasonic digital, Panasonic, Hamburg, Deutschland), welche an der Zimmerdecke befestigt wurde, gefilmt. Die Datenerhebung erfolgte mit Hilfe einer Software, welche speziell für Verhaltensversuche entwickelt wurde (EthoVision®, 51 Material und Methoden Noldus, Wageningen, Niederlande). Eine Ausnahme bildeten die Versuche zur Überprüfung von Depressions-assoziiertem Verhalten, welche frontal per SchwarzWeiß-Kamera (CCD-Kameramodul, Conrad Electronic GmbH, Hannover, Deutschland) aufgenommen und mittels Videorecorder (Thomson Chroma Pro II VCR, Deutschland; Samsung Fernseher, Schwalbach, Deutschland) manuell ausgewertet wurden. Bei allen lichtsensitiven Verhaltensversuchen sowie in Studie 3 beim Morris-WaterMaze wurden Stehlampen mit Deckenfluter (Halogenlampen, 300 Watt) eingesetzt, um eine gleichmäßige indirekte Beleuchtung der jeweiligen Versuchsapparatur gewährleisten zu können. Die Versuchsaufbauten wurden jedes Mal zwischen den Durchgängen von einzelnen Tieren gründlich von Kot und Urin gesäubert sowie mit Essigsäurelösung in einer Konzentration von 0,1% behandelt, um etwaige Geruchsspuren zu standardisieren. Während der Verhaltensversuche wurden die Tiere von einem technischen Mitarbeiter auf das Auftreten von spontanen epileptischen Anfällen beobachtet. Entwickelte ein Tier einen Krampfanfall, so wurde mindestens eine Stunde abgewartet, bevor das Tier den jeweiligen Verhaltensversuch absolvierte. Das Ziel war, eine anfallsfreie Zeit von mindestens 60 Min. zu gewähren, so dass die Ausprägung von spontanen Anfällen die Resultate der verhaltensphysiologischen Untersuchungen möglichst nicht beeinflusste. 4.9.1 Eingangscharakterisierung und Überprüfung von Katalepsie Eingangscharakterisierung: Irwin-Test Es erfolgte eine Adaptierung der von IRWIN (1968) empfohlenen und von CRAWLEY (1997) modifizierten Tests an hiesige Laborbedingungen. Zu Beginn wurden die Tiernummern der Mäuse verblindet, so dass der Experimentatorin nicht bekannt war, zu welcher Versuchsgruppe das jeweilige zu untersuchende Tier zuzuordnen war. Mindestens 30 Min. vor Beginn der Versuche wurden die Tiere in den Vorbereitungsraum des Mausverhaltenslabors verbracht. Zuerst wurde die Maus gewogen und das Gewicht notiert. 52 Material und Methoden Für den ersten Abschnitt des Irwin-Tests, der Allgemeinuntersuchung, wurden 3 Min. eingeplant, um zu gewährleisten, dass jedes Tier über dieselbe Zeitdauer beurteilt wurde. Zu Beginn der Allgemeinuntersuchung wurde beobachtet, ob die Maus nach Hochheben am Schwanz versuchte, zu flüchten und wie ihr Platzierungsverhalten beim Absetzen aussah. Die Tiere wurden einzeln in einen Makrolonkäfig des Typs II gesetzt und während der Allgemeinuntersuchung lediglich von außen betrachtet. Für jedes Tier wurde ein sauberer Untersuchungskäfig verwendet. Es wurden Körperhaltung, Schwanztonus, Atmung, Piloerektion, Hautdurchblutung sowie die Sauberkeit des Fells beurteilt. Ferner wurde auf das mögliche Auftreten von Exophtalmus, Ptosis sowie Tränen- und Speichelfluss geachtet. Die Schnelligkeit des Bewegungsablaufs wie auch die Fortbewegung der Tiere im Untersuchungskäfig wurden bewertet. Mittels eines Klickers wurde die Schreckhaftigkeit sowie anhand eines Schlüssels das Hörvermögen der Tiere getestet. Im zweiten Abschnitt des Irwin-Tests erfolgte eine Manipulation bzw. Fixierung der Tiere. Zuerst wurde das Ausmaß des Urinabsatzes sowie die Anzahl der Kotboli notiert. Mittels leichter Bewegung des Untersuchungskäfigs von rechts nach links wurde das Gleichgewicht der Tiere überprüft. Ein Gegenstand wurde den Tieren gezeigt und beurteilt, ob sich die Mäuse dem Objekt annäherten. Mittels eines Pinsels erfolgte eine Berührung am Rücken der Tiere und es wurde bewertet, wie intensiv sich die Ausweichbewegung der Mäuse darstellte. Nach Reizung des Auges mittels einer Borste wurde der Cornealreflex sowie nach Reizung der Barthaare der Barthaarreflex überprüft. Die Experimentatorin maß die Rektaltemperatur der Tiere. Die Mäuse wurden an den Rand des umgedrehten Untersuchungskäfigs gesetzt und das Explorationsverhalten der Tiere an der Kante des Käfigs beurteilt. Durch Kneifen in die Schwanzwurzel der Mäuse mittels einer Pinzette wurde der Haffner-Reflex getestet. Anhand von einer kleinen Taschenlampe überprüfte die Experimentatorin den Pupillen-Reflex der Tiere. Bauchdeckenspannung sowie Muskeltonus der Extremitäten wurden nach Tasten mit dem Zeigefinger der Experimentatorin bewertet. Der Aufrichtreflex der Tiere wurde getestet, indem die Tiere mit ihrem Rücken zur Wand des umgedrehten Untersuchungskäfigs an ihrem Schwanz über die Kante gehoben wurden. Die Experimentatorin beurteilte, wie schnell die Mäuse 53 Material und Methoden ihre Lage korrigierten. Zum Schluss des Irwin-Test erfolgte eine abermalige rektale Messung der Körpertemperatur der Tiere. Der Beurteilung dienten je nach Untersuchungsparameter Scores zwischen 0 und 5. Die möglichen zu vergebenen Zahlen für jeden Parameter finden sich im Anhang 10.1 wieder. Mit Ausnahme des Parameters Pupillenreflex wurde Normalverhalten mittels eines Scores von 2 bewertet. Überprüfung von Katalepsie: Bar-Test (Studie 1) Mit dem Bar-Test (SANBERG et al. 1988) wird bei Nagern Katalepsie überprüft. Es wurde eine 3,5 cm hohe Zellkulturflasche (Greiner Bio-one, Frickenhausen, Deutschland) verwendet, auf welcher die Maus mit beiden Vorderbeinen platziert wurde. Der Bar-Test wurde 15-16 Wochen nach SE durchgeführt. Die Experimentatorin maß die Zeitdauer, welche die Maus ohne Korrektur ihrer Lage auf dem Podest verblieb. Nach maximal 120 s wurde der Test abgebrochen. Jedem Tier wurden drei Versuchsdurchläufe gewährt, welche unmittelbar hintereinander durchgeführt wurden. Veränderte die Maus in mindestens einem der Versuchsdurchläufe innerhalb von 120 s ihre Lage, so galt der Test als bestanden, und das Tier wurde infolgedessen als nicht kataleptisch bewertet. 4.9.2 Überprüfung von Exploration, Lokomotion und Angst-assoziiertem Verhalten Open-Field-Test Die Spontanaktivität von Nagern wird überprüft, indem sie in eine neue, offene Arena (das Open-Field) platziert werden, aus welcher sie aufgrund von umgebenden Wänden nicht entkommen können (WALSH u. CUMMINS 1976). Der Open-Field-Test wurde 5-6 Wochen (Studie 1) bzw. 10-13 Wochen nach SE (Studie 3) durchgeführt. In Studie 1, in welcher eine verhaltensphysiologische Charakterisierung von (LiCl-) Pilocarpin-behandelten NMRI-Mäusen erfolgte, wurde ein schwarzes, sowie in den Studien 2 und 3, in welcher Pilocarpin-behandelte B6Mäuse untersucht wurden, ein weißes Open-Field mit einer Grundfläche von 60 x 60 cm² und einer Höhe von 40 cm verwendet, um einen guten Kontrast zwischen 54 Material und Methoden Fellfarbe der Maus und der Versuchsapparatur für die Kameraaufzeichnung zu gewährleisten. Wie Abbildung 4.4 darstellt, wurde das Open-Field virtuell in drei (Studien 1, 2 und 3) bzw. zwei Zonen (Studie 3) unterteilt. Bei der Drei-Zonen-Einteilung wiesen äußerer und innerer Randbereich der Arena jeweils eine Breite von 10 cm auf, die Fläche des Zentrums betrug 20 x 20 cm². Bei der Zwei-Zonen-Einteilung war der Rand der Arena 15 cm breit und das Zentrum hatte eine Fläche von 28 x 28 cm². B A Zentrum Zentrum Innerer Randbereich Randbereich Äußerer Randbereich Abb. 4.4: Schematische Darstellung der virtuellen Zoneneinteilung des Open-Fields. A: Drei-ZonenEinteilung (Studien 1 und 2), B: Zwei-Zonen-Einteilung (Studie 3). In Studie 1 betrugen die Lichtstärken im äußeren Randbereich 10-15 Lux sowie im Zentrum 25 Lux. In Studie 2 lagen die Werte in den Ecken der Arena bei 160 Lux und im Zentrum bei 200 Lux. In Studie 3 wurden Lichtstärken von 180 Lux in den Ecken der Arena sowie 220 Lux im Zentrum verwendet. Die höheren Luxwerte in den Studien 2 und 3 wurden gewählt, um eine Vergleichbarkeit zur Studie von GRÖTICKE et al. (2007) zu gewährleisten. Alle Lichtstärken wurden mittels eines Luxmeters exakt eingestellt. Das Einsetzen der Tiere in das Open-Field erfolgte im Zentrum mit stets derselben Blickrichtung. Die Versuchsdauer betrug 5 Min. in Studie 1 sowie 10 Min. in den Studien 2 und 3. In Studie 3 wurden die ersten 10 Min. des Novel-Object-ExplorationTests (wird im nachfolgenden Kapitel beschrieben) als absolviertes Open-Field ausgewertet. 55 Material und Methoden Gemessene Parameter stellten die Aufenthaltsdauer in den einzelnen Zonen (s), die zurückgelegte Gesamtwegstrecke (cm), die Bewegungsgeschwindigkeit (cm/s) und die Anzahl des Aufrichtens der Tiere (n) dar. Novel-Object-Exploration-Test Mittels des Novel-Object-Exploration-Tests wird bei Nagern das Annäherungs- oder Vermeidungsverhalten von einem neuen Objekt überprüft, welches in eine bekannte Umgebung verbracht wird (VAN GAALEN u. STECKLER 2000). In Studie 3 wurde das weiße Open-Field eingesetzt, welches die Mäuse während der 30-minütigen Habituationsphase frei explorieren konnten. Nach Abschluss der Habituationsphase wurden die Tiere kurz aus der Arena herausgenommen und ein Objekt (blaue, wassergefüllte Plastikflasche: 0,5 Liter, 6 x 22,5 cm), welches den Tieren unbekannt war, in das Zentrum des Open-Fields platziert (Abbildung 4.5). Für die 15-minütige Objektphase, in welcher die Tiere die Möglichkeit hatten, das Objekt frei zu erkunden, wurden die Tiere am Rand der Arena eingesetzt. Abb. 4.5: Darstellung der Objektphase des Novel-Object-Exploration-Tests: Versuchsapparatur des Open-Field mit Präsentation des Objekts (Wasserflasche im Zentrum der Arena). Als Untersuchungsparameter sind die gleichen wie bei der Absolvierung des im vorherigen Kapitel beschriebenen Open-Field-Tests zu nennen: Aufenthaltsdauer im Zentrum bzw. Rand der Arena (s), Gesamtwegstrecke (cm) sowie Bewegungsgeschwindigkeit (cm/s). Alle Parameter wurden jeweils für die Habituations- sowie für 56 Material und Methoden die Objektphase ermittelt. Da die ersten 10 Min. der Habituation als Open-Field-Test ausgewertet wurden, galten die letzten 15 Min. der Habituation als untersuchte Habituationsphase des Novel-Object-Exploration-Tests. Die gesamten 15 Min., in welcher die Tiere das Objekt explorieren konnten, wurden als Objektphase ausgewertet. Hole-Board-Test Der Hole-Board-Test wird verwendet, um Aktivität sowie Explorationsverhalten von Nagern zu überprüfen (FILE u. WARDILL 1975). Als Apparatur für den Hole-BoardTest diente eine graue, 70 cm erhöht über dem Boden stehende Plastikplatte (36 x 36 cm), welche mit 16 Löchern (Durchmesser 2,5 cm) durchsetzt und von einer 0,3 cm hohen Kante umgeben ist. Die Lichtintensität wurde auf 150 Lux sowohl am Rand, als auch im Zentrum der Versuchsapparatur eingestellt. Für den Versuchsablauf, 16 bis 19 Wochen nach SE durchgeführt, wurde eine Maus in das Zentrum des Hole-Boards gesetzt. Sie konnte über 5 Min. die Apparatur samt ihrer Löcher frei explorieren. Die Apparatur des Hole-Board-Tests ist mit Lichtschranken ausgestattet, welche registrieren, ob eine Maus mit ihrer Nase die Löcher erkundet (Head-Dip, Abbildung 4.6) und diese Information an eine externe Zähleinheit weitergeben. So konnte nach Beendigung des Tests an der automatischen Zähleinheit die Anzahl der Head-Dips abgelesen werden. Abb.4.6: Darstellung eines Head-Dips einer Maus bei der Absolvierung des Hole-Board-Tests. 57 Material und Methoden Die Anzahl der Edge-Dips, welche bedeuten, dass eine Maus über den Rand der Versuchsapparatur herabschaut, wurden manuell mittels Beobachten der Tiere auf dem Computermonitor gezählt. Als Untersuchungsparameter wurden beim HoleBoard-Test außer der Anzahl der Head-Dips (n) sowie der Edge-Dips (n) auch die zurückgelegte Wegstrecke (cm) sowie die Bewegungsgeschwindigkeit (cm/s) herangezogen. Elevated-Plus-Maze Das Elevated-Plus-Maze stellt die natürliche Aversion von Nagern vor offenen Flächen dar und überprüft infolgedessen Angst-assoziiertes Verhalten (LISTER 1987). Der Test wurde 6-7 Wochen (Studie 1) bzw. 14-17 Wochen nach SE (Studie 3) durchgeführt. Wie Abbildung 4.7 darstellt, besteht die Versuchsapparatur des Elevated-Plus-Mazes aus grauem Plastik sowie aus vier plusförmig angeordneten Armen (jeweils 30 x 5 cm²). Der Abstand zwischen den Armen und der Bodenfläche des Labors beträgt 68 cm. Zwei dieser Arme waren von Wänden in einer Höhe von 15 cm umschlossen. Die anderen zwei Arme wurden als offene Arme gestaltet und lediglich von einer 0,3 cm hohen Kante umgeben, um ein versehentliches Abrutschen der Tiere von den offenen Armen zu verhindern. Die Maße des Zentrums, welches den Verbindungspunkt aller vier Arme darstellt, betragen 5 x 5 cm. In Studie 1 wurde die Lichtstärke auf folgende Luxwerte eingestellt: In den offenen Armen auf 200 Lux, am Anfangsbereich der geschlossenen Arme auf 80 Lux sowie am Ende der geschlossenen Arme auf 20 Lux. In Studie 3 betrugen die Lichtstärken analog zur Studie von GRÖTICKE et al. (2007) im Zentrum 27 Lux, am Ende der offenen Arme 33 Lux sowie am Ende der geschlossenen Arme 15 Lux. 58 Material und Methoden Geschlossener Arm Offener Arm Abb. 4.7: Versuchsapparatur des Elevated-Plus-Mazes. Die Tiere wurden mit stets derselben Blickrichtung zum offenen Arm in das Zentrum der Versuchsapparatur platziert und konnten sich auf dieser über eine Versuchsdauer von 5 Min. frei bewegen. Als Untersuchungsparameter galten die Aufenthaltsdauer auf den offenen und geschlossenen Armen (s), das Verhältnis des Aufenthalts auf den offenen zu den geschlossenen Armen, die Gesamtwegstrecke (cm) sowie die Bewegungsgeschwindigkeit (cm/s). Sprangen Mäuse von der Versuchsapparatur, so wurde das Tier von der Experimentatorin so schnell wie möglich erneut in das Zentrum des Elevated-Plus-Maze platziert und die Anzahl der Absprünge (n) notiert. Light-Dark-Box Die Light-Dark-Box wurde von CRAWLEY und GOODWIN (1980) als Verhaltenstest zur Überprüfung von Angst-assoziiertem Verhalten eingeführt. Die Mäuse absolvierten den Test 15-18 Wochen nach SE. Wie Abbildung 4.8 darstellt, besteht die Versuchsapparatur aus einer Plastikkammer mit einem Deckel für den dunklen Bereich. Das größere, helle, offene Kompartment misst 33 x 26 x 29 cm³. Die Lichtstärke betrug 360 Lux im Zentrum, 300 Lux in den beiden Ecken nah des dunklen Kompartments sowie 350 Lux in den äußeren Ecken. Das kleinere, schwarze, bedeckte Kompartment trägt die Maße 14 x 26 x 29 cm³. Die Lichtstärke wurde auf 22 Lux im Durchgangsbereich sowie 6 Lux an der Wand gegenüber des 59 Material und Methoden Durchgangs eingestellt. Der Durchgang, welcher Maße von 6 x 5 cm² aufweist, verbindet beide Kompartments miteinander. Geschlossenes & offenes Kompartment Abb. 4.8: Versuchsapparatur der Light-Dark-Box. Für die Absolvierung des Tests wurde jede Maus mit Blickrichtung zur weißen Wand gegenüber dem Durchgang ins Zentrum des weißen Kompartments platziert. Über die Dauer von 5 Min. konnte die Maus die Versuchsapparatur frei explorieren. Folgende Parameter wurden ausgewertet: Aufenthaltsdauer (s) im hellen und dunklen Kompartment, die zurückgelegte Gesamtstrecke (cm), die Bewegungsgeschwindigkeit (cm/s) sowie die Anzahl der Kreuzungen zwischen weißem und schwarzen Kompartment (n). 4.9.3 Überprüfung der motorischen Fähigkeiten Rotarod-Test Der Rotarod-Test überprüft die Fähigkeiten von Nagern, auf einem rotierenden Stab zu balancieren (COUGHENOUR et al. 1977). Das Rotarod für Mäuse (Abb. 4.9, Treadmill 7600; Ugo Basile, Comerio, Italien) wurde auf eine Drehgeschwindigkeit von 6 Umdrehungen pro Min. eingestellt. 60 Material und Methoden Abb. 4.9: Rotarod für Mäuse. Der Versuch bestand aus einem Trainingstag und einem darauffolgenden Testtag. Die Tiere wurden mit Laufrichtung nach vorne auf das Rotarod eingesetzt. Am Trainingstag wurden die Tiere so oft auf dem Rotarod platziert, bis sie kumulativ 60 s auf dem sich drehenden Zylinder (Durchmesser 4 cm) balancierten. Es wurde die Anzahl der Absprünge pro Tier notiert. Am Testtag fanden pro Tier drei Versuchsdurchläufe von maximal 60 s statt. Der Test galt als bestanden, wenn die Maus in mindestens einem von drei Versuchen 60 s auf dem sich drehenden Stab die Balance halten konnte. Bei Mäusen, welche vor Ablauf der 60 s herunterfielen, wurde die Latenzzeit bis zum Fall (s) notiert. Hanging-Wire-Test Eine weitere Überprüfung der motorischen Fähigkeiten erfolgte mittels des HangingWire-Tests (COUGHENOUR et al. 1977). Es wurde ein ebenes Gitter mit einer Maschenweite von 1,5 cm² verwendet, dessen Seitenränder mit Alufolie umspannt waren, so dass ein Erklettern der Oberfläche für die Tiere nicht möglich war. Die Mäuse wurden von oben auf das Metallgitter gesetzt, welches von der Experimentatorin horizontal in einer Höhe von etwa 50 cm bis 1 m über einer freien Arbeitsfläche gehalten wurde. Um zu gewährleisten, dass die Tiere festen Halt am Gitter suchten, wurde das Gitter mehrmals kurz nach rechts und links bewegt. Nach 61 Material und Methoden der Drehung des Gitters um 180° mussten sich die Tiere kopfüber hängend mindestens 60 s am Gitter festhalten (Abb. 4.10). Abb. 4.10: Durchführung des Hanging-Wire-Tests. Bewertet wurde, ob sich die Maus 60 s am Gitter festhalten konnte. Falls dies nicht der Fall war, wurde die Latenzzeit (s) bis zum Fall notiert. Jede Maus absolvierte den Versuch lediglich einmal. Chimney-Test Mittels des Chimney-Tests wird die motorische Fähigkeit eines Tieres überprüft, rückwärts aus einer Röhre herauszuklettern (WLÁZ 1998). Für den Test wurde eine durchsichtige Kunststoffröhre mit einem Durchmesser von 2,5 cm bei einer Länge von 21 cm verwendet. Die Röhre wurde horizontal auf eine Arbeitsplatte gelegt und die Maus vorsichtig hineingeleitet. Kletterte das Tier in die Röhre und erreichte das hintere Ende, setzte die Experimentatorin die Röhre sofort senkrecht auf die Arbeitsfläche, so dass die Maus rückwärts aus der Röhre klettern musste (Abb. 4.11). 62 Material und Methoden Abb. 4.11: Absolvierung des Chimney-Tests. Da die Zeitdauer, welche die Tiere benötigen, um aus der Röhre zu klettern, sehr variabel ist, wurde lediglich als Ja-Nein-Antwort bewertet, ob die Tiere in der Lage waren, rückwärts aus der Röhre zu klettern oder nicht. Nach maximal 60 s wurde der Test abgebrochen. Jedes Tier erhielt nur einen Versuchsdurchlauf. Zwischen den Testdurchgängen der einzelnen Tiere wurde die Röhre von Kot- und Urinspuren gereinigt. 4.9.4 Überprüfung der räumlichen Lern- und Gedächtnisleistung: Morris-WaterMaze Mittels des Morris-Water-Mazes werden räumliche Lern- und Gedächtnisfähigkeiten von Nagern getestet (MORRIS 1984). 63 Material und Methoden A A N B O W Plattform S C 0 1 2 3 4 5 6 7 8 9 10 H 20 21 RT Akquisitionstage 30 31 CV Abb. 4.12: Darstellung der Versuchsapparatur des Morris-Water-Mazes (A), einer schematischen Zeichnung der Aufsicht auf das Becken des Morris-Water-Maze (B) sowie der Zeitachse des Versuchsablaufs (C). Abb. B: N = Norden, O = Osten, W = Westen und S = Süden. Abb. C: Anhand der angegebenen Zahlen wurden die Versuchstage nummeriert. H = Habituation, RT = RetentionTest, CV = Cued-Version. Absolvierung von Retention-Test und Cued-Version nur in Studie 3. Die Durchführung des Morris-Water-Mazes begann 7-9 Wochen (Studie 1) bzw. 1922 Wochen (Studie 3) nach SE. Das in Abbildung 4.12 A dargestellte schwarze 64 Material und Methoden Becken des Morris-Water-Maze weist eine Höhe von 50 cm sowie einen Durchmesser von 1 m auf. Die Maße der bei NMRI-Mäusen schwarzen, sowie bei B6-Mäusen durchsichtigen Plattform betrugen 10 x 10 cm. Die Plattform wurde in einer Höhe 18-20 cm im Becken befestigt. Die Wasserhöhe über der Plattform maß 1 cm, so dass die Plattform für die Tiere versteckt unter der Wasseroberfläche lag. Als Hinweisreize dienlich befanden sich 3 Schilder mit einfachen geometrischen Formen außerhalb des Beckens. Das erste Schild wies eine Größe von 20 x 20 cm auf, hatte eine quadratische Form, war blau mit einem weißen Kreis in der Mitte und befand sich am Standort Nord. Die Maße des zweiten Schildes betrugen 20 x 37 cm, es beinhaltete ein Rechteck, war blau/weiß gestreift und wurde am Standort West eingesetzt. Das dritte Schild hatte eine Größe von 20 x 20 cm, eine dreidimensionale Form, eine weiße Farbe mit einem schwarzen Kreuz und befand sich am Standort Südost. Die exakte Position wurde aufgrund von Markierungen auf dem Boden gewährleistet. Für Studie 3 wurde das Wasser mit 3 Litern Vollmilch pro Beckenfüllung eingetrübt, um eine Detektierung der schwarzen Mäuse mittels Kamera im schwarzen Becken zu ermöglichen. In Studie 1 wurde die normale Deckenbeleuchtung eingeschaltet, in Studie 3 dagegen das Becken mit Stehlampen gleichmäßig ausgeleuchtet. Das Becken wurde für jeden Versuchstag neu mit Wasser gefüllt, wobei die Wassertemperatur in Studie 1 23°C sowie in Studie 3 24°C betrug. An Tag 0 erfolgte die Habituationsphase des Versuchs. Die Mäuse wurden drei Mal hintereinander für jeweils 10 s auf die für sie unsichtbare Plattform gesetzt, so dass sie lernten, dass sich im wassergefüllten Becken eine Plattform befindet. Sprangen die Tiere von der Plattform, so wurden sie erneut auf dieser platziert, bis sie kumulativ drei Mal 10 s auf der Plattform verbrachten. In der Akquisitionsphase (Abb. 4.12 C) erfolgten 10 aufeinanderfolgende Trainingstage, an welchen jede Maus viermal pro Tag mit Blickrichtung zur Wand in das Becken eingesetzt wurde. Als die vier Einsatzpunkte galten die Himmelsrichtungen Ost, Nord, West und Süd, welche am Becken markiert waren. In Studie 1 wurden die Tiere an jedem Tag der Akquisition im Osten beginnend, dann reihum in der Richtung gegen den Uhrzeigersinn in den anderen Himmelsrichtungen 65 Material und Methoden eingesetzt. In Studie 3 wurde ferner die Himmelsrichtung, an welcher die Tiere als erstes eingesetzt wurden, von Versuchstag zu Versuchstag gegen den Uhrzeigersinn gewechselt. Die Plattform befand sich in Studie 1 im Südwesten sowie in Studie 3 im Südosten des Beckens. Konnte die Maus innerhalb der maximalen Versuchsdauer von 1 Min. die Plattform auffinden, so wurde sie 20 s auf dieser sitzen gelassen und bis zum Beginn des nächsten Versuchsdurchlaufs in den Transportkäfig verbracht. Vermochte die Maus die Plattform innerhalb von 1 Min. nicht zu finden, leitete die Experimentatorin die Maus vorsichtig zur Plattform hin und gewährte ihr gleichfalls eine Verweildauer von 20 s auf der Plattform, welche der Maus zur Orientierung diente. Zwischen den Versuchsdurchläufen der Tiere wurde das Wasser oberflächlich mit der Hand der Experimentatorin durchgerührt, um etwaige Geruchsspuren zu reduzieren. Als Hauptparameter galt während der Akquisitionsphase die gemessene Latenzzeit (s, Mittelwert pro Tier pro Trainingstag), welche die Tiere benötigten, um die Plattform aufzufinden. Ferner wurde in Studie 3 die mittlere Schwimmgeschwindigkeit der Tiere (cm/s) ermittelt. An Akquisitionstag 10 wurde lediglich aus den ersten drei Versuchsdurchläufen der Mittelwert der Latenzzeit für diesen Tag gebildet. Der vierte Durchgang wurde als Probe-Trial durchgeführt. Dies bedeutet, dass die Plattform aus dem Becken entfernt wurde und infolgedessen dem Tier die Möglichkeit gegeben wurde, 60 s im Becken zu schwimmen. Hier zeigte sich, ob die Maus in der Akquisitionsphase gelernt hatte, an welcher Stelle sich die Plattform befand, da die Zeitdauer gemessen wurde, die das Tier im Quadraten mit der ehemaligen Plattformposition verbrachte (Studie 1) bzw. die Kreuzungspunkte mit der ehemaligen Plattformposition ermittelt wurden (Studie 3). In Studie 1 lag der Startpunkt für den Probe-Trial im Osten, in Studie 3 im Norden. Nach einem trainingsfreien Intervall von 9 Tagen wurde in Studie 3 ferner ein Retentionstest (Abbildung 4.12 C) durchgeführt, um die Langzeitgedächtnisleistung der Tiere zu überprüfen. Für den Retentionstest wurden an zwei aufeinanderfolgenden Tagen (Tag 20 und 21) analog zur Akquisitionsphase vier 66 Material und Methoden Versuchsdurchläufe pro Tier pro Tag durchgeführt. Die Plattform befand sich an derselben Stelle wie in der Trainingsphase. Nach einem weiteren trainingsfreien Intervall von 9 Tagen absolvierten die Tiere in Studie 3 zudem an Tag 30 und 31 eine Cued-Version des Morris-Water-Maze (OWEN et al. 1997), um sicherzustellen, dass etwaige Lern- und Gedächtniseinbußen nicht auf visuellen Defiziten oder Motivationsunterschieden beruhten. Für die Cued-Version wurde die Plattform mittels eines bunt beklebten, 10 cm langen Lineals, welches mit einem Gummiring an der Plattform befestigt wurde, sichtbar gemacht. Ferner befand sich die Plattform für die Tiere gut zu sehen 0,5 cm über der Wasseroberfläche. Die Plattform wurde in ihrer Position verändert und befand sich in der Cued-Version am Standort Nordwest. Analog zur Akquisitionsphase wurden wieder vier Versuchsdurchläufe pro Tier pro Tag durchgeführt. Im Retentionstest sowie in der Cued-Version wurde gleichfalls die Latenzzeit (s) ermittelt, welche die Tiere benötigten, um die Plattform aufzufinden. Nach Absolvierung der Versuche wurden die Tiere unter eine Wärmelampe gesetzt, so dass ihr Fell trocknete, bevor sie in den Heimkäfig zurückgesetzt wurden. 4.9.5 Überprüfung von Depressions-assoziiertem Verhalten Die Tests zu Untersuchung von Depressions-assoziiertem Verhalten wurden 9-11 Wochen (Studie 1) bzw. 25-28 Wochen (Studie 3) nach SE durchgeführt. Tail-Suspension-Test Mittels des Tail-Suspension-Tests wird überprüft, wie die Fähigkeit von Nagern ausgeprägt ist, auf eine stressauslösende Situation zu reagieren (CRYAN et al. 2005). Er wird verwendet, um die Reaktionen von Nagern auf antidepressiv wirkende Substanzen zu überprüfen (MAYORGA u. LUCKI 2001). Für die Durchführung des Tail-Suspension-Tests wurde ein kontrastreicher Hintergrund in Form einer schwarzen Pappe gewählt, vor welcher eine Stange in einer Höhe von 30 cm an einem Stativ angebracht wurde. Da jeweils zwei Mäuse zur gleichen Zeit den Versuch absolvierten, wurde eine Trennwand verwendet, so dass sich die beiden Mäuse nicht sehen und infolgedessen nicht gegenseitig beeinflussen konnten. Bei 67 Material und Methoden jeder Maus wurde der gerade Schenkel einer aufgebogenen Büroklammer mittels Textilklebeband etwa zu Beginn des letzten Drittels an den Schwanz des Tieres geklebt. Anhand der Büroklammer wurde die Maus kopfüber an der Stange aufgehängt (Abb. 4.13), über die Versuchsdauer von 6 Min. in dieser Art und Weise hängen gelassen und währenddessen von frontal gefilmt. Abb. 4.13: Eine Maus wurde für die Absolvierung des Tail-Suspension-Tests kopfüber an ihrem Schwanz aufgehängt. Die Experimentatorin beobachtete die Tiere während des Versuchsablaufs, befand sich aber versteckt im Raum, so dass die Tiere nicht durch die Anwesenheit der Experimentatorin beeinflusst wurden, während sie den Versuch absolvierten. Die Auswertung erfolgte anhand der aufgezeichneten Videos, wobei die Tiernummern verblindet wurden, so dass der Experimentatorin bei der Auswertung nicht bekannt war, welcher Gruppe das jeweilige Tier angehörte. Den Hauptparameter stellte die kumulative Immobilisationszeit (s) dar, welche mit Hilfe einer Stoppuhr bei der Auswertung anhand der aufgezeichneten Videos ermittelt wurde. Porsolt-Test Einen weiteren Screening-Test, um die Reaktion von Mäusen auf antidepressivwirkende Substanzen zu überprüfen, stellt der Porsolt-Test dar (PORSOLT et al. 1977). Für die Durchführung des Versuchs wurden zwei durchsichtige Bechergläser 68 Material und Methoden mit einer Höhe von 26,5 cm sowie einem Durchmesser von 16,5 cm vor einem kontrastreichen Hintergrund platziert. Analog zum Tail-Suspension-Test wurde eine Trennwand verwendet, so dass zwei Tiere gleichzeitig den Versuch absolvieren konnten. Jedes Becherglas wurde bis zu einer Höhe von 15 cm mit Wasser in einer Temperatur von 22°C gefüllt. Für den Versuchsdurchlauf wurde eine Maus vorsichtig in die Mitte des Gefäßes eingesetzt und für 6 Min. schwimmen gelassen (Abb. 4.14). Abb. 4.14: Absolvierung des Porsolt-Tests. Die Maus zeigt eine unbewegliche Körperhaltung, welche als Immobilität des Tieres gewertet wird. Wie bereits für den Tail-Suspension-Test beschrieben, beobachtete auch hier die Experimentatorin die Mäuse während des Versuchsablaufs, befand sich jedoch von den Tieren unbemerkt versteckt im Raum. Es wurde insbesondere auf das Auftreten von spontanen epileptischen Anfällen der Mäuse geachtet, welche die Schwimmfähigkeit der Tiere beeinträchtigen können. Nach Absolvierung des Versuchs bekamen die Tiere die Möglichkeit, unter einer Wärmelampe zu trocknen, bevor die Rückkehr in ihren Heimkäfig erfolgte. Als Hauptparameter galt auch beim zweiten Test zur Überprüfung von Depressionsassoziiertem Verhalten die kumulative Immobilitätszeit (s), jedoch wurden beim Porsolt-Test lediglich die letzten vier Min. eines sechsminütigen Versuchsdurchlaufs ausgewertet. Die Ermittlung der Immobilitätszeit erfolgte analog zum TailSuspension-Test anhand der frontal aufgezeichneten Videos unter verblindeten Bedingungen. Die Körperhaltung der Tiere wurde als immobil gewertet, wenn sich 69 Material und Methoden die Mäuse reglos im Wasser treiben ließen und lediglich minimale Bewegungen einer Gliedmaße ausführten, um sich über der Wasseroberfläche halten zu können. 4.10 Histologie 4.10.1 Gewinnung und Aufarbeitung der Gehirne Die Mäuse aus Studie 1 wurden 5 Monate nach Pilocarpin- bzw. Vehikelinjektion dekapitiert. Bei den Tieren aus Studie 3 wurden jeweils 5 Pilocarpin-behandelte Mäuse, sowohl mit als auch ohne SE, nach 4 Wochen sowie die Versuchsgruppen aus der Verhaltensbatterie 9 Monate nach Pilocarpin- bzw. Vehikelapplikation mittels cervicaler Dislokation getötet. Die Nackenmuskulatur sowie die Kopfhaut wurden mittels einer Schere entfernt. Ausgehend vom freigelegten Magnum okcipitale wurde die Schädelkalotte unter Schonung des unfixierten Gehirngewebes in der Medianen eröffnet. Vorsichtig wurde mittels einer Knochenzange der dorsale Anteil des Schädelknochens entfernt und das Gehirn nach Durchtrennung der Bulbi olfactorii sowie der Gehirnnerven entnommen. Das entnommene Gehirn wurde unmittelbar in ein Behältnis aus Alufolie (Durchmesser 1,8 cm, Höhe 2,2 cm) gelegt, welches zuvor mit Einbettmedium (Tissue Freezing Medium®, Jung, Nussloch, Deutschland) befüllt wurde. Ein Behältnis mit flüssigem Stickstoff diente der Kühlung von 2-Methylbutan, in welchem das in Einbettmedium befindliche Gehirn über die Dauer von 2-3 Min. eingefroren wurde. Die eingefrorenen Gehirne wurden bei -20°C gelagert. Mittels eines Kryostaten (HM 560 M, Microm, Walldorf, Deutschland) wurden coronale Schnitte in einer Schnittdicke von 14 µm angefertigt. Es wurden die Ebenen -1,94 mm, -2,54 mm und -3,16 mm sowie in Studie 3 zusätzlich -1,46 mm zu Bregma (PAXINOS u. FRANKLIN 2001) ausgewählt. Die Gehirnschnitte wurden auf Objektträger aufgezogen, welche mit Siliciumwasserstoff beschichtet sind (Histobond, Marienfeld, Lauda-Königshofen). Die Lagerung der Kryostatschnitte erfolgte gleichfalls bei -20°C. 70 Material und Methoden B A D C Abb. 4.15: Darstellung der ausgewerteten Schnittebenen, -1,46 mm (A, nur Studie 3), -1,94 mm (B), 2,54 mm (C) sowie -3,16 mm (D) zu Bregma (PAXINOS u. FRANKLIN 2001) 4.10.2 Thionin-Färbung Für die histologischen Schnitte der Studien 1 und 3 erfolgte eine Nissl-Färbung. Da sich Nissl-Substanz insbesondere in den Somata von Neuronen befindet, stellen sich diese nach Färbung mittels einer Thionin-Lösung deutlich dar. In Nissl-Färbung wurden die Bewertungen mittels Scoring-System (dargestellt in Kapitel 4.10.5) sowie das Auszählen von Neuronen (Kapitel 4.10.6) vorgenommen. Vor Beginn der Färbung wurden die Kryostatschnitte 10 Min. in 4% Paraformaldehyd fixiert und jeweils 3 Min. mit Ethanol in absteigenden Konzentrationen behandelt. Nach dreiminütiger Waschung in Aqua dest. erfolgte die Färbung in Thionin-Lösung über eine Dauer von 90 s. Nach erneuter Behandlung von jeweils 3 Min. mit Ethanol in denselben Konzentrationen (diesmal in aufsteigender Reihenfolge) wurden die Kryostatschnitte mit Terpineol/Xylol-Ersatzmedium (Mischverhältnis 1:1) sowie in Xylol-Ersatzmedium behandelt. Die Schnitte wurden sofort mit einem Eindeckmedium (Entellan®, Merck, Darmstadt, Deutschland) und Deckgläschen 71 Material und Methoden direkt auf den Objektträgern eingedeckt und über Nacht unter dem Abzug trocknen gelassen. Das exakte Protokoll der Färbung sowie eine Beschreibung der Zusammensetzung der Thionin-Lösung befinden sich in Anhang 10.2. 4.10.3 Fluoro-Jade-C-Färbung Gehirnschnitte von jeweils 2 Tieren pro Gruppe aus den Studien 1 und 3 wurden mittels Fluoro-Jade-C (FJC), einem hochselektiven, fluoreszierenden Marker für degenerierende Neuronen (SCHMUED et al. 1997; SCHMUED et al. 2005) gefärbt. Vor Beginn der Färbung erfolgte eine Post-Fixierung der Kryostatschnitte in 4% Paraformaldehyd. Nach Behandlung der Gehirnschnitte mit 80% sowie anschließend 70% Ethanol, Waschung in Aqua dest. sowie 0,06% Kalium-Permanganatlösung, wurden die Kryostatschnitte unter Lichtausschluss mittels FJC-Lösung gefärbt. Nach einer mehrstündigen Trocknungsphase wurden die Schnitte mit Xylene-Lösung behandelt, mit einem Eindeckmedium (DPX-Mounting-Medium) und Deckgläschen direkt auf den Objektträgern eingedeckt und über Nacht unter dem Abzug trocknen gelassen. Das Protokoll der FJC-Färbung und eine Beschreibung der Zusammensetzung der FJC-Lösung liegen in Anhang 10.3. 4.10.4 GFAP-Färbung 1 repräsentatives Tier pro Versuchsgruppe aus den Studien 1 und 3 wurde mittels Glial-fibrillary-acidic-protein (GFAP), einem Astroglia-spezifischem Intermediärfilament-Protein markiert (STEWARD et al. 1992). Hierbei handelt es sich um einen immunhistochemischen Nachweis. Nach Fixierung der Gefrierschnitte in 4% Paraformaldehyd erfolgte eine Hemmung der endogenen Peroxidase mittels 0,5% H2O2. Über Nacht wurden die Kryostatschnitte mit dem primären Antikörper (polyclonaler Rabbit-anti-Cow-GFAP [DAKO, Hamburg, Deutschland]) inkubiert. Am darauffolgenden Tag erfolgte die 90-minütige Inkubation mit dem sekundären Antikörper (biotinillierter Pig-anti-rabbit-Antikörper, DAKO, Hamburg, Deutschland). Als Färbung wurde Vectastain-Lösung (Biozol, München) sowie 3,3'- Diaminobenzidin-Lösung (DAB) eingesetzt. Die histologischen Schnitte wurden am darauffolgenden Tag mit Eindeckmedium (Entellan®) und Deckgläschen direkt auf 72 Material und Methoden den Objektträgern eingedeckt. Das Protokoll für die GFAP-Färbung sowie der verwendeten Lösungen befindet sich in Anhang 10.4. 4.10.5 Histologische Auswertung Die histologische Auswertung erfolgte an einem Mikroskop (Leica, Solms, Deutschland), welches eine digitale Kamera (CCD, Axiocam, Zeiss, Göttingen, Deutschland) besitzt und mit einem Computer verbunden ist, auf welchem eine Bildanalysesoftware (Axiovision®) installiert ist. Die Bewertung der Schnitte erfolgte stets unter verblindeten Bedingungen, so dass der untersuchenden Person die Gruppenzugehörigkeit der Tiere nicht bekannt war. 4.10.5.1 Bewertung nach Scoring-System Die Bewertung nach Scoring-System (BRANDT et al. 2003) wurde in 25- sowie 100facher Vergrößerung durchgeführt. Score 0 bezeichnete keinen sichtbaren Neuronenverlust, Score 1 einen möglichen Neuronenverlust in einem Ausmaß bis zu 20%, Score 2 einen Neuronenverlust von 20-50% sowie Score 3 einen Neuronenverlust in einem Ausmaß von über 50%. Es wurde jeweils der Mittelwert aus den Ergebnissen für den rechten und linken Hippocampus pro Schnittebene und anschließend aus diesem ermittelten Wert der Mittelwert aus den bewerteten Schnittebenen (-1,46 mm [nur Studie 3], -1,94 mm, -2,54 mm sowie -3,16 mm zu Bregma) gebildet. Die untersuchten Subregionen stellten CA 1 und CA 3 des Hippocampus sowie Hilus und Körnerzellschicht des Gyrus dentatus dar. Als Neuronen wurden polymorphe Zellen mit einem Durchmesser von mindestens 8 µm gewertet. 4.10.5.2 Auswertung des Hilus des Gyrus dentatus Zusätzlich zur Bewertung nach Scoring-System (Kapitel 4.10.5.1) wurde in Studie 3 die Fläche des Hilus des Gyrus dentatus ausgemessen, indem der Umriss des Hilus umfahren sowie zwei Hilfslinien von der Spitze der CA 3c-Subregion zu beiden Enden des Gyrus dentatus gezogen wurden, analog zu den Arbeiten von GRÖTICKE et al. (2007; 2008). Es wurde die Dichte an Neuronen berechnet, indem der Quotient 73 Material und Methoden aus Anzahl an Neuronen pro ausgemessene Fläche in µm ermittelt wurde. In Studie 1 konnte die Dichte im Hilus des Gyrus dentatus nicht ausgewertet werden, da aufgrund des ausgeprägten Neuronenverlusts in der Körnerzellschicht des Gyrus dentatus sowie in der CA 3c-Subregion des Hippocampus ein Ausmessen der Hilusfläche nicht möglich war. 4.10.5.3 Auszählen von Neuronen innerhalb definierter Fenster Das Auszählen von Neuronen erfolgte für die Subregionen CA 1 und CA 3 des Hippocampus sowie in Studie 1 für den Hilus des Gyrus dentatus und für die Amygdala innerhalb definierter Fenster, welche eine Größe von 265 x 355 µm² hatten. Es wurde in 400-facher Vergrößerung gezählt. Für die Subregion CA 1 wurden jeweils die Neuronen von 3 definierten Fenstern ausgezählt (in der Steigung am Anfang, in der Mitte, sowie in der Absenkung zum Ende der Körnerzellschicht der CA 1-Subregion), für die Subregion CA 3a wurden zwei Fenster (im steilsten Punkt der Steigung sowie in der Gerade der Körnerzellschicht) sowie in der Region CA 3c zu Beginn der Körnerzellschicht und inmitten des Hilus jeweils ein Fenster ausgezählt. Es wurde zunächst der Mittelwert aus den ausgezählten Neuronen der definierten Fenster gebildet, sowie anschließend der Mittelwert aus den Ergebnissen für den rechten und linken Hippocampus ermittelt. In den Subregionen CA 1 und CA 3 wurde die Schnittebene -1,94 mm zu Bregma ausgezählt. Für den Hilus wurde ein Mittelwert aus den Ergebnissen der Schnittebenen -1,94 mm und -2,54 mm zu Bregma gebildet. Bei der Auswertung der Amygdala wurde ein Fenster inmitten der Kerngebiete ausgezählt. Es wurden nur Gehirnschnitte verwendet, bei welchen die Amygdala eine hinlängliche Größe (Schnittebene auf Ebene der Amygdala -1,94 mm zu Bregma) aufwies. Da dies bei nicht allen Tieren der Fall war, wurden die Pilocarpin-behandelten Tiere bei der Amygdala-Auswertung nicht nach LiClVorbehandlung aufgetrennt, um eine ausreichende Anzahl an Tieren pro Gruppe gewährleisten zu können. 74 Material und Methoden 4.11 Korrelationen zwischen Neurodegeneration und Verhaltensauffälligkeiten (Studie 1) Es wurden für Studie 1 Korrelationen zwischen der Neurodegeneration für die ausgewerteten Subregionen CA 1 und CA 3c des Hippocampus sowie für den Hilus des Gyrus dentatus und den Abweichungen in den verhaltensphysiologischen Untersuchungen berechnet. Als Parameter aus den Verhaltenstests dienten die Aufenthaltsdauer im Zentrum des Open-Field sowie auf den offenen Armen des Elevated-Plus-Maze und die Immobilitätsdauer im Tail-Suspension- und Porsolt-Test. Beim Morris-Water-Maze-Test wurde ein Quotient aus der Latenzzeit von Tag 8 zu Tag 1 gebildet. Für die Berechnungen wurde der jeweilige Wert der Kontrollen (im Falle der histologischen Auswertungen die Anzahl der Neuronen sowie im Falle der Verhaltenstests die Zeitdauer in s) als 100% gesetzt. Über Dreisatzberechnungen wurde der prozentuale Verlust an Neuronen bzw. an Aufenthaltszeit für die epileptischen Tiere ermittelt. Beim Morris-Water-Maze wurden die errechneten Quotienten aus der Latenzzeit von Tag 8 zu Tag 1 verwendet. Die jeweils berechneten Verhaltensparameter wurden mit den histologischen Abweichungen in Korrelation gesetzt. 4.12 Statistische Berechnungen Sämtlichen statistischen Berechnungen diente das Programm GraphPad Prism 5 für Windows. Die Daten wurden als Mittelwert ± Standard Error of the Mean (SEM) angegeben. War die Gruppengröße ausreichend, so wurde zunächst nach D’Agostino & Pearson berechnet, ob sich die Daten entsprechend der Gauss’schen Normalverteilung verhielten. Bei zu geringer Gruppengröße wurde wie bei nichtparametrischen Daten verfahren. Bei Vergleichen von zwei Versuchsgruppen wurde für parametrische Daten ein ungepaarter t-Test sowie für nicht-parametrische Daten der Mann-Whitney-Test durchgeführt. Wurden mindestens drei Versuchsgruppen miteinander verglichen und lagen parametrische Daten vor, wurde eine einfaktorielle Varianzanalyse (One-WayANOVA) eingesetzt. Waren die Daten nicht-parametrisch, so wurde der KruskalWallis-Test verwendet. Die statistischen Berechnungen beim Morris-Water-Maze- 75 Material und Methoden Test erfolgten mittels zweifaktorieller Varianzanalyse (Two-Way-ANOVA). Das Signifikanzniveau wurde auf < 0,05 festgesetzt. Lag ein signifikantes Ergebnis vor, wurde im Falle von Berechnungen nach ANOVA als post hoc-Test für parametrische Daten der Bonferroni’s-Multiple-Comparison-Test sowie für nicht-parametrische Daten der Dunn’s-Multiple-Comparison-Test eingesetzt. Statistische Daten in einer Kontingenztafel wurden mittels Fisher’s-Exakt-Test berechnet. Für die Berechnungen von Korrelationen zwischen dem Ausmaß des Neuronenverlusts im Hippocampus und den Verhaltensabweichungen der epileptischen Tiere wurden nicht- parametrische Korrelationen nach Spearman verwendet (Studie 1). Die im Einzelnen verwendeten Tests werden bei der jeweiligen Berechnung im Ergebnisteil angegeben. 76 Ergebnisse 5. Ergebnisse 5.1 Verhaltenscharakterisierung und histologische Untersuchung von (LiCl-) Pilocarpin-behandelten NMRI-Mäusen (Studie 1) Insgesamt wurden 52 Mäuse des Stammes NMRI in der PhD-Arbeit von Frau Gröticke für den Vergleich von Pilocarpin-behandelten-Tieren sowohl mit als auch ohne LiCl-Vorbehandlung verwendet (dargestellt in Tabelle 5.1). Diese Mäuse wurden in meiner Arbeit in Studie 1 weitergehend verhaltensphysiologisch sowie histologisch charakterisiert, um etwaige Unterschiede zwischen LiCl-vorbehandelten und nicht vorbehandelten Tieren aufzuzeigen, wie auch Pilocarpin-behandelte Tiere ohne SE zu untersuchen. 5.1.1 Konsequenzen der Applikation von Pilocarpin mit oder ohne LiClVorbehandlung Wie Tabelle 5.1 darstellt, wurden in Vorversuchen verschiedene Dosierungen von Pilocarpin sowohl mit als auch ohne LiCl-Vorbehandlung getestet. Die höchste SEInduktionsrate erlangten Tiere, welche nicht mit LiCl vorbehandelt wurden und Pilocarpin in einer Dosierung von 300 mg/kg erhielten (83%). Demgegenüber entwickelten bei dergleichen Pilocarpin-Dosierung nur 40 % der LiCl-vorbehandelten Tiere einen SE. Mittels LiCl-Vorbehandlung konnte die konvulsive Dosis von Pilocarpin nicht gesenkt werden, denn bei LiCl-vorbehandelten Tieren entwickelten bei einer Pilocarpin-Dosierung von 200 mg/kg nur 1/5 Tieren einen SE, bei einer Pilocarpin-Dosierung von 150 und 200 mg/kg keines der getesteten 5 Tiere einen SE. 77 Ergebnisse Dosis (mg/kg) Vorbehandlung mit Li-Cl Anzahl Mäuse (n) Mäuse mit Einzelanfällen, aber ohne SE Mäuse mit SE Überlebende Mäuse mit SE Gesamtmortalität 250 Nein 5 3 (60%) 2 (40%) 2 (40%) 0 300 Nein 12 2 (17%) 10 (83%) 9 (75%) 1 (8%) 350 Nein 5 4 (80%) 1 (20%) 1 (20%) 4 (80%) 150 Ja 5 0 0 0 0 200 Ja 5 1 (20%) 0 0 0 250 Ja 5 0 2 (40%) 2 (40%) 0 300 Ja 10 6 (60%) 3 (30%)* 3 (30%)* 1 (10%) 350 Ja 5 2 (40%) 2 (40%) 1 (20%) 3 (60%) Tab. 5.1: Vergleich der Wirkungen von Pilocarpin alleine mit der Wirkung von LiCl-Pilocarpin in Kombination. Pilocarpin wurde als Bolus in verschiedenen Dosierungen mit oder ohne Vorbehandlung mit LiCl (15-19 Stunden vor Pilocarpinapplikation) injiziert. SE wurde bei allen Mäusen nach 90 Min. mit Diazepam (10 mg/kg) abgebrochen. * = Pilocarpin-behandelte Tiere ohne LiCl-Vorbehandlung signifikant zu Pilocarpin-behandelten Tieren mit LiCl-Vorbehandlung (Kontingenztafel und Fisher’sExakt-Test, p = 0,0274) Aus diesen Tieren wurden die vier Versuchsgruppen für die Absolvierung der Verhaltensbatterie sowie für die histologische Auswertung gebildet: Aus der Gruppe „LiCl/Pilocarpin ohne SE“ (n = 10) erhielten jeweils 5 Tiere 150 mg/kg und 5 Tiere 200 mg/kg Pilocarpin nach einer Vorbehandlung mit LiCl. Lediglich ein Tier erlangte einen Einzelanfall nach Pilocarpin-Applikation. In der Gruppe „Pilocarpin ohne SE“ (n = 5) bekamen 3 Tiere 250 mg/kg und 2 Tiere 300 mg/kg Pilocarpin. Die Tiere dieser Versuchsgruppe erreichten 1-5 einzelne Anfälle nach Pilocarpin-Injektion. Der Gruppe „LiCl/Pilocarpin mit SE“ (n = 5) wurden 2 Tiere zugeordnet, welche 250 mg/kg, sowie 3 Tiere, welche 300 mg/kg Pilocarpin erhalten haben. Die Gruppe „Pilocarpin mit SE“ (n = 11) bestand aus 2 Tieren mit einer Dosierung von 250 mg/kg und 9 Tieren mit einer Dosierung von 300 mg/kg Pilocarpin. Hinzugefügt wurde als fünfte Gruppe eine altersentsprechende Kontrollgruppe (n = 10), welche dieselbe Dosierung an Methylscopolamin und Diazepam erhalten haben, jedoch anstelle von Pilocarpin eine NaCl-Vehikelinjektion. 78 Ergebnisse 5.1.2 Detektion von spontanen Anfällen Alle Pilocarpin-behandelten Mäuse wurden genau beobachtet, um nachzuweisen, dass Tiere, welche einen SE erlangten, auch spontane wiederkehrende Anfälle, und infolgedessen eine chronische Epilepsie entwickelten. 8 von 16 Tieren mit SE mit oder ohne LiCl-Vorbehandlung zeigten mindestens einen spontanen Anfall während der sechswöchigen Absolvierung der Verhaltensbatterie. Mäuse, welche während des Handlings bei den Verhaltensversuchen keinen spontanen Anfall detektieren ließen, wurden über 3-7 aufeinanderfolgende Tage videoüberwacht, bis jedes Tier, welches unmittelbar nach Pilocarpin-Applikation einen SE erlangte, mindestens einen spontanen Anfall zeigte. Der Phänotyp der detektierten spontanen Anfälle erwies sich als vergleichbar zu den unmittelbaren Krampfanfällen nach Pilocarpinapplikation, so dass erneut die Skala nach RACINE (1972) verwendet wurde. Üblicherweise zählten die detektierten spontanen epileptischen Anfälle der Tiere zu Stadium 4 oder 5 (Kapitel 4.3). Zusammengefasst lässt sich sagen, dass alle (LiCl-) Pilocarpin behandelten Tiere mit SE mindestens einen spontanen Anfall entwickelten, so dass für diese Tiere die Entwicklung von chronischer Epilepsie bestätigt werden kann. Bei (LiCl-) Pilocarpin behandelten Tieren ohne SE konnten keine spontanen Anfälle beobachtet werden. 5.1.3 Resultate der Verhaltensbatterie In Studie 1 absolvierten die Versuchstiere lediglich eine Auswahl von fünf Verhaltensversuchen zur Überprüfung von Exploration und Lokomotion, von Angstassoziiertem Verhalten, von räumlicher Lern- und Gedächtnisleistung sowie von Depressions-assoziiertem Verhalten, da eine ausführliche Verhaltens- charakterisierung von epileptischen NMRI-Mäusen im Pilocarpin-Modell bereits in der genannten These von Frau Gröticke angefertigt wurde. Neu in meiner These ist die Verhaltenscharakterisierung sowie histologische Untersuchung von LiCl- vorbehandelten Mäusen sowie Tieren, welche Pilocarpin erhalten haben, jedoch keinen SE erreichten (Gruppen „LiCl-Pilocarpin- und Pilocarpin ohne SE“). 79 Ergebnisse 5.1.3.1 Überprüfung von Katalepsie: Bar-Test Es absolvierten lediglich die chronisch epileptischen Mäuse den Bar-Test, da nur bei ihnen aufgrund von geringerer Spontanaktivität im Vergleich zu Kontrolltieren ein mögliches kataleptisches Verhalten vermutet werden konnte. Von insgesamt 15 Tieren bestand jedoch nur ein epileptisches Tier den Bar-Test nicht, bei den übrigen 14 epileptischen Mäusen konnte keine Katalepsie nachgewiesen werden. Auffällig war, dass zwei weitere epileptische Mäuse aus dieser Versuchsgruppe in einem bzw. zwei Versuchsdurchläufen über die gesamte Versuchsdauer von 120 s ihre Lage nicht veränderten. Bar-Test Anzahl Tiere (n) 15 nicht bestanden bestanden 10 5 0 Pilo mit SE Abb. 5.1: Bar-Test zur Überprüfung von Katalepsie. Pilo mit SE: n = 15. Lediglich ein Tier bestand den Bar-Test nicht. 5.1.3.2 Überprüfung von Exploration, Lokomotion und Angst-assoziiertem Verhalten Open-Field Im Open-Field (Abb. 5.2), einem Test zur Überprüfung von Exploration, Lokomotion und Angst-assoziiertem Verhalten, ergab sich für die epileptischen Mäuse im Vergleich zur Gruppe „LiCl/Pilo ohne SE“ eine signifikant verringerte Aufenthaltsdauer im Zentrum (p < 0,0001) sowie eine erhöhte Aufenthaltsdauer im Randbereich der Arena (p = 0,0002). Auch ein Vergleich der Tiere mit zu ohne SE innerhalb der LiCl-vorbehandelten Gruppen stellte sich bezüglich Aufenthaltsdauer im Zentrum bzw. am Rand signifikant unterschiedlich dar (p < 0,05). Verglichen zur Kontrolle verbrachte die Gruppe „LiCl/Pilo mit SE“ signifikant weniger Zeitdauer im Zentrum (p < 0,05) sowie mehr Zeitdauer am Rand der Arena (p = 0,0002). Die 80 Ergebnisse Parameter Gesamtstrecke (p = 0,0150) und Laufgeschwindigkeit (p = 0,0155) waren bei der Gruppe „Pilo mit SE“ im Vergleich zur Kontrolle erhöht. B OF: Aufenthaltsdauer am Rand 300 30 Zeitdauer (s) Zeitdauer (s) A OF: Aufenthaltsdauer im Zentrum 40 20 * 10 200 100 0 K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE 0 C OF: Zurückgelegte Gesamtstrecke D OF: Laufgeschwindigkeit * Geschwindigkeit (cm/s) 5000 Strecke (cm) * 4000 3000 2000 1000 15 * 10 5 0 K on Li C tr l/P ol le ilo oh ne Pi SE lo oh ne Li C S l/P E ilo m it SE Pi lo m it S E K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE 0 20 Abb. 5.2: Darstellung der Parameter Aufenthaltsdauer im Zentrum (s) bzw. am Rand der Arena (s), der zurückgelegten Gesamtstrecke (cm) sowie der Laufgeschwindigkeit (cm/s) im Open-Field. OF = Open-Field, LiCl = Lithiumchlorid-Vorbehandlung, Pilo = Pilocarpin, Kontrolle: n = 10, LiCl/Pilo ohne SE: n = 10, Pilo ohne SE: n = 5, LiCl/Pilo mit SE: n = 5, Pilo mit SE: n = 11, A-D: 1-way ANOVA nonparametrisch (Kruskal-Wallis-Test), Posthoc: Dunn's-Multiple-Comparison-Test, * = Pilo mit SE signifikant zur Kontrolle, Signifikanzniveau: p < 0,05 Ein Blick auf die zurückgelegten Gesamtstrecken der Mäuse stellt dar, dass die Versuchsgruppen auch hier voneinander differieren. Die Kontrollen sowie die Pilocarpin-behandelten Tiere ohne SE (mit oder ohne LiCl-Vorbehandlung) explorierten die gesamte Arena (Abb. 5.3 A, B, C). Die epileptischen Tiere (Abb. 5.3 81 Ergebnisse D, E) hingegen bewegten sich insbesondere entlang der Wand, präsentierten also Thigmotaxis, welche als Maß für Angst-assoziiertes Verhalten gilt (SIMON et al. 1994). A B D E C Abb. 5.3: Aufsicht auf das Open-Field mit Markierung der zurückgelegten Wegstrecken der Mäuse. Abb. A bezeichnet ein Kontrolltier, Abb. B ein Tier aus der Gruppe „LiCl/Pilo ohne SE“ sowie Abb. C ein Tier aus der Gruppe „Pilo ohne SE“. Die Tiere aus den Gruppen „LiCl/Pilo mit SE“ (D) sowie „Pilo mit SE“ (E) zeigten Thigmotaxis. Elevated-Plus-Maze In einem weiteren Test zur Untersuchung von Angst-assoziiertem Verhalten, dem Elevated-Plus-Maze (Abb. 5.4), ließen sich keine signifikanten Unterschiede zwischen den Versuchsgruppen bei den Parametern Aufenthaltsdauer auf den offen bzw. geschlossenen Armen (s), bei der zurückgelegten Wegstrecke (cm), sowie bei dem Verhältnis des Eintritts in die offenen/geschlossenen Arme feststellen. Lediglich das Absprungverhalten (Abb. 5.4 E) von der Versuchsapparatur war bei den epileptischen Tieren im Vergleich zu den übrigen Gruppen signifikant erhöht (p = 0,0094). 82 Ergebnisse B EPM: Aufenthaltsdauer auf den geschlossenen Armen A EPM: Aufenthaltsdauer auf den offenen Armen 200 Zeitdauer (s) 150 100 50 150 100 50 0 K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE 0 D EPM: Verhältnis der Eintritte in die offenen/geschlossenen Arme 4 2000 Offene: geschlossene Arme 1500 1000 500 3 2 1 Anzahl Absprünge (n) Versuchsapparatur * Kontrolle/Pilo ohne SE Pilo mit SE 20 10 0 Absprung ohne Absprung 83 E m it S Pi lo it S SE C l/P i lo m ne oh Li ne Pi lo l/P Li C SE lle K on tr o K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE E EPM: Absprünge von der 30 E 0 0 ilo Gesamtstrecke (cm) C EPM: Zurückgelegte Gesamtstrecke oh Zeitdauer (s) 200 Ergebnisse Abb. 5.4: Darstellung der Ergebnisse im Elevated-Plus-Maze: Aufenthaltsdauer auf den offenen bzw. geschlossenen Armen (s), der zurückgelegten Gesamtstrecke (cm), des Verhältnisses der Eintritte in die offenen/geschlossenen Arme sowie der Anzahl der Absprünge von der Versuchsapparatur. EPM = Elevated-Plus-Maze, LiCl = Lithiumchlorid-Vorbehandlung, Pilo = Pilocarpin, Kontrolle: n = 10, LiCl/Pilo ohne SE: n = 10, Pilo ohne SE: n = 5, LiCl/Pilo mit SE: n = 5, Pilo mit SE: n = 11. In Abb. E wurden die Gruppen nicht nach LiCl-Vorbehandlung aufgetrennt. A-D: 1-way-ANOVA nonparametrisch (Kruskal-Wallis-Test), Posthoc: Dunn's-Multiple-Comparison-Test, E: Kontingenztafel und Fisher’s-Exakt-Test, Signifikanzniveau: p < 0,05 5.1.3.3 Überprüfung der räumlichen Lern- und Gedächtnisleistung: MorrisWater-Maze Eine Überprüfung der räumlichen Lern- und Gedächtnisleistung der Tiere erfolgte im Morris-Water-Maze. Wie Abbildung 5.5 A darstellt, ergab ein Vergleich der Latenzzeit bis zum Erreichen der Plattform eine signifikante Verbesserung der Kontrolltiere von Tag 1 zu Tag 6, 7 und 8 (Abb. 5.5 A, p = 0,0062). Die Gruppe „LiCl/Pilocarpin ohne SE“ verbesserte ihre Latenzzeit, um die Plattform aufzufinden, von Tag 1 zu Tag 9 (p = 0,0165). Abbildung 5.5 A stellt ferner dar, dass die Pilocarpin-behandelten Tiere ohne SE (mit oder ohne LiCl-Vorbehandlung) nicht von den Kontrolltieren differierten. Beide Gruppen von epileptischen Tieren zeigten über die Akquisitionsstage keine signifikante Verbesserung ihrer Lernleistung. Für die Gruppe „Pilo mit SE“ ergab sich daher am Akquisitionsstag 8 eine signifikant schlechtere Lernleistung als bei den Kontrolltiere (Abb. 5.5 B, p < 0,05). Bei der Auswertung des Probe-Trials unterschieden sich die Versuchsgruppen nicht voneinander, es gibt lediglich eine Tendenz, dass die epileptischen Tiere weniger Zeit im Quadranten der ehemaligen Plattformposition verbrachten (Abb. 5.5 C). 84 Ergebnisse A MWM: Latenzzeit bis zum Erreichen der Plattform Latenzzeit (s) 40 Kontrolle LiCl/Pilo ohne SE Pilo ohne SE * 30 20 10 # 0 1 B 2 3 4 5 6 7 8 9 MWM: Latenzzeit bis zum Erreichen der Plattform 40 Latenz (s) 30 Kontrolle LiCl/Pilo mit SE Pilo mit SE * 20 10 0 1 2 3 4 5 6 7 8 9 85 Ergebnisse C Probe T rial: Quadrant der ehemaligen Plattformposition Zeitdauer (s) 25 20 15 10 5 it SE m Pi lo Li C l/P ilo m it SE SE SE Pi lo oh ne oh ne Li C l/P ilo K on tr ol le 0 Abb. 5.5: Darstellung der Latenzzeit bis zum Auffinden der Plattform im Morris-Water-Maze der Pilocarpin-behandelten Tiere ohne SE (5.5 A) sowie der epileptischen Tiere (5.5 B), jeweils im Vergleich zu den Kontrolltieren. Abb. C stellt die Zeitdauer da, welche die Mäuse im Quadranten der ehemaligen Plattformposition verbrachten. MWM = Morris-Water-Maze; LiCl = LithiumchloridVorbehandlung, Pilo = Pilocarpin, Kontrolle: n = 10, LiCl/Pilo ohne SE: n = 10, Pilo ohne SE: n = 5, LiCl/Pilo mit SE: n = 5, Pilo mit SE: n = 11. A+B: 2-way-Repeated-Measures-ANOVA und BonferroniPosttests, Abb. A: * = signifikante Verbesserung der Lernleistung im Vergleich zu Tag 1 bei den Kontrollen sowie # = bei den LiCl/Pilo-behandelten Tieren ohne SE. Abb. B: * = Pilo mit SE signifikant zu den Kontrollen. Signifikanzniveau: p < 0,05 Die Auswertung der Schwimmstrecken veranschaulicht an repräsentativen Abbildungen an Akquisitionstag 9, wie ein Kontrolltier sowie jeweils ein Pilocarpinbehandeltes Tier mit bzw. ohne LiCl-Vorbehandlung eine Lernstrategie entwickelten und direkt zur Plattform schwammen (Abb. 5.6 A-C). Die epileptischen Tiere beider Gruppen (Abb. 5.6 D-F) dagegen entwickelten keinerlei Suchstrategie nach der verborgenen Plattform. Meist schwammen sie entweder direkt an der Wand entlang, präsentierten also Thigmotaxis (Abb. 5.6 D, E) oder bisweilen zeigten sie ein sogenanntes „Floating“-Verhalten (Abb. 5.6 F) (LANG et al. 2003). Letzteres bedeutet, dass sie in einer sehr langsamen Geschwindigkeit lediglich kleine Kreise schwammen und infolgedessen die Plattform nicht auffinden konnten. 86 Ergebnisse A B C D E F Abb. 5.6: Aufsicht auf das Morris-Water-Maze mit Darstellung von repräsentativen Schwimmstrecken der Mäuse. A bezeichnet ein Kontrolltier, B ein Tier aus der Gruppe „LiCl/Pilo ohne SE“ sowie C ein Tier aus der Gruppe „Pilo ohne SE“. Tiere dieser drei Gruppen lernten, wo sich die Plattform befand und schwammen direkt auf sie zu. Die Tiere aus den Gruppen „LiCl/Pilo mit SE“ (D) sowie „Pilo mit SE“ (E) zeigten Thigmotaxis bzw. „Floating“ (F). 5.1.3.4 Überprüfung von Depressions-assoziiertem Verhalten Bei beiden Tests, mit welchen Depressions-assoziiertes Verhalten von Nagern untersucht wird, ließen sich ähnliche Resultate feststellen: Die Zeitdauer, in welcher die Tiere eine immobile Körperhaltung präsentierten, war bei den epileptischen Tieren im Vergleich zur Kontrollgruppe und zu den beiden Pilocarpin-behandelten Gruppen ohne SE signifikant herabgesetzt. Im Tail-Suspension-Test (Abb. 5.7 A) zeigte die Gruppe „Pilo mit SE“ eine höhere Aktivität im Vergleich zu den Kontrollen sowie zu den Gruppen „LiCl/Pilo mit SE“ und „Pilo mit SE“ (p = 0,0010). Im PorsoltTest (Abb. 5.7 B) zeigten beide Gruppen von epileptischen Tieren eine signifikant verringerte Immobilitätszeit im Vergleich zu den Kontrollen. Ferner ergab sich für die Gruppe „LiCl/Pilo mit SE“ eine reduzierte Schwimmaktivität im Vergleich zu den Gruppen „LiCl/Pilo ohne SE“ sowie „Pilo ohne SE“ (p < 0,0001). 87 Ergebnisse A Tail-Suspension-Test: B Immobilitätsverhalten 150 60 40 20 * Zeitdauer (s) Zeitdauer (s) 80 100 50 0 * * K on Li C tr l/P ol le ilo oh ne SE Pi lo oh ne Li C SE l/P ilo m it SE Pi lo m it SE SE m m it it Pi lo ilo l/P lo SE SE ne SE Li C Pi ilo oh oh ne tr o lle 0 l/P K on C Li Porsolt-Test: Immobilitätsverhalten Abb. 5.7: Darstellung des Immobilitätsverhaltens im Tail-Suspension-Test (A) sowie im Porsolt-Test (B). LiCl = Lithiumchlorid-Vorbehandlung, Pilo = Pilocarpin, Kontrolle: n = 10, LiCl/Pilo ohne SE: n = 10, Pilo ohne SE: n = 5, LiCl/Pilo mit SE: n = 5, Pilo mit SE: n = 10; Besonderheit des TailSuspension-Tests für die Gruppen Kontrolle: n = 9 sowie Pilo mit SE: n = 8 (wegen wiederholten Hochkletterns aus dem Versuch ausgeschlossen); A+B: 1-way ANOVA Kruskal-Wallis-Test, Posthoc: Dunn's-Multiple-Comparison-Test, * = (LiCl-) Pilo mit SE signifikant zur Kontrolle, Signifikanzniveau: p < 0,05 5.1.4 Resultate der histologischen Auswertung Um neurodegenerative Veränderungen untersuchen zu können, wurden die Gehirne der Tiere nach der in Kapitel 4.10.1 beschriebenen Weise entnommen und die histologischen Schnitte mittels der Nisslfärbung (Kapitel 4.10.2) angefärbt. Abbildung 5.8 zeigt repräsentativ den Verlust an Neuronen im gesamten Hippocampus (Abb. 5.8 E) sowie im Hilus des Gyrus dentatus (Abb. 5.8 F) bei einem epileptischen Tier im Vergleich zu einem Kontrolltier (Abb. 5.8 A, B) wie auch einem Pilocarpinbehandelten Tier ohne SE (Abb. 5.8 C, D). 88 Ergebnisse A B C D E F Abb. 5.8: Übersicht über den Hippocampus (A, C, E) sowie einem Ausschnitt aus dem Hilus des Gyrus dentatus (B, D, F) eines Kontrolltieres (A, B), eines Tieres aus der Gruppe Pilo ohne SE (C, D) und eines epileptischen Tieres (E, F). Die Schnittebene beträgt -1,94 mm zu Bregma (PAXINOS u. FRANKLIN 2001). Die Darstellung erfolgte mittels Nissl-Färbung (Kapitel 4.10.2). Der Maßstabbalken entspricht 500 µm für die Abb. A, C und E sowie 100 µm für die Abb. B, D und F. 5.1.4.1 Histologische Auswertung in Thionin-Färbung In allen bewerteten Subregionen des Hippocampus ergaben sich signifikante Unterschiede hinsichtlich der Neurodegeneration zwischen den epileptischen Tieren und der Kontrollgruppe. Die Gehirnschnitte der Mäuse beider epileptischer Versuchsgruppen zeigten bei der Bewertung nach Scoring-System in der CA 1-Subregion (Abb. 5.9 A) eine ausgeprägte Neurodegeneration im Vergleich zu Kontrollen (p < 0,01) sowie zu beiden Pilocarpin-behandelten Gruppen ohne SE (p < 0,05). Bezüglich der Zählung von Neuronen (Abb. 5.9 B) ergaben sich bei den histologischen Schnitten der epileptischen Tiere ohne LiCl-Vorbehandlung eine signifikant verringerte Anzahl an Neuronen als bei den Kontrollen und der Gruppe „LiCl/Pilo ohne SE“ (p = 0,0035). 89 Ergebnisse In der Subregion CA 3a (Abb. 5.9 C) zeigte sich bei den Gehirnschnitten beider epileptischer Gruppen ein nach Scoring-System bewerteter signifikanter Verlust von Neuronen im Vergleich zu den Kontrolltieren, zur Gruppe „LiCl/Pilo ohne SE“ sowie teilweise im Vergleich zur Gruppe „Pilo ohne SE“ (p < 0,0001). Mittels Auszählen von Neuronen (Abb. 5.9 D) konnte eine verringerte Anzahl bei den histologischen Schnitten der Pilocarpin-behandelten Tieren mit SE zu denen ohne SE (beide Gruppen ohne LiCl-Vorbehandlung) festgestellt werden (p = 0,0033). Die Gehirnschnitte beider epileptischen Gruppen wiesen in der Subregion CA 3c (Abb. 5.9 E) einen nach Scoring-System bewerteten signifikant höheren Verlust an Neuronen als die Kontrollen auf. Die histologischen Schnitte der epileptischen Mäuse ohne LiCl-Vorbehandlung ergaben auch zu beiden Pilocarpin-behandelten Gruppen ohne SE eine signifikante Neurodegeneration (p < 0,0001). Bei den Gehirnschnitten der Gruppe „Pilo mit SE“ ließ sich ferner nach Auszählen von Neuronen (Abb. 5.9 F) eine verringerte Neuronenanzahl im Vergleich zu den Kontrollen sowie zur Gruppe „LiCl/Pilo ohne SE“ (p = 0,0008) detektieren. Auch im Hilus des Gyrus dentatus (Abb. 5.9 G) zeigte sich bei der Auswertung der Gehirnschnitte beider epileptischer Gruppen nach Bewertung mittels Scoring-System ein signifikant verringerter Score, verglichen zu den Kontrollen sowie den Pilocarpinbehandelten Gruppen ohne SE. Ähnlich stellte sich die Situation nach Auszählen von Neuronen dar (jeweils p < 0,0001). Die Bewertung der Körnerzellschicht des Gyrus dentatus ergab eine signifikante Neurodegeneration bei beiden epileptischen Versuchsgruppen im Vergleich zur Kontrolle sowie teilweise zu den Pilocarpin-behandelten Gruppen ohne SE (Abb. 5.9 I, p < 0,0001). Ferner trat bei nahezu allen epileptischen Tieren (14 von 16) eine Dispersion der Körnerzellschicht des Gyrus dentatus auf. Auszählen von Neuronen innerhalb eines definierten Fensters inmitten der Amygdala ergab eine signifikant verringerte Anzahl an Neuronen bei den histologischen Schnitten der epileptischen Tiere, verglichen zu den Kontrolltieren (Abb. 5.9 J, p = 0,0505). 90 Score 2.5 3.0 2.5 * C * K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE Score 3.0 * 2.0 1.5 1.0 0.5 Anzahl Neuronen (n) K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE 2.0 * 1.5 1.0 0.5 Anzahl Neuronen (n) A K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE Ergebnisse CA 1 (Scoring) B 0.0 CA 3a (Scoring) D 0.0 91 CA 1 (Neuronenzählung) 100 80 60 40 20 * 0 CA 3a (Neuronenzählung) 100 80 60 40 20 0 Score 2.5 G 3.0 2.5 * Hilus (Scoring) * K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE Score 3.0 * 2.0 1.5 1.0 0.5 Anzahl Neuronen (n) K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE * 2.0 1.5 1.0 0.5 Anzahl Neuronen (n) E K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE Ergebnisse CA 3c (Scoring) F 0.0 0.0 92 CA 3c (Neuronenzählung) 80 60 40 20 * 0 H 5 0 Hilus (Neuronenzählung) 25 20 15 10 * * Ergebnisse Gyrus dentatus (Scoring) J Anzahl Neuronen (n) 3.0 2.0 * 1.5 1.0 * 0.5 0.0 100 80 * 60 40 20 SE Pi lo m it SE (L iC l-) (L iC l-) K on tr ol le K Li on C tr l/P ol ilo le oh ne Pi SE lo oh Li ne C SE l/P ilo m it SE Pi lo m it SE 0 oh ne Score 2.5 Amygdala (Neuronenzählung) Pi lo I Abb. 5.9: Ergebnisse der Bewertung der CA 1-Subregion (A), der CA 3a-Subregion (C) und der CA 3c-Subregion (E) des Hippocampus sowie des Hilus (G) und der Körnerzellschicht des Gyrus dentatus (I) anhand eines Scoring-Systems. Score 0 = kein Neuronenverlust, Score 1 < 20 % Neuronenverlust, Score 2 < 50 % Neuronenverlust, Score 3 > 50 % Neuronenverlust vorhanden. Auszählen von Neuronen innerhalb von definierten Fenstern (355 x 265 µm) in der CA 1-Subregion (B), in der CA 3aSubregion (D) sowie in der CA 3c-Subregion des Hippocampus, ferner im Hilus des Gyrus dentatus (F, H) sowie in der Amygdala (J). Alle statistischen Berechnungen erfolgten mittels 1-way-ANOVA nonparametrisch (Kruskal-Wallis-Test) und Dunnet’s-Multiple-Comparison-Test als Posthoc-Test. * = (LiCl-) Pilo mit SE signifikant zur Kontrolle, Signifikanzniveau: p < 0,05 5.1.4.2 Histologische Untersuchung von repräsentativen Tieren in FJC Es wurden histologische Schnitte von repräsentativen Tieren aus allen Versuchsgruppen 5 Monate nach SE, sowie Gehirnschnitte von 17 zusätzlichen Tieren 5, 24, 48 Stunden sowie 7 Tage nach SE bzw. Pilocarpin-/Vehikelinjektion (Bolusdosierungen von 250 bzw. 300 mg/kg Pilocarpin) mit FJC, einem spezifischen Marker für degenerierende Neuronen, gefärbt. Die Ergebnisse der Bewertung nach FJC-Markierung sind vergleichbar mit denen aus der Thionin-Färbung. Bei den Gehirnschnitten der Kontrollen (Abb. 5.10 A, B) sowie der Pilocarpin-behandelten Tiere ohne SE (Abb. 5.10 G, H) sind keine angefärbten, d.h. degenerierenden Neuronen sichtbar. Bei den histologischen Schnitten der epileptischen Tiere waren bereits 5 Stunden nach SE (Abb. 5.10 C, D) vereinzelt degenerierende, nach FJC-Markierung hellgrün leuchtende Neuronen im Hilus des Gyrus dentatus sowie in der amygdalohippocampalen-Area zu beobachten. In der Schnittebene -3,16 mm zu Bregma konnten auch einzelne FJC-markierte Neuronen in den Subregionen CA 1 und 3 93 Ergebnisse detektiert werden. Ferner waren in den Gehirnschnitten einer Maus vereinzelt degenerierende Neuronen im entorhinalen Cortex zu sehen. Der Höhepunkt der Neurodegeneration lag bei 24 (Abb. 5.11 A, B) bis 48 Stunden nach SE (Abb. 5.10 E, F). Es konnten zahlreiche FJC-markierte Neuronen über den gesamten Hippocampus, über thalamische Kerngebiete sowie über den Cortex verteilt detektiert werden. 7 Tage nach SE (Abb. 5.11 C, D) fanden sich nur noch vereinzelt degenerierende, FJC-markierte Neuronen Bereichen. A B C D 94 in corticalen sowie thalamischen Ergebnisse E e F G H Abb. 5.10: Auf den Abb. A, C, E, G ist die CA 1-Subregion sowie auf den Abb. B, D, F, H der Gyrus dentatus des Hippocampus zu sehen. Ausschnitte eines Gehirnschnittes eines Kontrolltieres stellen die Abb. A und B, eines Tieres 5 Stunden nach Pilocarpin-induziertem SE die Abb. C und D, eines Tieres 48 Stunden nach Pilocarpin-induziertem SE die Abb. E und F sowie eines Pilocarpinbehandelten Tieres ohne SE die Abb. G und H dar. Der Maßstabbalken bezeichnet 50 µm für die CA 1-Subregion sowie 100 µm für den Gyrus dentatus. 5.1.4.3 Auswertung in FJC- und GFAP-Markierung Bei der Auswertung der Gehirnschnitte in FJC-Färbung bemerkten wir bei den epileptischen Tieren nicht nur die Präsenz von fluoreszierenden Neuronen (Abb. 5.11 A, B, markiert mittels eines Pfeils), sondern ab 7 Tagen nach SE auch die Anfärbung von Zellen, welche eine nicht-neuronale Morphologie aufwiesen. Es wurden einerseits langestreckte Zellen (morphologisch ähnlich radialer Glia, Abb. 5.11 C, D), sowie andererseits sternförmige Zellen mit vielen Fortsätzen (mit Astrozytenähnlicher Morphologie, Abb. 5.11 E, F) detektiert. Radiale Glia stellen unter anderem neuronale Progenitorzellen dar und können sich entweder zu Neuronen oder zu Gliazellen entwickeln (CORBIN et al. 2008). Auch SCHMUED et al. (2005) 95 Ergebnisse beschreiben, dass sich in Gehirnschnitten von Tieren nach Kainat-Behandlung in einigen Regionen mit ausgeprägter Neurodegeneration, wie beispielsweise dem Hippocampus, teilweise Zellen mit einer Morphologie von hypertrophierten Astrozyten anfärben lassen. Analog zur Beobachtung von SCHMUED et al. (2005) ließen sich auch die oben beschriebenen Zelltypen, welche wir in der vorliegenden Arbeit detektierten, weniger intensiv mit FJC anfärben als degenerierende Neuronen. Nachfolgend wurden die Gehirnschnitte mittels des Astrozytenmarkers GFAP gefärbt. Bei den histologischen Schnitten der epileptischen Tiere ließ sich eine vermehrte Anzahl von GFAP-markierten Astrozyten darstellen. Auch Zellen mit der oben beschriebenen nicht-neuronalen Morphologie ließen sich mittels GFAP markieren (Abb. 5.11 G, H), infolgedessen konnte als Schlussfolgerung zugelassen werden, dass es sich um radiale Glia sowie hypertrophierte Astrozyten handelt. Beide Zelltypen wurden in einer Studie von BORGES et al. (2006) mit GFAPFärbung nach einem Pilocarpin-induziertem SE beschrieben. In dieser PhD-Arbeit traten radiale Glia und hypertrophierte Astrozyten insbesondere im späteren Verlauf der Epileptogenese, also 7 Tage (Abb. 5.11 C, D) sowie 5 Monate nach SE (Abb. 5.11 E, F), auf. Zum Zeitpunkt von 7 Tagen nach SE traten hypertrophierte Astrozyten insbesondere im Hilus des Gyrus dentatus, dem Stratum radiatum sowie im Molecular layer des Hippocampus auf. In der Schnittebene -3,16 mm zu Bregma traten hypertrophierte Astrozyten auch vereinzelt im dorsalen Cortex sowie im Subiculum des Hippocampus auf. 5 Monate nach SE wiesen vor allem der Hilus des Gyrus dentatus sowie zum Teil auch thalamische Kerngebiete hypertrophierte Astrozyten auf. 96 Ergebnisse A B C D E F 97 Ergebnisse G H Abb. 5.11: Darstellung des Gyrus dentatus nach FJC- (Abb. A-F) bzw. GFAP-Markierung (Abb. G, H) zu verschiedenen Zeitpunkten nach Pilocarpin-induziertem SE in zwei verschiedenen Vergrößerungsstadien. 24 Stunden nach SE (A, B) zeigen FCJ-angefärbte Zellen die typische Form von Neuronen (gezeigt durch einen Pfeil in Abb. B). 7 Tage nach SE (C, D) werden nur noch wenige Neuronen durch FJC angefärbt. Zusätzlich färbten sich Zellen mit radial verlaufenden Fortsätzen (bezeichnet durch den Pfeil in Abbildung D) sowie langgezogene Zellen an. Der zuletzt genannte Zelltyp dominierte 5 Monate nach SE (E, F; Pfeil in Abbildung F). In den Abb. G (5 Monate nach SE) und H (7 Tage nach SE) ist zu sehen, dass sich einige der beiden zuletzt beschriebenen Zelltypen, welche sich 7 Tage und 5 Monate nach SE durch FJC anfärben lassen, mittels des Gliazellmarkers GFAP anfärben lassen. Der Maßstabbalken repräsentiert 50 µm für die Abbildungen A, E, C und G sowie 20 µm für die Abbildungen B, D, F und H. 5.1.5 Korrelationen zwischen Neurodegeneration und Verhaltensauffälligkeiten Bei den Korrelationsberechnungen zwischen einzelnen bewerteten Parametern der histologischen Ergebnisse zu ausgewählten Untersuchungsparametern der Verhaltensänderungen der epileptischen Tiere (Kapitel 4.11), ergab sich lediglich eine signifikante Korrelation zwischen der Neurodegeneration in der CA 3cSubregion zur Aufenthaltsdauer im Zentrum des Open-Fields (Tab. 5.2, p = 0,0206). 98 LiCl/Pilo mit SE Histologische Auswertung Ergebnisse von Untersuchungsparametern der Verhaltensbatterie CA 1 CA 3c* Hilus OF - Zentrum EPM – Offene Arme MWM Tag 8 zu Tag 1 Tail-Suspension Porsolt-Test 0,00 0,00 80,61 81,82 98,01 0,85 91,59 100 85,38 100,00 92,73 0 68,13 0,59 76,45 100 59,94 66,85 84,25 85,45 0 0,58 59,62 98,08 47,57 49,92 76,96 83,03 0 1,00 61,31 98,08 43,06 100,00 87,88 40,61 0 0,76 86,54 100 75,47 100,00 93,94 79,39 0 0,33 83,18 89,44 72,55 89,42 79,40 70,91 43,66 0,83 100 95,95 100,00 86,67 56,36 0 0,66 100 92,34 90,83 93,94 72,12 0 0,25 91,59 0,00 6,88 75,76 66,06 26,59 0,63 66,35 66,41 77,28 100,00 91,52 0 68,13 0,82 94,95 89,44 12,23 77,43 80,61 45,45 39,72 0,81 93,27 100 19,21 31,57 74,55 81,82 97,69 1,00 100,00 46,26 68,04 99,29 98,79 79,39 85,7 1,00 78,13 91,36 56,79 81,66 95,15 23,64 24,61 0,39 88,22 100 98,65 93,65 92,73 23,64 0 1,00 65,45 Ergebnisse 99 Tab. 5.2: Übersicht über die Daten zur Korrelationsberechnung zwischen Neuronenverlust (%) zu Verlust der Zeitdauer in den untersuchten Parametern der Verhaltenstests (%) (mit Ausnahme des MWM: Quotient der Latenzzeit (s) von Tag 8 zu Tag 1 der Akquisition) bei den epileptischen Mäusen im Vergleich zu den Kontrollen. Jede Zeile entspricht den Ergebnissen einer Maus. Im Tail-Suspension-Test wurden 3 Mäuse aufgrund von wiederholten Kletterns auf die Versuchsapparatur sowie im Porsolt-Test 1 Tier wegen wiederholter Krampfanfälle aus der Auswertung der Tests herausgenommen. OF = Open-Field, EPM = Elevated-Plus-Maze, MWM = Morris-Water-Maze. Statistik: Non-parametrische Korrelation nach Spearman. Signifikanzniveau: p < 0,05. * = Korrelation zwischen CA 3c und OF – Zentrum signifikant. Pilo mit SE Ergebnisse 5.2 Etablierung des Pilocarpin-Modells sowie Unterschiede in der Sensitivität bei Substämmen und Sublinien von B6 Mäusen (Studie 2) 5.2.1.1 Etablierung des Pilocarpin-Modells für die B6-Maus Wie in Kapitel 2.5.1 erläutert, ist die Etablierung des Pilocarpin-Modells bei der B6Maus aufgrund einer häufig geringen SE-Induktions- sowie hohen Mortalitätsrate keineswegs trivial. Wir testeten drei verschiedene Substämme (B6JOlaHsd und B6NHsd von Harlan-Winkelmann sowie B6NCrl von Charles River) hinsichtlich ihrer Sensitivität auf Pilocarpin (Tabelle 5.3), um einen B6-Substamm mit möglichst hoher SE-Induktionsrate und niedriger Mortalitätsrate zu detektieren. Ferner variierten wir das Applikationsregime (Bolus oder fraktionierte Applikation) sowie die Dosis von Pilocarpin. Verstarben Tiere während des Pilocarpin-Versuchs, so erlangten diese üblicherweise nach Pilocarpin-Applikation solch heftige Einzelkrämpfe, dass sie in diesen vermutlich aufgrund von Atemversagen verstarben, bevor sie einen SE erreichen konnten. Tabelle 5.3 verdeutlicht, dass die beiden Substämme von Harlan-Winkelmann eine nur geringe SE-Induktions- und eine hohe Mortalitätsrate aufwiesen. Der Substamm von Charles River (B6NCrl) jedoch erreichte bei den Bolusdosierungen (300 m/kg, p = 0,0037) sowie bei fraktionierter Applikation (100 mg/kg, p = 0,0002) eine signifikant höhere SE-Induktionsrate verglichen mit dem Substamm B6JOlaHsd. B6NCrl zeigten ferner eine signifikant höhere SE-Induktionsrate sowie geringere Mortalitätsrate im Applikationsprotokoll 100 mg/kg fraktioniert verglichen mit dem Substamm B6NHsd (p = 0,0003). Diese Ergebnisse zeigen, dass das Pilocarpin-Modell sowohl mittels Bolusdosierung (300 mg/kg), als auch mittels fraktionierter Applikation ähnlich zu NMRI-Mäusen beim Substamm B6NCrl eine hohe SE-Induktionsrate hervorbringt. Da ein fraktioniertes Applikationsregime eine individuellere Dosierung pro Maus ermöglicht, setzten wir diese Applikationsform beim Substamm B6NCrl für den Hauptversuch ein. Wie Tabelle 5.3 darstellt, entwickelten überraschenderweise nur 7 von 23 Tieren (30%) einen SE, die Gesamtmortalität hingegen erreichte einen Wert von 74%. Diese Ergebnisse waren signifikant schlechter (p = 0,0024) als in den Vorversuchen, welche mit demselben Substamm (B6NCrl) desselben Züchters Charles River absolviert wurden. Den hauptsächlichen Unterschied stellte dar, dass 100 Ergebnisse die B6NCrl des Hauptversuchs mit der geringeren SE-Induktionsrate aus Barriere 9, sowie die Tiere aus den Vorversuchen mit der höheren SE-Induktionsrate aus Barriere 8 des Züchters Charles River stammten. Substamm B6 Applikations -regime (i.p.) Dosis (mg/kg) Anzahl Mäuse (n) Mäuse mit SE Überlebende Mäuse mit SE Gesamtmortalität B6JOlaHsd Bolus 300 10 0 - 1 (10%) B6JOlaHsd Bolus 325 5 0 - 0 B6JOlaHsd Bolus 350 10 0 0 4 (40%) B6JOlaHsd Bolus 400 5 2 (40%) 1 (20%) 4 (80%) B6JOlaHsd Fraktioniert (50 mg/kg) Fraktioniert (100 mg/kg) 400-550 5 0 - 5 (100%) 300-1000 19 3 (16%) 0 16 (84%) B6NHsd Bolus 300 5 1 (20%) 1 (20%) 1 (20%) B6NHsd Bolus 325 5 1 (20%) 1 (20%) 0 B6JOlaHsd B6NHsd Bolus 350 6 2 (33%) 2 (33%) 3 (50%) B6NHsd Fraktioniert (50 mg/kg) Fraktioniert (100 mg/kg) 500-550 5 0 - 1 (20%) 300-1000 11 1 (9%) 0 10 (91%) Bolus 300 5 4 (80%)* 4 (80%)* 0 Bolus 325 10 7 (70%)* 6 (60%)* 3 (30%) Fraktioniert (50 mg/kg) Fraktioniert (100 mg/kg) Fraktioniert 100 mg/kg 300-550 5 3 (60%) 2 (40%) 1* (20%) 300-1000 10 8 (80%)*,+ 1 (10%)*,+ 300-1400 23 9 (90%)*,+ 7 (30%) 6 (26%) 17 (74%) B6NHsd B6NCrl Barriere 8 B6NCrl Barriere 8 B6NCrl Barriere 8 B6NCrl Barriere 8 B6NCrl Barriere 9 Tab. 5.3: Übersicht über die Wirkungen von Pilocarpin bei verschiedenen Substämmen von B6Mäusen. SE wurde nach 90 Min. mit Diazepam abgebrochen (außer bei 5 Mäusen, die vor Ende der 90 Min. verstarben). * = B6NCrl signifikant zu B6JOlaHsd, + = B6NCrl signifikant zu B6NHsd, Signifikanzniveau: p < 0,05 101 Ergebnisse 5.2.1.2 EEG-Aufzeichnungen während Pilocarpin-Applikation Es wurde für vier Tiere des Stammes B6JOlaHsd sowie für vier Tiere des Stammes B6NCrl während einer fraktionierten Injektion von Pilocarpin jeweils ein EEG abgeleitet. Abbildung 5.12 stellt repräsentative Ausschnitte der EEG-Aufzeichnungen für den Stamm B6NCrl dar. In Abbildung 5.12 A ist die Basislinie eines naiven Tieres vor der ersten Pilocarpin-Applikation zu sehen. Abbildungen 5.12 B und C zeigen einen Einzelkrampf nach der 3. Pilocarpin-Injektion, zu Beginn (B) sowie im weiteren Verlauf des Anfallsgeschehens (C). Abbildung 5.12 D stellt kontinuierliche paroxysmale EEG-Veränderungen während eines SE dar. Die EEG-Veränderungen korrelierten mit den Verhaltensbeobachtungen, d.h. Krampfanfälle waren mit paroxysmalen EEG-Veränderungen assoziiert. C h a rt W A 2 3 .0 5 . 2 0 0 8 in d o w 9 : 0 0 :5 4 ,5 9 1 0,5 mV 5 0 EPM_EEG 2 (mV) 1s 0 -5 0 9 : 0 0 :5 5 9 :0 0 : 5 6 9 :0 0 : 5 7 C h a rt W 2 3 .0 5 . 2 0 0 8 B 9 : 0 0 :5 8 9 :0 0 : 5 9 in d o w 9 : 4 6 :2 7 ,6 4 1 0,5 mV 5 0 EPM_EEG 1 (mV) 1s 0 -5 0 9 :4 6 : 2 8 9 : 4 6 :2 9 9 :4 6 : 3 0 102 9 : 4 6 :3 1 9 : 4 6 :3 2 9 :4 6 Ergebnisse C h a rt W C 2 3 .0 5 . 2 0 0 8 in d o w 9 : 4 8 :0 1 ,6 4 1 0,5 mV 5 0 EPM_EEG 1 (mV) 1s 0 -5 0 9 :4 8 : 0 2 9 : 4 8 :0 3 9 : 4 8 :0 4 C h a r t W D 2 3 .0 5 . 2 0 0 8 9 : 4 8 :0 5 9 :4 8 : 0 6 in d o w 1 0 : 3 8 :2 3 ,7 8 1 0,5 mV 5 0 EPM_EEG 1 (mV) 1s 0 - 5 0 - 1 0 0 1 0 : 3 8 :2 4 1 0 : 3 8 :2 5 1 0 : 3 8 :2 6 1 0 : 3 8 :2 7 1 0 : 3 8 :2 8 1 0 : 3 8 :2 9 Abb. 5.12: EEG-Aufzeichnungen einer Basislinie vor Pilocarpin-Applikation (A), zu Beginn (B) sowie im weiteren Verlauf (C) eines Einzelkrampfes nach Pilocarpin und kontinuierliche EEGVeränderungen eines SE (D) beim Mausstamm B6NCrl 5.2.2 Untersuchung von Tieren der Barrieren 8 und 9 5.2.2.1 Reproduzierung der Sensitivitätsunterschiede im Pilocarpin-Modell Um zu eruieren, ob die Sensitivitätsunterschiede hinsichtlich Pilocarpin bei dem Mausstamm B6NCrl zwischen Barriere 8 und 9 reproduzierbar sind, testeten wir jeweils 17 Tiere aus beiden Barrieren hinsichtlich ihrer Pilocarpinsensitivität (Abb. 5.13). Ein Vergleich der SE-Induktionsrate zeigte einen signifikanten Unterschied (p = 0,0366) zwischen den Barrieren 8 und 9. Bei allen Tieren aus Vorversuch, Hauptversuch und Reproduzierungsversuch zusammengenommen, ergaben sich signifikante Unterschiede hinsichtlich der SE-Induktions- (p = 0,0001) und der Mortalitätsrate (p = 0,0002). 103 Ergebnisse A SE-Induktionsrate 15 Anzahl Tiere (n) 10 5 #8 5 0 be rl e be nd Ve rs to rb en nd rs to rb en be Ü C SE-Induktionsrate Ü rl e be SE SE O hn e O hn e SE SE 0 D Gesamtmortalität * * 30 Anzahl Tiere (n) 30 20 10 20 10 be r Ü Ü SE e SE O hn SE e SE hn O be rle be nd Ve rs to rb en 0 0 le be nd Ve rs to rb en Anzahl Tiere (n) #9 10 Ve Anzahl Tiere (n) B Gesamtmortalität * 15 Abb. 5.13: Vergleich der SE-Induktions- (A, C) sowie Mortalitätsrate (B, D) in den Barrieren 8 (schwarze Balken) und 9 (schraffierte Balken) beim Substamm B6NCrl. Abb. A und B: Reproduzierungsversuch der Sensitivitätsunterschiede (jeweils n = 17). Abb. C und D: alle Tiere aus Vorversuchen, Hauptversuch sowie des Reproduzierungsversuchs zusammengenommen (# 8 = Barriere 8: n = 27, # 9 = Barriere 9: n = 40). A-D: Kontingenztafel und Fisher's-Exakt-Test; Signifikanzniveau: p < 0,05 Um herauszufinden, ob sich die Barrieren 8 und 9 des Substammes B6NCrl auch in einzelnen Untersuchungsparametern unterscheiden, wurden die Pilocarpin-Dosis und die Latenzzeit bis zum Auftreten des 1. Krampfes sowie bis zum Erreichen eines SE aufgeschlüsselt (Abb. 5.14). Es ergaben sich signifikante Unterschiede bei der Pilocarpindosis zwischen den beiden Barrieren sowohl bis zum Auftreten des 1. Krampfes (Abb. 5.14 A, p = 0,0180), als auch bis zum Erlangen eines SE (Abb. 5.14 C, p = 0,0425). Hinsichtlich der Latenzzeit (Abb. 5.14 B und D) konnten keine signifikanten Unterschiede detektiert werden. 104 Ergebnisse A Dosis an Pilocarpin bis zum Auftreten des 1. Krampfes B Latenzzeit bis zum Auftreten des 1. Krampfes 400 100 Latenz (Min.) Dosis (mg) 600 * 200 0 #8 20 #8 #9 Latenzzeit bis zum Erreichen eines SE 150 Latenz (Min.) Dosis (mg) 40 D 800 600 * 200 0 60 0 #9 C Dosis an Pilocarpin bis zum Erreichen eines SE 400 80 #8 100 50 0 #9 #8 #9 Abb. 5.14: Darstellung der Dosis von Pilocarpin bis zum Auftreten des 1. Krampfes (A) bzw. SE (C) sowie der Latenzzeit bis zum Auftreten des 1. Krampfes (B) bzw. SE (D). # 8 = Barriere 8, # 9 = Barriere 9 des Substammes B6NCrl, A+B: # 8: n = 26, # 9: n = 40; C+D: # 8: n = 22; # 9: n = 13; A-D: t-Test und Mann-Whitney-Test, Signifikanzniveau: p < 0,05 Bis zur 4. Pilocarpin-Injektion ergab sich ein signifikanter Unterschied zwischen den Barrieren 8 und 9 bezüglich des Auftretens eines SE (Abb. 5.19 C, p < 0.0001). Bis zur 5. Injektion waren die folgenden dargestellten Parameter signifikant unterschiedlich: Auftreten des 1. Krampfes (Abb. 5.15 B, p = 0,0329), Erlangung eines SE (Abb. 5.15 D, p < 0.0001) sowie die Gesamtmortalität (Abb. 5.15 F, p = 0,0176). 105 Ergebnisse Mortalität bis zur 4. Pilo-Injektion SE SE hn e O O hn e hn e Mortalität bis zur 5. Pilo-Injektion F 40 35 30 25 20 15 10 5 0 Ve rs to rb Ü en be rle be nd Ve rs to rb Ü en be rle be nd Anzahl Tiere (n) 40 35 30 25 20 15 10 5 0 106 * Ve rs to rb Ü en be rle be nd SE SE SE Anzahl Tiere (n) * O SE O hn e SE Anzahl Tiere (n) * 40 35 30 25 20 15 10 5 0 E Anzahl Tiere (n) 1. K ra m hn pf e K ra m pf 1. K ra O m hn pf e K ra m pf bis zur 5. Pilo-Injektion bis zur 4. Pilo-Injektion Ve rs to rb Ü en be rle be nd * D Erreichen eines SE C Erreichen eines SE 40 35 30 25 20 15 10 5 0 40 35 30 25 20 15 10 5 0 O Anzahl Tiere (n) Barriere 9 SE Barriere 8 B Auftreten des 1. Krampfes bis zur 5. Pilo-Injektion 1. K ra O m hn pf e K ra m pf 40 35 30 25 20 15 10 5 0 1. K ra O m hn pf e K ra m pf Anzahl Tiere (n) A Auftreten des 1. Krampfes bis zur 4. Pilo-Injektion Ergebnisse Abb. 5.15: Darstellung des Vorhandensein des 1. Krampfes (A, B) bzw. eines SE (C, D) und der Mortalität (E, F) bis zur 4. (A, C, E) bzw. 5. Injektion (B, D, F). Pilo = Pilocarpin, # 8 = Barriere 8, # 9 = Barriere 9 des Substammes B6NCrl, # 8: n = 27, # 9: n = 40, Kontingenztafel und Fisher's-Exakt-Test, Signifikanzniveau: p < 0,05 5.2.2.2 Absolvierung des Open-Field von Tieren der Barrieren 8 und 9 Um zu untersuchen, ob die detektierten Unterschiede zwischen Barriere 8 und 9 des Substammes B6NCrl lediglich die Sensitivität hinsichtlich Pilocarpin betreffen, oder sich zudem naive Tiere beider Barrieren in Verhaltensparametern unterscheiden, wurden unbehandelte Tiere im Open-Field-Test überprüft. Hier ließen sich jedoch keine signifikanten Unterschiede darstellen (Abb. 5.16 A-D). B OF: Aufenthaltsdauer im Zentrum 500 125 400 100 Zeitdauer (s) Zeitdauer (s) A OF: Aufenthaltsdauer am Rand 300 200 100 0 50 25 0 #8 #9 #8 C OF: Zurückgelegte Gesamtstrecke Geschwindigkeit (cm/s) 4000 3000 2000 1000 0 #8 #9 D OF: Bewegungsgeschwindigkeit 5000 Wegstrecke (cm) 75 #9 10 8 6 4 2 0 #8 #9 Abb. 5.16: OF = Open-Field; # 8 = Barriere 8, # 9 = Barriere 9 des Substammes B6NCrl, # 8: n = 5, # 9: n = 8, A+B: Mann-Whitney-Test, C+D: Ungepaarter t-Test. Signifikanzniveau: p < 0,05 5.2.2.3 Untersuchung von Tieren aus Barriere 8 und 9 im MEST (Kapitel 4.5) Die naiven Tiere aus beiden Barrieren, welche lediglich das Open-Field absolvierten (Kapitel 5.2.2.2), wurden hinsichtlich ihrer maximalen elektrischen Krampfschwelle (MEST-Test) getestet. Wie Abbildung 5.17 darstellt, zeigte sich hinsichtlich der CC50 107 Ergebnisse kein signifikanter Unterschied bei den naiven Tieren (A), jedoch bei solchen, welche mit Pilocarpin vorbehandelt waren (B, p = 0,0110). A B MEST-Test (naive Tiere) 1.5 CC 50 (log) CC 50 (log) 1.5 MEST-Test (Pilo-vorbehandelte Tiere) 1.0 0.5 * 1.0 * 0.5 0.0 0.0 #8 #8 #9 #9 Abb. 5.17: Untersuchung der maximalen elektrischen Krampfschwelle bei Tieren der Barrieren 8 und 9. MEST = Maximal-Elektroshock-Seizure-Threshold (maximale elektrische Krampfschwelle). Pilo = Pilocarpin. # 8 = Barriere 8 und # 9 = Barriere 9, jeweils n = 8. Statistische Berechnungen: Ungepaarter t-Test. * = Barriere 8 signifikant unterschiedlich zu Barriere 9. Signifikanzniveau: p < 0,05 5.2.3 Untersuchung weiterer B6-Barrieren im Pilocarpin-Modell Im nächsten Schritt wurde die Pilocarpin-Sensitivität von drei weiteren B6-Barrieren des Züchters Charles River (Barriere 4, 7, 11) überprüft, sowie aus Barriere 9 männliche und weibliche Tiere miteinander verglichen (Abb. 5.18). Es zeigte sich, dass sich die Barrieren 4, 7 und 11 nicht signifikant von Barriere 9 unterschieden. Die männlichen Tiere aus Barriere 9 zeigten eine signifikant geringere SE-Induktionsrate (p = 0,0384) im Vergleich zu den weiblichen Tieren aus Barriere 9. Die Mortalitätsrate hingegen erwies sich zwischen den Tieren beider Geschlechter aus Barriere 9 als nicht signifikant unterschiedlich. 108 Ergebnisse Testen weiterer Barrieren im Pilocarpin-Modell Anzahl Tiere (n) 20 #4 #7 #9w #9m # 11 15 * 10 5 0 SE Mortalität Abb. 5.18: Überprüfung von verschiedenen Barrieren des Züchters Charles River hinsichtlich ihrer Sensitivität auf Pilocarpin. # = Barriere, w = weiblich, m = männlich, # 4, 7 und 11 nur weibliche Tiere; Anzahl jeweils n = 20; Kontingenztafel und Fisher’s-Exakt-Test, Signifikanzniveau: p < 0,05. 5.2.4 Überprüfung der F1-Generation im Pilocarpin-Modell Um aufzuzeigen, ob eine vererbbare Mutation oder unterschiedliche Umweltbedingungen zwischen den Barrieren 8 und 9 zu den detektierten Differenzen hinsichtlich der Pilocarpin-Sensitivität führte, züchteten wir aus Barriere 8-Weibchen und Barriere 9-Männchen eine Hybrid-F1-Generation (Zuchtschema in Kapitel 4.1). Diese F1-Generation wurde hinsichtlich ihrer Pilocarpin-Sensitivität getestet. Es ließ sich kein signifikanter Unterschied zwischen den F1-Weibchen und der weiblichen Barriere 9-Parentalgeneration darstellen (Abb. 5.19 A), jedoch konnte eine signifikant schlechtere SE-Induktionsrate zu allen getesteten Tieren aus Barriere 8 festgestellt werden (Abb. 5.19 B, p = 0,0227). Bei F1-Männchen hingegen ergab sich eine signifikant bessere SE-Induktionsrate als Parentalgeneration (Abb. 5.19 C, p = 0,0083). 109 bei der männlichen Barriere 9- Ergebnisse A 100 80 Prozent (%) Prozent (%) 100 60 40 B 80 * 60 40 20 20 0 0 Barriere 9 w Barriere 8 w Hybrid F1 w Prozent (%) 100 Hybrid F1 w C 80 * 60 40 20 0 Barriere 9 m Hybrid F1 m Abb. 5.19: SE-Induktionsrate der Tiere aus der Parentalgeneration (Barriere 8 w, Barriere 9 m) sowie der F1-Generation (weiblich und männlich) aus der Hybridzucht der Barriere 8 w x Barriere 9 m; w = weiblich, m = männlich, F1 w: n = 28, F1 m: n = 32, Kontingenztafel und Fisher’s-Exakt-Test, Signifikanzniveau: p < 0,05 5.2.5 Detektion von spontanen Anfällen bei der F1-Generation Es wurden 14 weibliche Pilocarpin-behandelte Tiere mit SE in der F1-Generation generiert. Um zu überprüfen, ob diese auch eine chronische Epilepsie entwickeln, wurden 12 dieser Tiere über 6-9 Tage 24 Stunden täglich videoüberwacht. 7 dieser Tiere zeigten mindestens einen spontanen Anfall. Bei 3 Tieren traten Anfallscluster mit einer maximalen Anzahl von 9-14 Krampfanfällen pro Tag auf. Von 13 männlichen Pilocarpin-behandelten Mäusen in der F1-Generation mit SE entwickelten 6 Tiere nach 1-9 Tagen Videoüberwachung mindestens einen spontanen Anfall. Für 4 Tiere ergaben sich Anfallscluster mit bis zu 11 epileptischen Anfällen pro Tag. Insgesamt betrachtet traten bei der gezüchteten F1-Generation analog zu den charakterisierten NMRI- (Studie 1) sowie zu den kommerziell erworbenen B6- 110 Ergebnisse Mäusen (Studie 3) sowohl bei weiblichen, als auch bei männlichen Tieren spontane wiederkehrende Anfälle auf. 5.2.6 Erneute Untersuchung von Tieren aus Barriere 9 sowie Testen von B6J im Pilocarpin-Modell Es wurde ein weiterer Substamm, B6J aus dem Jackson Laboratory, USA (zur Verfügung gestellt von Charles River, Sulzfeld), hinsichtlich seiner Sensitivität auf Pilocarpin getestet. Um mit Tieren vergleichen zu können, welche in demselben Jahr wie die gezüchteten Tiere geboren wurden, erfolgte erneut eine Überprüfung von männlichen sowie weiblichen Mäusen aus Barriere 9 des Substammes B6NCrl hinsichtlich ihrer Pilocarpinsensitivität. Wir konnten bei den Tieren der Barriere 9 die prozentuale SE-Induktionsrate exakt reproduzieren (vgl. Abb. 5.18), d.h. die weiblichen Tiere entwickelten wieder zu 45 % sowie die männlichen Tiere wieder zu 15 % einen SE (Abb. 5.20 A). Bezüglich der Gesamtmortalität konnten keine signifikanten Unterschiede detektiert werden (Abb. 5.20 B). Die weiblichen Tiere der Barriere 9 zeigen ferner eine signifikant höhere SE-Induktionsrate als der Substamm B6J (p = 0,0057). Beim Substamm B6J entwickelten zwar 2 von 20 Mäusen einen SE, dieser jedoch endete nach etwa 45 bzw. 70 Min. spontan. SE-Induktionsrate A 40 * B Prozent % Mortalität Anzahl Tiere (n) 50 30 20 10 0 Gesamtmortalität 100 80 60 40 20 0 #9w #9m B6J #9w #9m B6J Abb. 5.20: Darstellung der SE-Induktions- sowie Mortalitätsrate; # 9 = Barriere 9 des Substammes B6NCrl, w = weibliche, m = männliche Tiere; B6J = Substamm aus den Jackson Laboratories, Kontingenztafel und Fisher’s-Exakt-Test, * = # 9 w signifikant zu Kontrolle, Signifikanzniveau: p < 0,05 111 Ergebnisse 5.2.7 Generierung der F2-Generation Da eine spontane Mutation in Barriere 8 Ursache für die detektierten Verhaltensänderungen sein könnte (Diskussion, Kapitel 6.7), wurde eine F2Generation zwischen den Parentalweibchen aus Barriere 8 mit den Männchen aus der F1-Generation erzeugt (Zuchtschema in Kapitel 4.1). Es entstand lediglich ein Wurf mit überlebenden Tieren, da die Tiere aus Barriere 8 zum Zeitpunkt der Zucht bereits über 1 Jahr alt waren und die Muttertiere mehrfach verwarfen. Weitere Zuchtweibchen aus Barriere 8 konnten nicht erworben werden, da der Züchter Charles River diese Barriere geschlossen hatte. Aufgrund der infolgedessen geringen Anzahl an Tieren der F2-Generation, wurden diese vier Tiere (zwei Weibchen und zwei Männchen) lediglich zum Weiterzüchten verwendet und nicht hinsichtlich ihrer Pilocarpin-Sensitivität untersucht. 5.2.8 Überprüfung der F3-Generation im Pilocarpin-Modell Aus den zwei Zuchtpaaren der F2-Generation generierten wir eine F3-Generation, welche wir hinsichtlich ihrer Pilocarpin-Sensitivität testeten. Bei den weiblichen Tieren der F3-Generation entwickelten 13 von 18 untersuchten Tieren einen SE (72%). Die SE-Induktionsrate unterschied sich wie auch schon bei der F1-Generation nicht signifikant von der weiblichen Parentalgeneration aus Barriere 9 (Abb. 5.21 A). Jedoch differierte die weibliche F3-Generation im Gegensatz zur F1-Generation nun nicht mehr signifikant zur Pilocarpin-sensitiven Parentalgeneration aus Barriere 8 (Abb. 5.21 B). Bei den männlichen Tieren der F3-Generation erreichten 12 von 14 Tieren einen SE. Infolgedessen lag die SE-Induktionsrate bei 86%. Dies ist signifikant höher als bei der männlichen Parentalgeneration aus Barriere 9 (Abb. 5.21 C, p < 0,0001). Sowohl die weiblichen, als auch die männlichen Mäuse der F3-Generation, welche keinen SE erlangten, verstarben während des Pilocarpin-Versuchs. 112 Ergebnisse B Anzahl T iere mit SE (n) Anzahl T iere mit SE (n) A 15 #9w F3 w 10 5 0 SE 25 #8w F3 w 20 15 10 5 0 Ohne SE SE Ohne SE Anzahl Tiere mit SE (n) C * 20 #9m F3 m 15 10 5 0 SE Ohne SE Abb. 5.21: Vergleich der SE-Induktionsrate von der F3-Generation mit der Parentalgeneration; # 8 = Barriere 8 w: n = 27 , # 9 = Barriere 9 m: n = 20, F3 w: n = 18, F3 m: n = 14, Kontingenztafel und Fisher’s-Exakt-Test, Signifikanzniveau: p < 0,05 113 Ergebnisse 5.3 Verhaltenscharakterisierung und histologische Untersuchung von Pilocarpin-behandelten B6-Mäusen (Studie 3) Aus den Vorversuchen wurden 14 Mäuse, welche mittels des fraktionierten Applikationsregimes von 100 mg/kg Pilocarpin einen SE erlangten, als Gruppe „Pilo mit SE“ definiert. 5 Pilocarpin behandelte Tiere ohne SE (jeweils ein Tier aus den Bolus-Applikationsregimes 300 mg/kg und 325 mg/kg, zwei Tiere aus dem fraktionierten Applikationsregime mit 50 mg/kg sowie ein Tier mit 100 mg/kg) bildeten die Gruppe „Pilo ohne SE“. Hinzugefügt wurden 12 altersentsprechende Tiere, welche Methylscopolamin, fünf NaCl-Injektionen anstelle von Pilocarpin, sowie Diazepam erhielten, als Kontrollgruppe. 5.3.1 Detektion von spontanen Anfällen Alle Pilocarpin-behandelten Mäuse sowohl mit als auch ohne SE wurden vor Beginn der Verhaltensbatterie (7-10 Wochen nach SE) über 48 Stunden durchgehend videoüberwacht. 6 von 14 Tieren aus der Gruppe „Pilo mit SE“ zeigten hier bereits mindestens einen spontanen Anfall. Ferner notierten wir alle Anfälle, welche während des Handlings bei der Absolvierung der Verhaltensbatterie beobachtet wurden. Mäuse aus der Gruppe „Pilo mit SE“, welche nach dieser Prozedur noch keinen spontanen Anfall zeigten, wurden nach Absolvierung der Verhaltensbatterie erneut Video- sowie zwei Tiere zusätzlich EEG-überwacht. Einen spontanen Anfall im EEG stellt Abbildung 5.22 dar. Chart W indow 100 14.04.2008 22:02:2 8,915 0,5 mV 50 1s 0 -50 Abb. 5.22: Spontaner Anfall im EEG. 114 Ergebnisse Nach dieser Methode konnte bei allen 14 Tieren aus der Gruppe „Pilo mit SE“ mindestens ein spontaner Anfall detektiert und infolgedessen die Entwicklung von chronischer Epilepsie nachgewiesen werden. Bei den Pilocarpin-behandelten Tieren ohne SE konnten keine spontanen Anfälle beobachtet werden. 5.3.2 Resultate der Verhaltensbatterie 5.3.2.1 Eingangscharakterisierung: Irwin-Test Um einen ersten Eindruck von Verhalten, Haltung und Gesundheitszustand der Tiere zu gewinnen, wurde der IRWIN-Test (1968) zu Beginn der Verhaltensbatterie (9-12 Wochen nach SE) durchgeführt. Folgende bewertete Parameter zeigten sich bei allen drei Versuchsgruppen unverändert: Körperhaltung, Piloerektion, Hautfarbe, Exophtalmus, Ptosis, Lakrimation, Salivation, Hörvermögen, Balance, Cornea-Reflex, Barthaar-Reflex, Haffner-Reflex, Pupillen-Reflex sowie der Muskeltonus. Verhaltensauffälligkeiten sind in Tabelle 5.3 dargestellt. Über ein Drittel der epileptischen Tiere zeigte einen erhöhten Schwanztonus, Fortbewegung und Schnelligkeit des Bewegungsablaufs waren bei fast der Hälfte der epileptischen Tiere reduziert, und 36 % zeigten eine erhöhte Schreckhaftigkeit bei Reaktion auf Berührung, welche sich durch starkes Zusammenzucken sowie plötzliches Hochspringen manifestierte. Für 50% der Kontrollen sowie der epileptischen Tiere ergab sich ein erhöhtes Explorationsverhalten. 115 Ergebnisse Veränderungen: Pilo mit SE Schwanztonus - ↓ Pilo ohne SE ↑ 5 (36 %) Kontrolle ↓ ↑ ↓ ↑ - - - - Atmung - 3 (21 %) - - - - Fellsauberkeit - 1 (7 %) - - - - Fortbewegung 6 (43 %) 1 (7 %) - - 1 (8 %) - Schnelligkeit des 6 (43 %) 1 (7 %) - - 1 (8 %) - - 5 (36 %) - - Bewegungsablaufes Schreckhaftigkeit - Anzahl Kotboli (n) 0-3 1-3 0-5 Anzahl Urin (n) 0-4 0-2 0-5 - Abnormales Verhalten: Neugierverhalten Reaktion auf Berührung Explorationsverhalten Aufricht-Reflex 3 (21 %) 2 (14 %) - - - 5 (36 %) - - - 7 (50 %) - 6 (43 %) - - 1 (20 %) - 2 (17 %) - 6 (50%) - Tabelle 5.3: Darstellung der Parameter im Irwin-Test, welche bei mindestens einem Tier vom Normalverhalten abweichen. Kontrolle: n = 12, Pilo ohne SE: n = 5, Pilo mit SE: n = 14. - = keine Abweichung vom Normalverhalten, ↑ = Untersuchungsparameter erhöht, ↓ = Parameter verringert 5.3.2.2 Überprüfungen von Exploration, Lokomotion sowie Angst-assoziiertem Verhalten Open-Field Wie in Abbildung 5.23 dargestellt, ergab sich für die epileptischen Tiere im OpenField im Vergleich zu den Kontrollen und zur Gruppe „Pilo ohne SE“ eine signifikant kürzere Aufenthaltsdauer im Zentrum (jeweils p = 0,0042) und infolgedessen eine verlängerte Aufenthaltsdauer im Randbereich der Arena (jeweils p = 0,0042). Die zurückgelegte Gesamtstrecke der epileptischen Tiere war im Vergleich zu den Kontrollen signifikant erhöht (p < 0,0001). Die epileptischen Tiere wiesen ein im Vergleich zur Gruppe „Pilo ohne SE“ verringertes Aufrichtverhalten auf (p = 0,0246). 116 Ergebnisse Zeitdauer (s) OF: Aufenthaltsdauer im Zentrum 150 100 *+ 50 750 Zeitdauer (s) A 200 0 * 500 250 Kontrolle Pilo ohne SE Pilo mit SE C OF: Zurückgelegte Gesamtstrecke * # 2500 0 D Anzahl Aufrichten (n) Strecke (cm) 5000 OF: Aufenthaltsdauer am Rand + 0 Kontrolle Pilo ohne SE Pilo mit SE 7500 B OF: Aufrichtverhalten 12.5 10.0 7.5 + 5.0 2.5 0.0 Kontrolle Pilo ohne SE Pilo mit SE Kontrolle Pilo ohne SE Pilo mit SE Abb. 5.23: Darstellung der Parameter Aufenthaltsdauer im Zentrum und am Rand der Arena (s, Abb. A und B), der zurückgelegten Gesamtstrecke (cm, Abb. C) sowie des Aufrichtverhaltens (Abb. D) im Open-Field. OF = Open-Field; Kontrolle: n = 12, Pilo ohne SE: n = 5, Pilo mit SE: n = 14; Statistik: A und B mit 1-way-ANOVA nonparametrisch (Kruskal-Wallis-Test) und Posthoc Dunn's-MultipleComparison-Test; Gesamtstrecke und Aufrichtverhalten mit 1-way-ANOVA und Posthoc Bonferroni'sMultiple-Comparison-Test; * = „Pilo mit SE“ signifikant zur Kontrolle; + = „Pilo mit SE“ signifikant zu „Pilo ohne SE“; # = „Pilo ohne SE signifikant zur Kontrolle, Signifikanzniveau: p < 0,05 Novel-Object-Exploration-Test Wie Abbildung 5.24 darstellt, ergab sich für die epileptischen Tiere - ähnlich wie im Open-Field - in der Habituationsphase des Novel-Object-Exploration-Test eine verglichen zu den Kontrollen und der Gruppe „Pilo ohne SE“ verringerte Aufenthaltsdauer im Zentrum der Arena (p = 0,0005), sowie eine erhöhte zurückgelegte Gesamtstrecke im Vergleich zu den Kontrollen (p = 0,0016). Die signifikant erhöhte Gesamtstrecke der epileptischen Tiere, verglichen mit den Kontrollen, findet sich auch in der Objektphase wieder (p = 0,0001). Für die epileptischen Tiere ergab sich in der Objektphase im Vergleich zu den Kontrolltieren eine signifikant erhöhte Aufenthaltsdauer im Zentrum (p = 0,0003). 117 Ergebnisse A NOE: Habituationsphase Aufenthaltsdauer im Zentrum B NOE: Habituationsphase Gesamtstrecke 150 50 *+ Wegstrecke (cm) Zeitdauer (s) 200 100 * 10000 250 8000 6000 4000 2000 0 0 Kontrolle Pilo ohne SE Pilo mit SE Kontrolle Pilo ohne SE Pilo mit SE NOE: Objektphase C Aufenthaltsdauer im Zentrum * 200 150 100 50 NOE: Objektphase Gesamtstrecke 12500 Wegstrecke (cm) Zeitdauer (s) 250 D 10000 * 7500 5000 2500 0 0 Kontrolle Pilo ohne SE Pilo mit SE Kontrolle Pilo ohne SE Pilo mit SE Abb. 5.24: Darstellung der Ergebnisse der Untersuchungsparameter Aufenthaltsdauer im Zentrum in der Habituations- (A) sowie Objektphase (C), sowie der Gesamtstrecke während der Habituation (B) und der Objektphase (D) im Novel-Object-Exploration-Test. NOE = Novel-Object-Exploration-Test; 1way-ANOVA nonparametrisch (Kruskal-Wallis-Test) und Posthoc Dunn's-Multiple-Comparison-Test; * = Pilo mit SE signifikant zu Kontrolle; + = Pilo mit SE signifikant zu Pilo ohne SE, Signifikanzniveau: p < 0,05 Die Auswertung der zurückgelegten Wegstrecken der Mäuse im Novel-ObjectExploration-Test veranschaulicht, dass die Kontrollen sowie die Pilocarpinbehandelten Tiere ohne SE sowohl in der Absolvierung des Open-Fields (Abb. 5.25 A, B), als auch in der Habituationsphase des Novel-Object-Exploration-Tests die gesamte Arena erkundeten. In der Objektphase jedoch verblieben sie vorwiegend am Rand des Open-Fields (Abb. 5.25 D, E). Viele epileptische Tiere bewegten sich während der Absolvierung des Open-Fields sowie in der Habituationsphase des Novel-Object-Exploration-Tests nahezu ausschließlich am Rand entlang, zeigten also Thigmotaxis (Abb. 5.25 C). In der Objektphase dagegen ergab sich für die 118 Ergebnisse epileptischen Mäuse das exakt gegenteilige Verhalten, d.h. sie näherten sich ausgesprochen häufig dem Objekt an (Abb. 5.25 F). A B C D E F Abb. 5.25: Aufsicht auf das Open-Field mit Darstellung der zurückgelegten Wegstrecken der Mäuse (A-C) sowie in der Objektphase des Novel-Object-Exploration-Tests (D-F). In den Abb. A+D ist ein Kontrolltier, in den Abb. B+E ein Pilocarpin-behandeltes Tier ohne SE sowie in den Abb. C+F ein epileptisches Tier zu sehen. Die Maus in Abb. C zeigte Thigmotaxis. Hole-Board-Test Für die Pilocarpin-behandelten Mäuse ohne SE ergab sich im Vergleich zu den beiden übrigen Versuchsgruppen eine signifikante Steigerung der Frequenz der Head-Dips im Hole-Board-Test (Abb. 5.26 A, p = 0,0090). Die epileptischen Tiere zeigten verglichen mit den Pilocarpin-behandelten Tieren ohne SE und den Kontrollen eine erhöhte Frequenz der Edge-Dips (Abb. 5.26 B, p = 0,0022) sowie eine erhöhte zurückgelegte Gesamtstrecke (Abb. 5.26 C, p = 0,0114). Neun von 14 epileptischen Mäusen sprangen einmal bis mehrfach von der Versuchsapparatur des Hole-Boards ab. Eine Maus musste aufgrund von wiederholten Abspringens aus dem Versuch genommen werden. Dies ergab ein signifikant erhöhtes Absprungverhalten verglichen zu den Kontrollen und den Pilocarpin-behandelten Tieren ohne SE (Abb. 5.26 D, p = 0,0012). 119 Ergebnisse A HB: Head-Dips #+ 60 40 20 0 HB: Gesamtstrecke * Strecke (cm ) 1200 1000 800 600 400 200 0 4 2 Kontrolle Pilo ohne SE Pilo mit SE D Anzahl Absprünge (n) C *+ 6 0 Kontrolle Pilo ohne SE Pilo mit SE 1400 HB: Edge-Dips B 8 Anzahl (n) Anzahl (n) 80 HB: Absprünge * 16 14 12 10 Kontrolle/ Pilo ohne SE Pilo mit SE 8 6 4 2 0 Absprung Kontrolle Pilo ohne SE Pilo mit SE ohne Absprung Abb. 5.26: Ergebnisse der Parameter Head-Dips (A), Edge-Dips (B), Gesamtstrecke (C) sowie Absprünge von der Versuchsapparatur (D) im Hole-Board-Test. HB = Hole-Board-Test; Kontrolle: n = 12, Pilo ohne SE: n = 5, Pilo mit SE: n = 13 (ein Tier sprang wiederholt von der Apparatur ab); Statistik: A und C mit 1-way-ANOVA nonparametrisch (Kruskal-Wallis test) und post hoc Dunn's Multiple Comparison Test; B mit 1-way-ANOVA und Posthoc Bonferroni's-Multiple-Comparison-Test sowie Abb. D mit Kontingenztafel und Fisher's-Exakt-Test; * = Pilo mit SE signifikant zur Kontrolle; + = Pilo mit SE signifikant zu Pilo ohne SE; # = Pilo ohne SE signifikant zur Kontrolle, Signifikanzniveau: p < 0,05 Elevated-Plus-Maze Bezüglich der Parameter der Aufenthaltsdauer auf den offenen Armen (Abb. 5.27 A) sowie des Verhältnisses der Eintritte in die offenen/geschlossenen Arme (Abb. 5.27 B) ließen sich keine signifikanten Unterschiede zwischen den Versuchsgruppen detektieren. Bei der zurückgelegten Wegstrecke jedoch ergab sich für die epileptischen Tiere im Vergleich zu den Kontrollen sowie zu den Pilocarpinbehandelten Tieren ohne SE analog zu den vorangegangenen Tests eine signifikante Erhöhung (Abb. 5.27 C, p < 0,0001). Wie bereits im Hole-Board-Test beobachtet, zeigten die epileptischen Tiere verglichen mit den übrigen beiden 120 Ergebnisse Versuchsgruppen auch im Elevated-Plus-Maze ein erhöhtes Absprungverhalten (Abb. 5.27 D, p < 0,0001). EPM: Aufenthaltsdauer auf den offenen Armen A B 25 Verhältnis offen:geschlossen 150 Zeitdauer (s) EPM: Verhältnis der Eintritte in die offenen/geschlossenen Arme 100 50 20 15 10 5 0 0 Kontrolle Pilo ohne SE Pilo mit SE Kontrolle Pilo ohne SE Pilo mit SE Wegstrecke (cm) D EPM: Absprünge von der Versuchsapparatur EPM: Gesamtstrecke *+ Anzahl der T iere (n) C 2000 1500 1000 500 0 20 * 15 Pilo ohne SE/ Kontrolle Pilo mit SE 10 5 0 Kontrolle Pilo ohne SE Pilo mit SE Absprung ohne Absprung Abb. 5.27: Auswertung der Parameter Aufenthaltsdauer auf den offenen (A) und geschlossenen Armen (B), der zurückgelegten Gesamtstrecke (C) sowie der Absprünge von der Versuchsapparatur (D) im Elevated-Plus-Maze. EPM = Elevated-Plus-Maze, Kontrolle: n = 12, Pilo ohne SE: n = 5, Pilo mit SE: n = 14; Statistik: A, B und C mit 1-way-ANOVA nonparametrisch (Kruskal-Wallis-Test) und Posthoc Dunns-Multiple-Comparison-Test sowie Abb. D mit Kontingenztafel und Fisher's-Exakt-Test; Signifikanzniveau: p < 0,05 ; * = Pilo mit SE signifikant zur Kontrolle; + = Pilo mit SE signifikant zu Pilo ohne SE. Light-Dark-Box Wie Abbildung 5.28 darstellt, zeigten die epileptischen Tiere im Vergleich zu den übrigen beiden Gruppen in der Light-Dark-Box eine signifikant verringerte Aufenthaltsdauer im aversiven hellen Bereich (Abb. 5.28 A, p = 0,0032) sowie eine sigifikant erhöhte Aufenthaltsdauer im geschützten dunklen Bereich (Abb. 5.28 B, p = 0,0032). Ferner wiesen die epileptischen Mäuse eine signifikant reduzierte Anzahl von Übertritten zwischen dem hellen und dem dunklen Kompartment auf (p = 0,0008). Im Gegensatz zu den vorangegangen Tests, Open-Field, Novel-Object- 121 Ergebnisse Exploration-Test, Hole-Board-Test sowie zum Elevated-Plus-Maze, ergab sich für die epileptischen Tiere verglichen zu den Kontrollen und zu den Pilocarpin-behandelten Tieren ohne SE in der Light-Dark-Box eine verringerte zurückgelegte Wegstrecke (p = 0,0003). A *+ 300 200 Zeitdauer (s) Zeitdauer (s) 250 150 100 LDB: Aufenthaltsdauer im dunklen Bereich B LDB: Aufenthaltsdauer im hellen Bereich *+ 50 200 100 0 0 Kontrolle Pilo ohne SE Pilo mit SE Kontrolle Pilo ohne SE Pilo mit SE D 20 15 10 LDB: Gesamtstrecke 1500 25 Wegstrecke (cm) Anzahl der Übertritte (n) C LDB: Übertritte zwischen dem hellen und dunklen Kompartment *+ 5 1000 500 *+ 0 0 Kontrolle Pilo ohne SE Pilo mit SE Kontrolle Pilo ohne SE Pilo mit SE Abb. 5.28: Ergebnisse der Aufenthaltsdauer im hellen Bereich (A), im dunklen Bereich (B), der Übertritte zwischen dem hellen und dunklen Kompartment (C) sowie der Gesamtstrecke (D) in der Light-Dark-Box. LDB = Light-Dark-Box, Kontrolle: n = 12, Pilo ohne SE: n = 5, Pilo mit SE: n = 14; Statistik: 1-way-ANOVA nonparametrisch (Kruskal-Wallis-Test) und Posthoc Dunn's-MultipleComparison-Test; * = Pilo mit SE signifikant zur Kontrolle; + = Pilo mit SE signifikant zu Pilo ohne SE, Signifikanzniveau: p < 0,05 Die zurückgelegten Wegstrecken der Tiere in der Light-Dark-Box stellen dar, dass die Kontrollen sowie die Pilocarpin-behandelten Tiere ohne SE den gesamten offenen, hellen Bereich explorierten (Abb. 5.29 A, B), die epileptischen Tiere sich dagegen üblicherweise schnell vom Einsatzpunkt im hellen Bereich in das dunkle, geschützte Kompartment begaben, aus welchem sie, wenn dies der Fall war, nur selten wieder hervortraten (Abb. 5.29 C). 122 Ergebnisse A C B Abb. 5.29: Aufsicht auf die Light-Dark-Box und Darstellung der zurückgelegten Wegstrecken eines Kontrolltieres (A) sowie eines Pilocarpin-behandelten Tieres ohne (B) bzw. mit (C) SE. 5.3.2.3 Überprüfung der motorischen Fähigkeiten Die Versuchsgruppen absolvierten drei Tests, welche die Motorik von Nagern überprüfen. Das Balancieren auf einem rotierenden Stab (Rotarod-Test, 17 bis 20 Wochen nach SE) stellte für die Tiere aller drei Versuchsgruppen kein Problem dar (Abb. 5.30 A). Den Hanging-Wire-Test (Abb. 5.30 B, 18-21 Wochen nach SE) bestanden 10 von 14 epileptischen Mäusen nicht. Für die epileptischen Mäuse ergab sich also ein signifikanter Unterschied zu den Kontrollen (p = 0,001) sowie zu den Pilocarpin-behandelten Tieren ohne SE (p = 0,0018). Das rückwärtige Klettern aus einer Röhre (Chimney-Test, Abb. 5.30 C, ebenfalls 18-21 Wochen nach SE) stellte für die Mäuse des Stammes B6 eine außerordentliche Schwierigkeit dar, denn aus allen drei Versuchsgruppen bestanden die meisten Tiere diesen Test nicht. A B Rotarod Anzahl Tiere (n) Anzahl Tiere (n) Hanging-Wire 15 15 10 5 0 *+ 10 5 0 bestanden nicht bestanden bestanden 123 nicht bestanden Ergebnisse Chimney-Test C Kontrolle Pilo ohne SE Pilo mit SE Anzahl Tiere (n) 15 10 5 0 bestanden nicht bestanden Abb. 5.30: Darstellung der Ergebnisse aus Rotarod, Hanging-Wire und Chimney-Test; Kontrolle: n = 12, Pilo ohne SE: n = 5, Pilo mit SE: n = 14; Statistik: Kontingenztafel und Fisher’s-Exakt-Test, * = Pilo mit SE signifikant zur Kontrolle; + = Pilo mit SE signifikant zu Pilo ohne SE, Signifikanzniveau: p < 0,05 5.3.2.4 Überprüfung der räumlichen Lern- und Gedächtnisleistung: MorrisWater-Maze Bei der Überprüfung von räumlicher Lern- und Gedächtnisleistung, zeigten die epileptischen Tiere deutliche Defizite (Abb. 5.31 A), welche sich in einer signifikant schlechteren Lernleistung an den Trainingstagen 1 und 5 (jeweils p < 0,05), 6 (p < 0,01) sowie 7 bis 10 (jeweils p < 0,001) im Vergleich zu den Kontrollen widerspiegelten. Verglichen mit den Pilocarpin-behandelten Tieren ohne SE manifestierte sich eine signifikant schlechtere Lernleistung bei den epileptischen Tieren an den Trainingstagen 1, 4 (jeweils p < 0,01), 6 (p < 0,05), 7 (p < 0,01), 8 (p < 0,001), 9 (p < 0,01) und 10 (p < 0,001). Die Schwimmgeschwindigkeiten der epileptischen Tiere waren an den Trainingstagen 9 und 10 verglichen zu den Kontrollen reduziert (Abb. 5.31 B, p < 0,05). Die mittlere Latenzzeit, welche die Mäuse benötigten, um die Plattform aufzufinden, betrug für die Kontrollen 30 s an Tag 1 sowie nur noch 10 s an Tag 10. Dies stellt für die Kontrolltiere eine signifikante Verbesserung der räumlichen Lern- und Gedächtnisleistung dar (p < 0,0001). Epileptische Mäuse hingegen benötigten durchschnittlich 45 s an Tag 1, um zur Plattform zu gelangen, sowie 38 s an Tag 10. Infolgedessen ergab sich für die epileptischen Tiere keine signifikante Verbesserung der Latenzzeit. 124 Ergebnisse An Tag 10, dem Probe-Trial, kreuzten die epileptischen Tiere die Position der ehemaligen Plattform seltener als die Kontrolltiere (Abb. 5.31 C, p = 0,0019). Bei der Überprüfung der Langzeitgedächtnisleistung mittels Retention-Test (Abb. 5.31 D), welchen die Tiere an Tag 20 und 21 absolvierten, ergab sich für die epileptischen Tiere im Vergleich zu den Kontrollen eine signifikant schlechtere Lernleistung (an beiden Tagen jeweils p < 0,001). Die Lern- und Gedächtnisleistung der epileptischen Mäuse stellte sich auch im Vergleich zu den Pilocarpin-behandelten Tieren ohne SE signifikant schlechter dar (Tag 20: p < 0,001, Tag 21: p < 0,01). Bei der Variante mit sichtbarer Plattform (Cued-Version, Abb. 5.31 E) waren keine signifikanten Unterschiede zwischen den drei Versuchsgruppen ermittelbar. Im Gegensatz zu den Pilocarpin-behandelten Tieren zeigten die Kontrollen allerdings eine signifikant bessere Lernleistung von Tag 1 zu Tag 2 der Cued-Version (p = 0,0043). MWM: Lernkurve A Latenzzeit (s) 60 *+ 40 + * Kontrolle Pilo ohne SE Pilo mit SE *+ *+ *+ *+ *+ 20 0 1 2 3 4 5 6 7 Trainingstage 8 9 10 C 22 5 20 4 Anzahl (n) Geschwindigkeit (cm/s) B MWM: Schwimmgeschwindigkeit 18 16 ** 14 1 2 3 4 5 6 7 Trainingstage 8 9 3 2 1 12 MWM: Kreuzungen der ehemaligen Plattformposition * 0 10 Kontrolle Pilo ohne SE Pilo mit SE 125 Ergebnisse Latenzzeit (s) 30 MWM: Retention-Test *+ 40 *+ Latenzzeit (s) D 40 20 10 30 E MWM: Cued-Version * 20 10 0 0 Tag 21 Tag 31 Tag 22 Tag 32 Abb. 5.31: Darstellung der Ergebnisse der Lernkurve (A), der Schwimmgeschwindigkeit (B), der Kreuzungen der ehemaligen Plattformposition im Probe trial (C), des Retention-Test (D) sowie der Cued-Version (E). MWM = Morris-Water-Maze; Kontrolle: n = 12, Pilo ohne SE: n = 5, Pilo mit SE: n = 14; Statistik: A, B, D, E: 2-way-Repeated-Measures-ANOVA und Bonferroni-Posttests, C: 1-wayANOVA Kruskal-Wallis-Test und Dunn's-Multiple-Comparison-Test; * = Pilo mit SE signifikant zur Kontrolle, + = Pilo mit SE signifikant zu Pilo ohne SE, Signifikanzniveau: p < 0,05 Interessante Aufschlüsse bietet ferner die Auswertung der zurückgelegten Wegstrecken der Mäuse über die Tage der Akquisition im Morris-Water-Maze. Abbildung 5.32 stellt repräsentative Abbildungen der Wegstrecken an Trainingstag 9 bei Tieren von allen drei Versuchsgruppen dar. Das Kontrolltier (Abb. 5.32 A) sowie die Pilocarpin-behandelte Maus ohne SE (Abb. 5.32 B) hatten keine Schwierigkeiten, die Plattform aufzufinden, denn sie hatten gelernt, eine Strategie zu entwickeln, die versteckte Plattform zu erreichen. Das epileptische Tier (Abb. 5.32 C) jedoch entwickelte keine aktive Suchstrategie nach der verborgenen Plattform. Es schwamm vorwiegend entlang des Beckenrandes, zeigte also Thigmotaxis, und konnte infolgedessen die Plattform innerhalb der vorgegebenen Zeit nicht auffinden. A C B Abb. 5.32: Aufsicht auf das Morris-Water-Maze. Zurückgelegte Wegstrecken an Trainingstag 9 eines Kontrolltieres (A), eines Pilocarpin-behandelten Tieres ohne SE (B) sowie eines epileptischen Tieres (C). Die Tiere auf den Abb. A und B hatten gelernt, wo sich die Plattform befindet. Das epileptische Tier auf Abb. C zeigt Thigmotaxis, ein charakteristisches Verhalten für die Pilocarpin-behandelten Tiere mit SE, welches als Angst-assoziiert gilt. 126 Ergebnisse 5.3.2.5 Überprüfung von Depressions-assoziiertem Verhalten In beiden Tests, welche Depressions-assoziiertes Verhalten überprüfen, ergab sich für die epileptischen Tiere eine verringerte Dauer der Immobilität. Im TailSuspension-Test (Abb. 5.33 A) erwies sich diese bei den epileptischen Tiere im Vergleich zu den Kontrollen sowie zu den Pilocarpin-behandelten Tieren ohne SE als reduziert (p = 0,0082). Im Porsolt-Test (Abb. 5.33 B) zeigte sich im Vergleich zu den Kontrolltieren ein ähnliches Resultat (p = 0,0031). Ein Problem des Tail-SuspensionTests stellte dar, dass es einigen Tieren gelang, wiederholt auf die horizontale Stange der Versuchsapparatur zu klettern. Dies betraf alle Gruppen, insbesondere jedoch die Kontrolltiere. Aus diesem Grund ist die Anzahl der Tiere im TailSuspension-Test verringert, da nicht jede Maus diesen Test zu absolvieren A Tail-Suspension-Test 150 100 50 *+ 0 Kontrolle Pilo ohne SE Pilo mit SE Dauer der Immobilität (s) Dauer der Immobilität (s) vermochte. 150 Porsolt-Test B 100 * 50 0 Kontrolle Pilo ohne SE Pilo mit SE Abb. 5.33: Darstellung der Dauer der Immobilität im Tail-Suspension-Test (A, Kontrolle: n = 6, Pilo ohne SE: n = 3, Pilo mit SE: n = 11) und Porsolt-Test (B, Kontrolle: n = 12, Pilo ohne SE: n = 5, Pilo mit SE: n = 14); Statistik: 1-way-ANOVA nonparametrisch (Kruskal-Wallis-Test) und Posthoc Dunn'sMultiple-Comparison-Test; * = Pilo mit SE signifikant zur Kontrolle, + = Pilo mit SE signifikant zu Pilo ohne SE, Signifikanzniveau: p < 0,05 5.3.3 Resultate der histologischen Auswertung Abbildung 5.34 stellt den Hippocampus (A, C, E) sowie den Hilus des Gyrus dentatus (B, D, F) in Thionin-Färbung dar. Bei den epileptischen Tieren ist ein Verlust an Neuronen, insbesondere im Hilus des Gyrus dentatus, erkennbar (Abb. 5.34 F). 127 Ergebnisse A B C D E F Abb.5.34: Übersicht über den Hippocampus (A, C, E) sowie eines Ausschnitts aus dem Gyrus dentatus des Hippocampus (B, D, F) eines Kontrolltieres (A, B), eines Tieres aus der Gruppe „Pilo ohne SE“ (C, D) sowie eines epileptischen Tieres (E, F). Die Anfärbung erfolgte mittels Thioninlösung. Der Maßstabbalken entspricht 500 µm für die Abbildungen A, C und E sowie 100 µm für die Abbildungen B, D und F. 5.3.3.1 Histologische Auswertung 4 Wochen nach SE Um die Auswirkungen von Pilocarpin zu verschiedenen Zeitpunkten zu vergleichen, wurden zunächst die histologischen Schnitte von jeweils 5 Tieren pro Gruppe (Pilo mit und ohne SE) 4 Wochen nach Pilocarpin-Applikation mittels eines ScoringSystems bewertet (Kapitel 4.10.5.1) sowie die Anzahl an Neuronen ausgezählt (Kapitel 4.10.5.3). Es erschien zunächst ausreichend, die Wirkungen von Pilocarpin 4 Wochen nach SE bzw. Injektion zu bewerten. Die Auswertung von histologischen Schnitten von Kontrolltieren wurde nur zum Zeitpunkt von 9 Monaten nach Vehikelinjektion vorgenommen. Wie Abbildung 5.35 darstellt, ergaben sich für die Pilocarpin-behandelten Tiere mit SE in den Subregionen CA 1 und CA 3 des Hippocampus sowie in der Körnerzellschicht des Gyrus dentatus keine signifikanten Unterschiede zu den 128 Ergebnisse Pilocarpin-behandelten Tieren ohne SE. Im Hilus des Gyrus dentatus jedoch ließ sich bei den Gehirnschnitten der epileptischen Mäuse ein signifikant höherer Neuronenverlust mittels der Bewertung nach Scoring-System (Abb. 5.35 E, p = 0,0112) sowie eine verringerte Dichte an Neuronen (Abb. 5.35 F, p = 0,0079) nachweisen. Score 2.0 1.5 1.0 0.5 0.0 Pilo ohne SE C 2.5 CA 3a (Scoring) 1.5 1.0 0.5 80 60 40 20 D 100 Pilo mit SE CA 3a (Neuronenzählung) 80 60 40 20 0 E CA 3c (Scoring) 2.0 1.5 1.0 0.5 0.0 Pilo ohne SE Pilo ohne SE Pilo mit SE F Anzahl Neuronen (n) Pilo ohne SE Score CA 1 (Neuronenzählung) Pilo ohne SE 0.0 2.5 100 0 Pilo mit SE 2.0 Score B Anzahl Neuronen (n) CA 1 (Scoring) Anzahl Neuronen (n) A 2.5 100 Pilo mit SE CA 3c (Neuronenzählung) 80 60 40 20 0 Pilo mit SE Pilo ohne SE 129 Pilo mit SE Ergebnisse Hilus (Scoring) 2.5 * Score 2.0 1.5 1.0 0.5 0.0 Pilo ohne SE I 2.5 Hilus (Dichte) H Anzahl Neuronen/mm² G 500 400 300 * 200 100 0 Pilo ohne SE Pilo mit SE Pilo mit SE Gyrus dentatus (Scoring) Score 2.0 1.5 1.0 0.5 0.0 Pilo ohne SE Pilo mit SE Abb. 5.35: Bewertung der Subregionen CA 1 (a, b), CA 3a (c, d) und CA 3c (E, F) des Hippocampus sowie des Hilus (G, H) und der Körnerzellschicht des Gyrus dentatus (I) 4 Wochen nach Injektion von Pilocarpin. Beide Gruppen jeweils n = 5. Statistische Berechnungen mittels t-Test (Mann-WhitneyTest). * = Pilo mit SE signifikant zu Pilo ohne SE. Signifikanzniveau: p < 0,05 5.3.3.2 Histologische Auswertung 9 Monate nach SE Die Gehirnschnitte der Mäuse, welche die Verhaltensbatterie absolviert hatten (Kapitel 5.3.2), wurden ebenfalls histologisch mittels eines Scoring-Systems (Kapitel 4.10.5.1) bewertet, sowie die Anzahl von Neuronen innerhalb definierter Fenster ausgezählt (Kapitel 4.10.5.3). In der CA 1-Subregion des Hippocampus zeigte sich bei den histologischen Schnitten sowohl nach Bewertung mittels eines Scoring-Systems (Abb. 5.36 A, p = 0,0009), als auch nach Auszählen von Neuronen (Abb. 5.36 B, p = 0,0004) ein signifikanter Unterschied zwischen den Kontrollen und den epileptischen Tieren. Die Pilocarpin-behandelten Tiere ohne SE differierten von den Kontrolltieren hinsichtlich der Auswertung der CA 1-Subregion nur nach Beurteilung mittels Scoring-Systems signifikant (Abb. 5.36 A, p < 0,05). 130 Ergebnisse In der CA 3-Subregion ließ sich ebenfalls ein signifikanter Unterschied bei den Gehirnschnitten zwischen den Kontrollen und den epileptischen Tieren nach Bewertung mittels Scoring-Systems (Abb. 5.36 C: Region CA 3a, p = 0,0028, Abb. 5.36 E: Region CA 3c: p = 0,0008) wie auch mittels Auszählen von Neuronen (Abb. 5.36 D: CA 3a, p = 0,0004, Abb. 5.36 E: CA 3c, p = 0,0018) detektieren. Für die Pilocarpin-behandelten Tiere ohne SE ergab sich in der Auswertung der histologischen Schnitte bei der CA 3-Subregion nach Auszählen von Neuronen eine höhere Anzahl als bei den epileptischen Tieren (Abb. 5.36 D: CA 3a, p = 0,0004; Abb. 5.36 F: CA 3c, p < 0,05). Bei den Ergebnissen der Beurteilung des Hilus des Gyrus dentatus (Abb. 5.36 G, H) differierten die epileptischen Tiere sowohl von den Kontrollen (nach Scoring-System und Dichte, p < 0.0001), als auch von den Pilocarpin-behandelten Tieren ohne SE (nach Bewertung mittels Scoring-Systems und Auswertung der Dichte: p < 0,05). Die Bewertung der Körnerzellschicht des Gyrus dentatus (Abb. 5.36 I) nach ScoringSystem zeigte einen signifikanten Unterschied für die Gehirnschnitte der epileptischen Tiere im Vergleich zu den Pilocarpin-behandelten Tieren ohne SE sowie zu den Kontrolltieren (p = 0,0004). Im Gegensatz zu den NMRI-Mäusen in Studie 1 entwickelten nur 3 von 14 epileptischen B6-Mäusen eine Dispersion der Körnerzellschicht des Gyrus dentatus. B CA 1 (Scoring) Score 2.0 1.5 1.0 0.5 # * Anzahl Neuronen (n) A 2.5 CA 1 (Neuronenzählung) 100 80 60 * 40 20 0 0.0 Kontrolle Pilo ohne SE Pilo mit SE Kontrolle Pilo ohne SE Pilo mit SE 131 Ergebnisse C CA 3a (Scoring) Anzahl Neuronen (n) 2.5 Score 2.0 1.5 1.0 * 0.5 0.0 100 CA 3c (Scoring) Score 1.5 * 0.5 40 20 F 2.0 1.0 60 Kontrolle Pilo ohne SE Pilo mit SE Anzahl an Neuronen (n) E 0.0 100 Score Hilus (Scoring) 40 20 0 H *+ 2.0 1.5 1.0 0.5 0.0 500 I 300 200 Score *+ 100 0 Kontrolle Pilo ohne SE Pilo mit SE Gyrus dentatus (Scoring) 2.0 1.5 1.0 0.5 Hilus (Dichte) 400 Kontrolle Pilo ohne SE Pilo mit SE 2.5 *+ 60 Kontrolle Pilo ohne SE Pilo mit SE Anzahl Neuronen/mm² 2.5 CA 3c (Neuronenzählung) 80 Kontrolle Pilo ohne SE Pilo mit SE G *+ 80 0 Kontrolle Pilo ohne SE Pilo mit SE 2.5 CA 3a (Neuronenzählung) D *+ 0.0 Kontrolle Pilo ohne SE Pilo mit SE 132 Ergebnisse Abb. 5.36: Histologische Auswertung 9 Monate nach SE der Subregionen CA 1 (a, b), CA 3a (c, d) und CA 3c (e, f) des Hippocampus sowie des Hilus (g, h) und der Körnerzellschicht des Gyrus dentatus (i) nach Scoring-System (a, c, e, g, i) bzw. Auszählen von Neuronen (b, d, f, h). Kontrolle: n = 12, Pilo ohne SE: n = 5, Pilo mit SE: n = 14. Statistische Berechnungen mittels nicht-parametrischer 1way-ANOVA (Kruskal-Wallis-Test) und post hoc Dunn's-Multiple-Comparison-Test. * = Pilo mit SE signifikant zur Kontrolle, + = Pilo mit SE signifikant zu Pilo ohne SE, # = Pilo ohne SE signifikant zur Kontrolle. Signifikanzniveau: p < 0,05 5.3.3.3 Vergleich der Zeitpunkte – 4 Wochen versus 9 Monate nach SE Um verschiedene zeitliche Abstände zum SE zu untersuchen, wurden die Ergebnisse der epileptischen Mäuse für die Zeitpunkte 4 Wochen sowie 9 Monate nach SE aus den Abbildungen 5.35 und 5.36 miteinander verglichen. Nach Vergleich dieser Zeitpunkte zeigte sich bei den histologischen Schnitten der epileptischen Tiere in den Subregionen CA 1 und CA 3 des Hippocampus sowie im Hilus und in der Körnerzellschicht des Gyrus dentatus sowohl nach Bewertung mittels Scoring-Systems, als auch mittels Auszählen von Neuronen (nur CA 1 und CA 3) bzw. Berechnung der neuronalen Dichte (nur Hilus) kein signifikanter Unterschied (Two-way ANOVA). 5.3.3.4 Histologische Auswertung in FJC- sowie GFAP-Markierung Um das Vorhandensein von degenerierenden Neuronen zu detektieren, wurde eine FJC-Färbung durchgeführt. Vier Wochen sowie 9 Monate nach SE ließen sich nur vereinzelt FJC-markierte Neuronen in thalamischen Kerngebieten sowie dem endopiriformen Cortex detektieren, jedoch nicht im Hippocampus, in der Amygdala oder im cerebralen Cortex. Insbesondere zum Zeitpunkt 4 Wochen nach SE traten viele, mittels FJC schwächer als Neuronen angefärbte Zellen mit vielen sternförmig verlaufenden Fortsätzen auf, analog zu den bei NMRI entdeckten Zellen (Studie 1, Kapitel 5.1.4.3). Sie konnten im Gyrus dentatus sowie vereinzelt in der CA 1-Subregion des Hippocampus beobachtet werden. 9 Monate nach SE trat dieser Zelltyp ebenfalls auf, jedoch weniger häufig als zum Zeitpunkt von 4 Wochen nach SE. Analog zu den histologischen Schnitten der NMRI-Mäuse in Studie 1, ließen sich Zellen dieser Morphologie in Studie 3 bei den Gehirnschnitten der B6-Mäuse mittels GFAPMarkierung anfärben (Abb. 5.37 E, Abb. 5.38 B, D). Einen zweiten, schwächer als 133 Ergebnisse Neuronen angefärbten Zelltyp, stellen langgezogene Zellen dar, welche gleichfalls 4 Wochen nach SE häufiger auftraten als 9 Monate nach SE. Zellen mit derselben Morphologie ließen sich mittels GFAP markieren (Abb. 5.37 F, H), infolgedessen kann von einem Auftreten von hypertrophierten Astrozyten sowie von radialer Glia ausgegangen werden. Die histologischen Schnitte der epileptischen Tiere wiesen ferner eine vermehrte Anzahl mittels GFAP markierter Astrozyten im Vergleich zu den Kontrollen auf. Bei den Kontrollen (Abb. 5.37 A, B) sowie bei den Pilocarpin-behandelten Tieren ohne SE (Abb. 5.38 E, F) ließen sich keine Zellen mittels FJC anfärben. Die Gehirnschnitte der Pilocarpin-behandelten Tiere ohne SE differierten auch in der GFAP-Färbung (Abb. 5.38 G, H) nicht von den Kontrollen (Abb. 5.37 C, D). A B C D 134 Ergebnisse E F G H Abb. 5.37: Ausschnitte aus dem Gyrus dentatus, gefärbt mittels FJC (A, B, E, F) oder GFAP (C, D, G, H) in Kontrolltieren (A-D) bzw. 4 Wochen nach SE (E-H). Der Maßstabbalken steht für 50 µm in den Abbildungen A, C, E und G sowie für 20 µm in den Abbildungen B, D, F und H. In Kontrollgewebe sind keine Zellen mit FJC angefärbt (A, B). Vier Wochen nach SE sieht man zwei angefärbte Zelltypen: Sternförmige Zellen mit vielen Fortsätzen (bezeichnet mittels Pfeil in Abbildung F) sowie langgezogene Zellen (bezeichnet mittels Pfeil in Abbildung E). Diese beiden mittels FJC schwächer angefärbten Zellen sind auch in GFAP-Markierung zu erkennen, zu sehen in Abbildung G und H. A B 135 Ergebnisse C D E F G H Abb. 5.38: Ausschnitte aus dem Gyrus dentatus, gefärbt mittels FJC (A, B, E, F) oder GFAP (C, D, G, H) bei epileptischen Tieren 9 Monate nach SE (A-D) bzw. bei Mäusen, welche Pilocarpin erhalten haben, aber keinen SE erreichten, sondern nur einen oder mehrere einzelne Anfälle (E-H). Der Maßstabbalken bezeichnet 50 µm für die Abbildungen A, C, E und G sowie 20 µm für die Abbildungen B, D, F und H. Neun Monate nach SE färbt FJC vorwiegend hypertrophierte Astrozyten an (bezeichnet mittels Pfeil in Abbildung B). Diese Zellen werden ebenfalls vom Gliazellmarker GFAP angefärbt, dargestellt in den Abbildungen C und D. Gehirnschnitte von Mäusen, bei denen Pilocarpin keinen SE induzierte, waren nicht unterschiedlich von Kontrolltieren (FJC- [E, F] sowie GFAP- [G, H] Färbung). 136 Diskussion 6. Diskussion 6.1 Vergleich des LiCl-Pilocarpins- mit dem Pilocarpin-Modell (Studie 1) Die erste Hypothese in Studie 1 besagt, dass eine vorherige Applikation von LiCl bei Mäusen die Krampfempfindlichkeit steigert, so dass die konvulsiv wirkende Pilocarpinkonzentration reduziert werden kann. Dieser Fakt ist bei Ratten seit vielen Jahren bekannt, denn bei Ratten führt eine Vorbehandlung mit 3 mEq LiCl 12-24 Stunden vor Pilocarpin-Applikation zu einer um mehr als den Faktor 13 potenzierten Wirkung von Pilocarpin (JOPE et al. 1986). Gestützt wird dies durch weitere Studien: TURSKI et al. (1983a) injizierten Ratten ohne LiCl-Vorbehandlung 400 mg/kg Pilocarpin, um Krampfanfälle auszulösen. Auch in einer weiteren Studie (CLIFFORD et al. 1987) wird Ratten ohne LiCl-Vorbehandlung 400 mg/kg Pilocarpin appliziert. Nach einer vormaligen Injektion von 3 mEq/kg LiCl benötigen die Ratten lediglich 30 mg/kg Pilocarpin, um ein Anfallsgeschehen auszulösen. Die Wirkung von LiCl, die konvulsive Dosis von Pilocarpin zu verringern, wird auf eine Inhibition der Inositol-Monophosphatase durch LiCl zurückgeführt, infolgedessen kann der Phosphatidylinositol-Zyklus nur beeinträchtigt ablaufen (BELMAKER u. BERSUDSKY 2007). Zeitpunkt- und dosisabhängig kann eine intracerebroventrikuläre Injektion von Inositol ein durch LiCl-Pilocarpin-induziertes Krampfgeschehen unterbinden (BERSUDSKY et al. 1993). Die in Studie 1 durchgeführten Experimente jedoch zeigen, dass wir bei den getesteten Mäusen des Stammes NMRI diese Effekte nicht beobachten konnten. Im Gegenteil, mit LiCl-Vorbehandlung entwickelten sogar weniger Tiere (30%) einen SE als nicht mit LiCl vorbehandelte Mäuse (83% bei 300 mg/kg Pilocarpin). MAZARATI et al. (2004) geben an, dass sie bei Galanin-Rezeptor-knock-out-Mäusen mit einer Dosierung von 3 mEq/kg LiCl bei einer 16-24 Stunden später folgenden Applikation von 150 mg/kg Pilocarpin s.c. einen SE induzieren können, nennen jedoch nicht den prozentualen Anteil der Mäuse, bei welchen nach dieser Prozedur ein SE entstand. In einer Studie (LI et al. 2008) wird zwar benannt, dass über 80% der Balb/c-Mäuse nach einer LiCl-Vorbehandlung von 3 mEq einen SE entwickeln, jedoch liegt die Dosierung von Pilocarpin in einer Spanne von 280-340 mg/kg. In einer solch hohen 137 Diskussion Dosierung führt Pilocarpin bereits als Monoinjektion bei einem hohen Prozentsatz an Mäusen zu einem SE, hier hat LiCl also die konvulsive Dosis von Pilocarpin nicht reduzieren können. BERSUDSKY et al. (1994) beschreiben Spezies-Unterschiede hinsichtlich der Empfänglichkeit bezüglich LiCl-Pilocarpin-induzierter Anfälle. So wird vermutet, dass Interaktionen zwischen LiCl und Pilocarpin lediglich in Spezies auftreten, welche einen geringen Basalwert an Inositol im Gehirn aufweisen. Hier sind vor allem Ratten zu nennen. In der Studie (BERSUDSKY et al. 1994) entwickelten 80-100% der untersuchten Ratten bei einer Dosierung von 3 mEq/kg LiCl sowie 20 mg/kg Pilocarpin Krampfanfälle. Bei Mäusen lag der prozentuale Anteil der Tiere mit epileptischen Anfällen bei 70%, die Dosierung von LiCl wurde jedoch verglichen zu Ratten höher gewählt und liegt bei 10 mEq/kg bei 100 mg/kg Pilocarpin. Einen weiteren Hinweis auf die Vermutung, dass eine erhöhte Dosis von 10 mEq/kg LiCl die konvulsive Dosis von Pilocarpin bei Mäusen verringern könnte, liefert eine Studie von SHALDUBINA et al. (2007). Nach Applikation von 200 mg/kg Pilocarpin ohne LiCl-Vorbehandlung entwickelte keine der untersuchten knockout- sowie Wildtyp-Mäuse (B6-Hintergrund) einen SE. Ebenso konnten keine limbischen Anfälle nach Injektion von 100 mg/kg Pilocarpin nach einer Vorbehandlung mit 3 mEq/kg LiCl beobachtet werden. Jedoch präsentieren alle untersuchten Mäuse nach Applikation von 10 mEq/kg LiCl in Kombination mit 100 mg/kg Pilocarpin Krampfanfälle. In Studie 1 der vorliegenden Arbeit wurde eine Dosierung von 3 mEq/kg LiCl gewählt, weil dies die übliche Dosierung bei Ratten (JOPE et al. 1986; CLIFFORD et al. 1987; BERSUDSKY et al. 1993; BERSUDSKY et al. 1994; MARCHI et al. 2009) sowie bei Mäusen (MAZARATI et al. 2004; LI et al. 2008) darstellt. Eine weitere mögliche Ursache, welche zu der Tatsache führen könnte, dass eine Vorbehandlung mit LiCl bei den untersuchten NMRI-Mäusen die konvulsive Dosis von Pilocarpin nicht verringern konnte, könnte die Wahl des Applikationszeitpunkts von LiCl 15-19 Stunden vor Pilocarpin-Injektion sein. Eine Studie (O'DONNELL u. GOULD 2007) stellt dar, dass die Länge der Zeit zwischen LiCl- und PilocarpinApplikation eine bedeutsame Rolle spielt. Bei Ratten kann sogar eine solch geringe 138 Diskussion Dosis wie 0,5 mEq/kg von LiCl einen SE induzieren, wenn es volle 24 Stunden vor Pilocarpin-Injektion verabreicht wird. Hinsichtlich der verhaltensphysiologischen wie auch histologischen Charakterisierung des LiCl-Pilocarpins- zum Pilocarpin-Modell in Studie 1 konnten keine Unterschiede zwischen LiCl-vorbehandelten und nicht vorbehandelten Tieren detektiert werden. CLIFFORD et al. (1987) verglichen beide Modelle bei Ratten und fanden heraus, dass bei Ratten die Syndrome in Bezug auf Verhalten, Metabolismus, EEG sowie in neuropathologischer Hinsicht sowohl im alleinigen Pilocarpin-, als auch im LiCl-Pilocarpin-Modell nicht voneinander zu differenzieren sind. Dies geht konform mit den Beobachtungen in dieser Arbeit. Die Wirkungen von LiCl im LiCl-PilocarpinModell scheinen insbesondere akuter Natur zu sein. Selbst proinflammatorische Effekte von LiCl oder eine Erhöhung der Permeabilität der Blut-Hirn-Schranke (MARCHI et al. 2009) scheinen langfristig gesehen auf den Phänotyp des PilocarpinModells keine Auswirkungen zu haben. Nach Applikation von Pilocarpin wird eine Kaskade in Gang gesetzt, welche bekanntermaßen zu einer weitläufigen Neurodegeneration im Gehirn führt. Betroffen sind zahlreiche Regionen, wie beispielsweise olfaktorischer Cortex, Amygdala, Thalamus, Hippocampus, entorhinaler Cortex sowie Neocortex (CURIA et al. 2008). Aus diesem Grund scheint es nicht verwunderlich, dass die infolge der Pilocarpinapplikation induzierte Kaskade bereits von sich aus einen ausgeprägten Neuronenverlust ergibt, so dass etwaige Langzeiteffekte von LiCl vollkommen überlagert werden würden. 6.2 Verhaltensphysiologische und histologische Charakterisierung von (LiCl-) Pilocarpin-behandelten NMRI- (Studie 1) sowie B6-Mäusen (Studie 3) ohne SE In Studie 1 wurden ferner Pilocarpin-behandelte NMRI-Mäuse ohne SE verhaltensphysiologisch wie auch histologisch charakterisiert. Es konnten jedoch keine signifikanten Unterschiede zu Kontrollen detektiert werden. Eine Ausnahme bildeten die LiCl-Pilocarpin-behandelten Tiere ohne SE im Open-Field, denn die Verweildauer im Zentrum stellte sich signifikant erhöht dar. In Studie 3, der verhaltensphysiologischen Charakterisierung von Pilocarpin-behandelten B6- Mäusen, konnten einige wenige Effekte einer Pilocarpin-Behandlung ohne 139 Diskussion Ausprägung eines SE festgestellt werden. Dies zeigt, dass entweder die Applikation von Pilocarpin, die Ausprägung von einzelnen Anfällen oder eine Kombination aus beiden Faktoren leichte Verhaltensauffälligkeiten beim Mausstamm B6 bewirken kann. So präsentierten Pilocarpin-injizierte B6-Mäuse ohne SE im Open-Field eine im Vergleich zu Kontrollen signifikant erhöhte Lokomotion. Die epileptischen Mäuse wiesen allerdings eine noch höhere Aktivität als die Pilocarpin-behandelten Tiere ohne SE auf. Auch bezüglich des Aufrichtverhaltens im Open-Field zeigten sich Unterschiede, denn dies war bei den Pilocarpin-behandelten Mäusen ohne SE im Vergleich zu den epileptischen Tieren erhöht. Analog zur Steigerung des Aufrichtverhaltens im Open-Field, zeigte sich bei Pilocarpin-injizierten Tieren ohne SE ein erhöhtes Auftreten von Head-Dips im Hole-Board-Test. Bezüglich der Absolvierung der übrigen Verhaltenstests konnten die Pilocarpin-behandelten Tiere ohne SE nicht von den Kontrollen differenziert werden. Histologisch konnten sowohl bei Pilocarpin-injizierten Mäusen ohne SE des Stammes NMRI sowie B6 keine Unterschiede zu den Kontrollen detektiert werden. Eine Ausnahme bildete in Studie 3 eine signifikant erhöhte Bewertung der Subregion CA 1 nach Beurteilung mittels Scoring-Systems, jedoch ist zu sagen, dass der Score lediglich einen Wert zwischen 0 und 0,5 aufwies. Ferner konnte dieser Effekt mittels des Auszählens von Neuronen nicht bestätigt werden. Wir vermuteten, dass eventuell der Zeitpunkt (5 Monate nach SE bei NMRI- sowie 4 Wochen bzw. 9 Monate nach SE bei B6-Mäusen) zu spät gewählt ist, um subtile histologische Veränderungen detektieren zu können, welche die alleinige Applikation von Pilocarpin mit der Ausprägung einzelner Anfälle, jedoch keines SE, verursachen könnte. Einen Hinweis bildet eine Studie von BENGZON et al. (1997), welche nachweisen konnte, dass bereits ein einzelner Anfall Neurodegeneration verursachen kann. So führte bei Ratten eine einzige elektrische Stimulierung der hippocampalen CA 1-Subregion, welche lediglich eine fokale epileptiforme Aktivität von 80 s verursachte, zu einem signifikanten Anstieg von apoptotischen Neuronen im Gyrus dentatus. Nachgewiesen werden konnte dies mittels TUNEL-Markierung für apoptotische Zellen. Dieser Effekt konnte nur zu einem Zeitpunkt von 5 Stunden nach Stimulation gezeigt werden. 140 Diskussion Aufgrund der Studie von BENGZON et al. (1997), applizierten wir erneut NMRIMäusen Pilocarpin als Bolus in einer Dosierung zwischen 250-350 mg/kg. Es erwies sich jedoch als schwierig, Tiere mit möglichst vielen Anfällen zu generieren, da diese, sobald sie mehrere Krampfanfälle entwickelten, auch einen SE erreichten. So ergab sich lediglich ein Tier mit einem Einzelkrampf nach Pilocarpin. Die übrigen Tiere, welche Pilocarpin erhielten, aber keinen SE entwickelten, zeigten keine Einzelkrämpfe. Die Mäuse wurden 5 Stunden, 24 Stunden, 48 Stunden sowie 7 Tage nach SE dekapitiert und die Gehirnschnitte mittels FJC gefärbt. Die histologischen Schnitte der Pilocarpin-injizierten Tiere ohne SE ließen zu keinem der untersuchten Zeitpunkte, weder im Gyrus dentatus, noch in übrigen Hirnregionen degenerierende Neuronen erkennen, d.h. sie differierten nicht von den Kontrollen. Es kann vermutet werden, dass die Methode der FJC-Färbung nicht sensitiv genug für die Detektierung solch subtiler Effekte ist, auch wenn eine Studie (WANG et al. 2008) zeigt, dass die meisten der FJC-positiven Zellen Immunreaktivität hinsichtlich des Cytochrom-C, der Caspase-9 und vor allem der aktivierten Caspase-3 ausprägen, so dass bei FJCpositiven degenerierenden Neuronen ein apoptotischer Mechanismus angenommen werden kann. Einen weiteren Unterschied zur Studie von BENGZON et al. (1997) bildet, dass ein Einzelkrampf nach einem chemischen Konvulsivum wie Pilocarpin anders vermittelt wird, als eine einmalige elektrische Stimulation mittels Kindling. 6.3 FJC-Färbung der histologischen Schnitte der Pilocarpin-behandelten NMRI(Studie 1) sowie B6-Mäuse (Studie 3) mit SE Die Gehirnschnitte der untersuchten chronisch epileptischen NMRI-Mäuse wiesen FJC-gefärbte Zellen in unterschiedlichem Ausmaß auf, je nach Zeitpunkt nach SE. 7 Tage nach SE konnten vereinzelt degenerierende Neuronen detektiert werden, das Maximum lag bei 24 und 48 Stunden nach SE. Dies lässt sich mit einer Studie von WANG et al. (2008) vereinbaren, welche einen Zeitverlauf der Degenerierung von Neuronen mittels FJC nach Pilocarpin-induziertem SE bei Mäusen des Stammes Kunming darstellen. Sie fanden zwar ein maximales Auftreten von degenerierenden Neuronen 12 Stunden nach SE, untersuchten danach aber erst wieder den Zeitpunkt 3 Tage nach SE, in welchem der Anteil an degenerierenden Neuronen etwas 141 Diskussion geringer lag als nach 12 Stunden. Analog zu dieser Studie fanden auch wir bei Pilocarpin-behandelten Tieren mit SE degenerierende Neuronen im Hippocampus, im Cortex wie auch in Kernen der Amygdala sowie des Thalamus. Dies repräsentiert die nach Pilocarpin auftretende weitläufige Degeneration neuronaler Strukturen. 7 Tage nach SE ergaben sich für die histologischen Schnitte der untersuchten NMRIMäuse nur noch vereinzelt degenerierende Neuronen. Auch dies geht konform mit der Studie von WANG et al. (2008), in welcher gleichfalls ab 7 Tagen die Anzahl der FJC-markierten Zellen stark abnahm. Ab einem Zeitpunkt von 7 Tagen nach SE hingegen entdeckten wir sowohl bei NMRI- (Studie 1), als auch bei B6-Mäusen (Studie 3) zwei Zelltypen, welche mittels FJC schwächer angefärbt wurden als degenerierende Neuronen. Es konnten einerseits längliche Zellen mit wenigen Fortsätzen sowie andererseits sternförmige Zellen mit vielen Fortsätzen detektiert werden. Aufgrund dieser beschriebenen Morphologie sowie der Lokalisation kann von radialer Glia sowie hypertrophierten Astrozyten ausgegangen werden. SCHMUED (1997) stellt die FJC-Färbung als selektiven Marker für degenerierende Neuronen vor. In einer späteren Studie (SCHMUED et al. 2005) jedoch erläutert er, dass in den Gehirnschnitten von Kainat-behandelten Ratten in einigen Regionen mit weitläufiger neuronaler Degeneration, wie beispielsweise dem Hippocampus, hypertrophierte Astrozyten manchmal mit FJC markiert wurden. Diese Anfärbung ist weniger intensiv als bei degenerierenden Neuronen. Dies trifft exakt unsere Beobachtungen. Nach Färbung mittels des Astrozytenmarkers GFAP ließen sich Zellen der oben beschriebenen Morphologie darstellen. BORGES et al. (2006) beschrieben eine Degeneration sowie Proliferation von Astrozyten im Gyrus dentatus von Mäusen nach einem Pilocarpin-induziertem SE. Ferner induzierten Pilocarpininduzierte Krampfanfälle eine Überexpression von GFAP in Astrozyten (BORGES et al. 2006). Eine Hypertrophie von Astrozyten im Kainat-Modell für TLE wurde in weiteren Studien beschrieben (NADLER et al. 1980; NITECKA et al. 1984; NIQUET et al. 1994). Radiale Glia stellen multifunktionale Progenitorzellen dar, die sich zu Neuronen oder zu Astrozyten entwickeln können (SERI et al. 2001; SERI et al. 2004). Drei Tage nach Kainat-induziertem SE ließ sich eine Proliferation von radialer Glia mittels 142 Diskussion GFAP-Markierung darstellen (HÜTTMANN et al. 2003). In einer Studie von BORGES et al. (2006) wurde radiale Glia mit GFAP nach Pilocarpin-induziertem SE nachgewiesen. Unserem Wissen nach ist die Detektierung von radialer Glia nach Pilocarpin-induziertem SE mittels FJC-Färbung, wie sie in dieser PhD-Arbeit beschrieben wurde, neu. 6.4 Bewertung der histologischen Schnitte der chronisch epileptischen NMRI(Studie 1) sowie B6-Mäuse (Studie 3) in Thionin-Färbung Wie erwartet ergab sich bei der Bewertung der Gehirnschnitte von epileptischen NMRI- sowie B6-Mäusen in der Übersichtsfärbung Thionin eine signifikant erhöhte Neurodegeneration im Vergleich zu den Kontrollen. Auffällig war jedoch die Tatsache, dass B6-Mäuse zwar im Hilus einen zu NMRI-Mäusen vergleichbaren Neuronenverlust aufwiesen, in sonstigen Regionen aber wesentlich weniger stark von Neurodegeneration betroffen waren, als die untersuchten NMRI-Mäuse in Studie 1. Dies könnte auf eine erhöhte Resistenz von B6-Mäusen hinsichtlich experimentell induzierter Krampfanfälle zurückzuführen sein (FERRARO et al. 2004), wie beispielsweise im MEST-Test gezeigt wurde (FERRARO et al. 1998; FERRARO et al. 2002). B6-Mäuse zeigten sich ferner nach systemischer Applikation von Kainat resistent gegenüber neurodegenerativen Veränderungen (SCHAUWECKER u. STEWARD 1997). Passend zu unseren Beobachtungen stellt eine weitere Studie (MOHAJERI et al. 2004) dar, dass B6-Mäuse im Vergleich zu Mäusen des Stammes FVB auch im Pilocarpin-Modell eine weniger ausgeprägte Neurodegeneration aufweisen. Insbesondere die Subregionen CA 1 sowie CA 3 des Hippocampus erwiesen sich bezüglich der Neurodegeneration als relativ resistent. SHIBLEY und SMITH (2002) hingegen stellen dar, dass sich für B6-Mäuse nach Pilocarpininduziertem SE eine geringere neuronale Dichte im Hilus des Gyrus dentatus, sowie eine geringere Dichte von Pyramidenzellen in den Subregionen CA 1 und CA 3c des Hippocampus ergab. 143 Diskussion 6.5 Detektierung von spontanen epileptischen Anfällen bei NMRI- (Studie 1) sowie B6-Mäusen (Studie 3) Bei allen Pilocarpin-behandelten Mäusen mit SE aus Studie 1 des Stammes NMRI, sowie aus Studie 3 des Stammes B6 konnte mindestens ein spontaner Anfall detektiert werden. Dies lässt als Rückschluss zu, dass ein 90-minütiger SE zu einer 100%-Entwicklung von chronischer Epilepsie führt. Konform zu unseren Beobachtungen zeigen auch andere Studien (SHIBLEY u. SMITH 2002; CHEN et al. 2005), dass Mäuse in den folgenden Wochen nach SE spontane wiederkehrende Anfälle entwickeln. 6.6 Vergleich der Verhaltensabweichungen von epileptischen B6- (Studie 3) zu NMRI-Mäusen aus Studie 1 sowie aus GRÖTICKE et al. (2007) Bei den verhaltensphysiologischen Untersuchungen in Studie 1 ergaben sich für die epileptischen NMRI-Mäuse Auffälligkeiten, welche den Resultaten von GRÖTICKE et al. (2007) entsprachen: Die epileptischen NMRI-Mäuse präsentierten Angstassoziiertes Verhalten im Open-Field, jedoch nicht im Elevated-Plus-Maze. Im Morris-Water-Maze zeigten sich Lern- und Gedächtniseinbußen. Auch die bei epileptischen NMRI-Mäusen signifikant verringerte Immobilitätszeit sowohl im Porsolt-Test, als auch im Tail-Suspension-Test, konnte in dieser Arbeit reproduziert werden. Die Hypothese, dass epileptische Mäuse des Stammes B6 analog zu den detektierten Verhaltensänderungen bei NMRI Abweichungen aufweisen, welche sich in einer Verhaltensbatterie darstellen lassen, konnte bestätigt werden. Ein Vergleich der Gesamtheit aller absolvierten Tests zwischen epileptischen NMRI- (GRÖTICKE et al. 2007) sowie B6-Mäusen stellt Tabelle 6.1 dar. Bei der Eingangscharakterisierung, dem Irwin-Test, ergab sich für epileptische B6Mäuse eine reduzierte Lokomotion, welche auch bei NMRI-Mäusen auftrat. Angstassoziiertes Verhalten prägte sich bei den untersuchten zwei Mausstämmen unterschiedlich aus: Während die epileptischen NMRI-Mäuse aufgrund von FreezingVerhalten auffielen, zeigten epileptische B6-Mäuse eine erhöhte Schreckhaftigkeit, 144 Diskussion welche sich durch abruptes Hochspringen nach präsentierten Objekten oder Berührung auszeichnete. Bei den motorischen Tests konnten bei beiden untersuchten Mausstämmen ähnliche Resultate detektiert werden. Epileptische Mäuse beider Stämme absolvierten den Rotarod-Test ohne Schwierigkeiten. Im Hanging-Wire-Test traten bei epileptischen NMRI- sowie bei epileptischen B6-Mäusen signifikante Defizite auf. Dies verdeutlicht die Notwendigkeit von mehreren Tests innerhalb einer Verhaltensdomäne. Da die Gleichgewichtsfähigkeiten und die Koordination bei den epileptischen Tieren aufgrund der erfolgreichen Absolvierung des Rotarods offenbar gut funktionieren, scheinen die Einbußen im Hanging-Wire-Test entweder auf motorischen Defiziten der Greiffunktion (Muskelkraft) oder auf einer verminderten Motivation der epileptischen Mäuse zu beruhen, sich über 60 s kopfüber an einem Gitter festzuhalten. Ein weiterer Hinweis könnte sein, dass epileptische Mäuse im ElevatedPlus-Maze sowie im Hole-Board-Test ein erhöhtes Absprungverhalten von der Versuchsapparatur aufwiesen. Dies wird üblicherweise mit Impulsivreaktionen erklärt (HOLMES et al. 2000), wie sie auch bei Patienten mit einer Panikstörung vorkommen können, und in Zusammenhang mit einer verminderten Fähigkeit der Amygdala zu stehen scheinen, Angst-auslösende Situationen adäquat zu bewerten. Panikattacken zählen zu den Komorbiditäten bei Epilepsien (ALVAREZ-SILVA et al. 2006). Ferner wurden bei Patienten der TLE und iktalen Angstsymptomen kleinere Volumina der Amygdala gefunden (BEYENBURG 2005). So könnte auch ein „Herunterstürzen“ vom Gitter des Hanging-Wire-Tests eine Art Impulsivreaktion darstellen. Der Chimney-Test, das rückwärtige Herausklettern aus einer Röhre, stellte für nahezu alle B6-Mäuse, unabhängig davon, welcher Versuchsgruppe sie angehörten, eine außerordentliche Schwierigkeit dar. Es scheint ein stammspezifisches Problem zu sein, dass die B6-Mäuse nicht freiwillig in die Versuchsröhre laufen, da die NMRIMäuse diesen Test erfolgreich absolvierten (GRÖTICKE et al. 2007). Auffällig bei B6- im Gegensatz zu NMRI-Mäusen ist das Auftreten von erhöhter Aktivität in mehreren Verhaltenstests (Open-Field, Elevated-Plus-Maze, Hole-BoardTest sowie Novel-Object-Exploration-Test). Hier scheint eine Differenz zwischen verschiedenen Mausstämmen vorzuliegen. 145 CRAWLEY (1997) stützt diese Diskussion Beobachtung, denn sie beschreibt, dass Mäuse der C57-Inzuchtstämme, hierzu zählt auch die B6-Maus, generell eine hohe Aktivität im Open-Field präsentieren, so dass dies die Grundlage für die Hyperaktivität der epileptischen Tiere bilden könnte. Hyperaktivität stellt insbesondere bei Kindern mit Epilepsien eine bedeutende Komorbidität dar. Die Prävalenz von Hyperaktivität bei Epilepsie-erkrankten Kindern liegt um mindestens 20% höher als bei nicht-epileptischen Kindern (KAUFMANN et al. 2009). Dies stellt einen Vorteil des Pilocarpin-Modells bei der B6- im Vergleich zur NMRI-Maus dar, welche in der verhaltensphysiologischen Charakterisierung keine Hyperaktivität aufwies (GRÖTICKE et al. 2007). Auch Ratten präsentierten eine erhöhte lokomotorische Aktivität in der chronischen Phase ihrer Epilepsie im OpenField-Test sowie im Elevated-Plus-Maze (BRANDT et al. 2006). Lediglich in der Light-Dark-Box wiesen die epileptischen B6-Mäuse eine reduzierte Aktivität auf. Dies lässt sich jedoch vermutlich auf die Tatsache zurückführen, dass die Tiere sich zu Beginn des Versuchs rasch in das dunkle Kompartment der Versuchsapparatur bewegten, und sich nur selten in den offenen Bereich wagten. Die Kamera kann die Bewegungen der Tiere im dunklen, geschlossenen Bereich nicht detektieren, so dass nicht gesagt werden kann, ob sich die Tiere im geschlossenen Kompartment bewegten, und falls dies der Fall ist, in welchem Ausmaß. Im Open-Field-Test wiesen epileptische B6-Mäuse ferner Angst-assoziiertes Verhalten auf, welches sich in einer erhöhten Aufenthaltsdauer am Rand der Arena sowie durch reduziertes Aufrichtverhalten darstellt. Diese Ergebnisse ergaben sich auch für die untersuchten NMRI-Mäuse (GRÖTICKE et al. 2007). Die epileptischen NMRI-Mäuse wiesen im Hole-Board-Test Angst-assoziiertes Verhalten sowie eine geringere Exploration auf, da ihre Head-Dip-Frequenz im Vergleich zu den Kontrollen signifikant reduziert war. Epileptische B6-Mäuse zeigten dieses Verhalten nicht, für sie ergab sich hingegen eine erhöhte Anzahl der EdgeDips, welche bei den epileptischen NMRI-Mäusen nicht detektiert werden konnte. Dies könnte mit der erhöhten Absprungrate bzw. Klettern von der Versuchsapparatur des Hole-Board-Tests verbunden sein, welches ein Problem bei der Absolvierung des Versuchs bei den epileptischen B6-Mäusen darstellte. 146 Diskussion In der Light-Dark-Box konnte bei den epileptischen B6-Mäusen Angst-assoziiertes Verhalten nachgewiesen werden, da sie signifikant weniger Zeit im aversiven, offenen Bereich sowie vermehrt Zeit im dunklen, geschlossenen Kompartment verbrachten. Ferner zeigte sich eine Reduzierung der Übertritte zwischen beiden Kompartments, welche ebenso bei den untersuchten NMRI beobachtet werden konnte (GRÖTICKE et al. 2007). Im Elevated-Plus-Maze konnte bei keinem der beiden Stämme Angst-assoziiertes Verhalten nachgewiesen werden. Da dies in den übrigen Angst-assoziierten Tests der Fall war, liegt hier vermutlich ein testspezifisches Problem des Elevated-PlusMaze vor. KOMADA et al. (2008) äußern, dass Elevated-Plus-Maze und Light-DarkBox zwar beide verwendet werden, um Angst-assoziiertes Verhalten zu bewerten, jedoch nicht zwingend dieselben Resultate hervorbringen. Im Novel-Object-Exploration-Test ergaben sich interessante Unterschiede der B6- zu den NMRI-Mäusen: Während die Habituationsphase bei B6-Mäusen zum Open-Field vergleichbare Resultate hervorbrachte, d.h. die epileptischen Mäuse zeigten aufgrund einer erhöhten Aufenthaltsdauer am Rand der Arena Angst-assoziiertes Verhalten sowie eine Hyperaktivität, ergab sich für die Objektphase das exakte Gegenteil. Die epileptischen B6 zeigten in der Objektphase eine so häufige Annäherung an das neue Objekt, dass die Aufenthaltsdauer im Zentrum in der Objektphase signifikant erhöht war. Die epileptischen NMRI-Mäuse hingegen mieden ein neu präsentiertes Objekt, da sie in der Objektphase eine längere Zeitdauer am Rand des Open-Field verbrachten. Hier scheint eine bedeutende Rolle zu spielen, dass es sich um unterschiedliche Mausstämme handelt. Dass verschiedene Mausstämme unterschiedlich im Novel-Object-Exploration-Test reagieren, zeigt eine Studie (VAN GAALEN u. STECKLER 2000), in welcher naive Mäuse des Stammes A/J ein neues Objekt mieden, wohingegen B6-Mäuse sich dem präsentierten Objekt annähern. Dies können wir nicht bestätigen, da die Kontrollen sich zwar dem Objekt näherten, aber bei weitem nicht solch ein großes Interesse zeigten, wie die epileptischen Tiere. Zu unseren Resultaten passt vielmehr eine Studie von KIM et al. (2005), welche sich ebenfalls mit Unterschieden in der Annäherung von verschiedenen Mausstämmen bezüglich neuen Objekten befasst. Es wird zwischen 147 Diskussion primärer und sekundärer Annäherung an neue Objekte differenziert, letztere wird als Verspieltheit der Tiere gewertet. Während sich für BALB/cJ und DBA/2J-Mäuse beide Annäherungsarten ergaben, zeigten die übrigen gestesteten Mausstämme, wie B6J, lediglich primäres Explorationsverhalten. Dies trifft auf unsere Resultate zu, da die B6-Kontrolltiere das neue Objekt zwar explorierten, nach einiger Zeit jedoch kein sonderlich großes Interesse mehr aufwiesen. Lediglich die epileptischen B6-Mäuse explorierten das Objekt über die gesamte Dauer der Objektphase. Im Morris-Water-Maze ergab sich für die epileptischen Mäuse beider Stämme eine reduzierte Lern- und Gedächtnisleistung. Es konnte in einer Studie (LOGUE et al. 1997) gezeigt werden, dass hippocampale Läsionen bei B6-Mäusen zu einer beeinträchtigten Absolvierung des Morris-Water-Mazes führen können. Gleichfalls können Lern- und Gedächtnisdefizite im Morris-Water-Maze auch bei nichtepileptischen Tieren, wie z.B. bei P311-knock-out-Mäusen, eines Proteins, welches insbesondere im Hippocampus exprimiert wird (TAYLOR et al. 2008) oder bei Adenosin Rezeptor 1-knock-out-Mäusen (WILCOXON et al. 2007) auftreten. Üblicherweise gilt die aufgrund des Pilocarpin-induzierten SE massive Neurodegeneration, unter anderem im Hippocampus, als verantwortlich für die kognitiven Defizite. Es scheint überraschend, dass bei den epileptischen B6-Mäusen, deren Gehirnschnitte weniger Neuronenverlust aufweisen als die histologischen Schnitte der NMRI-Mäuse, eine ähnlich hohe kognitive Beeinträchtigung auftritt. Es kann infolgedessen angenommen werden, dass weitere Gründe als nur die Neurodegeneration im Hippocampus eine wichtige Rolle spielen könnten. Gestützt werden unsere Beobachtungen ferner durch die Ergebnisse der Studie von GRÖTICKE et al. (2007): Die Gehirnschnitte von NMRI-Mäusen mit einer lediglich 60-minütigen SE-Länge wiesen einen deutlich geringeren Neuronenverlust auf als Tiere mit einer SE-Länge von 90 oder 120 Min.. Dennoch vermochten auch die Mäuse mit 60-minütiger SE-Länge den Morris-Water-Maze-Test nicht erfolgreich zu absolvieren. MOHAJERI et al. (2003) wiesen mittels ihrer Untersuchungen nach, dass räumliches Lernvermögen im Morris-Water-Maze bei der F1-Generation von Hybrid-Mäusen (B6 x FVB) mit milden Anfällen nicht beeinträchtigt ist. Mäuse mit 148 Diskussion schwerem Krampfgeschehen hingegen konnten die Morris-Water-Maze-Aufgabe nicht erfüllen. Ein offensichtliches Merkmal bei der Absolvierung des Morris-Water-Mazes sowie des Open-Fields sowohl bei den untersuchten epileptischen NMRI-Mäusen aus Studie 1, als auch bei den epileptischen B6-Mäusen aus Studie 3, stellt das Auftreten von Thigmotaxis dar. Thigmotaxis bedeutet, dass viele epileptische Tiere über die gesamte Versuchsdauer lediglich entlang des Randes der Versuchsapparatur schwimmen oder laufen und gilt als Hinweis für Angst-assoziiertes Verhalten bei Nagern (SIMON et al. 1994; WILCOXON et al. 2007; BONSIGNORE et al. 2008). Dieses Verhalten kann mittels anxiogener Substanzen induziert, sowie mittels anxiolytischer Substanzen reduziert werden (SIMON et al. 1994). So scheinen bei der stark beeinträchtigten Absolvierung des Morris-Water-Maze von epileptischen Tieren nicht nur Lern- und Gedächtnisdefizite, sondern auch Angst-assoziiertes Verhalten eine wichtige Rolle zu spielen. Bei den Verhaltenstests, welche Depressions-assoziiertes Verhalten überprüfen, ergaben sich sowohl für epileptische NMRI-, als auch für epileptische B6-Mäuse dieselben Resultate, denn die epileptischen Tiere beider Mausstämme entwickelten sowohl im Tail-Suspension-Test, als auch im Porsolt-Test eine signifikant verringerte Immobilitätsdauer. Regulär werden diese beiden Tests als Screening-Tests für antidepressiv wirkende Substanzen verwendet (PORSOLT et al. 1977), d.h. nach vorheriger Applikation von Antidepressiva kann die Aktivitätsphase der Tiere im Verhältnis zur Immobilitätsphase deutlich verlängert werden. Dass die epileptischen Tiere im Vergleich zu den Kontrollen eine verlängerte Aktivitätsphase aufwiesen, sollte keineswegs als eine Art „antidepressives Verhalten“ der epileptischen Tiere gewertet werden. Analog zur Studie von CRYAN et al. (2005) wird in den Verhaltenstests zur Überprüfung von Depressions-assoziiertem Verhalten bewertet, wie die Fähigkeit eines Tieres ausgeprägt ist, mit einer ausweglosen Stresssituation umzugehen. Während die Kontrollen nach einiger Zeit der Fluchtversuche verstehen, dass sie nicht entkommen können, und infolgedessen eine reglose Körperhaltung einnehmen, scheinen die epileptischen Tiere den Kontext der Situation nicht zu begreifen, und vermindern infolgedessen ihre Fluchtbemühungen nicht (GRÖTICKE 149 Diskussion et al. 2007, 2008). Ursachen hierfür könnten die detektierten Lerndefizite und erhöhtes Angstverhalten der Mäuse sein. Ein spezifisches Problem des Tail-Suspension-Tests stellte dar, dass es in Studie 3 nicht wenigen B6-Mäusen gelang, der Testsituation zu entkommen und auf die horizontale Stange der Versuchsapparatur zu klettern. Dies betraf insbesondere die Kontrollgruppe, in welcher 50% der B6-Mäuse aus dem Versuch ausgeschlossen wurden, da sie wiederholt auf die Stange klettern konnten. Eine Studie (MAYORGA u. LUCKI 2001) beschreibt dieses Verhalten der Tiere im Tail-Suspension-Test als ein stammspezifisches Problem für B6-Mäuse. Keine der getesteten Mäuse der Stämme DBA/2J sowie 129-SV-ter zeigte dieses Kletterverhalten. Bei Mäusen des Stammes A/J betraf es lediglich 18% der untersuchten Tiere. Bei B6N-Mäusen (Harlan) dagegen kletterten 35%, bei B6J-Mäusen (JAX) sogar 70% entlang ihrer Schwänze auf die horizontale Stange der Versuchsaufbauten. Dies geht konform mit unseren Beobachtungen bei B6-Mäusen. Von den untersuchten NMRI aus Studie 1 mussten lediglich eine von 10 Kontrolltieren (10%) sowie 3 von 11 epileptischen Tieren (27%) aus dem Versuch aufgrund von Hochkletterns ausgeschlossen werden. 150 Diskussion Test Auffälligkeiten von Pilocarpin-behandelten Tieren mit SE vs. Kontrollen Motorische Fähigkeiten Irwin-Test NMRI B6 Rotarod-Test NMRI B6 Normal Hanging-Wire NMRI B6 Open-Field NMRI B6 Beeinträchtigt Locomotion Explorationsverhalten Angstassoziiertes Verhalten Ja (freezing) Reduziert Reduziert Reduziert Normal Ja (Schreckhaftigkeit) Reduziert (rearing) Reduziert (rearing) Reduziert Ja Erhöht (EdgeDips) Nein Depressionsassoziiertes Verhalten Lernen und Gedächtnis Normal Beeinträchtigt Normal Erhöht Hole-Board NMRI B6 Reduziert Erhöht Normal Elevated-PlusMaze NMRI B6 Light-Dark-Box NMRI B6 Novel-ObjectExploration NMRI B6 Ja Ja (Head-Dips) Nein Erhöht Reduziert Reduziert Nein Ja (freezing) Reduziert Reduziert Ja Normal Reduziert Ja Erhöht Erhöht Nein Normal Erhöht Normal Erhöht TailSuspension NMRI B6 Normal Erhöht Normal Normal Morris-WaterMaze NMRI B6 Normal Reduziert ? (Thigmotaxis) Beeinträchtigt Normal Reduziert ? (Thigmotaxis) Beeinträchtigt Porsolt-Test NMRI B6 Nein, aber reduzierte Immobilität Nein, aber reduzierte Immobilität Nein, aber reduzierte Immobilität Nein, aber reduzierte Immobilität 151 Diskussion Tab. 6.1: Übersicht über die Verhaltensauffälligkeiten von chronisch epileptischen Mäusen nach Pilocarpin-induziertem SE. Die Daten der NMRI-Mäuse stammen aus GRÖTICKE et al. (2007), die B6Daten aus dieser PhD-Arbeit. 6.7 Substammes- sowie Sublinienunterschiede bei B6 im Pilocarpin-Modell (Studie 2) Die Resultate der Studie 2 verdeutlichen, dass hinsichtlich des Konvulsivums Pilocarpin sowohl Substammes-, als auch Sublinienunterschiede innerhalb eines Substammes bestehen. Analog zu einer kürzlich veröffentlichten Arbeit von MEKADA et al. (2009) werden Substämme als Abzweigungen eines Inzuchtstammes definiert, von welchen entweder bekannt ist oder vermutet wird, dass sie vom ursprünglichen Inzuchtstamm genetisch differieren. Dies lässt sich auf folgende Gegebenheiten zurückführen: Als erstes sind Substämme zu nennen, welche nach mindestens 20, jedoch höchstens 40 Generationen einer Inzucht separieren. Zweitens Substämme, welche mehr als 20 Generationen von einem gebräuchlichen Ahnenstamm separieren, sowie drittens genetische Unterschiede zwischen Substämmen. Voneinander differierende Substämme eines Mausstammes wurden bereits bezüglich anderer Parameter beschrieben. Die Absolvierung des Morris-Water-Maze steht in einem hohen Abhängigkeitsgrad zum genetischen Hintergrund der Mausstämme sowie des verwendeten Substammes, denn innerhalb der 129-InzuchtMausstämme zeigten beispielsweise die Substämme 129S2/Sv, 129S6/SvEv sowie 129/Ola eine gute, dagegen der Substamm 129X1/SvJ eine schlechte Performance (SCHIMANSKI u. NGUYEN 2004). Auditorisch-evozierte-Potenziale unterschieden sich zwischen DBA/2J und DBA/2Hsd-Mäusen (CONNOLLY et al. 2003). Bezüglich Vergleichen zwischen verschiedenen Substämmen von B6-Mäusen finden sich folgende Studien in der Literatur: STIEDL et al. (1999) stellen mittels ihrer Untersuchungen dar, dass sich B6J sowie B6N-Mäuse hinsichtlich Kontext- sowie Ton-abhängiger Angstkonditionierung voneinander unterschieden. Die Hypothese von SIEGMUND et al. (2005), dass als Ursache hierfür die Expression des αSynuclein verantwortlich sein könnte, bestätigte sich nicht. Jedoch konnten die Substammesunterschiede zwischen B6J, B6N sowie einem dritten getesteten Substamm, B6JOla, reproduziert werden (SIEGMUND et al. 2005). Auch nach 152 Diskussion RADULOVIC et al. (1998) differierten B6J- und B6N-Mäuse bezüglich Angstkonditionierung. In einer Studie von VAN GAALEN u. STECKLER (2000) ergaben sich für B6J- (JAX) sowie B6CR-Mäuse (Charles River) keine Unterschiede hinsichtlich der lokomotorischen Aktivität im Open-Field sowie im Elevated-PlusMaze. Bei der Absolvierung der Light-Dark-Box wiesen B6J im Vergleich zu B6CR eine erhöhte Anzahl an Eintritten in das helle Kompartment auf. GROTTICK et al. (2005) fanden signifikante Unterschiede bezüglich Präpulsinhibition zwischen B6Jund B6NHsd-Mäusen. BOTHE et al. (2004) definierten lediglich 12 Mikrosatelliten, welche sich zwischen B6J- und B6NTac-Mäusen unterschiedlich ausprägten. Infolgedessen nahmen sie an, dass beide Substämme verhaltensphysiologisch nicht voneinander differenzierten, und konnten dies mittels der durchgeführten Experimente Rotarod, Open-Field sowie Angstkonditionierung nachweisen. BRYANT et al. (2008) weisen auf die Tatsache hin, dass zwischen B6-Substämmen einfache Sequenz-Längen-Polymorphismen, Single-Nukleotid-Polymorphismen sowie Copynumber-Variants bestehen. Sie entdeckten Unterschiede zwischen B6J-, B6NCrl-, B6NTac- und B6NHsd-Mäusen bezüglich motorischer Koordination (Rotarod-Test), Schmerzsensitivität sowie Angstkonditionierung (BRYANT et al. 2008). Eine Studie (JAMOT et al. 1994) beschreibt, dass sich B6JNmg-Mäuse vom parentalen Stamm B6J hinsichtlich ihrer Lernfähigkeit im Radial-Maze unterschieden. Ferner differierten männliche Mäuse der Sublinien B6JNmg und B6JKun hinsichtlich ihres Aggressionsverhaltens (SLUYTER et al. 1999). Die B6-Maus ist der bekannteste und am meisten verwendete Inzuchtstamm, welcher sich vom C57-Stamm ableitet, der von C. C. Little in den zwanziger Jahren des letzten Jahrhunderts entwickelt wurde. Der Stamm B6 trennte sich nebst B10 vom C57BL-parentalen Stamm in den mittleren dreißiger Jahren des letzten Jahrhunderts. Schließlich wurden in den siebziger Jahren 9 B6-Substämme etabliert. Die Substämme B6J (Jackson Laboratory) sowie B6N (National Institut of Health) gelten als Kernsubstämme von B6, welche sich von der Ahnen-B6-Linie während der vierziger sowie fünfziger Jahre entwickelten. Charles River erhielt B6N-Mäuse vom National Institut of Health im Jahre 1974 (MEKADA et al. 2009). 153 Diskussion Single Nukleotid Polymorphismen (SNP’s) stellen die ergiebigste Klasse von genetischen Markern im Genom dar. Die Verwendung von SNP’s kann helfen, um genetisch nah verwandte Stämme sowie auch Substämme innerhalb eines Stammes, mit potenziell genetischen Unterschieden, voneinander zu differenzieren. MEKADA et al. (2009) demonstrierten mittels SNP genetische Unterschiede zwischen B6J- sowie B6N-Mäusen in 11 SNP-Loci und eine Deletion von Exons im Nnt-Gen. Auch bei Ratten können Substammes-Unterschiede aufgezeigt werden, wie in einer Studie der Arbeitsgruppe Löscher (FEDROWITZ et al. 2004) nachgewiesen wurde. Zwei Substämme von Sprague-Dawley-Ratten differierten hinsichtlich der Wirkungen einer Magnetfeldbelastung. Bezüglich Substammesunterschieden hinsichtlich der Wirkungen von Pilocarpin existiert lediglich eine Arbeit (BORGES et al. 2003), in welcher Unterschiede zwischen B6J- sowie B6NCrl-Mäusen nachgewiesen werden konnten. Lediglich 12 von 99 untersuchten B6J-Mäusen des Züchters JAX entwickelten und überlebten einen SE, dies entspricht einem prozentualem Anteil von 12%. 63 Mäuse (64%) starben während des Versuchs, die übrigen 24 Mäuse erreichten keinen SE. Konträr zu den Resultaten der B6J stellen sich die Ergebnisse der B6NCrl des Züchters Charles River dar: 15 von 26 Mäusen, d.h. 58%, erlangten und überlebten einen SE. Eine weitere Studie (CHEN et al. 2005) verdeutlicht, dass tatsächlich B6-Mäuse des Züchters Charles River eine bessere Sensitivität hinsichtlich Pilocarpin als die übrigen B6-Substämme aufzuweisen scheinen, da B6NCrl dieser Studie zu über 80% einen SE entwickelten. Diese Resultate sind vergleichbar mit unseren Beobachtungen, denn in Studie 2 erreichten 80% der von uns getesteten B6NCrlMäuse (Barriere 8) einen SE, bei den Substämmen B6NHsd sowie B6JOlaHsd nur 20% bzw. keine der untersuchten Mäuse bei einer zu den zwei genannten Studien vergleichbaren Bolusdosierung von 300 mg/kg. GLIEN et al. (2001) beschreiben die Vorteile eines fraktionierten Applikationsregimes von Pilocarpin bei Ratten. In dieser Arbeit entwickelten 70% der eingesetzten Ratten nach Bolusapplikation von 30 mg/kg einen SE, die Mortalität lag bei 45%. Nach fraktionierter Applikation von 10 mg/kg Pilocarpin alle 30 Min. stellte sich die SE- 154 Diskussion Induktionsrate nicht signifikant unterschiedlich dar. Bezüglich der Gesamtmortalität jedoch konnte eine Verminderung auf 10% verbucht werden. In Studie 2 entwickelten B6NCrl-Mäuse (Barriere 8) nach Bolusapplikation von 300 mg/kg Pilocarpin zu 80% sowie nach fraktionierter Applikation von 100 mg/kg Pilocarpin zu einem leicht erhöhten Wert von 90 % einen SE. Wir blieben bei diesem fraktionierten Applikationsregime, da es eine individuellere Pilocarpindosierung pro Tier ermöglicht. Erstaunlicherweise differierten in Studie 2 nicht nur die verschiedenen B6Substämme bezüglich Pilocarpin, sondern ferner zwei Barrieren desselben Substammes des gleichen Züchters (Charles River). Hinweise zu Sublinienunterschieden desselben Substammes existieren in der Literatur nicht. Drei verschiedene Hypothesen lassen sich zu den detektierten Sublinienunterschieden in Studie 2 aufstellen: Die detektierten Unterschiede zwischen den Substämmen könnten umweltbedingt sein. Dies bedeutet, dass die unterschiedliche Lage der Barrieren 8 und 9 in den Örtlichkeiten des Züchters Charles River, oder die Versorgung von unterschiedlichen Tierpflegern zu einem erhöhten Stresspegel bei den Mäusen in einer der Barrieren führte. Da wir den Mäusen mindestens 7 Tage Habituation gewährten, bevor wir mit den Versuchen begannen, sowie die Tierhaltung hier im Institut im gleichen Haltungsraum erfolgt, müsste dieser Stresspegel schon sehr ausgeprägt sein, um etwaige Wirkungen auf die Pilocarpinsensitivität zu zeigen. Ferner existiert eine Studie (RAE et al. 1990), in welcher verglichen wurde, ob das Verbringen von Swiss-Mäusen in eine Stresssituation unmittelbar vor Pilocarpin-Applikation einen Einfluss auf die konvulsiven Wirkungen hat. Hinsichtlich der Inzidenz, des Schweregrades, der Mortalität sowie der Dauer der Pilocarpin-induzierten Krämpfe konnten RAE et al. (1990) bei gestressten zu nicht-gestressten Mäusen keinen Unterschied aufzeigen. Dass umweltbedingte Aspekte jedoch nicht zu vernachlässigen sind, zeigt eine Studie von CRABBE et al. (1999), in welcher 6 Vehaltenstests in drei unterschiedlichen Laboratorien durchgeführt werden. Es wurde versucht, das Prozedere zu standardisieren, d.h. es wurde exakt derselbe Mausstamm, die gleichen Versuchsapparaturen sowie dieselben Versuchsprotokolle verwendet. 155 Diskussion Ferner wurden die Haltung der Tiere sowie der Zeitpunkt des Versuchsablaufs standardisiert. Dennoch ergeben sich lediglich aus den umweltbedingten Unterschieden zwischen den Laboratorien Differenzen bezüglich der Ergebnisse der Verhaltensversuche (CRABBE et al. 1999). Als zweite Hypothese könnte für die von uns detektierten Barrierenunterschiede eine spontane Mutation verantwortlich sein, welche in einer der Barrieren auftrat, und an ihre Nachkommen weitervererbt wurde. Als dritte Hypothese wäre eine Kombination aus umweltbedingten sowie genetischen Faktoren denkbar. Eine Studie (YANG et al. 2003) stellt dar, dass spontan auftretende Mutationen mit multiplen, leicht zu beobachtenden Merkmalen zu einem großen Teil zum molekularen Verständnis von neurologischen Krankheiten beigetragen haben. Diese Mutationen konnten entdeckt werden, da sie mindestens einen offensichtlichen Phänotyp hervorbrachten. Weniger offensichtliche, jedoch nicht weniger wichtige, spontane Mutationen können in Inzuchtmausstämmen entstehen und Mausstämme, welche für Mutagenese-Screens verwendet werden „kontaminieren“. Viele Inzuchtstämme, wie die B6-Maus, werden nicht von „clonalen“ Beständen aufrechterhalten, sondern stammen von verschiedenen unabhängigen reinrassigen Linien, welche von einigen Generationen separiert wurden. Forschergruppen werden aus diesen Sublinien beliefert. So kann es geschehen, dass ein Inzuchtstamm, welcher zu einer Grundlagenstudie beigetragen hat, nur Monate später nicht mehr exakt dieselbe genetische Zusammensetzung aufweist, da er aus einer anderen Sublinie stammt. Die Spontanmutationsrate wird als selten mit einem Wert von 2x10-6 Mutationen/Lokus/Generation eingeschätzt (YANG et al. 2003). Um zu eruieren, wie sich weitere B6-Barrieren des Züchters Charles River bezüglich ihrer Sensivität auf Pilocarpin verhalten, testeten wir diese ebenfalls. Wir ermittelten keine signifikanten Unterschiede zwischen den Barrieren 4, 7 und 11 sowie zur Barriere 9. Infolgedessen müsste eine etwaige Spontanmutation in Barriere 8 stattgefunden haben. Um die Hypothese einer vererbbaren Mutation in Barriere 8 zu verifizieren, generierten wir eine F1-Generation aus weiblichen Pilocarpin-sensitiven Mäusen der Barriere 8 mit männlichen Pilocarpin-resistenten Mäusen der Barriere 9. Bei der F1-Generation entwickelten lediglich die männlichen F1-Hybriden im 156 Diskussion Vergleich zur resistenten Barriere 9-Parentalsublinie eine signifikant höhere SEInduktionsrate. Weibliche F1-Hybrid-Mäuse unterschieden sich nicht von weiblichen Pilocarpin-resistenten Tieren aus Barriere 9. Verglichen zu den weiblichen Pilocarpin-sensitiven Tieren aus Barriere 8 ergab sich jedoch eine signifikant geringere SE-Induktionsrate. Dies lässt vermuten, dass eine in Barriere 8 aufgetretene Spontanmutation auf dem X-Chromosom aufgetreten ist sowie rezessiv vererbt wird. Um diese Hypothese weiterzuverfolgen, generierten wir eine F2Generation aus den Pilocarpin-sensitiven Weibchen aus Barriere 8 mit den männlichen Tieren der F1-Generation. Infolge der geringen Anzahl an F2-Tieren wurden diese 4 Tiere nicht bezüglich ihrer Pilocarpin-Sensititvität getestet, sondern lediglich zum Weiterzüchten verwendet. Bei der entstehenden F3-Generation zeigte sich nach Überprüfung ihrer Pilocarpin-Sensitivität abermals ein signifikanter Unterschied zwischen männlichen F3-Nachkommen zu den männlichen resistenten Tieren aus Barriere 9 sowie kein signifikanter Unterschied zwischen weiblichen F3Nachkommen zu den weiblichen resistenten Tieren aus Barriere 9. Zu beachten ist allerdings, dass die männlichen resistenten Tiere aus Barriere 9 einen besonders niedrigen Prozentsatz an Tieren mit SE (15%) im Vergleich zu den weiblichen Tieren (45%) aufwiesen. Ferner ist ein Vergleich der weiblichen F3-Generation zu den weiblichen Pilocarpin-sensitiven Tieren aus Barriere 8 nun nicht mehr signifikant unterschiedlich. Zudem konnte die SE-Induktionsrate der F1-Generation (weiblich: 50%, männlich: 53%) auf 72% bei den weiblichen Tieren sowie 86% bei den männlichen Tieren der F3-Generation gesteigert werden. Dies sind Werte, welche in im Rahmen der Pilocarpin-sensitiven Tiere aus Barriere 8 liegen. Mit den Pilocarpin-sensitiven B6-Nachkommen wird in der Arbeitsgruppe Löscher eine Zucht aufgebaut. Es besteht ein weltweit großes Interesse an Pilocarpinsensitiven B6-Mäusen, Inzuchtstamm sowie da das die B6-Maus den Pilocarpin-Modell am eines häufigsten der verwendeten gebräuchlichsten Epilepsiemodelle darstellt. Für die Zukunft könnten diese Pilocarpin-sensitiven Mäuse also anderen Arbeitsgruppen zur Verfügung gestellt werden, um die SEInduktionsrate nach Pilocarpinapplikation zu steigern sowie die Mortalitätsrate bei 157 Diskussion den Tieren zu senken und der weitergehenden Epilepsieforschung an B6-Mäusen zu dienen. 158 Zusammenfassung 7. Zusammenfassung Christine Julia Müller Untersuchungen zu Verhaltensänderungen und Lern- und Gedächtnisdefiziten im Pilocarpinmodell für chronische Epilepsie bei der NMRI- und C57BL/6-Maus Epilepsien zählen zu den häufigsten neurologischen Erkrankungen und zeichnen sich durch das spontane und wiederholte Auftreten von Krampfanfällen zentralen Ursprungs aus. Die Temporallappenepilepsie zählt zu den komplex fokalen Epilepsien und stellt die häufigste Epilepsieform beim Menschen dar. Auch bei Haustieren, insbesondere Hund und Katze, gelten Epilepsien als häufig, wobei sie hinsichtlich ihrer Symptomatik vergleichbar zu denen des Menschen sind. Doch nicht nur die klinischen Auswirkungen der Epilepsie, sprich das Auftreten der Krämpfe, beeinträchtigen stark die Lebensqualität der Epilepsiepatienten. Bei bis zu 60% der Epilepsiekranken existieren ferner psychisch-kognitive Begleiterkrankungen. Zu nennen sind insbesondere Depressionen, Angsterkrankungen, Psychosen sowie Lern- und Gedächtnisdefizite. Obwohl die Prävalenz der psychischen Komorbiditäten bei Epilepsien so hoch ist, bestehen lediglich Hypothesen bezüglich ihrer Entstehung wie auch ihrer Zusammenhänge. Auch die Therapiemöglichkeiten sind nicht hinreichend erforscht. Infolgedessen ist es notwendig, ein Tiermodell zu generieren, welches nicht nur die Untersuchung von Mechanismen ermöglicht, welche der Epilepsie zugrunde liegen, sondern auch von Grundlagen der Epilepsie-assoziierten Komorbiditäten. Den ersten Schritt bildet die Generierung von epileptischen Mäusen. Hierzu wurde in dieser PhD-Arbeit das Pilocarpin-Modell verwendet, welches weltweit eines der gebräuchlichsten chronischen Epilepsiemodelle darstellt, da es ohne hohen technischen oder zeitlichen Aufwand durchzuführen ist. Als nächsten Schritt sollen die Mäuse eine Batterie an Verhaltenstests absolvieren, welche für psychische und kognitive Veränderungen existieren. 159 Zusammenfassung Dass epileptische NMRI-Mäuse Verhaltensauffälligkeiten präsentieren, welche sich in einer Verhaltensbatterie detektieren lassen, zeigt eine vorherige PhD-Arbeit von Frau Gröticke in der Arbeitsgruppe Löscher. Sie etablierte das Pilocarpin-Modell für die NMRI-Maus mit einer hohen Status-epilepticus-Induktions- und niedrigen Mortalitätsrate für ein fraktioniertes Applikationsregime. Die chronisch epileptischen NMRI-Mäuse verhielten sich in der Verhaltensbatterie häufig immobil, präsentierten Angst-assoziiertes Verhalten, wiesen räumliche Lern- und Gedächtnisdefizite auf und zeigten eine verlängerte Aktivitätsphase in den Verhaltenstests, welche Depressionsassoziiertes Verhalten überprüfen. Histologisch detektierte Frau Gröticke eine ausgeprägte Neurodegeneration bei den epileptischen NMRI-Mäusen. Neu in meiner PhD-Arbeit ist in Studie 1, dass NMRI-Mäuse, welche mit Lithiumchlorid vorbehandelt wurden, mit nicht-vorbehandelten Tieren im PilocarpinModell verhaltensphysiologisch sowie histologisch verglichen wurden. Es konnten keine Unterschiede zwischen dem LiCl-Pilocarpin- sowie dem Pilocarpin-Modell nachgewiesen werden. Ebenfalls neu im Vergleich zur PhD-Arbeit von Frau Gröticke ist die Untersuchung von Pilocarpin-behandelten NMRI-Mäusen ohne SE. Diese Tiere differierten im Wesentlichen Verhaltenscharakterisierungen, als auch sowohl hinsichtlich bezüglich der der histologischen Untersuchung nicht von den Kontrolltieren. In Studie 2 wurde das Pilocarpin-Modell für die C57BL/6 (B6)-Maus etabliert. Die B6Maus stellt einen beliebten Inzuchtstamm dar, welcher üblicherweise als Hintergrundstamm für transgene Tiere verwendet wird und infolgedessen auch in der Epilepsieforschung häufig eingesetzt wird. Die Etablierung des Pilocarpin-Modells für die B6-Maus ist keineswegs trivial: Aus der Literatur ist bekannt, dass die SEInduktionsrate häufig eher gering, und die Mortalitätsrate hoch ist. Auch von Substammesunterschieden wird berichtet. In dieser PhD-Arbeit wurde ein fraktioniertes Applikationsprotokoll für die B6-Maus etabliert, welches bereits von Frau Gröticke für die NMRI-Maus entwickelt wurde, da es den Vorteil einer individuelleren Dosierung im Vergleich zur Bolusapplikation bietet. Bei der Etablierung des Pilocarpin-Modells konnten Substammesunterschiede zwischen B6NCrl, B6NHsd sowie B6JOla entdeckt werden. Auch innerhalb des Substammes 160 Zusammenfassung mit der höchsten SE-Induktionsrate (B6NCrl) konnten überraschenderweise signifikante Sublinienunterschiede zwischen den Barrieren 8 und 9 des Züchters Charles River aufgedeckt werden. Wir vermuteten eine Spontanmutation innerhalb der Pilocarpin-sensitiven Barriere 8, da weitere Barrieren des Züchters sich hinsichtlich ihrer Pilocarpinsensitivität nicht signifikant unterschiedlich zu den resistenten Mäusen aus Barriere 9 verhielten. Es wurde eine Hybrid-F1-Generation aus Pilocarpin-sensitiven-Weibchen aus Barriere 8 mit Pilocarpin-resistentenMännchen aus Barriere 9 gezüchtet. Lediglich die männlichen Nachkommen der F1Generation wiesen eine signifikant höhere Pilocarpin-Sensitivität auf, als die männliche Barriere 9-Parentalgeneration. Die Hypothese, dass eine Spontanmutation auf dem X-Chromosom der Tiere in Barriere 8 stattgefunden hat, und einen rezessiven Erbgang aufweist, wurde verifiziert, indem eine Zucht aus Pilocarpin-sensitiven B6-Mäusen aufgebaut wurde. Für die gezüchteten Nachkommen der F3-Generation ergab sich eine SE-Induktionsrate, welche nicht zur SE-Induktionsrate der Pilocarpin-sensitiven Tiere aus Barriere 8 differierte. In Studie 3 konnten bei der Verhaltenscharakterisierung von chronisch epileptischen B6-Mäusen viele Ähnlichkeiten zu epileptischen NMRI-Mäusen aufgezeigt werden. Epileptische B6-Mäuse präsentierten ebenfalls Angst-assoziiertes Verhalten, Lernund Gedächtnisdefizite sowie eine verringerte Immobilitätsdauer in den Verhaltenstests, welche Depressions-assoziiertes Verhalten untersuchen. Auffällig war jedoch eine Hyperaktivität epileptischer B6-Mäuse in mehreren Tests, welche bei epileptischen NMRI-Mäusen nicht auftrat. Ferner zeigten epileptische B6-Mäuse konträr zu epileptischen NMRI-Mäusen eine hohe Affinität zu neu präsentierten Objekten. Pilocarpin-behandelte B6-Mäuse ohne SE wiesen lediglich wenige Verhaltensauffälligkeiten auf. Die histologischen Schnitte der Pilocarpin-behandelten B6-Mäuse ohne SE differierten nicht von den Kontrollen. Für epileptische B6-Mäuse ergab sich eine im Hilus des Gyrus dentatus ausgeprägte Neurodegeneration. Im Ganzen betrachtet stellte sich der Neuronenverlust bei epileptischen B6- im Vergleich zu epileptischen NMRI-Mäusen als wesentlich geringer dar. 161 Zusammenfassung Es lässt sich schlussfolgern, dass das Pilocarpin-Modell bei der B6-Maus als Modell für psychische und kognitive Verhaltensänderungen, wie sie beim humanen Epilepsiepatienten existieren, verwendet werden kann. Langfristig könnte es zu einem neuen Verständnis der Grundlagen dieser Begleiterkrankungen sowie zu neuen Therapieansätzen beitragen. 162 Summary 8. Summary Christine Julia Müller Investigations of behavioral alterations and learning and memory deficits in the pilocarpine model of chronic epilepsy in NMRI- and C57BL/6-mice Epilepsy constitutes one of the most common neurological disorders. It is characterized by the occurrence of spontaneous and recurrent seizures. Temporal lobe epilepsy with complex focal seizures is the most frequent type of epilepsy in humans. Also pets have a high prevalence of epilepsies, especially dogs and cats. The symptoms in pets are similar to humans. Up to 60% of epilepsy patients suffer from psychiatric and cognitive comorbidities, the most common ones are depression, anxiety, psychosis, and learning and memory deficits. Despite the high prevalence of psychiatric and cognitive comorbidities, there are as yet only hypotheses about their origins, correlations, and possibilities of therapies. So it is necessary to generate an animal model which offers not only the opportunity to investigate epilepsy, but also epilepsy-associated comorbidities. In the PhD-thesis we first produced epileptic mice by using the pilocarpine-model, which is one of the most common models of chronic epilepsy in rodents. Next we investigated psychiatric and cognitive properties of epileptic mice in behavioral tests. In Löscher’s working group, Ina Gröticke recently demonstrated in her PhD-thesis that epileptic NMRI-mice exhibited behavioral alterations which can be detected in a behavioral test battery. Ina Gröticke established the pilocarpine-model in NMRI-mice. A repeated low-dose treatment of pilocarpine increased the incidence of status epilepticus and decreased mortality of animals. In the battery of behavioral tests, chronic epileptic NMRI-mice were often immobile, exhibited anxiety-like behavior, learning and memory deficits, and a reduced duration of immobility in tests to investigate depression-like behavior. Ina Gröticke detected degeneration of neurons in brain slices of epileptic mice in hippocampus, amygdala, and piriform cortex. 163 Summary In study 1 we investigated NMRI-mice in behavioral tests and histological analysis, which received a pre-treatment of lithium-chloride before application of pilocarpine. There were no differences between the lithium-pilocarpine and the pilocarpine-model. We also characterized mice in behavioral tests and histologigal investigation, which received pilocarpine but reached no SE. These animals did not differ from controls in nearly all parameters. In study 2 we established the pilocarpine model in C57BL/6- (B6) mice. B6-mice form a popular inbred strain which is commonly used as a background strain for transgenic mice. So B6-mice are also often used in epilepsy research. Establishing of the pilocarpine model in B6-mice is not trivial. From the literature it is known that the rate of SE-induction is often low, but mortality is high. Furthermore there are differences reported between substrains of B6-mice. In this PhD-thesis we established a repeated low-dose treatment of pilocarpine in B6-mice, which was developed by Ina Gröticke in NMRI-mice. The advantage is more individual dosing of pilocarpine than with bolus application. During establishing of the pilocarpine model in B6-mice, we detected substrain differences between B6NCrl, B6NHsd, and B6JOla. In addition we surprisingly found within the substrain B6NCrl, which was the only pilocarpine-sensitive strain, differences between barrier 8 and 9 of the same vendor Charles River. We supposed a spontaneous mutation risen inside of the pilocarpine-sensitive animals of barrier 8 because all the other tested barriers of the supplier did not differ from pilocarpine-resistant mice of barrier 9. We generated a hybrid F1-generation obtained from making of pilocarpine-sensitive female mice of barrier 8 and pilocarpine-resistant male mice of barrier 9. Only male F1-mice exhibited a significant higher pilocarpine-sensitivity than male parental generation of barrier 9. These results strongly indicate that a spontaneous mutation with recessive inheritance could have risen on the X chromosome. We verified this hypothesis with breeding of pilocarpine-sensitive B6-mice. The offsprings of B6-mice exhibited a rate of SE-induction, which did not differ from pilocarpine-sensitive animals of barrier 8 of the vendor Charles River. In study 3 on behavioral characterization of chronic epileptic B6-mice, of pilocarpinetreated B6 mice without SE, and controls, we detected many similarities to NMRI- 164 Summary mice. Epileptic B6-mice exhibited anxiety-like behavior, learning and memory deficits and a decreased duration of immobility in depression-associated tests. We further noticed a hyperactivity of B6-mice in several tests, which was not presented in NMRImice. In addition, epileptic B6-mice exhibited a high interest to a novel object, which is a striking difference to epileptic NMRI-mice. Pilocarpin-treated mice without SE presented only few behavioral alterations compared to controls. Investigation of brain sections of pilocarpine-treated B6-mice without SE resulted in no differences to control animals. Epileptic B6-mice were affected by neurodegeneration, especially in the hilus of the dentate gyrus. Overall neuronal loss in B6-mice was less severe than in NMRI-mice. In conclusion, the pilocarpine model in B6-mice is an appropriate model for investigation of psychiatric and cognitive disturbances, which also occur in human epilepsy patients. In the long term it could contribute to further understanding of basic principles and opportunities for therapies in epilepsy-associated comorbidities. 165 Literaturverzeichnis 9. Literaturverzeichnis ADACHI, N., T. ONUMA, S. NISHIWAKI, S. MURAUCHI, N. AKANUMA, S. ISHIDA u. N. TAKEI (2000): Inter-ictal and post-ictal psychoses in frontal lobe epilepsy: a retrospective comparison with psychoses in temporal lobe epilepsy. Seizure 9, 328-335 ALLISON, J. H., R. L. BOSHANS, L. M. HALLCHER, P. M. PACKMAN u. W. R. SHERMAN (1980): The effects of lithium on myo-inositol levels in layers of frontal cerebral cortex, in cerebellum, and in corpus callosum of the rat. Journal of Neurochemistry 34, 456-458 ALTSHULER, L., R. RAUSCH, S. DELRAHIM, J. KAY u. P. CRANDALL (1999): Temporal lobe epilepsy, temporal lobectomy, and major depression. The Journal of Neuropsychiatry and Clinical Neurosciences 11, 436-443 ALVAREZ-SILVA, S., J. ALVAREZ-RODRIGUEZ, M. J. PEREZ-ECHEVERRIA u. I. ALVAREZ-SILVA (2006): Panic and epilepsy. Journal of Anxiety Disorders 20, 353-362 ARNOLD, P. S., R. J. RACINE u. R. A. WISE (1973): Effects of atropine, reserpine, 6-hydroxydopamine, and handling on seizure development in the rat. Experimental Neurology 40, 457-470 AVANCINI, G., I. N. ABREU, M. D. SALDANA, R. S. MOHAMED u. P. MAZZAFERA (2003): Induction of pilocarpine formation in jaborandi leaves by salicylic acid and methyljasmonate. Phytochemistry 63, 171-175 BAI, F., X. LI, M. CLAY, T. LINDSTROM u. P. SKOLNICK (2001): Intra- and interstrain differences in models of "behavioral despair". Pharmacology, Biochemistry, and Behavior 70, 187-192 BARLOW, C., S. HIROTSUNE, R. PAYLOR, M. LIYANAGE, M. ECKHAUS, F. COLLINS, Y. SHILOH, J. N. CRAWLEY, T. RIED, D. TAGLE u. A. WYNSHAW-BORIS (1996): Atm-deficient mice: a paradigm of ataxia telangiectasia. Cell 86, 159-171 BAZIL, C. W. (2003): Epilepsy and sleep disturbance. Epilepsy & Behavior 4 Supplement 2, S39-45 BEGHI, M., C. M. CORNAGGIA, B. FRIGENI u. E. BEGHI (2006): Learning disorders in epilepsy. Epilepsia 47 Supplement 2, 14-18 BELMAKER, R. H. u. Y. BERSUDSKY (2007): Lithium-pilocarpine seizures as a model for lithium action in mania. Neuroscience and Biobehavioral Reviews 31, 843-849 BENGZON, J., Z. KOKAIA, E. ELMER, A. NANOBASHVILI, M. KOKAIA u. O. LINDVALL (1997): Apoptosis and proliferation of dentate gyrus neurons after single and intermittent limbic seizures. Proceedings of the National Academy of Sciences of the United States of America 94, 10432-10437 166 Literaturverzeichnis BERSUDSKY, Y., O. MAHLER, O. KOFMAN u. R. H. BELMAKER (1994): Species differences in susceptibility to Li-pilocarpine seizures. European Neuropsychopharmacology 4, 429-430 BERSUDSKY, Y., I. VINNITSKY, N. GRISARU, O. KOFMAN u. R. H. BELMAKER (1993): Dose-response and time curve of inositol prevention of Li-pilocarpine seizures. European Neuropsychopharmacology 3, 428-429 BEYENBURG, S., SCHMIDT, D. (2005): Epilepsiepatienten mit Angsterkrankungen. Der Nervenarzt 76, 1077-1091 BIGAL, M. E., R. B. LIPTON, J. COHEN u. S. D. SILBERSTEIN (2003): Epilepsy and migraine. Epilepsy & Behavior 4 Supplement 2, S13-24 BOISSIER, J. R., SIMON, P. (1964): Dissociation de deux composantes dans le comportement d'investigation de la souris. Archives internationales de pharmacodynamie et de thérapie147, 372-387 BONSIGNORE, L. T., F. CHIAROTTI, E. ALLEVA u. F. CIRULLI (2008): Assessing the interplay between fear and learning in mice exposed to a live rat in a spatial memory task (MWM). Animal Cognition 11, 557-562 BORGES, K., M. GEARING, D. L. MCDERMOTT, A. B. SMITH, A. G. ALMONTE, B. H. WAINER u. R. DINGLEDINE (2003): Neuronal and glial pathological changes during epileptogenesis in the mouse pilocarpine model. Experimental Neurology 182, 21-34 BORGES, K., D. MCDERMOTT, H. IRIER, Y. SMITH u. R. DINGLEDINE (2006): Degeneration and proliferation of astrocytes in the mouse dentate gyrus after pilocarpine-induced status epilepticus. Experimental Neurology 201, 416-427 BORGES, K., D. L. MCDERMOTT u. R. DINGLEDINE (2004): Reciprocal changes of CD44 and GAP-43 expression in the dentate gyrus inner molecular layer after status epilepticus in mice. Experimental Neurology 188, 1-10 BORO, A. u. S. HAUT (2003): Medical comorbidities in the treatment of epilepsy. Epilepsy & Behavior 4 Supplement 2, S2-12 BOTHE, G. W., V. J. BOLIVAR, M. J. VEDDER u. J. G. GEISTFELD (2004): Genetic and behavioral differences among five inbred mouse strains commonly used in the production of transgenic and knockout mice. Genes, Brain, and Behavior 3, 149-157 BOURIN, M., F. CHENU, N. RIPOLL u. D. J. DAVID (2005): A proposal of decision tree to screen putative antidepressants using forced swim and tail suspension tests. Behavioral Brain Research 164, 266-269 167 Literaturverzeichnis BRANDT, C., A. M. GASTENS, M. SUN, M. HAUSKNECHT u. W. LÖSCHER (2006): Treatment with valproate after status epilepticus: effect on neuronal damage, epileptogenesis, and behavioral alterations in rats. Neuropharmacology 51, 789-804 BRANDT, C., M. GLIEN, H. POTSCHKA, H. VOLK u. W. LÖSCHER (2003): Epileptogenesis and neuropathology after different types of status epilepticus induced by prolonged electrical stimulation of the basolateral amygdala in rats. Epilepsy Research 55, 83-103 BROWN, S. (2006): Deterioration. Epilepsia 47 Supplement 2, 19-23 BRYANT, C. D., N. N. ZHANG, G. SOKOLOFF, M. S. FANSELOW, H. S. ENNES, A. A. PALMER u. J. A. MCROBERTS (2008): Behavioral differences among C57BL/6 substrains: implications for transgenic and knockout studies. Journal of Neurogenetics 22, 315-331 CARNEVALLI, L. S., C. M. PEREIRA, C. B. JAQUETA, V. S. ALVES, V. N. PAIVA, K. M. VATTEM, R. C. WEK, L. E. MELLO u. B. A. CASTILHO (2006): Phosphorylation of the alpha subunit of translation initiation factor-2 by PKR mediates protein synthesis inhibition in the mouse brain during status epilepticus. The Biochemical Journal 397, 187-194 CARTER, R. J., L. A. LIONE, T. HUMBY, L. MANGIARINI, A. MAHAL, G. P. BATES, S. B. DUNNETT u. A. J. MORTON (1999): Characterization of progressive motor deficits in mice transgenic for the human Huntington's disease mutation. The Journal of Neuroscience 19, 3248-3257 CAVALHEIRO, E. A., M. G. NAFFAH-MAZZACORATTI, L. E. MELLO u. J. P. LEITE (2006): The pilocarpine model of seizures. In: Models of seizures and epilepsy Elsevier Academic Press, Burlington, 433-448 CAVALHEIRO, E. A., N. F. SANTOS u. M. R. PRIEL (1996): The pilocarpine model of epilepsy in mice. Epilepsia 37, 1015-1019 CERVO, L., A. CANETTA, E. CALCAGNO, S. BURBASSI, G. SACCHETTI, S. CACCIA, C. FRACASSO, D. ALBANI, G. FORLONI u. R. W. INVERNIZZI (2005): Genotype-dependent activity of tryptophan hydroxylase-2 determines the response to citalopram in a mouse model of depression. The Journal of Neuroscience 25, 8165-8172 CHEN, J., S. LARIONOV, J. PITSCH, N. HOEROLD, C. ULLMANN, C. E. ELGER, J. SCHRAMM u. A. J. BECKER (2005): Expression analysis of metabotropic glutamate receptors I and III in mouse strains with different susceptibility to experimental temporal lobe epilepsy. Neuroscience Letters 375, 192-197 CLIFFORD, D. B., J. W. OLNEY, A. MANIOTIS, R. C. COLLINS u. C. F. ZORUMSKI (1987): The functional anatomy and pathology of lithium-pilocarpine and high-dose pilocarpine seizures. Neuroscience 23, 953-968 168 Literaturverzeichnis CONNOLLY, P. M., C. R. MAXWELL, S. J. KANES, T. ABEL, Y. LIANG, J. TOKARCZYK, W. B. BILKER, B. I. TURETSKY, R. E. GUR u. S. J. SIEGEL (2003): Inhibition of auditory evoked potentials and prepulse inhibition of startle in DBA/2J and DBA/2Hsd inbred mouse substrains. Brain Research 992, 85-95 CORBIN, J. G., N. GAIANO, S. L. JULIANO, S. POLUCH, E. STANCIK u. T. F. HAYDAR (2008): Regulation of neural progenitor cell development in the nervous system. Journal of Neurochemistry 106, 2272-2287 COSTALL, B., B. J. JONES, M. E. KELLY, R. J. NAYLOR u. D. M. TOMKINS (1989): Exploration of mice in a black and white test box: validation as a model of anxiety. Pharmacology, Biochemistry, and Behavior 32, 777-785 COUGHENOUR, L. L., J. R. MCLEAN u. R. B. PARKER (1977): A new device for the rapid measurement of impaired motor function in mice. Pharmacology, Biochemistry, and Behavior 6, 351-353 CRABBE, J. C., D. WAHLSTEN u. B. C. DUDEK (1999): Genetics of mouse behavior: interactions with laboratory environment. Science (New York, N.Y.) 284, 1670-1672 CRAWLEY, J. N., J. K. BELKNAP, A. COLLINS, J. C. CRABBE, W. FRANKEL, N. HENDERSON, R. J. HITZEMANN, S. C. MAXSON, L. L. MINER, A. J. SILVA, J. M. WEHNER, A. WYNSHAW-BORIS u. R. PAYLOR (1997): Behavioral phenotypes of inbred mouse strains: implications and recommendations for molecular studies. Psychopharmacology (Berl.) 132, 107-124 CRAWLEY, J. N. u. F. K. GOODWIN (1980): Preliminary report of a simple animal behavior model for the anxiolytic effects of benzodiazepines. Pharmacology, Biochemistry, and Behavior 13, 167-170 CRAWLEY, J. N. u. R. PAYLOR (1997): A proposed test battery and constellations of specific behavioral paradigms to investigate the behavioral phenotypes of transgenic and knockout mice. Hormones and Behavior 31, 197-211 CRYAN, J. F., C. MOMBEREAU u. A. VASSOUT (2005): The tail suspension test as a model for assessing antidepressant activity: review of pharmacological and genetic studies in mice. Neuroscience and Biobehavioral Reviews 29, 571-625 CURIA, G., D. LONGO, G. BIAGINI, R. S. JONES u. M. AVOLI (2008): The pilocarpine model of temporal lobe epilepsy. Journal of Neuroscience Methods 172, 143-157 D'HOOGE, R. u. P. P. DE DEYN (2001): Applications of the Morris water maze in the study of learning and memory. Brain Research. Brain Research Reviews 36, 60-90 DENNIS, C. (2005): Psychiatric disease: all in the mind of a mouse. Nature 438, 151-152 169 Literaturverzeichnis DEVINSKY, O. (2003): Psychiatric comorbidity in patients with epilepsy: implications for diagnosis and treatment. Epilepsy & Behavior 4 Supplement 4, S2-10 DUNHAM, N. W. u. T. S. MIYA (1957): A note on a simple apparatus for detecting neurological deficit in rats and mice. Journal of the American Pharmaceutical Association 46, 208-209 EICHENBAUM, H., C. STEWART u. R. G. MORRIS (1990): Hippocampal representation in place learning. The Journal of Neuroscience 10, 3531-3542 ELGER, C. E. (2002): Epilepsie: Gewitter im Gehirn. Neurowissenschaftliche Gesellschaft: Kosmos Gehirn 76-77 ENGEL, J., JR. (2001): Mesial temporal lobe epilepsy: what have we learned? Neuroscientist 7, 340-352 FEDROWITZ, M., K. KAMINO u. W. LÖSCHER (2004): Significant differences in the effects of magnetic field exposure on 7,12-dimethylbenz(a)anthraceneinduced mammary carcinogenesis in two substrains of Sprague-Dawley rats. Cancer Research 64, 243-251 FERRARO, T. N., G. T. GOLDEN, G. G. SMITH, D. DEMUTH, R. J. BUONO u. W. H. BERRETTINI (2002): Mouse strain variation in maximal electroshock seizure threshold. Brain Research 936, 82-86 FERRARO, T. N., G. T. GOLDEN, G. G. SMITH, J. F. MARTIN, F. W. LOHOFF, T. A. GIERINGER, D. ZAMBONI, C. L. SCHWEBEL, D. M. PRESS, S. O. KRATZER, H. ZHAO, W. H. BERRETTINI u. R. J. BUONO (2004): Fine mapping of a seizure susceptibility locus on mouse Chromosome 1: nomination of Kcnj10 as a causative gene. Mammalian Genome 15, 239-251 FERRARO, T. N., G. T. GOLDEN, R. SNYDER, M. LAIBINIS, G. G. SMITH, R. J. BUONO u. W. H. BERRETTINI (1998): Genetic influences on electrical seizure threshold. Brain Research 813, 207-210 FILE, S. E. u. A. G. WARDILL (1975): Validity of head-dipping as a measure of exploration in a modified hole-board. Psychopharmacologia 44, 53-59 FISHER, R. S. (1989): Animal models of the epilepsies. Brain Research Reviews 14, 245-278 FISHER, R. S., W. VAN EMDE BOAS, W. BLUME, C. ELGER, P. GENTON, P. LEE u. J. ENGEL, JR. (2005): Epileptic seizures and epilepsy: definitions proposed by the International League Against Epilepsy (ILAE) and the International Bureau for Epilepsy (IBE). Epilepsia 46, 470-472 170 Literaturverzeichnis FORSGREN, L. u. L. NYSTROM (1990): An incident case-referent study of epileptic seizures in adults. Epilepsy Research 6, 66-81 FREITAG, C. M., T. W. MAY, M. PFAFFLIN, S. KONIG u. D. RATING (2001): Incidence of epilepsies and epileptic syndromes in children and adolescents: a population-based prospective study in Germany. Epilepsia 42, 979-985 FUKUCHI, T., K. KANEMOTO, M. KATO, S. ISHIDA, S. YUASA, J. KAWASAKI, S. SUZUKI u. T. ONUMA (2002): Death in epilepsy with special attention to suicide cases. Epilepsy Research 51, 233-236 GILLIAM, F., H. HECIMOVIC u. Y. SHELINE (2003): Psychiatric comorbidity, health, and function in epilepsy. Epilepsy & Behavior 4 Supplement 4, S26-30 GILLIAM, F. u. A. M. KANNER (2002): Treatment of depressive disorders in epilepsy patients. Epilepsy & Behavior 3, 2-9 GLIEN, M., C. BRANDT, H. POTSCHKA, H. VOIGT, U. EBERT u. W. LÖSCHER (2001): Repeated low-dose treatment of rats with pilocarpine: low mortality but high proportion of rats developing epilepsy. Epilepsy Research 46, 111-119 GOODMAN, J. H. (1998): Experimental models of status epilepticus. In: Neuropharmacology methods in epilepsy research CRC Press, Boca Raton, 95-121 GRÖTICKE, I., K. HOFFMANN u. W. LÖSCHER (2007): Behavioral alterations in the pilocarpine model of temporal lobe epilepsy in mice. Experimental Neurology 207, 329-349 GRÖTICKE, I., K. HOFFMANN u. W. LÖSCHER (2008): Behavioral alterations in a mouse model of temporal lobe epilepsy induced by intrahippocampal injection of kainate. Experimental Neurology 213, 71-83 GROTTICK, A. J., D. BAGNOL, S. PHILLIPS, J. MCDONALD, D. P. BEHAN, D. T. CHALMERS u. Y. HAKAK (2005): Neurotransmission- and cellular stress-related gene expression associated with prepulse inhibition in mice. Brain Research. Molecular Brain Research 139, 153-162 GRUNWALD, T., K. LEHNERTZ, C. HELMSTAEDTER, M. KUTAS, N. PEZER, M. KURTHEN, D. VAN ROOST u. C. E. ELGER (1998): Limbic ERPs predict verbal memory after left-sided hippocampectomy. Neuroreport 9, 3375-3378 HALL, C. u. E. BALLECHEY (1932): A study of the rat's behavior in a field: A contribution to method in comparative psychology. University of California Publications in Psychology 6, 1-12 171 Literaturverzeichnis HAMILTON, S. E., M. D. LOOSE, M. QI, A. I. LEVEY, B. HILLE, G. S. MCKNIGHT, R. L. IDZERDA u. N. M. NATHANSON (1997): Disruption of the m1 receptor gene ablates muscarinic receptor-dependent M current regulation and seizure activity in mice. Proceedings of the National Academy of Sciences of the United States of America. 94, 13311-13316 HANNESSON, D. K., J. G. HOWLAND, M. POLLOCK, P. MOHAPEL, A. E. WALLACE u. M. E. CORCORAN (2005): Anterior perirhinal cortex kindling produces long-lasting effects on anxiety and object recognition memory. The European Journal of Neuroscience 21, 1081-1090 HAUSER, W. A., J. F. ANNEGERS u. L. T. KURLAND (1993): Incidence of epilepsy and unprovoked seizures in Rochester, Minnesota: 1935-1984. Epilepsia 34, 453-468 HELMSTAEDTER, C. (2002): Effects of chronic epilepsy on declarative memory systems. Progress in Brain Research 135, 439-453 HELMSTAEDTER, C. u. E. KOCKELMANN (2006): Cognitive outcomes in patients with chronic temporal lobe epilepsy. Epilepsia 47 Supplement 2, 96-98 HELMSTAEDTER, C. u. M. KURTHEN (2001): Memory and epilepsy: characteristics, course, and influence of drugs and surgery. Current Opinion in Neurology 14, 211-216 HERMANN, B. P., M. SEIDENBERG u. B. BELL (2000): Psychiatric comorbidity in chronic epilepsy: identification, consequences, and treatment of major depression. Epilepsia 41 Supplement 2, S31-41 HESDORFFER, D. C., W. A. HAUSER, J. F. ANNEGERS u. G. CASCINO (2000): Major depression is a risk factor for seizures in older adults. Annals of Neurology 47, 246-249 HESDORFFER, D. C., W. A. HAUSER, E. OLAFSSON, P. LUDVIGSSON u. O. KJARTANSSON (2006): Depression and suicide attempt as risk factors for incident unprovoked seizures. Annals of Neurology 59, 35-41 HOLMES, A., Q. LIT, D. L. MURPHY, E. GOLD u. J. N. CRAWLEY (2003): Abnormal anxiety-related behavior in serotonin transporter null mutant mice: the influence of genetic background. Genes, Brain, and Behavior 2, 365-380 HOLMES, A., S. PARMIGIANI, P. F. FERRARI, P. PALANZA u. R. J. RODGERS (2000): Behavioral profile of wild mice in the elevated plus-maze test for anxiety. Physiology & Behavior 71, 509-516 HÜTTMANN, K., M. SADGROVE, A. WALLRAFF, S. HINTERKEUSER, F. KIRCHHOFF, C. STEINHAUSER u. W. P. GRAY (2003): Seizures preferentially stimulate proliferation of radial glia-like astrocytes in the adult dentate gyrus: functional and immunocytochemical analysis. The European Journal of Neuroscience 18, 2769-2778 172 Literaturverzeichnis IKEGAYA, Y., N. NISHIYAMA u. N. MATSUKI (2000): L-type Ca(2+) channel blocker inhibits mossy fiber sprouting and cognitive deficits following pilocarpine seizures in immature mice. Neuroscience 98, 647-659 INTERNATIONAL LEAGUE AGAINST EPILEPSY (ILAE) www.ilae.org. INTERNATIONALE LIGA GEGEN EPILEPSIE www.ligaepilepsie.org IRWIN, S. (1968): Comprehensive observational assessment: Ia. A systematic, quantitative procedure for assessing the behavioral and physiologic state of the mouse. Psychopharmacologia 13, 222-257 JACOBY, A., G. A. BAKER, N. STEEN, P. POTTS u. D. W. CHADWICK (1996): The clinical course of epilepsy and its psychosocial correlates: findings from a U.K. Community study. Epilepsia 37, 148-161 JAMOT, L., J. Y. BERTHOLET u. W. E. CRUSIO (1994): Neuroanatomical divergence between two substrains of C57BL/6J inbred mice entails differential radial-maze learning. Brain Research 644, 352-356 JOHNSON, E. K., J. E. JONES, M. SEIDENBERG u. B. P. HERMANN (2004): The relative impact of anxiety, depression, and clinical seizure features on health-related quality of life in epilepsy. Epilepsia 45, 544-550 JOHNSON, N. J. u. R. STEVENS (1983): Acute and chronic effects of estrogen treatment on pimozide-induced catalepsy in the rat. Pharmacology, Biochemistry, and Behavior 18, 31-36 JOPE, R. S. u. R. A. MORRISETT (1986): Neurochemical consequences of status epilepticus induced in rats by coadministration of lithium and pilocarpine. Experimental Neurology 93, 404-414 JOPE, R. S., R. A. MORRISETT u. O. C. SNEAD (1986): Characterization of lithium potentiation of pilocarpine-induced status epilepticus in rats. Experimental Neurology 91, 471-480 KANEMOTO, K., T. TSUJI u. J. KAWASAKI (2001): Reexamination of interictal psychoses based on DSM IV psychosis classification and international epilepsy classification. Epilepsia 42, 98-103 KANNER, A. M. (2000): Psychosis of Epilepsy: A Neurologist's Perspective. Epilepsy & Behavior 1, 219-227 KANNER, A. M. (2003): Depression in epilepsy: a frequently neglected multifaceted disorder. Epilepsy & Behavior 4 Supplement 4, 11-19 173 Literaturverzeichnis KANNER, A. M. (2006): Epilepsy, suicidal behaviour, and depression: do they share common pathogenic mechanisms? Lancet Neurology 5, 107-108 KANNER, A. M., S. STAGNO, P. KOTAGAL u. H. H. MORRIS (1996): Postictal psychiatric events during prolonged video-electroencephalographic monitoring studies. Archives of Neurology 53, 258-263 KARL, T., R. PABST u. S. VON HORSTEN (2003): Behavioral phenotyping of mice in pharmacological and toxicological research. Experimental and Toxicologic Pathology 55, 69-83 KAUFMANN, R., H. GOLDBERG-STERN u. A. SHUPER (2009): Attention-deficit disorders and epilepsy in childhood: incidence, causative relations and treatment possibilities. Journal of Child Neurology 24, 727-733 KIM, D., S. CHAE, J. LEE, H. YANG u. H. S. SHIN (2005): Variations in the behaviors to novel objects among five inbred strains of mice. Genes, Brain, and Behavior 4, 302-306 KIMBALL, A. W., W. T. BURNETT, JR. u. D. G. DOHERTY (1957): Chemical protection against ionizing radiation. I. Sampling methods for screening compounds in radiation protection studies with mice. Radiation Research 7, 1-12 KOMADA, M., K. TAKAO u. T. MIYAKAWA (2008): Elevated plus maze for mice. Journal of Visualized Experiments LAMBERTY, Y. u. A. J. GOWER (1996): Arm width and brightness modulation of spontaneous behaviour of two strains of mice tested in the elevated plus-maze. Physiology & Behavior 59, 439-444 LANG, U. E., F. LANG, K. RICHTER, V. VALLON, H. P. LIPP, J. SCHNERMANN u. D. P. WOLFER (2003): Emotional instability but intact spatial cognition in adenosine receptor 1 knock out mice. Behavioral Brain Research 145, 179-188 LEHRNER, J., R. KALCHMAYR, W. SERLES, A. OLBRICH, E. PATARAIA, S. AULL, J. BACHER, F. LEUTMEZER, G. GROPPEL, L. DEECKE u. C. BAUMGARTNER (1999): Health-related quality of life (HRQOL), activity of daily living (ADL) and depressive mood disorder in temporal lobe epilepsy patients. Seizure 8, 88-92 LI, X., J. ZHOU, Z. CHEN, S. CHEN, F. ZHU u. L. ZHOU (2008): Long-term expressional changes of Na+ -K+ -Cl- co-transporter 1 (NKCC1) and K+ -Cl- co-transporter 2 (KCC2) in CA1 region of hippocampus following lithium-pilocarpine induced status epilepticus (PISE). Brain Research 1221, 141-146 LISTER, R. G. (1987): The use of a plus-maze to measure anxiety in the mouse. Psychopharmacology (Berl.) 92, 180-185 174 Literaturverzeichnis LOGUE, S. F., R. PAYLOR u. J. M. WEHNER (1997): Hippocampal lesions cause learning deficits in inbred mice in the Morris water maze and conditionedfear task. Behavioral Neuroscience 111, 104-113 LÖSCHER, W. (1999): Animal models of epilepsy and epileptic seizures. In: Handbook of experimental pharmacology: Antiepileptic drugs Springer-Verlag, Berlin, 19-61 LÖSCHER, W. (2003): Pharmakologische Grundlagen zur Behandlung der Epilepsie bei Hund und Katze. Praktischer Tierarzt 84, 574-586 LÖSCHER, W., M. GERNERT u. U. HEINEMANN (2008): Cell and gene therapies in epilepsy--promising avenues or blind alleys? Trends in Neurosciences 31, 62-73 LÖSCHER, W. u. H. LEHMANN (1996): L-deprenyl (selegiline) exerts anticonvulsant effects against different seizure types in mice. The Journal of Pharmacology and Experimental Therapeutics. 277, 1410-1417 MACHLEIDT, W. (2004): Psychische Störungen bei Epilepsie - Epilepsie als psychische Störung. In: Psychiatrie, Psychosomatik und Psychotherapie Georg Thieme Verlag, Stuttgart, 382-390 MAINIO, A., K. ALAMAKI, K. KARVONEN, H. HAKKO, T. SARKIOJA u. P. RASANEN (2007): Depression and suicide in epileptic victims: a population-based study of suicide victims during the years 1988-2002 in northern Finland. Epilepsy & Behavior 11, 389-393 MARCHI, N., Q. FAN, C. GHOSH, V. FAZIO, F. BERTOLINI, G. BETTO, A. BATRA, E. CARLTON, I. NAJM, T. GRANATA u. D. JANIGRO (2009): Antagonism of peripheral inflammation reduces the severity of status epilepticus. Neurobiology of Disease 33, 171-181 MAYORGA, A. J. u. I. LUCKI (2001): Limitations on the use of the C57BL/6 mouse in the tail suspension test. Psychopharmacology (Berl.) 155, 110-112 MAZARATI, A., X. LU, S. SHINMEI, H. BADIE-MAHDAVI u. T. BARTFAI (2004): Patterns of seizures, hippocampal injury and neurogenesis in three models of status epilepticus in galanin receptor type 1 (GalR1) knockout mice. Neuroscience 128, 431-441 MCAREAVEY, M. J., B. R. BALLINGER u. G. W. FENTON (1992): Epileptic seizures in elderly patients with dementia. Epilepsia 33, 657-660 MEKADA, K., K. ABE, A. MURAKAMI, S. NAKAMURA, H. NAKATA, K. MORIWAKI, Y. OBATA u. A. YOSHIKI (2009): Genetic differences among C57BL/6 substrains. Experimental Animals. 58, 141-149 175 Literaturverzeichnis MENDEZ, M. F., R. GRAU, R. C. DOSS u. J. L. TAYLOR (1993): Schizophrenia in epilepsy: seizure and psychosis variables. Neurology 43, 1073-1077 MIYAKAWA, T., M. YAMADA, A. DUTTAROY u. J. WESS (2001a): Hyperactivity and intact hippocampus-dependent learning in mice lacking the M1 muscarinic acetylcholine receptor. The Journal of Neuroscience 21, 5239-5250 MIYAKAWA, T., E. YARED, J. H. PAK, F. L. HUANG, K. P. HUANG u. J. N. CRAWLEY (2001b): Neurogranin null mutant mice display performance deficits on spatial learning tasks with anxiety related components. Hippocampus 11, 763-775 MOHAJERI, M. H., R. MADANI, K. SAINI, H. P. LIPP, R. M. NITSCH u. D. P. WOLFER (2004): The impact of genetic background on neurodegeneration and behavior in seizured mice. Genes, Brain, and Behavior 3, 228-239 MOHAJERI, M. H., K. SAINI, H. LI, A. CRAMERI, H. P. LIPP, D. P. WOLFER u. R. M. NITSCH (2003): Intact spatial memory in mice with seizure-induced partial loss of hippocampal pyramidal neurons. Neurobiology of Disease 12, 174-181 MORRIS, R. (1984): Developments of a water-maze procedure for studying spatial learning in the rat. Journal of Neuroscience Methods 11, 47-60 MOTAMEDI, G. u. K. MEADOR (2003): Epilepsy and cognition. Epilepsy & Behavior 4 Supplement 2, S25-38 NADLER, J. V., B. W. PERRY, C. GENTRY u. C. W. COTMAN (1980): Degeneration of hippocampal CA3 pyramidal cells induced by intraventricular kainic acid. Journal of Comparative Neurology 192, 333-359 NATIONAL INSTITUTE OF MENTAL HEALTH (NIMH, 2008) The numbers count: mental disorders in America. www.nimh.nih.gov/publicat/numbers.cfm NIQUET, J., Y. BEN-ARI u. A. REPRESA (1994): Glial reaction after seizure induced hippocampal lesion: immunohistochemical characterization of proliferating glial cells. Journal of Neurocytology 23, 641-656 NITECKA, L., E. TREMBLAY, G. CHARTON, J. P. BOUILLOT, M. L. BERGER u. Y. BEN-ARI (1984): Maturation of kainic acid seizure-brain damage syndrome in the rat. II. Histopathological sequelae. Neuroscience 13, 1073-1094 NOE, K. H. u. E. M. MANNO (2005): Mechanisms underlying status epilepticus. Drugs of Today (Barc.) 41, 257-266 NOEBELS, J. L. (2001): Modeling human epilepsies in mice. Epilepsia 42 Supplement 5, 11-15 176 Literaturverzeichnis O'DONNELL, K. C. u. T. D. GOULD (2007): The behavioral actions of lithium in rodent models: leads to develop novel therapeutics. Neuroscience and Biobehavioral Reviews 31, 932-962 OTTMAN, R. u. R. B. LIPTON (1996): Is the comorbidity of epilepsy and migraine due to a shared genetic susceptibility? Neurology 47, 918-924 OWEN, E. H., S. F. LOGUE, D. L. RASMUSSEN u. J. M. WEHNER (1997): Assessment of learning by the Morris water task and fear conditioning in inbred mouse strains and F1 hybrids: implications of genetic background for single gene mutations and quantitative trait loci analyses. Neuroscience 80, 1087-1099 PAXINOS, G. u. K. B. J. FRANKLIN (2001): The mouse brain in stereotaxic coordinates. Academic Press, San Diego PAYLOR, R., M. NGUYEN, J. N. CRAWLEY, J. PATRICK, A. BEAUDET u. A. ORR-URTREGER (1998): Alpha7 nicotinic receptor subunits are not necessary for hippocampal-dependent learning or sensorimotor gating: a behavioral characterization of Acra7-deficient mice. Learning & Memory (Cold Spring Harbor, N.Y.) 5, 302-316 PENG, Z. u. C. R. HOUSER (2005): Temporal patterns of fos expression in the dentate gyrus after spontaneous seizures in a mouse model of temporal lobe epilepsy. The Journal of Neuroscience 25, 7210-7220 PENG, Z., C. S. HUANG, B. M. STELL, I. MODY u. C. R. HOUSER (2004): Altered expression of the delta subunit of the GABAA receptor in a mouse model of temporal lobe epilepsy. The Journal of Neuroscience 24, 8629-8639 PENOVICH, P. E. (2000): The effects of epilepsy and its treatment on sexual and reproductive function. Epilepsia 41 Supplement 2, S53-61 PETERSON, S. L. (1998): Electroshock. In: Neuropharmacology methods in epilepsy research CRC Press, Boca Raton, 1-26 PIAZZINI, A., M. P. CANEVINI, G. MAGGIORI u. R. CANGER (2001): Depression and Anxiety in Patients with Epilepsy. Epilepsy & Behavior 2, 481-489 PINEL, J. P. u. L. I. ROVNER (1978): Experimental epileptogenesis: kindling-induced epilepsy in rats. Experimental Neurology 58, 190-202 PLOMIN, R., G. E. MCCLEARN, G. GORA-MASLAK u. J. M. NEIDERHISER (1991): Use of recombinant inbred strains to detect quantitative trait loci associated with behavior. Behavior Genetics 21, 99-116 177 Literaturverzeichnis POHLMANN-EDEN, B. (2000): Epilepsie. In: Klinische Neuro-Psychiatrie Georg Thieme Verlag, Stuttgart, 270-297 PORSOLT, R. D., A. BERTIN u. M. JALFRE (1977): Behavioral despair in mice: a primary screening test for antidepressants. Archives Internationales de Pharmacodynamie et de Thérapie 229, 327-336 PORSOLT, R. D., A. BERTIN u. M. JALFRE (1978): "Behavioural despair" in rats and mice: strain differences and the effects of imipramine. European Journal of Pharmacology 51, 291-294 POWELL, S. B., M. A. GEYER, D. GALLAGHER u. M. P. PAULUS (2004): The balance between approach and avoidance behaviors in a novel object exploration paradigm in mice. Behavioral Brain Research 152, 341-349 PRIEL, M. R. u. E. X. ALBUQUERQUE (2002): Short-term effects of pilocarpine on rat hippocampal neurons in culture. Epilepsia 43 Supplement 5, 40-46 RACINE, R. J. (1972): Modification of seizure activity by electrical stimulation. II. Motor seizure. Electroencephalography and Clinical Neurophysiology. 32, 281-294 RADULOVIC, J., J. KAMMERMEIER u. J. SPIESS (1998): Generalization of fear responses in C57BL/6N mice subjected to one-trial foreground contextual fear conditioning. Behavioral Brain Research 95, 179-189 RAE, G. A., G. H. PEREIRA u. T. C. DE-LIMA (1990): The influence of stress on convulsive parameters in the mouse. Neuroscience and Biobehavioral Reviews 14, 491-494 RAJKOWSKA, G., J. J. MIGUEL-HIDALGO, J. WEI, G. DILLEY, S. D. PITTMAN, H. Y. MELTZER, J. C. OVERHOLSER, B. L. ROTH u. C. A. STOCKMEIER (1999): Morphometric evidence for neuronal and glial prefrontal cell pathology in major depression. Biological Psychiatry 45, 1085-1098 RIPOLL, N., D. J. DAVID, E. DAILLY, M. HASCOET u. M. BOURIN (2003): Antidepressant-like effects in various mice strains in the tail suspension test. Behavioral Brain Research 143, 193-200 SANBERG, P. R. (1980): Haloperidol-induced catalepsy is mediated by postsynaptic dopamine receptors. Nature 284, 472-473 SANBERG, P. R., M. D. BUNSEY, M. GIORDANO u. A. B. NORMAN (1988): The catalepsy test: its ups and downs. Behavioral Neuroscience 102, 748-759 SANDER, J. W. u. S. D. SHORVON (1996): Epidemiology of the epilepsies. Journal of Neurology, Neurosurgery, and Psychiatry 61, 433-443 178 Literaturverzeichnis SCHAUWECKER, P. E. (2002a): Complications associated with genetic background effects in models of experimental epilepsy. Progress in Brain Research 135, 139-148 SCHAUWECKER, P. E. (2002b): Modulation of cell death by mouse genotype: differential vulnerability to excitatory amino acid-induced lesions. Experimental Neurology 178, 219-235 SCHAUWECKER, P. E. u. O. STEWARD (1997): Genetic determinants of susceptibility to excitotoxic cell death: implications for gene targeting approaches. Proceedings of the National Academy of Sciences of the United States of America 94, 4103-4108 SCHIMANSKI, L. A. u. P. V. NGUYEN (2004): Multidisciplinary approaches for investigating the mechanisms of hippocampus-dependent memory: a focus on inbred mouse strains. Neuroscience and Biobehavioral Reviews 28, 463-483 SCHMIDT, D. (1992a): Diagnose und Klassifikation epileptischer Anfälle. In: Taschenatlas Epilepsien W. Zuckschwerdt Verlag, München, 6-15 SCHMIDT, D. (1992b): Diagnose und Klassifikation von Epilepsien und epileptischen Syndromen. In: Taschenatlas Epilepsien W. Zuckschwerdt Verlag, München, 16-51 SCHMUED, L. C., C. ALBERTSON u. W. SLIKKER, JR. (1997): Fluoro-Jade: a novel fluorochrome for the sensitive and reliable histochemical localization of neuronal degeneration. Brain Research 751, 37-46 SCHMUED, L. C., C. C. STOWERS, A. C. SCALLET u. L. XU (2005): Fluoro-Jade C results in ultra high resolution and contrast labeling of degenerating neurons. Brain Research 1035, 24-31 SERI, B., J. M. GARCIA-VERDUGO, L. COLLADO-MORENTE, B. S. MCEWEN u. A. ALVAREZBUYLLA (2004): Cell types, lineage, and architecture of the germinal zone in the adult dentate gyrus. The Journal of Comparative Neurology 478, 359-378 SERI, B., J. M. GARCIA-VERDUGO, B. S. MCEWEN u. A. ALVAREZ-BUYLLA (2001): Astrocytes give rise to new neurons in the adult mammalian hippocampus. The Journal of Neuroscience 21, 7153-7160 SHALDUBINA, A., R. BUCCAFUSCA, R. A. JOHANSON, G. AGAM, R. H. BELMAKER, G. T. BERRY u. Y. BERSUDSKY (2007): Behavioural phenotyping of sodium-myo-inositol cotransporter heterozygous knockout mice with reduced brain inositol. Genes, Brain, and Behavior 6, 253-259 SHELINE, Y. I. (2003): Neuroimaging studies of mood disorder effects on the brain. Biological Psychiatry 54, 338-352 179 Literaturverzeichnis SHIBLEY, H. u. B. N. SMITH (2002): Pilocarpine-induced status epilepticus results in mossy fiber sprouting and spontaneous seizures in C57BL/6 and CD-1 mice. Epilepsy Research 49, 109-120 SHIKHANOV, N. P., N. M. IVANOV, A. V. KHOVRYAKOV, K. KASPERSEN, G. M. MCCANN, P. P. KRUGLYAKOV u. A. A. SOSUNOV (2005): Studies of damage to hippocampal neurons in inbred mouse lines in models of epilepsy using kainic acid and pilocarpine. Neuroscience and Behavioral Physiology 35, 623-628 SIEGMUND, A., K. LANGNAESE u. C. T. WOTJAK (2005): Differences in extinction of conditioned fear in C57BL/6 substrains are unrelated to expression of alpha-synuclein. Behavioral Brain Research 157, 291-298 SILVA, S. R., H. A. FUTURO-NETO u. J. G. PIRES (1995): Effects of 5-HT3 receptor antagonists on neuroleptic-induced catalepsy in mice. Neuropharmacology 34, 97-99 SIMON, P., R. DUPUIS u. J. COSTENTIN (1994): Thigmotaxis as an index of anxiety in mice. Influence of dopaminergic transmissions. Behavioral Brain Research 61, 59-64 SLUYTER, F., C. C. MARICAN u. W. E. CRUSIO (1999): Further phenotypical characterisation of two substrains of C57BL/6J inbred mice differing by a spontaneous single-gene mutation. Behavioral Brain Research 98, 39-43 SMOLDERS, I., G. M. KHAN, J. MANIL, G. EBINGER u. Y. MICHOTTE (1997): NMDA receptor-mediated pilocarpine-induced seizures: characterization in freely moving rats by microdialysis. British Journal of Pharmacology 121, 1171-1179 STABLES, J. P., E. H. BERTRAM, H. S. WHITE, D. A. COULTER, M. A. DICHTER, M. P. JACOBS, W. LÖSCHER, D. H. LOWENSTEIN, S. L. MOSHE, J. L. NOEBELS u. M. DAVIS (2002): Models for epilepsy and epileptogenesis: report from the NIH workshop, Bethesda, Maryland. Epilepsia 43, 1410-1420 STAFSTROM, C. E. (2002): Assessing the behavioral and cognitive effects of seizures on the developing brain. Progress in Brain Research 135, 377-390 STEWARD, O., E. R. TORRE, R. TOMASULO u. E. LOTHMAN (1992): Seizures and the regulation of astroglial gene expression. Epilepsy Research Supplement 7, 197-209 STIEDL, O., J. RADULOVIC, R. LOHMANN, K. BIRKENFELD, M. PALVE, J. KAMMERMEIER, F. SANANBENESI u. J. SPIESS (1999): Strain and substrain differences in context- and tone-dependent fear conditioning of inbred mice. Behavioral Brain Research 104, 1-12 TAKEDA, H., M. TSUJI u. T. MATSUMIYA (1998): Changes in head-dipping behavior in the hole-board test reflect the anxiogenic and/or anxiolytic state in mice. European Journal of Pharmacology 350, 21-29 180 Literaturverzeichnis TAYLOR, G. A., R. M. RODRIGUIZ, R. I. GREENE, X. DANIELL, S. C. HENRY, K. R. CROOKS, R. KOTLOSKI, L. TESSAROLLO, L. E. PHILLIPS u. W. C. WETSEL (2008): Behavioral characterization of P311 knockout mice. Genes, Brain, and Behavior 7, 786-795 TECOTT, L. H. (1998): Gene targeting models of epilepsy: technical and analytical considerations. In: Neuropharmacology methods in epilepsy research CRC Press, Boca Raton, 193-209 THAPAR, A., M. ROLAND u. G. HAROLD (2005): Do depression symptoms predict seizure frequency--or vice versa? Journal of Psychosomatic Research 59, 269-274 TRIMBLE, M. R. u. L. T. VAN ELST (2003): The amygdala and psychopathology studies in epilepsy. Annals of the New York Academy of Sciences 985, 461-468 TRULLAS, R., B. JACKSON u. P. SKOLNICK (1989): Genetic differences in a tail suspension test for evaluating antidepressant activity. Psychopharmacology (Berl.) 99, 287-288 TU, B., Y. JIAO, H. HERZOG u. J. V. NADLER (2006): Neuropeptide Y regulates recurrent mossy fiber synaptic transmission less effectively in mice than in rats: Correlation with Y2 receptor plasticity. Neuroscience 143, 1085-1094 TURSKI, W. A., E. A. CAVALHEIRO, Z. A. BORTOLOTTO, L. M. MELLO, M. SCHWARZ u. L. TURSKI (1984): Seizures produced by pilocarpine in mice: a behavioral, electroencephalographic and morphological analysis. Brain Research 321, 237-253 TURSKI, W. A., E. A. CAVALHEIRO, M. SCHWARZ, S. J. CZUCZWAR, Z. KLEINROK u. L. TURSKI (1983a): Limbic seizures produced by pilocarpine in rats: behavioural, electroencephalographic and neuropathological study. Behavioral Brain Research 9, 315-335 TURSKI, W. A., S. J. CZUCZWAR, Z. KLEINROK u. L. TURSKI (1983b): Cholinomimetics produce seizures and brain damage in rats. Experientia 39, 1408-1411 VAN GAALEN, M. M. u. T. STECKLER (2000): Behavioural analysis of four mouse strains in an anxiety test battery. Behavioral Brain Research 115, 95-106 VAZQUEZ, B. u. O. DEVINSKY (2003): Epilepsy and anxiety. Epilepsy & Behavior 4 Supplement 4, S20-25 VICTOROFF, J. I., F. BENSON, S. T. GRAFTON, J. Jr. ENGEL, J. C. MAZZIOTTA Depression in complex partial seizures. Electroencephalography and cerebral metabolic correlates. Archives of Neurology 51, 155-163 181 Literaturverzeichnis WALSH, R. N. u. R. A. CUMMINS (1976): The Open-Field Test: a critical review. Psychological Bulletin 83, 482-504 WANG, L., Y. H. LIU, Y. G. HUANG u. L. W. CHEN (2008): Time-course of neuronal death in the mouse pilocarpine model of chronic epilepsy using Fluoro-Jade C staining. Brain Research 1241, 157-167 WHISHAW, I. Q. u. J. A. TOMIE (1996): Of mice and mazes: similarities between mice and rats on dry land but not water mazes. Physiology & Behavior 60, 1191-1197 WIEBE, S. u. D. C. HESDORFFER (2007): Epilepsy: being ill in more ways than one. Epilepsy Currents 7, 145-148 WIESER, H. G. (2004): ILAE Commission Report. Mesial temporal lobe epilepsy with hippocampal sclerosis. Epilepsia 45, 695-714 WILCOXON, J. S., G. J. NADOLSKI, J. SAMARUT, O. CHASSANDE u. E. E. REDEI (2007): Behavioral inhibition and impaired spatial learning and memory in hypothyroid mice lacking thyroid hormone receptor alpha. Behavioral Brain Research 177, 109-116 WILLIAMS, P. A., J. L. HELLIER, A. M. WHITE, K. J. STALEY u. F. E. DUDEK (2007): Development of spontaneous seizures after experimental status epilepticus: implications for understanding epileptogenesis. Epilepsia 48 Supplement 5, 157-163 WINOKUR, R. S., T. KUBAL, D. LIU, S. F. DAVIS u. B. N. SMITH (2004): Recurrent excitation in the dentate gyrus of a murine model of temporal lobe epilepsy. Epilepsy Research 58, 93-105 WLÁZ, P., LÖSCHER W (1998): Evaluation of associated behavioral and cognitive deficits in anticonvulsant drug testing. In: Neuropharmacology Methods in Epilepsy Research CRC Press, Boca Raton, 171-192 WOLFER, D. P., W. E. CRUSIO u. H. P. LIPP (2002): Knockout mice: simple solutions to the problems of genetic background and flanking genes. Trends in Neurosciences 25, 336-340 YANG, Y., B. J. BEYER, J. F. OTTO, T. P. O'BRIEN, V. A. LETTS, H. S. WHITE u. W. N. FRANKEL (2003): Spontaneous deletion of epilepsy gene orthologs in a mutant mouse with a low electroconvulsive threshold. Human Molecular Genetics 12, 975-984 ZHANG, N., W. WEI, I. MODY u. C. R. HOUSER (2007): Altered localization of GABA(A) receptor subunits on dentate granule cell dendrites influences tonic and phasic inhibition in a mouse model of epilepsy. The Journal of Neuroscience 27, 7520-7531 182 Anhang 10. Anhang 10.1 Untersuchungsgang des Irwin-Tests Allgemeinuntersuchung (3 Min.): Hochheben des Tieres am Schwanz 0- kein Fluchtversuch 2- moderater Fluchtversuch 4- starker Fluchtversuch 5- Springen/ Aggressivität Platzierungsverhalten beim Absetzen der Maus 0- keine Reaktion 2- Ausstrecken der Vorderpfoten Körperhaltung 0- flach in Bauchlage liegend 1- Seitenlage 2- normale Körperhaltung 3- sitzende Körperhaltung 4- starre oder verkrampfte Haltung Schwanztonus 0- ohne Tonus, nachschleifend 2- normale Schwanzhaltung 3- 45° Schwanzhaltung 4- 90° Schwanzhaltung 5- über den Körper aufgestellter Schwanz (Straub-Phänomen) 183 Anhang Atmung 1- verminderte Atemfrequenz 2- normale Atmung 3- erhöhte Atemfrequenz Piloerection 2- nicht vorhanden 3- leicht vorhanden 4- stark ausgeprägt Hautdurchblutung 0- bläulich verfärbte Haut 1- weiße Haut mit kaum sichtbaren Gefäßen 2- leicht rosa gefärbte Haut 3- dunkelrosa verfärbte Haut 4- rot verfärbte Haut Fell 2- sauber 4- schmutzig Exophtalmus 2- nicht vorhanden 4- vorhanden Ptosis 2- Augenlider normal geöffnet 3- Augenlider halb geöffnet 4- Augenlider zu einem Viertel geöffnet 5- Augenlider geschlossen 184 Anhang Tränenfluss 2- nicht vorhanden 5- vorhanden Speichelfluss 2- nicht vorhanden 5- vorhanden Schnelligkeit des Bewegungsablaufs 0- unbeweglich 1- langsam 2- aktiv 3- schnell Fortbewegung im Untersuchungskäfig 1- hypoaktiv 2- aktiv 3- hyperaktiv Schreckhaftigkeit (Klicker) 0- ohne Schreckreaktion 1- abgeschwächte, verzögerte Schreckreaktion 2- normale Schreckreaktion, kurzes Erstarren 3- starke Schreckreaktion, Flucht, Springen, langes Erstarren Hörvermögen 0- nicht vorhanden 2- vorhanden 185 Anhang Abnormales Verhalten: Urin- und Kotabsatz Handling Gleichgewicht (Käfig wird leicht bewegt) 0- vermindert 2- normal Neugierverhalten (Vorzeigen eines Gegenstandes) 0- keine Reaktion 1- vermindertes Neugierverhalten 2- normales Neugierverhalten, Kontaktaufnahme mit Barthaaren 3- Kontaktaufnahme mit der Nase 4- Aggressivität Berührungsreaktion (mit einem Gegenstand am Rücken) 0- ohne Reaktion 1- langsame Ausweichbewegung 2- moderate Ausweichbewegung 3- stark ausfallende Ausweichbewegung 5- Flüchten über größere Distanz, Aggressivität auf leichte Berührung Korneal-Reflex (Reizung des Auges mit einer Borste) 0- keine Reaktion 2- normaler Lidschluss 3- häufiger Lidschluss 4- Reaktion des gesamten Körpers 186 Anhang Barthaar-Reflex (Reizung der Barthaare) 0- keine Reaktion 2- normale Reaktion 3- Bewegung des Kopfes 4- Bewegung des Körpers Rektaltemperatur Explorationsverhalten an einer Kante (einer etwas erhöht liegenden Plattform) 0- keine Reaktion 1- keine Exploration der Kante 2- Exploration der Plattform 3- Exploration und Herunterklettern 4- Abspringen, ohne Exploration Haffner-Reflex (Schmerzreflex an der Schwanzwurzel) 0- 30 s lang ohne Schmerzreaktion 1- Schmerzreaktion tritt langsamer als 5 s ein 2- Schmerzreaktion tritt schneller als 5 s ein Pupillen-Reflex 0- nicht vorhanden 1- vorhanden Bauchdeckenspannung und Muskeltonus der Extremitäten 0- nicht vorhanden 1- verringert 2- moderat 3- erhöht 4- stark erhöht 187 Anhang Aufrichtereflex (aus Rücken- oder Seitenlage heraus) 0- keine Lagekorrektur 1- Lagekorrektur verzögert 2- sofortige Lagekorrektur Rektaltemperatur 188 Anhang 10.2 Protokoll der Thionin-Färbung a) Thioninlösung: • 100 ml 1 M Essigsäure + 36 ml 1 M Natronlauge • auf 1 l mit Aqua destillata auffüllen • auf 60-70°C erhitzen • darin 1,25 g Thionin lösen • 1 Stunde auf einem Magnetrührer rühren • anschließend heiß filtrieren • die Lösung ist bei 60°C ca. 1 Monat haltbar b) Fixierung mit Paraformaldehyd Die Kryostat-Schnitte werden 10 Min. in 4 % Paraformaldehydlösung fixiert. c) Thioninfärbung: Auf Objektträger aufgezogene Gehirnschnitte werden wie folgt behandelt: • 3 Min. in 100% Ethanol • 3 Min. in 95% Ethanol • 3 Min. in 70% Ethanol • 3 Min. in 50% Ethanol • 3 Min. in Aqua destillata • 90 s in Thioninlösung • 3 Min. in 50% Ethanol • 3 Min. in 70% Ethanol • 3 Min. in 95% Ethanol • 3 Min. in 100% Ethanol • 3 Min. in Terpineol/Xylol-Ersatzmedium (Mischverhältnis 1:1) • 3 Min. in Xylol-Ersatzmedium • 3 Min. in frisches Xylol-Ersatzmedium → sofortiges Eindecken der Schnitte mit Entellan und Trocknen 189 Anhang 10. 3 Protokoll der FJC-Färbung a) Fluoro-Jade C-Stocklösung: 5 mg Fluoro-Jade C Pulver + 50 ml Aqua destillata b) Fixierung mit Paraformaldehyd Die Kryostat-Schnitte werden 10 Min. in 4 % Paraformaldehydlösung fixiert. c) Fluoro-Jade C-Färbung: Auf Objektträger aufgezogene Gehirnschnitte werden wie folgt behandelt: • 5 Min. in 80% Ethanol • 2 Min. in 70% Ethanol • 2 Min. in Aqua destillata • 10 Min. in 0,06% Kalium-Permanganatlösung • 1-2 Min. spülen mit Aqua demineralisata Unter Lichtausschluss: • 30 Min. 0,0001% Fluoro-Jade C-Lösung (1 ml Fluoro-Jade C-Stocklösung + 99 ml 0,1% Essigsäure) • 3 x 1 Min. Aqua destillata • mehrere Stunden trocknen lassen • 1 Min. Xylene-Lösung → Gehirnschnitte mit DPX mounting medium eindecken und trocknen lassen 190 Anhang 10.4 Protokoll der GFAP-Färbung Überblick Nachweis von GFAP mittels prim. AK polyclonal rabbit anti Cow-GFAP (DAKO), sek. AK biotinillierter pig anti rabbit, Färbung: Vectastain-Kit, DAB Vorgang 1.Tag Fixierung, Demaskierung, prim. AK • Fixierung: direkt 10 Min. in frischem 4% Paraformaldehyd (+4°C) fixieren • 3x 5 Min. waschen in TBS • Hemmung der endogenen Peroxidase: 30 Min. in 0,5% H2O2 (13 µl H2O2 (35%)/1 ml TBS) • 3x 5 Min. waschen in TBS (Spülen bis keine Blasen mehr vorhanden!!) • Einspannen in die cover plates und einmal mit TBS (bei RT!!) waschen (2,5 ml) • Blocking: 60 Min. in block solution (150 µl) • prim AK: über Nacht mit prim. AK (1:1000) in carrier solution (150 µl) bei 4°C im Kühlschrank 2. Tag sek. AK; DAB • 3x waschen in TBS • sek. AK: 90 Min. in sek. AK (1:500) in carrier solution • 3x waschen in TBS • Verstärkung: 90 Min. in Vectastain-Lösung (150 µl), Lösung 30 min vor Gebrauch ansetzen! • 3x waschen in TBS, dann 1x waschen in einer Glasküvette mit TBS • Färbung: 15 Min. in DAB-Lösung • 3x waschen in TBS • 1x waschen in Aqua dest., an der Luft trocknen lassen Am nächsten Tag eindecken. 191 Anhang Lösungen: 4% Paraformaldehydlösung 100 ml 8% Paraformaldehyd 100 ml 0,2 mol/l Phosphat-gepufferte NaCl-Lösung (PBS) TBS TRIS-buffered saline 0,9 % NaCl-Lösung (pH 7,6) Carrier solution 100 ml TBS 1 ml pig serum 1 g Rinderserumalbumin (BSA) Blocking solution 4,5 ml carrier solution 0,5 ml pig serum 100 mg BSA Vectastain-Lösung 5 ml TBS jeweils 20 µl Lösung A und Lösung B DAB-Lösung 1125 µl Ansatz (entspricht 123,75 mg 3,3´-DAB) 150 ml TRIS/Ni-Lösung 37,5 µl H2O2 TRIS/Ni-Lösung 0,3 g Nickelammoniumsulfat 50 ml TBS 192 Anhang Erklärung Hiermit erkläre ich, dass ich die Dissertation („Untersuchungen zu Verhaltensänderungen und Lern- und Gedächtnisdefiziten im Pilocarpinmodell für chronische Epilepsie bei der NMRI- und C57BL/6-Maus“) selbständig verfasst habe. Bei der Anfertigung wurden folgende Hilfen Dritter in Anspruch genommen: Frau Doris Pieper-Matriciani (Technische Angestellte) führte mit mir zusammen die Thionin-Färbungen aus Studie 1 durch. Herr Tobias Kalair (ehemaliger Auszubildender zum Biologielaboranten) beobachtete die C57BL/6-Mäuse aus Studie 3 während der Verhaltensversuche auf das Vorkommen von spontanen Anfällen. Frau Ina Gröticke (ehemalige PhD-Studentin) fertigte die Kabel für die EEGÜberwachung an. Ich habe keine entgeltliche Hilfe von Vermittlungs- bzw. Beratungsdiensten (Promotionsberater oder anderer Personen) in Anspruch genommen. Niemand hat von mir unmittelbar oder mittelbar entgeltliche Leistungen für Arbeiten erhalten, die im Zusammenhang mit dem Inhalt der vorgelegten Dissertation stehen. Ich habe die Dissertation an folgenden Institutionen angefertigt: Institut für Pharmakologie, Toxikologie und Pharmazie der Stiftung Tierärztliche Hochschule Hannover Die Dissertation wurde bisher nicht für eine Prüfung oder Promotion oder für einen ähnlichen Zweck zur Beurteilung eingereicht. Ich versichere, dass ich die vorstehenden Angaben nach bestem Wissen vollständig und der Wahrheit entsprechend gemacht habe. _______________________________ eigenhändige Unterschrift 193 Anhang Publikationen Originalarbeiten MÜLLER, C. J., GRÖTICKE, I., HOFFMANN, K., SCHUGHART, K., LÖSCHER, W. (2009): Differences in sensitivity to the convulsant pilocarpine in substrains and sublines of C57BL/6 mice. Genes, Brain and Behavior 8, 481-492 MÜLLER, C. J., GRÖTICKE, I., BANKSTAHL, M., LÖSCHER, W. (2009): Behavioral and cognitive alterations, spontaneous seizures, and neuropathology developing after a pilocarpine-induced status epilepticus in C57BL/6 mice. Experimental Neurology 219, 284–297 MÜLLER, C. J., BANKSTAHL, M., GRÖTICKE, I., LÖSCHER, W. (2009): Pilocarpine vs. lithium-pilocarpine for induction of status epilepticus in mice: Development of spontaneous seizures, behavioral alterations and neuronal damage. European Journal of Pharmacology 619 15–24 Zitierfähige Kongressbeiträge MÜLLER, C. J., GRÖTICKE, I., HOFFMANN, K., SCHUGHART, K., LÖSCHER, W.(2009): Differences in sensitivity to the convulsant pilocarpine in substrains and sublines of C57BL/6 mice, Naunyn-Schmiedeberg’s Archives of Pharmacology, 379:46-46, 213, Suppl. 1 MÜLLER, C. J., GRÖTICKE, I., LÖSCHER, W. (2008): Behavioral alterations in the pilocarpine model of temporal lobe epilepsy in C57BL/6 mice 2008. Abstract Viewer. Washington, DC: Society for Neuroscience Program No.645.20/W11 194 Anhang Sonstige Beiträge MÜLLER, C. J., GRÖTICKE, I., LÖSCHER, W. (2008): Verhaltensänderungen und Lern- und Gedächtnisdefizite im Pilocarpin-Modell für Temporallappenepilepsie bei der C57BL/6-Maus 18. Symposium VetPharm, Gießen MÜLLER, C. J., GRÖTICKE, I., LÖSCHER, W. (2008): Epilepsie-assoziierte Verhaltensänderungen und Lern- und Gedächtnisdefizite im Pilocarpin-Modell bei verschiedenen Mausstämmen Epileptologisches Werkstattgespräch, Bielefeld-Bethel 195 Anhang Danksagung Mein größter Dank gilt Herrn Prof. Löscher für die Überlassung des Themas, die Unterstützung bei der Bewerbung um finanzielle Förderung der PhD-These, der guten wissenschaftlichen Betreuung und Anleitung zur experimentellen Forschung sowie Hilfe bei der Abfassung der These. Ich danke Herrn Prof. Dietrich und Herrn Prof. Hildebrandt für die gute Betreuung während meines PhD-Studiums. Herrn Prof. Hildebrandt danke ich ebenfalls für die Unterstützung bei der Bewerbung um finanzielle Förderung. Frau Dr. Marion Bankstahl danke ich für die jederzeit gewährte Hilfestellung, für die gute Betreuung meiner Dissertation und für die schnelle Korrektur der These. Mein Dank gilt Frau Ina Gröticke, PhD, für die gute Betreuung meines Projekts während ihrer Zeit als wissenschaftliche Mitarbeiterin am Institut sowie für ihre Unterstützung auch über diese Zeit hinaus. Frau Katrin Hoffmann, PhD, danke ich für die gute Betreuung zu Beginn meiner Dissertation. Allen weiteren wissenschaftlichen Mitarbeitern des Instituts möchte ich für ihre Hilfsbereitschaft danken. Ich danke allen Doktoranden und Diplomanden des Instituts für die nette Arbeitsatmosphäre. Insbesondere danke ich meiner Freundin und Büro-Nachbarin Frau Nadine Polascheck für ihre stetige Hilfe, aber auch für viele Gespräche, gemeinsames Lachen und positives Denken. Besonderer Dank gilt auch Frau Stefanie Honndorf sowie Frau Saskia Kücker für ihre Freundschaft. Mein Dank gilt ferner allen weiteren Mitarbeitern des Institutes für ihre Hilfsbereitschaft und Unterstützung. Insbesondere danke ich Frau Julia Förster für ihre stetige Hilfe bei sämtlichen Fragen zur Maus-Video- und EEG-Überwachung sowie Frau Doris Pieper-Matriciani und Herrn Michael Weißing Hilfestellungen bei Fragen zu histologischen Untersuchungsmethoden. 196 für ihre Anhang Ich danke Frau Gorgina Zivkovic für die gute Betreuung der Tierhaltung sowie der kompetenten Zucht der Mäuse. Ich danke Frau Dr. Dagmar Esser, Frau Nadja Borsum, Frau Patricia Bock sowie Frau Manuela Chambers aus dem Koordinationsreferat des Zentrums für Systemische Neurowissenschaften (ZSN) für die stetige Hilfe bei allen Anliegen rund um das PhD-Studium. Ferner danke ich dem ZSN für die gewährte dreimonatige Anschubfinanzierung zu Beginn der These. Mein Dank gilt meiner Mama Renate und meiner Schwester Lara Müller, meinem Freund Gérard Fuchs sowie meinen langjährigen Freundinnen aus Köln und Hannover für die immer gewährte Unterstützung. Der Konrad-Adenauer-Stiftung, Sankt Augustin, danke ich für das gewährte Promotionsstipendium, ohne das die Durchführung der PhD-These für mich nicht möglich gewesen wäre. 197