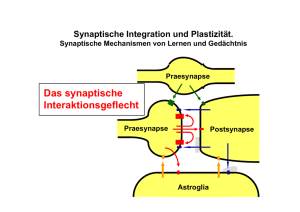
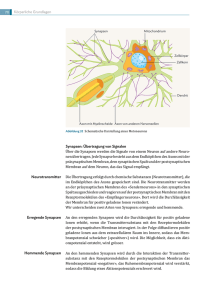
Die Synapse - e-Shop
Werbung

Die Synapse C. R. Rose, A. Konnerth und C.-M. Becker B-2 EINLEITUNG Mrs Inglethorp was lying on the bed, her whole body form agitated by violent convulsions, in one of which she must have overturned the table beside her. As we entered, however, her limbs relaxed, and she fell back upon the pillows. . . . A strangled cry from the bed startled me. A fresh access of pain seized the unfortunate old lady. The convulsions were of a violence terrible to behold. Everything was confusion. We thronged round her, powerless to help or alleviate. A final convulsion lifted her from the bed, until she appeared to rest upon her head and her heels, with her body arched in an extraordinary manner. In vain Mary and John tried to administer more brandy. The moments flew. Again the body arched itself in that peculiar fashion. At that moment, Dr Bauerstein pushed his way authoritatively into the room. For one instant he stopped dead, staring at the figure on the bed, and, at the same instant, Mrs Inglethorp cried out in a strangled voice, her eyes fixed on the doctor: ¹Alfred ± Alfredª. (Aus Agatha Christie, The Mysterious Affair at Styles, Harper Collins Publishers, London, 1994) So beschreibt Agatha Christie um 1920 den stadienhaften Ablauf einer letalen Strychninvergiftung. Bereits geringste Reize können schwere Krämpfe auslösen, die die gesamte Muskulatur erfassen und den Körper in eine bizarre Rückenstreckung zwingen (Opisthotonus). Der Tod tritt durch Atemstillstand ein. Dr. Alfred Bauerstein stand der Vergiftung, die durch Blockade des Glycinrezeptors verursacht wird, hilflos gegenüber. Glycin wirkt hemmend auf Motoneurone im Rückenmark, eine Strychninvergiftung löst daher massive Muskelkrämpfe aus. Mit heutigem Wissen und heute verfügbaren Medikamenten hätte Dr. Bauerstein die Vergiftung jedoch wirkungsvoll bekämpfen können. pp pp A BC PH PS 2.1 Überblick über die Funktionsweise von Synapsen l l l Synapsen dienen der elektrischen Signalübertragung zwischen einzelnen Zellen Die vielfältigen Funktionen des Nervensystems wie Wahrnehmung, Motorik, Regulation innerer Organfunktionen und geistige Leistungen beruhen auf einer geordneten Signalübertragung zwischen Nervenzellen in ZNS, vegetativen Zentren und ihren Zielorganen. Die Nervenzellen sind miteinander über Synapsen verbunden. Synapsen dienen der schnellen Signalübertragung von einem Neuron auf eine benachbarte Zelle. Auch die Kontakte zu peripheren Sensoren, Drüsen und der Muskulatur erfolgen über Synapsen. Im Zentralnervensystem liegt die Aufgabe von Synapsen allerdings nicht nur in der reinen Weiterleitung von Information von einem Neuron zum anderen. Vielmehr besteht eine wichtige Aufgabe zentraler Synapsen auch darin, die Informationsverarbeitung zwischen Nervenzellen zu steuern, indem manche Verbindungen unterdrückt, andere verstärkt werden. Diese synaptischen Vorgänge bilden die zelluläre Grundlage von Lernen und Gedächtnis (Kap. B-6). Es gibt zwei Arten von Synapsen: elektrische und chemische Synapsen. Diese beiden Synapsentypen erfüllen unterschiedliche Aufgaben und unterscheiden sich grundlegend in ihrem Aufbau und ihrer Funktionsweise. l l l Elektrische Synapsen sind Zellverbindungen, die aus Gap Junctions bestehen und Signale elektrotonisch weiterleiten Molekulare Anatomie elektrischer Synapsen. Elektrische Synapsen sind weitaus weniger häufig als chemische Synapsen. Im Zentralnervensystem von Wirbeltieren dienen sie vorwiegend der Synchronisation der Aktivität neuronaler Zellverbände. Ein Beispiel hierfür sind die neuroendokrinen Zellverbände des Hypothalamus (Abschn. C-3.2), deren pulsartiger Hormonausstoû durch elektrische Kopplung synchronisiert wird. Elektrische Synapsen sind auch für die Erregungsweiterleitung zwischen glatten Muskelzellen, kardialen Myocyten und Gliazellen verantwortlich (Abschn. B-19.5, C-6.4). Struktur und Funktionsweise elektrischer Synapsen sind schematisch in Abb. 2-1 dargestellt. An elektrischen Synapsen sind die Membranen der präsynaptischen und der postsynaptischen Zelle nur durch einen sehr schmalen Spalt 2.1 Überblick über die Funktionsweise von Synapsen y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 27 Stimulation 1 Ableitung Ableitung Zelle 1 Zelle 1 Zellmembran Zelle 1 10 mV Stimulation Zelle 1 Zellmembran Zelle 2 Connexone Ableitung Zelle 2 2 ms Zelle 2 Ableitung 2 Abb. 2-1. Struktur und Funktionsweise elektrischer Synapsen. Links ist schematisch die Verbindung zweier Zellen über Gap Junctions dargestellt. Gap Junctions bestehen aus Connexonen in der Plasmamembran beider Zellen, die eine direkte Verbindung zwischen den Intrazellulärräumen herstellen (Mitte). Rechts: Elektrische Stimulation führt zu einer Potentialänderung der präsynaptischen Zelle 1. Die präsynaptische Potentialänderung ruft eine zeitlich nur geringfügig verzögerte Potentialänderung in der postsynaptischen Zelle 2 hervor von etwa 2±3 nm Breite voneinander getrennt. Dieser Spalt wird durch Ionenkanäle überbrückt, die in beide Zellmembranen eingelagert sind (Gap Junctions; Abschn. A-18.2). Dadurch entsteht eine cytoplasmatische Verbindung zwischen den Zellen, die eine direkte Fortleitung elektrischer Impulse ermöglicht. Die beteiligten Ionenkanäle werden von zwei einander gegenüberliegenden spezialisierten Membranproteinen, den Connexonen, gebildet. Diese Halbkanäle bestehen aus jeweils sechs rosettenförmig angeordneten Connexinen, Untereinheiten mit einer Molekülmasse von ca. 30 kDa. diese Synapse erzeugt somit ein funktionelles Syncytium, wie es z. B. zwischen Astrocyten oder kardialen Myocyten vorliegt (Abschn. B-1.2, C-6.3). Die Kanäle der Gap Junctions ermöglichen jedoch nicht nur einen Stromfluss, sondern auch die Diffusion von Ionen von einer Zelle in die andere. Daneben sind sie für organische Verbindungen bis zu einer Molekülmasse von ca. 1 kDa wie ATP oder IP3 (Inositol1,4,5-trisphosphat) und andere intrazelluläre Botenstoffe durchlässig. Gap Junctions vermitteln daher nicht nur die schnelle und synchrone Weiterleitung elektrischer Signale, sondern können auch Stoffwechselsignale zwischen den Zellen weiterleiten. Physiologische Eigenschaften elektrischer Synapsen. Durch die direkte cytoplasmatische Verbindung zwischen den Zellen besitzen elektrische Synapsen einen niedrigen elektrischen Widerstand (Abschn. A-1.5). Die Cytoplasmaverbindung ermöglicht die elektrotonische Weiterleitung des Stroms von einer Zelle auf die andere. Durch die elektrotonische Ausbreitung kommt es nur zu einer geringen zeitlichen Verzögerung der Signalweiterleitung (Abb. 2-1). Daher ermöglicht die Signalübertragung an elektrischen Synapsen die rasche und synchrone Übertragung von Aktionspotentialen (Abschn. A-9.5, B-1.4) zwischen gekoppelten Zellen und somit die Synchronisierung ihrer Aktivität. Elektrische Synapsen ermöglichen auch die Übertragung von unterschwelligen Spannungsänderungen, also solchen Potentialänderungen, die nicht zur Auslösung von Aktionspotentialen führen. Diese werden allerdings aufgrund der rein elektrotonischen Weiterleitung auf ihrem Weg in die postsynaptische Zelle abgeschwächt (Abb. 2-1). Der Stromfluss an den meisten elektrischen Synapsen ist ungerichtet, kann also wechselweise von der einen oder der anderen Zelle in einem Gewebeverband ausgehen (bidirektional). Die elektrische Kopplung benachbarter Zellen durch 28 Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* Modulation der Leitfähigkeit elektrischer Synapsen. Die Leitfähigkeit der Gap Junctions kann moduliert werden. Wenn eine Zelle verletzt wird, kommt es meistens zu einem Abfall des zellulären pH-Werts und einem Anstieg des cytosolischen Calciumspiegels. Unter diesen Bedingungen schlieûen sich die Gap Junctions und unterbrechen den elektrischen Strom und den Stofftransport durch die elektrische Synapse. Dieser Mechanismus dient zum Schutz benachbarter Zellen vor einer Zellschädigung. l l l An chemischen Synapsen wird das elektrische Signal der präsynaptischen Zelle in ein chemisches Signal umgewandet Signalübertragung an chemischen Synapsen. Chemische Synapsen stellen die vorherrschende Form der synaptischen Signalübertragung im zentralen und peripheren Nervensystem dar. Neben der Signalübertragung zwischen Neuronen vermitteln chemische Synapsen die Signalübertragung von Neuronen auf Muskelzellen (neuromuskuläre Synapse) oder von Neuronen auf Drüsenzellen. Im Gegensatz zu elektri- präsynaptisch (Zelle 1) Stimulation 1 Ableitung 40 mV Ableitung Zelle 1 präsynaptische Endigung Stimulation 2 ms Transmitter postsynaptisch (Zelle 2) postsynaptische Rezeptoren A) erregende Synapse Ableitung 10 mV postsynaptische Endigung Zelle 2 Ableitung 2 B) inhibitorische Synapse Ableitung Abb. 2-2. Struktur und Funktionsweise chemischer Synapsen. Links und in der Mitte ist schematisch die Verbindung zweier Zellen über eine chemische Synapse dargestellt. Rechts: Elektrische Stimulation erzeugt ein Aktionspotential in der präsynaptischen Zelle 1 (oben). Das Aktionspotential ruft eine zeitlich ver- zögerte Potentialänderung in der postsynaptischen Zelle 2 hervor (unten). Handelt es sich um eine erregende Synapse (A), wird die postsynaptische Zelle depolarisiert. An einer inhibitorischen Synapse kommt es zu einer Hyperpolarisation der postsynaptischen Zelle (B) schen Synapsen vermitteln chemische Synapsen grundsätzlich eine gerichtete Signalübertragung: Der Erregungsfluss verläuft von der präsynaptischen zur postsynaptischen Zelle und ist nicht umkehrbar. Zwischen prä- und postsynaptischer Membran von chemischen Synapsen (Abb. 2-2, Abb. 2-3 a) liegt der Extrazellulärraum, der einen 20±40 nm breiten synaptischen Spalt bildet. Zwischen den Zellen besteht kein leitender Kontakt, der eine direkte Übertragung elektrischer Signale ermöglichen würde. Stattdessen führt ein Aktionspotential der vorgeschalteten Zelle an der präsynaptischen Endigung zur Freisetzung eines chemischen Überträgerstoffs (Transmitter) aus synaptischen Vesikeln. Dadurch wird das zunächst als Ionenstrom entlang der äuûeren Plasmamembran fortgeleitete Signal in ein chemisches Signal (Transmitter) umgewandelt, das dann als Botenstoff den synaptischen Spalt zwischen präund postsynaptischer Zelle überquert. Der Transmitter diffundiert durch den synaptischen Spalt und bindet an spezialisierte Rezeptoren der postsynaptischen Membran. Die Bindung des Transmitters an die Rezeptoren löst einen Ionenstrom oder eine Enzymkaskade aus, was eine Depolarisation (erregende Synapsen) oder Hyperpolarisation (hemmende Synapsen) der postsynaptischen Zelle zur Folge haben kann. Somit wird das chemische Signal durch die postsynaptische Zelle wieder in ein elektrisches umgewandelt. Durch die Umwandlung des elektrischen Signals in ein chemisches entsteht an chemischen Synapsen eine Verzögerung in der Signalübertragung zwischen prä- und postsynaptischer Zelle von 2±3 ms (synaptic delay). synaptische Membranverdichtungen im Elektronenmikroskop sichtbar. Direkt gegenüber der aktiven Zone ist, durch den synaptischen Spalt getrennt, die postsynaptische Dichte als dunkle Struktur erkennbar. Die postsynaptische Dichte reicht etwa 30 nm in das Cytosol der postsynaptischen Zelle hinein und enthält einen hochkomplexen biochemischen Apparat. Dieser ist aus postsynaptischen Transmitterrezeptoren, intrazellulären Signalproteinen und Ankerproteinen (s. u.) aufgebaut. Die meisten erregenden Synapsen im Gehirn sind im Bereich des Dendritenbaums und dort an dendritischen Dornfortsätzen (Spines; Abb. 2-3 a, Abb. 2-13, Abb. 2-16, Abschn. B-1.1) lokalisiert. Spines sind kleine knopfartige Auswüchse der Dendriten. Inhibitorische Synapsen dagegen befinden sich meist direkt am Zellkörper. Struktur zentraler Synapsen. Die typische Ultrastruktur einer zentralen Synapse ist in Abb. 2-3 a illustriert. Die präsynaptische Endigung ist dicht mit Vesikeln gefüllt. Die aktive Zone, an der die Transmitterfreisetzung erfolgt, ist durch prä- Struktur von Synapsen im peripheren Nervensystem. Die Axone postganglionärer Neurone verzweigen sich in oder auf den Zielorganen und bilden ein Vielzahl von kleinen Auftreibungen (Varikositäten) aus. Die Varikositäten sind mit Vesikeln gefüllt, die den Transmitter enthalten. Dieser wird bei Aktivität des präsynaptischen Neurons ausgeschüttet und löst nach Bindung an spezifische Rezeptoren eine Antwort der postsynaptischen Zelle aus (Abschn. B-1.1, C-4.1). Physiologische Eigenschaften chemischer Synapsen. Die Eigenschaften chemischer Synapsen unterscheiden sich in vielen Punkten von denen elektrischer Synapsen. Neben der Tatsache, dass der Signalfluss nur in eine Richtung stattfindet, liegt ein weiterer wesentlicher Unterschied darin, dass die Übertragung an chemischen Synapsen nicht einer einfachen 1:1-Regel gehorcht. Nur Aktionspotentiale (Abschn. A-9.5, B-1.4), jedoch keine unterschwelligen Spannungsänderungen können von der präsynaptischen auf die postsy2.1 Überblick über die Funktionsweise von Synapsen y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 29 Motoneuron neuromuskuläre Synapse Muskelfaser a Schicht aus Schwann-Zellen Myelin Endplattenregion Axon präsynaptische Endknöpfchen Mitochondrium synaptische Vesikel (ACh) Calciumkanal präsynaptische Membran synaptischer Spalt postsynaptische Membran Basalmembran ACh-Rezeptoren aktive Zone subsynaptische Einfaltung 30 c b Abb. 2-3. Struktur von Synapsen. (a) Ultrastruktureller Aufbau erregender Synapsen im Hippocampus der erwachsenen Maus. Man erkennt die präsynaptischen Axonendigungen (1) mit zum Teil zahlreichen synaptischen Vesikeln und präsynaptischen Membranverdichtungen sowie postsynaptische dendritische Dornfortsätze (Spines; 2) mit postsynaptischen Membranverdichtungen. Vergröûerung ca. 20 000fach. Bild von B. Brühl, Heidelberg. (b) Schematischer Aufbau der neuromuskulären Synapse mit präsynaptischem Motoneuron, das an der motorischen Endplatte Kontakt zu einer Muskelfaser unterhält. (c) Ult- rastruktureller Aufbau der neuromuskulären Synapse des M. soleus einer Maus (Skalierungsbalken = 1 mm). Die Nervenendigung (NT) ist von einer Schwann-Zelle (S) überlagert und enthält die synaptischen Vesikel. Die Nervenendigung liegt gegenüber der postsynaptischen Membran, deren Einfaltungen deutlich zu erkennen sind. Der Pfeil markiert den primären, der Stern den sekundären synaptischen Spalt. Synaptische Einfaltungen trennen das Sarkoplasma (X), die subsynaptischen Nuclei (N), Mitochondrien (m) und Myofibrillen (f) von der postsynaptischen Membran. Bild von O. Henschel und V. Witzemann, Heidelberg naptische Zelle weitergeleitet werden. Daneben setzt ein präsynaptisches Aktionspotential in der Regel nicht genug Transmitter frei, um ein postsynaptisches Aktionspotential auszulösen. Zwei Ausnahmen stellen die neuromuskuläre Synapse (s. u.) und die Synapsen zwischen Kletterfasern und Purkinje-Zellen des Kleinhirns dar. Die Erregung der präsynaptischen Zelle (d. h. das Feuern von Aktionspotentialen) führt je nach Art des freigesetzten Transmitters und der postsynaptischen Rezeptoren entweder zu einer Erregung oder Hemmung der postsynaptischen Zelle. Die chemische Über- tragung ist zwar langsamer als die elektrische, hat aber den Vorteil, dass die Übertragungseigenschaften chemischer Synapsen vielfach modifizierbar sind. Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* é pp p A PH BC 2.2 Die Weiterleitung elektrischer Signale auf andere Zellen des Nervensystems oder auf periphere Zielzellen kann auf zwei verschiedenen Wegen erfolgen: Elektrische Synapsen vermitteln über Gap Junctions die meist ungerichtete, elektrotonische Weiterleitung von Potentialänderungen und dienen damit vornehmlich zur Synchronisation der elektrischen Aktivität von Zellverbänden. Chemische Synapsen, die vorherrschende Form der Signalübertragung zwischen Neuronen, vermitteln hingegen eine gerichtete, zeitlich verzögerte Signalweiterleitung, die zur Erregung oder Hemmung der postsynaptischen Zelle führt. Die Modifizierbarkeit der Signalweiterleitung an chemischen Synapsen spielt eine wichtige Rolle bei der Informationsverarbeitung im Gehirn und bildet die Grundlage für Lernen und Gedächtnis. Die neuromuskuläre Synapse als Modellsystem chemischer Synapsen l l l Neuromuskuläre Synapsen und chemische Synapsen des ZNS und des vegetativen Nervensystems unterscheiden sich strukturell erheblich, dennoch kann die neuromuskuläre Synapse als Modellsystem für chemische Synapsen dienen Struktur der neuromuskulären Synapse. Die Signalweiterleitung von Motoneuronen auf Skelettmuskelfasern wird durch die neuromuskuläre Synapse vermittelt. Da ihr struktureller Aufbau relativ einfach ist (Abb. 2-3 b, c) und elektrophysiologische Ableitungen von der postsynaptischen Zelle (der Muskelfaser) bereits seit langem möglich sind, ist sie die am besten untersuchte chemische Synapse bei Vertebraten. Das von einem motorischen Nerv kommende Axon verzweigt sich nahe der Muskelfaser in mehrere dünne ¾ste (Abb. 2-3 b). Die Enden dieser ¾ste verdicken sich zu den synaptischen Endknöpfchen, die über Einfaltungen der postsynaptischen Membran liegen und die motorische Endplatte ausbilden. Jedes synaptische Endknöpfchen besitzt alle Komponenten, die notwendig sind, um Neurotransmitter auszuschütten. Dazu gehören sowohl synaptische Vesikel als auch die aktive Zone (Abb. 2-3 b, c), in der sich präsynaptische Calciumkanäle befinden, die den Einstrom von Calcium während präsynaptischer Aktionspotentiale vermitteln (s. u.). Aus den synaptischen Endknöpfchen wird der Neurotransmitter Acetylcholin freigesetzt, daher werden diese Synapsen cholinerge Synapsen genannt. Clustering von postsynaptischen Rezeptoren an der neuromuskulären Synapse. Die postsynaptischen Acetylcholinre- 1. Synthese und Speicherung von Transmitter in Vesikeln präsynaptische Endigung 1. Ca2+ Ca2+ 2. 6. 3. 2. präsynaptisches Aktionspotential des Motoneurons, Öffnung spannungsaktivierter Ionenkanäle und Einstrom von Calcium 3. Fusion der Vesikel mit der Membran und Ausschüttung des Transmitters 4. Bindung des Transmitters an postsynaptische Rezeptoren 4. 5. postsynaptische Membran 5. Öffnung postsynaptischer Ionenkanäle, postsynaptischer Strom 6. Inaktivierung des Transmitters Abb. 2-4. Schematische Abfolge der Vorgänge der synaptischen Übertragung einer chemischen Synapse. Die Schritte 1±6 sind im Text näher erläutert. Nach Purves D, Augustine GJ, Fitzpatrick D, Katz LC, LaMantia AS, McNamara JO, Williams SM. Neuroscience, 2. Aufl. Sinauer Ass., Sunderland (2001) zeptoren (s. u.) sind an den oberen Rändern der Einfaltungen in einer sehr hohen Dichte (> 10 000 mm±2) konzentriert (Abb. 2-3 b, c). Die Bildung dieser Cluster wird direkt durch Aktivität des präsynaptischen Neurons induziert. Das Motoneuron sezerniert das Proteoglycan Agrin, das in die Basallamina integriert wird, die die postsynaptischen Einfaltungen auskleidet. Agrin führt zur Aktivierung von Musk, einer Rezeptor-Tyrosin-Kinase der Muskelfaser. Musk steuert die Aggregation der postsynaptischen Acetylcholinrezeptoren über das cytoplasmatische Ankerprotein Rapsyn (s. Abb. 2-9). Trotz der dargestellten Unterschiede in ihrem strukturellen und molekularen Aufbau verläuft die Übertragung an den verschiedenen chemischen Synapsentypen nach dem gleichen Prinzip. Die einzelnen Schritte der Übertragung an einer chemischen Synapse sind in Abb. 2-4 in einer Übersicht schematisch dargestellt. Sie werden im Folgenden am Beispiel der neuromuskulären Synapse Schritt für Schritt näher erläutert. l l l 1. Schritt: An chemischen Synapsen wird der Neurotransmitter synthetisiert, in synaptischen Vesikeln angereichert und gespeichert Transmittersynthese. Erste Voraussetzung für die Funktionsfähigkeit einer chemischen Synapse ist die Bildung und Speicherung des chemischen Überträgerstoffs in der präsynaptischen Endigung (Abb. 2-4, 1. Schritt). In der präsynaptischen Endigung der neuromuskulären Synapse wird der Neurotransmitter Acetylcholin durch Veresterung des Aminoalkohols Cholin mit Essigsäure gebildet. Cholin ist im Cytoplasma der präsynaptischen Endigung in einer Konzentration von ungefähr 10 mmol L±1 enthalten und wird über einen hochaffinen Na+-Cholin-Cotransporter aufgenommen. Die Synthese von Acetylcholin wird durch das Enzym Cho- 2.2 Die neuromuskuläre Synapse als Modellsystem chemischer Synapsen y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 31 lin-Acetyltransferase (ChAT) katalysiert. Das Vorhandensein von Cholin-Acetyltransferase gilt als direkter Hinweis darauf, dass ein Neuron Acetylcholin bildet. Verpackung des Transmitters. Der Transmitter liegt nicht frei im Cytosol der präsynaptischen Endigung vor, sondern wird in so genannten synaptischen Vesikeln angereichert. An der neuromuskulären Synapse wird das synthetisierte Acetylcholin durch einen sekundär aktiven Transport im Austausch gegen Protonen (H+) in die synaptischen Vesikel befördert. Die intravesikuläre Acetylcholinkonzentration erreicht dabei 100 mmol L±1 und entspricht einem Gehalt von etwa 10 000 Acetylcholinmolekülen pro Vesikel. Die synaptischen Vesikel sind im elektronenmikroskopischen Bild gut zu erkennen, und es hat den Anschein, dass das gesamte Lumen des präsynaptischen Endkolbens mit Vesikeln ausgefüllt ist (Abb. 2-3). Endosom Dynamin Synapsin Budding Budding Docking Priming Ein in die präsynaptische Endigung einlaufendes Aktionspotential stellt das primäre elektrische Signal zur Transmitterausschüttung dar (Abb. 2-4, 2. Schritt). Durch die Depolarisation der präsynaptischen Membran öffnen sich spannungsgesteuerte Calciumkanäle. Zwischen Extrazellulärraum und Zellinnerem besteht ein steiler Konzentrationsgradient für Calcium: In der extrazellulären Umgebung der Präsynapse beträgt die Calciumkonzentration ca. 1±2 mmol L±1, während im Cytosol des präsynaptischen Endkolbens mit nur 100 nmol L±1 eine 10 000fach geringere Konzentration gemessen wird. Daraus leitet sich nach der Nernst-Gleichung (Abschn. A-9.2) ein Gleichgewichtspotential für Calcium-Ionen von +116 mV ab. Nach Öffnung der Calciumkanäle folgen die Calcium-Ionen ihrem elektrochemischen Gradienten und strömen durch die Membranbarriere in die Präsynapse ein. In kürzester Zeit steigt die intrazelluläre Calciumkonzentration an. Dieser transiente Anstieg der Calciumkonzentration stellt das Signal für die Freisetzung des Transmitters in den synaptischen Spalt dar. Vesikel-Priming. Die meisten Vesikel der Präsynapse bilden eine Reservepopulation: Sie werden durch das vesikuläre Membranprotein Synapsin stabilisiert und sind noch nicht zur unmittelbaren Transmitterfreisetzung bereit. Um die Fusion zu ermöglichen, fügen sich die in der Plasmamembran lokalisierten Proteine Syntaxin und SNAP-25 (synaptosomassoziiertes Protein mit 25 kDa Molekülmasse) mit dem Vesikelprotein Synaptobrevin zu einem so genannten Kernkomplex zusammen (Abschn. A-16.6). Ausschlieûlich diese membrangebundenen Vesikel lassen sich in einem zweiten, als Priming bezeichneten Schritt zu fusionsbereiten Vesikeln aktivieren (Abb. 2-5). Sie stellen die Fraktion dar, die durch den Calciumanstieg während des Aktionspotentials aktivierbar ist und ihren Inhalt in den synaptischen Spalt ausschütten kann. Die Ausbildung fusionsbereiter Vesikel ist ein energieabhängiger Prozess, der durch die ATPase NSF (N-ethylmaleimide-sensitive factor) katalysiert wird. 32 Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* Clathrin Synaptotagmin NFS SNAPs l l l 2. Schritt: Präsynaptische Aktionspotentiale führen zu einem Einstrom von Calcium in die präsynaptische Endigung Fusion SNAREs Ca2+ Abb. 2-5. Präsynaptische Proteine steuern die Fusion der transmitterhaltigen Vesikel mit der präsynaptischen Membran. Zunächst werden die Vesikel von Endosomen abgeschnürt (Budding). Anschlieûend werden sie für die Fusion vorbereitet (Priming) und lagern sich an der präsynaptischen Membran an (Docking). Unter Einfluss von Calcium verschmelzen die Membranen von Vesikel und Präsynapse. Synaptotagmin dient als Calciumsensor und Vermittler der Membranfusion. In den Folgeschritten werden präsynaptische Membranabschnitte abgeschnürt und als Vesikel wieder in den Vorrat sekretorischer Vesikel überführt. NSF = N-Ethylmaleimid-sensitiver Faktor; SNAP = soluble NSF-attachment protein; SNARE = soluble NSFattachment protein receptor Giftwirkungen durch Hemmung der präsynaptischen Transmitterfreisetzung. An der Präsynapse greifen die Bakteriengifte von Clostridien an und hemmen die Freisetzung von Neurotransmittern (s. Tab. 2-5). Diese anaeroben Bakterien keimen unter Luftabschluss aus Sporen aus und bilden Neurotoxine mit Protease-Aktivitäten, die spezifisch präsynaptische Vesikelproteine spalten. In verdorbenen Lebensmittelkonserven kann Clostridium botulinum (Abschn. A-23.5) unter Luftabschluss ein Gift bilden, das nach Nahrungsaufnahme und enteraler Resorption die cholinerge Präsynapse motorischer und vegetativer Nerven angreift und zu Paresen (schlaffen Lähmungen) führt. Botulinustoxine spalten überwiegend Syntaxin und SNAP-25. Anaerobe Bedingungen in tiefen und verunreinigten Wunden stellen die geeignete Umgebung für das Auskeimen der Sporen von Clostridium tetani dar, dessen Gift vornehmlich hemmende glycinerge Synapsen (Abschn. B-2.5) angreift und das Vesikelprotein Synaptobrevin spaltet. Der Verlust der neuronalen Inhibition führt zum Wundstarrkrampf (Tetanus), dessen Symptome einer Strychinvergiftung gleichen. l l l 3. Schritt: Der Anstieg der präsynaptischen Calciumkonzentration löst eine Fusion der synaptischen Vesikel mit der präsynaptischen Membran aus Die durch das präsynaptische Aktionspotential induzierte Erhöhung der Calciumkonzentration löst die Fusion der synaptischen Vesikel mit der Plasmamembran des präsynaptischen Neurons aus (Abb. 2-4, 3. Schritt). Dieser Vorgang wird durch das in der Membran der neurotransmitterhaltigen Vesikel vorhandene Protein Synaptotagmin (Abb. 2-5) vermittelt. Synaptotagmin trägt zwei Bindungsstellen für Calcium-Ionen. Bei niedrigen Calciumkonzentrationen interagiert Synaptotagmin mit dem Kernkomplex, wobei die fusionsbereiten Vesikel in unmittelbarer Nähe zur präsynaptischen Membran fixiert werden (Abschn. A-16.6). Diese Interaktion bricht nach Calciumeinstrom in kürzester Frist zusammen. Bindung von Calcium an Synaptotagmin hebt die Wechselwirkung mit dem Kernkomplex auf und ermöglicht die Vesikelfusion, d. h. das Verschmelzen der Phospholipiddoppelschichten von synaptischem Vesikel und präsynaptischer Membran. Durch die Ausbildung einer Fusionspore entsteht eine durchgehende Verbindung vom Vesikelinneren zum Extrazellulärraum (Abb. 2-5), und der Transmitter wird in den synaptischen Spalt freigesetzt. Eine Reduktion der extrazellulären Calciumkonzentration führt zu einem verminderten Calciumeinstrom in die präsynaptische Endigung und zu verminderter Transmitterausschüttung bis hin zu einer Blockierung der synaptischen Übertragung. Eine ähnliche Wirkung wird durch Erhöhung der extrazellulären Magnesiumkonzentration erzielt. Magnesium verdrängt kompetitiv Calcium-Ionen von den präsynaptischen Calciumkanälen. An der neuromuskulären Synapse führen beide Manipulationen zu einer Relaxation. Recycling von Vesikelmembran. Die Fusion eines synaptischen Vesikels fügt neue Membranabschnitte zur Plasmamembran der präsynaptischen Endigung hinzu. Diese zusätzliche Membran wird innerhalb kurzer Zeit durch Endocytose als ¹coated vesicleª wieder in das Cytoplasma der präsynaptischen Endigung aufgenommen. Nach Einschleusung in Endosomen wird die wieder aufgenommene Membran schlieûlich zur Herstellung neuer synaptischer Vesikel verwendet (Abschn. A-16.6). l l l 4. Schritt: Der freigesetzte Transmitter diffundiert durch den synaptischen Spalt und bindet an Rezeptoren der postsynaptischen Membran Nach seiner Freisetzung durch das Motoneuron trifft Acetylcholin an der postsynaptischen Membran der Muskelfaser auf spezifische Rezeptoren (Abb. 2-4, 4. Schritt). Diese Rezeptoren sind Transmembranproteine, die neben Bindungsdomänen für Acetylcholin auch einen selektiven Ionenkanal beinhalten. Daher nennt man sie Acetylcholinrezeptorkanäle (Abschn. B-2.5). Die erregende Acetylcholinwirkung an der motorischen Endplatte lässt sich durch Gabe des giftigen Tabakalkaloids Nicotin experimentell imitieren. Daher be- zeichnet man die an der motorischen Endplatte vorhandene Rezeptorklasse auch als nicotinische Acetylcholinrezeptoren (s. Abb. 2-9, Abb. 2-10). Im Gegensatz dazu werden muscarinische Acetylcholinrezeptoren durch das Pilzgift Muscarin aktiviert (s. u.). Sobald zwei Moleküle Acetylcholin an den nicotinischen Acetylcholinrezeptor des Skelettmuskels binden, kommt es zu einer Konformationsänderung des Rezeptors und zur Öffnung seines intramolekularen Kationenkanals. Nach kurzer Zeit schlieût sich der Rezeptorkanal wieder. l l l 5. Schritt: Die Bindung des Transmitters an postsynaptische Rezeptoren löst elektrische Signale in der postsynaptischen Zelle aus Ligand-Rezeptor-Wechselwirkung. Wenn das in den synaptischen Spalt der neuromuskulären Endplatte ausgeschüttete Acetylcholin an die postsynaptischen Rezeptorkanäle bindet, kommt es zu einer kurzzeitigen Öffnung der Rezeptorkanäle (Abb. 2-4, 5. Schritt; Abb. 2-6). Die Öffnungsdauer der Einzelkanäle ist unterschiedlich lang und ruft daher entsprechend lange Einzelkanalströme hervor. Die Summe aller an der postsynaptischen Membran ausgelösten Einzelkanalströme bildet den Gesamtstrom der postsynaptischen Zelle, den so genannten Endplattenstrom (EPS; Abb. 2-6). Dieser wird normalerweise durch die Öffnung von mehr als 200 000 Einzelkanälen hervorgerufen. Der Endplattenstrom ist an der neuromuskulären Synapse ein Einwärtsstrom, d. h. ein Nettoeinstrom von positiven Ladungen in die Muskelfaser. Der Endplattenstrom führt zu einer Potentialänderung der postsynaptischen Zelle, dem Endplattenpotential (EPP; Abb. 2-6), das die Muskelfaser depolarisiert. Besonderheit neuromuskulärer Synapsen. Die neuromuskuläre Synapse zeichnet sich nicht nur durch eine besondere molekulare Anatomie aus (s. o.), sondern weist auch einige entscheidende physiologische Unterschiede zu Synapsen auf, die zwischen Neuronen gebildet werden. Besonderes Merkmal der neuromuskulären Endplatte ist die Gröûe der synaptischen Potentiale, deren Amplitude in der Regel überschwellig ist. Daher führt im Normalfall jedes Endplattenpotential zur Öffnung von spannungsaktivierten Ionenkanälen und zur Bildung eines Aktionspotentials. Das Aktionspotential breitet sich über die gesamte Skelettmuskelfaser aus und bewirkt deren Kontraktion. An glutamatergen oder anderen Synapsen des ZNS müssen demgegenüber, aufgrund der viel kleineren Amplitude, mehrere postsynaptische Potentiale zusammentreffen, bevor die Depolarisationsschwelle zum Aktionspotential überschritten wird (Abschn. B-2.6). 2.2 Die neuromuskuläre Synapse als Modellsystem chemischer Synapsen y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 33 ranständigen Transporter (Na+-Cholin-Cotransport; s. o.) erneut in die Präsynapse aufgenommen wird und zur Resynthese von Acetylcholin dient, wird Essigsäure im Intermediärstoffwechsel abgebaut (Citratzyklus; Abschn. A-6.3, A-11.3). ACh 1 2 3 4 5 6 2 ms 3 pA Strom durch ACh-gesteuerte Einzelkanäle a 1 5 4 3 3 pA 6 2 Summe der Einzelkanalströme 2 ms b 5 nA Gesamtstrom der postsynaptischen Zelle (=EPS) c 10 mV Potentialänderung der postsynaptischen Zelle (=EPP) d Abb. 2-6. Entstehung eines postsynaptischen Stroms und einer postsynaptischen Potentialänderung an der neuromuskulären Synapse. (a) Die Freisetzung von Acetylcholin (ACh) bewirkt die Öffnung einzelner Rezeptorkanäle in der postsynaptischen Membran (Membranpotential Em = ±70 mV). (b) Zeitlicher Verlauf des Summenstroms durch die sechs in (a) dargestellten Einzelkanäle. (c) Die Summe aller an der postsynaptischen Membran ausgelösten Einzelkanalströme repräsentiert den Gesamtstrom der postsynaptischen Zelle, den Endplattenstrom (EPS). Der langsame Abfall des EPSC (excitatory postsynaptic current) veranschaulicht das zufällige, zeitlich verzögerte Schlieûen der Einzelkanäle. (d) Der Endplattenstrom führt zu einer Potentialänderung der postsynaptischen Zelle, dem Endplattenpotential (EPP) l l l 6. Schritt: Das freigesetzte Acetylcholin wird im synaptischen Spalt inaktiviert Nach Freisetzung und Rezeptorbindung wird die chemische Übertragung durch Inaktivierung des Transmitters beendet (Abb. 2-4, 6. Schritt). Neben dem Apparat zur präsynaptischen Freisetzung verfügt die neuromuskuläre Synapse über Mechanismen zur Inaktivierung von Acetylcholin durch das Enzym Acetylcholinesterase, das Acetylcholin hydrolytisch in Cholin und Essigsäure spaltet. Diese Endprodukte gelangen wieder in die Zellen. Während Cholin über einen memb34 Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* Molekularer Aufbau der Acetylcholinesterase und Hemmstoffe. Acetylcholinesterase ist ein aus mehreren Untereinheiten bestehendes Protein, das über Membrananker mit der postsynaptischen Membran verbunden ist. Als Membrananker dient eine Proteindomäne mit der Sekundärstruktur einer Kollagentripelhelix (Abschn. B-17.2). Im katalytischen Zentrum der Acetylcholinesterase liegt ein Serinrest vor, wie er auch von Serin-Proteasen bekannt ist. Die chemische Blockade dieses Serinrests durch Kampfgifte (z. B. das Nervengas Sarin) führt zunächst zu einer Steigerung der cholinergen Neurotransmission und zu Krämpfen. Durch die Dauerdepolarisation des Muskels kommt es anschlieûend zur Muskellähmung. Insektizide wie E 605 verbinden sich irreversibel mit Acetylcholinesterase und machen sie dadurch unwirksam. Eserin (Physostigmin) und Neostigmin sind reversible Hemmstoffe der Acetylcholinesterase. Nicht-enzymatische Funktionen der Acetylcholinesterase. Die Tatsache, dass Acetylcholinesterase in der Frühentwicklung des Nervensystems vor Einsetzen der Synthese von Acetylcholin exprimiert wird, war der Anlass, nach nicht-enzymatischen Funktionen der Acetylcholinesterase zu suchen. Inzwischen ist gesichert, dass die Acetylcholinesterase auch Funktionen eines Zelladhäsionsmoleküls ausübt (Abschn. B-17.2). Lokalisation von Acetylcholinrezeptoren und Acetylcholinesterase. An der motorischen Endplatte weisen Acetylcholinrezeptoren und Acetylcholinesterase eine besondere Verteilung auf: Während die Rezeptoren auf den Spitzen der subsynaptischen Einfaltungen sitzen, findet sich das Enzym in den postsynaptischen Falten. Auf diese Weise entfaltet der durch den postsynaptischen Spalt diffundierende Neurotransmitter zunächst seine Wirkung auf die Rezeptoren, bevor er schlieûlich auf das Enzym trifft und abgebaut wird. Da die Inaktivierung im Moment der Freisetzung des Transmitters beginnt, kommt es zu einer Konkurrenz von Inaktivierung und Rezeptorwirkung des Transmitters. Infolgedessen steigern Pharmaka, die abbauende Enzyme oder die Wiederaufnahmesysteme hemmen, die Konzentration des Neurotransmitters im synaptischen Spalt und verstärken damit seine Wirkung auf die Rezeptoren. 2.3 Box 2-1. Myasthenia gravis Myasthenia gravis ist eine Erkrankung, die etwa einen von 200 000 Menschen betrifft. Sie ist durch eine ausgeprägte Schwäche der Skelettmuskulatur gekennzeichnet, die vor allem bei längerer Aktivität auftritt. Der Grund für diese Muskelschwäche liegt in der Produktion von Antikörpern gegen postsynaptische nicotinische Acetylcholinrezeptoren. Durch die Reduktion der funktionellen Rezeptoren kommt es nach Acetylcholinausschüttung zu einem verkleinerten Endplattenpotential an der neuromuskulären Synapse. Dieses kann dazu führen, dass die Schwelle zur Auslösung von Aktionspotentialen nicht mehr erreicht wird und daher der Muskel nicht kontrahiert. Eine Verbesserung der Situation kann durch Gabe von Hemmern der Acetylcholinesterase (z. B. Neostigmin) erreicht werden, die die Wirkung von Acetylcholin im synaptischen Spalt verstärken. Vergleichbare myasthenische Syndrome können auch durch immunologische und genetische Defekte der Calciumkanäle an der neuromuskulären Präsynapse, des nicotinischen Acetylcholinrezeptors und der Acetylcholinesterase hervorgerufen werden (Tab. 2-1). é An der neuromuskulären Synapse führt ein aktionspotentialinduzierter Anstieg der Calciumkonzentration in der präsynaptischen Endigung zur Freisetzung von Acetylcholin in den synaptischen Spalt. Das freigesetzte Acetylcholin bindet an nicotinische Acetylcholinrezeptoren an der postsynaptischen Membran und bewirkt die Öffnung von Ionenkanälen, die einen Ionenstrom über die Muskelfasermembran vermitteln. Der postsynaptische Endplattenstrom führt zur Depolarisation und zur Auslösung von Aktionspotentialen der Muskelfaser. Die synaptische Übertragung wird durch den schnellen enzymatischen Abbau von Acetylcholin beendet. Entstehung postsynaptischer Ströme und Potentiale p PH l l l Die treibende Kraft für Ionenbewegungen über die Plasmamembran ist durch den elektrochemischen Gradienten des Ions gegeben Bestimmung der beteiligten Ionen. Welche Ionen an der Erzeugung des Endplattenpotentials beteiligt sind, wird durch den elektrochemischen Gradienten bestimmt. Der elektrochemische Gradient ist durch den Unterschied zwischen dem aktuellen Membranpotential einer Zelle und dem Gleichgewichtspotential gegeben, das mit Hilfe der Nernst-Gleichung berechnet werden kann (Abschn. A-9.2). Ein Gleichgewichtspotential oder Umkehrpotential ist dasjenige Potential, bei dem die treibende Kraft für die Bewegung eines bestimmten Ions gleich null ist. Stimmt das Membranpotential einer Zelle mit dem Gleichgewichtspotential dieses Ions überein, flieût kein Nettostrom, selbst wenn die entsprechenden Ionenkanäle geöffnet sind. Daher werden auch ± trotz geöffneter Ionenkanäle ± keine Membranpotentialveränderungen ausgelöst. Ist das Membranpotential dagegen negativer als das Umkehrpotential, flieût bei Öffnung von Ionenkanälen, die für Kationen durchlässig sind, ein Nettoeinwärtsstrom, d. h. ein Strom von positiven Ladungen in die Zelle. Der Einwärtsstrom führt zu einer Depolarisation der Zellmembran, bis das Membranpotential mit dem Umkehrpotential übereinstimmt. Ist das Membranpotential positiver als das Umkehrpotential, flieût ein Auswärtsstrom. Ein Ausstrom von positiven Ladungen aus der Zelle führt zu einer Hyperpolarisation. Für negativ geladene Ionen wie Chlorid-Ionen gelten analoge Verhältnisse. Ist das Membranpotential negativer als das Umkehrpotential, führt die Öffnung von Chloridkanälen zu einen Ausstrom von Chlorid-Ionen aus der Zelle, was zu einer Depolarisation führt. Dieser Verlust an negativen Ladungen kann mit einem Gewinn von positiven Ladungen gleichgesetzt werden. Ist das Membranpotential positiver als das Umkehrpotential, strömen Chlorid-Ionen in die Zelle ein und verursachen eine Hyperpolarisation, was mit einem Verlust bzw. einem Auswärtsstrom von positiven Ladungen gleichgesetzt werden kann. Tabelle 2-1. Myasthenische Syndrome: Pathophysiologie der neuromuskulären Synapse Wirkort Syndrom Zielmolekül Pathomechanismus Präsynapse Lambert-EatonSyndrom Myasthenia gravis konnatale Myasthenie konnatale Myasthenie spannungsabhängiger Calciumkanal nicotinischer Acetylcholinrezeptor nicotinischer Acetylcholinrezeptor Acetylcholinesterase Autoantikörper bei Bronchialcarcinom hemmen die Ca2+-abhängige Freisetzung von Acetylcholin Autoantikörper führen zu Verlust oder Blockade von Rezeptoren Mutation einer Rezeptoruntereinheit ändert Acetylcholinbindung oder Leitfähigkeit des Ionenkanals verminderter Abbau steigert die Konzentration von Acetylcholin und führt zu Rezeptordesensitivierung Neurotransmitterrezeptor Inaktivierung des Transmitters 2.3 Entstehung postsynaptischer Ströme und Potentiale y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 35 l l l Das Umkehrpotential synaptischer Ströme wird mit Hilfe der Spannungsklemmtechnik bestimmt Voltage Clamp (Spannungsklemme). Das Umkehrpotential eines Stroms kann mit der Spannungsklemmmethode bestimmt werden (Abschn. B-1.5). Dabei wird das Membranpotential mit Hilfe von Mikroelektroden schrittweise auf vorgegebene Werte angehoben oder gesenkt (¹geklemmtª). Wenn sich unter diesen Bedingungen Ionenkanäle der Membran öffnen, muss der dadurch entstehende Ionenstrom durch den Strom der Mikroelektroden ausgeglichen werden. Dieser Ausgleichsstrom spiegelt die Membranströme wider und erlaubt es, den Ionenstrom zu messen. Mit dieser Methode hat man beobachtet, dass sich der acetylcholininduzierte Einwärtsstrom der Muskelfaser bei positiver werdendem Membranpotential verkleinert (Abb. 2-7). Bei Anhebung des Membranpotentials auf etwa 0 mV konnte kein Strom mehr beobachtet werden, d. h. das Umkehrpotential war erreicht. Bei Membranpotentialen, die positiver als 0 mV waren, kehrte der Strom seine Richtung um und wurde zu einem Auswärtsstrom (Abb. 2-7). Der nicotinische Acetylcholinrezeptor als unspezifischer Kationenkanal. Nach der Nernst-Gleichung liegt das Gleichgewichtspotential für Kalium-Ionen in der Skelettmuskelfaser bei etwa ±100 mV, das für Natrium-Ionen bei etwa +60 mV und das für Chlorid-Ionen bei etwa ±50 mV. Das Gleichgewichtspotential für den Ionenfluss durch Kanäle, die selektiv für ein Ion durchlässig sind, entspricht dem Potential, das mit der Nernst-Gleichung berechnet werden kann (z. B. spannungsaktivierte Natriumkanäle; Abschn. B-1.5). Daher muss es sich bei dem acetylcholininduzierten Strom, dessen Gleichgewichtspotential bei Null liegt, um einen gemischten Ionenfluss handeln. Die Identität der beteiligten Ionen wurde ermittelt, indem ihre Konzentration in der Extrazellulärlösung experimentell variiert und die Folgen dieser Veränderungen auf das Umkehrpotential untersucht wurden. Diese Versuche ergaben, dass der geöffnete Acetylcholinrezeptorkanal die monovalenten Kationen Natrium und Kalium simultan, wenn auch in verschiedene Richtungen, passieren lässt. Der Acetylcholinrezeptor ist also ein unspezifischer Kationenkanal, der sich nur nach Bindung des Liganden Acetylcholin, nicht aber durch eine Spannungsänderung an der Membran öffnet. Es gibt jedoch weitere Einflüsse auf das Gleichgewichtspotential eines Stroms. Bei Kanälen, die für mehrere Ionen leitfähig sind, wird das Gleichgewichtspotential des Gesamtstroms nicht nur durch die Gleichgewichtspotentiale der einzelnen Ionen bestimmt, sondern auch durch die relative Leitfähigkeit für die jeweils durchströmenden Ionen. Das Umkehrpotential des Endplattenstroms entspricht nicht dem arithmetischen Mittelwert der Umkehrpotentiale für Natrium- und Kalium-Ionen (±40 mV), sondern liegt mit 0 mV näher am Natriumumkehrpotential. Dies bedeutet, dass der Acetylcholinrezeptorkanal eine höhere Leitfähigkeit für Natrium- als für Kalium-Ionen besitzt. Postsynaptische Ströme haben einen kürzeren Zeitverlauf als die daraus resultierenden Potentialveränderungen. Wie 36 Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* Em = ENa (+60 mV) K+ postsynaptisches Potential postsynaptischer Strom Acetylcholin Acetylcholin Hyperpolarisation Auswärtsstrom a Em = EGleichgew (0 mV) K+ keine Potentialänderung kein Strom Na+ b Em = Ruhepotential (–70 mV) K+ Einwärtsstrom Na+ c E m = EK d Depolarisation (–100 mV) Depolarisation Einwärtsstrom Na+ Abb. 2-7. Abhängigkeit postsynaptischer Potentialänderungen und Ströme vom Membranpotential der postsynaptischen Muskelfaser. (a) Liegt das postsynaptische Membranpotential (Em) bei +60 mV, d. h. beim Gleichgewichtspotential für Natrium (ENa), so findet bei Öffnung der Acetylcholinrezeptorkanäle nur ein Ausstrom von Kalium, jedoch keine Nettobewegung von Natrium statt. Dies verursacht eine Hyperpolarisation und einen Nettoauswärtsstrom. (b) Entspricht das Membranpotential dem Gleichgewichtspotential (0 mV), so flieût trotz geöffneter Ionenkanäle kein Nettostrom. Daher findet auch keine Potentialänderung statt. (c) Beim Ruhemembranpotential (±70 mV) kommt es sowohl zu einem Auswärtsstrom von Kalium als auch zu einem Einwärtsstrom von Natrium. Da der Natriumeinstrom überwiegt, wird die postsynaptische Membran depolarisiert, und es findet ein Nettoeinwärtsstrom statt. (d) Entspricht des Membranpotential dem Kaliumgleichgewichtspotential (EK), kommt es zu einem Nettoeinwärtsstrom und einer Depolarisation, die allein durch den Einstrom von Natrium getragen wird. Nach Purves D, Augustine GJ, Fitzpatrick D, Katz LC, LaMantia AS, McNamara JO, Williams SM. Neuroscience, 2. Aufl. Sinauer Ass., Sunderland (2001) in Abb. 2-6 und Abb. 2-7 zu erkennen ist, steigt der Endplattenstrom der neuromuskulären Synapse schneller an und fällt auch wieder schneller ab als das daraus resultierende Endplattenpotential. Während der Endplattenstrom das Öffnen und Schlieûen der acetylcholinaktivierten Rezeptorkanäle widerspiegelt (Abschn. B-1.5), ergibt sich der langsamere zeitliche Verlauf der Potentialänderung durch die passiven elektrischen Eigenschaften der postsynaptischen Membran. Die zeitliche Verzögerung wird vor allem durch die Membrankapazität bedingt (Abschn. A-1.5), die durch den Ionenstrom zunächst umgeladen werden muss (Abschn. B-1.6). l l l Die Menge des freigesetzten Transmitters hängt direkt von der präsynaptischen Calciumkonzentration ab Die Menge des ausgeschütteten Neurotransmitters ist eine direkte Funktion des Calciumeinstroms in die präsynaptische Endigung. Daher wirken sich alle Mechanismen, die die präsynaptische Calciumkonzentration beeinflussen, auch auf die Transmitterfreisetzung aus. Prinzipiell steigt der Einstrom von Calcium über die spannungsgesteuerten präsynaptischen Calciumkanäle mit der Aktionspotentialfrequenz und der Dauer der synaptischen Stimulation an. Mit Erhöhung der Transmitterfreisetzung erhöht sich damit auch die Amplitude des postsynaptischen Potentials. In vielen Nervenzellen wird nach einer tetanischen Stimulation, d. h. einer kurzen, hochfrequenten Reizung des präsynaptischen Neurons beobachtet, dass nachfolgende, einzelne Aktionspotentiale eine gröûere postsynaptische Depolarisation hervorrufen als vor der tetanischen Reizung. Dieser Effekt wird posttetanische Potenzierung genannt. Die posttetanische Potenzierung kommt dadurch zustande, dass die Calciumkonzentration in der präsynaptischen Endigung nach der starken Stimulation noch nicht auf ihren Ruhewert zurückgefallen ist. Die vorübergehende Erhöhung der präsynaptischen Calciumkonzentration führt dann bei erneuter Reizung zu einer verstärkten Transmitterausschüttung. An vielen Synapsen nimmt die Amplitude der postsynaptischen Potentiale bei lang anhaltender hochfrequenter Stimulation dagegen ab. Dieser Effekt beruht darauf, dass die Geschwindigkeit des Vesikel-Recyclings in der präsynaptischen Membran (Abschn. B-2.2) nicht ausreicht, um dauerhaft eine ausreichende Zahl fusionsbereiter Transmittervesikel bereitzustellen. l l l Die Freisetzung von Transmittern erfolgt in festgesetzten ¹Quantenª Indirekte Bestimmung der Transmitterkonzentration. Die Acetylcholinkonzentration im synaptischen Spalt lässt sich zwar nicht direkt messen, kann aber indirekt bestimmt werden. Werden postsynaptische Aktionspotentiale experimentell unterdrückt, spiegelt die Höhe des Endplattenpotentials die Zahl der aktivierten Acetylcholinrezeptoren wider. Letztere ist wiederum von der Konzentration des Neurotransmitters im synaptischen Spalt abhängig. Die Transmitterkonzentration im synaptischen Spalt kann jedoch nicht stufenlos verändert werden. Dementsprechend ändert sich auch die postsynaptische Depolarisationsamplitude nur stufenweise. Die kleinste Einheit der Transmitterfreisetzung, die etwa der Menge von 10 000 Acetylcholinmolekülen entspricht, wurde von dem Neurophysiologen Bernard Katz als Quantum bezeichnet. Inzwischen weiû man, dass ein Quantum dem Acetylcholingehalt eines präsynaptischen Vesikels entspricht und die Transmitterfreisetzung in Quanten somit die vesikuläre Acetylcholinfreisetzung widerspiegelt. Ein Aktionspotential setzt normalerweise mehrere Hundert Quanten frei. Auch im ruhenden Muskel werden 1±2 Vesikel pro Sekunde spontan freigesetzt. Diese spontane Acetylcholinfreiset- zung führt zu den so genannten Miniaturendplattenpotentialen, deren Funktion noch nicht geklärt ist. é 2.4 Die Ionenbewegungen, die nach Öffnung transmittergesteuerter postsynaptischer Ionenkanäle stattfinden, sind vom elektrochemischen Gradienten und von der Leitfähigkeit der Kanäle für das betreffende Ion abhängig. Je nach dem Verhältnis zwischen aktuellem Membranpotential und Umkehrpotential der beteiligten Ionen führt die Öffnung von Ionenkanälen somit zu einem Einwärtsstrom und einem depolarisierenden postsynaptischen Potential oder zu einem Auswärtsstrom und einer postsynaptischen Hyperpolarisation. Neurotransmitter und Neuromodulatoren A PH l l l Ein Neurotransmitter ist durch einen Katalog spezifischer Kriterien definiert. Ein Neuromodulator erfüllt diese Kriterien nur teilweise Allgemeines. Die Übertragung an chemischen Synapsen wird durch eine Vielzahl neurobiologisch aktiver Substanzen vermittelt, deren Bindung an entsprechende Rezeptoren die elektrischen Membraneigenschaften der postsynaptischen Zellen verändert. Chemische Synapsen werden nach der Substanz benannt, die von ihnen freigesetzt wird: Acetylcholin freisetzende Synapsen heiûen cholinerg; Synapsen, an denen Glutamat ausgeschüttet wird, werden als glutamaterge Synapsen bezeichnet. Analog dazu werden die Neurone, die den jeweiligen Botenstoff liefern, ebenfalls so benannt: Ein Dopamin produzierendes Neuron wird als dopaminerg bezeichnet. Neurotransmitter ± Neuromodulatoren. Die natürlich vorkommenden neurobiologisch aktiven Substanzen werden in zwei verschiedene Klassen unterteilt, Neurotransmitter und Neuromodulatoren. Neurotransmitter stellen die klassischen chemischen Botenstoffe dar. Sie werden nach Werman und Aprison folgendermaûen definiert: Ein Neurotransmitter muss · von einem Neuron selbst synthetisiert werden, · in den präsynaptischen Terminalen vorkommen, dort akkumuliert und bei Depolarisation des Neurons in den synaptischen Spalt in einer Menge freigesetzt werden, die ausreicht, um auf der postsynaptischen Seite eine Erregung oder Hemmung der elektrischen Membranantwort herbeizuführen, · bei experimenteller Applikation die Wirkung des ¹endogenenª Transmitters nachahmen und · spezifisch inaktiviert werden können. 2.4 Neurotransmitter und Neuromodulatoren y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* pp p 37 BC Eine positive Definition des Begriffs ¹Neuromodulatorª ist aufgrund der Heterogenität der Eigenschaften dieser Substanzen nicht möglich. Als Neuromodulatoren werden diejenigen im Nervensystem wirkenden Substanzen zusammengefasst, die nicht alle Kriterien eines Neurotransmitters erfüllen. Die Wirkungsgeschwindigkeit ist kein sicheres Kriterium zur Definition eines Neurotransmitters. Zwar wirken Neurotransmitter in der Regel rascher als Neuromodulatoren (s. u.), doch gibt es zahlreiche Ausnahmen. Kategorien von Neuromodulatoren. Die Neuromodulatoren setzen sich aus zwei verschiedenen Untergruppen zusammen. Die erste und gröûte Gruppe sind die Neuropeptide. Die zweite, kleinere Gruppe stellen die nicht-peptidergen Neuromodulatoren. O Acetylcholin Glutamat + H3N 38 Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* O CH3 C H C COO– CH2 CH2 COOH GABA + H3N CH2 CH2 CH2 COO– H Glycin + H3N COO– C H Biogene Amine CH2 + CH2 NH3 CH2 NH3 CH2 NH2 HO l l l Zu den Neurotransmittern gehören Acetylcholin, Aminosäuren und biogene Amine Das ¹Ein-Neuron-ein-Transmitter-Dogmaª. Lange Zeit wurde angenommen, dass ein Neuron an allen seinen präsynaptischen Endigungen jeweils ein und denselben Transmitter ausschüttet (Dale-Prinzip). Die meisten Neurone schütten jedoch neben einem niedermolekularen Transmitter auch Pep- CH2 Aminosäuren Dopamin Zu den Transmittern zählen Acetylcholin, die Aminosäuren Glutamat, GABA (g-Aminobuttersäure) und Glycin sowie die biogenen Amine Dopamin, Noradrenalin, Adrenalin, Serotonin (5-Hydroxytryptamin) und Histamin (b-Imidazolethylamin; Abb. 2-8). Da Dopamin, Noradrenalin und Adrenalin durch den gemeinsamen ¹Catecholringª eng miteinander verwandt sind, werden sie zusammen als Catecholamine bezeichnet. Catecholamine und Serotonin werden der Gruppe der Monoamine zugerechnet. Die Neurotransmitter werden fast ausnahmslos in den präsynaptischen Endigungen durch cytosolische oder in Vesikeln kompartimentierte Enzyme synthetisiert (Acetylcholin z. B. durch Cholin-Acetyltransferase; Abschn. B-2.2) und in den synaptischen Vesikeln gespeichert. Acetylcholin ist nicht nur der Transmitter der neuromuskulären Synapse (Abschn. B-2.2), sondern vermittelt u. a. auch die Übertragung an peripheren Synapsen des Parasympathikus (Abschn. B-2.5, C-4.1) sowie in einigen Hirnarealen wie dem Hippocampus und dem Neokortex. Glutamat und GABA sind wesentlich an der Signalübertragung im Gehirn beteiligt (Abschn. B-2.5, B-2.6), während Glycin als wichtigster inhibitorischer Transmitter im Rückenmark fungiert (Abschn. B-2.5, B-2.6). Monoaminerge Neurone finden sich vorwiegend im peripheren Nervensystem (sympathische Ganglien) und im Hirnstamm (Abschn. B-3.6). Synthese, Abbau und Wirkung von Monoaminen werden gesondert besprochen (Abschn. B-2.8, C-4.1). Histamin wird im Gehirn hauptsächlich in Neuronen des Hypothalamus produziert. Histaminerge Neurone projizieren z. B. in den Hippocampus. CH2 (CH3)3N OH OH CH Noradrenalin + HO OH OH CH Adrenalin + CH3 HO OH HO 5-Hydroxytryptamin (Serotonin (5-HT)) + CH2 CH2 NH3 CH2 CH2 NH3 N Histamin HN + N Abb. 2-8. Strukturformeln der wichtigsten niedermolekularen Neurotransmitter. Aufgrund ihres chemischen Aufbaus werden diese Transmitter unterteilt in Acetylcholin, Aminosäuren und biogene Amine (Catecholamine, Indolamine und Imidazolamine) tide aus. Wirken beide Substanzen synergistisch auf ihre Zielzellen, spricht man von Cotransmission. Ein Beispiel für das gemeinsame Vorkommen von klassischen Transmittern und Peptidmodulatoren in präsynaptischen Endigungen ist die Präsenz von Acetylcholin und vasointestinalem Protein (VIP) in parasympathischen Nerven von exokrinen Drüsen oder das Vorkommen von GABA mit Somatostatin. Auch die Aminosäuren GABA und Glycin können als Cotransmitter an denselben Synapsen auftreten. l l l Neuropeptide sind die umfangreichste Klasse der Neuromodulatoren. Sie werden als groûe Vorläufermoleküle im Zellkörper synthetisiert und in die Präsynapse transportiert Neuroaktive Peptide repräsentieren die gröûte Klasse von Neuromodulatoren. Sie werden aufgrund struktureller Merkmale in mehrere Familien eingeteilt (Tab. 2-2). Bis heute wurden mehr als 50 neuroaktive Peptide identifiziert, die entweder erregende oder hemmende Wirkungen ausüben können. Viele funktionell wichtige Neuropeptide wirken auch als Hormone, die aus der Neurohypophyse, aus Nervenendigungen am Hypothalamusboden oder aus gastrointestinalen endokrinen Zellen freigesetzt werden (Abschn. C-3.2, C-10.9). Neuropeptidvorläufer. Trotz ihrer groûen Vielfalt besitzen Neuropeptide mehrere grundlegende Gemeinsamkeiten, die sie von den schnellen Transmittern unterscheiden. Im Gegensatz zu niedermolekularen Transmittern werden Neuropeptide durch im neuronalen Zellkern transkribierte mRNAs codiert. Deren Translationsprodukt ist nicht das biologisch aktive Neuropeptid selbst, sondern ein hochmolekulares Vorläufermolekül. Die mRNA wird häufig von Genen codiert, die aus mehreren Exons bestehen. Teilweise entstehen durch alternatives Spleiûen des Primärtranskripts mehrere reife mRNAs und somit verschiedene Vorläufer. Die Vorläufer tragen eine Signalsequenz sowie die Sequenz für ein oder mehrere Neuropeptide: Der Vorläufer Angiotensinogen enthält die Sequenz für ein Neuropeptid, Angiotensin; der Vorläufer Proopiomelanocortin (POMC) enthält die Sequenz von acht verschiedenen Neuropeptiden. Die Vorläufer tragen potentielle Erkennungssequenzen für spezifische Endopeptidasen (Abschn. A-3.7). Im Falle von POMC existieren sieben spezifische Endopeptidase-Erkennungssequenzen. Die unterschiedliche Ausstattung verschiedener Neurone und endokriner Zellen mit Endopeptidasen und deren Inhibitoren bedingt, dass die Prozessierung desselben Vorläufers zu verschiedenen biologisch aktiven Peptiden führen kann. Vorläufer, Endopeptidasen und Endopeptidase-Inhibitoren werden im trans-Golgi-Netzwerk in sekretorische Vesikel verpackt (Abschn. A-16.6). Die Prozessierung findet während des axonalen Transports (Abschn. B-1.1) und in der Präsynapse statt. Speicherung und Abgabe. Bis auf wenige Ausnahmen werden Neuropeptide in groûen, elektronendichten Vesikeln (large dense core vesicles; Durchmesser ca. 100±150 nm) transportiert und gespeichert; nur die neurohypophysären Hormone sind in gröûeren Neurosekretgranula (Durchmesser bis 250 nm) gespeichert. Ihre Freisetzung wird durch Calcium gesteuert, erfordert aber eine stärkere Aktivierung als die Ausschüttung von schnellen Transmittern. Vermutlich liegt diesem Unterschied der gröûere Abstand der elektronendichten Vesikel von der präsynaptischen Membran zugrunde. Neuropeptide binden meist mit sehr hoher Affinität (picomolare Konzentrationen) an die Rezeptoren ihrer Zielzellen. l l l Am Beispiel von Cholecystokinin und den Opioiden lassen sich Gemeinsamkeiten und Unterschiede von Neuropeptiden illustrieren Cholecystokinin (CCK). CCK wird von gastrointestinalen Zellen und Neuronen des ZNS hergestellt. Es kommt in mehreren biologisch aktiven Formen vor; im Gehirn dominiert das C-terminale Oktapeptid CCK-8. CCK-8 exprimierende Neurone existieren vor allem im cerebralen Kortex und im limbischen System (Abschn. B-7.3). Die mRNA codiert für einen Vorläufer (Präprocholecystokinin) mit einer Länge von 115 Aminosäuren. Durch posttranslationale Modifikationen werden verschiedene Fragmente des CCK gebildet: CCK-58, CCK-39, CCK-31, CCK-25, CCK-8, CCK-5, CCK-4. Eine weitere Erhöhung der Diversität kommt dadurch zustande, dass einige CCK-Formen in einer sulfatierten und in einer nichtsulfatierten Form vorliegen. Neutrale Endopeptidase, Thiol- und Serin-Proteasen sind für den Abbau von CCK-8 verantwortlich, liefern dabei aber gleichzeitig die biologisch aktiven Formen CCK-5 und CCK-4. Opioide. Dynorphine, Endorphine und Enkephaline fasst man aufgrund ihrer opiatartigen Wirkung als Opioide zusammen; ihre Wirkung gleicht der Wirkung von Morphinen, einer Gruppe in Opium enthaltener pflanzlicher Alkaloide. Trotz sehr ähnlicher biologischer Effekte unterscheiden sie sich grundlegend; sie werden von verschiedenen Genen codiert und unterschiedlich prozessiert. Opioide hemmen die Weiterleitung von Schmerzen im Rückenmark und Hirnstamm. Morphine wirken an denselben Synapsen wie Opioide und induzieren Analgesie (Abschn. B-11.5). Im Zusammenspiel mit dem dopaminergen Belohnungssystem des Nucleus accumbens (Abschn. B-7.3) besitzt Heroin (Diacetylmorphin) ein hohes Suchtpotential. Dynorphine sind eine Gruppe von sieben neuroaktiven Peptiden, die alle aus einem gemeinsamen Vorläufer (Prodynorphin oder auch Proenkephalin B) gebildet werden. Endorphine stammen von dem Vorläufer Proopiomelanocortin (POMC) ab. POMC ist nicht nur Vorläufer von Endorphin, sondern auch zahlreicher funktionell verschiedenartiger Neuropeptide wie ACTH, die melanotropen Hormone, CLIP (corticotropin-like intermediary peptide) und JP (joining peptide). Ein Zwischenprodukt der Prozessierung von POMC ist das b-Lipotropin (Abschn. C-3.2). Die entstehenden Endorphine umfassen das b-Endorphin (1±27) und das b-Endorphin (1±26), das a-Endorphin (116) und das g-Endorphin (1±17). Enkephaline stammen vom Vorläufer Proenkephalin ab, aus dem sich insgesamt fünf verschiedene Enkephaline ableiten (Synenkephalin, Leu-Enkephalin, Met-Enkephalin-Arg-Phe, Met-Enkephalin-Arg-Gly-Leu und Met-Enkephalin). 2.4 Neurotransmitter und Neuromodulatoren y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 39 Tabelle 2-2. Neuropeptidfamilien Neuropeptid Aktives Neuropeptid Abkürzung des Neuropeptids Vorläufer Angiotensin Angiotensin II Angiotensin II (1±7) Angiotensin IV Calcitonin ¹Calcitonin gene related peptideª Cholecystokinin [CCK-58; CCK-39; CCK-33; CCK-25; CCK-8; CCK-5; CCK-4] ¹Corticotropin-releasing factorª [CRF(1±39); CRF(1±41); CRF(4±41); CRF(9±41)] a-Neoendorphin b-Neoendorphin Dynorphin A(1±17) Dynorphin A(1±13) Dynorphin A(1±8) Dynorphin B(1±29) Dynorphin B(1±13) Met-Enkephalin Leu-Enkephalin Met-Enkephalin-Arg-Phe Met-Enkephalin-Arg-Gly-Leu Synenkephalin Melanin konzentrierendes Hormon Neuropeptid GlutamatIsoleucin Neuropeptid Glycin-Glutamat Neurotensin Neuromedin N adrenocorticotropes Hormon [ACTH(1±39); ACTH(11±24); ACTH(4±10)] a-Melanocyten stimulierendes Hormon b-Melanocyten stimulierendes Hormon g-Melanocyten stimulierendes Hormon Endorphine [b-Endorphin(1±27); b-Endorphin(1±26); g-Endorphin(1±17); a-Endorphin(1±16)] b-Lipotropin ¹corticotropin-like intermediary peptideª ¹Joining peptideª Substanz P Neuropeptid K Neurokinin A Neuropeptid g Neurokinin B Neuropeptid Y ¹C-flanking peptide of NPYª Somatostatin-28(1±12) Somatostatin-14 vasoaktives intestinales Polypeptid Peptid Histidin-Isoleucin Peptid Histidin-Methionin ANG Angiotensinogen CT CGRP CCK Procalcitonin ProCGRP ProCCK CRF Präpro-CRF NEO Prodynorphin (auch Proenkephalin B genannt) Calcitonin-Genprodukte Cholecystokinine CorticotropinReleasing-Faktoren Dynorphine Enkephaline Melanin konzentrierendes Hormon Neurotensine Proopiomelanocortine Tachykinine Neuropeptid Y Somatostatine Produkte des vasoaktiven intestinalen PolypeptidGens 40 Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* DYN Met-ENK Leu-ENK Met-ENK-Arg-Phe Met-ENK-Arg-Gly-Leu Syn-ENK MCH Proenkephalin A Pro-MCH NEI NG NT NmN ACTH Proneurotensin Proopiomelanocortin (POMC) a-MSH b-MSH g-MSH END b-LIP CLIP JP SP NPK NKA NPg NKB NPY CPON SS VIP PHI PHM Präprotachykinin A Präprotachykinin B Pro-NPY Präpro-Somatostatin Pro-VIP l l l Nicht-peptiderge Neuromodulatoren sind Purine, Derivate der Arachidonsäure und die gasförmigen Substanzen CO und NO Purine. Das Purinnucleotid ATP sowie Adenosin können als neuroaktive Substanzen wirken. ATP wird zusammen mit anderen Neurotransmittern oder Neuromodulatoren freigesetzt; z. B. sind in präsynaptischen Vesikeln cholinerger und noradrenerger Neurone Purine (Kap. A-12) in hoher Konzentration enthalten. Im Gehirn kann ATP die präsynaptische Freisetzung von Glutamat fördern oder dessen postsynaptische Wirkung steigern. Freigesetztes ATP wird extrazellulär durch Aktivität der Ekto-ATPase zu ADP hydrolysiert; durch die Aktivität der Ektoapyrase werden ATP und ADP zu AMP metabolisiert. Anschlieûend konvertiert die Ekto-50 -Nucleotidase AMP zu Adenosin. Adenosin wirkt überwiegend hemmend auf die präsynaptische Freisetzung erregender Neurotransmitter. Durch Coffein und Theophyllin wird die Wirkung von Adenosin unterbunden, was vermutlich die anregende Wirkung dieser in Kaffee und Tee vorkommenden Xanthine erklärt. Arachidonsäurederivate. ¾hnlich wie die Neuropeptide werden die neuroaktiven Derivate der Arachidonsäure (Abschn. A-8.2, A-10.7) durch eine Abfolge von enzymatischen Prozessen aus einem Vorläufer hergestellt. Wie Second Messenger werden Metabolite der Arachidonsäure im Zellinneren gebildet, wo sie auf enzymatische Aktivitäten oder Ionenleitfähigkeit wirken können. Als Neuromodulatoren werden einige dieser Derivate in den Extrazellulärraum abgegeben und wirken auf benachbarte Zellen. Aus der Arachidonsäure können Prostaglandine, Thromboxane, Leukotriene, Lipoxine und Anandamide (die endogenen Interaktionspartner der Cannabinoidrezeptoren) hergestellt werden. Die Prostaglandine vermitteln Entzündungsreaktionen, Fieber und Schmerz. Sie werden auch von Neuronen bei Verletzungen des Nervensystems, Schlaganfall und starker synaptischer Aktivierung während eines epileptischen Anfalls in den Extrazellulärraum freigesetzt. Gasförmige Substanzen. Kohlenmonoxid (CO) und Stickstoffmonoxid (NO) können als Neuromodulatoren agieren. Dass ein Gas als Modulator der zellulären Erregbarkeit dienen kann, wurde zuerst an der glatten Gefäûmuskulatur beobachtet. Gefäûendothel setzt unter Einfluss von Acetylcholin oder Bradykinin einen Mediator frei, der die glatte Gefäûmuskulatur entspannt und damit vasodilatierend wirkt. Dieser vom Endothel abstammende relaxierende Faktor EDRF (endothelium-derived relaxing factor) konnte als Stickstoffmonoxid (NO) identifiziert werden (Abschn. C-7.7). NO wirkt aber auch auf neuronale Gewebe. Dort wird es durch ein spezifisches Enzym, die Stickoxid-Synthase (NOS) gebildet. Im Gegensatz zu Transmittern und anderen Neuromodulatoren wird NO nicht in Vesikeln gespeichert; als hochdiffusibles Gas kann es nicht gespeichert werden. Deshalb wird es bei Bedarf synthetisiert und diffundiert dann in das umliegende Gewebe. NO wirkt über Bindung an die intrazellulären Guanylatcyclasen, d. h. nicht nur am synaptischen Spalt. NO wird auch nicht durch spezifische Enzyme inaktiviert, sondern zerfällt aufgrund seiner chemischen Struktur mit einer Halb- wertszeit von wenigen Sekunden. Dieser Zerfall begrenzt auch den Aktionsradius von NO. NO ist ein Neuromodulator, dem eine sehr wichtige Rolle bei Prozessen zukommt, die mit Lernen und Gedächtnis in Zusammenhang stehen (Abschn. B-6.4). NO kann als retrograder Botenstoff dienen, indem es auf das ¹präsynaptischeª Neuron zurückwirkt. l l l Die synaptische Übertragung wird durch Inaktivierung, Wiederaufnahme oder Wegdiffusion der freigesetzten Transmitter beendet Damit die synaptische Übertragung die Aktivität des präsynaptischen Neurons zuverlässig weiterleiten kann, muss die ausgeschüttete neuroaktive Substanz schnell wieder aus dem synaptischen Spalt entfernt werden. Dazu stehen drei Mechanismen zur Verfügung. Inaktivierung. Diese geschieht über einen enzymatischen Abbau der Substanz, z. B. die Spaltung von Acetylcholin durch Acetylcholinesterase (Abschn. B-2.2) und der Abbau vieler Neuropeptide durch Aminopeptidasen und neutrale Endopeptidasen. Wiederaufnahme. Der häufigste Mechanismus der Beendigung der Transmitterwirkung ist die Wiederaufnahme durch spezifische Transportproteine. Für alle Neurotransmitter mit Ausnahme von Histamin konnte die Existenz solcher Transportproteine nachgewiesen werden. Über Transportproteine wird der gröûte Teil des ausgeschütteten Transmitters aus dem synaptischen Spalt entfernt. Diese Transportproteine sind nicht nur in der Plasmamembran von Neuronen, sondern auch von Gliazellen lokalisiert. Über diesen Mechanismus wird z. B. Glutamat aus dem synaptischen Spalt entfernt. Nach seiner Freisetzung wird Glutamat durch hochaffine Transporter sowohl in Gliazellen als auch in die präsynaptische Endigung und die postsynaptische Zelle aufgenommen. Die hochaffinen Glutamattransporter der Plasmamembran (exzitatorische Aminosäuretransporter, EAAT) verwenden die Energie aus dem einwärts gerichteten elektrochemischen Gradienten von Natrium-Ionen, um den Einwärtstransport von Glutamat zu bewerkstelligen. Bei starker Erhöhung der intrazellulären Natriumkonzentration (bzw. einer Verringerung des Natriumgradienten) kann es daher zur Umkehrung der Transportrichtung und zum Auswärtstransport von Glutamat kommen. Dieser Mechanismus wird teilweise für die erhöhte extrazelluläre Glutamatkonzentration während cerebraler Ischämie verantwortlich gemacht (Box 2-3). Gliazellen enthalten das Enzym Glutamin-Synthethase, die das aufgenommene Glutamat in Glutamin umwandelt. Glutamin wird wiederum von den Gliazellen ausgeschleust und in die präsynaptische Endigung aufgenommen. Innerhalb der präsynaptischen Endigung wird Glutamin durch das mitochondriale Enzym Glutaminase zu Glutamat umgewandelt und anschlieûend in synaptische Vesikel verpackt. Auch die Transmitter GABA, Glycin, Dopamin, Noradrenalin und 5-Hydroxytryptamin werden durch hochaffine Transporter wieder in die Zellen aufgenommen. Der enzyma2.4 Neurotransmitter und Neuromodulatoren y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 41 2.5 tische Abbau von Monoamintransmittern wird durch die intrazellulären Enzyme Monoamin-Oxidase (MAO) und die Catechol-O-Methyltransferase (COMT) bewerkstelligt (Abschn. B-2.8). Inhibitoren der MAO werden klinisch z. B. zur Behandlung von Depressionen eingesetzt. Transportproteine für Transmitter sind Angriffspunkte von Psychopharmaka und Drogen. Die Aufnahme von Noradrenalin wird z. B. durch Cocain gehemmt, während Antidepressiva die Aufnahme von 5-Hydroxytryptamin unterbinden. l l l Ein und dieselbe neuroaktive Substanz kann auf verschiedene Rezeptortypen wirken und dadurch unterschiedliche Wirkungen an Zielzellen hervorrufen Rezeptortypen und rezeptorvermittelte Effekte. Synapsen können, wenn sie dieselbe neuroaktive Substanz verwenden, grundlegende Unterschiede aufweisen: Sie können sich in ihrer Wirkung, d. h. erregend oder hemmend, im Mechanismus ihrer postsynaptischen Signalweiterleitung und in ihrer Empfindlichkeit gegenüber Toxinen oder Pharmaka unterscheiden. Diese funktionellen Unterschiede sind Folge einer unterschiedlichen Ausstattung der postsynaptischen Membran mit verschiedenen Klassen von Rezeptoren. Diffusion. Dieser Weg der Inaktivierung ist bisher nur für die neuroaktiven Gase NO und CO bewiesen. Die Diffusion von Neurotransmittern und Neuromodulatoren weg vom synaptischen Spalt reduziert natürlich deren akut verfügbare Mengen, bedeutet aber nicht, dass die Substanzen inaktiviert werden. é Rezeptoren für Neurotransmitter und Neuromodulatoren Die synaptische Übertragung an chemischen Synapsen wird durch eine Vielzahl von neuroaktiven Substanzen vermittelt. Diese können in zwei Klassen eingeteilt werden, Neurotransmitter und Neuromodulatoren. Die Transmitter sind an der Weiterleitung von Aktionspotentialen beteiligt. Neuromodulatoren modulieren einerseits Transmittereffekte, können aber auch unabhängig von Transmittern wirken. Die synaptische Übertragung wird durch enzymatische Inaktivierung, Wiederaufnahme in Glia oder Neurone oder durch Wegdiffusion der freigesetzten neuroaktiven Substanz beendet. Mechanismen der Steuerung eines Ionenkanals. Ein Rezeptor kann einen Ionenkanal grundsätzlich durch zwei Mechanismen steuern: Zum einen gibt es Rezeptoren, die direkt mit Ionenkanälen gekoppelt sind. Diese Proteinkomplexe sind Ionenkanäle, die aus vier oder fünf membrangängigen Proteinuntereinheiten gebildet werden und extrazelluläre Bindungsstellen für die neuroaktive Substanz tragen. Je nachdem, ob man stärker ihre Fähigkeit zur Bindung oder ihre Eigenschaft als Ionenkanäle betonen will, bezeichnet man sie als ionotrope Rezeptoren oder ligandengesteuerte Ionenkanäle. Als Ligand wird eine Substanz bezeichnet, die an einen Rezeptor bindet. Wichtige ionotrope Rezeptoren sind in Tabelle 2-3 aufgeführt. Die zweite Klasse von Rezeptoren für neuroaktive Substanzen interagiert nicht direkt, sondern mittelbar über intra- Tabelle 2-3. Wirkung von Neurotransmittern auf ionotrope und metabotrope Rezeptoren Transmitter Ionenkanalrezeptor Selektivität + + 2+ Metabotroper Rezeptor Varianten und Effektoren mGluR1,5: ­ +PLC mGluR2±4, 6±8: AC mGluR2±4, 6±8: AC AC, gK+ ± M1,3: ­ +PLC M2: AC, +gK+ M4,5: AC, +PLC 5-HT1,6: AC 5-HT2: ­ +PLC 5-HT4,5,7: +AC H1: ­­ +PLC, ­ +PLA2 H2: ­­­ +AC, H3 (??) D1,5: ­ +AC D2±4: AC, +gK+ a1: ­­ +PLC a2: AC, gK+ b1±3: ­ +AC A1,3: AC A2A/B: ­ +AC P2Y1,2: ­ +PLC (ATP/UTP) AMPA Kainat NMDA GABAA/C Glycin nicotinischer Acetylcholinrezeptor Na , K (Ca ) Na+, K+ (Ca2+) Na+, K+, Ca2+ Cl± (HCO±3) Cl± (HCO±3) Na+, K+ (Ca2+) metabotroper Glutamatrezeptor Glutamatrezeptor GABAB ± muscarinischer Acetylcholinrezeptor Serotonin (5-HT) 5-HT3 Na+, K+, Ca2+ metabotroper Serotoninrezeptor Histamin ± ± Histaminrezeptor Dopamin ± ± Dopaminrezeptor Noradrenalin (Adrenalin) Purine (Pyrimidine) ± ± Catecholaminrezeptor ± ± ATP (P2X) Na+, K+, Ca2+ Adenosinrezeptor (P1) ATP-Rezeptor (P2Y) Glutamat GABA Glycin Acetylcholin AC = Adenylatcyclase; PLC, PLA2 = Phospholipase C, A2; gK+ = Kaliumkanäle 42 Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* pp p A PH BC zelluläre G-Proteine mit den jeweiligen Ionenkanälen. Diese werden als metabotrope oder G-Protein-gekoppelte Rezeptoren bezeichnet. Rezeptoren mit Tyrosin-Kinase- oder Guanylatcyclase-Aktivität sind dagegen nicht an der schnellen Transmission beteiligt, sondern können die synaptische Aktivität modulieren. Wie die Übersicht in Tabelle 2-3 zeigt, existieren für viele Transmitter sowohl ionotrope als auch metabotrope Rezeptoren. Rezeptor-Tyrosin-Kinasen (RTKs; Abschn. A-17.3). RTKs dienen vielen Wachstumsfaktoren im Nervensystem als Rezeptoren, z. B. den Neurotrophinen, Fibroblastenwachstumsfaktoren (FGFs), insulinartigen Wachstumsfaktoren (IGFs) und PDGF (platelet-derived growth factor). Diese Faktoren sind auch nach Abschluss der Entwicklungs- und Differenzierungsphasen (Abschn. B-1.2, B-3.2) für die Erhaltung von Neuronen und für synaptische Plas- tizität verantwortlich. Zum Beispiel wird das Neurotrophin BDNF (brain-derived neurotrophic factor) im adulten Gehirn von Neuronen synthetisiert und aktivitätsabhängig sezerniert. BDNF kann über seinen Rezeptor trkB, eine RTK, neuronale Aktivität modulieren. l l l Ionotrope Rezeptoren bestehen aus membranständigen Proteinuntereinheiten, die extrazelluläre Bindungsdomänen für Transmitter besitzen und einen Ionenkanal bilden Architektur des Acetylcholinrezeptors. Einer der ersten ligandenaktivierten Kanäle, dessen Struktur im Detail aufge- NH2 γ/ε α COOH extrazellulär α δ β extrazellulär MMMM 1 23 4 intrazellulär intrazellulär Untereinheit α γ/ε α δ β a b S1-Domäne NH2 N-terminale Domäne Glutamat S2-Domäne Acetylcholin Flip/Flop COOH IV I IV I III III II PSD 95 Q/R II COOH Rapsyn Na+ Na+ pentameres Kanalprotein tetrameres Kanalprotein c Abb. 2-9. Molekulare Struktur des Acetylcholinrezeptorkanals und des AMPA-Rezeptorkanals. (a) Der nicotinerge Acetylcholinrezeptorkanal besteht aus fünf Untereinheiten (2 a, b, g oder e und d), die vier transmembranäre Regionen (M1, M2, M3 und M4) umfassen. Nach Kandel ER, Schwartz JH, Jessel TM. Principles of Neural Science, 4. Aufl. Elsevier, New York (2000). (b) Räumliches Modell des Acetylcholinrezeptorkanals. (c) Vergleich der molekularen Architektur von Untereinheiten des nicotinischen Acetylcholinrezeptors und des Glutamatrezeptors (AMPA-Rezeptor). Der Glutamatrezeptor weist für jede seiner vier Untereinheiten drei Membrandurchgänge auf 2.5 Rezeptoren für Neurotransmitter und Neuromodulatoren y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 43 klärt werden konnte, ist der Acetylcholinrezeptor der neuromuskulären Endplatte. Der nicotinische Acetylcholinrezeptor besteht aus fünf Proteinuntereinheiten (2 a + b + (g oder e) + d), die die postsynaptische Membran mit jeweils vier Transmembranregionen durchspannen. Jede der rosettenförmig angeordneten Untereinheiten trägt zur Bildung des zentral gelegenen Ionenkanals bei, der jeweils von Transmembranregion 2 jeder Untereinheit ausgekleidet wird (Abb. 2-9). Die Acetylcholinrezeptoren von Muskel und Gehirn weisen unterschiedliche Kombinationen aus verschiedenen Varianten der fünf Untereinheiten auf. Jeder Rezeptorkomplex besitzt zwei Bindungsstellen für Acetylcholin, die von den groûen extrazellulären Domänen der beiden a-Untereinheiten und einer benachbarten Untereinheit gebildet werden. Dieses Grundschema wird für die ionotropen Rezeptoren der Superfamilie des nicotinischen Acetylcholinrezeptors aufrechterhalten (s. u.). Muscarinische Acetylcholinrezeptoren gehören zu den metabotropen Rezeptoren und besitzen eine abweichende Proteinstruktur (s. u.). Embryonaler versus adulter Acetylcholinrezeptor. Der nicotinische Acetylcholinrezeptor des Skelettmuskels existiert in einer embryonalen und einer adulten Isoform. Bei einem embryonalen, von Nervenfortsätzen noch unberührten Skelettmuskel sind die nicotinischen Acetylcholinrezeptoren gleichmäûig auf der Oberfläche verteilt. Wenn ein motorischer Nerv in den Muskel einwächst und neuromuskuläre Synapsen bildet, kommt es zu einer Rezeptorumverteilung. Die nicotinischen Acetylcholinrezeptoren reichern sich unter den Nervenendigungen auf der postsynaptischen Membran des Muskels an. Gleichzeitig wird der zunächst vorherrschende embryonale Rezeptor gegen die adulte Isoform ausgetauscht. Auf molekularer Ebene unterscheiden sich die beiden Rezeptorproteine durch eine von fünf Untereinheiten: Der Muskel synthetisiert nach Innervation adulte Acetylcholinrezeptoren, die anstelle des embryonalen g-Polypeptids eine e-Untereinheit enthalten. Im ZNS existieren weitere Varianten des nicotinischen Acetylcholinrezeptors, die dem der neuromuskulären Endplatte strukturell hochgradig verwandt sind. Vergleichbare Protein- familien stellen auch die durch die Aminosäuren GABA und Glycin und die durch 5-Hydroxytryptamin (Serotonin) aktivierten Rezeptorkanäle des ZNS dar (GABAA-, GABAC-, Glycin-, 5-HT3-Rezeptor; Tab. 2-3). Da alle Mitglieder dieser vier Rezeptorfamilien fünf Untereinheiten mit jeweils vier Transmembranregionen besitzen und somit wesentliche Strukturmerkmale teilen, fasst man sie zur Superfamilie der nicotinischen Acetylcholinrezeptoren zusammen. Von dieser Rezeptorsuperfamilie unterscheiden sich die ionotropen Glutamatrezeptoren, die einen anderen Transmembranaufbau aufweisen (s. u.). l l l Agonisten und Antagonisten des nicotinischen Acetylcholinrezeptors werden zur Muskelrelaxation eingesetzt Für den nicotinischen Acetylcholinrezeptor existiert eine Vielzahl spezifischer Agonisten (körperfremde Substanzen, die die gleiche Wirkung wie der Transmitter hervorrufen) und Antagonisten (körperfremde Substanzen, die nach ihrer Bindung die Rezeptorfunktion hemmen), die an ihn binden (Tab. 2-4). Viele dieser Substanzen führen zur Muskelrelaxation und werden daher zur Muskelentspannung bei der Allgemeinnarkose eingesetzt. Zur Gruppe der Agonisten gehört neben Nicotin auch Succinylcholin. Letzteres öffnet die Rezeptorkanäle und führt zu einer Dauerdepolarisation der Endplatte, da es durch Acetylcholinesterase nur langsam abgebaut wird. Durch diese Dauerdepolarisation kommt es zu einer Inaktivierung der Natriumkanäle und zu einer Muskellähmung. Derivate von Succinylcholin werden klinisch zur Muskelrelaxation verwendet. Zur Gruppe der Antagonisten zählen das Giftnattertoxin a-Bungarotoxin sowie das südamerikanische Pfeilgift Curare (Tab. 2-5). Diese Gifte blockieren die synaptische Übertragung an der neuromuskulären Synapse und führen zu Lähmungen. Da Curare nicht durch die Darmwand resorbiert Tabelle 2-4. Pharmakologie von Ionenkanalrezeptoren Rezeptor Agonist Antagonist allosterischer Ligand nicotinischer Acetylcholinrezeptor GABAA-Rezeptor Glycinrezeptor NMDA-Rezeptor AMPA-Rezeptor Kainatrezeptor Acetylcholin, Nicotin Curare ± GABA Glycin Glutamat, NMDA Glutamat, AMPA Glutamat, Kainat Bicucullin Strychnin Aminophosphonovalerat CNQX Kynurensäure Benzodiazepine ± Glycin ± ± Tabelle 2-5. Toxinwirkungen an Synapsen des neuromuskulären Systems 44 Toxinwirkung Cholinerge Synapsen (Exzitation) Glycinerge Synapsen (Inhibition) Präsynaptische Hemmung der Transmitterfreisetzung Postsynaptische Blockade der Rezeptorbindung Leitsymptome am motorischen System Botulinustoxin (Bakteriengift von Clostridium botulinum) Curare (nicotinischer Acetylcholinrezeptor) schlaffe Paresen (Muskellähmungen) Tetanustoxin (Bakteriengift von Clostridium tetani) Strychnin (Glycinrezeptor) Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* Krämpfe der gesamten Skelettmuskulatur wird, können durch Curare getötete Tiere problemlos verspeist werden. Curare bzw. Curarederivate werden in der Chirurgie häufig zur Muskelrelaxation eingesetzt. Dabei ist jedoch zu beachten, dass die Lähmung der Muskulatur ohne Bewusstseinstrübung erfolgt, da die nicotinerge Übertragung im Gehirn praktisch nicht vorkommt, so dass der Patient bei vollem Bewusstsein durch Lähmung der Atemmuskulatur ersticken kann. l l l Ionotrope Glutamatrezeptoren bilden Kationenkanäle und werden nach ihren pharmakologischen Agonisten benannt Ionotrope Glutamatrezeptoren. Auch Glutamat, der wichtigste erregende Transmitter im Gehirn, aktiviert unterschiedliche Typen von Rezeptoren (Tab. 2-3, Tab. 2-4). Die ionotropen Glutamatrezeptoren lassen sich drei Familien zuordnen, die nach ihren jeweiligen pharmakologischen Agonisten benannt werden. Dieses sind die AMPA-Rezeptoren (AMPA von a-Amino-3-hydroxy-5-methyl-4-isoxazolpropionat), die Kainatrezeptoren und die NMDA-Rezeptoren (NMDA von N-Methyl-D-aspartat) (s. Abb. 2-15). Glutamat bindet zusätzlich auch an metabotrope Glutamatrezeptoren (mGluR, s. u.), die über zwischengeschaltete G-Proteine die Leitfähigkeit von Ionenkanälen steuern (Abschn. A-17.5). AMPA-Rezeptoren vermitteln die schnellsten glutamatinduzierten Antworten. Wie die ionotropen Acetylcholinrezeptoren sind auch die Ionenkanäle, die von AMPA-Rezeptoren gebildet werden, überwiegend unspezifische Kationenkanäle. Ihre Öffnung führt zu einem schnellen Strom von Natriumund Kalium-Ionen, der die postsynaptische Zelle depolarisiert. Diese Kanäle bestehen aus vier Untereinheiten (Abb. 29), deren Polypeptidketten die postsynaptische Membran jeweils dreimal vollständig durchqueren. Eine weitere als TM2 bezeichnete hydrophobe Region dringt von der cytosolischen Seite schleifenförmig in die Membran ein und führt ins Zellinnere zurück. Diese Schleife kleidet den Kationenkanal des AMPA-Rezeptors aus. Die extrazellulären Anteile des Rezeptors, die einen hohen Anteil a-helicaler Elemente besitzen, bilden zwei gegeneinander bewegliche Domänen aus. Wie die Schalen einer Muschel schlieûen sich diese Domänen um den Rezeptoragonisten Glutamat. Bis heute wurden die Gensequenzen von vier Untereinheiten des AMPA- und fünf Untereinheiten des Kainatrezeptors kloniert. Durch selektive Desaminierung (Editieren) und alternatives Spleiûen des primären Gentranskripts (Abschn. A-14.10) wird die Anzahl der möglichen Untereinheitenvarianten zusätzlich erhöht. Daraus ergibt sich eine relativ groûe Anzahl an unterschiedlich zusammengesetzten Varianten des ionotropen Glutamatrezeptors, die sich funktionell unterscheiden (z. B. im Desensitivierungsverhalten und in ihrer Calciumleitfähigkeit). NMDA-Rezeptoren. Wie AMPA-Rezeptoren bilden auch NMDA-Rezeptoren Kationenkanäle, deren Öffnung eine Depolarisation der postsynaptischen Zelle bewirkt. NMDA-Rezeptoren sind allgemein nicht nur für Natrium und Kalium, sondern auch für Calcium permeabel. In den letzten Jahren hat man die Gensequenzen von drei NMDA-Rezeptorfamilien kloniert, die mehrere Untereinheitenvarianten umfassen. l l l Ionotrope GABAA-Rezeptoren stellen Chloridkanäle dar und sind der Angriffspunkt von Neuropharmaka GABA-Rezeptorkanäle. GABA wirkt sowohl auf ionotrope als auch auf metabotrope Rezeptoren (Tab. 2-3). Die ionotropen Rezeptoren umfassen zwei Klassen, die man als GABAA- und GABAC-Rezeptoren bezeichnet. Im Gegensatz zu diesen ligandengekoppelten Ionenkanälen gehören GABAB-Rezeptoren zur Klasse der metabotropen Rezeptoren (s. u.). GABAAund GABAC-Rezeptoren bestehen aus fünf Untereinheiten. Der GABAA-Rezeptor ist ein Heteropentamer (2 a, b, g, d), der GABAC-Rezeptor ist aus einem Untereinheitstyp (r) aufgebaut. Da diese Untereinheiten sich strukturell unterscheiden und in unterschiedlicher Stöchiometrie zu Rezeptorkomplexen zusammengesetzt sind, gibt es für ionotrope GABA-Rezeptoren eine groûe Vielfalt an unterschiedlichen postsynaptischen Antworten. Die Ionenkanäle der GABAA-Rezeptoren sind für ChloridIonen durchlässig. Das neuronale Umkehrpotential für Chlorid liegt im Bereich von ±70 bis ±80 mV und ist damit in den meisten Fällen negativer als das Membranpotential (etwa ±65 bis ±70 mV). Daher führt die Öffnung der Kanäle zu einem Einstrom von Chlorid und zu einer postsynaptischen Hyperpolarisation (s. u.). Der experimentell eingesetzte Hemmstoff Bicucullin ist ein kompetitiver GABAA-Rezeptorantagonist und führt somit zu einer Blockade der GABAergen Übertragung. Er kann epileptische Krämpfe hervorrufen. Bindungsstellen. Der GABAA-Rezeptor besitzt eine Bindungsstelle für GABA und weitere allosterische Bindungs- GABA Benzodiazepine Kanalpore a-Untereinheit Barbiturate Steroide Picrotoxin Chlorid-Ionen Abb. 2-10. Schematisches Modell des ionotropen GABAA-Rezeptors. Gezeigt sind die durch die Membran reichenden a-, bund g-Untereinheiten, die in ihrer Mitte eine für Chlorid-Ionen durchlässige Pore bilden. Auûerdem ist die Lage der Bindungsstellen für GABA, Benzodiazepine, Barbiturate, Steroide und Picrotoxin schematisch angedeutet. Nach Purves D, Augustine GJ, Fitzpatrick D, Katz LC, LaMantia AS, McNamara JO, Williams SM. Neuroscience, 2. Aufl. Sinauer Ass., Sunderland (2001) 2.5 Rezeptoren für Neurotransmitter und Neuromodulatoren y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 45 stellen für Benzodiazepine, Barbiturate und Steroide. Abb. 210 zeigt schematisch die Bindungsstellen für Barbiturate (die klinisch als Schlafmittel, Beruhigungsmittel und Antiepileptika eingesetzt werden) und Steroide (Abschn. A-10.4, C-3.1), die auûerhalb der Pore des GABAA-Ionenkanals in der Nähe der transmembranären Domäne liegen. Die allosterischen Bindungsstellen für Benzodiazepine, die die GABAerge Übertragung verstärken, liegen auûerhalb der Pore in der extrazellulären Domäne. Picrotoxin, ein Antagonist der ionotropen GABA-Rezeptoren, führt dagegen zu einer Blockade der GABAergen Übertragung durch Bindung in der Pore. l l l Glycinrezeptoren sind vor allem im Rückenmark zu finden und bilden wie GABAA-Rezeptoren ligandenaktivierte Chloridkanäle Glycinrezeptoren sind ligandenaktivierte Chloridkanäle mit fünf Untereinheiten (Abb. 2-11). Glycin ist der dominierende hemmende Transmitter in Rückenmark und Hirnstamm, während glycinerge Synapsen im Gehirn selten zu finden sind. Glycin wird von den kleinen Interneuronen des Rückenmarks aus Serin gebildet und wirkt hemmend auf Motoneurone, Renshaw-Zellen und viele nozizeptive Neurone. In der Groûhirnrinde bindet Glycin nicht an Glycinrezeptoren, sondern agiert dort als Coaktivator der NMDA-Glutamatrezeptoren (s. o.). Strychnin. Glycinrezeptoren binden das Krampfgift Strychnin (Abb. 2-11, Tab. 2-5), das eine sehr hohe Affinität für den Rezeptor besitzt und den natürlichen Transmitter Glycin aus seiner Bindungsstelle verdrängt. Eine Strychninvergiftung (s. Einleitung) geht mit einem weitgehenden Verlust der glycinergen Hemmung und massiven Muskelkrämpfen einher. Die Symptome der Vergiftung werden mit Diazepam (Valium) behandelt, Cl– Strychnin Glycin a1 b Gephyrin Abb. 2-11. Molekulare Struktur des Glycinrezeptorkanals. Der Glycinrezeptorkanal ist vorwiegend für Chlorid-Ionen permeabel. Geöffnet wird er durch die Bindung von Glycin. Das neurotoxische Alkaloid Strychnin ist ein hochaffiner Antagonist der Glycinwirkung. Jedes Glycinrezeptorkanalmolekül besteht aus fünf Untereinheiten, denen sich intrazellulär das Ankerprotein Gephyrin anlagert 46 Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* das die Hemmung der Motoneurone durch den mit dem Glycinrezeptor synergistisch wirkenden GABAA-Rezeptor verstärkt. Lässt sich keine Besserung erzielen, werden die Blockade der neuromuskulären Synapse durch Antagonisten des nicotinischen Acetylcholinrezeptors (Curare) und künstliche Beatmung erforderlich. Die sofortige Gabe von Aktivkohle hemmt die Giftresorption. Rezeptorpathologie des neuromuskulären Systems. Die Aufklärung molekularer Zusammenhänge der Signalübertragung an biologischen Membranen trägt zu einem näheren Verständnis der Pathogenese neurologischer und psychiatrischer Erkrankungen bei. Im neuromuskulären System können schlaffe Lähmungen (Paresen) entstehen, wenn die Funktion der exzitatorischen cholinergen Synapsen gestört ist. Demgegenüber führt der Ausfall hemmender Synapsen zu Steigerungen des Muskeltonus und zu Krämpfen. Tabelle 2-5 fasst die Wirkung verschiedener Toxine an Synapsen des neuromuskulären Systems zusammen. Die entsprechenden Leitsymptome (Paresen oder Krämpfe) können sowohl durch Toxinwirkung an der Präsynapse als auch an der postsynaptischen Membran entstehen. Box 2-2. Stiff Baby Syndrome Das Stiff Baby Syndrome (Synonyme: Startle-Syndrom, Hyperekplexie) ist eine neurologische Krankheit, die durch Steigerungen der Muskelspannung und ausgeprägte Schreckreflexe (Startle-Reaktionen) geprägt ist und autosomal dominant oder rezessiv vererbt wird. In ihren ersten Lebensmonaten leiden die kleinen Patienten an einer anhaltenden Muskelsteifheit, die zum Namen Stiff Baby Syndrome geführt hat. Gefürchtet ist der plötzliche Kindstod durch Atemstillstand infolge von Muskelkrämpfen. Im Laufe des ersten Lebensjahrs bildet sich die muskuläre Hypertonie zurück, und eine exzessive Startle-Reaktion wird zum führenden Symptom. Charakteristisch sind plötzliche Versteifungen der Muskulatur mit ungeschützten Stürzen. Das Bewusstsein bleibt bei diesen Episoden erhalten. Dem glycinergen Defekt entsprechend gleichen die Symptome einer Strychninvergiftung. In vielen Fällen kann Hyperekplexie auf eine Mutation des GLRA1-Gens auf Chromosom 5q zurückgeführt werden, das für die a1-Untereinheit des Glycinrezeptors codiert. Dabei überwiegen Punktmutationen, die zu Aminosäureaustauschen führen (Missense-Mutationen). Abhängig von der Position des Aminosäureaustauschs innerhalb der a1-Untereinheit kann sich die Mutation auf die Bindung des Neurotransmitters, die Leitfähigkeit des Chloridkanals oder sein Desensitivierungsverhalten auswirken l l l Serotonin und Purine aktivieren ebenfalls ligandenaktivierte Ionenkanäle Zu den ligandenaktivierten Ionenkanälen gehören auch Rezeptoren für 5-Hydroxytryptamin (5-HT, Serotonin) und Purine (Tab. 2-3). Die Klasse der 5-HT3-Rezeptoren repräsentiert nicht-selektive Kationenkanäle, die in manchen Zellen auch für Calcium durchlässig sind (Tab. 2-3). Die meisten der bekannten 5-HT-Rezeptoren sind jedoch an G-Proteine gekoppelt (Tab. 2-3). Aus der groûen Anzahl unterschiedlicher purinerger Rezeptortypen bilden nur die so genannten P2X-Rezeptoren ligandenaktivierte Kanäle (Tab. 2-3). Auch diese Rezeptoren sind unspezifische Kationenkanäle, die allerdings eine von anderen ligandengesteuerten Ionenkanälen abweichende Untereinheitenarchitektur mit nur zwei Transmembranregionen besitzen und für Natrium-, Kalium- und Calcium-Ionen durchlässig sind. P2XRezeptoren sind in nahezu allen Gehirnregionen und im Rückenmark exprimiert. l l l Heterotrimere G-Proteine vermitteln zwischen Rezeptoren und intrazellulären Second Messengern und modulieren Ionenkanäle l l l Metabotrope Rezeptoren enthalten Proteinuntereinheiten mit sieben Transmembrandomänen Metabotrope Rezeptoren (G-Protein-gekoppelte Rezeptoren) unterscheiden sich von den ionotropen Rezeptoren grundlegend in Aufbau und Funktionsweise. Metabotrope Rezeptoren bestehen aus Proteinuntereinheiten mit sieben Transmembrandomänen, die wahrscheinlich als Proteindimere vorliegen. Sie besitzen eine extrazelluläre Bindungsstelle für die neuroaktive Substanz und eine intrazelluläre Bindungsstelle für G-Proteine (Abb. 2-12), die durch zwei Domänen gebildet wird. Die Bindungsstelle für die neuroaktive Substanz besteht aus den extrazellulären Anteilen von mindestens vier der sieben Transmembrandomänen und taucht taschenförmig in die Membranumgebung ein. Nach Aktivierung durch den Rezeptor kann das G-Protein die Leitfähigkeit der zellulären Ionenkanäle direkt oder über zwischengeschaltete Proteine beeinflussen. Inzwischen wurden mehr als 100 verschiedene metabotrope Rezeptoren beschrieben (Tab. 2-3). Dazu gehören die metabotropen Rezeptoren für Acetylcholin (M1 bis M5), Glutamat (mGluR1 bis mGluR8), GABA (GABAB), Adrenalin/Noradrenalin (a1, a2, b1, b2, b3) und Dopamin (D1 bis D5) sowie Glutamat extrazellulär PLC PI intrazellulär Rezeptor GTP G-Protein DAG für die meisten Neuropeptide. Neuropeptidrezeptoren sind nicht nur in den postsynaptischen Membranabschnitten zu finden, sondern sind über die Membranoberflächen der Zielneurone und nicht-neuronalen Zielzellen verteilt. Allerdings gilt dies auch für einige Neurotransmitterrezeptoren, z. B. den Dopamin-D2-Rezeptor. IP3 2+ Ca - Freisetzung Abb. 2-12. Metabotrope Glutamatrezeptoren. Illustriert werden die Funktionselemente der metabotropen Glutamatrezeptoren der Gruppe I. Nach Andocken von Glutamat kommt es zu einer G-Protein-vermittelten Aktivierung der Phospholipase C (PLC). Daraufhin wird der sekundäre Botenstoff Inositol-1,4,5-trisphosphat (IP3) und Diacylglycerin (DAG) aus Phosphatidylinositol (PI) gebildet. IP3 führt zur signalartigen Freisetzung von Calcium-Ionen aus dem endoplasmatischen Reticulum. Nach Kandel ER, Schwartz JH, Jessel TM. Principles of Neural Science, 4. Aufl. Elsevier, New York (2000) Molekulare Zusammensetzung der G-Proteine. Die G-Proteine, die von metabotropen Rezeptoren aktiviert werden, bestehen aus drei Untereinheiten (Abb. 2-12; Abschn. A-17.5), die man als a-, b- und g-Untereinheiten bezeichnet. Die aUntereinheit kann GTP oder GDP binden. Ist GDP an die aUntereinheit gebunden, bindet sie auch die b- und g-Untereinheit, und das Protein liegt als heterotrimerer, inaktiver Komplex vor. Die Bindung der neuroaktiven Substanz an den metabotropen Rezeptor bewirkt den Austausch von GDP gegen GTP an der a-Untereinheit. Durch die Bindung von GTP an die a-Untereinheit löst sich der inaktive Komplex. Dadurch können die GTP-gebundene a-Untereinheit sowie die freie b/g-Untereinheit an nachgeschaltete Proteine binden bzw. intrazelluläre Signalkaskaden aktivieren. Diese vermitteln die postsynaptische Antwort auf die neuroaktive Substanz. Im Allgemeinen besteht innerhalb dieser Kaskaden die Möglichkeit zur Signalverstärkung und -verlängerung. Direkte Modulation von Ionenkanälen durch G-Proteine. In einigen Fällen binden durch metabotrope Rezeptoren aktivierte G-Proteine direkt an Kaliumkanäle oder andere Ionenkanäle in der Zellmembran und lösen dadurch einen postsynaptischen Strom aus. Dabei werden bis zur Generierung eines postsynaptischen Potentials etwa 20±30 ms benötigt. Damit sind selbst die schnellsten metabotropen Antworten deutlich langsamer als ionotrop generierte postsynaptische Potentiale, die innerhalb weniger Millisekunden entstehen. Muscarinische Acetylcholinrezeptoren. Beispiele für die direkte Kopplung von Ionenkanälen mit G-Proteinen sind die muscarinischen Acetylcholinrezeptoren im Herzen (Abschn. C-6.10) und an der peripheren Synapse des Parasympathikus (Abschn. C-4.1). Da die Acetylcholinwirkung durch Muscarin, eines der Gifte des Fliegenpilzes Amanita muscaria, imitiert wird, lässt sich diese Rezeptorklasse vom nicotinischen Acetylcholinrezeptor pharmakologisch abgrenzen. Ein Toxin, das die Wirkung von muscarinischen Acetylcholinrezeptoren blockiert, ist Atropin, das Gift der Tollkirsche (Atropa belladonna). Atropin kann therapeutisch zur Pupillenweitung eingesetzt werden. Auch der muscarinische Acetylcholinrezeptor umfasst verschiedene Rezeptorisoformen (M1 bis M5; Tab. 2-3). Die Ionenkanäle, die durch muscarinische Acetylcholinrezeptoren gesteuert werden, sind für Kalium-Ionen durchlässig. Da das Umkehrpotential für Kalium-Ionen im Normalfall negativer als das Membranpotential ist, führt ihre Öffnung zu einer Hyperpo- 2.5 Rezeptoren für Neurotransmitter und Neuromodulatoren y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 47 larisation. Man nimmt an, dass die Öffnung der Kaliumkanäle durch direkte Bindung der b/g-Untereinheit der G-Proteine an diese Kanäle verursacht wird. Darüber hinaus kann die freie GTP-gebundene a-Untereinheit der G-Proteine die Schlieûung von spannungsaktivierten Natrium- und Calciumkanälen bewirken und dadurch die Auslösung von Aktionspotentialen erschweren. Indirekte Modulation von Ionenkanälen durch G-Proteine. In vielen Fällen wirken die durch metabotrope Rezeptoren aktivierten G-Proteine nicht direkt auf Ionenkanäle, sondern üben ihre Effekte durch die Auslösung intrazellulärer Signalkaskaden aus. Zu den Enzymen, die durch G-Proteine aktiviert werden können, zählen Adenylatcyclase und Phospholipase C (Abb. 2-12, Abschn. A-17.5). Die groûe Anzahl der Komponenten, die an intrazellulären Signalwegen beteiligt sind, erlaubt eine präzise zeitliche und räumliche Kontrolle der Funktion einzelner Neurone und ihrer Zielzellen. Dadurch werden auch die synaptischen Übertragungseigenschaften beeinflusst und die Aktivität neuronaler Zellverbände gesteuert. Phospholipase C wird z. B. nach Bindung von Acetylcholin an muscarinische Rezeptoren durch das G-Protein G0 aktiviert. Dies führt zur Bildung von Inositol-1,4,5-trisphosphat (IP3) und Diacylglycerin (DAG) und somit zur Ausschüttung von Calcium aus intrazellulären Speichern und zur Aktivierung der ProteinKinase C, die die Leitfähigkeit vieler Ionenkanäle direkt modulieren kann. Adenylatcyclase wird durch das G-Protein Gs (stimulierendes G-Protein) nach Bindung von Noradrenalin an b-adrenerge Rezeptoren aktiviert. Adenylatcyclase katalysiert die Bildung von cAMP (zyklisches Adenosinmonophosphat), das in einigen Zelltypen direkt an Ionenkanäle binden und ihre Leitfähigkeit verändern kann. In den meisten Zellen jedoch aktiviert cAMP Protein-Kinasen, insbesondere die Protein-Kinase A (PKA), die wiederum Ionenkanäle phosphoryliert und dadurch deren Leitfähigkeit beeinflusst. Die Adenylatcyclase wird durch das G-Protein Gi (inhibitorisches G-Protein) inhibiert, beispielsweise nach GABA-Bindung an GABAB-Rezeptoren. Modulation der Genexpression durch G-Proteine. Neuroaktive Substanzen können nicht nur die ¾nderung postsynaptischer Ionenleitfähigkeiten bewirken, sondern auch die Genexpression postsynaptischer Zellen steuern. Diese Effekte sind erst nach Stunden oder Tagen zu beobachten und können sehr lange anhalten. Die Veränderung der Genexpression wird durch die Bildung verschiedener sekundärer Botenstoffe wie cAMP eingeleitet. Die entstandenen sekundären Botenstoffe können dann über weitere intrazelluläre Signalkaskaden wie den cAMP-regulierten Transkriptionsfaktor CREB (Abschn. A-14.6) die Synthese von Ionenkanälen oder Proteinen, die die Ionenkanalleitfähigkeit modulieren, beeinflussen. Diese ¾nderungen der zellulären Proteinexpression führen zu längerfristigen Veränderungen der synaptischen Übertragungseigenschaften. 48 Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* l l l Bindung der neuroaktiven Substanz an ionotrope oder metabotrope Rezeptoren löst unterschiedliche postsynaptische Effekte aus Schnelle und langsame Generierung postsynaptischer Ströme. Die Aktivierung ionotroper Rezeptoren führt grundsätzlich zur sehr schnellen Generierung postsynaptischer Ströme (und damit auch postsynaptischer Potentiale), die meist nach wenigen Millisekunden ihre maximale Amplitude erreichen. Die Dauer der Stromänderung entspricht in etwa der Verweildauer der neuroaktiven Substanz im synaptischen Spalt (Abschn. B-2.3). Dementsprechend vermitteln ionotrope Rezeptoren die schnelle synaptische Übertragung z. B. am Skelettmuskel oder im Gehirn. Metabotrope Rezeptoren agieren dagegen durch die Zwischenschaltung weiterer Proteine wesentlich langsamer und anhaltender. Zwischen Bindung des Transmitters an den Rezeptor und der Beeinflussung der Leitfähigkeit eines Ionenkanals können mehrere Hundert Millisekunden vergehen. Postsynaptische Potentiale entstehen im Vergleich mit der Ausschüttung des Transmitters von der präsynaptischen Zelle nur mit groûer Verzögerung. Daher sind diese Mechanismen nicht nur zur ¾nderung der Erregbarkeit der postsynaptischen Zelle geeignet, sondern dienen auch der Modulation und Regulation der schnellen synaptischen Übertragung. l l l Neurotransmitterrezeptoren werden auf der neuronalen Membran durch postsynaptische Ankerproteine fixiert Nach den Vorstellungen des Flüssigmosaikmodells sind Membranproteine in der Plasmamembran (Abschn. A-9.1) durch seitliche Diffusion weitgehend frei beweglich. Eine effiziente synaptische Übertragung setzt jedoch voraus, dass Neurotransmitterrezeptoren an der postsynaptischen Membran fixiert sind. Spezifische Ankerproteine verbinden die cytosolischen Domänen der Rezeptorproteine mit Proteinen des Cytoskeletts. Der nicotinische Acetylcholinrezeptor wird durch das Ankerprotein Rapsyn (Abb. 2-9) in der Membran der Skelettmuskelfaser fixiert. Spezifische Bindungsproteine wurden auch für ionotrope Glutamatrezeptoren (PSD-95; Abb. 2-9), den GABAA-Rezeptor (GABA-RAP) und den Glycinrezeptor (Gephyrin) identifiziert (s. Abb. 2-11). l l l Rezeptoren können unempfindlich gegen neuroaktive Substanzen werden Rezeptoren können gegen ihre Liganden unempfindlich werden, wenn sie ihnen über längere Zeit ausgesetzt waren. Bei einem zweiten Kontakt führt die Bindung des Liganden dann nicht mehr zur Öffnung der Rezeptorkanäle (ionotrope Rezeptoren) oder zur G-Protein-Aktivierung (metabotrope Rezeptoren). Diesen Effekt, der analog zu der Inaktivierung spannungsgesteuerter Natriumkanäle verläuft (Abschn. B1.5), bezeichnet man als Desensitivierung. Wahrscheinlich dient die Desensitivierung als Schutzmechanismus vor einer zu starken Aktivierung der Rezeptoren. Down-Regulation durch Endocytose. Einen langsameren Prozess der agonisteninduzierten Rezeptorinaktivierung stellt die Down-Regulation durch Endocytose dar, wobei Rezeptoren in Stachelsaumvesikel (coated vesicles; Abschn. A16.7) inkorporiert und abgebaut werden. Das Gleichgewicht von Inkorporation und Neusynthese bestimmt die aktuelle Rezeptorkonzentration an der Synapse. Auf diese Weise führt eine anhaltende Stimulation des Rezeptors zur Selbstbegrenzung seiner Wirkung. é p PH 2.6 Es gibt zwei verschiedene Rezeptorklassen, die an chemischen Synapsen für die Bindung von Neurotransmittern verantwortlich sind. Ionotrope Rezeptoren stellen funktionell Ionenkanäle dar und vermitteln vorwiegend die schnelle synaptische Übertragung. Metabotrope Rezeptoren, die aus sieben Transmembrandomänen bestehen, interagieren indirekt über intrazelluläre G-Proteine mit den jeweiligen Ionenkanälen. Ihre Effekte sind dadurch langsamer und anhaltender als die ionotroper Rezeptoren. Synaptische Übertragung im Zentralnervensystem l l l Die synaptische Übertragung im Zentralnervensystem ist um ein Vielfaches komplexer als die synaptische Übertragung an der neuromuskulären Synapse Unterschwellige Depolarisation. An der neuromuskulären Synapse führt jedes acetylcholinvermittelte depolarisierende Endplattenpotential (EPP) zur Bildung eines Aktionspotentials der Muskelfaser. Damit nimmt die motorische Endplatte eine Sonderstellung ein, denn an den meisten Synapsen des zentralen Nervensystems genügt die isolierte Aktivierung einzelner Synapsen nicht, um ein Aktionspotential auszulösen. Stattdessen bewirkt die Erregung eines präsynaptischen Neurons eine unterschwellige Depolarisation (erregende Synapsen) oder eine Hyperpolarisation (hemmende Synapsen) der postsynaptischen Nervenzelle. Allgemein werden Potentialänderungen, die durch chemische Übertragung in einem postsynaptischen Neuron ausgelöst werden, als postsynaptische Potentiale (PSPs) bezeichnet. Die Effektivität einer Synapse hängt dabei wesentlich von ihrer Lokalisation auf der Nervenzelle ab. Innervation. Während reife Skelettmuskelfasern meist nur von einem einzigen Motoneuron innerviert werden, sind zentrale Neurone mit Hunderten oder sogar Tausenden anderer Nervenzellen verbunden. So ist z. B. jede einzelne Purkinje-Zelle des Kleinhirns (s. Abb. 2-16) über die so genannten Parallelfasern mit über 100 000 Körnerzellen verbunden (Abschn. B-3.8, B-24.6). Transmitter und Rezeptoren. Für die Übertragung an neuromuskulären Synapsen ist nur ein einziger Neurotransmitter (Acetylcholin) verantwortlich, der an einen Rezeptortyp (nicotinischer Acetylcholinrezeptor) bindet. Im Zentralnervensystem erhält ein einzelnes Neuron jedoch sowohl inhibitorische als auch erregende Eingänge, die über verschiedene Transmitter vermittelt werden, die an unterschiedliche Rezeptoren binden. Das postsynaptische Neuron verarbeitet alle synaptischen Eingänge zu einer Antwort, die an nachgeschaltete Zellen weitergeleitet wird (Integration). l l l Erregende synaptische Übertragung führt das postsynaptische Neuron näher an den Schwellenwert zur Auslösung von Aktionspotentialen, während hemmende synaptische Übertragung die Wahrscheinlichkeit von Aktionspotentialen verringert Erregende Synapsen. An erregenden Synapsen führt die Öffnung von Ionenkanälen zu einem Ionenstrom, der das postsynaptische Neuron depolarisiert. Dieser Strom wird als einwärts gerichteter, erregender postsynaptischer Strom (EPSC von excitatory postsynaptic current) bezeichnet. Im Fall einer glutamatergen Synapse (s. u.) kommt ein EPSC nach Bindung von Glutamat an ionotrope AMPA-Rezeptoren durch die Öffnung der assoziierten Kationenkanäle zustande. Das EPSC ruft ein erregendes postsynaptisches Potential (EPSP), also eine kurzzeitige Depolarisation des postsynaptischen Neurons hervor (Abb. 2-13). Dadurch wird das Membranpotential der Zelle näher an den Schwellenwert zur Aus- Pyramidenzelle des Hippocampus postsynaptische Antwort erregendes postsynaptisches Potential (EPSP) Ableitung 5 mV Dendrit präsynaptische Endigung 10 ms Stimulation erregender postsynaptischer Strom (EPSC) dendritische Spines 20 pA 10 ms 20 mm Stimulation Abb. 2-13. Durch den Glutamatrezeptorkanal vermitteltes erregendes postsynaptisches Potential (EPSP) und der dazu gehörende postsynaptische Strom (EPSC von excitatory postsynaptic current). Die erregenden (glutamatergen) Synapsen der Pyramidenzellen des Hippocampus (links) befinden sich jeweils an dendritischen Spines (Mitte). Die Freisetzung von Glutamat führt zur Entstehung eines EPSP (rechts oben). Wenn statt der Potentialregistrierung der postsynaptische Strom gemessen wird, kann der entsprechende EPSC beobachtet werden (rechts unten). Zu beachten ist die viel kürzere Dauer des EPSC 2.6 Synaptische Übertragung im Zentralnervensystem y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 49 lösung eines Aktionspotentials gebracht bzw. die Wahrscheinlichkeit der Auslösung von Aktionspotentialen erhöht. Hemmende Synapsen. Hemmende Synapsen zeichnen sich dadurch aus, dass ihr Transmitter (z. B. GABA) einen Ionenstrom auslöst, der die Wahrscheinlichkeit eines Aktionspotentials herabsetzt. Dieses kann durch den Einstrom von negativen Ladungen (z. B. Chlorid-Ionen) vermittelt werden. Der entsprechende inhibitorische synaptische Strom wird als IPSC (inhibitory postsynaptic current) bezeichnet. Der IPSC führt dann zu einer Hyperpolarisation der postsynaptischen Zelle bzw. zu einem inhibitorischen postsynaptischen Potential (IPSP) (s. Abb. 2-17). Stimmt das Membranpotential der postsynaptischen Zelle allerdings mit dem Umkehrpotential des IPSC überein, kommt es nicht zu einer Membranpotentialänderung, da kein Nettostrom durch die geöffneten Kanäle flieût (Abschn. B-2.3). Allerdings kann die Öffnung dieser Kanäle auch inhibitorisch wirken, indem sie das Membranpotential durch einen ¹Kurzschlussª auf Werte unterhalb des Schwellenwerts zur Auslösung von Aktionspotentialen senken und so der Depolarisation Zellmembran entgegenwirken (shunting inhibition). Die Ionenselektivität von Kanälen bestimmt, ob ein Transmitter erregende oder hemmende Wirkung besitzt. Ob durch synaptische Übertragung in der nachgeschalteten Zelle ein EPSP oder ein IPSP ausgelöst wird, hängt ausschlieûlich von EPSP Axonhügel der Ionenselektivität der von den postsynaptischen Neurotransmitterrezeptoren gesteuerten Kanäle ab. Sind diese Kanäle durchlässig für Ionen, deren Umkehrpotential positiver als das aktuelle Membranpotential ist, wird die Membran bei Öffnung depolarisieren und demzufolge ein EPSP ausgelöst. Ist das Umkehrpotential aber negativer als das Membranpotential, hyperpolarisiert die Membran, und es folgt ein IPSP. Stimmt das Umkehrpotential mit dem aktuellen Membranpotential überein, bleibt die synaptische Übertragung trotz geöffneter Ionenkanäle ohne Einfluss auf das Membranpotential (s. o.). l l l Synaptische Potentiale werden elektrotonisch zur Impulsentstehungszone weitergeleitet und dabei räumlich und zeitlich integriert Summation synaptischer Potentiale. Im Gegensatz zur neuromuskulären Synapse reichen einzelne postsynaptische Potentiale an zentralen Synapsen meistens nicht aus, um direkt Aktionspotentiale auszulösen (eine der Ausnahmen ist allerdings die Synapse zwischen Kletterfaser und Purkinje-Zelle im Kleinhirn). Wie kommt es dann aber zur Signalweiterleitung im Gehirn? Die Signalweiterleitung bzw. Aktionspotentialentstehung im postsynaptischen Neuron wird dadurch ermöglicht, dass seine vielfältigen synaptischen Eingänge im Aktionspotential keine Weiterleitung EPSP/ IPSP keine Weiterleitung aktive Weiterleitung IPSP 1 EPSP 1 elektrotonische Weiterleitung elektrotonische Weiterleitung elektrotonische Weiterleitung EPSP 1 EPSP 1 elektrotonische Weiterleitung EPSP 2 a b Abb. 2-14. Summation postsynaptischer Potentiale in zentralen Neuronen. (a) Ein EPSP (EPSP 1) breitet sich von seinem Entstehungsort an einer Synapse eines peripheren Dendriten elektrotonisch entlang dem Dendritenbaum bis zum Soma hin aus und wird dabei abgeschwächt. Am Axonhügel erreicht die Potentialänderung nicht den Schwellenwert zur Auslösung von Aktionspotentialen, daher findet keine Weiterleitung des Signals statt. (b) Wird gleichzeitig zu EPSP 1 an einer zweiten Synapse ein weiteres EPSP generiert (EPSP 2), kommt es durch Summation der beiden elektrischen Signale zu einer gröûeren Potential50 Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* c änderung am Axonhügel, und die Schwelle zur Auslösung von Aktionspotentialen wird erreicht. Die Summation der EPSPs führt zu einer aktiven Signalweiterleitung der synaptischen Signale in Form von Aktionspotentialen. (c) Wird gleichzeitig zu EPSP 1 ein inhibitorisches postsynaptisches Potential (IPSP 1) generiert, so summieren sich auch hier die Signale. Allerdings führt die Summation in diesem Fall dazu, dass die Schwelle zur Auslösung von Aktionspotentialen am Axonhügel nicht erreicht wird und keine Weiterleitung stattfindet Dendritenbaum und Zellsoma räumlich und zeitlich summiert bzw. integriert werden. Entscheidend dabei ist, dass postsynaptische Potentiale elektrotonisch entlang dem Dendritenbaum zum Zellkörper geleitet werden (Abschn. B-1.6). Dadurch können sich diese Potentialänderungen auf ihrem Weg zur Impulsentstehungszone (im Normalfall der Axonhügel) mit anderen synaptisch generierten Potentialänderungen überlagern. Räumliche und zeitliche Summation. Werden zur gleichen Zeit an unterschiedlichen Stellen im Dendritenbaum EPSPs generiert, können sich diese an Verzweigungspunkten bzw. an Punkten, an den denen sich die dendritischen Fortsätze vereinigen, überlagern (Abb. 2-14). Diese Summation zweier, gleichzeitig an verschiedenen Stellen generierter EPSPs zu einem einzigen Signal kann eine Vergröûerung der Depolarisationsamplitude nach sich ziehen. Dadurch kann die Schwelle zur Auslösung eines Aktionspotentials am Axonhügel bzw. Impulsentstehungsort überschritten werden (räumliche Summation; Abb. 2-14 b). Genauso verhalten sich zwei EPSPs, die in dichter zeitlicher Abfolge an derselben Synapse ausgelöst werden. Wird das zweite EPSP generiert, bevor die Potentialänderungen des ersten Impulses vollständig abgeklungen sind, können sich auch diese beiden unterschwelligen Impulse zu einem überschwelligen Signal addieren (zeitliche Summation). Synaptische Inhibition beruht auf den gleichen Prinzipen: Die Überlagerung von an sich überschwelligen EPSPs mit hyperpolarisierenden IPSPs kann dazu führen, dass das Schwellenpotential zur Auslösung von Aktionspotentialen nicht mehr überschritten wird (Abb. 2-14 c). Das Neuron kann den erregenden Impuls nicht mehr weiterleiten. l l l Erregende und hemmende Synapsen befinden sich an unterschiedlichen Positionen entlang der postsynaptischen Nervenzelle Axosomatische, axodendritische Synapsen. Synapsen werden von einem Axon sowohl direkt an Zellkörpern (axosomatische Synapsen), an Dendriten und dendritischen Dornfortsätzen (axodendritische Synapsen) als auch an Axonen (axoaxonische Synapsen) ausgebildet (Abschn. B-1.1). Einen Spezialfall stellen die dendrodendritischen Synapsen (Synapsen von Dendriten an Dendriten) der Mitralzellen des Bulbus olfactorius und die von Neuronen im Thalamus dorsalis dar (Abschn. B-3.9, B-3.10, B-15.1). Sie dienen dem Aufbau lokaler neuronaler Netzwerke. Wie oben erläutert, werden postsynaptische Potentiale auf ihrem Weg von der Synapse zum Zellkörper bzw. zur Impulsentstehungszone elektrotonisch weitergeleitet und abgeschwächt (Abschn. B-1.6). Daher ist die räumliche Nähe einer Synapse zum Impulsentstehungsort entscheidend für ihre Effektivität. Erregende Synapsen. Die meisten Synapsen an dendritischen Spines sind erregend (Abb. 2-13, Abb. 2-16, Abschn. B-1.1). Spines stellen räumlich vom dendritischen Schaft getrennte Kompartimente dar, in denen nach synaptischer Übertragung isolierte Erhöhungen der Calciumkonzentration beobachtet werden können. Aufgrund dieser Eigenschaft werden sie als das kleinste integrative Element von Neuronen angesehen. Inhibitorische Synapsen. Inhibitorische Synapsen befinden sich im Gehirn meist direkt am Zellkörper. Ihre Aktivierung führt zu einer erhöhten Chloridleitfähigkeit der somatischen Membran, wodurch sich der Einfluss gleichzeitig einlaufender EPSPs stark abschwächen kann (shunting inhibition; s. o.). Dadurch kann eine einzelne inhibitorische axosomatische Synapse den Effekt vieler erregender axodendritischer Synapsen aufheben oder zumindest deutlich schmälern. Axoaxonische Synapsen sind eine besondere Form inhibitorischer Synapsen und vermitteln die präsynaptische Hemmung. Sie sind z. B. an der präsynaptischen Endigung von I a-Afferenzen zu finden, die erregende Synapsen auf Motoneuronen bilden (Abschn. B-24.2). Die inhibitorische Aktivität des präsynaptischen Neurons der axoaxonischen Synapse führt dabei zu einer Verringerung der Effektivität der nachgeschalteten synaptischen Verbindung zwischen I a-Afferenz und Motoneuron. Diese Form der synaptischen Verschaltung ermöglicht die selektive Steuerung einzelner synaptischer Eingänge. l l l Glutamat vermittelt die überwiegende Mehrzahl schneller erregender synaptischer Übertragungen im Gehirn Lokalisation und Wirkung von Glutamat. Glutamat ist der dominierende erregende Transmitter im Zentralnervensystem. Die Wirkung von Glutamat an zentralen Synapsen kann jedoch recht unterschiedlich sein. Einmal werden kurze EPSPs beobachtet, ein andermal relativ lang anhaltende EPSPs. Teilweise werden keinerlei Calciumkonzentrationsänderungen beobachtet, teilweise sind die EPSPs mit ¾nderungen der intrazellulären Calciumkonzentration verbunden. Auch der Zeitverlauf dieser Calciumkonzentrationsänderungen kann sehr verschiedenartig sein. Der Grund für die Variabilität der glutamatinduzierten postsynaptischen Antworten ist die Expression verschiedener Glutamatrezeptortypen (Tab. 2-3, Tab. 2-4, Abschn. B-2.5, s. u.). l l l AMPA-Rezeptoren vermitteln die schnellsten glutamatinduzierten Antworten. Öffnung von NMDA-Rezeptoren bewirkt einen Anstieg der Calciumkonzentration in der postsynaptischen Zelle AMPA-Rezeptoren als unspezifische Kationenkanäle. Die Bindung von Glutamat an AMPA-Rezeptoren führt zu einer Öffnung unspezifischer Kationenkanäle und löst einen schnellen Strom von Natrium- und Kalium-Ionen durch die Membran aus (EPSC; Abb. 2-13, Abb. 2-15). Da das Umkehrpotential dieses Stroms bei etwa 0 mV und das Membranpotential von Neuronen bei etwa ±70 mV liegt, führt die Öffnung der integralen Ionenkanäle von Glutamatrezeptoren zu einer postsynaptischen Depolarisation, einem EPSP (Abb. 213). AMPA-Rezeptoren desensitivieren sehr schnell. 2.6 Synaptische Übertragung im Zentralnervensystem y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 51 NMDA-Rezeptorkanal AMPA-Rezeptorkanal Na+ Ca2+ Glutamat + Na Glutamat Zn2+ Mg2+ Glycin K+ K+ b a synaptische Stimulation NMDA-Rezeptoraktivierter Strom Membranpotential +20 mV APV: AMPA-Rezeptoraktivierter Strom – 80 mV APV Besonderheiten von NMDA-Rezeptoren. Wie AMPA-Rezeptoren sind die NMDA-Rezeptorkanäle für unspezifische Kationen permeabel, zeigen aber mehrere Besonderheiten (Abb. 2-15). Ihr Strom entwickelt sich langsamer und hält länger an als der von AMPA-Rezeptoren, da NMDA-Rezeptoren vergleichsweise langsam desensitivieren. Zudem benötigen sie für ihre Öffnung neben Glutamat auch Glycin, das als obligatorischer Cotransmitter dient. Bereits in geringen Konzentrationen potenziert Glycin die erregende Wirkung des Neurotransmitters Glutamat auf Nervenzellen. Dieser Mechanismus ist unabhängig von der hemmenden Wirkung von Glycin. Nur bei gleichzeitiger Besetzung der Bindungsstellen für Glutamat und Glycin öffnet sich der Kationenkanal des NMDA-Rezeptorkomplexes. Auûerdem haben NMDA-Rezeptorkanäle eine hohe Leitfähigkeit für Calcium-Ionen. Calcium kann als Second Messenger intrazelluläre Signalkaskaden aktivieren. Spannungsabhängigkeit von NMDA-Rezeptorkanälen. Schlieûlich besitzen NMDA-Rezeptorkanäle die für ionotrope Rezeptoren ungewöhnliche Eigenschaft, dass ihre Öffnung spannungsabhängig ist. Bei normalen Ruhemembranpotential (etwa ±70 mV) werden die Kanäle durch die physiologisch extrazellulär vorhandenen Magnesium-Ionen blockiert, d. h. auch wenn Glutamat und Glycin an die Rezeptoren binden, öffnen sie bei diesem Potential nicht (Abb. 2-15). Wird die postsynaptische Membran jedoch auf Werte von mehr als ±30 mV depolarisiert (z. B. bei repetitiver Stimulation), löst sich Magnesium vom Rezeptor und die Kanäle öffnen. l l l Aktivierung von metabotropen Glutamatrezeptoren führt zur Calciumfreisetzung aus intrazellulären Speichern c Abb. 2-15. Ionotrope Glutamatrezeptorkanäle. (a) Der AMPARezeptorkanal ist für Natrium- und Kalium-Ionen permeabel. (b) Der NMDA-Rezeptorkanal ist für Calcium-, Natrium- und Kalium-Ionen permeabel. Allerdings wird der Kanal nur geöffnet, wenn die Zelle auf mehr als etwa ±40 mV depolarisiert und dadurch der Magnesiumblock beseitigt wird. Die Öffnung des NMDA-Rezeptorkanals erfordert die Bindung von Glycin an den Rezeptor. Der Strom durch den NMDA-Rezeptorkanal wird durch Zink-Ionen reduziert. (c) Die Beteiligung von NMDA-Rezeptoren an Membranströmen einer glutamatergen Synapse kann mit Hilfe des NMDA-Rezeptorblockers APV (2-Amino-5-phosphonovalerat) untersucht werden. Bei hohem Membranpotential (±80 mV) bleibt APV ohne deutliche Wirkung auf den postsynaptischen Strom. Dies zeigt, dass der Strom fast ausschlieûlich durch die Öffnung von AMPA-Rezeptoren zustande kommt. Bei Depolarisation der Zelle auf +20 mV dagegen führt APV zu einer deutlichen Reduktion des Stroms. Der verbleibende Stromanteil wird durch AMPA-Rezeptoren hervorgerufen, während der durch APV blockierte Strom durch NMDA-Rezeptoren hervorgerufen wird. Nach Kandel ER, Schwartz JH, Jessel TM. Principles of Neural Science, 4. Aufl. Elsevier, New York (2000) 52 Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* Die Aktivierung der meisten erregenden Synapsen zentraler Neurone führt zur Freisetzung von Calcium aus intrazellulären Speichern im postsynaptischen Neuron. Diese Freisetzung von Calcium wird häufig durch die Aktivierung metabotroper Glutamatrezeptoren und die anschlieûende Erzeugung von IP3 vermittelt. In Purkinje-Neuronen des Kleinhirns ist diese Form der synaptischen Übertragung am besten untersucht. Abb. 2-16 zeigt, dass IP3-vermittelte Calciumfreisetzung aus intrazellulären Speichern nach synaptischer Aktivierung metabotroper Glutamatrezeptoren zu einem vergleichsweise langsamen lokalen Calciumtransienten in Dendriten und dendritischen Dornfortsätzen (Spines; Abschn. B1.1) führt. l l l Glutamaterge Synapsen besitzen mehrere Typen von Glutamatrezeptoren Spines Ableitung Purkinje-Zelle des Kleinhirns Axon 2+ langsames EPSP lokaler Ca -Transient 5 mV 5 mV 250 ms 250 ms Stimulation Stimulation a präsynaptische Endigung Spine Dendrit IP3-Rezeptor AMPARezeptor Ca2+ IP3-Rezeptor Ca2+ Ca2+ IP3 Glutamat metabotroper Glutamatrezeptor endoplasmatisches Reticulum b Abb. 2-16. Synaptische Funktion metabotroper Glutamatrezeptoren in den Purkinje-Zellen des Kleinhirns. (a) Die PurkinjeZellen des Kleinhirns (links) bilden mehrere Hunderttausend erregende Synapsen mit den afferenten Parallelfasern, jede davon an einem dendritischen Dornfortsatz (Spine). Neben den AMPARezeptorkanälen, befinden sich auf den Spines metabotrope Glutamatrezeptoren (s. b). Die durch metabotrope Glutamatrezeptoren ausgelöste postsynaptische Antwort besteht aus einem langsamen EPSP und zusätzlich aus einem intrazellulären Calciumsignal (rechts). (b) Schematischer Aufbau der glutamatergen Parallelfasersynapsen AMPA- und NMDA-Rezeptoren. Die meisten glutamatergen Synapsen besitzen sowohl AMPA- als auch NMDA-Rezeptoren. Der Strom, der durch jeden dieser beiden Rezeptortypen hervorgerufen wird, kann pharmakologisch und durch ¾nderung der Membranspannung isoliert werden. Abb. 2-15 c zeigt, dass APV (2-Amino-5-phosphonovalerat), ein Hemmstoff vom NMDA-Rezeptoren, kaum Auswirkungen auf den Verlauf des postsynaptischen Stroms hat, wenn das Membranpotential in der Nähe des Ruhemembranpotentials liegt (hier bei ±80 mV). Wird die Zelle jedoch auf +20 mV depolarisiert, zeigt sich unter Einfluss von APV eine deutliche Verringerung des Stroms, die auf die Blockade der NMDA-Rezeptoren zurückzuführen ist. Die spannungsabhängige Blockade der NMDA-Rezeptoren wird durch Magnesium-Ionen vermittelt. Sie kann daher durch die Entfernung von Magnesium aus der Extrazellulärlösung aufgehoben werden. Bedeutung der unterschiedlichen Rezeptorkanäle. Da ihre Öffnung nur vom Vorhandensein von Glutamat und nicht vom Membranpotential der postsynaptischen Zelle abhängt, sind AMPA-Rezeptoren für die Vermittlung schneller glutamatinduzierter postsynaptischer Antworten bei stark negativem Membranpotential ± d. h. in der Nähe des Ruhemembranpotentials ± verantwortlich. Dies bedeutet, dass sie auch aktiviert werden, wenn das postsynaptische Neuron keine Aktionspotentiale feuert. Durch die schnelle Desensitivierung von AMPA-Rezeptorkanälen werden dabei nur relativ kurze EPSPs ausgelöst. Im Gegensatz dazu sind NMDA-Rezeptoren nahe des Ruhemembranpotentials durch Magnesium blockiert. Auch bei präsynaptischer Glutamatfreisetzung tragen sie daher nicht zum postsynaptischen Strom bei. Kommt es jedoch durch eine starke synaptische Aktivierung der AMPARezeptoren zu einer starken postsynaptischen Depolarisation und zur Auslösung von Aktionspotentialen, wird der Magnesiumblock der NMDA-Rezeptoren aufgehoben und sie tragen zum postsynaptischen Strom bei. Dieser Strom hält wegen der relativ geringen Desensitivierung der Rezeptoren lange an. NMDA-Kanäle und synaptische Plastizität. Die besonderen Eigenschaften von NMDA-Rezeptoren ± vor allem der selektive NMDA-vermittelte Anstieg der intrazellulären Calciumkonzentration bei starker Stimulation ± haben zu der Auffassung geführt, dass NMDA-Kanäle eine wichtige Rolle bei der Entstehung synaptischer Plastizität (Abschn. B-6.4) spielen. Eine Fehlfunktion dieser Rezeptoren führt im Tiermodell zu deutlich verschlechterten Lernleistungen. Auch die durch die Aktivierung metabotroper Glutamatrezeptoren hervorgerufenen intrazellulären Calciumsignale sind für bestimmte Lernvorgänge essentiell. Mausmutanten, denen metabotrope Glutamatrezeptoren fehlen, zeigen charakteristische cerebelläre Symptome wie Ataxien und unkoordinierte Bewegungsmuster. 2.6 Synaptische Übertragung im Zentralnervensystem y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 53 Box 2-3. Exzitotoxizität Als Exzitotoxizität bezeichnet man den durch eine übermäûige Aktivierung erregender Rezeptoren hervorgerufenen Zelltod von Neuronen. Im Normalfall wird bei synaptischer Übertragung die Glutamatkonzentration im synaptischen Spalt nur für einige Millisekunden erhöht, da Gliazellen und Neurone das Glutamat sehr schnell wieder aufnehmen (Abschn. B-2.4). In pathologischen Situationen wie Ischämie (mangelnde Blutversorgung) oder Anoxie (Sauerstoffmangel) kann es jedoch zu einer massiven Erhöhung der Glutamatkonzentration im Extrazellulärraum kommen, da die energieabhängige Aufnahme von Glutamat reduziert wird. Dies führt zu einer anhaltenden Stimulation von NMDA-Rezeptoren und zu einem starken Calciumeinstrom in die postsynaptischen Zellen. Die erhöhte intrazelluläre Calciumkonzentration wird als Hauptursache für die auftretende Neurodegeneration angesehen. Tatsächlich kann die Anwendung von Glutamatrezeptorantagonisten im Tierexperiment zu einer deutlichen Verringerung des ischämieinduzierten Zelltods führen. l l l GABA und Glycin vermitteln als inhibitorische Transmitter die synaptische Hemmung von Nervenzellen Die Aminosäuren GABA und Glycin sind die wichtigsten Transmitter hemmender Synapsen im ZNS. Der strukturelle Aufbau einer glycinergen Synapse ist in Abb. 2-17 darge- stellt. Sowohl GABAA-Rezeptoren als auch Glycinrezeptoren sind als ligandengesteuerte Anionenkanäle für Chlorid-Ionen sehr gut durchlässig (Tab. 2-4). In den meisten Neuronen des adulten Gehirns ist das Umkehrpotential für diesen Chloridstrom mit etwa ±85 mV negativer als das Membranpotential, das bei etwa ±70 mV liegt. Infolgedessen kann Chlorid bei Öffnung der Kanäle entlang seinem elektrochemischen Gradienten in die Zelle einströmen. Aufgrund ihrer negativen Ladung hyperpolarisieren Chlorid-Ionen die Zelle und lösen damit ein IPSP aus. GABA-Hemmung versus Erregung. Aufgrund einer relativ hohen intrazellulären Chloridkonzentration liegt das Umkehrpotential von Chlorid im embryonalen Nervensystem und in Spinalganglien über dem postsynaptischen Membranpotential. Daher bewirkt die Ausschüttung von GABA eine Depolarisation. Ob diese Depolarisation hemmend oder erregend wirkt, hängt von dem genauen Wert des Chloridumkehrpotentials ab. Liegt es über dem Schwellenwert zur Auslösung von Aktionspotentialen, fungiert GABA als erregender Transmitter. Dies ist in der frühen Gehirnentwicklung, vor der Ausreifung glutamaterger Synapsen, der Fall. Wenn das Chloridumkehrpotential deutlich unter dem Schwellenpotential zur Auslösung von Aktionspotentialen liegt, wird das Membranpotential der Zelle auf den Wert des Chloridpotentials gesenkt, und die GABA-induzierte Depolarisation kann hemmend wirken (shunting inhibition; s. o.). é Ca2+ Glycin Transport CI– 2.7 – CI Jedes Neuron im Nervensystem empfängt ständig synaptische Signale von anderen Neuronen. Diese Signale können sowohl erregend als auch hemmend sein. Glutamat und GABA sind die wichtigsten Transmitter im Zentralnervensystem und binden sowohl an ionotrope als auch an metabotrope Rezeptoren. Durch elektrotonische Ausbreitung der postsynaptischen Potentialänderungen entlang dem Dendritenbaum werden die verschiedenen synaptischen Eingänge integriert, d. h. sie können sich gegenseitig verstärken oder abschwächen. Dabei ist die Lokalisation der Synapsen entscheidend für ihren Einfluss und ihre Effektivität. Gephyrin Monoamine in der synaptischen Signalübertragung IPSP Em Abb. 2-17. Schematischer Aufbau einer glycinergen Synapse. Der depolarisationsinduzierte Einstrom von Calcium führt zur Freisetzung von Glycin aus präsynaptischen Vesikeln. Nach Bindung von Glycin an postsynaptische Rezeptoren kommt es zu einem Einstrom von Chlorid-Ionen (Cl±) und zu einem inhibitorischen postsynaptischen Potential (IPSP). Glycin wird über spezifische Transportmechanismen wieder in die präsynaptische Endigung aufgenommen; Chlorid wird ebenfalls über Transporter aus der postsynaptischen Zelle ausgeschleust. Das Protein Gephyrin dient zur Verankerung der Glycinrezeptoren in der postsynaptischen Membran 54 Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* l l l Monoaminerge Neurone gibt es vor allem im Hirnstamm und im peripheren autonomen Nervensystem Durch Hydroxylierung und anschlieûende Decarboxylierung von Aminosäuren entstehen die Monoamine Dopamin, Noradrenalin und Serotonin. Histamin wird dagegen durch direkte Decarboxylierung synthetisiert. Im ZNS sind die Zellkörper monoaminerger Neurone fast ausnahmslos im Hirnstamm lokalisiert, erreichen jedoch mit ihren Axonen fast alle Hirnareale (Kap. B-3). Wie der Verlust dopaminerger Neurone der Substantia nigra (Abschn. B-3.6) bei Morbus pp p A PH BC Parkinson zeigt, führen Funktionsstörungen dieser wichtigen Systeme zu schweren neurologischen Defekten. Monoamine vermitteln ihre Wirkung im ZNS und im peripheren sympathischen Nervensystem (Abschn. C-4.1) überwiegend durch metabotrope Rezeptoren. Freisetzung aus axonalen Varikositäten. Aminerge Synapsen des peripheren vegetativen Nervensystems unterscheiden sich von denen im ZNS durch den Aufbau ihrer präsynaptischen Seite. Monoamine werden peripher an so genannten Varikositäten der Axone freigesetzt. In Varikositäten finden sich neben kleinen präsynaptischen Vesikeln (Durchmesser 50 nm) auch gröûere Vesikel (Durchmesser > 80 nm), die neben dem Transmitter das saure Protein Chromogranin enthalten und im Elektronenmikroskop dunkel erscheinen (large dense core vesicles). Im ZNS bilden monoaminerge Axone teils ¹klassischeª Synapsen mit prä- und postsynaptischen Membranspezialisierungen, teilweise findet Transmitterfreisetzung jedoch auch an Orten statt, an denen diese morphologischen Spezialisierungen fehlen (¹Volumentransmissionª). Monoamine werden jedoch nicht nur an Synapsen, sondern auch als parakrine Mediatoren von Paraganglien und neuroendokrinen Zellen (Abschn. C-4.2, C-10.9) in Darm und Lunge, von Mastzellen und Leukocyten sezerniert. Indem sie in das umgebende Gewebe diffundieren, wirken Monoamine über eine gröûere Distanz auf die glatte Muskulatur und benachbarte Gefäûe. Daneben dienen sie als Vermittler der Entzündungsreaktion. Die Grenzen zwischen parakrinen Mediatoren und Hormonen sind flieûend (Abschn. C-3.1): Das zu den Catecholaminen zählende Adrenalin wird im Nebennierenmark gebildet und ins Blut freigesetzt, so dass es als Hormon eine systemische Wirkung auf den gesamten Organismus entfaltet. Adrenalin bindet an G-Protein-gekoppelte Catecholaminrezeptoren, die wiederum denen an noradrenergen Synapsen gleichen. COOH C H2 CH H2N Phenylalanin PhenylalaninHydroxylase Tetrahydrobiopterin COOH HO C H2 CH H2N COOH HO C H2 CH H2N HO Tyrosin TyrosinHydroxylase Tetrahydrobiopterin L-DOPA Dihydroxyphenylalanin DOPADecarboxylase PLP (Pyridoxalphosphat) H HO C H2 CH H2N HO Dopamin Dopamin-βHydroxylase Ascorbat OH H HO C H CH Noradrenalin H2N HO PNMT PhenylethanolaminN-Methyltransferase SAM S-Adenosylmethionin OH H HO C H HO CH Adrenalin NH H 3C Abb. 2-18. Bildung von Catecholaminen aus Tyrosin l l l Catecholamine werden aus Tyrosin gebildet Die Neurotransmitter Dopamin und Noradrenalin werden aus Tyrosin gebildet (Abb. 2-18). Geschwindigkeitsbestimmend für die Synthese ist die Hydroxylierung zu L-DOPA (Dihydroxyphenylalanin). Dieser Schritt wird durch Tyrosin-Hydroxylase, eine mischfunktionelle Oxidase, unter Beteiligung von Tetrahydrobiopterin und molekularem Sauerstoff im Cytosol des Neurons katalysiert. Das in seiner Proteinstruktur der Phenylalanin-Hydroxylase (Abschn. A-11.6) homologe Enzym, dessen vier Untereinheiten (60 kDa) Erkennungsmotive für Protein-Kinasen tragen (PKA, PKC, CAM-Kinase), wird durch Phosphorylierung aktiviert. Hohe Enzymaktivitäten finden sich in Hirnstamm, sympathischen Ganglien und Nebennierenmark. Durch pyridoxalphosphatabhängige Decarboxylierung geht L-DOPA in Dopamin über. Dopamin ist das Endprodukt in den dopaminergen Neuronen der Substantia nigra, des ventralen Tegmentums, des retrorubralen Feldes und des Hypothalamus (Abschn. B-3.9). Das beteiligte Enzym, DOPADecarboxylase (oder aromatische L-Aminosäure-Decarboxylase), ist nicht für die Catecholaminsynthese spezifisch, son- dern auch an der Bildung von Serotonin beteiligt; sie kommt auch in nicht-neuronalen Zellen vor. Speicherung von Dopamin in präsynaptischen Vesikeln. Im ZNS reichert der membranständige Antiporter VMAT2 (vesicular membrane transporter 2) Dopamin und andere Catecholamine im Austausch gegen Protonen in den präsynaptischen Vesikeln an (Abb. 2-19). Dabei wird im Vesikellumen eine Catecholaminkonzentration von 0,5 mol L±1 erreicht. Den dazu erforderlichen Protonengradienten erzeugt eine ATP-abhängige Protonenpumpe der Vesikelmembran. VMAT2 ist ein Membranprotein mit 12 Transmembranregionen. Das früher zur Blutdrucksenkung genutzte pflanzliche Alkaloid Reserpin blockiert die Aufnahme von Dopamin und anderen Catecholaminen ins Vesikelinnere durch VMAT2 mit sehr hoher Affinität. Da die antihypertensive Wirkung von Reserpin mit dem Auftreten von Depressionen und Parkinson-ähnlichen Bewegungsstörungen erkauft wird, darf diese Substanz nur noch in besonderen Fällen verschrieben werden. 2.7 Monoamine in der synaptischen Signalübertragung y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 55 Tryrosin Tryrosin Tryptophan TyrosinHydroxylase TyrosinHydroxylase TryptophanHydroxylase L-DOPA L-DOPA 5-Hydroxytryptophan aromatische AminosäureDecarboxylase aromatische AminosäureDecarboxylase Dopamin Dopamin Serotonin Dopamin H+ VMAT2 aromatische AminosäureDecarboxylase Dopamin H+ VMAT2 Dopaminb-Hydroxylase H+ VMAT2 Serotonin Noradrenalin DAT NET 1 Na+ Dopamin Noradrenalin NH2 D1-5 NH2 COOH a1-3,b1-3 COOH Na+ Serotonin NH2 5-HT1,2,4-7 COOH Na+ 5-HT3 Abb. 2-19. Synaptische Übertragung durch Monoamine. Die vergleichende Darstellung zeigt, dass dopaminerge, noradrenerge und serotonerge Synapsen einen ähnlichen Aufbau besitzen. Ausgehend von den Aminosäuren Tyrosin und Tryptophan entstehen die Monoamine, die über den H+-Antiporter VMAT2 (vesicular membrane transporter 2) in Speichervesikel aufgenommen werden. Nach Ausschüttung in die Synapse werden die Monoamine in einem natriumabhängigen Transportschritt zunächst wieder ins Cytosol, von dort in die Vesikel aufgenommen. Die Neurotransmitterkonzentration im synaptischen Spalt hängt von der präsynaptischen Freisetzung und der Geschwindigkeit seiner Inaktivierung ab. Der Transmitter kann durch enzymatischen Abbau oder durch Wiederaufnahme in die neuronale Präsynapse oder umgebende Gliazellen inaktiviert werden. DAT = Dopamintransporter; NET1 = Noradrenalintransporter 1; SERT = Serotonintransporter Synthese von Noradrenalin und Adrenalin. In den Vesikeln noradrenerger Neurone wird Dopamin unter Beteiligung von molekularem Sauerstoff und Ascorbinsäure (Vitamin C) durch die Dopamin-b-Hydroxylase, eine mischfunktionelle Oxidase, zu Noradrenalin umgesetzt (Abb. 2-19). Noradrenalin wird in den Vesikeln der Varikositäten gespeichert und nach Einstrom von Calcium gemeinsam mit Dopamin-b-Hydroxylase in den Extrazellulärraum ausgeschüttet. In den meisten Zellen des Nebennierenmarks und in wenigen Hirnstammneuronen, die als adrenerg bezeichnet werden, folgt ein weiterer Schritt: Dort wird durch das Enzym Phenylethanolamin-N-Methyltransferase (PNMT) eine Methylgruppe auf den Stickstoff von Noradrenalin übertragen und dadurch Adrenalin gebildet. Als Lieferant der Methylgruppen dient S-Adenosylmethionin. Adrenalin ist auch Transmitter im Sympathikus von Vögeln, Reptilien und Amphibien, nicht jedoch bei Säugern. Noradrenalintransporter NET1 (norepinephrine transporter) sind Glycoproteine der äuûeren Zellmembran, die den jeweiligen Transmitter im Cotransport mit Natrium ins Cytosol aufnehmen (Abb. 2-19). Dadurch stellt sich ein Gleichgewicht von Freisetzung und neuronaler Wiederaufnahme ein, das die Transmitterkonzentration vor den Rezeptoren und die Stärke des synaptischen Signals bestimmt. Durch die Hemmung der Wiederaufnahme von Dopamin und Noradrenalin steigern trizyklische Antidepressiva (z. B. Desipramin) oder das Rauschgift Cocain deren Transmitterwirkung deutlich. Der H+-Antiporter VMAT2 schleust diese Monoamine schlieûlich wieder vom Cytosol in die präsynaptischen Vesikel ein, wo sie erneut zur synaptischen Freisetzung verfügbar sind. l l l Die Wirkung von Monoaminen wird durch präsynaptische Wiederaufnahme und enzymatischen Abbau beendet Aufnahme durch Transporter. Die in den synaptischen Spalt freigesetzten Neurotransmitter Dopamin und Noradrenalin werden erneut in die Präsynapse aufgenommen und vesikulär gespeichert. Der Dopamintransporter DAT und der 56 SERT Na+ Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* Biochemischer Abbau. Catecholamine werden durch die im Cytosol vorkommende Catechol-O-Methyltransferase (COMT) und eine in Form von zwei Isoenzymen existierende Monoamin-Oxidase (MAO) der äuûeren Mitochondrienmembran enzymatisch abgebaut. Vesikulär gespeicherte Catecholamine sind vor dem Abbau geschützt. Beide Enzyme sind Flavoproteine, die in Neuronen und umgebenden Gliazellen, aber auch in den Verdauungsorganen vorkommen. Während das Isoenzym MAO-A neben Noradrenalin auch Serotonin umsetzt, greift MAO-B auch Dopamin und andere Catecholamine an. Die Expression von MAO-B und COMT in Darm und Leber schützt den Organismus vor den unerwünschten Wirkungen biogener Amine in der Nahrung. Unabhängig davon, ob zunächst MAO oder COMT angreift, führt der enzymatische Abbau von Noradrenalin schlieûlich zu dem im Urin ausgeschiedenen Metaboliten Vanillinmandelsäure (3-Methoxy-4-hydroxymandelsäure). Phäochromocytome sind endokrin aktive Tumoren, die überwiegend in der Nebenniere auftreten. Da diese Tumoren stoûweise Noradrenalin und Adrenalin freisetzen, kommt es zu krisenhaften Blutdruckanstiegen. Der Tumor lässt sich durch eine exzessive Ausscheidung von Vanillinmandelsäure im Urin nachweisen. l l l Es gibt fünf Rezeptoren für Dopamin. Dopaminerge Systeme sind bei Krankheiten wie Schizophrenie und Morbus Parkinson gestört Dopaminrezeptoren. Unter den sieben Transmembranregionen tragenden Rezeptoren bilden die verschiedenen Varianten des Dopaminrezeptors eine Familie mit zwei Untergruppen: D1-artige Dopaminrezeptoren (D1,5) stimulieren über ein G-Protein die Aktivität der Adenylatcyclase und erhöhen damit den cAMP-Spiegel der Zelle. Durch die D2-artigen Rezeptorvarianten (D2±4) wird Adenylatcyclase dagegen gehemmt, während die Leitfähigkeit von Kaliumkanälen gesteigert wird (Abb. 2-19, Tab. 2-3). Dem D2-Subtyp gehören auch die präsynaptischen Autorezeptoren der dopaminergen Synapse an, die die weitere Synthese und Freisetzung des Transmitters hemmen. Dopaminerge Systeme und Krankheiten des Nervensystems. Dopamin ist an der motorischen Regulation und der Beeinflussung der Stimmungslage beteiligt. Im ZNS existieren drei wichtige dopaminerge Systeme: Die nigrostriatalen Bahnen (Abschn. B-3.10, B-24.7) gehen von den melaninhaltigen, an ihrer dunklen Pigmentierung erkennbaren Neuronen der Substantia nigra aus und innervieren das Striatum. Als Teil der Basalganglien (früher als ¹extrapyramidal-motorisches Systemª bezeichnet) mindern sie den Tonus der Muskulatur und wirken an der Umsetzung von Bewegungsabläufen mit. Durch den Untergang von Neuronen der Substantia nigra kommt es beim Morbus Parkinson zum Verlust der dopaminergen Innervation des Striatums, die sich durch Tremor, Rigor und Akinesie äuûert (Basalganglien; Kap. B-3, B-24). Eine wirksame Therapie stellt die Gabe von L-DOPA dar, das im Gegensatz zu Dopamin von den Transportern der Blut-Hirn-Schranke aufgenommen wird. Das mesolimbische (mesokortikale) System, dessen Zellkörper im Tegmentum des Mittelhirns liegen, innerviert u. a. Kortex, Hippocampus und Amygdala (Abschn. B-3.10) und beeinflusst das psychische Befinden. Schizophrenien sind durch Denkstörungen charakterisierte seelische Erkrankungen, die schubweise verlaufen. Haloperidol und andere als Neuroleptika bezeichnete Antagonisten des D2-Rezeptors werden zur Therapie von Schizophrenien eingesetzt, um die psychotischen Schübe zu verkürzen und ihr erneutes Auftreten zu verhindern. Das tuberoinfundibuläre System hemmt die Freisetzung des Laktationshormons Prolactin aus der Hypophyse (Abschn. C-3.2). Durch den Verlust dieser Hemmung kann es bei einer antipsychotischen Neuroleptikatherapie mit D2Antagonisten sogar zu einem unerwünschten Milchfluss kommen. l l l Noradrenalin und Adrenalin wirken auf G-Protein-gekoppelte Rezeptoren Adrenerge Rezeptoren. Noradrenalin und Adrenalin wirken auf die verschiedene Varianten umfassende adrenerge Rezeptorfamilie, deren Mitglieder ausnahmslos zu den an heterotrimere G-Proteine gekoppelten Rezeptoren gehören und mit unterschiedlichen Effektorsystemen verbunden sind. Adrenerge Rezeptoren wirken vor allem an der kardiovaskulären, pulmonalen und metabolischen Regulation durch das vegetative Nervensystem mit (Kap. C-6, Abschn. C-7.10, C-8.7). Während a1-Rezeptoren die Aktivität der Phospholipase C stimulieren, interagieren a2-Rezeptoren mit der Adenylatcyclase; sie können je nach Subtyp den cAMP-Spiegel heben oder senken. Alle Unterformen der adrenergen b-Rezeptoren vermitteln ihre Wirkung durch Aktivierung der Adenylatcyclase. Während b1- und b2-Rezeptoren weit verbreitet sind, finden sich b3-Rezeptoren nur im braunen Fettgewebe, in dem sie zur Thermoregulation beitragen sollen (Kap. C-12.2). l l l Serotonin und Histamin dienen als Neurotransmitter und parakrine Mediatoren Vorkommen von Serotonin. Serotonin (5-Hydroxytryptamin, 5-HT) dient vor allem den RaphØ-Kernen des Hirnstamms (Abschn. B-3.6) als Neurotransmitter, die aufsteigende Projektionen in die frontale Groûhirnrinde, das Striatum und den Gyrus dentatus senden, und soll zur Regulation des Wachheitsgrads beitragen (Abschn. B-5.3). Serotonin ist nicht nur ein Neurotransmitter des ZNS, es kommt auch als parakriner Mediator vor. Bei der Blutgerinnung (Abschn. C1.7) wird Serotonin aus den Thrombocyten freigesetzt, wobei es zur Vasokonstriktion kommt. Im Darm reguliert Serotonin die Peristaltik (Kap. C-10). Von den daran beteiligten neuroendokrinen Zellen abgeleitete Darmtumoren (Carcinoide) bilden ebenfalls Serotonin und setzen den Transmitter schubartig frei. Durch Wirkung auf periphere Rezeptoren kommt es zu Bauchkrämpfen, Diarrhö und Flush (Hautrötung). Zur Diagnose wird 5-Hydroxyindolessigsäure (s. u.) im Urin bestimmt. Synthese. In serotonergen Neuronen beginnt die Synthese des Neurotransmitters mit der Hydroxylierung der Aminosäure Tryptophan, die mittels erleichterter Diffusion über die Blut-Hirn-Schranke aufgenommen wird (Abschn. B-1.2). Als Cosubstrate der Tryptophan-Hydroxylase, die den Enzymen Phenylalanin-Hydroxylase und Tyrosin-Hydroxylase strukturell homolog ist, dienen Tetrahydrobiopterin und molekularer Sauerstoff. Dabei entsteht 5-Hydroxytryptophan, das anschlieûend zu Serotonin decarboxyliert wird (Abb. 2-19). Dieser pyridoxalphosphatabhängige Schritt wird durch die 2.7 Monoamine in der synaptischen Signalübertragung y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice* 57 aromatische L-Aminosäure-Decarboxylase katalysiert, die auch an der Catecholaminsynthese beteiligt ist. Serotonin wird im Austausch gegen Protonen durch den Transporter VMAT2 vesikulär gespeichert und unter dem Einfluss von Calcium sezerniert. In den synaptischen Spalt freigesetztes Serotonin wird durch den membranständigen Transporter SERT (Serotonintransporter) wieder in die Präsynapse aufgenommen und inaktiviert (Abb. 2-19). Der enzymatische Abbau von Serotonin erfolgt durch Monoamin-Oxidase (MAO) und Aldehyd-Dehydrogenase zu 5-Hydroxyindolessigsäure (5-HIAA). Rezeptorwirkung von Serotonin. Metabotrope Serotoninrezeptoren (5-HT1±2 und 5-HT4±7) sind über stimulierende und hemmende G-Proteine mit Adenylatcyclase sowie aktivierend mit dem Phospholipase-Signalweg verbunden (Tab. 2-3, Abb. 2-19). Sie beeinflussen das circadiane Schlaf-WachVerhalten, insbesondere den REM-Schlaf, und das Essverhalten. Die Wirkung des Halluzinationen erzeugenden Rauschgifts LSD soll auf die Blockade von 5-HT2-Rezeptoren zurückzuführen sein. Das Migränemittel Sumatriptan ist ein Agonist am 5-HT1-Rezeptor. 5-HT3-Rezeptor. Neben G-Protein-gekoppelten Rezeptoren aktiviert Serotonin einen ligandengesteuerten Kationenkanal. Mit vier Transmembranregionen pro Untereinheit gehört der 5-HT3-Rezeptor zu der Superfamilie des nicotinischen Acetylcholinrezeptors (Tab. 2-3). In hoher Dichte finden sich diese Rezeptoren in der Chemorezeptoren tragenden Zone der Area postrema des Mittelhirns (Abschn. B-3.6), deren Stimulation Erbrechen auslösen kann. Antagonisten des 5-HT3- USB dA 58 LIC Rezeptors (z. B. Odansetron) wirken antiemetisch. In der Substantia gelatinosa des Rückenmarks (Abschn. B-3.3) modulieren 5-HT3-Rezeptoren die Nozizeption, indem sie die Freisetzung von Substanz P fördern (Abschn. B-11.3). Histamin ist nicht nur ein wichtiger Mediator von Mastzellen (Abschn. C-1.5) und neuroendokrinen Zellen der Magenschleimhaut (Abschn. C-10.7), sondern auch Transmitter von Neuronen der tuberomammillären Region des Hypothalamus (Abschn. B-3.9), von der Projektionen in die Groûhirnrinde, in den Thalamus und ins Kleinhirn ausgehen. Als Transmitter und Gewebshormon entsteht Histamin durch Decarboxylierung von Histidin durch die L-Histidin-Decarboxylase; es wird vesikulär gespeichert und freigesetzt. Histamin wird durch Histamin-N-Methyltransferase inaktiviert. Histamin wirkt auf metabotrope Rezeptoren, die mit Phospholipase C und A2 bzw. Adenylatcyclase gekoppelt sind (Tab. 2-3). é Die meisten Monoamine entstehen durch Hydroxylierung und Decarboxylierung von Aminosäuren. Sie tragen im zentralen und peripheren autonomen Nervensystem überwiegend zur Signaltransduktion durch metabotrope Rezeptoren an langsamen Synapsen bei. Monoaminerge Neurone gibt es vor allem im Hirnstamm. Neurone des peripheren sympathischen Nervensystems sind noradrenerg und setzen den Transmitter an axonalen Varikositäten frei. Bei psychischen Erkrankungen finden sich häufig Funktionsstörungen monoaminerger Synapsen. Kc Die zellulären Grundlagen synaptischer Übertragung werden zur Zeit intensiv untersucht. Durch die Anwendung leistungsfähiger molekularbiologischer Methoden sind entscheidende Fortschritte zu erwarten. Die weitere Analyse der Untereinheitenstruktur von Transmitterrezeptoren verbindet sich mit der Hoffnung auf spezifisch wirkende Medikamente, mit denen sich die Symptome neurologischer Krankheiten gezielt therapieren lassen. Zu klären bleibt u. a. die Funktion bestimmter Transmitterrezeptoren wie des nicotinischen Acetylcholinrezeptors und die Rolle von NO in der retrograden Signalübertragung im Gehirn. Schlieûlich ist ein entscheidender Erkenntnisgewinn auch durch die Aufklärung der Funktion und Rolle langsamer synaptischer Signale (metabotroper Antworten) zu erwarten. Viele zentrale Erkrankungen, insbesondere solche, denen eine Neurodegeneration zugrunde liegt wie Morbus Alzheimer, Morbus Parkinson oder Chorea Huntington, gehen mit Funktionsstörungen der synaptischen Übertragung einher. Die Aufklärung der molekularen Mechanismen der zellulären Kommunikation im Nervensystem weckt daher berechtigte Hoffnungen auf verbesserte Diagnose- und Therapiemöglichkeiten dieser schweren Krankheiten. Kapitel B-2 Die Synapse y:/ftb01/auftrag/proedit/l80168/umbruch/teil-b/kap02.3d***11.3.2003***11:31:15 Format: A3 842 x 1191 pts Original: 657.638 x 904.252 pts *setpagedevice*