Perioperative Schmerztherapie bei Kindern
Werbung

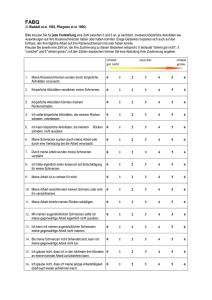
Perioperative Schmerztherapie bei Kindern C. Philippi-Höhne Einleitung Die perioperative Schmerztherapie bei Kindern hat sich in den vergangenen Jahrzehnten verbessert. Es herrscht jedoch trotz aller Fortschritte große Unsicherheit, die zu einem Vorenthalten oder zu einer unzureichenden Schmerztherapie führt. Schmerzen müssen unabhängig vom Alter der Patienten aus ethischen und medizinischen Gründen effektiv behandelt werden. Es ist bekannt, dass bereits Früh- und Neugeborene Schmerzen wahrnehmen können. Da die deszendierenden inhibitorischen Nervenfasern im Hinterhorn des Rückenmarks noch nicht ausgereift sind, kann die Schmerzwahrnehmung sogar intensiver als bei Erwachsenen sein. Starke Schmerzzustände können bei Kindern zu Stress und Verhaltensänderungen führen. Durch die weit verbreitete Verwendung der schnell an- und abflutenden volatilen bzw. kurzwirksamen intravenösen Anästhetika ist die Bedeutung der postoperativen Schmerztherapie noch weiter gestiegen: Aufgrund der kurzen Aufwachphase können Schmerzen viel früher wahrgenommen werden, deshalb ist eine effektive und präventive Schmerzdämpfung besonders wichtig. Die Schmerztherapie ist außerdem schwieriger, wenn Kinder bereits länger anhaltende starke Schmerzen hatten. Als Ursachen wird die Sensibilisierung des Rückenmarkes bei repetitiven starken Schmerzreizen angesehen, die die Schmerzschwelle herabsetzen. Schmerzmessung Die regelmäßige Erfassung und Dokumentation von Schmerzen im Aufwachraum oder auf den Kinderstationen ist eine wichtige Voraussetzung zur Verbesserung der Versorgung von Kindern mit akuten und chronischen Schmerzen. Bei Neugeborenen, Säuglingen und Kleinkindern bis zum 4. Lebensjahr können Fremdbeurteilungsskalen zur Schmerzmessung verwendet werden (z.B. KUSS, Tab. 1). Ab dem 4. Lebensjahr können Kinder häufig ihre Schmerzen schon selbst einschätzen, z.B. mit der bekannten Smiley- Skala (Abb. 1). Spätestens ab dem 8. Lebensjahr haben Kinder eine gute Vorstellung von Zahlen und Dimensionen, so dass auch numerische Skalen (NRS, 0 = keine Schmerzen, 10 = stärkste Schmerzen) oder visuelle Analogskalen verwendet werden können. Bei zu hohen Schmerz­werten (KUSS bzw. NRS > 4) sollten klare Algorithmen vorgehalten werden, wie die Schmerzbehandlung verbessert werden kann [u.a. 1]. 265 Weinen Gesichtsausdruck Rumpfhaltung Beinhaltung Motorische Unruhe Gar nicht 0 Stöhnen, Jammern, Wimmern 1 Schreien 2 Entspannt, lächelnd 0 Mund verzerrt 1 Grimassieren 2 Neutral 0 Unstet 1 Aufbäumen/Krümmen 2 Neutral 0 Strampelnd, tretend 1 An den Körper gezogen 2 Nicht vorhanden 0 Mäßig 1 Ruhelos 2 Gesamt 0-10* Tab. 1. Schmerzmessung bis zum 4. Lebensjahr: Kindliche Unbehagens- und Schmerzskala (KUSS, [2]) * Analgetischer Therapiebedarf beginnt mit vier Punkten Abb. 1: Smiley- Skala, anhand derer Kinder ab dem vierten Lebensjahr ihre Schmerzen selbst einschätzen können. Multimodale Therapieansätze Die für eine effektive und altersgerechte Schmerztherapie bei Kindern erforderlichen Wirkstoffe und Verfahren sind inzwischen in ausreichender Zahl bekannt und bewährt. Die wichtigsten Wirkstoffgruppen sind Nicht-Opioid-Analgetika, Opioide und Lokalanästhetika. Anhand des WHO-Stufenschemas (Tab. 2) sollten die Wirkstoffgruppen eingesetzt werden. WHO Stufe 1 WHO Stufe 2 WHO Stufe 3 WHO Stufe 4 Nicht-Opioide Nicht-Opioide + Nicht-Opioide + Weiterführende Behandlung Schwache Opioide Starke Opioide u.a. Lokalanästhetika NSAID Tramadol Piritramid Bupivacain Metamizol Nalbuphin Morphin Ropivacain Paracetamol Ketamin Tabelle 2. Wirkstoffgruppen / Wirkstoffe und derer Einsatz anhand des WHO-Stufenschemas Nicht-Opioid-Analgetika, z.B. Paracetamol, sind als Monotherapie bei stärkeren Schmerzen nicht ausreichend wirksam, so dass sehr häufig zusätzlich Opioide eingesetzt werden müssen. Opioide werden auch bei Kindern am besten bedarfsadaptiert pfleger- oder patientenkontrolliert verabreicht. 266 Die Bedeutung der lokal- und regionalanästhesiologischen Verfahren hat in den vergangenen Jahren stark zugenommen. Anders als bei Erwachsenen werden sie bei Kindern meistens in einer Allgemeinanästhesie angelegt. Dadurch sinkt bereits intraoperativ der Bedarf an systemischen Analgetika und nach der Operation können die Kinder mit ge­ringen oder ohne Schmerzen aufwachen. Durch eine Kombination von Wirkstoffen mit verschiedenen Wirkmechanismen werden die analgetischen Wirkungen optimiert und die unerwünschten Wirkungen minimiert (multimodale Schmerzbehandlung). In vielen Fällen ist es deshalb günstig, bei einem Patienten mehrere Verfahren gleichzeitig anzuwenden, z.B. zunächst ein Nicht-Opioid-Analgetikum, intraoperativ ein lokales oder regionales Verfahren und postoperativ bei Bedarf zusätzlich Opioide. Aus Gründen der besseren Übersichtlichkeit und Sicherheit ist es hilfreich, wenn man sich auf wenige Präparate aus jeder Wirkstoffgruppe beschränkt [3]. Kinder haben große Angst vor punktionsbedingten Schmerzen, deshalb sollen Analgetika bei Kindern immer schmerzfrei, also bei liegendem Zugang intravenös, oder oral bzw. rektal, keinesfalls aber subkutan oder gar intramuskulär appliziert werden. Nicht-Opioid- Analgetika Paracetamol ist trotz intensiver Diskussion das am weitesten verbreitete Analgetikum in dieser Gruppe [u.a. 4]. Nach rektaler Applikation ist die Resorption verzögert (Stunden) und sehr variabel. Deshalb hat es sich bewährt, beim perioperativen Einsatz von Paracetamol dieses bereits präoperativ oral oder rektal zu verabreichen. Mit einer aus­ reichenden Initialdosis (z.B. 40 mg/kg KG) rektal kann Paracetamol als Basisanalgetikum eingesetzt werden. Paracetamol hat folgende Nachteile: -geringe Effektivität -Lebertoxizität trotz propagierter Tagesmaximaldosen (100 mg/kg KG bei rektaler Applikation > 3. Lebensmonat) ist Paracetamol die häufigste Ursache von medikamenten-induzierter Leberinsuffizienz im Kindesalter. -Einnahme im ersten Lebensjahr führt möglicherweise zur erhöhten Häufigkeit von Asthma bronchiale, Rhinokonjunktivitis oder Ekzemen [5]. -Die antiemetische Therapie mit 5-HT3-Antagonisten hemmt die Wirkung von Paracetamol [6]. Dosisempfehlung Paracetamol intravenös (Perfalgan® ) Kinder > 10 kg: 15 mg/kg KG alle 4 -6 h, Tagesmaximaldosis 60 mg/kg KG Kinder < 10 kg: 7,5 mg/kg KG alle 6 h, Tagesmaximaldosis 30 mg/kg KG Dosisempfehlung Paracetamol rektal Säugling < 3 Monate: 20 mg/kg KG (loading dose), 15-20 mg/kg (Repetitionsdosis), Tagesmaximaldosis 60 mg/kg Säugling > 3 Monaten: 35-40 mg/kg KG (loading dose), 15-20 mg/kg (Repetitionsdosis), Tagesmaximaldosis 100 mg/kg Nichtsteroidale Antiphlogistika (NSAR, z.B. Diclofenac oder Ibuprofen) hemmen Cyclooxygenasen unspezifisch und sind deshalb analgetisch, antientzündlich und antipyre267 tisch wirksam. Die schmerzdämpfende Wirkung ist besser als beim Paracetamol. Aus diesem Grund werden nichtsteroidale Antiphlogistika bei Kindern ab einem Jahr zunehmend eingesetzt. NSAR sind besonders gut bei Knochen- und Weichteilschmerz wirksam. Bewährt hat sich die rektale und orale Applikation. Bei kurzzeitiger Anwendung und Beachtung der Kontraindikationen (hämorrhagische Diathesen, vorbestehende Nierenerkrankung) treten kaum Nebenwirkungen auf. Bei Säuglingen werden nichtsteroidale Antiphlogistika zur Zeit eher zurückhaltend und bei Neugeborenen wegen der noch unreifen Nierenfunktion nur in begründeten Ausnahmefällen eingesetzt. Vorsicht ist bei großen Wundflächen und Situationen mit verminderter renaler Perfusion geboten. Dosis Ibuprofen: 10 mg/ kg KG alle 8 h, Tagesmaximaldosis 40 mg/ kg KG Dosis Diclofenac: 1 mg/ kg KG alle 8 h, Tagesmaximaldosis 3 mg/ kg KG Diskussionspunkt: NSAR nach Tonsillektomie Die postoperativen Schmerzen nach einer Tonsillektomie sind stark und bedürfen einer adäquaten Schmerztherapie. Eine gute postoperative Analgesiequalität ist z.B. mit Ibupro­ fen oder Diclofenac zu erreichen. Dabei findet sich in verschiedenen Metaanalysen jedoch eine größere Häufigkeit von Re-Operationen aufgrund von Nachblutungen, die unter anderem auch vom operativen Verfahren abhängig ist [u. a. 7]. Hier ist das Vorgehen gemeinsam mit den HNO-Kollegen abzusprechen. Eine Alternative bietet hier das Metamizol. Metamizol (z.B. 10-20 mg/kg KG als Kurzinfusion, Tagesmaximaldosis 80 mg/kg KG) wirkt besonders gut bei kolikartigen Schmerzen im Gastrointestinal- und Urogenitaltrakt. Es wird derzeit in bis zu 70% aller deutschen Kliniken eingesetzt. Bei zu schneller intravenöser Applikation können Blutdruckabfälle auftreten, deshalb sollte Metamizol als Kurzinfusion über 15 min oder mit einer Perfusorspritzenpumpe verabreicht werden. Es sind Allergien bekannt. In sehr seltenen Fällen kann eine Agranulozytose auftreten. Deshalb ist bei längerer Anwendung eine Blutbildkontrolle empfehlenswert. Clonidin ist ein α2-Adrenozeptor-Agonist, der die Freisetzung von Noradrenalin aus den Nervenendigungen des Hinterhorns des Rückenmarks hemmt. Es hat analgetische, blutdrucksenkende, sedierende, und antiemetische Wirkungen und kann somit als Adjuvans eingesetzt werden. Nach einer systemischen Gabe von 1-2 µg/kg KG Cloni­din sind die Kinder postoperativ häufig leicht sediert und verbrauchen weniger Analgetika, benötigen aber eine Überwachung. Behandlungsbedürftige Blutdruckabfälle oder Brady­kar­dien sind in diesem Dosierungsbereich nicht zu erwarten. Die atemdepressiven Wirkungen des Clonidins sind im Vergleich zu den Opioiden sehr gering. Bei Erwachsenen konnte aber ein vermindertes Ansprechen des Atemzentrums auf CO2 nach Clonidin­applikation nachgewiesen werden. Es ist deshalb empfehlenswert, Clonidin bei Säuglingen und besonders bei ehemaligen Frühgeborenen nur mit besonderer Vorsicht zu verwenden. Ketamin hat als N-methyl-D-Aspartat (NMDA)-Rezeptor-Antagonist und möglicherweise auch als µ-Agonist potente analgetische Wirkungen. Nach der intravenösen Gabe von 0,25-0,5 mg/kg KG (S)-Ketamin oder 0,5-1 mg/kg KG Ketamin entsteht eine effektive Analgesie, die bei Kindern 10-15 min anhält. (S)-Ketamin eignet sich deshalb besonders als Analgetikum in Notfällen und zur Erstversorgung von sehr unruhigen Kindern mit starken akuten Schmerzen vor Beginn einer multimodalen Schmerztherapie. Unangenehme Träume sollen bei Kindern in Zusammenhang mit Ketamin seltener auftreten, dies kann aber auch mit den noch eingeschränkten Mitteilungsmöglichkeiten zusammenhängen. 268 (S)-Ketamin kann auch auf der Intensivstation kontinuierlich in folgender Dosierung eingesetzt werden: 25-100-(200) μg/ kg KG/ h, titriert nach Wirkung. Höhere Dosierungen ziehen stärkere psychomimetische Nebenwirkungen nach sich [8]. Opioide Opioide können bei Kindern mit starken Schmerzen in allen Altersgruppen eingesetzt werden. Perioperativ werden auch bei Kindern meistens reine µ-Agonisten (z.B. Morphin oder Piritramid) verwendet, denn die analgetischen Wirkungen von Partialagonisten und gemischten Agonisten/Antagonisten sind bei starken Schmerzzuständen begrenzt („ceiling effect“). Aufgrund der atemdepressiven Nebenwirkung wurden Opioide in der Vergangenheit bei Kindern selten eingesetzt, jedoch ist eine effektive Therapie von starken Schmerzen ohne Opioide kaum möglich. Wenn Opioide bedarfsadaptiert in kleinen Dosen gegen den Schmerz titriert werden, tritt eine Atemdepression auch bei kleinen Kindern selten auf. Tramadol ist ein schwaches Opioid (1/10 Wirkung im Vergleich zu Morphin), welches mit einer intravenösen Dosis 1-2 mg/kg KG als Kurzinfusion verabreicht werden kann. Von Nachteil sind Übelkeit oder Erbrechen vor allem bei rascher Bolusgabe. Kontraindikationen sind Kinder im Alter <1 Jahr, Epilepsie und erhöhter Hirndruck. Auf der Suche nach geeigneten Alternativen, z.B. zur Schmerztherapie nach Tonsillektomie, ist Tramadol mehrfach untersucht worden. Es ist effektiv, geht aber mit einer erhöhten Rate von Übelkeit und Erbrechen einher. Zudem scheint der Effekt variabel, da genetische Polymorphismen bei der Metabolisierung des Medikamentes vorliegen [9]. Nalbuphin ist ein κ-Agonist und µ-Antagonist. Die analgetische Potenz ist mit der von Morphin vergleichbar, oberhalb einer Dosierung von 200 µg/kg KG kann es jedoch zu einem „ceiling effect“ kommen. In der frühen postoperativen Phase kann speziell für Kinder die über κ-Rezeptoren vermittelte sedierende Nebenwirkung vorteilhaft sein. Nalbuphin kann sowohl zur Schmerzbehandlung als auch zur Behandlung von µ-Rezeptor vermittelten Nebenwirkungen anderer Opioide, z.B. Atemdepression und Juckreiz, verwendet werden. Morphin ist das Opioid, welches bei Kindern am besten untersucht und weltweit am häufigsten eingesetzt wird. Bei Früh- und Neugeborenen ist die Eliminationshalbwertszeit von Morphin verlängert und die Clearance vermindert. Nach dem zweiten Lebensmonat unterscheiden sich die pharmakokinetischen Parameter von Kindern und Erwachsenen aber nicht mehr wesentlich. Pharmakodynamische Untersuchungen liegen für Früh- und Neugeborene nur sehr vereinzelt vor. Es ist aber möglich, dass Morphin bei Früh- und Neugeborenen mit einer unreifen Blut- Hirn- Schranke, einem unreifen Zytochrom-P450-Enzymsystem und verminderten Plasma-Protein-Konzentrationen (freier Wirkstoffanteil erhöht) stärker atemdepressiv wirkt [10]. Dosisempfehlung: Bolus bei Säuglingen 30 µg/kg KG, bei Kleinkindern 80 µg/kg KG Piritramid ist lipophiler als Morphin, deshalb tritt die Wirkung nach intravenöser Gabe auch schneller ein. Die analgetische Potenz ist geringfügig niedriger und die Wirkdauer etwas länger. Die Eliminationshalbwertszeit von Piritramid ist bei Neugeborenen verlängert und bei Säuglingen und Kleinkindern kürzer als bei Erwachsenen. Im Vergleich zu Morphin treten Nebenwirkungen, insbesondere Atemdepression und Juckreiz, möglicherweise seltener auf. Piritramid wird in Deutschland sehr häufig bei Kindern aller Altersklassen eingesetzt, während es in vielen anderen Ländern fast unbekannt ist [11]. 269 Dosisempfehlung: 0,05 - 0,1 mg/kg KG titrierend intravenös, Repetition frühestens nach 5 min, eine Tagesmaximaldosis gibt es nicht, da bis zur Schmerzfreiheit titriert wird. Naloxon wirkt an allen Opioidrezeptoren antagonistisch. Es sollte für den seltenen Fall einer schweren opioidbedingten Atemdepression (Dosierung z.B. 10 µg/kg KG) bereitgehalten werden. Mit niedrigeren Dosierungen (z.B. 1-2 µg/kg KG) können auch andere opioidbedingte Nebenwirkungen, z.B. Pruritus, behandelt werden. Naloxon wird in der Leber metabolisiert und hat eine kürzere Eliminationshalbwertszeit (60 min) als die meisten µ-Agonisten. Bei Kindern mit starken Schmerzen und prolongierter Opioidtherapie können nach der Gabe von Naloxon Entzugssymptome auftreten. Opioidtitration im Aufwachraum: Der postoperative Opioidbedarf ist auch bei Kindern interindividuell sehr variabel. Mit einer bedarfsadaptierten Titration von kleinen Einzeldosen werden diese Unterschiede besser berücksichtigt, als mit einer intermittierenden Applikation nach einem starren Schema. Die Opioidtitration kann bei postoperativen Schmerzen im Aufwachraum mit Piritramid (Bolus 50 µg/kg KG) oder Morphin (Bolus 30 µg/kg KG) begonnen werden. Nach drei bis sechs Einzeldosen entsteht fast immer eine ausreichende Analgesie. Nach der letzten Opioidgabe werden die Kinder noch 30 min im Aufwachraum überwacht und können dann auf die Normalstation verlegt werden, wenn die Sauerstoffsättigung mit Raumluft mehr als 92% beträgt. Patientenkontrollierte Analgesie (PCA). Wenn absehbar ist, dass weitere Opioidgaben erforderlich sind, wird die Schmerzbehandlung nach Verlegung auf eine Normalstation mit einer PCA-Pumpe fortgesetzt (Standardeinstellungen siehe Tab. 3). Die Opioidapplikation über eine PCA-Pumpe ist besonders sicher, wenn die Pumpe von den Kindern selbst bedient wird. Dies ist in Abhängigkeit von der Kooperationsfähigkeit ab einem Lebensalter von fünf Jahren möglich. Bei sehr häufigen Bolusanforderungen tritt neben dem analgetischen Effekt auch eine sedierende Wirkung auf, so dass die Kinder müde werden und die Pumpe nicht mehr so oft auslösen. Die Plasmakonzentrationen fallen dann wieder ab und eine Überdosierung wird ziemlich sicher vermieden. Wenn eine PCA mit einer kontinuierlichen Infusion (z.B. Morphin 10-20 µg/kg KG/h) unterlegt wird, verbessert sich der Nachtschlaf der Kinder, andererseits können aber unerwünschte Wirkungen, z.B. Übelkeit, Erbrechen oder Abfälle der Sauerstoffsättigung, häufiger auftreten. Bei niedrigdosierter Morphininfusion (z.B. 4 µg/kg KG/h) treten diese Nebenwirkungen seltener auf [10]. In den meisten Kinderkliniken wird PCA mit kontinuierlicher Infusion auf Normalstationen aber nur in Ausnahmefällen bei Kindern mit sehr hohem Opioidverbrauch verwendet. Bei Säuglingen und jüngeren Vorschulkindern können die PCA-Pumpen von sorgfältig eingewiesenem Pflegepersonal oder in Ausnahmefällen auch von den Eltern bedient werden. In einzelnen Fällen kann es allerdings schwierig sein, zwischen Schmerzen und Unruhezuständen zu unterscheiden. Kinder mit einer PCA-Pumpe oder einer Opioidinfusion sollen einem standardisierten Überwachungsprotokoll unterliegen. Zur respiratorischen Überwachung werden sie an ein Pulsoxymeter angeschlossen. Bei den neueren Geräten können die Alarme mit der Schwesternrufanlage gekoppelt und deshalb schneller registriert werden. Mindestens einmal täglich wird eine Schmerzvisite von einem Anästhesisten durchgeführt [12]. Wirkstoff Bolus [µg/kg KG] Sperrzeit [min] 4h-Max.Dosis [µg/kg KG/4h] Infusion [µg/kg KG/h] Morphin 20 10 350 keine oder 4-20 Piritramid 30 10 500 keine oder 6-30 Tab. 3. Patientenkontrollierte Analgesie bei Kindern: Mögliche Einstellungen für die Gabe von Morphin und Piritramid [u.a. 10,12] 270 Lokal- und Regionalanästhesie Die lokalen und regionalen Blockaden werden vorzugsweise in Allgemeinanästhesie zu Beginn der Operation oder an deren Ende angelegt. Das Regionalanästhesieverfahren muss in einem guten Nutzen-Risiko-Verhältnis stehen. So sollten zum Beispiel die Risiken eines epiduralen Katheterverfahrens nicht bei kleinen chirurgischen Eingriffen eingegangen werden. In der Kinderanästhesie kommen folgenden Verfahren zum Einsatz: • Kaudalanästhesie (häufig) • Periphere Blockaden, unter anderem Peniswurzelblock (PWB), Ilioinguinalis- Iliohypogastricus- Block, Oberstscher Block (häufig) • Wundinfiltration (häufig) • Spinal- und Epiduralanästhesie (selten). Bei kleinen Kindern mit dünnen, noch unvollständig myelinisierten Nervenfasern sind niedrigere Konzentrationen von Lokalanästhetika ausreichend analgetisch wirksam. Die Wirkdauer ist dagegen kürzer als bei Erwachsenen, weil die Lokalanästhetika durch die höhere Gewebeperfusion schneller resorbiert werden. Wenn immer möglich, werden deshalb lang wirksame Lokalanästhetika, z.B. Bupivacain oder Ropivacain eingesetzt, häufig in Kombination mit Adjuvanzien. Für viele kleine und mittlere Eingriffe reicht die analgetische Wirkung dieser Verfahren intraoperativ und in den ersten postoperativen Stunden völlig aus. Bei abklingender Wirkung kann die Schmerztherapie bei Bedarf mit NichtOpioid-Analgetika oder Opioiden fortgesetzt werden. Für eine längerdauernde Schmerztherapie kann ein Katheter von kaudal, lumbal oder thorakal in den Epiduralraum gelegt werden, über den in der postoperativen Phase kontinuierlich oder intermittierend Lokalanästhetika, Opioide und andere analgetisch wirksame Substanzen appliziert werden können. Bei älteren Kindern kann dies auch als patientenkontrollierte epidurale Analgesie (PCEA) durchgeführt werden. Lokalanästhetika Bei der Auswahl des Lokalanästhetikums müssen Vor- und Nachteile abgewogen werden. Zu einigen Verfahren, z.B. single-shot Kaudalanästhesie, gibt es eine sehr große Anzahl an Studien, deren Ergebnisse jedoch die Auswahl nicht vereinfachen. Kriterien zum Einsatz des Lokalanästhetikums sind: • Wirkdauer • systemische Resorption • kardiale und zentralnervöse Toxizität • motorische Blockade (erwünscht oder unerwünscht) • Kosten. Die Resorption des Lokalanästhetikums ist abhängig von der Konzentration, vom Volumen und vom Injektionsort. Zur Vermeidung von Überdosierungen und toxischen Plasmakonzentrationen von Lokalanästhetika müssen die Höchstdosen (Tab. 4) unbedingt eingehalten werden. Die größte Gefahr entsteht jedoch durch eine versehentliche intravasale Injektion, der durch sorgfältige Aspirationsversuche vorgebeugt werden kann. Bei Neugeborenen und Säuglingen sollte aufgrund der verminderten Proteinbindung und des geringeren Anteils an sauerem α1-Glycoprotein mit erhöhten Plasmaspiegeln des Lokalanästhetikums gerechnet werden, was vor allem bei repetitiver oder kontinuierlicher Gabe bedacht werden muss. 271 Lokalanästhetikum Empfohlene Höchstdosis Einzelgabe [mg/kg KG] Empfohlene Höchstdosis Kontinuierliche Gabe [mg/kg KG/h] Bupivacain 2,5 0,25 Ropivacain 3-4 0,4 (Levobupivacain) 2,5 0,25 Lidocain 7 2 Prilocain 5-7 Cave Methämoglobinämie Nicht empfohlen. Tab. 4: Höchstdosen von Lokalanästhetika [13] Bupivacain ist das Lokalanästhetikum, welches bisher am häufigsten bei Kindern zur Regionalanästhesie eingesetzt wurde. Wenn die Maximaldosierungen eingehalten werden, treten toxische Reaktionen extrem selten auf. Schwere Komplikationen (Krampfanfall, Herzrhythmusstörungen, Herzkreislaufstillstand) sind eher Folge einer unbeabsichtigten systemischen intravenösen oder intraossären Injektion. Ropivacain hat im Vergleich zum Bupivacain den Vorteil einer geringeren Kardiotoxizität. In mehreren Fallberichten wurde über eine versehentliche intravenöse Injektion von Ropivacain berichtet, die keine nachteiligen Auswirkungen für die betroffenen Kinder hatte. Ropivacain erscheint besonders für Kinder mit langandauernden Lokalanästhetikainfusionen, bei eingeschränkter Leberfunktion, bei Früh- und Neugeborenen und für Blockadetechniken, die eine hohe Lokalanästhetikadosis erfordern, vorteilhaft zu sein. Nach epiduraler Applikation wird Ropivacain langsamer resorbiert als Bupivacain. Kaudalanästhesie Die Kaudalanästhesie kann bei allen abdominalen und urogenitalen Eingriffe unterhalb des Rippenbogens (Th7), Leisteneingriffen und Operationen der unteren Extremitäten bei Kindern < 25 kg KG und < 6. Lebensjahr angewendet werden. In höherem Lebensalter ist das Ligament, welches punktiert wird, häufig verkalkt. Das Verfahren ist technisch einfach und sehr sicher, weil die Punktion in großem Abstand von vulnerablen Nervenstrukturen durchgeführt wird. Die Punktion erfolgt z.B. mit einer SPROTTE®- Nadel (22-23 G) mit Mandrin, damit keine Hautzylinder nach epidural verschleppt werden. Das Kind befindet sich in Seitenlage und die Hüfte ist gebeugt. Nach Aufsuchen des Hiatus sacralis zwischen den Cornua sacralia wird das Ligamentum sacrococcygeum im Winkel von 45-60 ° punktiert [u.a. 14]. Nach einem Widerstandsverlust wird die Nadel abgesenkt und 3-5 mm vorgeschoben und dort belassen. Somit ist eine Punktion des Durasacks nahezu ausgeschlossen. Das Risiko einer Durapunktion ist bei kleinen Säuglingen erhöht, weil der Abstand zwischen Hiatus sacralis und dem Durasack nur 1-2 cm beträgt. Nach negativer Aspiration sollte eine adrenalinhaltige Testdosis appliziert werden. Treten innerhalb von 60 s kein Herzfrequenz- oder T-Wellenanstieg auf, kann langsam die Wirkdosis injiziert werden. Die Wirkdauer der Kaudalanästhesie beträgt 4-8 h [u.a. 15]. Komplikationen und Nebenwirkungen: • Fehlinjektion ins subkutane Gewebe • Spinalanästhesie nach Duraperforation • Gefäßpunktion => Hämatom • akzidentelle intravasale Injektion => Herzrhythmusstörungen, Krampfanfälle • motorische Blockade der unteren Extremitäten bei höherer Lokalanästhetika­ konzentration • Infektion => bisher ein Fallbericht nach single-shot Injektion 272 Als langwirksame Lokalanästhetika stehen in Deutschland Bupivacain und Ropivacain für die Kaudalanästhesie zur Verfügung. Es existiert eine große Anzahl von Studien mit der Fragestellung, welches dieser Medikamente von Vorteil ist. Zusammenfassend kann gesagt werden, dass 0,2% Ropivacain bei single-shot zur Kaudalanästhesie Anwendung analgetisch äquipotent zu 0,25% Bupivacain ist. Tendenziell gibt es nach Bupivacain häufiger motorische Blockaden, die jedoch stark konzentrationsabhängig sind (unterschiedliches Studiendesign). Bei Gabe von 0,125% Bupivacain treten motorische Blockaden bei gleicher Analgesiedauer äußerst selten auf. In einigen klinischen Untersuchungen wurden Ropivacain und Bupivacain mit Levobupivacain verglichen, wobei mit allen drei Lokalanästhetika eine suffiziente Analgesie erzielt wurde [16]. Das S-Enanatiomer Levobupivacain scheint in Tiermodellen und bei gesunden Erwachsenen eine geringere kardiale und ZNS Toxizität aufzuweisen, die Erfahrungen in der Kinderanästhesie sind gering. Es ist in Deutschland aktuell nicht mehr im Handel. Mit welcher Menge an Lokalanästhetikum welche Blockhöhe erreicht wird, ist in Tab. 5 dargestellt. Höhe des sensiblen Blocks Menge [ml/kg KG] sakral 0,5-0,7 lumbal und sakral 1-1,2 tief thorakal, lumbal und sakral bis 1,5 Tab. 5: Menge (ml/kg KG) des Lokalanästhetikums (0,2% Ropivacain oder 0,125% Bupivacain) zur Kaudalanästhesie für die entsprechende Höhe des sensiblen Blocks/ Operationsgebietes Adjuvanzien zur Kaudalanästhesie Der Einsatz von Adjuvanzien soll die Wirkdauer der Regionalanästhesie verlängern. Dafür stehen zur Kaudalanästhesie verschiedene Medikamente zur Verfügung (Tab. 6), auf deren Vor- und Nachteile im Folgenden eingegangen wird. Adrenalin kann durch Vasokonstriktion potentiell die Resorption des Lokalanästhetikums verzögern, was jedoch bei der Kaudalanästhesie kaum nachweisbar ist. Zudem treten möglicherweise Symptome des A. spinalis anterior Syndroms bei höherer Dosierung auf. Bei epiduraler Regionalanästhesie sollte jedoch Adrenalin als Testdosis verwendet werden, um eine versehentliche intravasale oder intraossäre Injektion frühzeitig zu erkennen. Diese würde sich in einem raschen Anstieg der Herzfrequenz und der T-Welle im EKG bemerkbar machen. Clonidin als Zusatz führt bei der Kaudalanästhesie zu einer Verlängerung der Analgesiedauer um 3-6 h und wird aufgrund seiner geringen Nebenwirkungen häufig verwendet [17]. Der Wirkmechanismus ist weiterhin nicht vollständig geklärt. Clonidin interagiert mit spinalen und supraspinalen α2- Rezeptoren, supprimiert die Freisetzung der Substanz P aus den spinalen nozizeptiven Neuronen und vermindert die Reizweiterleitung in peripheren Aδ- und C-Nervenfasern. Eine potentielle, dosisabhängige Sedierung tritt postoperativ auch bei niedriger Dosierung auf und wird von den Eltern und Kindern als angenehm empfunden. Die Dosisempfehlung sollte jedoch nicht überschritten werden, da es sonst zur Bradykardie kommen kann. Bei Früh- und Neugeborenen und auch Säuglingen erhöht Clonidin epidural außerdem die 273 Apnoegefahr und sollte deshalb erst ab dem 8-12 Lebensmonat eingesetzt werden. Die Grenze in der eigenen Klinik liegt bei 10 kg KG, anhand der Literatur ist derzeit keine Evidenz möglich. Neurotoxische Nebenwirkungen sind nach Anwendung von Clonidin nicht beschrieben. (S)-Ketamin hat analgetische Effekte (NMDA-Rezeptor-Antagonist, µ-Rezeptor- Agonist und Natriumkanalinteraktion) und kann, mehr als Clonidin, die Wirkdauer der Kaudalanästhesie deutlich verlängern [17]. Bekannt sind psychomimetische Nebenwirkungen bei hoher Dosierung und das Auftreten eines Nystagmus. Die Frage der Neurotoxizität von (S)-Ketamin ist in vielen Modellen untersucht worden und konnte bisher nicht abschließend geklärt werden. In einer aktuellen Untersuchung an einem Tiermodell konnten nach repetitiver intrathekaler Gabe von konservierungsmittelfreiem (S)-Ketamin histologisch Zeichen der Neurotoxizität nachgewiesen werden [18]. So kann derzeit für (S)-Ketamin keine Empfehlung gegeben werden [19]. Morphin hat den Vorteil der langen Analgesiedauer bis zu 24 h nach Einzelgabe epidural/ kaudal mit einer Ausbreitung bis in thorakale Segmente. Demgegenüber stehen jedoch einige Nebenwirkungen: Übelkeit, Erbrechen, Harnretention, Pruritus, Atemdepression v.a. bei Früh-, Neugeborenen und Säuglingen. Deshalb sollte sich der Einsatz auf größere chirurgische Eingriffe beschränken, die obligatorisch eine postoperative Überwachung nach sich ziehen. Ein epidurales Katheterverfahren steht als Alternative bei entsprechenden Voraussetzungen zur Verfügung (s.u.). Weitere Adjuvanzien, wie Neostigmin, Midazolam oder Tramadol, haben aufgrund der geringen Wirkungsverlängerung bzw. des Nebenwirkungsprofils bisher keinen Einzug in den klinischen Alltag gefunden. Wirkstoff Dosierung Adrenalin (als Testdosis) 1:200 000 Clonidin 2-3 µg/kg KG (S)-Ketamin 0,25-0,5 mg/kg KG Morphin 50 µg/kg Tab. 6: Adjuvanzien zur Kaudalanästhesie und Dosierungen [u.a. 17] Epiduralkatheter Epidurale Katheterverfahren können bei Kindern bis zum 6. Lebensjahr von kaudal, in jedem Alter aber auch lumbal eingesetzt werden. Zur korrekten Positionierung kann die sonographische Lagekontrolle hilfreich sein [20]. Das gilt erst recht, wenn der Katheter thorakal platziert werden soll. Kaudale Epiduralkatheter können bei Früh-, Neugeborenen und Säuglingen angewendet werden, sollten jedoch Spezialisten in Kliniken mit kinderanästhesiologischem Schwerpunkt vorbehalten sein. Wegen der anatomischen Nähe zu Anus und Windelbereich ist das Infektionsrisiko bei Kaudalkathetern erhöht. Deshalb sollte der Katheter nach Anlage getunnelt und die Liegedauer soweit als möglich begrenzt werden [21]. Für Säuglinge und Kinder sind Kaudalkathetersets verfügbar. Zur kontinuierlichen Infusion können bei Säuglingen 0,2 mg/kg KG/h Ropivacain 0,1% und bei älteren Kindern 0,4 mg/kg KG/h Ropivacain 0,1% verabreicht werden. Die epidurale Applikation des hydrophilen Morphin (Dosis 50 µg/kg KG in 2-5 ml NaCl) über einen kaudalen oder lumbalen Zugang führt zu einer langanhaltenden Analgesieaus274 breitung bis in thorakale Segmente. Die lipophilen Opioide Fentanyl und Sufentanil sind im Vergleich deutlich kürzer wirksam als Morphin und verteilen sich nach epiduraler Applikation nicht so weit nach rostral wie Morphin. Die Wahrscheinlichkeit einer postoperativen Atemdepression ist aus diesem Grund niedriger und der analgetische Effekt stärker segmental begrenzt. Die lipophilen Opioide können die Analgesiequalität einer epiduralen Lokalanästhetikaapplikation verbessern. Übelkeit, Erbrechen, Harnverhalt, Juckreiz und Atemdepression treten nach epiduraler Opioidapplikation häufiger auf. Peniswurzelblock und Wundinfiltration Der gezielte Einsatz peripherer Nervenblockaden kann eine gute postoperative Analgesie bei gleichzeitig geringer Komplikationsrate gewährleisten und zur Zufriedenheit der Kinder und Eltern beitragen. Ausführlich beschreibt Jöhr in seinem Beitrag [22] die verschiedenen Techniken, so dass hier nur auf den häufig eingesetzten Peniswurzelblock und die Wundinfiltration eingegangen wird, da diese beiden Verfahren in jeder Klinik eingesetzt werden können und keiner besonderen Ausstattung bedürfen. Peniswurzelblock Der Peniswurzelblock (PWB) ermöglicht eine optimale Analgesie nach Zirkumzision oder nach Hypospadiekorrektur (bis zu 24h). Die beiden Penisnerven liegen etwa bei 2 und 10 Uhr auf beiden Seiten der dorsalen Mittellinie. Sie werden an der Basis des Penisschafts im subpubischen Raum blockiert. Die Einstichstellen der Nadel befinden sich knapp unterhalb der Symphyse ungefähr 0,5-1 cm seitlich der Mittellinie (je nach Größe des Patienten). Eine dünne Nadel (25 G oder 27 G) wird in leicht kaudaler und medialer Richtung vorgeschoben. Nach Durchstechen der Haut können mehrere leichte Widerstände überwunden werden (oberflächliche und tiefe Schicht der Abdominalfaszie), bis sich die Nadelspitze im subpubischen Raum befindet. Dabei kommt es sehr selten zur Punktion der A. dorsalis penis, die häufiger nach medianer Einmalpunktion auftritt. Die subpubische Injektion mittels zweier paramedianer Punktionen ist eine einfach zu erlernende und sichere Methode [u.a. 14]. Für den PWB werden 0,2 ml/kg KG eines langwirksamen Lokalanästhetikums injiziert, wobei 0,5% oder 0,75% Bupivacain und 1% Ropivacain ähnlich gut geeignet sind. Beim PWB darf Adrenalin nicht als Zusatz verwendet werden, da Ischämiegefahr im Endstromgebiet besteht. Wundinfiltration An eine Wundinfiltration mit einem langwirksamen Lokalanästhetikum sollte zur postoperativen Analgesie immer gedacht werden. Es ist ein sicheres Verfahren bei allen oberflächlichen, peripheren Eingriffen. Es sollten 0,5 ml/kg KG Ropivacain 0,2% oder 0,2 ml/ kg KG Bupivacain 0,5% zum Einsatz kommen. 275 Literatur 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. 22. 276 Berde CB, Sethna NF. Analgesics for the treatment of pain in children. N Engl J Med 2002; 347:1094103. Büttner W et al. Development of an observational scale for assessment of postoperative pain in infants. Anästhesiol Intensivmed Notfallmed Schmerzther 1998; 33: 353-61. Sümpelmann R, Münte S. Postoperative analgesia in infants and children. Curr Opin Anaesthesiol 2003;16: 309-13 Giest J et al. Paracetamol für die Schmerztherapie im Kindesalter – Ende einer Ära? Anästh Intensivmed 2009; 50: 57-9. Beasley R et al. Association between paracetamol use in infancy and childhood, and risk of asthma, rhinoconjunctivits, and eczema in children aged 6-7 years: analysis from Phase Three of the ISAAC programme. Lancet 2008; 372: 1039-48. Pickering G et al. Analgesic effect of acetaminophen in humans: first evidence of a central serotonergic mechanism. Clin Pharmacol Ther 2006; 79: 371-9. Moiniche S et al. Nonsteroidal anti-inflammatory drugs and the risk of operative site bleeding after tonsillectomy: a quantitative systematic review. Anesth Analg 2003; 96: 68-77. Lundeberg S und Lönnqvist PA. Update on systemic postoperative analgesia in children. Pediatr Anesth 2004; 14: 394-7. Bozkurt P. Use of tramadol in children. Pediatr Anesth 2005; 15: 1041-7. Kart T et al. Recommended use of morphine in neonates, infants and children based on a literature review: Part 2-Clinical use. Pediatr Anaesth 1997; 7: 93-101. Müller C et al. Pharmacokinetics of piritramide in newborns, infants and young children in intensive care units. Eur J Pediatr 2006; 165: 229-39. Sümpelmann R et al. Patientenkontrollierte Analgesie bei Kindern. Anästh Intensivmed 1996; 1: 19-26. Jöhr M, Berger T. Regional anesthetic techniques for neonatal surgery. Best Pract Res Clin Anesthesiol 2004; 18: 357-75. Höhne C. Kinderanästhesie - Regionalanästhesie bei Früh- und Neugeborenen, Säuglingen und Kleinkindern. Anästhesiol Intensivmed Notfallmed Schmerzther 2007; 42: 616-22. Marhofer P et al. Kaudalanästhesie. Anaesthesist 2003; 52: 55-67. De Negri P et al. New drugs, new techniques, new indications in pediatric regional anesthesia. Minerva Anesthesiol 2002; 68: 420-7. Ansermino M et al. Nonopioid additives to local anaesthetics for caudal blockade in children: a systematic review. Pediatr Anesth 2003; 13: 561-73. Vranken JH et al. Severe toxic damage to the rabbit spinal cord after intrathecal administration of preservative-free S-ketamine. Anesthesiol 2006; 105: 813-8. Becke K et al. S(+)-Ketamin als Supplement zur Kaudalanästhesie im Kindesalter. Anästh Intensivmed 2007; 48: 298-9. Rapp HJ et al. Ultrasound-guided epidural catheter insertion in children. Anesth Analg 2005; 101: 333-9. Seefelder C. The caudal catheter in neonates: where are the restrictions? Curr Opin Anaesthesiol 2002; 15: 343-8. Jöhr M. Periphere Blockaden bei Kindern. Anästhesiol Intensivmed Notfallmed Schmerzther 2006; 41: 173-8.