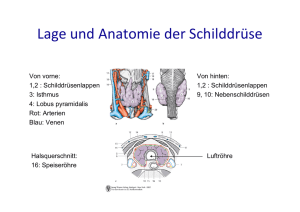
- MyScienceWork
Werbung

Untersuchungen zum Gallium-68-DOTATOC Uptake in gesundem und pathologisch verändertem Schilddrüsengewebe Dissertation zur Erlangung des akademischen Grades Dr. med. an der medizinischen Fakultät der Universität Leipzig eingereicht von: Grit Orschekowski geboren am 29.11.1984 in Leipzig angefertigt an: Der Universität Leipzig Medizinische Klinik (III) für Endokrinologie und Nephrologie und Klinik und Poliklinik für Nuklearmedizin Betreuer: Prof. Dr. med. Ralf Paschke Univ.-Prof. Dr. med. Osama Sabri Dr. med. Thomas Lincke Beschluss über die Verleihung des Doktorgrades vom: 24. 04. 2012 1 Bibliographische Beschreibung: Orschekowski, Grit Untersuchungen zum Gallium-68-DOTATOC Uptake in gesundem und pathologisch verändertem Schilddrüsengewebe Universität Leipzig, Dissertation Seitenzahl: 74 Literaturangaben: 71 Abbildungen: 28 Tabellen: 17 Anlagen: Abkürzungsverzeichnis Literatur- und Quellennachweis Danksagung und Widmung Erklärung über die eigenständige Abfassung der Arbeit Lebenslauf Referat: Im Rahmen der vorliegenden Studie wurde die Somatostatinrezeptordichte in gesundem und pathologisch positronenemissionstomographisch mittels verändertem Schilddrüsengewebe Gallium-68-DOTATOC untersucht. Insgesamt wurden 165 Patienten in die Studie eingeschlossen und entsprechend ihres Schilddrüsenbefundes sechs Gruppen zugeordnet. Es konnte gezeigt werden, dass gesunde Schilddrüsen einen deutlichen Somatostatinrezeptorbesatz in unterschiedlicher Ausprägung aufweisen. Bei männlichen Individuen war eine im Mittel höhere thyreoidale Somatostatinrezeptordichte mittels PET nachweisbar als bei Frauen. Bei den verschiedenen Formen der Schilddrüsenautonomien sowie den meisten aktiven Hashimoto-Thyreoiditiden zeigte sich ebenfalls eine erhöhte Somatostatinrezeptordichte. 2 Inhaltsverzeichnis 1. Einleitung ....................................................................................................................... 5 2. Material und Methoden .......................................................................................... 12 2.1 Patienten .................................................................................................................. 12 2.2 Somatostatinrezeptor Darstellung mittels Ga-68-DOTATOC PET .................. 12 2.2.1 2.2.2 2.2.3 2.2.4 2.2.5 2.2.6 2.2.7 2.2.8 2.3 Radiotracer....................................................................................................... 12 Ga-68-Gewinnung ............................................................................................ 13 Untersuchungsablauf ....................................................................................... 14 Schilddrüsenspezifische Auswertung der PET-Scans ...................................... 15 Anamneseerhebung und Aktenauswertung....................................................... 16 Labordiagnostik ............................................................................................... 17 Sonographische Untersuchung der Schilddrüse .............................................. 18 Schilddrüsenszintigraphie ................................................................................ 18 Statistische Auswertung ......................................................................................... 19 3. Ergebnisdarstellung ................................................................................................. 20 3.1 Ga-68-DOTATOC PET: Klassifikation der Patienten entsprechend ihrer schilddrüsenspezifischen Untersuchung .............................................................. 20 3.2 Datenzusammenstellung der Ga-68-DOTATOC PET Untersuchungen von 07/07 bis 09/08 ......................................................................................................... 22 3.2.1 3.2.2 3.2.3 3.3 Allgemeine Patientendaten ............................................................................... 22 Target-Background-Ratios (TBRs) bei verschiedenen SD-Pathologien .......... 26 Zusammenhang zwischen Schilddrüsenvolumen und TBR-Wert...................... 34 Zusammenfassende Auswertung der Ga-68-DOTATOC PET Untersuchungen von 09/06 bis 09/08 .................................................................................................. 34 3.3.1 3.3.2 3.3.3 3.3.4 3.3.5 3.3.6 Schilddrüsenspezifische Auswertung................................................................ 35 Allgemeine Patientendaten ............................................................................... 37 Target-Background-Ratios (TBRs) bei verschiedenen SD-Pathologien .......... 39 Intraindividuelle Differenzen bezüglich des schilddrüsenspezifischen Uptakes bei wiederholten Untersuchungen am selben Patienten .................................. 45 Kontrolluntersuchungen von gesunden Schilddrüsen mit verhältnismäßig hohen Uptake-Werten ....................................................................................... 47 Prüfung auf Korrelation zwischen der applizierten Ga-68-Aktivität und den zugehörigen TBR-Werten ................................................................................. 50 3 3.4. Vergleich der ermittelten TBR-Werte bei Ga-68-DOTATOC PET und In-111Octreotidszintigraphie ................................................................................................ 52 4. Schlussfolgerung und Diskussion ........................................................................ 54 4.1 Beurteilung und Diskussion der dargestellten Ergebnisse ................................. 54 4.2 Ausblick über weitere Forschungsansätze ........................................................... 62 5. Zusammenfassung der Arbeit............................................................................... 63 6. Anhang .......................................................................................................................... 65 6.1 Abkürzungsverzeichnis .......................................................................................... 65 6.2 Literaturverzeichnis ............................................................................................... 67 6.3 Danksagung und Widmung ................................................................................... 72 6.4 Erklärung über die eigenständige Abfassung der Arbeit ................................... 73 6.5 Lebenslauf ............................................................................................................... 74 4 1. Einleitung Die Somatostatinrezeptor-Positronen-Emissions-Tomographie (SSTR-PET) spielt eine zunehmende Rolle im Bereich der molekularen Bildgebung (1, 2). Eine spezielle Form ist das Gallium-68-DOTATOC PET. Hierbei handelt es sich um ein nuklearmedizinisches Untersuchungsverfahren, mit dessen Hilfe die relative Dichte von Somatostatinrezeptoren (SSTR) in vivo abgebildet werden kann. Es findet überwiegend Anwendung in der Diagnostik neuroendokriner Tumoren (NET). DOTATOC ist eine dem Somatostatin (SST) analoge Peptidverbindung (3, 4, 5). Es zeigt gute biokinetische Eigenschaften hinsichtlich der Aufspürung SST positiver Tumoren und Metastasen (6). Die Effekte von SST und seinen Analoga werden durch die Somatostatinrezeptoren vermittelt. Derzeit sind fünf Somatostatinrezeptor-Subtypen bekannt (SSTR 1-5). SSTR 2 liegt dabei infolge differenter Splicingvorgänge in zwei verschiedenen Varianten vor, SSTR 2A und SSTR 2B (7). Die fünf SSTR Gene sind auf verschiedenen Chromosomen lokalisiert und sind mit Ausnahme von SSTR 2 intronlos (8). DOTATOC weist eine besonders hohe Affinität für die SSTR Subtypen 2 und 5 auf, eine mittlere Affinität bezüglich SSTR 3 und jeweils nur eine geringe Affinität hinsichtlich der Subtypen SSTR 1 und SSTR 4 (7-13). Die SSTRs sind Glykoproteine (14) und gehören der Familie der G-Protein gekoppelten sieben Transmembranrezeptoren an (15, 16). Eine Vielzahl von gesunden Geweben und Tumoren exprimieren Somatostatinrezeptoren (17). Sie spielen eine Schlüsselrolle in der Regulation der Hormonausschüttung und steuern exo- und endokrine Drüsenfunktionen. Zudem beeinflussen sie die gastrointestinale Motilität und Sekretion, regulieren das Schlafverhalten sowie verschiedene kognitive Prozesse und haben Einfluss auf die Regulation der Zellproliferation (18). SSTRs findet man beispielsweise im Magen-Darm-Trakt, im Pankreas oder in der Hypophyse (9). Außerdem konnten SSTRs bereits auf menschlichen Immunzellen, wie mononuklearen Leukozyten und peripheren Blut-Lymphozyten, nachgewiesen werden (19). Eine Überexpression der Somatostatinrezeptoren wird vor allem für 5 neuroendokrine Tumore beschrieben. Hierzu gehören Karzinoide, Paragangliome, Phäochromozytome, medulläre Schilddrüsenkarzinome und endokrine Neoplasien der Lunge. Auch für Lymphome und Meningeome wird eine erhöhte SSTR-Analoga Akkumulation beschrieben (20). Der Vorläufer der Somatostatin-Peptid-Familie wird durch ein einzelnes Gen verschlüsselt, welches beim Menschen auf Chromosom 3q28 lokalisiert ist. Die SSTRs werden sowohl durch die beiden natürlichen Liganden, Somatostatin 14 und Somatostatin 28, als auch durch die Bindung von Corticostatin aktiviert (18). Diese sind gleichermaßen im ZNS und im PNS zu finden (7). Mit Ausnahme von SSTR 5 weisen die beiden natürlichen Liganden des Somatostatins annähernd gleiche Affinitäten zu den einzelnen Rezeptor-Subtypen auf. Für SSTR 5 wird bezüglich SST 28 eine circa zehnfach höhere Affinität in der Literatur beschrieben (7). Dennoch scheint SST 14 im Vergleich zu SST 28 die bedeutendere Rolle im Organismus zu spielen (7). SST wird in den δ-Zellen des Pankreas gebildet. Es ist eine aus 14 Aminosäuren (AS) aufgebaute Peptidverbindung, die in einer Vielzahl von menschlichen Geweben nachgewiesen werden kann (21). Die Plasmahalbwertszeit des nativen SST beträgt zwei bis drei Minuten (22). Im menschlichen Gehirn fungiert SST als Neurotransmitter und Neuromodulator und ist in verschiedene kognitive Funktionen und Bewegungsabläufe involviert (22). In peripheren Geweben sind die Effekte von SST durch die Unterdrückung von Funktionen in den Zielzellen charakterisiert. Es bewirkt eine verminderte Gastrinsekretion der G-Zellen des Magens sowie eine reduzierte Insulin- und Glukagonbereitstellung der pankreatischen Inselzellen (22). Somatostatin greift zudem hemmend in exokrine Vorgänge, wie die Amylase- und Pepsinogensekretion, oder die Ausschüttung von Bikarbonat, Pankreasenzym und Gallenflüssigkeit ein. Weiterhin wirkt es als Immunmodulator (7). Viele der G-Protein gekoppelten sieben Transmembranrezeptoren, sowie auch einige der SSTR Subtypen, besitzen die Fähigkeit zur Homo- und Heterodimer-Bildung (11). Voraussetzung dafür ist, dass sie im Vorfeld durch die Bindung spezifischer Liganden aktiviert werden. 6 Patel zeigte, dass an der äußeren Zellmembran liegende monomere Rezeptoren nach Aktivierung zur Homo- und Heterodimer-Bildung befähigt sind (8). Die Dimerisation von SSTR 2A und SSTR 3, sowie SSTR 1 und SSTR 5 wurde bereits beschrieben (23, 24). Rocheville weist allerdings darauf hin, dass nicht jede Kombination der SSTRs untereinander zu einer Heterodimer-Bildung führt. Bei den neu entstandenen Dimeren konnte eine Veränderung der Rezeptorexpression, Rezeptorinternalisation, sowie der pharmakologischen Rezeptoreigenschaften nachgewiesen werden (24). Auch die Mitglieder nah verwandter G-Protein gekoppelter Familien oligomerisieren untereinander. So bildet der Dopamin Rezeptor D2 mit SSTR 5 einen neuen Rezeptor, welcher sich durch eine gesteigerte funktionelle Aktivität auszeichnet (25). Auch der μ-Opioid-Rezeptor bildet mit SSTR 2A ein heterodimeres Molekül, welches veränderte pharmakologische Eigenschaften aufweist (26). Für die In-vivo-Diagnostik von SSTR exprimierenden Geweben eignet sich die Gallium-68-DOTATOC PET Untersuchung (3, 4, 5, 27-29). Der verwendete Radiotracer zeichnet sich durch eine sehr ausgeprägte Affinität zu selbst geringen SSTR- Expressionsmengen aus (20, 30-32). Daraus ergibt sich eine verhältnismäßig hohe diagnostische Aussagekraft der Untersuchung (32). Zu beachten ist dennoch, dass ein unspezifischer Uptake des Radiopharmakons durch infiltrierende Lymphozyten, sowie peri- und intratumorale Blutgefäße möglich sein kann. Die Expression von SSTRs auf der Membran von T-Lymphozyten wurde bereits beschrieben (27, 33). Neben verschiedenen Organen und Geweben ist auch in Schilddrüsengewebe eine SSTR-Expression bekannt. Einige Studien haben sich bereits mit einer vermehrten Radiotracerspeicherung im Fall von unterschiedlichen Schilddrüsenpathologien in vivo befasst. Eine erhöhte SSTR-Expression wurde in Fällen von Morbus Basedow, autonomen Adenomen (AA) und Strumen, als Vertreter der benignen Pathologien, beschrieben (9, 34). Des Weiteren weisen auch maligne Schilddrüsenerkrankungen, wie das medulläre oder das papilläre Schilddrüsenkarzinom, eine erhöhte SSTAnaloga Speicherung auf (7, 35, 36). 7 Viele Arbeiten beschäftigten sich bereits mit dem großen Einfluss der Somatostatinrezeptoren auf intrazelluläre Vorgänge. Die verschiedenen SSTRSubtypen werden zum Teil auf der gleichen Zelle exprimiert und sind mit unterschiedlichen Postrezeptormechanismen gekoppelt (14, 27). Krantic zeigt in seiner Studie, dass die Aktivierung von SSTR 1–5 zu einer Inhibition der Adenylatzyklase, vermittelt durch Gα1–3, führt. Gleichermaßen erfolgt eine Aktivierung der Phopholipase Cβ durch pertussisabhängige und -unabhängige G-Proteine (7, 27). Außerdem bewirkt eine Stimulation der Rezeptoren eine Aktivierung von Kalium- und von spannungsabhängigen Kalziumkanälen (7, 27). SSTRs sind in der Lage, Glutamatrezeptor-Ionenkanäle zu modulieren und auf diese Weise deren Eigenschaften zu verändern (15). In die Signalkaskadenwege der SSTRs sind neben den genannten weiterhin Serin/Threonin-Phophatasten, Tyrosin-Phosphatasen und Kalzium abhängige Phosphatasen eingebunden. Zudem vermitteln extrazellulär regulierte Kinasen 1 und 2 (ERK 1 und ERK 2), sowie Natrium-Protonen-Austauscher zusätzliche SSTR induzierte Effekte an der Zelle (7). Erwähnt wird weiterhin ein Koexpressionssystem der SSTRs. Dies beinhaltet eine Hochregulation eines SSTR-Subtyps, im Falle der reduzierten Ausprägung eines anderen SSTR-Subtyps (7, 27). Die Bedeutung von Somatostatin für die Schilddrüse wurde bereits mehrfach beschrieben (37, 38). So unterdrückt es die Freisetzung der Schilddrüsenhormone, reduziert den Thymidin-Einbau in die Ribonukleinsäure (RNA) der Follikelzellen und hemmt die TSH-stimulierte Adenylatzyklase (AC) in gesundem und pathologisch verändertem Schilddrüsengewebe. Durch SSTR 1 spezifische Agonisten wird vermutlich eine Hemmung der Proliferation, Calcitoninsekretion und CalcinogenExpression in parafollikulären C-Zellen herbeigeführt (37). Desweiteren verlangsamt SST die Tumorproliferation in vitro und zeigt direkte antiproliferative Effekte auf Zelllinien von papillären und follikulären Schilddrüsenkarzinomen (37, 38). Bei diesem Effekt bewirkt eine Stimulation des Thyreotropinrezeptors (TSHR) die ACAktivierung, wodurch das zyklische Adenosinmonophosphat (cAMP) ansteigt. Durch diesen intrazellulären cAMP-Anstieg wird in der Folge die Proteinkinase A (PKA) sowie die Phosphoinositol-3-Kinase (PI-3-K) aktiviert. Die PKA aktiviert RhoA, was zu einer Down-Regulation des Zellwächters p27kip1 führt. Desweiteren wird durch die TSHR- Stimulation ein Anstieg der Zyklin abhängigen Kinase 2 (CDK 2) und eine 8 Erhöhung des Zyklin-E-Levels erreicht. Durch die Beeinflussung dieser beiden Signalwege und die gleichzeitige Phosphorylierung des Retinoblastom Proteins wird ein Zellzyklusstopp von der G1 in die S-Phase herbeigeführt (39, 40). Da SST den AC/cAMP-Mechanismus hemmt, könnte es als funktioneller Gegenspieler zum TSH wirken (27, 39). Diskutiert wird zudem, dass die inhibitorischen Effekte von SST und seinen Analoga durch eine Hemmung der peritumoralen Angiogenese verursacht werden könnten (41-43). Eine besondere Rolle scheint der Subtyp SSTR 2 bei der Aktivierung spannungsabhängiger Kalziumkanäle durch SST zu spielen. Es bewirkt einen Abfall des intrazellulären Kalziumspiegels und eine Hemmung der GH-Sekretion durch SST (44). In der Folge können starke antiproliferative Effekte auftreten. SST nimmt weiterhin Einfluss auf die rezeptorvermittelte Exocytose (16, 27). Florio zeigte, dass SST einen wachstumshemmenden Effekt auf die PCC-13-Zelllinie besitzt, indem es eine Aktivierung der membranständigen Phophotyrosin- Phosphatase induziert (17, 27). Des Weiteren zeigte sich, dass durch SSTR 2 und SSTR 3 der programmierte Zelltod (Apoptose) durch eine Konzentrationserhöhung von IGFBP (Insulin like growth factor binding protein) induziert werden kann (27, 45). Im Gegensatz dazu hemmt TSH die IGFBP-Konzentration (27, 45). Wachstum und Funktion der Schilddrüse werden hauptsächlich durch Aktivierung des Thyreotropinrezeptors (TSHR) vermittelt (46). Der TSHR gehört der Familie von G-Protein gekoppelten Rezeptoren der B-Subklasse an. Er besteht aus zwei Untereinheiten, deren struktureller Aufbau ihn von anderen Glykoprotein- Hormonrezeptoren unterscheidet (47, 48). Zahlreiche Studien belegen für den TSHR eine Homo- und Heterodimer-Bildung im Schilddrüsengewebe (47-50). Die Entwicklung der Schilddrüsenfollikelzellen wird dominierend über das Zusammenspiel von TSH und IGF 1 gesteuert (40). In der differenzierten Schilddrüsenkarzinom-Zelllinie FRTL 5 ist SST in der Lage, die durch TSH und IGF 1 vermittelte Zellproliferation zu hemmen. Die antiproliferativen Effekte des SST werden hier vor allem durch die Subtypen SSTR 2, SSTR 1 und SSTR 5 vermittelt. Um Einfluss auf das Wachstumsverhalten zu nehmen, benötigt SST allerdings die Anwesenheit eines positiven Effektors, des TSH. In Abwesenheit von TSH wirkt SST 9 somit nicht wachstumshemmend auf FRTL-5-Zellen. Diese Beobachtungen weisen auf die sehr enge Verknüpfung der Somatostatin- und der TSH-Signalkaskade hin (40). Bisher sind nur wenige Untersuchungen hinsichtlich der SSTR-Expression von Schilddrüsengewebe in vivo bekannt. Lincke et al. zeigen in ihrer Studie, dass bestimmte Schilddrüsenerkrankungen, wie die aktive Hashimoto-Thyreoiditis oder autonome Adenome einen erhöhten Traceruptake aufweisen (28). Des Weiteren wird über erhöhte In-111-Pentetreotide und Ga-68-DOTATOC Uptake-Werte im Fall von gesunden Schilddrüsen berichtet (28, 34). Becker stellt weiterhin einen Zusammenhang mit dem endemischen Jodmangel her. In dieser Studie wurde das SST-Analogon 111In-Octreotide verwendet (9). Ein klar erhöhter Traceruptake im Fall von Jodmangelstrumen konnte gezeigt werden. Druckenthaner et al. demonstrierten, das eine Mehranreicherung verschiedener SST-analoger Radiopharmazeutika nicht nur bei Schilddrüsenkarzinomen, sondern auch im Fall von benignen Schilddrüsenerkrankungen gefunden werden kann. Durchgeführt wurde die Studie mit Somatostatinanaloga, die an F-18, Ga-68 und Tc-99m gekoppelt waren. Dabei zeigte sich stets, unabhängig vom verwendeten SSTAnalogon, eine hohe Affinität und Selektivität bezüglich des SSTR 2 (38). Bei der Untersuchung von spezifischer Schilddrüsen-mRNA wiesen Ain et al. eine Dominanz der Subtypen SSTR 3 und SSTR 5 nach (41). Im Gegensatz dazu zeigten die Analysen von Druckenthaner eine bevorzugte SSTR 2-Expression in gesundem menschlichem Schilddrüsengewebe (38). Der beschriebenen Prädominanz des SSTR 2 im Schilddrüsengewebe wird durch Druckenthaner ein hoher Stellenwert in der Behandlung thyreoidaler Tumoren in der Zukunft zugeschrieben (38). Pisarrek konnte in seiner Studie bei der Untersuchung menschlicher Schilddrüsentumore die Präsenz aller SSTRs, einschließlich der Subtypen SSTR 2A und SSTR 2B, nachweisen (36). Bei dieser Studie zeigte SSTR 1 eine dominierende Rolle hinsichtlich der Expression in pathologisch veränderten Schilddrüsengeweben. In 88% der untersuchten Schnittpräparate konnte SSTR 1 spezifische mRNA nachgewiesen werden (36). Mögliche pathophysiologische Ursachen, die bei der Entstehung von Schilddrüsenadenomen eine Rolle spielen können, werden in der Fachliteratur 10 diskutiert. So stellen Führer et al. eine Verbindung zwischen der Entstehung toxischer Schilddrüsenadenome und dem familiärem Hyperthyreodismus mit einer Mutation des humanen TSHR her (51). Krohn beschreibt, dass es durch diese Mutationen zu unkontrollierten Signalimpulsen des Rezeptors kommt. Eine überschießende Proliferation des Schilddrüsengewebes sowie eine gesteigerte Hormonausschüttung sind die Folge (52). Trulzsch et al. fanden bei der Analyse von 75 toxischen Schilddrüsenknoten in 43 Fällen wesentliche Mutationen des aktivierten TSH-Rezeptors (53). Die Somatostatinanaloga sind schon seit langem im diagnostischen und therapeutischen klinischen Einsatz. So werden sie beispielsweise genutzt, um die akute Oesophagusvarizenblutung unterstützend zur endoskopischen Therapie zu behandeln. Der Grund hierfür liegt in der Reduktion der portalen Hypertension durch Verminderung der arteriellen Perfusion im Splanchniskusgebiet (54). Die Auswirkung einer Langzeittherapie mit dem SST-Analogon Sandostatin untersuchte Kohlfürst bei Patienten mit progressivem Schilddrüsenkrebs und SST-positiven Metastasen. Eine Stabilisierung des Krebses konnte hierbei nicht beobachtet werden. Alle behandelten Patienten zeigten unter der Therapie eine Progression des carcinomatösen Wachstums (55). Weitere wachstumshemmenden Einsatz Studien, die verschiedener sich ebenfalls SST-analoger mit dem Verbindungen beschäftigten, kamen zu ähnlichen Ergebnissen (8, 41, 56-58). Folglich bleibt der gewünschte antiproliferative Effekt der SST-Analoga bezüglich der Therapie von Schilddrüsenkarzinomen weiterhin umstritten. Festzuhalten ist, dass es bis zum jetzigen Zeitpunkt noch nicht möglich ist, endgültige Aussagen über die SSTR-Expression in Schilddrüsengewebe und ihre Bedeutung für die Schilddrüse zu treffen (28). Ziel dieser Arbeit ist es, einen Vergleich des Ga-68-DOTATOC Uptakes im Fall von gesunden und pathologisch veränderten Schilddrüsen herzustellen. Bezugnehmend auf die bereits publizierte Studie von Lincke et al. (28) sollen die Ergebnisse in einem größeren Patientenkollektiv beurteilt und validiert werden. Zur Diskussion stehen die folgenden Fragen: 11 1. Lassen sich die gefundenen erhöhten Uptake Werte (28) im Fall von Strumen und/oder knotigen Schilddrüsen im Vergleich zu gesunden Schilddrüsen bei einem größeren Patientenkollektiv bestätigen? 2. Entwickeln Patienten mit gesunden Schilddrüsen und deutlich erhöhten Uptake-Werten eine Schilddrüsenpathologie im Verlauf? (kann somit eine Erklärung der erhöhten Radiotraceruptake Werte vorgenommen werden?) 3. Finden sich weitere Faktoren, die den SSTR-Uptake beeinflussen? Nehmen das Schilddrüsenvolumen, Patientenalter und Patientengeschlecht, sowie die Grunderkrankung, oder die eventuelle Einnahme von L-Thyroxin Einfluss auf den Ga-68-DOTATOC Uptake? 2. Material und Methoden 2.1 Patienten Eine Studienteilnahme kam nach Aufklärung und schriftlicher Einverständniserklärung für alle Patienten in Frage, die im Zeitraum von Juli 2007 bis September 2008 eine Untersuchung mittels Gallium-68-DOTATOC PET aufgrund eines extrathyreoidalen Tumorleidens erhielten. Zusätzlich wurden alle Patienten eingeschlossen, die in der von Lincke et al. durchgeführten Studie im Zeitraum von August 2006 bis Juli 2007 bereits untersucht wurden (27). Insgesamt konnte so das Patientenkollektiv von ursprünglich 76 Patienten auf 165 Patienten erweitert werden. 2.2 Somatostatinrezeptor Darstellung mittels Ga-68-DOTATOC PET 2.2.1 Radiotracer Ga-68-DOTATOC ist aufgrund seiner hervorragenden pharmakokinetischen Eigenschaften heute eines der am häufigsten verwendeten radioaktiv markierten SST-Analoga im Bereich der PET-Bildgebung (31). Durch seine rasche Blutclearance sowie die günstige Halbwertszeit des zur Radiomarkierung verwendeten Gallium-68 12 von 68 min, wird Ga-68-DOTATOC zu einem idealen Radiotracer für den klinischen Einsatz (1, 29, 59). DOTATOC ist eine chemische Verbindung aus Tyrosin3 -Octreotid (TOC) und DOTA (1,4,7,10-tetra-aza-cyclo-dodecane-N,N´,N´´,N´´´-tetraacetic acid) (28). Wie bereits erwähnt, ist seine Affinität zu den SSTR-Subtypen 2 und 5 am höchsten (59). Abb.1) Biochemische Formel von DOTATOC (29) 2.2.2 Ga-68-Gewinnung Die radiochemische Herstellung von Ga-68-DOTATOC erfolgt vor Ort in der anwendenden Einrichtung. Für seine Herstellung wird ein Chemotrade Ga-68 / Ge-68 Generator des Herstellers Cyclotron Co. Ltd. Obinsk, Russland verwendet (29, 60). Dies ist ein Generator chromatographischen Typs, bestehend aus einer Glassäule mit einem Sorbent aus modifiziertem Titandioxid (60). Das Mutternuklid Germanium68 ist an dieses Sorbent im IV+ Zustand gebunden (29). Germanium zerfällt mit einer HWZ von 270,8 Tagen durch Elektroneneinfang in das kurzlebigere Gallium-68 (29). Die Ausgangsaktivität des verwendeten Germanium-68 beträgt bei einem neuen Generator circa 1480 MBq (27). Das aus dem Zerfall von Ge-68 entstehende Ga-68 wird mittels 0,1M HCL-Lösung (ca. 7 ml) aus der Säule ausgewaschen. Acht Stunden nach erfolgter Elution kann der Generator wieder 99,2 % seiner maximalen Ga-68 13 Aktivitätsmenge abgeben. Bereits nach vier bis sechs Stunden kann ein zweites Mal mit einer Ausbeute von 91-97% eluiert werden (27). Das Eluat wird im Anschluss vorkonzentriert und von möglichen Verunreinigungen befreit. Nach der Markierung von DOTATOC mit Ga-68 erfolgt eine Qualitätskontrolle hinsichtlich der radioaktiven Konzentration, der radiochemischen Reinheit, des pHWertes und der Radionuklid-Identität. Ga-68 zerfällt zu 89% durch Positronenemission mit einer maximalen Energie von 1,92 MeV und zu 11% durch Elektroneneinfang (29). Die Verunreinigung des Eluats mit Germanium-68 liegt bei max. 0,01%. Die Aktivitätskonzentration beträgt über 185 MBq/ml, die spezifische Aktivität über 18500 MBq/mg. Die Reinheit von Ga-68 liegt bei über 99,8%. Die inaktiven Verunreinigungen sind relativ gering, so findet sich für Gallium eine Verunreinigung von unter 3 μg/37 MBq und für Nickel unter 1 μg/37 MBq (27, 29). 2.2.3 Untersuchungsablauf Die mittlere Aktivität des applizierten Radiopharmakons betrug für alle Patienten 174,5 MBq (Min: 67,0 MBq; Max: 274,0 MBq). Die Ganzkörperaufnahmen im 2DModus erfolgten mittels Positronenemissiontomographie-Scans (PET) circa eine Stunde nach intravenöser Applikation von Ga-68-DOTATOC. Pro jeweilige Bettposition betrug die Aufnahmezeit ungefähr neun Minuten. Insgesamt wurde jeder Patient circa 60 Minuten gescannt (5-7 Bettpositionen). Die Aufnahmen wurden im Zeitraum von August 2006 bis Oktober 2007 mit einem ECAT EXAT HR+ Tomographen der Firma Siemens durchgeführt (Siemens AG, Erlangen, Deutschland). Der mit Hilfe von 32 Ringdetektoren erfasste Datensatz wird in 63 transversalen Schichten von jeweils 2,4 mm Dicke dargestellt. Die Größe des axialen Erfassungsfeldes liegt bei 15,2 cm. Ab Oktober 2007 erfolgten die PETAufnahmen an einem Biograph 16 PET/CT der Firma Siemens (Siemens AG, Erlangen, Deutschland). Dieses Hybridgerät besteht aus einem 16-Zeilen CT und einem PET-Scanner mit 39 Detektorringen. Die Größe des axialen Erfassungsfeldes liegt bei diesem Gerät bei 16,2 cm. Der PET-Datensatz wurde unter Zuhilfenahme des Ordered Subset Expectation Maximization (OSEM) Algorithmus mit zwei Iterationen und acht Subsets rekonstruiert. 14 2.2.4 Schilddrüsenspezifische Auswertung der PET-Scans Die schilddrüsenspezifische Auswertung der PET-Bilder erfolgte an der Hermes Workstation der Firma Hermes Medical Solutions mit der Software Multi Modality mittels speziell entworfener, standardisierter „Region of interest“-Sets (ROI) an coronalen Schnittbildern. Zu diesem Zweck wurden jeweils zwei 5 mm dicke coronale Schichten zu einem 10 mm dicken Schnittbild addiert. Im Anschluss erfolgte die Auswahl derjenigen beiden schilddrüsenspezifischen Auswertung wurde Kompositionsbilder, Uptake jeweils aufwiesen. das welche Für Schnittbild die mit den endgültige der höchsten statistische höchsten mittleren Radiotraceranreicherung in der Schilddrüse verwendet. Zunächst erfolgte eine Platzierung beider ROIs (ROI 1 und ROI 2) im Bereich über der Schilddrüsenregion, wie in der zweiten Abbildung dargestellt. Somit erhielt man die Summe aus Schilddrüsenuptake und dem unspezifischem Hintergrunduptake. Im Anschluss wurde das ROI-Set in den Bereich direkt unterhalb der Schilddrüse im oberen Mediastinum platziert, um selektiv den unspezifischen Hintergrunduptake zu erfassen (Abbildung 3). Target to Background Ratios (TBRs) wurden berechnet. Sie ergaben sich als Quotienten der mittleren Aktivitätswerte der im Schilddrüsenbereich positionierten ROIs (Summe aus Schilddrüsenuptake und unspezifischem Hintergrunduptake) zur unspezifischen Hintergrundaktivität (mediastinale ROI). Abb. 2) ROI-Set über der Schilddrüsenregion Abb. 3) ROI-Set im oberen Mediastinum unterhalb der SD-Region 15 In der vorliegenden Arbeit wurden die ROI-Sets genutzt, die auch in der Arbeit von Lincke et al. (28) zur Anwendung kamen. ROI 1 und ROI 2 weisen dabei eine längselliptische Form auf. Sie besitzen einen Querdurchmesser von 16,5 mm, sowie einen Längsdurchmesser von 44,9 mm. Außerdem sind die vorliegenden ROIs gegenüber der Vertikalen um einen Winkel von -18° gedreht, um die physiologischen Gegebenheiten der Schilddrüsenprojektion nachzuahmen (28). In vier Fällen von fokaler Mehrspeicherung des Radiopharmakons wurde von der Verwendung des Standard ROI-Sets abgewichen. Zur genaueren Auswertung wurde dann ein spezielles ROI entworfen, welches in Größe und Form der fokalen Läsion angepasst wurde. Diese Methode kam bei drei Patienten mit autonomen Adenomen, sowie bei einem weiteren Patienten mit einer Metastase eines SSTR-positiven neuroendokrinen Tumors (NET) zum Einsatz. 2.2.5 Anamneseerhebung und Aktenauswertung Die schilddrüsenspezifische Anamnese wurde mit Hilfe eines standardisierten Fragebogens erhoben. Dieser enthielt Fragen bezüglich einer Erkrankung der Schilddrüse, sowie über bereits stattgehabte Untersuchungen. Zudem wurde nach familiären Schilddrüsenerkrankungen und möglichen, in der Vergangenheit durchgeführten, Schilddrüsenoperationen oder Radiojodtherapien gefragt. Weiterhin wurden die Studienteilnehmer hinsichtlich der regelmäßigen Einnahme einer schilddrüsenspezifischen Medikation, wie Jod, Thyroxin oder Thyreostatika, befragt. Mittels Aktenauswertung sowie Sichtung der Patientenbefunde im Klinikinformationssystem konnte die Anamnese hinsichtlich der neuroendokrinen Tumorerkrankung, welche die Indikation zur SSTR PET-Untersuchung ergeben hatte, komplettiert werden. Durch ein regelmäßiges Studium der bereits erfassten Patientenakten wurden stattgehabte Nachsorgeuntersuchungen wie z.B. empfohlene Schilddrüsensonographien oder Szintigraphien noch innerhalb der Studienlaufzeit erfasst. Jeder Studienteilnehmer erhielt in einem Abstand von vier bis acht Wochen nach der Schilddrüsenuntersuchung einen persönlichen Brief, welcher Laborparameter, die 16 Untersuchungsergebnisse der durchgeführten Schilddrüsensonografie, sowie mögliche Empfehlungen hinsichtlich einer Kontrolluntersuchung beinhaltete. 2.2.6 Labordiagnostik Jeder Teilnehmer der Ga-68-DOTATOC Studie erhielt zunächst eine Bestimmung des TSH-Wertes und der Anti-TPO-Antikörper. Die Bestimmung des TSH-Wertes erfolgte mittels Cobas TSH Elecsys® Test (Firma Roche) Immunoassay Analyseautomaten Modular Analytics E 170 (Elecsys Modul). Der Messbereich liegt bei diesem Test bei 0,005-100,00 und die Nachweisgrenze wird mit 0,005 mU/l angegeben. Die Anti-TPO-Antikörper-Konzentration wurde unter Verwendung des automatisierten kompetitiven Immunfluoreszenzassay BRAHMS anti-TPOn Kryptor und dem BRAHMS Kryptor als Analysegerät ermittelt. Hier liegt die Nachweisgrenze bei 28 U/ml. Fielen bei Patienten TSH-Werte kleiner 0,4 mU/l oder größer 4,2 mU/l auf, wurden im Anschluss die freien Schilddrüsenhormone Thyroxin (fT4), sowie Thrijodthyronin (fT3) bestimmt. Anhand dieser Werte war es dann möglich zu ermitteln, ob es sich um eine latente oder manifeste Hyper- bzw. Hypothyreose handelt. Die Bestimmung der freien Hormone erfolgte mittels Cobas Elecsys® Test und unter Verwendung des Analyseautomaten Modular Analytics E170 (Elecsys Modul) der Firma Roche. Bei diesem Test liegt die Nachweisgrenze für fT4 bei 0,3 pmol/l und für die fT3Bestimmung bei 0,4 pmol/l. Bestand aufgrund der sonographischen Untersuchung, sowie der ermittelten Laborparameter und der klinischen Untersuchung der Verdacht auf eine autoimmune Schilddrüsenerkrankung, erfolgte zusätzlich die Bestimmung des TSH-Rezeptor-Antikörpers (TRAK). Die Ermittlung des TRAK-Wertes erfolgte mit Hilfe des Anti-TSH-Rezeptor-Elisa (IgG) der Firma Euroimmun. Hier wird die untere Nachweisgrenze mit 0,2 IE/l angegeben. Die Sensitivität des Testes liegt nach Herstellerangabe bei 89%, die Spezifität bei 100%. 17 2.2.7 Sonographische Untersuchung der Schilddrüse Die Ultraschalluntersuchung der Schilddrüse erfolgte bei allen Patienten in Rückenlage bei rekliniertem Kopf. In Leipzig wurde ein Sonographiegerät der Firma Siemens mit einem 7,5 MHz Schallkopf verwendet. Die Sonographieuntersuchung dient zum einen der Volumenbestimmung der Schilddrüse, zum anderen können knotige Veränderungen sowie Auffälligkeiten des Schilddrüsenbinnenmusters beschrieben werden. Die Ermittlung der Größe beider Lappen erfolgte dabei seitengetrennt. Hierfür wurden jeweils ein Längs- und ein Querschnittbild der Schilddrüse eingestellt, um die Ausdehnung des jeweiligen Schilddrüsenlappens in drei Dimensionen zu ermitteln. Die Berechnung der Volumina erfolgte durch Multiplikation von Länge x Breite x Tiefe x optimierten Korrekturfaktor f=0,479 (61). Nach Aufsummierung der Werte für rechten und linken Schilddrüsenlappen erhielt man das Gesamtvolumen. Die in unserer Studie verwendeten Normwerte für dieses Gesamtvolumen der Schilddrüse liegen für Frauen bei 18 ml und für Männer bei 25 ml. 2.2.8 Schilddrüsenszintigraphie Wurden durch die Schilddrüsensonographie Knoten mit einem größten Durchmesser von mehr als einem Zentimeter entdeckt, oder fielen erniedrigte TSH-Werte unter 0,4 mU/l auf, so bekamen die Patienten zusätzlich die Empfehlung zur Durchführung einer Szintigraphie der Schilddrüse. Mit Hilfe dieser Untersuchung wird das UptakeVerhalten der Schilddrüse bezüglich des Radiopharmakons Technetiums-99m Pertechnetat (Tc-99m Pertechnetat) als Korrelat für die Jodavidität bestimmt. Es wurden für diese Untersuchung circa 75 MBq Tc-99m Pertechnetat verwendet. Die Applikation des Radiopharmakons erfolgte intravenös. Nach einer Wartezeit von 20 Minuten wurde die szintigraphische Untersuchung am sitzenden Patienten durchgeführt. Das Radionuklid Tc-99m sendet durch seinen Zerfall γ-Strahlen aus, die mit Hilfe einer speziellen Gammakamera erfasst werden (62). Die szintigraphische Messung dauert circa 5 Minuten. Die Bildauswertung erfolgt visuell und mit Bestimmung des relativen Tc-Uptakes (63). 18 2.3 Statistische Auswertung Die statistische Auswertung der vorliegenden Daten erfolgte analog zur ersten Studie von Lincke et al. (28). Verwendet wurde die PC-Software SPSS 14.0 Student Version für Windows XP Home. Die deskriptive Statistik der ermittelten Patientendaten erfolgte unter Verwendung von Tabellen, Kreis- und Säulendiagrammen. Für die Parameter Patientenalter, TSHWert, Schilddrüsenvolumen, sowie verabreichte Aktivität erfolgte die Berechnung von Mittelwert, Median, Range, Minimum, Maximum und Standardabweichung. Diese Kenngrößenberechnung erfolgte weiterhin bei der Analyse der gesamt TBR, sowie der gruppenspezifisch ermittelten TBR-Werte. Das Patientenkollektiv der vorliegenden Studie wurde mittels Kolmogorov-Smirnov Test auf Normalverteilung geprüft. Da die einzelnen Patientengruppen keine Normalverteilung aufweisen, erfolgt die weitere Testung der TBRs auf signifikante Unterschiede mit dem Mann-Whitney U-Test für unabhängige Stichproben. Um eine Vergleichbarkeit der ermittelten Daten vor und nach der Umstellung des PET-Scanners zu prüfen, wurden die Unterschiede bezüglich der ermittelten TBRs mit Hilfe des Wilcoxon Tests auf Signifikanz getestet. Bei den Testverfahren wurden Unterschiede mit einem minimalen Signifikanzniveau p < 0,05 als statistisch signifikant erachtet (27). Im Falle von multiplen Testreihen wurde eine Korrektur unter Zuhilfenahme der α-Adjustierung nach Bonferronie vorgenommen (64). Die graphische Veranschaulichung der ermittelten gruppenspezifischen TBRs erfolgte mit Hilfe von Boxplot-Diagrammen. Eine mögliche Korrelation bezüglich der TBR-Werte wurde hinsichtlich des Schilddrüsenvolumens, des Patientenalters, der Anti-TPO-AK-Werte, sowie der applizierten Radiotraceraktivität unter Verwendung der Korrelations- und Regressionsanalyse getestet. 19 3. Ergebnisdarstellung 3.1 Ga-68-DOTATOC PET: Klassifikation der Patienten entsprechend ihrer schilddrüsenspezifischen Untersuchung Die nachfolgende Tabelle stellt die Gruppenzuordnung der Patienten entsprechend der jeweiligen Schilddrüsendiagnose vor. Die Klassifikationskriterien werden erläutert. Tab. 1) Schilddrüsengruppen Gruppe Thyreoidektomie Normale Schilddrüse Struma und/oder knotig umgebaute Schilddrüse Klassifikationskriterien Z. n. Thyreoidektomie Normaler Ultraschallbefund unauffälliges Labor (TSH < 4,2 mU/l und TSH > 0,4 mU/l ) keine Hinweise auf SD-Erkrankungen in der Anamnese und bei der SD-Untersuchung SD-Volumen bei Männern > 25 ml, bei Frauen > 18 ml und/oder: knotige Veränderungen der Schilddrüse bei Knoten > 1cm zusätzlich per Szintigrafie eine mögliche SD-Autonomie ausgeschlossen Laborwerte ohne Anhalt für SD-Autonomie Schilddrüsenautonomien und M. Basedow a) Unifokale Autonomie b) Multifokale Autonomie c) Disseminierte Autonomie d) Morbus Basedow Hoch aktive HashimotoThyreoiditis Niedrig aktive HashimotoThyreoiditis a) und b) szintigraphisch heiße Knoten, negative TRAKs c) supprimiertes TSH, diffus erhöhter szintigraphischer Uptake, negative TRAKs d) positive TRAKs Anti-TPO stark erhöht (> 500U/mL) keine Anzeichen für einen Morbus Basedow auf Grundlage des Labors und der klinischen Untersuchung SD-Volumen vergrößert Anti-TPO moderat erhöht (> 60 U/mL, aber < 500 U/mL) hypodenses Echomuster 20 Im Anschluss werden die jeweiligen Patientenzahlen pro Schilddrüsengruppe tabellarisch dargestellt (analog der Gruppeneinteilung von Lincke et al. (28). Tab. 2) Anzahl der Ga-68-DOTATOC Patienten Gruppe Anzahl der Patienten Thyreoidektomie 10 Normale Schilddrüse 64 Struma und/oder knotig umgebaute 61 Schilddrüse Schilddrüsenautonomien 12 (einschl. Morbus Basedow) (a) 3 (b) 2 (c) 6 (d) 1 Hoch aktive Hashimoto-Thyreoiditis 7 Niedrig aktive Hashimoto-Thyreoiditis 11 In der vorliegenden Datenzusammenstellung fehlen insgesamt sieben Patienten (fünf Patienten nach Hemithyreoidektomie, ein Patient nach Radiojodtherapie, sowie ein weiterer Patient mit Metastasen eines NET in der Schilddrüse). Aufgrund der zu geringen Gruppengröße wurden diese sieben Patienten nicht in den Auswertungsmodus einbezogen. Die kompletten Daten von 12 Patienten wurden in beiden Erfassungszeiträumen erhoben. Diese Patienten tauchen in der Auswertung des vorliegenden Erfassungszeitraumes auf, gehen aber in die Gesamtauswertung jeweils nur einfach ein. Tabelle 3 unterteilt die Studienpartizipanten entsprechend der beiden Erfassungszeiträume und vermittelt einen Überblick hinsichtlich des gesamten Patientenkollektives. 21 Tab. 3) Studienpartizipanten entsprechend der beiden Erfassungszeiträume Gruppe 1. Erfassungszeitraum 2. Erfassungszeitraum (09/06 – 07/07) (07/07 – 09/08) Thyreoidektomie 10 0 Normale SD 26 42 Struma und/oder knotig 28 36 4 8 (a) 2 (b) 0 (c) 2 (d) 0 (a) 1 (b) 2 (c) 4 (d) 1 5 3 4 9 umgebaute Schilddrüse Schilddrüsenautonomien Aktive HashimotoThyreoiditis Niedrig aktive Hashimoto-Thyreoiditis Im Anschluss erfolgt zunächst eine Vorstellung der Ergebnisse der vorliegenden Studie (Zeitraum 07/07 bis 09/08). 3.2 Datenzusammenstellung der Ga-68-DOTATOC PET Untersuchungen von 07/07 bis 09/08 An dieser Stelle werden die 102 Studienteilnehmer der hier vorliegenden Arbeit vorgestellt. Im Anschluss wird die Gesamtauswertung mit den bereits publizierten Daten von Lincke et al. (28) dargestellt. 3.2.1 Allgemeine Patientendaten Die verabreichte Aktivitätsmenge von Gallium-68 lag zwischen 67,0 MBq und 274,0 MBq und zeigt einen Mittelwert von 163,4 MBq. Die Spannweite betrug 207,0 MBq, die Standardabweichung lag bei 35,6 MBq. Die nachfolgende Abbildung Nummer 4 illustriert die gruppenspezifischen Schilddrüsenvolumina, Tabelle 4 weist die jeweiligen Mittelwerte pro Gruppe aus. 22 Abb. 4) Gruppenspezifische Gesamtschilddrüsenvolumina 80,00 Gesamtschilddrüsenvolumen 60,00 40,00 20,00 0,00 Normale SD Struma und/oder Knoten SD Autonomien Hoch aktive HD Niedrig aktive HD Gruppenzugehörigkeit entsprechend der SD-Pathologie Tab. 4) Gruppenmittelwerte des Schilddrüsenvolumens Gruppe MW SD-Volumen Gesamt 13,6 ml Normale Schilddrüse 11,6 ml Struma und/oder Knoten 17,0 ml Schilddrüsenautonomien 22,3 ml Hoch aktive Hashimoto-Thyreoiditis 16,9 ml Niedrig aktive Hashimoto-Thyreoiditis 7,4 ml Der größte Mittelwert der Schilddrüsenvolumina findet sich in der Gruppe der Schilddrüsenautonomien (mittleres SDV=22,3 ml). Weiterhin zeigen die Gruppe der hoch aktiven Hashimoto-Thyreoiditiden (HD) sowie die Gruppe der Patienten mit knotig veränderten Schilddrüsen und/oder Strumen erhöhte Schilddrüsenvolumina (mittleres SDV=17 ml). Die kleinsten Volumina finden sich in der Gruppe der niedrig aktiven Hashimoto-Thyreoiditiden (mittleres SDV=7,4 ml). 23 Mittels der folgenden Abbildung Nummer 5 wurde ein möglicher Zusammenhang zwischen der TBR und dem Patientenalter geprüft. In diese Auswertung bezüglich der Abhängigkeit der TBR von dem Patientenalter wurden aufgrund der jeweiligen Gruppenanzahl nur Patienten mit gesunder Schilddrüse, sowie Patienten mit Strumen und/oder knotig veränderten Schilddrüsen eingeschlossen. Das mediane Alter der 78 Patienten liegt bei 57,0 Jahren. Die Range beträgt 57 Jahre, wobei der jüngste Studienteilnehmer 20,0 Jahre und der älteste Studienteilnehmer 77,0 Jahre alt waren. Abb.5) Target-Background-Ratio (TBR) in Abhängigkeit vom Patientenalter TBR (Target-Background-Ratio) 8,0 6,0 4,0 2,0 0,0 20,00 30,00 40,00 50,00 60,00 70,00 80,00 Patientenalter Zwischen dem Alter der untersuchten Studienteilnehmer und der dazu ermittelten Target-Background-Ratio lässt sich anhand der vorliegenden Daten keine statistisch signifikante Korrelation ableiten (Pearson-Korrelation: -0,49, p=0,62). In die hier vorliegende Studie wurden insgesamt 44 Frauen und 54 Männer eingeschlossen. Zwei Studienteilnehmer nach Hemithyreoidektomie, einer nach Radiojodtherapie und ein weiterer Studienteilnehmer mit Metastasen eines Neuroendokrinen Tumors in der Schilddrüse wurden aufgrund der kleinen Fallzahl pro Gruppe ausgeschlossen. 24 Tabelle 5 gibt einen Überblick hinsichtlich der neuroendokrinen Tumorerkrankung der Studienteilnehmer und den mittleren gruppenspezifischen TBR-Werten. Ein Drittel der Studienteilnehmer leidet an Karzinomen des Gastrointestinaltraktes (GIT), 14% an Karzinoiden des GIT. Einige Studienteilnehmer erhielten die Untersuchung mittels Gallium-68 DOTATOC PET bereits wiederholt zur Primumsuche bei vorhandenen Metastasen oder im Zuge einer erneuten Metastasensuche. Einige Teilnehmer erhielten die Untersuchung zur Abklärung einer bestehenden Flush-Symptomatik unter dem Verdacht auf ein Karzinoid-Syndrom. Die Gruppe „Andere“ beinhaltet all jene Patienten, deren neuroendokrines Tumorleiden nicht in die übrigen Gruppen einzuordnen war. Tab. 5) Neuroendokrine Tumorerkrankungen und TBRs Grunderkrankung Verdacht auf NET, der Patientenzahl Mittelwert TBR Median TBR 15 3,2 3,1 10 2,9 2,9 Lungen-Karzinoid 7 2,9 2,8 Lungen-Karzinom 6 3,4 2,6 Karzinoid des 14 3,7 3,9 33 3,0 2,6 13 3,2 3,5 sich im PET nicht bestätigte Primumsuche bei Metastasen oder Rezidivverdacht Gastrointestinaltraktes Karzinom des Gastrointestinaltraktes Andere Hinsichtlich der schilddrüsenspezifischen Medikationseinnahme fanden sich 12 Studienteilnehmer, die regelmäßig Präparate speziell für die Schilddrüse einnehmen. 10 der Patienten nehmen L-Thyroxin in unterschiedlichen Dosierungen zwischen 50 μg und 125 μg ein. Eine weitere Patientin nimmt täglich 200 µg Jodid ein. Die medikamentöse Einstellung auf das Thyreostatikum Methizol 5 mg (Thiamazol) eines Patienten mit Morbus Basedow erfolgte im Studienverlauf. 25 3.2.2 Target-Background-Ratios (TBRs) bei verschiedenen SDPathologien Abbildung 6 stellt die Gruppenzugehörigkeit der Patienten hinsichtlich ihrer Schilddrüsenpathologie und die zugehörigen TBR-Werte dar. Abb. 6) Gruppenzugehörigkeit entsprechend der SD-Pathologie 8,0 TBR 6,0 4,0 2,0 0,0 Normale SD Struma und/oder SD Autonomie Knoten Hoch aktive HD Niedrig aktive HD Gruppenzugehörigkeit entsprechend der SD-Pathologie Fünf Patienten wurden in dem vorliegenden Diagramm nicht erfasst, da sie den bestehenden Gruppen nicht zuzuordnen sind. Eine Auswertung innerhalb einer neuen Gruppe würde aufgrund der geringen Anzahl von ein oder zwei Patienten keine Vergleichbarkeiten zulassen. Bei den Studienteilnehmern handelt es sich um jeweils einen Patienten mit Zustand nach Radiojodtherapie (RIT) und einen weiteren Patienten mit Metastasen eines neuroendokrinen Tumors (NETs) in der Schilddrüse. Zwei Patienten nach Hemithyreoidektomie wurden ebenfalls nicht in den Diagrammen erfasst. Patienten ohne Schilddrüsenpathologie (n=42, Mittelwert TBR=3,28) zeigen im Mittel einen höheren Schilddrüsenuptake im Vergleich zu Patienten mit inaktiven Hashimoto-Thyreoiditiden (n=9, Mittelwert TBR= 2,03). Der Unterschied bezüglich 26 der TBR-Werte zwischen diesen beiden Gruppen ist statistisch signifikant (MannWhitney U-Test: p=0,009). Verglichen mit normalen Schilddrüsen findet sich in der Gruppe von Patienten mit Strumen und/oder knotigen Schilddrüsen kein signifikanter Mittelwertunterschied (Mann-Whitney U-Test: p=0,66) bezüglich des Uptakes (n=36, Mittelwert TBR=3,4). Für die übrigen Gruppen wurde aufgrund der zu geringen Fallzahlen innerhalb der Gruppen auf eine Signifikanztestung verzichtet. In der zusammenfassenden Auswertung des ersten und zweiten Erfassungszeitraumes waren allerdings aufgrund der nun größeren Gruppen weitere Signifikanztestungen möglich (siehe Abschnitt der zusammenfassenden Auswertung der beiden Studienzeiträume). Eine Patientin mit Schilddrüsenuptake autonomem (TBR=5,4). Adenom Die zeigte einen disseminierten erhöhten fokalen Schilddrüsenautonomien präsentieren sich mit vergleichbar hohen Uptake-Werten im Gallium-68-DOTATOC PET (n=4, Mittelwert TBR= 4,80). Ein Patient mit Morbus Basedow, welcher im Studienverlauf diagnostiziert wurde, zeigte ebenfalls erhöhte Uptake-Werte im Ga68-DOTATOC PET (TBR=4,9). Im Anschluss wird das Patientenkollektiv der vorliegenden Studie getrennt nach männlichen und weiblichen Studienteilnehmern betrachtet. Das Säulendiagramm (Abb. 7) illustriert die absoluten Patientenzahlen hinsichtlich der verschiedenen Schilddrüsenpathologiegruppen, sowie eine geschlechtsspezifische Unterscheidung der Studienteilnehmer. 27 Abb. 7) Studienteilnehmer pro SD-Gruppe – getrennt nach männlichen und weiblichen Partizipanten Geschlecht 30 männlich weiblich 25 Patientenanzahl 20 15 10 5 0 Normale SD Struma und/oder Knoten SD Hoch aktive Autonomien HD Niedrig aktive HD Gruppen der Schilddrüsenpathologien Insgesamt wurden 54 Männer und 44 Frauen in die vorliegende Studie eingeschlossen. Die geschlechtsspezifische Auswertung der Patienten zeigt in der Gruppe der vergrößerten Schilddrüsen mit oder ohne Knoten weitestgehende Übereinstimmungen. Die Geschlechtsverteilung ist hier annähernd ausgeglichen. Frauen sind mit 19, Männer mit 17 Gruppenmitgliedern vertreten. In der Gruppe von Patienten mit gesunder Schilddrüse findet sich eine geschlechtsspezifische Diskrepanz. Hier sind die Frauen mit nur 14 Teilnehmern vertreten, die Männer mit 27. Die Gruppe der niedrig aktiven Hashimoto-Thyreoiditiden weist einen klaren Frauenüberhang mit acht von neun Gruppenmitgliedern aus. Die Schilddrüsenautonomien zeigen im Gegensatz dazu einen Männerüberschuss (sieben Männer bei insgesamt acht Gruppenmitgliedern). Die Gruppe der hoch aktiven Hashimoto-Thyreoiditiden umfasst nur drei Patienten, wovon zwei männlich und einer weiblich ist. Aufgrund der geringen Patientenzahlen der drei letztgenannten Gruppen ist es allerdings schwierig, hier eine statistische Tendenz zu erkennen, im Diagramm (Abb. 8) sind deshalb nur die beiden Gruppen dargestellt, die aufgrund der 28 Patientenanzahl innerhalb der Gruppe einen statistisch sinnvollen Vergleich zulassen. Abb. 8) Gruppenzugehörigkeit entsprechend der SD-Pathologiegruppe Geschlecht 8,0 weiblich männlich TBR 6,0 4,0 2,0 0,0 Normale SD Struma und/oder Knoten Gruppenzugehörigkeit entsprechend der SDPathologie In der nachfolgenden Tabelle (Tab. 6) werden die einzelnen Gruppenmittelwerte getrennt nach männlichen und weiblichen Studienteilnehmern betrachtet. Tab. 6) Geschlechtsspezifische Gruppenmittelwerte Gruppe MW TBR ♀ MW TBR ♂ Gesamt 1,16 (44) 1,26 (53) Normale SD 2,8 (15) 3,5 (28) Struma und/oder Knoten 3,4 (18) 3,5 (17) SD Autonomien 5,3 (1) 4,5 (7) Hoch aktive HD 3,6 (2) 3,0 (1) Niedrig aktive HD 2,0 (8) 1,3 (1) Die mittleren TBRs liegen bei der geschlechtsspezifischen Gesamtauswertung annähernd in den gleichen Bereichen, die Unterschiede sind bis auf eine Ausnahme nicht signifikant. 29 Auffällig ist, dass gesunde Schilddrüsen von männlichen Studienteilnehmern hier höhere mittlere TBRs als die Frauenvergleichsgruppe aufweisen (Mittelwert TBR♀=2,8; Mittelwert TBR♂=3,5). Die Frauen sind in der Gruppe der gesunden Schilddrüsen jeweils mit 15, die Männern mit 28 Mitgliedern vertreten. Patienten mit Struma und/oder Knoten verhalten sich hinsichtlich der ermittelten TBRs in der geschlechtsspezifischen Unterteilung wieder annähernd gleich (n♀=18, Mittelwert TBR♀ = 3,4; n♂=17 Mittelwert TBR ♂ = 3,5). Mit Hilfe des Mann-Whitney U-Tests wurden die Unterschiede innerhalb der einzelnen Schilddrüsengruppen geschlechterspezifisch auf Signifikanz getestet. Aufgrund der geringen Patientenzahlen in den Gruppen der SD-Autonomien und der Hashimoto-Thyreoiditiden, konnte die Signifikanztestung nur für die gesunden Schilddrüsen und die Strumen mit oder ohne knotige Veränderungen vorgenommen werden. Tabelle 7 zeigt die ermittelten p-Werte. Tab. 7) p-Werte Gruppenvergleich p - Wert Gesunde SD ♀ und ♂ 0,045 Knoten/Strumen ♀ und ♂ 0,751 Die Ergebnisse demonstrieren, dass die erste Gruppe, welche Patienten mit gesunden Schilddrüsen beinhaltet, einen signifikanten geschlechtsspezifischen Unterschied hinsichtlich der ermittelten TBRs (Mann-Whitney U-Test: p=0,045) aufweist. Nach dieser Aufschlüsselung werden die Gruppen nachfolgend wieder als Gesamtkollektiv betrachtet. Dies geschieht unabhängig von der jeweiligen Zuordnung hinsichtlich des Geschlechts. Tabelle 8 weist die gruppenspezifischen TBR-Werte aus. 30 Tab. 8) Gruppenspezifische Mittelwerte Patientengruppe Patientenanzahl Gruppenspezifische pro Gruppe TBRs Gesamt 98 3,29 ± 1,43 Normale Schilddrüse 42 3,28 ± 1,35 Struma und/oder Knoten der 36 3,43 ± 1,57 SD Autonomien 8 4,61 ± 1,10 Hoch aktive HD 3 3,40 ± 0,38 Niedrig aktive HD 9 2,03 ± 0,50 Schilddrüse Die Schilddrüsenautonomien zeigen signifikant erhöhte TBR-Werte im Vergleich mit allen anderen Gruppen (mittlerer TBR=4,61). Die niedrig aktiven Hashimoto-Thyreoiditiden weisen im Vergleich zu normalen Schilddrüsen erniedrigte TBR-Werte auf. Dieser Unterschied ist statistisch signifikant (Mann-Whitney U-Test: p=0,001). Im Gegensatz dazu stehen die Gruppen der Strumen mit oder ohne Knoten, sowie die normalen Schilddrüsen. Hier liegen die mittleren TBR-Werte zwischen 3,2 und 3,4. Zwischen diesen beiden untersuchten Gruppen lässt sich kein statistisch signifikanter Unterschied der TBRs nachweisen (Mann-Whitney U-Test: p=0,668). Auch zwischen den normalen Schilddrüsen und den hoch aktiven Hashimoto-Thyreoiditiden ergibt sich kein signifikanter Unterschied bezüglich der ermittelten TBR-Werte (Mann-Whitney U-Test: p=0,389). Es folgen einige ausgewählte Ga-68 DOTATOC Kompositionsbilder von Patienten, die im Zeitraum von Juli 2007 bis September 2008 erfasst wurden. Die Patientenbilder, die unter den Abbildungen 17 und 18 zu finden sind, wurden in der Gesamtauswertung nicht mit erfasst, da sie mit ihrer Schilddrüsenpathologie jeweils nur einmal in dieser Studie vertreten waren (ein Patient mit Z.n. RIT und ein weiterer Patient Metastasen eines NET in der Schilddrüse). 31 Abb. 9) Gesunde Schilddrüse Abb. 10) Gesunde Schilddrüse, erhöhter Uptake-Wert Abb. 11) Aktive Hashimoto-Thyreoiditis Abb. 12) Morbus Basedow 32 Abb. 13) Disseminierte Autonomie Abb. 15) Patient mit SD-Metastasen eines Abb. 14) Z.n. Radiojodtherapie Abb. 16) Patient mit kalten Knoten in der SD Neuroendokrinen Tumors in der SD 33 3.2.3 Zusammenhang zwischen Schilddrüsenvolumen und TBRWert Abb. 17) Zusammenhang von SD-Volumen und TBR-Wert TBR 8,0 r = 0,007 6,0 4,0 2,0 0,0 0,00 20,00 40,00 60,00 80,00 Schilddrüsenvolumen (ml) Mittels der Abbildung Nummer 17 wurde unter Einbeziehung der Gruppen gesunde Schilddrüse, sowie Struma mit oder ohne Knoten ein möglicher Zusammenhang zwischen Schilddrüsenvolumen und TBR-Wert untersucht. In der Analyse der hier getesteten 78 Studienteilnehmer lässt sich kein statistisch signifikanter Zusammenhang zwischen Volumen der Schilddrüse und TBR-Wert erkennen (Pearson-Korrelation: 0,007; p=0,951). 3.3 Zusammenfassende Auswertung der Ga-68-DOTATOC PET Untersuchungen von 09/06 bis 09/08 Aufgrund der begrenzten Patientenzahlen in der bereits bestehenden Arbeit von Lincke et al. (28) erfolgte eine fortführende Analyse von Patienten, die eine Ga-68DOTATOC Untersuchung erhielten. Die Gesamtauswertung beider Erfassungszeiträume mit einem nun größeren Patientenkollektiv findet sich im Folgenden. 34 12 Patienten, die aufgrund wiederholter PET-Untersuchungen im Erfassungszeitraum mehrfach in die Studie eingeschlossen wurden, sind jeweils nur einfach in die Gesamtauswertung eingegangen. Gleiches gilt hinsichtlich der Nachkontrollen jener Patienten, die mit erhöhten TBR-Werten im Studienverlauf auffällig wurden. Auch hier fließt jeweils nur der erste erhobene Wert in die Gesamtauswertung mit ein. 3.3.1 Schilddrüsenspezifische Auswertung Die entstandenen coronalen Kompositionsbilder wurden analog zum ersten Erfassungszeitraum mittels vorliegender ROI-Paare ausgewertet. In der PET-Analyse wurde jeweils nur der Koronarschnitt mit der intensivsten Traceranreicherung über der Schilddrüsenregion ausgewählt. Abbildung 18 zeigt alle 165 Studienteilnehmer, die in der Gesamtauswertung eingeschlossen wurden. In den nachfolgenden Auswertungen werden die kleinen Gruppen (Hemithyreoidektomie mit insgesamt 5 Patienten, sowie Zustand nach Radiojodtherapie mit einem Patienten und Metastasen eines neuroendokrinen Tumors in der Schilddrüse bei einem weiteren Patienten) aufgrund der geringen Patientenzahl vernachlässigt. 35 Abb. 18) Alle Schilddrüsenpathologiegruppen Gesamtzahl der Patienten 60 40 20 0 mie kto e d oi yre h le T ta To n SD n HD HD mie ote ale tive tive no m k k Kn r o t a a o r n e g Au ch dri /od Ho SD nd Nie u a um Str Gruppen der Schilddrüsenpathologien In der nachfolgenden Tabelle 9 werde alle erfassten Ga-68-DOTATOC Patienten entsprechend der einzelnen Gruppen (analog zu der Gruppeneinteilung von Lincke et al. (28) dargestellt. Tab. 9) Schilddrüsenpathologiegruppen Gruppe Anzahl der Patienten Studienteilnehmer gesamt 165 Thyreoidektomie 10 Normale Schilddrüse 64 Struma und/oder knotig umgebaute Schilddrüse 61 SD Autonomien 11 (a) 3 (b) 2 (c) 6 Morbus Basedow 1 Hoch aktive Hashimoto-Thyreoiditis 7 Niedrig aktive Hashimoto-Thyreoiditis 11 36 3.3.2 Allgemeine Patientendaten Die verabreichte Aktivität erstreckt sich über alle Gruppen von 67,0 MBq bis 274,0 MBq und zeigt einen Mittelwert von 174,5 MBq. Die Spannweite beträgt 207,0 MBq, die Standardabweichung liegt bei 34,5 MBq. Die nachfolgende Abbildung Nummer 19 illustriert die gruppenspezifischen Schilddrüsenvolumina, Tabelle 10 weist die jeweiligen Mittelwerte pro Gruppe aus. Abb. 19) Gruppenzugehörigkeit entsprechend der Schilddrüsenpathologien 80,00 Gesamtschilddrüsenvolumen 60,00 40,00 20,00 0,00 Normale SD Struma und/oder Knoten SD Autonomien Hoch aktive HD NIedrig aktive HD Gruppenzugehörigkeit entsprechend der SD-Pathologie Tab. 10) Gruppenmittelwerte des Schilddrüsenvolumens Gruppe MW SD - Volumen Gesamt 15,7 ml Normale SD 11,6 ml Struma und/oder Knoten 18,4 ml SD Autonomien 25,1 ml Hoch aktive Hashimoto-Thyreoiditis (HD) 22,3 ml Niedrig aktive Hashimoto-Thyreoiditis (HD) 9,2 ml 37 Die höchsten Schilddrüsenvolumina finden sich bei der gemeinsamen Auswertung in der Gruppe der Schilddrüsenautonomien (mittleres SDV=25,1 ml). Verglichen mit dem Gesamtkollektiv zeigen weiterhin die Gruppe der hoch aktiven HashimotoThyreoiditiden und auch die Gruppe von Patienten mit knotig veränderten Schilddrüsen und/oder Strumen erhöhte Volumina. Die kleinsten Schilddrüsenvolumina finden sich in der Gruppe der niedrig aktiven HashimotoThyreoiditiden (mittleres SDV=9,2 ml). Die folgende Abbildung Nummer 20 stellt die Target-Background-Ratio in Abhängigkeit vom Patientenalter dar. In diese Auswertung wurden jeweils, aufgrund der Anzahl an Gruppenmitgliedern nur Patienten mit gesunder Schilddrüse, sowie Patienten mit Strumen und/oder knotig veränderten Schilddrüsen eingeschlossen. Abb. 20) Target-Background-Ratio (TBR) in Abhängigkeit vom Patientenalter TBR 8,0 7,0 6,0 5,0 4,0 3,0 2,0 1,0 20,00 30,00 40,00 50,00 60,00 70,00 80,00 90,00 Patientenalter Das mediane Alter der 124 Patienten liegt bei 59,0 Jahren. Die Range beträgt 61 Jahre, wobei der jüngste Studienteilnehmer 20,0 Jahre und der älteste Studienteilnehmer 81,0 Jahre alt waren. Zwischen dem Alter der Patienten und der 38 dazu ermittelten Target-Background-Ratio lässt sich keine statistisch signifikante Korrelation erkennen (Pearson-Korrelation: -0,11, p=0,24). Insgesamt wurden 75 Frauen und 90 Männer in die zusammenfassende Auswertung der beiden Erfassungszeiträume eingeschlossen. Mittels Korrelations- und Regressionsanalyse wurde bei den 165 Studienteilnehmern geprüft, ob sich ein möglicher Zusammenhang zwischen dem ermittelten Anti-TPO-Antikörper-Wert und dem zugehörigen TBR-Wert finden lässt. In 25 Fällen zeigten sich detektierbare Anti-TPOAntikörper, welche über der Nachweisgrenze von 28 U/ml lagen. Eine statistisch signifikante Korrelation konnte anhand der vorliegenden Daten nicht gezeigt werden (Pearson-Korrelation: 0,082; p=0,305). 3.3.3 Target-Background-Ratios (TBRs) bei verschiedenen SDPathologien Die folgende Grafik zeigt die Target-Background-Ratios der jeweiligen Gruppen bei verschiedenen Schilddrüsenpathologien. Abb. 21) Gruppenzugehörigkeit entsprechend der SD-Pathologien 39 Hier werden die Studienteilnehmer entsprechend der zugeteilten Gruppen hinsichtlich ihrer Schilddrüsenpathologie in einem Box-Plot graphisch dargestellt. In der vorliegenden Statistik konnten Daten von insgesamt 165 Patienten verwendet werden. Die Gruppen „Zustand nach Radiojodtherapie“, „Metastasen eines NET in der Schilddrüse“ sowie die „Hemithyreoidektomie-Gruppe“ wurden in diese Gesamtauswertung nicht einbezogen. Ebenso fließen die Ergebnisse von Mehrfachuntersuchungen am gleichen Patienten nur einmalig ein. So erklärt sich die Diskrepanz der Summe von Patienten beider Erfassungszeiträume und der Summe der Gesamtpatientenzahl. Abbildung 22 zeigt getrennt nach männlichen und weiblichen Studienteilnehmern die TBRs bei verschiedenen Schilddrüsenpathologien. Abb. 22) Gruppen der SD-Pathologien – getrennt nach männlichen und weiblichen Partizipanten Geschlecht 40 männlich weiblich Patientenanzahl 30 20 10 0 Totale Thyreoidektomie normale SD Struma und/oder SD Autonomien Knoten Hoch aktive HD Niedrig aktive HD Gruppen der Schilddrüsenpathologien 40 Die Abbildung demonstriert die geschlechtsspezifische Verteilung der Patienten innerhalb der verschiedenen Schilddrüsengruppen. Insgesamt wurden 90 männliche und 75 weibliche Studienteilnehmer in diese Auswertung eingeschlossen. Die geschlechtsspezifische Auswertung der Patientendaten zeigt in der Gruppe mit den vergrößerten Schilddrüsen mit beziehungsweise ohne Knoten, weitgehende Übereinstimmung hinsichtlich der mittleren TBRs. Zudem weist diese Gruppe eine annähernd gleiche geschlechtsspezifische Aufteilung auf (30 Männer und 31 Frauen). Auch in der Gruppe von Patienten mit Zustand nach totaler Thyreoidektomie zeigen sich nach den Geschlechtern getrennt weitestgehende Übereinstimmungen bezüglicher der erhobenen TBR-Werte. In der Gruppe der Patienten mit gesunder Schilddrüse findet sich allerdings eine geschlechtsspezifische Diskrepanz. Die männlichen Studienteilnehmer (n=40) weisen in ihrer Gruppe im Mittel die höheren TBR-Werte auf (TBR=3,2). Die Frauen (n=24) zeigten mittlere TBRs von 2,4. Dieser Unterschied in den TBRs ist als statistisch signifikant anzusehen (p=0,002). Die übrigen Gruppen konnten aufgrund der geringen jeweiligen Patientenzahl nicht weiter auf geschlechtsspezifische Unterschiede untersucht werden. In der folgenden Grafik wird die geschlechtsspezifische Aufteilung des Patientenkollektives veranschaulicht. 41 Abb.23) Gruppenzugehörigkeit entsprechend der SD-Pathologie Geschlecht 10,0 männlich weiblich 8,0 TBR 6,0 4,0 2,0 0,0 Totale Thyreoidektomie normale SD Struma und/oder SD Autonomie Knoten Hoch aktive HD NIedrig aktive HD Gruppenzugehörigkeit entsprechend der Schilddrüsenpathologie Die nachfolgende Tabelle Nummer 11 gibt eine Gesamtübersicht hinsichtlich der gruppenspezifischen TBRs. Dargestellt sind die Klassifikationskriteren bezüglich der Pathologiegruppen sowie die Anzahl von Männern und Frauen je Gruppe. 42 Tab.11) Zusammenfassung: Gruppenspezifische TBRs Gruppe Klassifikationskriterien Männer Frauen Patienten- TBR zahl Median (Min - Max) Thyroidektomie Z. n. Thyreoidektomie 5 5 10 1,18 1,24 (0,9-1,5) Schilddrüse/ Normaler Ultraschall unauffälliges Labor keine Hinweise auf SD-Erkrankungen in keine der Anamnese und bei der SD- Pathologien Untersuchung Struma und/ SD-Volumen bei Männern bei Frauen Normale ≥ 25 ml, ≥ 18 ml 40 24 64 2,89 2,63 (1,2-7,3) 30 28 58 3,12 oder knotig umgebaute Schilddrüse 2,91 und/oder: (1,2-7,6) knotige Veränderungen der Schilddrüse bei Knoten ≥ 1 cm zusätzlich per Szintigrafie Autonomie ausgeschlossen SD Autonomien durch Laboruntersuchung ausgeschlossen SchilddrüsenAutonomien: a) Unifokale Autonomie a) szintigraphisch heiße Knoten, negative TRAKs 1 2 3 7,2 6,4 (5,3-9,7) b) Multifokale Autonomie b) szintigraphisch heiße Knoten, negative TRAKs 2 0 2 3,4 / 4,9 c) Disseminierte Autonomie c) supprimiertes TSH, diffus erhöhter szintigraphischer Uptake, negative TRAKs 5 1 6 4,89 5,12 (2,8-6,3) Morbus positive TRAKs 1 0 1 4,9 Basedow Hoch aktive HD Anti-TPO-AK deutlich erhöht (>500 U/mL) keine Anzeichen für einen Morbus Basedow auf Grundlage 3,72 3 4 7 3,45 (1,8-7,1) 43 Niedrig aktive HD des Labors und der klinischen Untersuchung SD-Volumen erhöht Anti-TPO-AK moderat erhöht (>60 U/mL aber < 500 U/mL) hypodenses Echomuster 2 9 11 1,97 2,01 (1,1-2,7) Kalte Knoten Szintigraphisch kalte Knoten 1 2 3 3,68 4,75 (1,5-4,9) Im Studienverlauf fielen drei Patienten mit kalten Knoten auf, diese sind in Tabelle 11 extra aufgeführt. In den übrigen Auswertungsmodi bilden diese Patienten aufgrund der geringen Anzahl keine eigene Schildrüsenpathologiegruppe, sondern finden sich in der Gruppe der Strumen mit bzw. ohne knotige Veränderungen wieder. Ein Patient, bei dem im Studienverlauf ein Morbus Basedow diagnostiziert wurde, ist in der Tabelle ebenfalls extra aufgeführt, er wird aber in den Auswertungsmodi jeweils der Schilddrüsenautonomie-Gruppe zugerechnet. Die Gruppe der Schilddrüsenautonomien zeigt in der Auswertung signifikant erhöhte TBR-Werte im Vergleich mit den übrigen Gruppen. Die ermittelten TBRs bei thyreoidektomierten Patienten liegen tendenziell im unteren Bereich nahe 1,0. Auch die niedrig aktiven Hashimoto-Thyreoiditiden weisen im Vergleich zu normalen Schilddrüsen erniedrigte TBR-Werte auf. Die Unterschiede hinsichtlich der TBRs differieren in diesem Fall signifikant (Mann-Whitney U-Test: p=0,008). Im Gegensatz dazu stehen die Gruppen der Strumen mit oder ohne Knoten, sowie die normalen Schilddrüsen. Hier finden sich jeweils mittlere TBR-Werte zwischen 2,8 und 3,1. Eine statistisch signifikante Unterscheidung der TBR-Werte bezüglich dieser beiden Gruppen ist nicht möglich (Mann-Whitney U-Test: p=0,164). Die aktiven Hashimoto-Thyreoiditiden liegen verglichen mit beiden Gruppen tendenziell gering höher mit TBR-Werten um 3,7. Eine statistisch signifikante Unterscheidung der aktiven Hashimoto-Thyreoiditiden ist weder im Vergleich mit den normalen Schilddrüsen (Mann-Whitney U-Test: p=0,081), noch mit den Strumen, mit oder ohne knotige Veränderungen, (Mann-Whitney U-Test: p=0,218) möglich. 44 3.3.4 Intraindividuelle Differenzen bezüglich des schilddrüsenspezifischen Uptakes bei wiederholten Untersuchungen am selben Patienten In einigen Fällen wurden Patienten wiederholt in der Studie erfasst, da sie im Rahmen der Suche nach neuroendokrinen Tumoren oder Metastasen erneut vorstellig wurden. Auf diesem Wege konnten die schilddrüsenspezifischen Untersuchungsdaten von insgesamt 12 Patienten ein zweites Mal studienspezifisch erfasst werden. Hier wurde darauf geachtet, dass Studienteilnehmer, die bereits im ersten Durchgang in die Auswertung eingeschlossen wurden, in die Gesamtauswertung nur einfach eingehen. In den genannten Fällen erfolgte eine vergleichende Analyse von Erst- und Wiederholungsuntersuchung hinsichtlich des Radiotraceruptakes, der sonographischen Beurteilung der Schilddrüse, sowie eine Laborparameterkontrolle. Diese umfasste eine Bestimmung des TSH-Wertes, sowie der Anti-TPO-Antikörper. Um mögliche Veränderungen zu erfassen, wurde die schilddrüsenspezifische Anamnese ein zweites Mal erhoben. Die nachfolgende Zusammenstellung (Tab.12) gibt einen Überblick über die Ergebnisse dieser Verlaufskontrollen. Tab. 12) Verlaufskontrollen Pat. SD-Gruppe Nr. TBR TBR Abstand in Veränderung? (1) (2) Monaten 4 Z.n. Hemithyreoidektomie 2,8 2,5 8 Keine 24 Nicht aktive HD 1,2 1,4 7 Keine 26 Keine SD-Pathologie 2,2 2,2 9 Keine 94 Keine SD-Pathologie 1,9 1,8 15 Keine 98 Hoch aktive HD 3,1 3,0 5 TPO rückläufig, Volumen geringer (von 29 ml auf 19 ml) 100 Z.n. Hemithyreoidektomie 2,2 2,3 14 ein neu aufgetretener Knoten rechts 45 101 Metastasen eines 5,7 6,5 4,5 Keine 1,0 1,1 12 TPO rückläufig, neuroendokrinen Tumors in der SD 102 Inaktive HD TSH Anstieg 104 SD Knoten, keine Struma, 2,5 2,4 11 Keine keine Autonomie 109 Keine SD-Pathologie 3,8 4,0 12 Keine 118 Nicht aktive HD 1,9 2,3 15 TPO rückläufig 150 SD Knoten, keine Struma, 1,0 1,0 16 TSH Anstieg keine Autonomie (latente Hypothyreose) In der oben stehenden Tabelle 12 sind jeweils die ermittelten TBR-Werte der Erstund Zweituntersuchung (TBR 1 und TBR 2) dargestellt. Diese absoluten Werte differieren untereinander jeweils nur in einem geringen Maß und lassen eine weitestgehende Übereinstimmung der TBRs von Erst- und Kontrolluntersuchung erkennen. Hinsichtlich der sonographischen Beurteilung der Schilddrüse finden sich keine signifikanten Unterschiede. Geringere Schwankungen, bezüglich der bestimmten Schilddrüsenvolumina, können aufgrund unterschiedlicher Untersucher erklärt werden. Mit Ausnahme eines Falles zeigten sich hinsichtlich der bestimmten Schilddrüsenparameter geringe, jedoch allzeit normwertige Schwankungen. Patient Nummer 150 entwickelte im Studienverlauf eine latente Hypothyreose und wurde daraufhin auf L-Thyroxin 50 μg eingestellt. Zusammenfassend zeigten sich geringe Schwankungen bezüglich der Untersuchungsergebnisse beim selben Patienten im Verlauf. Die Unterschiede bezüglich der ermittelten TBRs sind bei lediglich geringen Abweichungen statistisch nicht signifikant (Mann-Whitney U-Test: p=0,98). Die mittlere Abweichung der ermittelten TBRs zwischen Erst- und Zweituntersuchung beträgt 0,2. Der maximale Unterschied zwischen Erst- und Zweituntersuchung beträgt 0,8. Der mediane Untersuchungsabstand liegt bei 10,7 Monaten. 46 3.3.5 Kontrolluntersuchungen von gesunden Schilddrüsen mit verhältnismäßig hohen Uptake-Werten Bei der Datenerfassung fielen insgesamt 15 Studienteilnehmer mit gesunden Schilddrüsen (unauffällige Schilddrüsensonographie, normale Laborparameter, blande schilddrüsenspezifische Anamnese, sowie klinische Untersuchung), aber relativ erhöhten TBR-Werten (TBR>4,0) im DOTATOC PET auf. In acht Fällen war es möglich, eine schilddrüsenspezifische Folgeuntersuchung durchzuführen. Hierbei erhielten die Teilnehmer eine erneute Schilddrüsensonographie sowie eine Analyse der schilddrüsenspezifischen Laborparameter. Der mittlere Untersuchungsabstand zwischen Erst- und Wiederholungsuntersuchung liegt bei 11,4 Monaten (Range 6 Monate bis 14 Monate). Abbildung Nummer 24 zeigt das DOTATOC PET Kompositionsbild eines Patienten mit gesunder Schilddrüse und erhöhtem Radiotraceruptake in der Untersuchung. Abb. 24) DOTATOC PET In der Folge sind die Schilddrüsensonographie desselben Patienten dargestellt. Gezeigt wird eine gesunde Schilddrüse mit homogenem und echonormalem Schilddrüsenbinnenmuster. 47 Abb. 25) Linker Schilddrüsenlappen Abb. 26) Rechter Schilddrüsenlappen Die folgende Tabelle Nummer 13 fasst die durchgeführten Kontrolluntersuchungen zusammen. Tab. 13) Verlaufskontrollen Patient TBR Abstand Veränderung? in Monaten 1 3,5 16 Labor: normwertig Sono: keine Knoten, SD Volumen 9 ml geringer 2 3,8 15 Labor: normwertig Sono: keine Veränderung 3 4,5 14 Labor: normwertig Sono: keine Knoten, SD Volumen 4 ml geringer 4 4,5 11 Labor: normwertig Sono: keine Knoten, SD Volumen 3 ml geringer 5 4,6 9 Labor: normwertig Sono: ein kleiner Knoten rechts neu 6 5,8 7 Labor: normwertig Sono: keine Veränderung 48 7 6,8 9 Labor: normwertig Sono: keine Veränderung 8 7,3 10 Labor: normwertig Sono: keine Veränderung Hinsichtlich des Anti-TPO-Antikörper-Wertes ergaben sich keine signifikanten Unterschiede. Die TSH-Werte waren jederzeit im normwertigen Bereich. Der Ultraschall der Schilddrüse zeigte jeweils homogene Schilddrüsenmuster mit geringen Volumenschwankungen. Bei allen acht Studienteilnehmern, die sich für eine erneute Kontrolle bereiterklärt haben, konnten keine signifikanten Veränderungen der Schilddrüse festgestellt werden. Bei 15 Patienten, die im Studienverlauf durch knotige Schilddrüsen mit einem maximalen Knotendurchmesser von 10 mm auffielen, erfolgte eine szintigraphische Beurteilung der Schilddrüse, diese sind in der nachfolgenden Tabelle 14 aufgewiesen. Tab. 14) Szintigraphieergebnisse Szintigraphische Tc-99m TBR Schilddrüsen- Patientenzahl Charakterisierung Pertechnetat- (Ga-68-DOTATOC pathologiegruppe der Uptake im PET) Schilddrüsenknoten Knotenbereich Heißer Knoten Ja (stark) 7,20 Schilddrüsenautonomie 3 Kalter Knoten Nein 3,70 Kalte Knoten (Struma 3 und/oder knotige SD) Isointenser Knoten Ja (schwach) 2,83 Struma und/ oder 9 knotige SD Drei Patienten mit unifokalen Schilddrüsenautonomien zeigten in der durchgeführten Tc-99m Pertechnetat Untersuchung erhöhte Uptake-Werte im Knotenareal. Bei neun weiteren Patienten wiesen die sonographisch detektierten Knoten nur geringe Uptake-Werte auf. Kalte Knoten zeigten keine erhöhten Uptake- Werte in der durchgeführten Schilddrüsenszintigraphie. 49 3.3.6 Prüfung auf Korrelation zwischen der applizierten Ga-68Aktivität und den zugehörigen TBR-Werten Im Folgenden wurde untersucht, ob sich ein Zusammenhang bezüglich der applizierten Aktivität von Ga-68 und den zugehörigen TBR-Werten finden lässt. Die Analyse erfolgte jeweils unter Einbeziehung der Gruppen gesunde Schilddrüse, sowie Strumen und/oder Knoten der Schilddrüse. Es zeigt sich ein schwacher statistisch aber nicht signifikanter, negativer Zusammenhang zwischen der applizierten Aktivität von Ga-68 und dem TBR-Wert (Pearson-Korrelation: -0,20, p=0,084). Dieses Ergebnis legt nahe, dass die Unterschiede der TBRs innerhalb der Gruppen nicht auf die applizierte Aktivität des Radiotracers rückführbar sind. Wie in dem Kapitel Material und Methoden bereits erwähnt, führte die Nuklearmedizin der Universität Leipzig 10/07 einen Wechsel des PET-Scanners durch. Bis zu diesem Zeitpunkt wurden alle Patienten mit dem ECAT EXAT HR+ Tomographen der Firma Siemens untersucht. Im Oktober erfolgte dann die Umstellung des Tomographen auf das Gerät Biograph 16 PET/CT der Firma Siemens. Alle Patienten, die im Zeitraum von 10/07 bis 9/08 in die Studie eingeschlossen wurden, erhielten eine PET-Untersuchung mit diesem Gerät. Im Rahmen von Verlaufsuntersuchungen wurden bei einigen Patienten repetitiv PETScans durchgeführt. Daraus ergibt sich, dass jene Patienten eine Untersuchung mit beiden Scannern erhielten. Die so gewonnenen Daten wurden für die Überprüfung der Vergleichbarkeit der Daten in der vorliegenden Studie mit verwendet. Die untersuchten Patienten sind weder in der ersten, noch in der zweiten Studie erfasst, da diese Kontrollen erst im Zeitraum 12/09 bis 03/10 durchgeführt wurden. Es liegen Daten von 10 untersuchten Patienten vor. Die nachfolgende Tabelle zeigt die ermittelten TBRs bei gleichen Patienten, die mit beiden Geräten untersucht wurden. 50 Tab. 15) TBR-Werte (a) EXAT HR+ Tomograph der Firma Siemens und (b) Biograph 16 PET/CT der Firma Siemens Patient 1 2 3 4 5 6 7 8 9 10 TBR (a) 5,6 4,2 2,5 4,7 3,1 1,5 2,6 4,0 2,1 3,2 TBR (b) 4,6 5,5 2,6 4,1 3,1 1,0 2,7 3,1 1,4 3,0 Gegenübergestellt werden im Folgenden die statistischen Kenngrößen der beiden Untersuchungsdurchläufe in Tabelle Nummer 16. Tab. 16) Statistische Werte Wert (a) (b) Mittelwert 3,4 3,1 Median 3,2 3,1 Standardabweichung 1,3 1,4 Varianz 1,6 1,9 Spannweite 4,1 4,5 Um eine Vergleichbarkeit der ermittelten Daten zu rechtfertigen, wurden die Unterschiede bezüglich der ermittelten TBRs mit Hilfe des Wilcoxon-Tests auf Signifikanz untersucht (p=0,213). Die nachfolgenden Abbildungen (27 und 28) zeigen die PET-Aufnahmen eines Patienten durchgeführt mit a) dem ECAT EXAT HR+ Tomographen und b) dem Biographen 16 PET/CT (die blaue ROI wurde in der Gesamtauswertung vernachlässigt). 51 Abb. 27) ECAT EXAT HR+ Tomograph Abb. 28) Biograph 16 PET/CT Die ermittelten TBRs weisen keine signifikanten scannerabhängigen Unterschiede auf. So kann angenommen werden, dass eine Vergleichbarkeit der Daten weiterhin gegeben ist. 3.4. Vergleich der ermittelten TBR-Werte bei Ga-68-DOTATOC PET und In-111-Octreotidszintigraphie Bezugnehmend zu der Arbeit von Singer (27) erfolgt an dieser Stelle ein zusammenfassender Vergleich des Gallium-Uptakes mit den ermittelten UptakeWerten der Octreotidszintigraphie. Die Indium-111-Octreotidszintigraphie ist ebenfalls ein nuklearmedizinisches Untersuchungsverfahren, welches die Darstellung von neuroendokrinen Tumoren erlaubt. Das Somatostatin-Analogon DTPA-Octreotid (Pentetreotid) wird bei diesem Verfahren mit dem Gammastrahler Indium-111 gekoppelt. Man erhält statischplanare Teil- und Ganzkörperaufnahmen (27). Bei einem Vergleich der ermittelten TBR-Werte beider Untersuchungsverfahren ist zu beachten, dass die statisch planare Analyse jeweils das Gewebe, welches vor bzw. hinter der Schilddrüse liegt, mit einbezieht. Im Auswertungsmodus der coronalen Schnittbilder der Ga-68-DOTATOC Untersuchung wurden, wie oben beschrieben, nur der jeweils am stärksten anreichernde Schnitt mit einem Zentimeter Dicke 52 gewählt und analysiert. Nachteil dieser Methode ist, dass nicht das gesamte Schilddrüsengewebe in die Auswertung einbezogen wird. Wie bereits mehrfach beschrieben (6, 28, 32) ergab die Auswertung der Ga-68DOTATOC Kompositionsbilder deutlich höhere TBR-Werte im Vergleich zu den statisch-planaren Bildern der Octreoscan Analyse. Hinzu kommt eine höhere räumliche Auflösung der coronalen Schnittbilder der Ga-68-DOTATOC Analyse. Die folgende Tabelle stellt die gruppenspezifisch ermittelten TBRs beider Verfahren gegenüber. Tab. 17) Gruppenspezifische TBRs beider Verfahren (27) Gruppe MW TBR In-111 MW TBR Ga-68 24h p.i. Absolute Differenz Gesamt 1,30 3,03 1,73 Thyreoidektomie 1,00 1,20 0,20 Normale SD 1,20 2,89 1,69 Struma und/oder 1,45 3,12 1,67 SD-Autonomien 1,80 5,28 3,48 Hoch aktive HD 1,40 3,72 2,32 Niedrig aktive HD 1,20 1,97 0,77 Knoten Die Differenzen der TBRs zwischen Gallium-68-DOTATOC PET und Indium-111Octreotid ist in den Gruppen mit hohen TBRs im Verhältnis größer. Dies gilt vor allem für die Schilddrüsenautonomien, sowie für die Gruppe der hoch aktiven Hashimoto-Thyreoiditiden. Ein minimaler Unterschied hinsichtlich der Radiotraceraufnahme findet sich hingegen in der Gruppe der Patienten nach Thyreoidektomie. Abgesehen von den Unterschieden der maximalen TBR-Werte zeigen beide nuklearmedizinischen Verfahren ein ähnliches Anreicherungsmuster bei verschiedenen Schilddrüsenpathologien. So lagen die ermittelten Werte für Patienten nach Thyreoidektomie nahe 1,0. Die niedrig aktiven Hashimoto-Thyreoiditiden weisen in beiden Verfahren jeweils niedrigere TBRs im Vergleich mit den gesunden 53 Schilddrüsen, sowie auch mit den Strumen und/oder knotig veränderten Schilddrüsen auf. Außerdem konnte ein klar nachweisbarer Radiotraceruptake im Fall von gesunden Schilddrüsen bestätigt werden (27, 28). Dieser ist statistisch signifikant im Vergleich mit Patienten nach Thyreoidektomie (Mann-Whitney U-Test: p<0,001). 4. Schlussfolgerung und Diskussion 4.1 Beurteilung und Diskussion der dargestellten Ergebnisse In der vorliegenden Studie wurde die Gallium-68-DOTATOC PET Anreicherung in der Schilddrüse bei verschiedenen Schilddrüsenpathologien untersucht. Dies geschah jeweils bezugnehmend auf die veröffentlichte Arbeit von Lincke et al. (28). Die vorliegenden Ergebnisse wurden zunächst einzeln und im Anschluss zusammenfassend analysiert und ausgewertet. Aufgrund des nun zahlenmäßig größeren Patientenkollektives konnten auch innerhalb der einzelnen Schilddrüsenpathologiegruppen höhere Fallzahlen erreicht werden. Die von Lincke et al. (28) und auch in weiteren Veröffentlichungen (33, 34, 65, 66) beschriebenen Tendenzen der Radiotracer Anreicherung bei verschiedenen Schilddrüsenpathologien lassen sich auch an den Werten der gemeinsamen Auswertung aller Patientendaten erkennen. In beiden Studien finden sich weitestgehende Übereinstimmungen hinsichtlich der Radiotracerakkumulation innerhalb der einzelnen Schilddrüsenpathologiegruppen. Der Auswertungsmodus wurde in der vorliegenden Studie analog der Arbeit von Singer (27) und Lincke et al. (28) durchgeführt, um eine Vergleichbarkeit der erhobenen Werte zu gewährleisten. Zusammenfassend zeigen die Ergebnisse der ermittelten TBR-Werte, dass Patienten mit gesunden Schilddrüsen (n=64) statistisch signifikant höhere TBRs aufweisen, als Patienten nach Thyreoidektomie (n=10; p<0,001). Im Gegensatz dazu stehen Studien von Becker et al., hier wurde kein signifikanter Uptake bei 12 untersuchten gesunden Schilddrüsen gefunden (9). Die vorliegenden Ergebnisse sprechen für einen basalen Uptake von Somatostatin analogen Verbindungen der Schilddrüse, dem nicht zwangsläufig pathologische 54 Vorgänge zu Grunde liegen müssen. Diese Erkenntnis steht im Einklang mit Druckenthaner, der eine vermehrte SSTR 2-Expression in gesundem Schilddrüsengewebe nachweisen konnte (38). Ein spezifischer, basaler Uptake der Schilddrüse ist also wahrscheinlich. Der Mittelwert der TBR-Werte für Patienten mit gesunden Schilddrüsen beträgt in der zusammenfassenden Auswertung der Gallium68-DOTATOC PET Untersuchung 2,89 (Median: 2,63; Min.: 1,2; Max.: 7,3). Die vorliegende Zusammenstellung von Ergebnissen befasst sich, mit Ausnahme eines Patienten, mit der Analyse benigner Schilddrüsenerkrankungen. Bei diesem Patienten liegt eine Metastase eines neuroendokrinen Lungentumors innerhalb der Schilddrüse vor. Die statistisch höchsten TBR-Werte lassen sich in der Gruppe von Patienten mit verschiedenen Schilddrüsenautonomien finden. Hierzu zählen drei entdeckte autonome Adenome, sowie sechs Patienten mit einer disseminierten Schilddrüsenautonomie und zwei Patienten mit einer multifokalen Autonomie. Innerhalb der Gruppe der Schilddrüsenautonomien findet sich ein weiterer Patient mit Morbus Basedow. Die medikamentöse Einstellung auf Methizol erfolgte im Studienverlauf. Im Fall der drei autonomen Adenome konnte jeweils eine klar abgrenzbare Tracerakkumulation beobachtet werden. Die Patienten mit disseminierter Autonomie präsentierten im Gegensatz dazu einen eher diffusen, über die gesamte Schilddrüse verteilten Radiotraceruptake. Gleiches gilt für den Patienten mit Morbus Basedow. Im Einklang mit bereits veröffentlichten Studien (9, 33, 67) und den Ergebnissen von Lincke et al. (28) bestätigt die vorliegende Arbeit erhöhte Uptake-Werte in den meisten Fällen von hoch aktiven Hashimoto-Thyreoiditiden. Ein erhöhtes Uptakeverhalten in den meisten Fällen von aktiven Hashimoto-Thyreoiditiden und in Fällen der Morbus Basedow Erkrankung (9, 33, 67) ist höchstwahrscheinlich zurückzuführen auf eine erhöhte SSTR-Expression aufgrund einer lymphozytären Schildrüseninfiltration (33). Während der gesamten Studienlaufzeit konnten sieben Patienten mit einer hoch aktiven Hashimoto-Thyreoiditis herausgefiltert werden. Die ermittelten TBRs liegen in 55 dieser Gruppe höher als in der Gruppe mit den gesunden Schilddrüsen. In einem Fall zeigte sich sogar ein stark erhöhter TBR-Wert von 7,1. Moderat erhöhte Werte fanden sich bei den aktiven Hashimoto-Thyreoiditiden bei vier weiteren Studienmitliedern (3,4; 3,5; 3,8 und 3,8). Alle Patienten mit aktiver HashimotoThyreoiditis zeigen im Vergleich zu Patienten mit autonomen Adenomen einen eher diffus über die Schilddrüse verteilten Radiotraceruptake. Ein erhöhter In-111 Pentetreotide- und Ga-68-DOTATOC-Uptake wurde bereits in zahlreichen Studien diskutiert und nachgewiesen (9, 27, 28, 34, 66, 67). Erhöhte Tracerakkumulationen im Fall von Schilddrüsenautonomien stehen in Übereinstimmung mit einer Publikation von Becker et al. (9). Vermutet wird, dass es eine Assoziation zwischen dem Radiotraceruptake und einem bestehenden Jodmangel geben könnte. Beschrieben wird dies vor allem für die Jodmangelstrumen, aber auch für jegliche Arten der Schilddrüsenautonomien, die stets mit einem relativen Jodmangel einhergehen. In diesen Fällen zeigen sich jeweils klar erhöhte Uptake-Werte in der Untersuchung. Desweiteren versucht Becker eine Erklärung für die erhöhten TBRs in einigen Fällen von aktiven Hashimoto-Thyreoiditiden, sowie weiteren autoimmunen Schilddrüsenerkrankungen zu finden (9). Beschrieben wird die Infiltration des Schilddrüsengewebes mit Lymphozyten bei der Hashimoto-Thyreoiditis, sowie in Fällen von Morbus Basedow bzw. des Marine-Lenhart-Syndroms (9, 33, 67). Die Präsenz von SSTR 2Rezeptoren auf Lymphozyten konnte bereits nachgewiesen werden (33). Weiterhin zeigte sich im Studienverlauf, dass Teilnehmer, bei denen Strumen und Knoten beziehungsweise jeweils nur Strumen oder nur Knoten gefunden wurden, im Vergleich zu gesunden Schilddrüsen, keinen statistisch signifikant erhöhten Radiotraceruptake aufweisen. Die dezent erhöhten Uptake-Werte von Strumen und/ oder knotigen Schilddrüsen gemäß Lincke et. al. konnten mit einem größeren Patientenkollektiv in dieser Arbeit demnach nicht bestätigt werden (28). Der Grund, warum einzelne knotige Schilddrüsen und Strumen leicht erhöhte Radiotraceruptake-Werte zeigten, kann zu diesem Zeitpunkt nicht endgültig geklärt werden. Möglicherweise liegt die Begründung in dem Vorhandensein von kalten Knoten bei einigen untersuchten Schilddrüsen, welche für die erhöhten UptakeWerte verantwortlich sind. In der vorliegenden Studie konnten lediglich drei kalte 56 Knoten identifiziert werden (mittlere TBR=3,7). Aufgrund der zu geringen Fallzahl kann an dieser Stelle allerdings keine fundierte Aussage bezüglich der getroffenen Vermutung geäußert werden. Dennoch bleibt zu erwähnen, dass vorige Studien bereits über eine gesteigerte Ga-68-DOTATOC Akkumulation im Fall von kalten Knoten berichtet haben (28). Unsere Ergebnisse demonstrieren die höchsten TBR-Werte für die verschiedenen Formen der Schilddrüsenautonomien. Desweiteren wird deutlich, dass einige Patienten mit aktiver Hashimoto-Thyreoiditis ebenfalls erhöhte TBR-Werte aufweisen. Ein eher geringer Radiotraceruptake zeigt sich bei Gruppenmitgliedern mit niedrig aktiven Hashimoto-Thyreoiditiden. Wie in der bereits publizierten Studie von Lincke et al. (28) gezeigt wurde, weisen einige Schilddrüsen, bei denen im Studienverlauf kein pathologischer Prozess nachgewiesen werden konnte, eine deutlich verstärkte Tracerakkumulation auf (TBR>4). Diese Erkenntnis steht in Einklang mit Yüksel, der in seiner Studie ebenfalls einen erhöhten Radiotraceruptake in gesundem, nicht pathologisch verändertem Schilddrüsengewebe beobachten konnte (34). Insgesamt zeigten acht Studienteilnehmer erhöhte Uptake-Werte im Ga-68-DOTATOC PET, bei scheinbar strukturell und funktionell normalen Schilddrüsen. Drei Patienten zeigten sogar massiv erhöhte Werte in der Ga-68-DOTATOC PET Untersuchung (TBR=7,3; 6,8 und 5,8). In den beschriebenen acht Fällen konnten Nachfolgeuntersuchung zwischen sechs und vierzehn Monaten durchgeführt werden, in deren Rahmen nach laborchemischen und sonographischen Veränderungen gefahndet wurde. Der Ultraschall der Schilddrüse zeigte jeweils homogene Schilddrüsenmuster mit geringen Volumenschwankungen, wahrscheinlich hervorgerufen durch methodenspezifische Messfehler der jeweiligen Untersucher. Bei den untersuchten Patienten konnte keine Entwicklung zu einer Schilddrüsenpathologie und vor allem auch kein Hinweis auf eine sich anbahnende Hashimoto-Thyreoiditis aufgedeckt werden. Dies lässt vermuten, dass es Fälle gibt, in denen völlig gesunde Schilddrüsen mit erhöhten Radiotraceruptake-Werten im DOTATOC PET auffallen, ohne dass sich in kürzerer Zeit eine Schilddrüsenpathologie entwickelt. 57 Zusammenfassend zeigt die Datenanalyse der 165 Studienteilnehmer annähernd gleiche Tendenzen verschiedenen bezüglich des Anreicherungsverhaltens Schilddrüsenpathologiegruppen. Dabei innerhalb der gehen die Schilddrüsenautonomien jeweils mit deutlich erhöhten Uptake-Werten einher. Niedrig aktive Hashimoto-Thyreoiditiden zeigen, verglichen mit normalen Schilddrüsen, eher erniedrigte TBR-Werte. Strumen und/oder knotige Schilddrüsen weisen im Vergleich allenfalls gering erhöhte mittlere TBRs auf, die sich aber nicht signifikant von den ermittelten TBRs der normalen Schilddrüsengruppe unterscheiden. Diese Erkenntnis lässt vermuten, dass sich nicht autonome, knotige Veränderungen nicht durch eine vermehrte SSTR-Expression auszeichnen. Gezeigt wurde weiterhin, dass Patienten nach Thyreoidektomie TBRs nahe dem Wert 1,0 aufweisen. Diese Erkenntnis legt nahe, dass in diesen Fällen der Uptake über der Schilddrüsenregion mit dem unspezifischen Hintergrunduptake gleichzusetzen ist. Das sich bei diesen Patienten keine Unterscheidung von Hintergrund und Schilddrüsenregion finden lässt, untermauert wieder die These von Becker (9), welcher den unspezifischen Schilddrüsenuptake anspricht. Wie bereits erwähnt, zeigen Schilddrüsen ohne gefundene pathologische Komponente in der Ga-68-DOTATOC PET Untersuchung einen klar nachweisbaren Radiotraceruptake. Dieser unterscheidet sich signifikant vom Uptake über der Schilddrüse bei thyreoidektomierten Patienten (27, 28). Die fortführende Analyse der Patientendaten erbrachte weiterhin, dass sich kein statistisch signifikanter Zusammenhang zwischen den Schilddrüsenvolumina und den zugehörigen TBRs finden lässt. Untersucht wurde dies jeweils für die Gruppen mit den gesunden Schilddrüsen, sowie für die Gruppen mit Strumen und/oder knotig veränderten Schilddrüsen. Weiterhin erwähnenswert ist, dass wiederholte Untersuchungen am selben Patienten zu weitestgehend übereinstimmenden Ergebnissen hinsichtlich der gefundenen TBRs führten. Zudem zeigten sich keine größeren Abweichungen der laborchemischen und sonographischen Untersuchungsergebnisse von Erst- und Zweituntersuchung der Schilddrüse. Der mittlere Untersuchungsabstand liegt bei 10,7 Monaten. Aus dieser annähernden Kongruenz der TBRs lässt sich auf eine 58 recht hohe Konstanz hinsichtlich der intraindividuellen SSTR-Expression der Schilddrüse schließen. Bezüglich der applizierten Aktivität von Gallium-68 und den zugehörigen TBR-Werten konnte erwartungsgemäß keine Korrelation gefunden werden. Die differierenden TBRs lassen sich somit nicht auf unterschiedliche Mengen applizierter Aktivität zurückzuführen. Die vorliegende Studie teilt das Patientenkollektiv von insgesamt 165 Partizipanten geschlechtsspezifisch auf. Ziel war es, mögliche Unterschiede in den Uptake-Werten hinsichtlich der einzelnen Schilddrüsenpathologiegruppen zu identifizieren. Die getrennte Auswertung von männlichen und weiblichen Studienmitgliedern ergab weitestgehende Konstanz der TBRs in den einzelnen Gruppen. Allerdings fiel in der größten Studiengruppe, welche Patienten mit gesunden Schilddrüsen beinhaltet auf, dass sich die ermittelten TBRs signifikant zwischen den Geschlechtern unterscheiden (Mann-Whitney U-Test: p=0,002). Die Männer (n=40; TBR=3,2) zeigten hier zum einen die höhere Uptake Werte und zum anderen die größere Spannweite innerhalb der TBRs, verglichen mit den weiblichen Gruppenmitgliedern (n=24; TBR=2,4). Jedoch waren die ermittelten TBR-Werte bei den Frauen immer noch signifikant höher, verglichen mit Patienten nach Thyreoidektomie (MannWhitney U-Test: p<0,001). Nach unserem bisherigen Wissenstand wurde bis zum jetzigen Zeitpunkt in keiner Studie über einen geschlechtsspezifischen Unterschied bezüglich des Ga-68DOTATOC Uptakes in gesunden Schilddrüsen berichtet. Der Grund für die gefundenen erhöhten TBR-Werte bei männlichen Studienteilnehmern ist noch unklar. Möglich wäre, dass Männer eine erhöhte SSTR-Expression im Vergleich zu den Frauen aufweisen. Ein positiver Volumeneffekt, der die erhöhten Werte rechtfertigen könnte, wurde in der vorliegenden Arbeit nicht bestätigt. Ein möglicher Einfluss bezüglich der Einnahme von schilddrüsenspezifischer Dauermedikation wurde für 165 Studienmitglieder evaluiert. 25 der Patienten nahmen zum Zeitpunkt des Studiendurchlaufes regelmäßig L-Thyroxin Präparate für die Schilddrüse ein. Im Vergleich mit Patienten, die keinerlei schilddrüsenspezifische 59 Medikation einnehmen, differieren die ermittelten TBR-Werte gruppenspezifisch nicht signifikant (Mann-Whitney U-Test: p=0,51). Die Studienpartizipanten nahmen an der Ga-68-DOTATOC PET Untersuchung im Rahmen von diagnostischen Erst- oder Verlaufskontrollen bei neuroendokrinen Tumorerkrankungen teil. Ziel einer weiteren Analyse der zu Grunde liegenden neuroendokrinen Tumorerkrankung sollte identifizieren, ob sich Unterschiede in den TBRs bei verschiedenen NETs finden lassen. Innerhalb der neu geformten Gruppen hinsichtlich des neuroendokrinen Tumorleidens (z. B. Karzinoide der Lunge: TBR=2,9; und Karzinome Gastrointestinaltraktes: der Lunge: TBR=3,4 TBR=3,7) fanden sich oder jeweils Karzinoide ähnliche des mittlere Radiotraceruptake-Werte. Die vorliegende Studie lässt somit vermuten, dass ein möglicher Einfluss des neuroendokrinen Tumorleides bezüglich der TBR-Werte nicht sehr wahrscheinlich ist. Ein möglicher Zusammenhang zwischen den TBRs und den Anti-TPO-AntikörperWerten wurde mittels Korrelations- und Regressionsanalyse geprüft (PearsonKorrelation: 0,082; p=0,305). In dieser Studie konnte kein statistisch signifikanter Zusammenhang zwischen den beiden untersuchten Größen ermittelt werden. Es ist davon auszugehen ist, dass ein über die Norm erhöhter Laborwert nicht zwangsläufig zu höheren TBRs führt. Desweiteren konnte keine signifikante Korrelation zwischen Patientenalter und den TBR-Werten gefunden werden (Pearson-Korrelation: -0,11, p=0,24). Wie in dem Kapitel Material und Methoden bereits erwähnt, führte die Nuklearmedizin der Universität Leipzig 10/07 einen Wechsel des PET-Scanners durch. Bis zu diesem Zeitpunkt wurden alle Patienten mit dem ECAT EXAT HR+ Tomographen der Firma Siemens untersucht. Im Oktober erfolgte dann die Umstellung des Tomographen auf das Gerät Biograph 16 PET/CT der Firma Siemens. Alle Patienten, die im Zeitraum von 10/07 bis 9/08 in die Studie eingeschlossen wurden, erhielten eine PET-Untersuchung mit diesem Gerät. Im Rahmen von Verlaufsuntersuchungen wurden bei einigen Patienten repetitiv PETScans durchgeführt. Daraus ergibt sich, dass jene Patienten eine Untersuchung mit 60 beiden Scannern erhielten. Die so gewonnenen Daten wurden für die Überprüfung der Vergleichbarkeit der Daten in der vorliegenden Studie mit verwendet. Die untersuchten Patienten sind weder in der ersten, noch in der zweiten Studie erfasst, da diese Kontrollen erst im Zeitraum 12/09 bis 03/10 durchgeführt wurden. Es liegen Daten von 10 untersuchten Patienten vor. Um eine Vergleichbarkeit der ermittelten Daten zu rechtfertigen, wurden die Unterschiede bezüglich der ermittelten TBRs mit Hilfe des Wilcoxon-Tests auf Signifikanz untersucht (p=0,213). Der ermittelte p-Wert zeigt an, dass die Unterschiede als nicht statistisch signifikant zu werten sind. Auf dieser Grundlage basierend wird nun angenommen, dass die ermittelten Ergebnisse des ersten Scanners mit denen des aktuellen Scanners vergleichbar sind und bleiben. Eine höhere Fallzahl bezüglich doppelt untersuchter Patienten wäre für die Zukunft wünschenswert, allerdings ist dies nur schwer umsetzbar, da es sich natürlich um eine freiwillige Teilnahme mit vorheriger Einwilligung handelt. Neben Gallium-68-DOTATOC PET lassen sich weitere Studien finden, die das Anreicherungsverhaltens von verschiedenen Tracern in der Schilddrüse untersuchen. Zum Einsatz kommen unter einigen anderen auch das F-18-FDG PET oder, die in der Studie von Lincke et al. untersuchte, In-111-Octreotidszintigraphie (28). Bogsrud untersuchte in seiner Studie die Anreicherung von F-18-FDG PET in verschiedenen Schilddrüsenknoten und konnte anhand der ermittelten SUVmaxWerte keine signifikante Differenz zwischen benignen und malignen Knoten feststellen (68). Nach wie vor ist die allein klinisch-bildgebende sichere Unterscheidung von benignen und malignen Schilddrüsenläsionen schwierig und eine exakte Differenzierung zwischen den Schilddrüsenpathologien ist meist nicht möglich (68, 69). Im Widerspruch dazu steht die jüngst veröffentlichte Studie von Traugott, die hervorbrachte, dass FDG-PET eine bedeutende Rolle beim Ausschluss maligner Schilddrüsenknoten zuzusprechen ist (70). Hinsichtlich des Anreicherungsverhaltens von F-18-FDG beschreibt Bogsrud ähnliche Tendenzen, wie sie sich auch für Gallium-68 finden lassen. Erhöhte 61 Akkumulationswerte findet man also in Fällen von Morbus Basedow oder in einigen Fällen von chronischen Schilddrüsenentzündungen (68). Weiterhin wird ein gesteigertes Uptakeverhalten bei follikulären Adenomen und hypermetabolischen Schilddrüsenarealen beschrieben (68). Die Anreicherung im normalen Schilddrüsengewebe wird als homogen, aber eher gering aufgezeigt. Dies steht im Gegensatz zu den hier vorliegenden Ergebnissen. Eine andere Untersuchung beschäftigte sich mit einem möglichen Einfluss der Größe von Schilddrüsenknoten auf die Schilddrüsenpathologie. Hier konnte kein signifikanter Zusammenhang der beiden Parameter nachgewiesen werden (71). 4.2 Ausblick über weitere Forschungsansätze Die vorliegende Studie konnte die von Singer et al. (27) vorab aufgeworfenen Fragen weitestgehend beantworten. Nicht komplett zu klären war allerdings, worauf die Schwankungen der TBRs innerhalb der verschiedenen Schilddrüsenpathologiegruppen zurückzuführen sind. Eine spezifische Analyse von Ga-68-DOTATOC PET Untersuchungen bei gesunden oder pathologisch veränderten Schilddrüsen im Verlauf könnte diese Frage eventuell klären. Weiterhin wäre die Beantwortung folgender Fragen interessant: 1. Lassen sich die starken Streuungen der TBR-Werte innerhalb der Schilddrüsenpathologiegruppen an größeren Patientenzahlen bestätigen? 2. Gelingt eine Verifizierung der detektierten höheren TBRs der Schilddrüse bei gesunden Männern im Vergleich zu Frauen? 62 5. Zusammenfassung der Arbeit Dissertation zur Erlangung des akademischen Grades Dr.med. Untersuchungen zum Gallium-68-DOTATOC Uptake in gesundem und pathologisch verändertem Schilddrüsengewebe eingereicht von: Grit Orschekowski geboren am 29.11.1984 in Leipzig angefertigt an: der Universität Leipzig Medizinische Klinik III für Endokrinologie und Nephrologie und Klinik und Poliklinik für Nuklearmedizin Betreuer: Prof. Dr. med. Ralf Paschke Univ.-Prof. Dr. med. Osama Sabri Dr. med. Thomas Lincke Monat/Jahr Einreichung: Zusammenfassung Somatostatinrezeptoren (SSTRs) hemmen die Hormonsekretion und Proliferation in einer Vielzahl von neuroendokrinen Geweben. Eine erhöhte Dichte dieser Rezeptoren konnte im Zusammenhang mit verschiedenen Schilddrüsenpathologien nachgewiesen werden. Mittels Gallium-68 (Ga-68) DOTA-Phe(1)-Tyr(3)-Octreotid (DOTATOC) PositronenEmissions-Tomographie (PET), einem nuklearmedizinischen Untersuchungsverfahren, ist die funktionelle Darstellung der SSTR-Expression in vivo möglich. Unser Studienziel war es, den Ga-68-DOTATOC Uptake als Korrelat 63 für die SSTR-Dichte in gesundem und pathologisch verändertem Schilddrüsengewebe zu quantifizieren. Die Ga-68-DOTATOC PET Bilder von insgesamt 165 Patienten wurden mittels (ROI)Technik ausgewertet und Schilddrüsenpathologiegruppen die Studienteilnehmer zugeordnet. verschiedenen Ergänzend erfolgte eine schilddrüsenspezifische Anamnese, eine Ultraschalluntersuchung der Schilddrüse, sowie die Bestimmung der Laborparameter TSH and Anti-TPO-Antikörper für jeden Studienteilnehmer. Normale Schilddrüsen, ohne eine erkennbare Pathologie, zeigten eine klar nachweisbare SSTR-Expression mit einer großen Spannweite innerhalb der ermittelten TBR-Werte. In acht Fällen war es möglich, Folgeuntersuchungen von Patienten mit normaler Schilddrüse, aber erhöhten Uptake-Werten in der Gallium-68DOTATOC PET Untersuchung, auszuwerten (TBR>4). Der Abstand der durchgeführten Kontrollen lag im Mittel bei 11,4 Monaten mit einer Spannweite von sechs bis vierzehn Monaten. In keiner der durchgeführten Kontrolluntersuchungen konnte eine neu aufgetretene Schilddrüsenpathologie nachgewiesen werden. Eine erhöhte SSTR-Dichte (TBR>3.4) zeigte sich zudem im Fall von autonomen Adenomen, disseminierten Schilddrüsenautonomien, sowie bei den meisten Patienten (fünf von acht) mit aktiven Hashimoto-Thyreoiditiden. Vor allem die gesunden Schilddrüsen von männlichen Studienteilnehmern fielen mit erhöhten Radiotraceruptake-Werten in der durchgeführten Untersuchung auf. Diese unterschieden sich signifikant von der Gruppe weiblicher Studienteilnehmer mit normaler Schilddrüse. Patienten ohne eine nachweisbare Schilddrüsenpathologie, aber mit erhöhten Uptake-Werten (TBR>4.0), zeigten in den späteren Kontrolluntersuchungen keinen Hinweis auf eine sich entwickelnde Pathologie, speziell keine Hinweise auf eine sich entwickelnde Hashimoto-Thyreoidititis. Alle Patienten mit verschiedenen Formen der Schilddrüsenautonomie zeigen einen erhöhten DOTATOC Uptake in unserer Studie. 64 6. Anhang 6.1 Abkürzungsverzeichnis AA: Autonomes Adenom AC: Adenylatcyclase (Adenylatzyclase) AK: Antikörper AS: Aminosäure(n) ca.: circa cAMP: zyklisches Adenosinmonophosphat CDK: Cyclin dependent kinase (Zyklin abhängige Kinase) cm: Zentimeter CT: Computertomographie DA: Disseminierte Autonomie ERK: Extrazellulär regulierte Kinase(n) et. al.: und andere F-18: Flour-18 fT3: freies Thrijodthyronin fT4: freies Thyroxin Ga-68: Gallium-68 Ge-68: Germanium-68 GH: growth hormon (Wachstumshormon) GIT: Gastrointestinaltrakt HCL: Hydrochlorsäure (Salzsäure) HD: Hashimoto-Thyreoiditis HWZ: Halbwertszeit IGF 1: Insulin like growth factor IGFBP: Insulin like growth factor binding protein M: molar m: männlich Max: Maximum MBq: Megabequerel MFA: Multifokale Autonomie Mg: Milligramm 65 Min: Minimum min: Minute ml: Milliliter mm: Millimeter mRNA: Messenger Ribonukleinsäure MW: Mittelwert NaCl: Natriumchlorid NET: Neuroendokriner Tumor OSEM: Ordered Subset Expectation Maximization PET: Positronenemissiontomographie p.i. post injection (nach Injektion) PI-3-K: Phosphoinositol-3-Kinase PKA: Proteinkinase A PNS: Peripheres Nervensystem RIT: Radiojodtherapie ROI: Region of interest SD: Schilddrüse SDL: Schilddrüsenlappen SDV: Schilddrüsenvolumen SST: Somatostatin SSTR: Somatostatinrezeptor TBR: Target-Background-Ratio Tc-99m: Technetium 99 Pertechnetat TPO: Thyreoidperoxidase TRAK: TSH-Rezeptor-Antikörper TSH: Thyreotropin TSHR: Thyreotropinrezeptor T1/2: Halbwertszeit U: Unit u.a.: unter anderem UFA: Unifokale Autonomie w: weiblich Μg: Mikrogramm ZNS: Zentrales Nervensystem 66 6.2 Literaturverzeichnis 1. Maecke HR, André JP, 2007, 68Ga-PET radiopharmacy: A generator-based alternative to 18Fradiopharmacy; Ernst Schering Res. Found Workshop (62):215-42. 2. Khan MU, Khan S, El-Refaie S, Win Z, Rubello D, Al-Nahhas A, 2009, Clinical indications for Gallium-68 positron emission tomography imaging; Eur J Surg Oncol. 35(6):561-7. 3. Krenning EP, et al., 1993, Somatostatin receptor scintigraphy with 111In-DTPA-D-Phe(1) and 123I-Tyr(3) -octreotide: the Rotterdam experience with more than 1000 patients; Eur J Nucl Med 20: 716-23. 4. Jamar F, et al., 1994, Somatostatin receptor imaging with indium-111-pentetreotide in gastroenteropancreatic neuroendocrine tumors: safety, efficiacy and impact on patient management; J Nucl Med 36: 542-9. 5. Otte A, et al., 1997, DOTATOC: a powerful new tool for receptor-mediated radionuclide Therapy; Eur J Nucl Med 24: 729-5. 6. Hofmann M, Maecke H, Börner R, Weckesser E, Schöffski P, Oei L, Schumacher J, Henze M, Heppeler A, Meyer J, Knapp H, Biokinetics and imaging with the somatostatin receptor PET radioligand (68)Ga-DOTATOC: preliminary data; Eur J Nucl Med (12):1751-7. 7. Krantic S, Goddard I, Saveanu A, Giannetti N, Fombonne J, Cardoso A, Jaquet P, Enjalabert A, 2004, Novel modalities of somatoatatin actions; European Journal of Endocrinology 151:643-655. 8. Patel RC, Kumar U, Lamb DC, Eid JS, Rocheville M, Grant M, Rani A, Hazlett T, Patel SC, Gratton E, Patel YC, 2002, Ligand binding to somatostatin receptors induces receptor-specific oligomer formation in live cells; Proc Natl Acad Sci U S A 99:3294-3299. 9. Becker W, Schrell U, Buchfelder M, Hensen J, Wendler J, Gramatzki M, Wolf F, 1995, Somatostatin receptor expression in the thyroid demonstrated with 111In-octreotide Scintigraphy; Nuklearmedizin 34:100-103. 10. Bustillo A, Telischi F, Weed D, Civantos F, Angeli S, Serafini A, Whiteman M, 2004, Octreotide Scintigraphy in the Head and Neck; The Laryngoscope 114:434-440. 11. Terrillon S, Bouvier M, 2004, Roles of G-protein-coupled receptor dimerization; EMBO Rep. 5:30-34. 12. Pfeiffer M, Koch T, Schroder H, Klutzny M, Kirscht S, Kreienkamp HJ, Hollt V, Schulz S, 2001, Homo- and heterodimerization of somatostatin receptor subtypes. Inactivation of sst(3) receptor function by heterodimerization with sst(2A); J Biol Chem 276:14027-14036. 13. Koukouraki S, Strauss LG, Georgoulias V, Eisenhut M, Haberkorn U, DimitrakopoulouStrauss A, 2006, Comparison of the pharmacokinetics of 68Ga-DOTATOC and [18F]FDG in patients with metastatic neuroendocrine tumours scheduled for 90Y-DOTATOC therapy; Eur J Nucl Mol Imaging (10):1115-22. 14. Ain KB, Taylor KD, 1994, Somatostatin analogs affect proliferation of human thyroid carcinoma cell lines in vitro; J Clin Endocrinol Metab 78:1097-1102. 15. Kumar U, 2007, Colocalization of somatostatin receptor subtypes (SSTR1-5) with somatostatin, NADPH-diaphorase (NADPH-d), and tyrosine hydroxylase in the rat hypothalamus; J Comp Neurol. 67 16. Danila DC, Haidar JN, Zhang X, Katznelson L, Culler MD, Klibanski A, 2001, Somatostatin receptor-specific analogs: effects on cell proliferation and growth hormone secretion in human somatotroph tumors; J Clin Endocrinol Metab.; 86(7):2976-81. 17. Florio T, Arena S, Thellung S, Iuliano R, Corsaro A, Massa A, Pattarozzi A, Bajetto A, Trapasso F, Fusco A, Schettini G, 2001, The Activation of the Phosphotyrosine Phosphatase (r-PTP) is Responsible for the Somatostatin Inhibition of PC C13 Thyroid Cell Proliferation; Molecular Endocrinology 15(10):1838-1852. 18. Ferone D, Saveanu A, Culler MD, Arvigo M, Rebora A, Gatto F, Minuto F, Jaquet P, 2007, Novel chimeric somatostatin analogs: facts and perspectives., European Journal of Endocrinology; 156:S23-S28. 19. Neumann I, Mirszaei S, Bierck R, Osinger K, Waldherr R, Köhn HD, Meisl FT, 2004, Expression of somatostatin receptors in inflammatory lesions and diagnostic value of somatostatin receptor scintigraphy in patients with ANCA-associated small vessel vasculitis; Rheumatology; 43:195-201. 20. Henze M, Dimitrakopoulou-Strauss A, Milker-Zabel S, Schuhmacher J, Strauss LG, Doll J, Mäcke HR, Eisenhut M, Debus J, Haberkorn U, 2005, Characterization of 68Ga-DOTA-DPhe1-Tyr3-octreotide kinetics in patients with meningiomas; J Nucl Med.; 46(5):763-9.# 21. http://www.megru.unizh.ch/j3/module/endokrinologie/endo.php?uniId=E71130&di=10. 22. Kahaly G, Gorges R, Diaz M, Hommel G, Bockisch A, 1998, Indium-111-pentetreotide in Grave s' disease; J Nucl Med 39:533-536. 23. Pfeiffer M, Koch T, Schroder H, Klutzny M, Kirscht S, Kreienkamp HJ, Hollt V, Schulz S, 2001, Homo- and heterodimerization of somatostatin receptor subtypes. Inactivation of sst(3) receptor function by heterodimerization with sst(2A); J Biol Chem 276:14027-14036. 24. Rocheville M, Lange DC, Kumar U, Sasi R, Patel RC, Patel YC, 2000, Subtypes of the somatostatin receptor assemble as functional homo- and heterodimers; J Biol Chem 275:78627869. 25. Rocheville M, Lange DC, Kumar U, Patel SC, Patel RC, Patel YC, 2000, Receptors for dopamine and somatostatin: formation of hetero-oligomers with enhanced functional activity; Science 288:154-15765. 26. Pfeiffer M, Koch T, Schroder H, Laugsch M, Hollt V, Schulz S, 2002, Heterodimerization of somatostatin and opioid receptors cross-modulates phosphorylation, internalization, and desensitization; J Biol Chem 277:19762-19772. 27. Singer J, 2009, Quantifizierung der Somatostatin-Rezeptor Expression in der Schilddrüse mittels Indium-111-Octreotid Szintigraphie und Gallium-68-DOTATOC PET und ihre Assoziation mit unterschiedlichen Schilddrüsenerkrankungen. 28. Lincke T, Singer J, Kluge R, Sabri O, Paschke R, 2009, Relative Quantification of In-111 Pentetreotide and Ga-68 DOTATOC Up-take in the Thyroid Gland and Association with Thyroid Pathologies; Thyroid:19(4):381-9. 29. Maecke HR, Hofmann M, Haberkorn U, 2005, (68)Ga-labeled peptides in tumor imaging; J Nucl Med. 46 Suppl 1:172S-8S. 30. De Herder WW, Kwekkeboom DJ, Feelders RA, van Aken MO, Lamberts SWJ, van der Lely A-J, Krenning EP, 2006, Somatostatin receptor imaging for neuroendocrine tumors; Pituitary 9:243-48. 31. Ruf J, Heuck F, Schiefer J, Denecke T, Elgeti F, Pascher A, Pavel M, Stelter L, Kropf S,Wiedenmann B, Amthauer H, 2010, Impact of Multiphase 68Ga-DOTATOC-PET/CT on therapy management in patients with neuroendocrine tumors. Neuroendocrinology; 91(1):101-9. 68 32. Kowalski J, Henze M, Schuhmacher J, Mäcke HR, Hofmann M, Haberkorn U, 2003, Evaluation of positron emission tomography imaging using [68Ga]-DOTA-D Phe(1)Tyr(3)-Octreotide in comparison to [111In]-DTPAOC SPECT. First results in patients with neuroendocrine tumors; Mol Imaging Biol (1):42-8. 33. Koriyama N, Nakazaki M, Hashiguchi H, Aso K, Ikeda Y, Kimura T, Eto H, Hirano H, Nakano S, Tei C, 2004, Thyrotropin-producing pituitary adenoma associated with Graves' disease; Eur J Endocrinol.; 151(5):587-94. 34. Yüksel M, Eziddin S, Wardelmann E, Biersack HJ, 2006, 111In-Pentetreotide uptake in a follicular adenoma of the thyroid gland: a pitfall for 111In-Pentetreotide scintigraphy; Rev Esp Med Nucl; 25(5):316-9. 35. Giammarile F, Houzard C, Bournaud C, Hafdi Z, Sassolas G, Borson-Chazot F, 2004, Diagnostic management of suspected metastatic thyroid carcinoma: clinical value of octreotide scintigraphy in patients with negative high-dose radioiodine scans; Eur J Endocrinol 150:277-283. 36. Pisarek H, Stepień T, Kubiak R, Borkowska E, Pawlikowski M, 2009, Expression of somatostatin receptor subtypes in human thyroid tumors: the immunohistochemical and molecular biology (RT-PCR) investigation; Thyroid Res.27;2(1):1. 37. Zatelli MC, degli Uberti EC, 2004, Somatostatin receptors: from basic science to clinical approach-thyroid; Dig Liver Dis 36 Suppl 1:S86-S92. 38. Druckenthaner M, Schwarzer C, Ensinger C, Gabriel M, Prommegger R, Riccabona G Decristoforo C, 2007, Evidence for Somatostatin receptor 2 in thyroid tissue; Regul Pept. 138(1):32-9. 39. Medina DL, Toro M-J, Santisteban P, 2000, Somatostatin Interferes with Thyrotropin-induced G1-S Transition Mediated by cAMP-dependent Protein Kinase and Phosphatidylinositol 3-Kinase; The Journal of Biological Chemistry 275 No20:15549-15556. 40. Medina DL, Velasco JA, Santisteban P, 1999, Somatostatin Is Expressed in FRTL-5 Thyroid Cells and Prevents Thyrotropin-Mediated Down-Regulation of the Cyclin-Dependent Kinase Inhibitor p27kip1; Endocrinology 140 No1:87-95. 41. Ain KB, Taylor KD, Tofiq S, Venkataraman G, 1997, Somatostatin Receptor Subtype Expression in Human Thyroid and Thyroid Carcinoma Cell Lines; Journal of Clinical Endocrinology and Metabolism 82:1857-1862. 42. Reubi JC, Horisberger U, Laissue J, 1994, High density of somatostatin receptors in veins surrounding human cancer tissue: role in tumor-host interaction?; Int J Cancer 56(5):681-8. 43. Reubi JC, Schaer JC, Laissue JA, Waser B, 1996, Somatostatin receptors and their subtypes in human tumors and in peritumoral vessels.Metabolism; 45(8 Suppl 1):39-41. 44. Yang SK, Parkington HC, Epelbaum J, Keating DJ, Chen C, 2007, Somatostatin decreases voltage-gated Ca2+ currents in GH3 cells through activation of somatostatin receptor 2; Am J Physiol Endocrinol Metab 292(6):E1863-70. 45. Phillips I D, Becks G P, Wang J F, Han V K M, Hill DJ, 1994, Hormonal Regulation and Biological Action of Insulin-Like Growth Factor Binding Proteins in Isolated Ovine Thyroid Follicles; Endocrinology 134 No3:1238-1246. 46. Paschke R, Ludgate M, 1997, The thyrotropin receptor in thyroid diseases; N Engl J Med 337:1675-1681. 47. Graves PN, Vlase H, Davies TF, 1995, Folding of the recombinant human thyrotropin (TSH) receptor extracellular domain: identification of folded monomeric and tetrameric complexes that bind TSH receptor autoantibodies; Endocrinology 136:521-527. 69 48. Graves PN, Vlase H, Bobovnikova Y, Davies TF, 1996, Multimeric complex formation by the thyrotropin receptor in solubilized thyroid membranes; Endocrinology 137:3915-3920. 49. Latif R, Graves P, Davies TF, 2002, Ligand-dependent inhibition of oligomerization at the human thyrotropin receptor; J Biol Chem 277:45059-45067. 50. Latif R, Graves P, Davies TF, 2001, Oligomerization of the human thyrotropin receptor fluorescent protein-tagged hTSHR reveals post-translational complexes; J Biol Chem 276:45217-45224. 51. Führer D, Lewis MD, Alkhafaji F, Starkey K, Paschke R, Wynford-Thomas D, Eggo M, Ludgate M, 2003, Biological activity of activating thyroid-stimulating hormone receptor mutants depends on the cellular context; Endocrinology 144:4018-4030. 52. Krohn K, Wohlgemuth S, Gerber H, Paschke R, 2000, Hot microscopic areas of iodinedeficient euthyroid goiters contain constitutively activating TSH receptor mutations; Journal of Pathology 192:37-42. 53. Trulzsch B, Krohn K, Wonerow P, Chey S, Holzapfel HP, Ackermann F, Fuhrer D, Paschke R, 2001, Detection of thyroid-stimulating hormone receptor and Gsalpha mutations: in 75 toxic thyroid nodules by denaturing gradient gel electrophoresis; J Mol Med 78:684-691. 54. Reynaert H, van Rossen E, Uyama N, Chatterjee N, Kumar U, Urbain D, Geerts A, 2007, Expression of somatostatin receptors in splanchnic blood vessels of normal and cirrhotic Rats; Liver Int 27(6):825-31. 55. Kohlfuerst S, Igerc I, Gallowitsch HJ, Gomez I, Kresnik E, Matschnig S, Lind P, 2006, Is there a role for sandostatin treatment in patients with progressive thyroid cancer and iodinenegative but somatostatin-receptor-positive metastases?; Thyroid 16(11):1113-9. 56. Coy DH, Taylor JE, 1996, Receptor-specific somatostatin analogs: correlations with biological Activity; Metabolism 45(8 Suppl 1):21-3. 57. Bruns C, Raulf F, Hoyer D, Schloos J, Lübbert H, Weckbecker G, 1996, Binding properties of somatostatin receptor subtypes; Metabolism 45(8 Suppl 1):17-20. 58. Zlock DW, Greenspan FS, Clark OH, Higgins CB, 1994, Octreotide therapy in advanced thyroid cancer; Thyroid 4(4):427-31. 59. Meyer G.-J., Mäcke H., Schuhmacher J., Knapp W.H., Hofmann M, 2004, 68Ga-labelled DOTA-derivatised peptide ligands; Eur J Nucl Med Mol Imaging (8):1097-104. 60. Fachinformation des Herstellers Cyclotron Co. Ldt., Obninsk, Russland. 61. Brunn J, Block U, Ruf G, Bos I, Kunze WP, Scriba PC, 1981, Volumetric analysis of thyroid Lobes; Dtsch Med Wochenschr. 106(41):1338-40. 62. Herstellerangaben für Skylight Gamma-Kamera und MEGP-Kollimator Spezifikation (Philips Medical Solutions). 63. http://www.nuklearmedizin.de/publikationen/leitlinien/schild_szin.php 64. Krummenauer F, 2003, Statistics in Medical Publications: Check lists for Authors; Klin Monbl Augenheilkd 220:362-365. 65. Brauer VF, Paschke R, 2004, Molecular aetiology of nodular goitre - consequences for therapy?; Zentralbl Chir. 2004 Oct;129(5):356-62. 66. Zatelli MC, degli Uberti EC, 2004, Somatostatin receptors: from basic science to clinical approach-thyroid; Dig Liver Dis 36 Suppl 1:S86-S92. 70 67. Krassas GE, Kahaly GJ, 1999, The role of octreoscan in thyroid eye disease; Eur J Endocrinol. 140(5):373-5. 68. Bogsrud TV, Karantanis D, Nathan MA, Mullan BP, Wiseman GA, Collins DA,Kasperbauer J.L. , Strome SE, Reading CC, Hay ID, Lowe VJ, 2007, The value of quantifying 18F-FDG uptake in thyroid nodules found incidentally on whole-body PET-CT; Nucl Med Commun 28(5):373-81. 69. Ohba K, Nishizawa S, Matsushita A, Inubushi M, Nagayama K, Iwaki H, Matsunaga H, Suzuki S, Sasaki S, Oki Y, Okada H, Nakamura H, 2010 High incidence of thyroid cancer in focal thyroid incidentaloma detected by 18F-fluorodexyglucose positron emission tomography in relatively young healthy subjects: results of 3-year follow-up; Department of Internal Medicine, Hamamatsu University School of Medicine, Hamamatsu, Japan. 70. Traugott AL, Dehdashti F, Trinkaus K, Cohen M, Fialkowski E, Quayle F, Hussain H, Davila R, Ylagan L, Moley JF, 2010, Exclusion of Malignancy in Thyroid Nodules with Indeterminate Fine-Needle Aspiration Cytology After Negative (18)F-Fluorodeoxyglucose Positron Emission Tomography: Interim Analysis; Department of Surgery, Washington University School of Medicine, 660 South Euclid Avenue, St. Louis, MO, 63110, USA. 71. Tibbo JJ, Corsten MJ, 2010, Does Size Matter? Evaluation of malignancy rate differences between small and large thyroid follicular neoplasms; Department of Otolaryngology-Head and Neck Surgery, University of Ottawa, Ottawa, Ontario. 71 6.3 Danksagung und Widmung Ich möchte Herrn Prof. Dr. med. Ralf Paschke für die Überlassung des Promotionsthemas sowie die stetige Unterstützung bis zur Fertigstellung der vorliegenden Arbeit danken. Außerdem danke ich Herrn Dr. med. Thomas Lincke, der mir von nuklearmedizinischer Seite aus stetig zur Seite stand und mir mit konstruktiven Ratschlägen auch durch schwierige Phasen der Promotionsarbeit half. Herrn Prof. Dr. med. Osama Sabri danke ich für die Überlassung der Patientendaten und die Ergebnisse der an seiner Klinik durchgeführten Gallium-68-DOTATOC PET Untersuchungen. Weiterhin danke ich allen Mitarbeitern der Klinik und Poliklinik für Nuklearmedizin für die stets freundliche Unterstützung und Zuarbeit bei der Durchführung meiner Promotionsarbeit. Mein besonderer Dank gilt Herrn Dr. med. Jörg Singer, der mich sowohl fachlich, als auch freundschaftlich durch alle Höhen und Tiefen bis zur Fertigstellung der Dissertationsarbeit begleitete. Ich widme diese Promotionsarbeit meinen Eltern und danke ihnen für ihre ständige Unterstützung und ihre aufbauenden Worte in allen Phasen der Promotionsarbeit. Weiterhin möchte ich diese Arbeit allen jenen Patienten widmen, die sich trotz ihrer schweren Erkrankung dazu bereiterklärten, an dieser Studie teilzunehmen. 72 6.4 Erklärung über die eigenständige Abfassung der Arbeit Hiermit erkläre ich, dass ich die vorliegende Arbeit selbständig und ohne unzulässige Hilfe oder Benutzung anderer als der angegebenen Hilfsmittel angefertigt habe. Ich versichere, dass Dritte von mir weder unmittelbar noch mittelbar geldwerte Leistungen für Arbeiten erhalten haben, die im Zusammenhang mit dem Inhalt der vorgelegten Dissertation stehen, und dass die vorgelegte Arbeit weder im Inland noch im Ausland in gleicher oder ähnlicher Form einer anderen Prüfungsbehörde zum Zweck einer Promotion oder eines anderen Prüfungsverfahrens vorgelegt wurde. Alles aus anderen Quellen und von anderen Personen übernommene Material, das in der Arbeit verwendet wurde oder auf das direkt Bezug genommen wird, wurde als solches kenntlich gemacht. Insbesondere wurden alle Personen genannt, die direkt an der Entstehung der vorliegenden Arbeit beteiligt waren. .................................. ......................................... Datum Unterschrift 73 6.5 Lebenslauf Persönliche Daten Name: Orschekowski Vorname: Grit Geburtsdatum: 29. 11. 1984 Geburtsort: Leipzig Schule, Universität, Praktika Schulausbildung: 1991 - 1995: Grundschule „Ernst Schneller“ in Leipzig 1995 - 1998: „53. Gymnasium“ in Leipzig 1998 - 2003: „I. Kant Gymnasium“ in Leipzig 06/2003: Studium: Allgemeine Hochschulreife 10/2003: Studium der Humanmedizin an der Uni Leipzig 03/2006: 1. Abschnitt der ärztlichen Prüfung Absolvierte Praktika: 2001: Betriebspraktikum (10. Klasse) NFZ Leipzig 2004: Pflegepraktikum Urologie (St. Elisabeth KH Leipzig) 2004/05: 2 Monate Pflegepraktikum allg. Chirurgie (Paracelsus KH Ruit) 2006: Famulatur in hausärztlicher Praxis (Nürtingen) 2007: Famulatur Allg. Chirurgie (Nürtingen) 2007: Famulatur Internistische ITS (Universität Leipzig) 2007: Famulatur Nuklearmedizin (Universität Leipzig) Praktisches Jahr: Anästhesie (16 Wochen Parkkrankenhaus Leipzig) (02/2009 – 01/2010) Kardiologie (8 Wochen Herzzentrum Leipzig, ITS Kardiologie) Nephrologie (8 Wochen Universitätsklinik Leipzig) Chirurgie (16 Wochen Stadtspital Waid, Zürich) 10/2010: Beruf: 2. Abschnitt der ärztlichen Prüfung seit 01/11: Assistenzärztin Chirurgie (Stadtspital Waid, Zürich) Sonstiges: Sprachen Englisch, Französisch, Latein Hobbys Kampfsport (Karate), Fitnesstraining, Lauftraining, Tennis 74