Leukämie bei Kindern: Heilen ist mehr als Überleben
Werbung

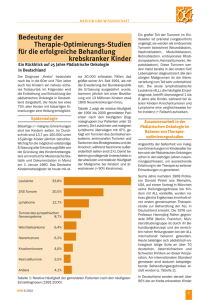
Quelle: Markus Winter von Ulrich Kraft Während sich die Forscher in den vergangenen Jahrzehnten auf die Verbesserung der Akuttherapie konzentrierten, geraten mittlerweile die möglichen Folgen einer Krebserkrankung immer stärker ins Blickfeld. Eigentlich fing es ganz harmlos an. Ein bisschen müde und schlapp wirkte der kleine Luis, etwas blass um die Nase war er – doch all dies hätte sich mit der erst kürzlich überstandenen Erkältung noch begründen lassen. Als der Dreijährige dann aber zudem über Schmerzen in den Beinen klagte, wollten die besorgten Eltern den Besuch beim Kinderarzt nicht länger aufschieben. Das dort bestimmte Differenzialblutbild weckte bereits einen schlimmen Verdacht, der sich in der Knochenmarkspunktion in der Klinik bestätigen sollte: akute lymphatische Leukämie (ALL) lautete die Diagnose. Leider kein Einzelfall. Akute Leukämien stellen mit weitem Abstand den Löwenanteil kindlicher Krebsleiden. 600 Kinder erkranken in Deutschland jedes Jahr an einer ALL, das Gros zwischen dem ersten und fünften Lebensjahr. Die akute myeloische Leukämie (AML), die meist im Schulalter auftritt, ist zwar deutlich seltener, wird aber dennoch bundesweit bei etwa 100 Kindern jährlich diagnostiziert. Besonders tückisch sind Leukämien, weil sie zunächst keine Schmerzen verursachen und deshalb oft lange unentdeckt bleiben. Erst im fortgeschrittenen Stadium, wenn die massive Produktion unreifer Vorläuferzellen die normale Blutbildung im Knochenmark fast verdrängt hat, treten die ersten Symptome auf – wie bei Luis typischerweise Müdigkeit, Spielunlust, Schmerzen in den Beinen, Blässe und blaue Flecken als Zeichen der Anämie und der Verminderung der Thrombozytenzahl. Außerdem neigen die Kinder, da sie kaum mehr gesunde Immunzellen besitzen, zu Infektionen. Kurze Zeit später können Haut- und Schleimhautblutungen, Fieber, Bauch- und Kopfschmerzen, Sehstörungen, Erbrechen, Atemnot sowie eine Vergrößerung von Lymphknoten, Milz und Leber hinzukommen. Bis Anfang der 1970er Jahre waren die akuten Leukämien praktisch ein Todesurteil – im Durchschnitt verstarben die kleinen Patienten etwas mehr als ein Jahr nach Diagnosestellung (Abb. 1). Das hat sich glücklicherweise in der Zwischenzeit massiv geändert. Wie die Daten des Kinderkrebsregisters in Mainz ergeben, können heute 75 bis 80 Prozent der an akuter lymphatischer Leukämie leidenden Kinder erfolgreich therapiert werden. Bei der myeloischen Form stehen die Überlebenschancen mit über 50 Prozent allerdings deutlich schlechter. Auch Luis gilt heute, zwei Jahre, nachdem sein Kinderarzt die Krebserkrankung feststellte, als geheilt. Dass er jetzt so munter mit seinen 15 Kurzer Therapieabriss Ziel des ersten Teils der Behandlung – der Induktionstherapie – ist es, den Anteil der Leukämiezellen im Knochenmark von fast 100 Prozent auf weniger als 5 Prozent zu reduzieren. Dazu werden die Kinder vier bis fünf Wochen mit einer Kombination aus Steroiden und mehreren Zytostatika behandelt. Nach der Remission kann die normale Blutbildung dann wieder einsetzen. Die daran anschließende Konsolidierungstherapie mit einer alternativen Medikamentenkombination – meist Methothrexat und 6-Mercaptopurin – soll die verbliebenen Krebszellen weiter reduzieren. Um auch die ruhenden Leukämiezellen zu vernichten und Rezidive zu verhindern, erhalten Kinder mit ALL zudem eine zytostatische Dauertherapie über einen Zeitraum von maximal zwei Jahren. Da die gängigen Zytostatika die Blut-HirnSchranke nicht überwinden, muss das zentrale Nervensystem gesondert behandelt werden. In diesem Punkt hat die Strahlentherapie des Schädels die Überlebenschancen der Patienten deutlich verbessert. Vor deren Einführung entwickelten 40-60 Prozent der an ALL erkrankten Kinder vom ZNS ausgehend ein Rezidiv. Mittlerweile ist bei der vorbeugenden Behandlung des zentralen Nervensystems die intrathekale Gabe von Zytostatika therapeutischer Standard. Die nebenwirkungsreiche Bestrahlung bleibt heute auf Hochrisikopatienten beschränkt. Geheilt – und doch nicht gesund So erfreulich die Fortschritte bei der Behandlung kindlicher Leukämien sind – die Medaille besitzt leider auch eine Kehrseite. Denn oft hinterlassen die aggressiven Therapien bleibende Spuren im Körper der kleinen Patienten, die über viele Jahre eine weitere medizinische Betreuung erforderlich machen. Geheilt heißt also nicht zwangsläufig gesund. „Etwa 10 Prozent aller Leukämiekinder leiden nach einer erfolgreichen Behandlung unter irreversiblen Langzeitfolgen“, erklärt Dr. Gabriele Calaminus von der Universitätskinderklinik in Düsseldorf. „Bei den bestrahlten High-Risk-Patienten liegt die Rate sogar bei 30 Prozent.“ Da sich der kindliche Organismus noch in der Entwicklung befindet, verursachen Zytostatika und Bestrahlung mehr und schwerere Folgeschäden als bei Erwachsenen. Calaminus, Leiterin des vom Kompetenznetz pädiatrische Onkologie und Hämatologie (KPOH) initiierten Projekts „Gesundheitsbezogene Lebensqualität und Spätfolgen bei krebskranken Kindern und Jugendlichen“, sieht in der Nachsorge der Therapienebenwirkungen eine der großen Herausforderungen für die Zukunft. „Im Jahre 2010 wird einer von 250 Erwachsenen Überlebender einer kindlichen Krebserkrankung sein. Pädiater und Ärzte anderer Disziplinen werden also immer öfter mit solchen Patienten konfrontiert.“ Leukämie Kameraden im Kindergarten herumtobt, verdankt der Kleine zum einen den enormen Fortschritten bei der Chemo- und Strahlentherapie, zum anderen den standardisierten Behandlungsplänen der Gesellschaft für Pädiatrische Onkologie und Hämatologie, die regelmäßig nach den neusten wissenschaftlichen Erkenntnissen optimiert werden. Mögliche Therapiefolgen erkennen Auch Prof. Jörn D. Beck von der Kinderklinik der Universität in Erlangen hält es für eine der wichtigsten Aufgaben der pädiatrischen Onkologie, die möglichen Spätfolgen einer erfolgreichen antineoplastischen Therapie im Rahmen der Nachsorge zu erkennen und zu beseitigen. Zu diesem Zweck wurde in Deutschland Anfang der 1990er Jahre das „Late-EffectSurveillance-System“ (LESS) ins Leben gerufen. Das von Professor Beck geleitete LESSStudienzentrum in Erlangen sammelt und analysiert Daten über die unerwünschten Folgeerscheinungen bei Überlebenden von Krebserkrankungen im Kindesalter, und zwar bezogen auf die Krebsart und die angewandten therapeutischen Maßnahmen. Bei Leukämien drohen in erster Linie folgende Komplikationen: • Kardiomyopathien Anthrazykline gehören zu den effektivsten Medikamenten der pädiatrischen Onkologie, können aber durch oxidative Mechanismen das Myokard schädigen. Die Folge ist eine dilatative Komplikationen einer Krebstherapie zu erkennen und zu behandeln, wird in der Zukunft eine der großen Herausforderungen sein, meint Dr. Calaminus. Abb. 1: Überlebensraten nach einer Krebserkrankung im Kindes- und Jugendalter Quelle: KPOH 16 Kardiomyopathie, die meist progredient verläuft. • Nierenfunktionsstörungen Leukämie Platinderivate und Oxazaphosphorine wie Ifosphamid sind nephrotoxisch und können sowohl glomeruläre als auch tubuläre Nierenfunktionsstörungen nach sich ziehen – bis hin zur terminalen Niereninsuffizienz. • Schädigungen des zentralen Nervensystems Quelle: privat Insbesondere jene Kinder, die eine kraniale Strahlentherapie erhalten haben, leiden unter vielschichtigen kognitiven Problemen, von Konzentrationsschwierigkeiten über motorische Defizite bis hin zu Teilleistungsstörungen – etwa in der sprachlichen Entwicklung – und psychischer Instabilität. Auch die Steroiddauertherapie wird mit neurologischen Schäden in Zusammenhang gebracht. Gabriele Calaminus betont, dass gerade diese kognitiven Defizite die Lebensqualität der Kinder oft sehr stark beeinträchtigen, sei es in der Schule oder später während der Berufsausbildung. • Störungen des endokrinen Systems Dr. Gabriele Calaminus, Leiterin des Projekts „Gesundheitsbezogene Lebensqualität und Spätfolgen bei krebskranken Kindern und Jugendlichen“. Besonderes Augenmerk gilt hier der Schilddrüse und den Gonaden. Infertilität ist unter ehemaligen Krebskindern eine mögliche Folgeerscheinung der Chemotherapie. Bestrahlungen des Schädels führen zu einer Dysregulation der Adeno- und/oder Neurohypophyse, die sich vor allem in einem Ausfall der Produktion von Wachstumshormon manifestieren kann. Auch wenn viele Kinder den Rückstand nach der Therapie rasch aufholen, muss die körperliche Entwicklung genau beobachtet werden. • Infektanfälligkeit Niedergelassene Pädiater könnten eine wichtige Rolle in der Langzeitnachsorge übernehmen. „Was der niedergelassene Arzt vor allem braucht, sind gut verfügbare Informationen.“ G. Calaminus Auch zwei Jahre nach dem Ende der Leukämietherapie lassen sich im Immunsystem noch gewisse Defekte nachweisen. Die Kinder sind also anfälliger für Infektionen als gesunde Gleichaltrige. Deshalb spielen prophylaktische Maßnahmen wie Impfungen und eine frühzeitige Antibiotikatherapie in der pädiatrischen Krebsnachsorge eine wichtige Rolle. Forschungsbrennpunkt Nachsorge Im Zusammenhang mit den Sekundärmalignomen weist Gabriele Calaminus auf eines der großen Probleme der Kinderonkologie hin: die fehlenden Langzeitstudien. „Das zentrale Kinderkrebsregister gibt es erst seit gut 20 Jahren, die längsten von uns untersuchten Verläufe gehen über 15 Jahre“, erklärt sie. „Wir wissen also gar nicht, was über diesen Zeitraum hinaus alles noch passieren kann.“ Zweitmalignome beispielsweise scheinen sich, wie amerikanische Studien zeigen, oft erst nach 20 bis 25 Jahren zu entwickeln. Also zu einem Zeitpunkt, an dem viele ehemalige Krebskinder schon fast vergessen haben, dass sie einmal krank waren. „Wir müssen sowohl die Patienten als auch die behandelnden Ärzte für diese möglichen Folgeerkrankungen sensibilisieren“, fordert Calaminus. „Und dazu brauchen wir mehr Informationen über den langfristigen Verlauf.“ Solche Informationen über die Spätfolgen liefern Projekte wie LESS. Kliniken und niedergelassene Ärzte melden eventuelle Folgeerkrankungen der von ihnen in der Nachsorge betreuten Patienten an das LESS-Studienzentrum, das die Daten dann zentral dokumentiert und auswertet. Dabei muss jeder Behandlungsschritt detailliert erfasst werden: Welches Medikament wurde in welcher Konzentration über welchen Zeitraum eingesetzt? Welche Therapie erzielte die beste Wirkung? Welche gesundheitlichen Probleme traten im weiteren Verlauf auf und wann manifestierten sie sich bevorzugt? Neue Herausforderung in der Praxis Bei den Leukämien obliegt vor allem die Beantwortung der letzten Frage zum großen Teil dem niedergelassenen Pädiater. Schließlich sind die betroffenen Kinder zum Zeitpunkt der Erkrankung in aller Regel so jung, dass sie auch nach ihrer Heilung noch jahrelang in der Obhut • Zweitmalignome Viele Chemotherapeutika und ganz besonders die des Kinderarztes bleiben. Gabriele Calaminus Hochdosisstrahlentherapie besitzen selbst kanze- möchte die pädiatrischen Praxen deshalb gerne enger in die Langzeitnachsorge mit einbeziehen. rogene Wirkung und bergen deshalb die Gefahr, ein Sekundärmalignom auszulösen. Diese Tumore Auch in den ambulanten Abschnitten der Krebskönnen sich bereits im ersten Jahr nach der Primär- therapie, also zum Beispiel der Dauertherapiephase, können sie einen Teil der Verlaufskonbehandlung entwickeln – unter Umständen aber trollen übernehmen – so dass kleine Patienten auch erst nach über 20 Jahren. Nach den Daten nur noch zu jedem zweiten Termin ins Tumordes Kinderkrebsregisters in Mainz liegt die Inzidenz der Zweitmalignome bei ALL-Patienten in zentrum kommen müssen. „Manche Untersuden ersten zehn Jahren nach Abschluss der Thera- chungen kann der Kinderarzt natürlich nicht leisten, weil ihm schlicht die diagnostischen pie bei zwei Prozent. 17 Forschungsfeld Therapieoptimierung Dass die Krebsforschung ihr Augenmerk derzeit sehr stark auf die Ermittlung von Kriterien für das individuelle Spätfolgenrisiko richtet, hat aber noch einen anderen Grund. Denn neue Medikamente, die die Leukämietherapie weiter revolutionieren könnten, sind momentan nicht in Sicht. Deshalb versuchen Onkologen, die Behandlung auf andere Weise zu optimieren. Zum einen wird die Dosierung der Chemotherapeutika verfeinert, nach dem Motto: „So viel wie nötig und so wenig wie möglich“. Zum anderen erhalten die kleinen Patienten schon während der Therapie supportive Medikamente, die mögliche Nebenwirkungen verhindern oder zumindest abschwächen sollen. Beispielsweise lassen sich Kinder mit einem erhöhten Risiko für eine Kardiomyopathie anhand des echokardiografischen Befundes ermitteln und dementsprechend prophylaktisch behandeln. In die individuelle Risikostratifizierung und die daraus resultierende Therapieoptimierung setzt Gabriele Calaminus große Hoffnungen: „Die Spätfolgen werden sich dadurch reduzieren – und manche Komplikationen kindlicher Leukämien sehen wir vielleicht in 20 Jahren gar nicht mehr.“ Für Kinder wie Luis, deren einst tödliches Leiden heute geheilt werden kann, sind das sehr gute Nachrichten. Leukämie Möglichkeiten fehlen“, räumt die Onkologin ein. „Doch vor allem nach dem ersten Behandlungsjahr macht die zweigleisige Nachsorge Tumorzentrum-Pädiater unter bestimmten Vorraussetzungen Sinn und wird in ländlichen Gegenden teilweise schon erfolgreich praktiziert.“ Voraussetzung dafür ist allerdings, dass die niedergelassenen Pädiater wissen, mit welchen Symptomen und Spätfolgen sie zu welchem Zeitpunkt rechnen sollten und welche Untersuchungen wann notwendig werden, um eventuelle Komplikationen möglichst frühzeitig zu erkennen. „Was der niedergelassene Arzt vor allem braucht, sind gut verfügbare Informationen“, betont Calaminus. „Hier müssen wir noch viel Energie investieren.“ Projekte wie LESS oder die Studien „Gesundheitsbezogene Lebensqualität und Spätfolgen bei krebskranken Kindern und Jugendlichen“ zielen deshalb auch nicht nur darauf ab, mögliche Folgeerscheinungen einfach zu erfassen. LESS möchte, wie Projektleiter Jörn Beck betont, den Ärzten einen Leitfaden mit konkreten Empfehlungen für die bestmögliche Nachsorge ihrer jungen Patienten in die Hand geben. Dabei sollen neue wissenschaftliche Erkenntnisse möglichst rasch in die therapeutischen Leitlinien einfließen und umgesetzt werden, so dass eine vertikale Vernetzung ermöglicht wird. „Um die optimalen Präventionsstrukturen zu schaffen, müssen die verschiedenen ärztlichen Disziplinen eng zusammenarbeiten“, fordert Gabriele Calaminus. Literatur: • Creutzig, U et al: Krebserkrankungen bei Kindern. Deutsches Ärzteblatt. 2003 März; 100 (13). • Creutzig, U et al: Kompetenznetz Pädiatrische Onkologie und Hämatologie (Editorial). Klin Pädiatrie. 1999; 211: 187-188. • Creutzig, U et al: Vertikale Vernetzung in der Pädiatrischen Onkologie. Onkologe. 2000; 6: 814-818. • Langer, T et al: Basic methods and the developing structure of a late effects surveillance system (LESS) in the long term follow-up of pediatric cancer patients in Germany. Medical and Pediatric Oncology. 2000; 34: 348-352. • Calaminus, G et al: Quality of Life in Children with Cancer. Klin. Pädiatrie. 2000; 212: 211-215. Abb. unten: Teilprojekt der KPOH zur vertikalen Vernetzung verschiedener therapeutischer und wissenschaftlicher Einrichtungen. Quelle: Kompetenznetz pädiatrische Onkologie und Hämatologie 18 © Kompetenznetzprojekt Vertikale Vernetzung Leukämie Nachsorgeplan des Kompetenznetzprojektes Vertikale Vernetzung