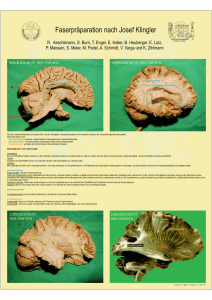
Dokument_34.
Werbung

Aus der Neurochirurgischen Klinik mit Poliklinik der Friedrich-Alexander-Universität Erlangen-Nürnberg Direktor: Prof. Dr. med. M. Buchfelder Untersuchung der Konnektivität der Sprachareale mittels Diffusions-Tensor-Bildgebung Inaugural–Dissertation zur Erlangung der Doktorwürde der Medizinischen Fakultät der Friedrich–Alexander–Universität Erlangen–Nürnberg Vorgelegt von Amir Zolal aus Pilsen Gedruckt mit Erlaubnis der Medizinischen Fakultät der Friedrich-Alexander-Universität Erlangen-Nürnberg Dekan: Prof. Dr. med. Dr. h.c. J. Schüttler Referent: Prof. Dr. med. Ch. Nimsky Korreferent: Prof. Dr. med. M. Buchfelder Tag der mündlichen Prüfung: 9.2.2011 Inhaltsverzeichnis Zusammenfassung ..................................................................................................1 Hintergrund und Ziele ...........................................................................................1 Methoden ..............................................................................................................1 Ergebnisse und Beobachtungen .............................................................................2 Praktische Schlussfolgerungen ..............................................................................2 Abstract ...................................................................................................................3 Background and Objectives ...................................................................................3 Methods ................................................................................................................3 Results ..................................................................................................................4 Conclusion ............................................................................................................4 Einleitung ................................................................................................................5 Kortikale Repräsentation der Sprache ....................................................................5 Geschichte ........................................................................................................5 Aktuelle fMRT- und Elektrostimulations-Studien ...............................................6 Konnektivität ........................................................................................................8 Konnektivität des phonologischen Systems ........................................................8 Konnektivität des semantischen Systems ............................................................8 Erörterung der Techniken ......................................................................................9 BOLD-fMRT .....................................................................................................9 DTI ...................................................................................................................9 Konnektivitätsanalyse mit dem A*-Algorithmus ............................................... 10 Ziel der Doktorarbeit ........................................................................................... 11 Patienten und Methoden....................................................................................... 12 Patienten und Probanden ..................................................................................... 12 Durchführbarkeit des Konnektivitätsanalyse-Algorithmus und Einfluss des Tumors auf die Diffusionsparameter ............................................................... 14 Verwendung der DTI-rekonstruierten Sprachbahnen in der Neuronavigation .. 16 Methoden ............................................................................................................ 16 Konnektivitätsanalyse mit dem A*-Algorithmus ............................................... 17 Rekonstruktion der Faserbahnen in iPlan Cranial 2.5 ..................................... 19 Verwendung der rekonstruierten Faserbahnen während der Operation ...........24 Import der Konnektivitätsanalyse-Faserbahnen in die Neuronavigation ..........26 Intraobserver-Variabilität bei der Konnektivitätsanalyse ................................ 29 Ergebnisse ............................................................................................................. 30 Allgemein ...........................................................................................................30 Durchführbarkeit des Konnektivitätsanalyse-Verfahrens ................................. 30 Intraobserver-Variabilität bei der Konnektivitätsanalyse ................................ 31 Interindividuelle Variabilität ...........................................................................33 Vergleich beider Methoden der Bahnrekonstruktion ............................................ 35 Verwendung der DTI-Faserbahnen in der Neuronavigation und klinischer Verlauf ........................................................................................................................... 38 Einfluss der Tumoren auf den FA-Wert ............................................................... 40 Kontrollgruppe ................................................................................................ 41 Patientengruppen ............................................................................................ 41 Fasciculus arcuatus ........................................................................................ 41 Fasciculus occipitofrontalis inferior ................................................................ 43 Einfluss des Tumorgrades ................................................................................... 46 Diskussion ............................................................................................................. 47 Ziele und klinische Anwendung der Traktographie.............................................. 47 Schonung der neuronalen Strukturen und Radikalität der Resektion .................... 48 Durchführbarkeit der Konnektivitätsanalyse bei Patienten mit supratentoriellen neuroepithelialen Tumoren .................................................................................. 50 Vergleich der Konnektivitätsanalyse mit dem Standardverfahren ........................ 51 Einfluss der Tumoren auf die FA-Mittelwerte der Bahnen ................................... 52 Literaturverzeichnis ............................................................................................. 54 Abkürzungen......................................................................................................... 61 Danksagung ...........................................................................................................62 Lebenslauf ............................................................................................................. 63 1 Zusammenfassung Hintergrund und Ziele Seit der Einführung der Diffusions-Tensor-Bildgebung (Diffusion Tensor Imaging, DTI) wurden enorme Fortschritte in der nichtinvasiven Darstellung der neuronalen Strukturen erzielt. Mit DTI lässt sich die Intensität der Brown‟schen MolekularBewegung der Wassermoleküle feststellen, und damit die Verstärkung in einer Richtung, die im Gewebe mit parallel-orientierten Axonmembranen zu beobachten ist. Unter Verwendung dieser Information kann dann die Mikrostruktur des Gewebes abgebildet werden. Eine vielversprechende Anwendung ist die sogenannte Traktographie, die zur Darstellung der Nervenbahnen der weißen Substanz dient. Die Ergebnisse der Traktographie können klinisch in präoperativer Planung und intraoperativer Neuronavigation angewendet werden. Das Ziel dieser Doktorarbeit ist es, bei Patienten mit supratentoriellen neuroepithelialen sprachrelevanten Tumoren die Faserbahnen Konnektivitätsanalyse-Algorithmus Durchführbarkeit mit Hilfe auszuwerten, der Darstellung eines und der experimentellen die gewonnenen Diffusionsparameter der rekonstruierten Faserbahnen zu evaluieren. Die Ergebnisse der operativen Eingriffe, die unter Verwendung der DTI-Faserbahnen durchgeführt wurden, wurden in dieser Arbeit zusammengefasst. Methoden Für die intraoperative Visualisierung der DTI-Traktographie wurde die Software iPlan 2.5 (BrainLab) verwendet, die einen Standardalgorithmus aus der Gruppe der „tensor-deflection“ Algorithmen enthält. Insgesamt wurden in diese Studie 38 Patienten und 5 Probanden eingeschlossen. Die Studie wurde aus praktischen Gründen in zwei Teilen konzipiert. Ein Teil der Studie befasst sich mit Patienten, die von Juli 2005 bis August 2007 in Erlangen unter Verwendung der SprachFaserbahnen in der Neuronavigation operiert wurden. Diese Untergruppe enthält 28 Patienten (18 männliche, 10 weibliche, Alter 17-67, Durchschnittsalter 43,6 Jahre ± 15,6). Im zweiten Teil der Studie wurden die Sprachbahnen bei 30 Patienten und 5 Probanden unter Verwendung des Konnektivitätsanalyse-Algorithmus rekonstruiert. 20 Patienten davon mit supratentoriellen neuroepithelialen Tumoren stellten die Patientengruppe für die statistische Auswertung der Diffusionsparameter der Faserbahnen dar, 5 Probanden und 5 Patienten mit rechts liegenden Tumoren ohne 2 Bezug zu den Sprachbahnen wurden als Kontrollgruppe definiert. Als Startpunkte für den Algorithmus wurden sprachrelevante fMRT-Aktivierungen (funktionelle Magnetresonanztomographie) der linken Hemisphäre verwendet. Die resultierenden FA-Mittelwerte (fractional anisotropy) für beide Gruppen wurden gesammelt und statistisch ausgewertet. Ergebnisse und Beobachtungen Klinisch wurde bei 4 Patienten, die unter Verwendung der Sprach-Faserbahnen operiert wurden, am ersten postoperativen Tag eine Verschlechterung der Sprachstörungen oder das Auftreten von neuen Sprachstörungen beobachtet. In 3 Fällen zeigte sich die Sprachstörung nach zehn Tagen rückläufig, in einem Fall ist es zu einer Progredienz des Tumorwachstums zusammen mit dem Auftreten von neuen neurologischen Defiziten einschließlich Aphasie gekommen. Eine anatomische Darstellung des Fasciculus arcuatus konnte unter Verwendung des Konnektivitätsanalyse-Algorithmus bei den 30 untersuchten Patienten und 5 Probanden gefunden werden; der Fasciculus occipitofrontalis inferior konnte in nur zwei Fällen nicht dargestellt werden. In der Untergruppe der Patienten mit neuroepithelialen Tumoren waren die FA-Mittelwerte der rekonstruierten Faserbahnen, die weniger als 20 mm vom Tumor entfernt lagen, statistisch signifikant niedriger als die FA-Mittelwerte der Kontrollgruppe. Praktische Schlussfolgerungen Beide sprachrelevanten Fasciculi können in den meisten Fällen als 3D-Faserbahnen zwischen sprachrelevanten fMRT-Aktivierungen mittels des KonnektivitätsanalyseAlgorithmus erfolgreich dargestellt werden. Das erlaubt die Anwendung dieser Methode in präoperativer Planung oder intraoperativer Neuronavigation. Die anatomische und physiologische Genauigkeit und die klinische Zuverlässigkeit der erworbenen Daten muss jedoch auch wegen der Veränderungen der Diffusionsparameter in der Nähe von neuroepithelialen Tumoren noch weiter evaluiert werden. 3 Abstract Background and Objectives Since the introduction of diffusion tensor imaging (DTI), enormous progress has been made in the field of noninvasive visualization of neuronal structures. Using DTI, it is possible to determine the intensity of the Brownian motion of water molecules, and also the increase in intensity in one direction that can be found in tissue with longitudinally oriented axonal membranes. Using this information, the microstructure of the tissue can then be visualized. A promising use is a so-called tractography, which is used to depict the neuronal fascicles in the white matter. Clinically, the results of tractography can be used in preoperative planning and intraoperative navigation. The objective of this dissertation is to analyze the feasibility of reconstruction of language-relevant fiber tracts with the use of an experimental connectivity analysis algorithm and to evaluate the diffusion parameters of the reconstructed fiber tracts. The results of operations that were performed with the use of DTI fiber tracts are also summarized in the manuscript. Methods The software iPlan 2.5 (BrainLab) was used for the intraoperative visualization of the DTI tractography; this software uses a standard tensor-deflection algorithm. In total, 38 patients and 5 healthy volunteers were included in this study. The study was divided into two parts for practical reasons. One part of the study describes the patients that were operated on from July 2005 till August 2007 in Erlangen with the use of language fiber tracts in navigation. This subgroup contains 28 patients (18 male, 10 female, ages 17-67, average 43.6 ± 15.6). In the second part of the study, the language fiber tracts were reconstructed using the connectivity analysis algorithm in 30 patients and 5 volunteers. Of these, 20 patients with supratentorially located neuroepithelial tumor represented the patient group for the statistical analysis of the diffusion parameters. 5 patients harboring a right sided tumor with no relationship to the language tracts and 5 normal volunteers represented the control group. Language fMRI-defined (functional magnetic resonance imaging) cortical areas in the left hemisphere were used as start areas for the algorithm. The resulting FA (fractional anisotropy) averages were collected for both groups and statistically analyzed. 4 Results A clinical deterioration in the preexisting language deficits or a new language deficit on the first postoperative day was observed in 4 patients that were operated on using the visualized language fiber tracts. The deficit had regressed after ten days in 3 of these cases, in one case there was a progressing growth of the tumor causing new neurological deficits including aphasia. An anatomically corresponding visualization of the arcuate fascicle could be achieved in all 30 patients and 5 volunteers; the inferior occipitofrontal fascicle could not be visualized in 2 cases. In the group of patients with neuroepithelial tumors, the FA averages of the reconstructed fiber tracts were significantly lower than in the control group in cases, where the distance between the tumor and the fiber tract was lower than 20 mm. Conclusion Both fascicles relevant to language could be reconstructed as 3D fiber tracts running between the fMRI based areas using the connectivity analysis algorithm. This allows for the use of this method in preoperative planning and intraoperative navigation. The anatomic and physiologic accuracy and the clinical reliability must however be further evaluated, also because of the changes of diffusion parameters in the vicinity of neuroepithelial tumors. 5 Einleitung Kortikale Repräsentation der Sprache Geschichte Die Grundlagen der klassischen Broca-Wernicke-Theorie wurden schon im neunzehnten Jahrhundert gelegt. Marc Dax (1770-1837) hat 1836 seine klinische Beobachtungen der Dominanz der linken Hemisphäre beschrieben [6]. Danach wurde der funktionelle Unterschied zwischen linker und rechter Hemisphäre, sowie der Zusammenhang zwischen Schädigung der linken Hemisphäre und einem klinischen Defizit im Sinne einer motorischen Aphasie 1861 von Paul Broca (18241880) als Fallbeobachtung eines Patienten beschrieben, der unter einem links-frontal gelegenen chronischen Hirnabszess litt. Derselbe Autor hat dann 1863 eine Studie mit 25 Fällen einer Aphasie (die er damals als „Aphemie“ bezeichnete) publiziert. 1865 hat er in seiner bekanntesten Arbeit die dritte linke frontale Hirnwindung als Sitz der artikulierten Sprache beschrieben, wobei auch die Arbeit von Marc Dax zitiert wurde [12]. So entstand die Bezeichnung „Broca-Areal“, die heute für die Brodmann-Areale (BA) 44 (Pars opercularis gyri frontalis inferioris) und 45 (Pars triangularis gyri frontalis inferioris) verwendet wird [5]. In dieser Arbeit erwähnte Broca auch die Theorie, dass bei einem kleinen Anteil der Population die rechte Hemisphäre dominant wird, weil auch die motorischen Funktionen, die normalerweise linksdominant sind und damit zur Rechtshändigkeit führen, in einem kleinen Anteil der Population offensichtlich rechtsdominant sind [12]. 1874 publizierte Carl Wernicke (1848-1905) seine Arbeit „Der aphasische Symptomencomplex”. In der Arbeit postulierte er, dass die von Broca beschriebenen Areale nicht bei allen Patienten mit Aphasien beschädigt sind, und dass auch die Schädigung der linkshemisphärischen perisylviischen Areale Aphasien verursacht. Darüber hinaus hat Wernicke die klassische Gliederung der Aphasien eingeführt, indem er drei Typen von Aphasie beschrieben hat: Die sensorische Aphasie (sogenannte Wernicke-Aphasie), die Leitungsaphasie und die motorische (Broca) Aphasie [12]. Heute werden die Brodmann-Areale 42 (Planum temporale), 22 (Gyrus temporalis superior) und 21 (der obere Teil des Gyrus temporalis medius) als Wernicke-Areal bezeichnet [5]. 6 Aktuelle fMRT- und Elektrostimulations-Studien Die aktuellen Studien, die sich mit der kortikalen Repräsentation der Sprache und mit der Darstellung sprachrelevanter Regionen befassen, weisen auf ein kompliziertes kortikales Netzwerk hin. Die meisten experimentellen Studien beschreiben drei funktionell und morphologisch unterschiedlich verbundene Teilfunktionen des kortikalen Sprachnetzwerks: Phonologie, Semantik und Syntax. Als phonologische Funktionen bezeichnet man hierbei die Funktionen, die die Perzeption der Laute als Einheiten im System einer Sprache ermöglichen. Semantische Funktionen betreffen die Fähigkeit, die Bedeutung der Sprachelemente wahrzunehmen und als Kommunikationsmittel zu verwenden. Die Fähigkeiten den Satzbau zu verstehen und Phrasen und Sätze zusammenzustellen, bezeichnet man als syntaktische Funktionen. [63]. Die phonologischen Kortexbereiche sind nach der neuen Metaanalyse der fMRTStudien [63] im Frontal-, Temporal- und Parietallappen lokalisiert. Im Frontallappen wurden in dieser Metaanalyse fünf Aktivierungscluster beschrieben. Ein Aktivierungscluster befindet sich im Sulcus Rolandi in der Nähe des motorischen Mundbereichs. Dieser Cluster wird nicht nur bei der Artikulierung, sondern auch beim Anhören von Silben aktiviert. Diese Beobachtung wird von den Ergebnissen einer anderen Studie [19] unterstützt, wo ein Anstieg von evozierten Potentialen im Bereich der Zungenmuskeln beim Anhören von gesprochener Sprache beschrieben wurde. Deswegen soll die kortikale Repräsentation der Phoneme nach dieser Metaanalyse nicht nur schall-kodiert, sondern durch Schall und motorisch kodiert sein. Andere frontale Aktivierungscluster wurden im Bereich des unteren Gyrus präcentralis, im Operculum Rolandi und im dorsalen Anteil der Pars triangularis gyri frontalis inferioris beschrieben, wobei sich die Pars triangularis gyri frontalis inferioris (F3td) an der phonologischen Gedächtnisschleife beteiligt. In einer neuen Elektrostimulations-Studie [14] wurden im ventralen Anteil des BA 6 (vPMC ventral premotor cortex, vorderer Anteil des Gyrus präcentralis) ähnliche oder gleiche Bereiche beschrieben, die bei Inaktivierung mittels zweiphasiger Stromstimulation Sprachstörungen im Sinne einer Anarthrie produziert hatten. Im Temporal- und Parietallappen wurden in der oben erwähnten Metaanalyse zwei Cluster mit Aktivierung während phonologischer Aufgaben gefunden: Planum temporale (PT) und Gyrus supramarginalis (SMG). SMG bildet gemeinsam mit F3td die phonologische Gedächtnisschleife. 7 Die semantischen Kortexbereiche sind nach der oben erwähnten Metaanalyse im Frontallappen meistens rostral von den phonologischen Aktivierungen lokalisiert. Folgende Aktivierungscluster wurden beschrieben: Dorsaler Anteil der Pars opercularis gyri frontalis inferioris, die Grenzzone zwischen der Pars opercularis der dritten frontalen Hirnwindung und dem Gyrus präcentralis, Pars triangularis gyri frontalis inferioris, und Pars orbitalis gyri frontalis inferioris, wobei die Partes opercularis und triangularis der dritten frontalen Hirnwindung (BA 44 und 45, Wernicke-Areal) auch in der Elektrostimulations-Studie als Bereiche, die kompletten Speech-Arrest verursachen, beschrieben wurden. In einer anderen Studie der selben Autoren [17] sind bei 5 von 9 Patienten bei intraoperativer Untersuchung semantische Paraphasien aufgetreten, und zwar bei Stimulation im Bereich der Pars orbitalis gyri frontalis inferioris, oder im Gyrus frontalis medialis, also rostral von den Bereichen, deren Stimulierung zu Anarthrien führte. Im Temporal- und Parietallappen viele wurden in der fMRT-Metaanalyse semantische Aktivierungscluster identifiziert: Im Temporalpol, im vorderen und hinteren Teil des Gyrus temporalis superior, im Gyrus temporalis medius und Gyrus fusiformis, sowie im Gyrus angularis (AG). Die Elektrostimulations-Studie [17] hat im Temporallappen folgende Bereiche identifiziert: Gyrus temporalis superior im hinteren unteren Teil und Gyrus temporalis medius im hinteren oberen Teil. Das entspricht einem Teil der Ergebnisse aus der Metaanalyse, die ElektrostimulationsStudie hat jedoch nicht den ganzen Kortex des Temporal- und Parietallappens umfasst, weil sich die Autoren auf den Bereich der Trepanation einschränken mussten. Syntaktische Funktionsbereiche sind nach Angaben der oben erwähnten Metaanalyse mit den anderen Modalitäten vermischt. Im Frontalkortex wurden Aktivierungscluster im Gyrus frontalis medius und zusammen mit semantischen Funktionen im dorsalen Anteil der Pars opercularis gyri frontalis inferioris und Pars triangularis gyri frontalis inferioris identifiziert. Im Temporal- und Parietallappen befinden sich die Aktivierungscluster im Bereich des Temporalpols, des vorderen Teils des Gyrus temporalis superior, des Gyrus temporalis medius und am hinteren Rand des Sulcus temporalis superior [63]. 8 Konnektivität Konnektivität des phonologischen Systems Die anatomischen sowie die DTI-Studien [51] haben gezeigt, dass der Fasciculus arcuatus (superior longitudinal fascicle, SLF) die Gyri frontales mit dem hinteren lateralen Teil des Gyrus temporalis superior einschließlich Planum temporale [63], und auch mit dem oben diskutierten Gyrus supramarginalis [16], verbindet. Der Fasciculus verläuft durch die Capsula externa um die Insel. Direkte Inhibition des Fasciculus mittels intraoperativer Elektrostimulation verursacht Sprachstörungen im Sinne einer Anomie, entsprechend den Symptomen, die man als Leitungsaphasie bezeichnet [15], oder phonologische Paraphasien [36]. hemisphärischen weißen Substanz, wie der Fasciculus Andere Teile der subcallosus, die periventrikuläre weiße Substanz und insulo-frontale Verbindungen spielen auch eine gewisse Rolle in der phonologischen Konnektivität [15]. Konnektivität des semantischen Systems Die Rolle des Fasciculus longitudinalis inferior (ILF) und des Fasciculus uncinatus im semantischen Netzwerk wurde von mehreren Autoren diskutiert [63], [51], [36], [13]. Der ILF verbindet den hinteren Teil des Sulcus temporalis superior und Gyrus fusiformis mit dem Temporalpol [8]. Die Information soll dann durch den Fasciculus uncinatus weitergeleitet werden. Die aktuellen Elektrostimulations-Studien weisen jedoch darauf hin, dass die Stimulation des ILF keine Sprachstörungen verursacht, und dass auch nach der Resektion des ILF keine langfristigen Sprachdefizite auftreten [36]. Als anatomisches Korrelat der von Parker beschriebenen ventralen Bahn bezeichnen beide oben erwähnte aktuelle Elektrostimulations-Studien den Fasciculus occipito-frontalis inferior [13], [36], die Existenz einer indirekten Sprachbahn im ILF bleibt fraglich. Die Verbindung des semantischen Systems soll nach den neuesten Studien durch den Fasciculus occipitofrontalis inferior (IOFF – inferior occipitofrontal fascicle) verlaufen [36], [17]. Die Anatomie dieser Faserbahn wurde kürzlich von Kier et al. in einer kombinierten Studie mit MRT und anatomischer Präpariation erörtert [27]. Der Fasciculus occipitofrontalis inferior verläuft durch den Temporallappen und durch die weiße Substanz zwischen dem Temporal- und Frontallappen („temporal stem“) in die Capsula externa und extrema, wo er oberhalb der Fasern des Fasciculus uncinatus liegt. Im Temporallappen stellt der IOFF eine lange rostrocaudal 9 verlaufende Faserbahn dar. Der höchste Punkt der Faserbahn liegt in der Ebene des Vorderhorns des Seitenventrikels [27]. Erörterung der Techniken BOLD-fMRT Die Grundlage der fMRT ist der Blood Oxygen Level Dependent (BOLD)-Effekt [50]. Paramagnetisches Desoxyhämoglobin verursacht (im Gegenteil zum diamagnetischen Oxyhämoglobin) lokale Feldinhomogenitäten, die zur Verkürzung der T2*-Zeiten führen [54]. Da die neuronale Aktivität zu einer lokal erhöhten Durchblutung und zum Gradientenechosequenzen, erhöhten die auf Sauerstoffbedarf lokale führt, Feldinhomogenitäten zeigen die besonders empfindlich reagieren, bei verstärkter neuronaler Aktivität eine schwache Intensitätserhöhung im Bild. Der Unterschied im Kontrast kann zwar normalerweise nicht beobachtet werden, unter Verwendung statistischer Methoden sind aber die Aktivierungen nachweisbar. Die Ergebnisse der fMRT sind jedoch von den Fähigkeiten und der Konzentration des Patienten, sowie vom verwendeten Stimulationsparadigma abhängig, da die sprachrelevante neuronale Aktivität nur durch die bewusste Tätigkeit hervorgerufen werden kann. DTI Diffusion-Tensor-Imaging (DTI) ist eine Bildgebungsmethode, deren Prinzip auf den variierenden Diffusionseigenschaften von Wassermolekülen in Abhängigkeit von ihrer Umgebung beruht. In einer Flüssigkeit befinden sich Moleküle in ständiger Bewegung (die Brown„sche Molekularbewegung). Die Bewegungsrichtung eines Moleküls ist vollkommen zufällig, außerdem erfolgen aufgrund der Wechselwirkung mit anderen Molekülen ständige Richtungsänderungen. Deswegen lässt sich für ein einzelnes Molekül nicht vorhersagen, in welche Richtung oder wie weit es sich in einer bestimmten Zeit von seinem ursprünglichen Aufenthaltsort fortbewegen wird. Durchschnittlich diffundieren jedoch Moleküle in alle Richtungen gleich schnell. Dieses Phänomen wird als isotrope Diffusion bezeichnet und lässt sich in homogenen Flüssigkeiten nachweisen (z.B. im Liquor). In der weißen Substanz, die vor allem aus den Axonen besteht, werden die Wassermoleküle jedoch durch strukturelle Barrieren wie Zellmembranen an der gleichmäßigen Diffusion gehindert. Die 10 Wahrscheinlichkeit der Bewegung in Längsrichtung der Axone ist daher größer als die in Querrichtung. Dieses Phänomen wird als anisotrope Diffusion bezeichnet. Bei diffusionsgewichteten Bildgebungsmethoden lassen sich der Grad der Anisotropie, die Stärke der Diffusion, sowie die Hauptrichtung der Diffusion feststellen. Die diffusionsgewichtete MR-Messmethode (DW-MRI) wurde bereits Mitte der 80er Jahre entwickelt [34]. Inzwischen hat die DW-MRI einen festen Platz in der radiologischen Diagnostik bei Erkrankungen des Zentralnervensystems; die wichtigste Anwendung ist derzeit in der Frühdiagnostik der zerebralen Ischämie [39]. Reine DW-MRI ergibt jedoch keine Information über die Richtung der Diffusion. Das Prinzip der Diffusionstensor-Bildgebung beruht darauf, dass pro Schicht mindestens sieben Aufnahmen gemacht werden. Die erste ist eine T2-Aufnahme. Für die weiteren sechs wird jeweils ein Gradient in eine bestimmte Richtung zusätzlich geschaltet. So erhält man pro Voxel (Element der dreidimensionalen Rasterdarstellung der MRT) einen Diffusionskoeffizienten für jede der sechs Richtungen im Raum [2]. Konnektivitätsanalyse mit dem A*-Algorithmus Die klassischen Traktographie-Algorithmen zur Rekonstruktion der neuronalen Bahnen verwenden den Haupteigenvektor des Diffusionstensors. In Regionen, die anisotrope Diffusionseigenschaften aufweisen, korreliert der Haupteigenvektor mit der Hauptrichtung der Diffusion. Im Falle von Kreuzungen oder Verzweigungen der Faserbahnen liegen jedoch planare oder sogar kugelförmige Tensoren vor. In diesen Fällen kommen mehrere Richtungen mit der gleichen Diffusionswahrscheinlichkeit vor, die für die Rekonstruktion berücksichtigt werden müssen. Die üblichen Fibertracking Algorithmen, wie „streamline propagation“ [40], „tensor deflection“ [33] oder eine Kombination beider Verfahren können diese Voraussetzung nicht erfüllen, weil die Entscheidung in jedem Fall nur für eine Richtung getroffen wird, die dann für die Weiterführung der Bahn verwendet wird. Deswegen wurden alternative Techniken entwickelt, die stochastische oder auf Graphentheorie basierende Methoden verwenden. Das Verfahren zur Konnektivitätsanalyse [37] gehört zu der letzteren Gruppe. Für die Berechnung der Bahn zwischen dem Start- und Zielknoten baut er einen Graph (ein mathematisches Gebilde, das aus Knoten besteht, die durch Kanten verbunden sind) zwischen den beiden Knoten auf. Jeder Kante des Graphs ist ein lokaler Kostenwert zugeordnet. In 11 jeder Iteration wird dann die Bahn mit den niedrigsten Kosten gesucht, die vom Start- zum Zielknoten führt. Die wichtigen Parameter des Algorithmus sind der „walkability threshold“, ein adäquates Suchgitter, und die Kostenfunktion. Unter „walkability threshold“ versteht man den Schwellenwert der fraktionalen Anisotropie (FA), der zur Differenzierung zwischen der weißen und grauen Substanz dient. Der lokale FA-Wert wird dann zur Entscheidung benutzt, ob der Graph in der jeweiligen Richtung ausgebaut wird. Im Suchgitter des KonnektivitätsanalyseAlgorithmus ist jeder Knoten mit 74 Nachbarn verbunden. Die Kostenwerte sind den Kanten aufgrund der lokalen Tensordaten zugeordnet. Mit Hilfe einer Kostenfunktion und einer Such-Heuristik wird der Graph aufgebaut, und mögliche Verbindungen zum Ziel gefunden. Das Suchvolumen des Algorithmus kann auch vom Benutzer nach anatomischen Angaben eingegrenzt werden. Ziel der Doktorarbeit Das Ziel dieser Doktorarbeit ist es, bei Patienten mit supratentoriellen neuroepithelialen Tumoren die Durchführbarkeit der Darstellung der Sprachfaserbahnen mit dem neuen Konnektivitätsanalyse-Algorithmus auszuwerten, die Ergebnisse mit dem Standardverfahren zu vergleichen, und die gewonnenen Diffusionsparameter der rekonstruierten Faserbahnen zu evaluieren. Das Hauptinteresse liegt bei der Verwendung der gewonnenen Faserbahnen in der Neuronavigation und bei den klinischen Folgerungen. 12 Patienten und Methoden Patienten und Probanden Insgesamt wurden in diese Studie 38 Patienten und 5 Probanden eingeschlossen. Die Studie wurde in zwei Teilen konzipiert. Bei 28 Patienten wurde eine Darstellung der sprachrelevanten Faserbahnen in der Neuronavigation während einer Operation verwendet. In einem Teil widmet sich die Studie retrospektiv der Bewertung des postoperativen klinischen Verlaufs bezüglich der Sprachstörungen bei diesen Patienten und der Durchführbarkeit der Faserbahnrekonstruktion in der NavigationSoftware. Bei 30 Patienten und 5 Probanden wurde eine Faserbahnrekonstruktion mittels des Konnektivitätsanalyse-Algorithmus durchgeführt. In dieser Untergruppe wurden verschiedene Diffusionsparameter Aspekte der ausgewertet, und Faserbahnrekonstruktion die Ergebnisse wurden und die mit dem Standardverfahren vergleicht. Tabelle 1 gibt eine Übersicht von Patienten und Probanden. Nr. 1 2 3 Alter / Geschlech t 54 / m 65 / f 59 / m 4 38 / m 5 56 / m 6 36 / m 7 58 / f 8 9 65 / m 25 / m 10 11 12 13 67 / m 44 / f 17 / f 49 / m 14 41 / m 15 16 25 / f 36 / f 17 55 / m 18 33 / f Diagnose Konnektivitätsanalyse Glioblastom (WHO IV) links temporal Glioblastom (WHO IV) links frontal Glioblastom (WHO IV) links frontal – Rezidiv Astrozytom (WHO II) links frontoparietal Glioblastom (WHO IV) links frontotemporal anaplastisches Astrozytom (WHO III) rechts frontolateral anaplastisches Oligoastrozytom (WHO III) links frontal – Rezidiv Gangliogliom (WHO I) links temporal pilozytisches Astrozytom (WHO I) links temporoparietal – Rezidiv Glioblastom (WHO IV) links temporal Glioblastom (WHO IV) links zentral PNET (WHO IV) links frontoparietal anaplastisches Oligodendrogliom (WHO III) links frontal anaplastisches Astrozytom (WHO III) rechts temporal – Rezidiv DNET (WHO I) links frontal Oligoastrozytom (WHO II) links temporal anaplastisches Oligodendrogliom (WHO III) links fronta anaplastisches Oligoastrozytom (WHO III) links temporal Nein Ja Nein Sprache-DTI intraoperativ verwendet Ja Ja Ja Ja Ja Ja Ja Ja** Ja Nein Ja Ja Ja* Ja Ja Ja Ja Ja Nein Ja Ja Ja Ja Ja** Ja Nein Ja Ja Ja Ja Ja Ja Ja 13 19 24 / f 20 38 / m 21 59 / f 22 23 66 / m 32 / m 24 46 / m 25 19 / m 26 27 28 29 54 / m 22 / m 38 / f 63 / m 30 31 29 / m 47 / w 32 34 / m 33 34 35 49 / m 44 / w 37 / m 36 47 / m 37 38 40 / w 22 / m anaplastisches Astrozytom (WHO III) links frontal diffuses Astrozytom (WHO II) links frontal anaplastisches Astrozytom (WHO III) links temporal Glioblastom (WHO IV) links temporal Glioblastom (WHO IV) links temporooccipital anaplastisches Astrozytom (WHO III) links temporal – Rezidiv pharmakoresistente Epilepsie nach Schädel-Hirntrauma mit li. frontalen Kontusionen Epilepsie bei vaskulärem Hamartom Cavernom links frontal Astrozytom (WHO II) links parietal anaplastisches Astrozytom (WHO III) links postzentral Astrozytom (WHO II) links postzentral anaplastisches Oligodendrogliom (WHO III) links parietooccipital anaplastisches Oligoastrozytom (WHO III) links temporoparietal Glioblastom (WHO IV) links temporal Astrozytom (WHO II) links frontal anaplastisches Oligoastrozytom (WHO III) links temporal anaplastisches Astrozytom (WHO II) links frontotemporal AV - Angiom links parietal Kavernöses Angiom links frontal K1 K2 K3 K4 K5 K6 K7 K8 K9 K10 28 / w 27 / m 36 / m 24 / m 53 / m 40 / m 26 / m 23 / w 34 / m 27 / m Kontrollgruppe Proband Proband Gliom III rechts frontolateral Cavernom rechts parietal AV Hamartom rechts parietal Gliom III rechts temporal Proband Gliom II rechts occipital Proband Proband Ja* Ja Ja* Ja Ja Ja Nein Ja Ja Ja Nein Ja Nein Ja Nein Nein Nein Ja Ja Ja Ja Nein Ja Ja Nein Nein Ja Nein Ja Ja Ja Nein Nein Nein Ja Nein Ja* Ja* Nein Nein Patient 6 Patient 14 Tabelle 1: Übersicht von Patienten und Probanden; die Patienten, die mit der Konnektivitätsanalyse untersucht wurden, haben jedoch die unten erwähnte Einschlusskriterien für die Auswertung des Einflusses des Tumors auf die Diffusionsparameter nicht erfüllt, sind mit einem Stern (*) markiert; die Patienten, die unter Verwendung der rechtsseitigen Sprachbahnrekonstruktion operiert wurden, haben jedoch nach der fMRT-Analyse eine linksseitige Sprachdominanz und wurden auch in die Kontrollgruppe hinzugefügt, sind mit zwei Sternen (**) markiert 14 Durchführbarkeit des Konnektivitätsanalyse-Algorithmus und Einfluss des Tumors auf die Diffusionsparameter Ergebnisse von 30 Patienten und Probanden (10 weibliche, 20 männliche, Durchschnittsalter 41,2 Jahre ± 14,1) wurden in diesen Teil der Studie eingeschlossen. Von diesen Personen wurden 10 als Kontrollgrupe verwendet, darunter 5 Probanden und 5 Patienten mit rechtsliegendem Tumor (Subjekte K1K10, Tabelle 1). Die Patientengruppe enthält 20 Personen (Tabelle 1). Die Einschlusskriterien für die Patientengruppe waren: 1. fMRT und DTI Aufnahmen wurden zwischen 1.1.2005 und 31.3.2007 gemessen, die fMRT-Daten wurden bearbeitet und die resultierenden Aufnahmen als DICOM-Dateien gespeichert. 2. Neuroepithelialer Tumor gemäß der überarbeiteten WHO- Klassifikation [28] in der linken Hemisphäre. 3. Der Tumor befindet sich in der Nähe einer der Sprachbahnen. 4. Patienten mit Tumoren, die nicht näher als 30 mm von einer der rekonstruierten Sprachbahnen lagen, wurden ausgeschlossen. 5. Patienten mit Tumoren, die rostral von der dritten frontalen Hirnwindung oder kaudal des Gyrus angularis lagen, wurden ausgeschlossen. 6. Die linke Hemisphäre ist nach den fMRT Aufnahmen dominant für Sprache. Patienten mit rechtsseitiger Dominanz wurden ausgeschlossen und die Ergebnisse aus der rechten Hemisphäre wurden nicht mit den anderen verglichen, da die Verhältnisse zwischen der kortikalen Dominanz und der Asymmetrie der weißen Substanz in der Literatur in Frage gestellt wurden [62]. 15 Abbildung 1: Verteilung der WHO Grade unter den Patienten, die mit der Konnektivitätsanalyse untersucht wurden und die oben erwähnten Einschlusskriterien erfüllt haben Die Kontrollgruppe besteht aus den Fällen K1-K10 (n=10). Die Fälle K1, K2, K7, K9 und K10 sind Probanden. Fälle K3, K6 und K8 sind Patienten mit rechtsseitigem Tumor mit keiner Überschreitung oder Verlagerung der Mittellinie, Fälle K4 und K5 sind Patienten mit rechtsseitigem parietal liegendem cavernösem Hämangiom. Alle Personen in dieser Gruppe hatten gemäß der fMRT linksseitige Sprachdominanz. Die Sprach-fMRT-Untersuchung wurde bei diesen Patienten aus verschiedenen Gründen durchgeführt. Patient K6 (Tabelle 1, WHO III Gliom rechts temporal) ist Linkshänder. Patienten K3 und K5 (Tabelle 1, WHO Gliom III rechts frontolateral bzw. Cavernom rechts parietal) litten unter einer symptomatischen Epilepsie, wobei in der Anamnese Sprachstörungen bzw. Sprach-Arrest während des Anfalles beschrieben wurden. Die Untersuchung der Sprache mittels fMRT zeigte jedoch auch bei diesen Patienten eine deutliche Linksdominanz, und die klinische Untersuchung bei der Aufnahme ergab keine Sprachstörungen. In dieser Studie wurden nur Patienten mit linksseitiger Dominanz nach fMRT untersucht. Nach einer DTI-Studie von Vernooij et al. [62] ist jedoch die strukturelle Asymmetrie des Fasciculus arcuatus überwiegend linksdominant und unabhängig von der funktionellen Lateralisation der Hemisphären sowie von der Händigkeit. Außerdem ist die Verwendung der kontralateralen gesunden Hemisphäre als Kontrolle in der Literatur 16 bekannt [57], [21]. Die Daten der gesunden Hemisphären der oben erwähnten Patienten können somit zum Vergleich mit der Patientengruppe verwendet werden. Verwendung der DTI-rekonstruierten Sprachbahnen in der Neuronavigation Insgesamt wurden von Juli 2005 bis August 2007 in Erlangen 28 Patienten (18 männliche, 10 weibliche, Alter 17-67, Durchschnittsalter 43,6 Jahre ± 15,6) unter Verwendung der Sprach-Faserbahnen in der Neuronavigation operiert (Tabelle 1). Davon waren 23 Resektionen und 5 Biopsien. Bei allen Patienten wurde das bereits beschriebene Standardverfahren zur Rekonstruktion der Faserbahnen verwendet [45]. Die Bahnrekonstruktion wurde im iPlan Cranial 2.5 (Navigationssystem VectorVision, BrainLab, Feldkirchen, Deutschland) durchgeführt. Der verwendete Algorithmus gehört zur Gruppe der „tensor-deflection“-Algorithmen, und wurde zum ersten Mal von Lazar et al. [33] beschrieben. Bei einem Patienten (Nr. 27) wurden Ergebnisse beider Algorithmen (Standardalgorithmus der iPlan Software und Konnektivitätsanalyse-Algorithmus) in die Neuronavigation eingebunden. Der klinische Zustand im Sinne der Sprachstörungen wurde am Aufnahmetag, am ersten postoperativen Tag und am zehnten postoperativen Tag ausgewertet. Methoden An der Neurochirurgischen Klinik der FAU Erlangen wird die DTI Messung mit einem Siemens Sonata 1.5T Scanner (single shot spin echo Sequenz, EPI readout, TR/TE 9200/86 ms, Matrix 128 x 128, FoV 240 mm, Schichtdicke 1.9 mm, b-Wert 0 und 1000 s/mm2) durchgeführt. Zur fMRT-Messung wird ebenso der 1,5 T Siemens Sonata – Scanner (EPI-Sequenz, 25 Schichten – Schichtdicke 3 mm, TR/TE: 2470/60ms) verwendet [22]. Die Stimulation wird visuell, mit Verwendung des Boxcar-Paradigmas mit 30 Messungen in Aktivitätsphase und 30 Messungen in Ruhephase durchgeführt. Da der visuelle Cortex relativ weit von den sprachrelevanten Arealen entfernt ist, ermöglicht die visuelle Stimulation bessere Signal-Rausch-Verhältnisse als die auditive Stimulation. Vier Typen von Stimulationsaufgaben werden durchgeführt: Lesen, Benennung von Gegenständen, Beantwortung von Fragen und Aufstellen von Verben und Sätzen zu einem gegebenem Substantiv. Die resultierende fMRT-Map, in der alle frontalen sowie temporoparietalen Sprachareale dargestellt werden, wird dann als DICOM-Datensatz gespeichert. 17 Konnektivitätsanalyse mit dem A*-Algorithmus Die anatomischen MRT Datensätze mit den assoziierten fMRT-Maps wurden rigide mit den DTI-B0 Datensätzen registriert [59]. Zur Analyse der Daten wurde die Visualisierungsapplikation Medalyvis verwendet, in der der Algorithmus zur Konnektivitätsanalyse implementiert ist. Die Aktivierungen in der linken Hemisphäre, die nach der anatomischen Lokalisation den oben genannten Sprachzentren entsprachen, wurden manuell als ROIs (regions of interest) markiert und als Startpunkte für den Algorithmus verwendet. Abbildung 2: Markierung der fMRT-Aktivierungen als ROIs für den Konnektivitätsanalyse-Algorithmus; lila – frontale Aktivierungen, grün – temporoparietale Aktivierungen, weiß – nichtmarkierte Aktivierungen in der rechten Hemisphäre Zusätzlich wurde das Suchvolumen nach anatomischen Verhältnissen für die jeweilige Bahn eingestellt und die Suche durchgeführt. In dem ersten Versuch war die Kostenfunktion mit dem Grenzwert für FA („walkability threshold“) 0.30, falls keine Bahn gefunden wurde, die der vorbekannten Anatomie der Sprachbahnen entsprechen würde, wurde der Grenzwert auf 0.15 eingestellt und die Suche wiederholt. Der Kostenwert für Abbiegungswinkel („bending angle“) wurde auf 0.9, der Grenzwert auf 75 Grad und der erwartete Mittelwert auf 20 Grad eingestellt. Für Pathfinding des IOFF wurde die obere Grenze des Suchvolumens direkt oberhalb des Cornu anterius ventriculi lateralis, die innere Grenze direkt medial von der Capsula externa eingestellt. Fasern, die der bekannten Anatomie des Fasciculus arcuatus oder des Fasciculus occipitofrontalis inferior nicht entsprachen, wurden gelöscht (Abbildung 3). Für Visualisierung und Rasterisierung der Bahnen können die Fasern in 3D-Hüllen eingehüllt werden. Dazu wird eine im Medalyvis implementierte Funktion (Iso- 18 Hulls) verwendet, mit folgenden Einstellungen: Parameter 0,6; Iterations: 40; Rasterisation mode: Gauss (Abbildung 4). Die FA-Mittelwerte der gefundenen Faserbahnen wurden gesammelt und die TumorFaserbahn-Abstände gemessen. Die Messung der Abstände der Läsionen zur Faserbahnen wurde direkt im Medalyvis durchgeführt. Die Endpunkte der Messungslinie wurden in der 2D-Ansicht an die Grenze der Läsion, und in der 3DAnsicht an den nächst gelegenen Punkt der Faserbahn gesetzt. Die Position der in der 3D-Ansicht dargestellten Messungslinie wurde dann ausführlich aus mehreren Ansichtswinkeln überprüft, damit eine Fehlsetzung ausgeschlossen werden konnte. Die FA-Daten wurden dann statistisch mit Verwendung des Student t-Tests für unabhängige Stichproben ausgewertet. Vor der Durchführung des t-Tests wurden die Daten dem Hartley-F-Test auf Varianzhomogenität unterzogen. Für die statistische Analyse wurde das Softwarepaket OpenEpi (http://www.openepi.com/) verwendet. Abbildung 3: Proband, Fall Nummer K2, 3D-Abbildung, gelb: ROIs definiert nach den fMRT-Aktivierungen, rot-grün – resultierende Sprachbahnen, FA-Wert Farbkodiert (höher = grün, niedriger = rot), rot – anatomisch definierte Suchvolumen für den Fasciculus occipitofrontalis inferior 19 Abbildung 4: Proband, Fall Nummer K2, 3D-Abbildung, Faserbahnen in 3D-Hüllen eingehüllt, gelb: ROIs, cyanblau – Fasciculus arcuatus, magentarot - IOFF Abbildung 5: Proband, Fall K2, 2D-Abbildung des IOFF auf einer fMRT-Map, die rekonstruierte Faserbahn verbindet Sprachrelevante Aktivierungen und entspricht der oben beschriebenen Anatomie des Fasciculus occipitofrontalis inferior nach [27] Rekonstruktion der Faserbahnen in iPlan Cranial 2.5 Die fMRT-Maps wurden als DICOM-Dateien gespeichert und in die iPlanApplikation importiert (PatXFer 5.1, BrainLab). In der iPlan Software wurden die DTI-Datensätze mit den fMRT-Maps registriert (Image Fusion). Für die Rekonstruktion des Fasciculus arcuatus wurde die 2-VOI (volume of interest) Methode mit Verwendung der fMRT-Aktivierungen durchgeführt. Ein VOI wurde im Bereich der temporoparietalen Aktivierungen definiert, und das Fiber-Tracking durchgeführt. Das zweite VOI wurde dann im Bereich der frontalen Aktivierungen 20 definiert und alle bisher rekonstruierten Fasern, die nicht durch das VOI liefen, wurden gelöscht. Eventuell wurden auch die Fasern gelöscht, die der gesuchten Sprachbahn nicht entsprachen. Der Fibertracking-Algorithmus wurde schon ausführlich beschrieben [45]. In der verwendeten Version der Software (iPlan Cranial 2.5) ist nur der FA-Grenzwert einstellbar, eine Einstellung des Grenzwertes für Abbiegungswinkel ist nicht möglich (Abbildung 6). 21 Abbildung 6: Rekonstruktion des Fasciculus arcuatus im iPlan Cranial 2.5; Proband (Nr. K2 in Tabelle 1), 3D-Darstellungen, grün: segmentierte fMRTAktivierungen; links oben: erstes VOI; rechts oben: Fiber-Tracking durchgeführt mit einem FA-Grenzwert von 0,15; links unten: zweites VOI, die nichtrelevante Fasern wurden gelöscht, rechts unten: Darstellung der rekonstruierten Faserbahn als 3DObjekt Bei den meisten Patienten, die unter Verwendung der visualisierten Sprachbahnen operiert wurden, wurde auch eine ventrale Bahn rekonstruiert. Die rekonstruierte Bahn entsprach in den meisten Fällen dem Fasciculus longitudinalis inferior, der als ein anatomisches Korrelat der ventralen semantischen Sprachbahn beschrieben wurde [63]. Dieser Fasciculus entspricht jedoch nach den neuesten Angaben der Literatur ([17], [36]) nicht der ventralen semantischen Sprachbahn. Die semantische Sprachbahn soll nach diesen Angaben dem Fasciculus occipitofrontalis inferior entsprechen; die Rekonstruktion dieses Fasciculus in iPlan ist jedoch kompliziert. Als Startvolumen wurde bei der Rekonstruktion der rostrale Teil der Capsula externa verwendet. Danach wurde das VOI im Bereich der temporoparietalen Aktivierungen definiert, und die Fasern, die nicht durch das VOI liefen, wurden gelöscht. Zusätzlich wurden auch die Fasern gelöscht, die nicht der Anatomie des Fasciculus occipitofrontalis inferior entsprachen. Die resultierenden Faserbahnen verlaufen 22 meistens neben den temporoparietalen fMRT-Aktivierungen weiter okzipital. Bei manchen Patienten ist die Rekonstruktion des Fasciculus occipitofrontalis inferior mit diesem Verfahren schwierig bis unmöglich. 23 A B C D E F Abbildung 7: Rekonstruktion des Fasciculus occipitofrontalis inferior in iPlan Cranial 2.5; Proband (Nr. K2 in der Tabelle 1); grün: segmentierte fMRTAktivierungen; A, B: Definierung des Startvolumens; C: Ergebnis des FiberTrackings; D: 3D-Darstellung des Ergebnisses des Fiber-Trackings und des zweiten VOI; E, F: die resultierende Faserbahn; weißer Pfeil: die Fasern enden nicht in den temporoparietalen Aktivierungen 24 Verwendung der rekonstruierten Faserbahnen während der Operation Die Schonung der eloquenten neuronalen Strukturen während der Operation ist eine wichtige Voraussetzung für Erhaltung einer guten Lebensqualität. Eine Schädigung der sprachrelevanten neuronalen Bahnen während der Operation würde zu postoperativen neurologischen Defiziten im Sinne einer Aphasie führen. Nach der Einspielung der DTI-rekonstruierten Faserbahnen in die Neuronavigation können die Bahnen intraoperativ visualisiert werden und das Ausmaß einer gefahrlosen Resektion in der Nähe der sprachrelevanten neuronalen Bahnen kann damit besser eingeschätzt werden. Die in der iPlan Software vorbereitete 3D-Objekte können im Operationsmikroskop sowie auf den Konsolen der Neuronavigation (VectorVision, BrainLab, Deutschland) visualisiert werden. Im Mikroskop zeigen sich die Konturen des Objekts in der Fokusebene als eine durchgezogene Linie, die Konturen unter der Fokusebene als eine gestrichelte Linie. Auf den Konsolen kann man die Position eines Digitalisierinstruments (Zeiger) beobachten, und die Grenzen der rekonstruierten Faserbahnen mit der Position des Instruments vergleichen. 25 Abbildung 8: Patientin (Nr. 16), Visualisierung der rekonstruierten Sprachbahnen im iPlan Cranial 2.5; grün: fMRT-Aktivierungen; lila, violett: rekonstruierte Sprachbahnen Abbildung 9: Patientin (Nr. 16), intraoperative Visualisierung in der Navigation; die durchgezogenen Linien zeigen die Konturen des 3D-Objekts in der Fokusebene, die gestrichelten Linien zeigen die Konturen unter der Fokusebene; orange: Tumor, lila und violett: Sprachbahnen; grün: fMRT-Aktivierungen 26 Bei Verwendung der vorbereiteten 3D-Objekte muss jedoch eine mögliche Verlagerung der tatsächlichen Anatomie, nachdem wesentliche Tumoranteile entfernt worden sind, berücksichtigt werden (sogennanter „brain shift“). Import der Konnektivitätsanalyse-Faserbahnen in die Neuronavigation Die Faserbahnen, die mit dem Konnektivitätsanalyse-Algorithmus in der Visualisierungsapplikation Medalyvis rekonstruiert werden, sind als Dateien nur in einem Vektorformat gespeichert. Nach Erstellung der 3D-Hüllen mit Medalyvis ist die rasterisierte Hülle im Programmordner der Applikation als zwei Dateien im RAW-Format (den.raw.gz und den.dat) gespeichert. Die Datei den.raw.gz enthält die Bilddaten und kann dekomprimiert (gunzip den.raw.gz) werden. Die Datei (den.raw) muss dann umbenannt werden, damit die Dateiendung .img wird (z. B. bahn1.img). Zur Erstellung der Analyze-Header Datei wird die Applikation MRICRO (http://www.sph.sc.edu/comd/rorden/mricro.html) verwendet [55]. Die Einstellungen sind: Dimension: 128, 128, 60; Size(mm): 1.875, 1.875, 1.9; Data: 8-bit int, bigendian:Sun. Die Header-Information wird dann als neue Datei (Menü Header-Save header) gespeichert, in demselben Ordner und mit demselben Namen wie die Bilddatei und mit der Dateiendung .hdr (z. B. bahn1.hdr). Abbildung 10: Einstellung der Header-Datei im MRICRO Die resultierende Analyze-Datei wird dann im MRICRO geöffnet, und als eine ROIDatei exportiert. Der Intensitätsfilter wurde empirisch auf 30 (unterer Grenzwert) eingestellt. Die ROI-Datei wird dann mit „Save as ROI“ gespeichert. 27 Abbildung 11: MRICRO - Export Analyze image as ROI/Analyze – Einstellungen Dann wird die fMRI-Datei, die schon mit dem B0-Datensatz registriert ist, im MRICRO geöffnet. Die gespeicherte ROI-Datei wird geöffnet. Dann werden die Teile der fMRT-Map, die unter dem ROI liegen, gelöscht. Die resultierende Analyze-Datei ist eine fMRT-Map mit rasterisierten Faserbahnen, die in der Datei als schwarze Voxels gespeichert sind. Diese Datei kann dann mittels der PatXfer Software (PatXfer 5.1, BrainLab, Deutschland) in die Navigation importiert werden. Die Faserbahn kann dann im iPlan Cranial 2.5 segmentiert und während der Operation visualisiert werden. Abbildung 12: Patient, (Nr. 27) Teile des Fasciculus occipitofrontalis inferior und des Fasciculus arcuatus, schwarze Voxel stellen die rasterisierte Faserbahnen dar 28 Abbildung 13: Patient, (Nr. 27), links: 3D Darstellung der Sprachbahnen in Medalyvis; rechts: 3D-Darstellung der importierten Faserbahnen (gelb), grün: fMRT-Aktivierungen; lila: Sprachbahn, die mit dem Standardverfahren in der BrainLab iPlan Software rekonstruiert wurde Abbildung 14: Proband (Nr. K2); links: Sprachbahnen, 3D-Hüllen in Medalyvis, rechts: importierte Sprachbahnen in iPlan, die Bahnen liegen in demselben anatomischen Raum, enden in den fMRT-Aktivierungen (grün), geringe Änderungen der Form und der Dicke der 3D-Objekte sind jedoch sichtbar Die Erstellung der 3D-Objekte, die Rasterisierung unter niedriger Auflösung (1,9 x 1,9 x 1,9 mm, Auflösung der DTI-Datensätzen), Filtrierung der Voxel nach Intensität und erneute Segmentierung in der iPlan Software stellen mögliche Fehlerquellen dar. Die anatomische Lokalisation und die Form der Faserbahn sind eingehalten und die Endpunkte der importierten Faserbahnen liegen in den (in iPlan segmentierten) fMRT-Aktivierungen. Die genaue (unter 2 mm) Lokalisation und die Dicke der Faserbahn werden aber von der Rasterisierung unter niedriger Auflösung beeinflusst. 29 Abbildung 15: Oben – die importierte Faserbahn (gelb) endet in der fMRTAktivierung (grün); Unten – möglicher Fehler, die Faserbahnen liegen in unmittelbarer Nähe der grauen Substanz (weiße Pfeile) Intraobserver-Variabilität bei der Konnektivitätsanalyse Das Konnektivitätsanalyse-Verfahren wurde bei einem Patienten (Fall 33) und einem Probanden (Fall K2) 5-mal durch den gleichen Untersucher wiederholt, um die Unterschiede zwischen den Ergebnissen auszuwerten. Die fMRT und DTI Daten wurden fünfmal erneut aufgeladen und die ROIs markiert, dann wurde die Suche mit den oben beschriebenen Einstellungen Kostenwert für Abbiegungswinkel 0,9, durchgeführt (FA-Grenzwert 0,30, Grenzwert 75, erwarteter Mittelwert 20 Grad). Das Suchvolumen für den Fasciculus occipitofrontalis inferior wurde ebenso für jede Suche erneut eingestellt. Die FA-Mittelwerte der rekonstruierten Faserbahnen wurden gesammelt und statistisch ausgewertet. 30 Ergebnisse Allgemein Durchführbarkeit des Konnektivitätsanalyse-Verfahrens Bei den 30 Patienten, bei denen die Rekonstruktion unter Verwendung des Konnektivitätsanalyse-Algorithmus durchgeführt wurde, wurde der Fasciculus arcuatus in 26 Fällen bereits mit dem FA-Grenzwert 0,30 gefunden. Bei den restlichen 4 Fällen wurde eine anatomisch relevante Faserbahn nach Einstellung des Grenzwertes auf 0,15 gefunden. Diese sind in der Tabelle 1 als Fälle 2, 11, 31 und 32 aufgeführt und hatten einen höhergradigen Tumor (WHO Grad III oder IV) in direkter Nachbarschaft (Abstand ≤ 5 mm) zu der rekonstruierten Faserbahn. Der Fasciculus occipitofrontalis inferior wurde in 28 Fällen mit dem FA-Grenzwert 0,30 gefunden. Bei den restlichen 2 Fällen (23 und 34, 7%) war es nicht möglich eine der oben beschriebenen Anatomie entsprechende Faserbahn zu rekonstruieren. Bei Patient 34 handelte es sich um ein WHO Grad II Gliom, das im linken frontotemporalen Marklager lokalisiert war. Der Patient mit Nummer 23 hatte einen 60 x 65 x 90 mm großen WHO Grad IV Tumor im linken Temporallappen. Bei allen Probanden und Patienten mit rechtsseitiger Läsion war die Rekonstruktion der linksseitigen Faserbahnen problemlos durchführbar. Abbildung 16: Patient, Fall Nummer 33, 2D Abbildung, Fasciculus arcuatus 31 Abbildung 17: Patient, Fall Nummer 33, 2D Abbildung, Fasciculus occipitofrontalis inferior, beide Faserbahnen sind vom temporal liegendem WHO Grad IV Tumor nach oben verlagert Intraobserver-Variabilität bei der Konnektivitätsanalyse Die rekonstruierten Bahnen zeigen visuell eine sehr gute Kongruenz, eine höhere Variabilität ist lediglich an den Enden der Faserbahnen zu beobachten. Aus den gesammelten FA-Mittelwerten der rekonstruierten Faserbahnen wurden Mittelwerte, Standardabweichungen und Variationskoeffizienten berechnet, wobei die Variationskoeffizienten bei allen vier Bahnen niedriger als 2% lagen. Diese Ergebnisse bestätigen eine gute Präzision und Reproduzierbarkeit des Verfahrens. Tabelle 2 fasst die Ergebnisse zusammen. Messung Nr. 1 2 3 4 5 Standardabweichung Mittelwert Variationskoeffizient Tabelle 2: inferior Proband AF 0,5733 0,5732 0,5755 0,5781 0,5811 0,0034 0,5762 0,59% Proband IOFF 0,5289 0,5474 0,5535 0,5544 0,5537 0,0108 0,5476 1,98% Patient - AF 0,4786 0,4839 0,4776 0,4855 0,4842 0,0036 0,4820 0,75% Patient IOFF 0,4188 0,4256 0,4181 0,4205 0,4069 0,0068 0,4180 1,64% AF – Fasciculus arcuatus, IOFF – Fasciculus occipitofrontalis 32 Abbildung 18: Oben: Proband, Fall Nummer K2, 3D-Abbildung, Visualisierung der Intraobserver-Variabilität: der linke Fasciculus arcuatus und Fasciculus occipitofrontalis inferior, die rekonstruierte Faserbahnen wurden in 3D-Hüllen eingehüllt. Das Überlagerungsbild rechts unten zeigt eine sehr gute Kongruenz. Unten: Patient, Fall Nummer 33, WHO Grad IV Gliom links temporal, Visualisierung der Intraobserver-Variabilität, die rekonstruierten Faserbahnen wurden in 3D-Hüllen eingehüllt. Im Vergleich zum Probanden zeigt sich hier eine deutliche Verlagerung der Faserbahnen. Das Überlagerungsbild rechts unten zeigt ebenfalls eine sehr gute Kongruenz. 33 Interindividuelle Variabilität Die interindividuelle Variabilität ist schon bei den Probanden deutlich zu beobachten. Bei den Patienten können die Bahnen sowie die Aktivierungen durch den Tumor deutlich verlagert werden. Die Abbildungen 19 und 20 illustrieren die interindividuelle Variabilität bei Probanden, beziehungsweise Patienten. A B C D Abbildung 19: Variabilität der Form der Sprachbahnen bei Probanden, Nummern A: K7, B: K1, C: K8, D: K10 34 A B C D E F G H Abbildung 20: Visualisierung der interindividuellen Variabilität: Patienten; Rekonstruierte Faserbahnen ohne die 3D-Hüllen; Nummerierung nach Tabelle 1: A – 31; B – 17; C- 37; D – 21; E – 19; F – 20; G – 9; H – 33 35 Vergleich beider Methoden der Bahnrekonstruktion Die Faserbahnen, die mit dem Konnektivitätsanalyse-Algorithmus rekonstruiert wurden, wurden bei 5 Patienten (4, 16, 17, 18, 21) und 5 Probanden (K1, K2, K7, K9, K10) in die iPlan-Software importiert. Nach dem Import konnten die Ergebnisse beider Methoden in einem Bild visualisiert werden (Abbildungen 21 und 22). Die Kongruenz der beiden Bahnsysteme ist nicht ideal, beide verlaufen zwar in demselben anatomischen Raum, die Formen und Größen der 3D-Objekte sind jedoch unterschiedlich. Bei verschiedenen Formen der Objekte sind die Distanzmessungen schwierig zu beurteilen und die Ränder der rekonstruierten Fasciculi arcuati zeigten sich in koronaren Schichten (quer zum Verlauf) im Mittelteil nicht mehr als 15 mm voneinander entfernt. In den Endbereichen in der Nähe des Kortex waren die Unterschiede jedoch größer. Die Abstände sind jedoch von der unterschiedlichen Größe der 3D-Objekte verursacht. Bei der Darstellung des Fasciculus occipitofrontalis war die Situation bei den Probanden ähnlich, die Distanzen im Mittelbereich waren niedriger als 10 mm. Bei den Patienten wurden die Ergebnisse des Konnektivitätsanalyse-Algorithmus mit den bereits intraoperativ verwendeten Faserbahnen verglichen (Abbildung 23). 36 Abbildung 21: Proband, Nr. K7 in Tabelle 1; gelb – Fasciculus occipitofrontalis inferior (iPlan), orange- Fasciculus arcuatus (iPlan), grün – KonnektivitätsanalyseBahnen; weißer Pfeil – Fasciculus occipitofrontalis inferior (iPlan) endet nicht in den Aktivierungen, verläuft weiter okzipital 37 Abbildung 22: Proband, Nr. K2 in der Tabelle 1; grün: fMRT-Aktivierungen, links oben: 3D-Darstellung, orange: iPlan – AF, gelb: iPlan – IOFF; rotKonnektivitätsanalyse-AF, lila-Konnektivitätsanalyse IOFF; rechts oben: orange – iPlan AF; violett- Konnektivitätsanalyse IOFF; unten: 2D-Darstellung des Fasciculus occipitofrontalis inferior, gelb – iPlan, lila – Konnektivitätsanalyse Abbildung 23: links: Patientin, Nr. 18, blau: Konnektivitätsanalyse-Bahnen, rot: iPlan-Bahnen, grün: Tumor; rechts: Patient, Nr. 4, grün: fMRT-Aktivierungen; violett: iPlan-Bahnen: blau: Konnektivitätsanalyse-Bahnen 38 Verwendung der DTI-Faserbahnen in der Neuronavigation und klinischer Verlauf Insgesamt wurden von Januar 2005 bis August 2007 in Erlangen 28 Patienten unter Verwendung der Sprach-Faserbahnen in der Neuronavigation operiert. Davon waren 23 Resektionen und 5 Biopsien (Nr. 2, 4, 12, 17 und 22). 25 Patienten wurden wegen eines neuroepithelialen Tumors operiert, darunter waren 19 Resektionen, eine makroskopisch komplette Resektion wurde bei 12 Patienten (63,2%) erreicht. Bei 7 Patienten (37%) davon wurde nach der intraoperativen MRT-Kontrolle ein Update der Navigation durchgeführt und der Tumor weiterreseziert. Die Diagnosen, die präoperativen und postoperativen Sprachstörungen und der klinische Verlauf sind in Tabelle 3 zusammengefasst. Klinisch wurden bei 12 Patienten präoperative Sprachstörungen festgestellt. Nach der Tumorresektion kam es bei 2 Patienten (Nr. 10, 24) zur Verschlechterung des vorbestehenden klinischen Defizits und bei 2 Patienten (Nr. 16, 21) zum Auftreten eines neuen klinischen Symptoms im Sinne einer Sprachstörung. Insgesamt kam es also bei 4 Patienten (14,3%) zur postoperativen Verschlechterung der Sprachfunktionen. Bei 3 Patienten (11, 12 und 23) kam es zur postoperativen Verbesserung der vorbestehenden Sprachstörungen. Bei Patient Nr. 10 zeigte sich die leichte postoperative Sprachstörung schon während des stationären Aufenthaltes rücklaufig. Bei Patientin Nr. 16 wurden weder in der Anamnese noch bei der Aufnahmeuntersuchung Sprachstörungen beschrieben. Postoperativ war eine Aphasie im Sinne von Wortfindungsstörungen sowie eine Leseschwäche aufgetreten, die sich jedoch im weiteren Verlauf unter logopädischer Behandlung deutlich gebessert hatten, so dass sich nach 3 Monaten im normalen Gespräch keine Sprachstörungen zeigten. Wortfindungsstörungen in der Bei Anamnese Patientin Nr. beschrieben, 21 bei wurden der Aufnahmeuntersuchung ließen sich jedoch keine Sprachstörungen nachweisen. Postoperativ kam es zu einer leichten Verschlechterung des Befundes, der sich jedoch bereits während des stationären Aufenthaltes deutlich gebessert hatte. Bei Entlassung wurden nur dezente Wortfindungsstörungen beschrieben. Bei Patient Nr. 24 kam es postoperativ zu einer deutlichen Progredienz des Tumors sowie zu einer Verschlechterung der Sprachstörungen. 39 Nr. 1 2 3 4 5 6 7 8 9 10 Präoperative Sprachstörungen Postoperative Entwicklung der Sprachstörungen diskret ausgeprägte motorische Dysphasie (von 5 Gegenständen wurden 4 korrekt benannt) ausgeprägte sensomotorische Aphasie mit deutliche Progredienz fremdanamnestisch einmaliger ca. 10-sekündiger Sprach-Arrest Sprache interiktal unauffälig, postiktale Dysphasie progrediente motorische Aphasie - 11 motorische Dysphasie und ausgeprägte Wortfindungsstörungen. 12 13 14 15 16 Diskrete motorische Aphasie und Wortfindungsstörungen - 17 18 19 20 21 leichte Wortfindungsstörungen 22 23 sensorische Aphasie leichte Wortfindungsstörungen. 24 25 26 27 28 leichte sensomotorische Aphasie Wortfindungsstörungen fremdanamnestisch - leichte Zunahme der vorbestehenden motorischen Aphasie, langsam rückläufig am zehnten Tag (Entlassung) sowohl die Aphasie, als auch die Absinktendenz rechtsseitig im Armvorhalteversuch waren zur Entlassung größtenteils regredient Diskrete Verbesserung der Aphasie. flüssige Aphasie mit einigen Wortfindungsstörungen und einem leichteingeschränktem Sprachverständnis sowie semantischen Paraphrasien, logopädisch behandelt Sensorische Aphasie mit Wortfindungsstörungen Die diskreten Wortfindungsstörungen waren bei Entlassung in ihrer Ausprägung regredient. Zunahme der vorbestehenden Aphasie - Tabelle 3: Übersicht der prä- und postoperativen Sprachstörungen den Patienten, die unter Verwendung der visualisierten Sprachbahnen operiert wurden. 40 Einfluss der Tumoren auf den FA-Wert Die gemessene FA-Mittelwerte und die Abstände der rekonstruierten Faserbahn vom Tumor sind in der Tabelle 4 zusammengefasst. Nr. Arcuatus - FA Mittelwert IOFF - FA Mittelwert Abstand ArcuatusTumor (mm) Abstand IOFFTumor (mm) 2 *0,393 0,492 2 14 4 0,486 0,533 3 24 5 0,424 0,529 6 17 8 0,503 0,424 23 8 10 0,55 0,493 8 8 11 *0,271 0,513 5 23 12 0,393 0,499 14 39 16 0,579 0,532 25 2 17 0,504 0,558 3 29 18 0,512 0,478 30 8 21 0,536 0,539 16 25 23 0,474 29 0,48 0,527 9 24 30 0,553 0,552 6 26 31 *0,361 0,561 4 37 32 *0,267 0,528 1 38 33 0,479 0,419 29 3 34 0,543 35 0,573 0,516 24 7 36 0,515 0,509 2 1 K1 0,554 0,557 K2 K3 K4 K5 K6 0,573 0,62 0,543 0,572 0,547 0,529 0,557 0,53 0,541 0,526 K7 0,557 0,554 K8 K9 0,581 0,525 0,548 0,537 6 16 41 K10 0,604 0,564 Tabelle 4: Die Abstände der Faserbahnen von den Tumoren und die gemessenen FA Mittelwerte. Die FA Mittelwerte der rekonstruierten Faserbahnen, die erst bei Einstellung des unteren Grenzwertes für FA auf 0,15 gefunden wurden, sind mit einem Stern (*) markiert. Kontrollgruppe Die durchschnittliche fraktionale Anisotropie für den Fasciculus arcuatus in dieser Gruppe war 0,568±0,0288 und für den Fasciculus occipitofrontalis inferior 0,544±0,0136. Patientengruppen Für jeden Fasciculus wurden zwei Patientengruppen zusammengefasst, je nach Abstand der rekonstruierten Faserbahn zum Tumor. Ein Grenzabstand von 20 mm wurde arbiträr bestimmt, um die Tumoren zu definieren, die in der Nähe von einem der Fasciculi liegen. Die Gruppen A<20 und A>20 enthalten die Daten von Patienten, bei denen der Tumor weniger, beziehungsweise mehr als 20 mm vom visualisierten Fasciculus arcuatus entfernt lag. Auf ähnliche Weise wurden für den Fasciculus occipitofrontalis inferior die Gruppen IOFF<20 und IOFF>20 erstellt. Tabelle 5 fasst die Patientengruppen zusammen. Die FA-Daten von den Faserbahnen, die mit dem FA-Grenzwert von 0, 30 nicht gefunden wurden, und nur unter der Verwendung des FA-Grenzwertes von 0,15 visualisiert werden konnten, kann man mit den restlichen nicht vergleichen (der FA-Grenzwert beeinflusst den gemessenen Mittelwert). Deswegen wurden diese Daten ausgeschlossen. Fälle N AF – weniger als 20 mm 4, 5, 10, 12, 17, 21, 23, 29, 30, 34, 36 11 AF – mehr als 20 mm 8, 16, 18, 33, 35 5 IOFF – weniger als 20 mm 2, 5, 8, 10, 16, 18, 33, 35, 36 9 IOFF – mehr als 20 mm 4, 11, 12, 17, 21, 29, 30, 31, 32 9 Tabelle 5: Übersicht der Gruppen Fasciculus arcuatus Die statistische Analyse wurde mittels Student's t-Tests für unabhängige Stichproben durchgeführt, wobei die Ergebnisse der A-Gruppen mit der Kontrollgruppe 42 verglichen wurden. Der FA-Mittelwert der Gruppe A>20 war 0,496 ± 0,0519. Die Differenz der Mittelwerte zwischen der Gruppe A<20 und der Kontrollgruppe war 0,071 und die Signifikanz (2-seitig) 0,001. Für die Gruppe A>20 (Tumore mehr als 20 mm vom Fasciculus arcuatus entfernt) war die Differenz 0,039 und nicht signifikant. Die Tabelle 6 fasst die Ergebnisse für den Fasciculus arcuatus zusammen. Gruppe FA-Mittelwert Differenz der Signifikanz (2-seitig) Mittelwerte von der Kontrollgruppe Kontrolle 0,568 ± 0,0288 A<20 0,496 ± 0,0519 0,071 0,001 A>20 0, 529 ± 0,0447 0,039 0,062 Tabelle 6: Übersicht der Ergebnissen des t-Tests für Fasciculus arcuatus Abbildung 24: 3D Darstellung, Patient Nummer 30, niedriggradiges Gliom links postzentral, die rekonstruierte Bahnen sind in 3D-Hüllen eingehüllt, gelb: ROIs, grün: Fasciculus arcuatus in der Nähe des Tumors, violett: IOFF, braun: Tumor (nach T2-Aufnahme segmentiert) 43 Fasciculus occipitofrontalis inferior Die FA-Mittelwerte der Gruppe IOFF<20 war 0,487 ± 0,0416 und signifikant different zur Kontrollgruppe. Die Differenz zwischen der Gruppe IOFF>20 (Tumor mehr als 20 mm vom Fasciculus occipitofrontalis inferior entfernt) und der Kontrollgruppe war 0,01 und nicht signifikant. Die Mittelwertdifferenzen und die Ergebnisse der t-Tests sind in Tabelle 7 zusammengefasst. Gruppe FA-Mittelwert Differenz der Mittelwerte Signifikanz (2seitig) Kontrolle 0,540 ± 0,0141 IOFF<20 0,487 ± 0,0416 0,056 0,003 IOFF>20 0,534 ± 0,0206 0,01 0,225 Tabelle 7: Übersicht der occipitofrontalis inferior Ergebnisse des t-Tests für den Fasciculus Abbildung 25: 3D Darstellung, Patientin Nummer 21, WHO III Gliom links temporal, 3D-Hüllen, magentarot: Fasciculus arcuatus, cyanblau: Fasciculus occipitofrontalis inferior, violett: Tumor, gelb: ROIs 44 Abbildung 26: 3D Darstellung, Patientin Nummer 18, WHO III Gliom links temporal, 3D-Hüllen, magentarot: Fasciculus arcuatus, cyanblau: Fasciculus occipitofrontalis inferior, gelb: ROIs Abbildung 27: 3D Darstellung, Patient Nummer K5, 3D-Hülle, cyanblau: Faserbahn weißer Pfeil: Teile der Faserbahn, die unter der dargestellten Schicht liegen, gelb: ROIs; weiß: fMRT-Aktivierungen; die Faserbahn entspricht anatomisch dem Fasciculus occipitofrontalis inferior 45 Abbildung 28: 3D Darstellung, Patient Nummer K5, 3D-Hüllen, cyanblau: Fasciculus occipitofrontalis inferior, magentarot: Fasciculus arcuatus, gelb: ROIs; weiß: fMRT-Aktivierungen; Teile des Fasciculus occipitofrontalis inferior liegen unter der dargestellten T1-Schicht Abbildung 29: 3D Darstellung, Patient Nummer 17, WHO Grad III Gliom links frontal (nicht sichtbar), Richtung der Fasern ist farbkodiert: grün – anteriorposterior, blau – superior-inferior, rot – rechts-links; Gelb: ROIs, rot: Suchvolumen für A*-Algorithmus, anatomisch gemäß den oben beschriebenen Grundlagen für den Fasciculus occipitofrontalis inferior eingestellt 46 Einfluss des Tumorgrades Die FA-Mittelwerte von Patienten mit hochgradigen Tumoren (WHO III und IV) wurden unter Verwendung des t-Tests für unabhängige Stichproben mit den FAMittelwerten bei Patienten mit niedriggradigen Tumoren (WHO I und II) verglichen. Für diesen Zweck wurden die Daten verwendet, bei denen der Tumor nicht mehr als 20 mm von der Faserbahn entfernt lag. Beim Vergleich von Patienten mit hochgradigem Gliom in der Nähe des Fasciculus arcuatus (n=7, FA-Mittelwert 0,480 ± 0,0567) mit Patienten mit niedriggradigem Gliom (n=4, FA-Mittelwert 0,524 ± 0,0302) ließen sich keine signifikanten Unterschiede nachweisen (Mittelwertdifferenz 0,44, Signifikanz (2-seitig) 0,190). Der Unterschied zwischen FA-Mittelwerten des rekonstruierten Fasciculus occipitofrontalis inferior bei Patienten mit hoch- (n=6, FA-Mittelwert 0,488 ± 0,385) und niedriggradigem (n=3, 0,489 FA-Mittelwert ± 0,0569) Gliom war ebenso (Mittelwertdifferenz 0,0009, Signifikanz (2-seitig) 0,979). nicht signifikant Tabelle 9 fasst die Ergebnisse der durchgeführten t-Tests zusammen. Gruppe n FA-Mittelwert Mittelwertdifferenz Signifikanz (2-seitig) Hochgradig, 7 Fasciculus 0,480 ± 0,0567 arcuatus Niedriggradig, Fasciculus 4 0,524 ± 0,302 6 0,488 ± 0,385 0,44 0,190 0,0009 0,979 arcuatus Hochgradig, IOFF Niedriggradig, IOFF Tabelle 8: Mittelwert 3 0,489 ± 0,0569 Hochgradige versus niedriggradige Gliome – Einfluss auf den FA- 47 Diskussion Ziele und klinische Anwendung der Traktographie Das Ziel der Traktographie ist es, mit Verwendung der DTI Daten die Information über den Verlauf der anatomisch und funktionell relevanten Faserbahnen darzustellen. Die DTI Daten enthalten jedoch keine explizite Information über die Fasern, sondern nur über die Diffusionscharakteristika der Hirnareale. Im Allgemeinen entsprechen nach den neuesten Studien die rekonstruierten DTIFaserbahnen den histologisch nachweisbaren Ergebnissen [11]. Da aber die gewonnenen Ergebnisse nur morphologische Daten darstellen (physiologische Information wie die Aktivierung oder Leitungsrichtung der Fasern sind in den DTIDaten nicht vorhanden) [41], können wir auf die physiologische Funktion der rekonstruierten Faserbahn nur aus der anatomischen Lokalisation bzw. aus dem Zusammenhang mit den Ergebnissen einer funktionellen Untersuchungsmethode schlussfolgern. Bisherige Ergebnisse der Traktographie unterstützen jedoch die Ergebnisse anderer Untersuchungsmethoden, die sich mit der Anatomie der Faserbahnen befassen, wie die Elektrostimulationsmethoden [36], [15], [16], Präparationstraktografie [26] oder histologische Methoden [10]. Die Ergebnisse der Traktographie können in der präoperativen Planung und in der intraoperativen Neuronavigation angewendet werden [48], [45]. In einer Studie von Kamada et al. wurden die Ergebnisse des Fibertrackings des Fasciculus arcuatus bei zwei Patienten auch während Wachoperationen implementiert und die Lokalisation der DTI-Faserbahnen mit Elektrostimulation verifiziert. Insgesamt wurde in dieser Studie die Rekonstruktion des Fasciculus arcuatus bei 22 Patienten beschrieben [23]. Die Angaben über den Zusammenhang des Fasciculus occipitofrontalis inferior mit den Sprachfunktionen sind ziemlich neu. Moderne elektrophysiologische und TracerInjektions-Studien haben 1999 die Möglichkeit der Existenz einer ventralen Sprachbahn angedeutet, 2005 wurde eine ventrale Sprachbahn in einer DTI-Studie von Parker et al. beschrieben [51]. Eine Verwendung der DTI-Rekonstruktion in der Neuronavigation des Fasciculus occipitofrontalis inferior wurde 2008 in einem Artikel beschrieben [4]. 48 Schonung der neuronalen Strukturen und Radikalität der Resektion Bei der Operation von supratentoriellen neuroepithelialen Tumoren müssen zwei wichtige Faktoren gegeneinander abgewogen werden: die Radikalität der Operation und die Schonung eloquenter Hirnstrukturen. Bei niedergradigen Tumoren stellt die Radikalität der Resektion, bzw. die Größe des Resttumors einen wichtigen Faktor dar, der neben dem progressionsfreien Intervall auch die Malignisierung des Tumorgewebes beeinflusst [7], [52]. Auch bei hochgradigen Tumoren bedeutet eine vollständige Resektion längeres Überleben und höhere Lebensqualität [1], [20], [25], [32]. Die Resttumorgröße stellt hierbei einen wichtigen prognostischen Faktor dar [66]. Andere Autoren haben jedoch einen Vorteil der Resektion gegenüber einer Biopsie nicht bestätigt [29], oder nur unter gewissen Bedingungen gefunden, zum Beispiel bei einem präoperativen Nachweis der Mittellinienverschiebung [31]. Der Einfluss der intraoperativen Hochfeld-MRT-Kontrolle auf die Radikalität wurde in einer Studie an 137 Patienten mit supratentoriellen Gliomen untersucht. Es zeigte sich, dass der Anteil der vollständigen Resektion durch die Verwendung der intraoperativen MRT-Kontrolle deutlich gesteigert werden kann [43]. Eine primäre komplette Resektion des Tumors wurde in dieser Studie bei 27% der Patienten erreicht. Nach der MRT-Kontrolle und Erweiterung der Resektion wurde die Resektion bei 40% der Patienten als vollständig beurteilt. Außerdem führte die in dieser Studie beschriebene Integration der funktionellen Daten zu einer niedrigen postoperativen Morbidität. Ein anderer Vorteil der intraoperativen MRT-Kontrolle ist die Möglichkeit der Koregistrierung der prä- und intraoperativen Bilddatensätzen (Update der Neuronavigation). Es kommt während einer Operation zu einer Verschiebung der Hirnstrukturen, wodurch die in der Neuronavigation integrierten funktionellen und anatomischen Daten nicht mehr mit der Realität übereinstimmen. Dieses Phänomen wird in der Literatur als sogenannter „brain shift“ beschrieben, und kann derzeit nur durch intraoperative Bildgebungsmethoden kompensiert werden [42, 44, 46, 47]. Eine präoperative bzw. intraoperative Lokalisation der eloquenten kortikalen und subkortikalen Strukturen ist eine wichtige Voraussetzung die für erfolgreiche Schonung dieser Strukturen während der Operation. Die kortikalen Areale können präoperativ mittels PET (Positronen-Emissions-Tomographie) [58], fMRT oder MEG (Magnetoenzephalographie) dargestellt werden [22]. Es ist auch möglich, die 49 sprachrelevanten Kortexbereiche mittels einer chronisch implantierten subduralen Gitterelektrode zu lokalisieren [30]. Die Lokalisation der subkortikalen Strukturen der weißen Substanz ist präoperativ mittels DTI bzw. DTI-Traktographie möglich. Intraoperativ kann zur Lokalisation der sprachrelevanten eloquenten Hirnareale die direkte elektrische Stimulation (DES) verwendet werden. Zu den Nachteilen der DES gehören die möglichen Komplikationen, wie generalisierte epileptische Anfälle, sowie die Tatsache, dass der Patienten während der mehrstündigen Operation wach bleiben muss [61]. Eine prospektive Studie von Serletis et al. [56] hat gezeigt, dass unter 511 Patienten, bei denen die DES während einer Wachoperation verwendet wurde, es bei 25 (4,9%) zu intraoperativen epileptischen Anfällen gekommen war. In der oben erwähnten Studie von Kamada et al. [23] wurden 2 Fälle der intraoperativen Visualisierung des Fasciculus arcuatus mittels DTI kombiniert mit der DES beschrieben. Bei der ersten Patientin wurde intraoperativ bei der Stimulation eine Dysnomie festgestellt. Der Minimalabstand zwischen dem Resektionsrand und dem DTI-rekonstruierten Fasciculus arcuatus betrug 1,2 mm. Postoperativ trat bei der Patientin eine zwar transiente, jedoch schwere motorische Aphasie auf. Bei der zweiten Patientin war der Minimalabstand zwischen dem Resektionsrand und dem DTI-rekonstruierten Fasciculus arcuatus 5,4 mm. Postoperativ traten keine neuen klinischen Defizite auf. Die Studien, die sich mit der intraoperativen elektrischen Stimulation der weißen Substanz mit Messung der motorisch evozierten Potentiale und Verifikation der DTI-rekonstruierten Pyramidenbahn beschäftigt haben, beweisen jedoch eine gute Kongruenz der DTIrekonstruierten Faserbahnen mit den funktionell entsprechenden Hirnarealen. In einer anderen Studie haben Kamada et al. 6 Patienten mit Läsionen in der Nähe der Pyramidenbahn beschrieben, die unter Verwendung der DTI-rekonstruierten Faserbahnen, DES und der Messung der motorisch evozierten Potentialen (MEP) operiert wurden [24]. Bei 3 Patienten davon wurden bei der Stimulation im Bereich der in der Neuronavigation visualisierten Faserbahnen MEP ausgelöst. Bei den anderen 3 Patienten lag der Resektionsrand mehr als 1 cm von der DTI-Faserbahn entfernt, und es wurden bei der elektrischen Stimulation keine MEP ausgelöst. Mikuni et al. haben in einer ähnlichen Studie [38] die Ergebnisse von 22 Patienten beschrieben. Bei 6 Patienten war der Stimulationspunkt näher als 7 mm an der DTIFaserbahn und die MEP wurden ausgelöst, bei 7 Patienten war der Stimulationspunkt mehr als 13 mm von der DTI-Faserbahn entfernt, und keine MEP wurden ausgelöst. 50 Bei den restlichen 9 Patienten lag der Stimulationspunkt 8-12 mm von der DTIFaserbahn entfernt, und die MEP wurden bei der Stimulation auf der Ebene der Corona radiata registriert. Bei den Patienten, die in Erlangen unter Verwendung der Sprach-DTI-Faserbahnen in der Navigation operiert wurden kam es nur in 4 Fällen (14,3%) zur Verschlechterung des klinischen Zustandes im Sinne von Sprachstörungen. In zwei Fällen wurde der Befund jedoch als leichte Verschlechterung beschrieben, die sich noch vor der Entlassung deutlich gebessert hatte. Bei diesen 4 Patienten lag der Tumor im Lobus temporalis, in unmittelbarer Nähe der temporalen fMRTAktivierungen. Aus der Dokumentation oder den Bilddaten lässt sich nicht feststellen, ob in diesen Fällen die kortikalen Sprachareale, die sprachrelevanten Faserbahnen oder beide Strukturen geschädigt wurden. Die direkte elektrische Stimulation wurde nicht verwendet. Von den 19 hier beschriebenen Resektionen eines neuroepithelialen Tumors wurde eine makroskopisch komplette Resektion bei 12 Patienten (63%) erreicht. Bei 7 Patienten (37%) davon wurde nach der intraoperativen MRT-Kontrolle ein Update der Navigation durchgeführt und der Tumor weiterreseziert. Die vorliegenden Daten zeigen, dass die intraoperative Anwendung der DTI-Faserbahnen zusammen mit den funktionellen Daten der fMRT und MEG zur Lokalisierung der kortikalen Sprachzentren kombiniert mit der intraoperativen MRT-Kontrolle führt zu einer gesteigerte Radikalität, sowie zu einer besseren postoperativen Lebensqualität der Patienten durch die intraoperative Schonung der eloquenten Hirnstrukturen führt. Durchführbarkeit der Konnektivitätsanalyse bei Patienten mit supratentoriellen neuroepithelialen Tumoren Diese Studie umfasst 20 Patienten mit supratentoriellen neuroepithelialen Tumoren, die weniger als 30 mm von den sprachrelevanten Faserbahnen entfernt lagen. Die Ergebnisse zeigen deutlich, dass es bei diesen Patienten möglich ist, die beiden sprachrelevanten Fasciculi mit dem Konnektivitätsanalyse-Algorithmus zu visualisieren. Der Fasciculus arcuatus wurde bei allen 20 Patienten erfolgreich dargestellt. Bei 4 Patienten musste jedoch der untere FA-Grenzwert niedriger eingestellt werden. Der Fasciculus occipitofrontalis inferior konnte in 2 Fällen 51 (10%) nicht dargestellt werden. Alle rekonstruierten Faserbahnen stellten eine Verbindung zwischen den frontalen und temporoparietalen fMRT-Aktivierungen dar. Die kombinierte fMRT-Konnektivitätsanalyse Methode mit Verwendung des anatomisch definierten Suchvolumens hat sich insbesondere für die Rekonstruktion des Fasciculus occipitofrontalis inferior als vorteilhaft herausgestellt, und könnte den Prozess der präoperativen und intraoperativen Visualisierung der Sprachbahnen deutlich vereinfachen und verkürzen. Mit anderen Methoden und Algorithmen ist diese Faserbahn schwierig zu differenzieren [49]. Außerdem bekräftigt diese DTIStudie die Ergebnisse der neuesten Elektrostimulationsstudien von Mandonnet et al. [36] und Duffau et al. [17], die die Sprachfunktion des Fasciculus occipitofrontalis inferior beschrieben. Vergleich der Konnektivitätsanalyse mit dem Standardverfahren Zwischen den Ergebnissen der beiden Algorithmen haben sich Unterschiede in der Form der rekonstruierten Faserbahnen gezeigt. Der funktionelle Unterschied zwischen den beiden Algorithmen liegt darin, dass der KonnektivitätsanalyseAlgorithmus die Verbindung zwischen den beiden Zentren aktiv sucht. Der Standardalgorithmus der iPlan-Software (basierend auf dem „tensor-deflection“ Algorithmus) rekonstruiert die Pfade, die in einem Startvolumen anfangen, die Existenz eines zweiten relevanten Zielvolumens wird dabei nicht beachtet. Deswegen lassen sich mit dem Konnektivitätsanalyse-Algorithmus auch anatomisch relevante Bahnen darstellen, die mit dem Standardalgorithmus nicht rekonstruierbar sind, weil die Richtung der Tensoren von einer größeren Faserbahn in demselben Voxel beeinflusst wird (Partial-Volumen-Effekt). Als Beispiel kann die Verbindung der semantischen Kortexbereiche durch den Fasciculus occipitofrontalis inferior dienen. Die oben erwähnten Studien von Mandonnet et al. [36] und Duffau et al. [17] haben gezeigt, dass die temporoparietalen und frontalen semantischen Kortexbereiche durch diesen Fasciculus verbunden sind, und dass die intraoperative Stimulation dieser Faserbahn zur semantischen Sprachstörungen führt. In ihrem temporalen Anteil verläuft jedoch die Faserbahn überwiegend in frontooccipitaler Richtung, die Haupteigenvektoren sind somit auch frontooccipital orientiert. Der Standardalgorithmus folgt deswegen der Richtung der Haupteigenvektoren und zeigt damit keine Verbindung zu den temporoparietalen Sprachzentren. Dem Standardverfahren gegenüber zieht der Konnektivitätsanalyse-Algorithmus auch 52 andere Faktoren neben der Richtung der Haupteigenvektoren und der bereits rekonstruierten Teile des Pfades in Betracht, wodurch die Darstellung der Verbindung des Fasciculus occipitofrontalis inferior zu den temporoparietalen Sprachzentren ermöglicht wird. Einen wichtigen Faktor stellt hier auch die Zeit dar, die zur Visualisierung der Faserbahnen notwendig ist. Bei dem Standardverfahren dauern die einzelnen Schritte ungefähr 20-30 Sekunden, insgesamt dauert das Fiber-Tracking etwa 5-10 Minuten. Eine intraoperative Verwendung des Standardverfahrens ist deswegen problemlos möglich. Die Konnektivitätsanalyse dauert je nach der Einstellung des Algorithmus zwischen 20-30 Minuten, dazu kommt noch die Zeit für Konversion und Koregistrierung der Daten, da eine automatische Registration der DTI und Anatomischen Daten derzeit nicht vorhanden ist. Eine Verwendung der Ergebnisse der Konnektivitätsanalyse in der Neuronavigation ist deswegen nur nach der präoperativen Vorbereitung durchführbar. Die anatomische und physiologische Relevanz und Genauigkeit beider Algorithmen bei der Rekonstruktion des Fasciculus arcuatus oder des Fasciculus occipitofrontalis inferior wurde noch nicht bestätigt, die rekonstruierten Bahnen entsprechen jedoch in beiden Fällen der bekannten Anatomie. Deswegen zeigt sich die Verwendung der rekonstruierten Faserbahnen bei Resektionen unter Beachtung eines Sicherheitsabstandes als empfehlenswert. An dieser Stelle ist es wichtig zu betonen, dass die Wahl des Algorithmus die Genauigkeit der Visualisierung nur zu einem gewissen Maß beeinflussen kann. Der wichtigste Faktor ist hier die Auflösung der DTI-Quelldaten. Einfluss der Tumoren auf die FA-Mittelwerte der Bahnen Die Veränderungen in der peritumoralen weißen Substanz wurden schon in einigen Studien beschrieben ([9], [57], [60], [65], [67]). Es kommt in der Regel zur Verlagerung, Infiltrierung oder zur Unterbrechung der Nervenbahnen [57], [60]. Der typische Effekt solcher Schädigung in den DTI-Daten ist die Senkung des FA-Wertes [35], [53], [57]. Neben dem direkten Einfluss des Tumors kann die Senkung des FAWertes auch von einem peritumoralen Ödem verursacht werden [53]. Eine Erhöhung des FA-Wertes wurde unter gewissen Bedingungen auch beschrieben [18], und in der Studie von Schonberg et al. [57] wurde eine Erhöhung des FA-Wertes in der Nähe von nicht-infiltrierenden Tumoren beobachtet. In dieser Arbeit wurden die 53 Veränderungen der weißen Substanz in Bezug auf die Konnektivitätsanalyse evaluiert. Eine statistisch signifikante Senkung des FA-Wertes wurde in den Faserbahnen nachgewiesen, die weniger als 20 mm von dem Tumor entfernt lagen. Für Faserbahnen, die mehr als 20 mm vom Tumor entfernt lagen, ließ sich keine signifikante Senkung nachweisen. Um die Faserbahnen zu rekonstruieren, die den Fasciculus arcuatus darstellen und weniger als 5 mm von einem höhergradigen Gliom entfernt lagen, musste der FA-Grenzwert (Standardeinstellung 0,30) in vier Fallen auf 0,15 eingestellt werden. Ansonsten ließ sich kein signifikanter Unterschied zwischen FA-Werten der Faserbahnen in der Nähe von höhergradigen und niedriggradigen Tumoren nachweisen. Diese Erfahrung steht im Einklang mit der Studie von Goebell et al, die mit der Verwendung von ROI-basierter Methode die FA-Werte in der peritumoralen normal aussehenden weißen Substanz und am Tumorrand von WHO Grad II und III Gliomen verglich [21], wobei sich für die normal aussehende weiße Substanz keine signifikanten Unterschiede nachweisen ließen. Für die ROIs am Tumorrand war jedoch der FA-Unterschied statistisch signifikant. Der FA-Wert stellt ein Maß der Anisotropie dar, und niedrigere FA-Werte deuten auf eine schlechter definierte Struktur des anisotropen Mediums hin [3]. Die beobachtete Senkung des FA-Wertes entlang der Faserbahnen, die in der Nähe von neuroepithelialen Tumoren verlaufen könnte andeuten, dass die rekonstruierten Faserbahnen bei Tumor-Patienten ungenauer sind. Eine neue Studie [11] an Rhesusaffen hat jedoch darauf hingewiesen, dass höhere FA-Grenzwerte (mehr als 0,25 für die Pyramidenbahn und eine Standardmethode des Fibertracking nach [64]) zu anatomisch fehlerhaften Ergebnissen führen. In derselben Studie haben die Autoren postuliert, dass die Feinabstimmung der Parameter des Algorithmus für die Genauigkeit der Ergebnisse essenziell ist. Die physiologische Richtigkeit und klinische Zuverlässigkeit der Ergebnisse der DTI-Traktographie und den einzelnen Algorithmen muss deshalb weiter mit Anwendung der klinischen Elektrostimulationsmethoden bzw. histologischen Methoden studiert werden. 54 Literaturverzeichnis 1. Albert, F.K., M. Forsting, K. Sartor, H.P. Adams, S. Kunze, (1994), Early postoperative magnetic resonance imaging after resection of malignant glioma: objective evaluation of residual tumor and its influence on regrowth and prognosis. Neurosurgery, 34(1): 45-60; discussion 60-1. 2. Basser, P.J., J. Mattiello, D. LeBihan, (1994), MR diffusion tensor spectroscopy and imaging. Biophys J, 66(1): 259-67. 3. Basser, P.J., C. Pierpaoli, (1996), Microstructural and physiological features of tissues elucidated by quantitative-diffusion-tensor MRI. J Magn Reson B, 111(3): 209-19. 4. Bello, L., A. Gambini, A. Castellano, G. Carrabba, F. Acerbi, E. Fava, C. Giussani, M. Cadioli, V. Blasi, A. Casarotti, C. Papagno, A.K. Gupta, S. Gaini, G. Scotti, A. Falini, (2008), Motor and language DTI Fiber Tracking combined with intraoperative subcortical mapping for surgical removal of gliomas. Neuroimage, 39(1): 369-82. 5. Bennett, M.R., P.M. Hacker, (2006), Language and cortical function: conceptual developments. Prog Neurobiol, 80(1): 20-52. 6. Benton, A., (1984), Hemispheric dominance before Broca. Neuropsychologia, 22(6): 807-11. 7. Berger, M.S., A.V. Deliganis, J. Dobbins, G.E. Keles, (1994), The effect of extent of resection on recurrence in patients with low grade cerebral hemisphere gliomas. Cancer, 74(6): 1784-91. 8. Catani, M., R.J. Howard, S. Pajevic, D.K. Jones, (2002), Virtual in vivo interactive dissection of white matter fasciculi in the human brain. Neuroimage, 17(1): 77-94. 9. Clark, C.A., T.R. Barrick, M.M. Murphy, B.A. Bell, (2003), White matter fiber tracking in patients with space-occupying lesions of the brain: a new technique for neurosurgical planning? Neuroimage, 20(3): 1601-8. 10. Dauguet, J., S. Peled, V. Berezovskii, T. Delzescaux, S.K. Warfield, R. Born, C.F. Westin, (2006), 3D histological reconstruction of fiber tracts and direct comparison with diffusion tensor MRI tractography. Med Image Comput Comput Assist Interv Int Conf Med Image Comput Comput Assist Interv, 9(Pt 1): 109-16. 55 11. Dauguet, J., S. Peled, V. Berezovskii, T. Delzescaux, S.K. Warfield, R. Born, C.F. Westin, (2007), Comparison of fiber tracts derived from in-vivo DTI tractography with 3D histological neural tract tracer reconstruction on a macaque brain. Neuroimage. 12. Doody, R.S., (1993), A reappraisal of localization theory with reference to aphasia. Part 1: Historical considerations. Brain Lang, 44(3): 296-326. 13. Duffau, H., (2005), Intraoperative cortico-subcortical stimulations in surgery of low-grade gliomas. Expert Rev Neurother, 5(4): 473-85. 14. Duffau, H., L. Capelle, D. Denvil, P. Gatignol, N. Sichez, M. Lopes, J.P. Sichez, R. Van Effenterre, (2003), The role of dominant premotor cortex in language: a study using intraoperative functional mapping in awake patients. Neuroimage, 20(4): 1903-14. 15. Duffau, H., L. Capelle, N. Sichez, D. Denvil, M. Lopes, J.P. Sichez, A. Bitar, D. Fohanno, (2002), Intraoperative mapping of the subcortical language pathways using direct stimulations. An anatomo-functional study. Brain, 125(Pt 1): 199-214. 16. Duffau, H., P. Gatignol, D. Denvil, M. Lopes, L. Capelle, (2003), The articulatory loop: study of the subcortical connectivity by electrostimulation. Neuroreport, 14(15): 2005-8. 17. Duffau, H., P. Gatignol, E. Mandonnet, P. Peruzzi, N. Tzourio-Mazoyer, L. Capelle, (2005), New insights into the anatomo-functional connectivity of the semantic system: a study using cortico-subcortical electrostimulations. Brain, 128(Pt 4): 797-810. 18. Eriksson, S.H., F.J. Rugg-Gunn, M.R. Symms, G.J. Barker, J.S. Duncan, (2001), Diffusion tensor imaging in patients with epilepsy and malformations of cortical development. Brain, 124(Pt 3): 617-26. 19. Fadiga, L., L. Craighero, G. Buccino, G. Rizzolatti, (2002), Speech listening specifically modulates the excitability of tongue muscles: a TMS study. Eur J Neurosci, 15(2): 399-402. 20. Forsting, M., F.K. Albert, S. Kunze, H.P. Adams, D. Zenner, K. Sartor, (1993), Extirpation of glioblastomas: MR and CT follow-up of residual tumor and regrowth patterns. AJNR Am J Neuroradiol, 14(1): 77-87. 21. Goebell, E., S. Paustenbach, O. Vaeterlein, X.Q. Ding, O. Heese, J. Fiehler, T. Kucinski, C. Hagel, M. Westphal, H. Zeumer, (2006), Low-grade and 56 anaplastic gliomas: differences in architecture evaluated with diffusiontensor MR imaging. Radiology, 239(1): 217-22. 22. Grummich, P., C. Nimsky, E. Pauli, M. Buchfelder, O. Ganslandt, (2006), Combining fMRI and MEG increases the reliability of presurgical language localization: a clinical study on the difference between and congruence of both modalities. Neuroimage, 32(4): 1793-803. 23. Kamada, K., T. Todo, Y. Masutani, S. Aoki, K. Ino, A. Morita, N. Saito, (2007), Visualization of the frontotemporal language fibers by tractography combined with functional magnetic resonance imaging and magnetoencephalography. J Neurosurg, 106(1): 90-8. 24. Kamada, K., T. Todo, Y. Masutani, S. Aoki, K. Ino, T. Takano, T. Kirino, N. Kawahara, A. Morita, (2005), Combined use of tractography-integrated functional neuronavigation and direct fiber stimulation. J Neurosurg, 102(4): 664-72. 25. Keles, G.E., B. Anderson, M.S. Berger, (1999), The effect of extent of resection on time to tumor progression and survival in patients with glioblastoma multiforme of the cerebral hemisphere. Surg Neurol, 52(4): 371-9. 26. Kier, E.L., L.H. Staib, L.M. Davis, R.A. Bronen, (2004), Anatomic dissection tractography: a new method for precise MR localization of white matter tracts. AJNR Am J Neuroradiol, 25(5): 670-6. 27. Kier, E.L., L.H. Staib, L.M. Davis, R.A. Bronen, (2004), MR imaging of the temporal stem: anatomic dissection tractography of the uncinate fasciculus, inferior occipitofrontal fasciculus, and Meyer's loop of the optic radiation. AJNR Am J Neuroradiol, 25(5): 677-91. 28. Kleihues, P., P.C. Burger, B.W. Scheithauer, (1993), The new WHO classification of brain tumours. Brain Pathol, 3(3): 255-68. 29. Kowalczuk, A., R.L. Macdonald, C. Amidei, G. Dohrmann, 3rd, R.K. Erickson, J. Hekmatpanah, S. Krauss, S. Krishnasamy, G. Masters, S.F. Mullan, A.J. Mundt, P. Sweeney, E.E. Vokes, B.K. Weir, R.L. Wollman, (1997), Quantitative imaging study of extent of surgical resection and prognosis of malignant astrocytomas. Neurosurgery, 41(5): 1028-36; discussion 1036-8. 57 30. Kral, T., M. Kurthen, J. Schramm, H. Urbach, B. Meyer, (2006), Stimulation mapping via implanted grid electrodes prior to surgery for gliomas in highly eloquent cortex. Neurosurgery, 58(1 Suppl): ONS36-43; discussion ONS3643. 31. Kreth, F.W., A. Berlis, V. Spiropoulou, M. Faist, R. Scheremet, R. Rossner, B. Volk, C.B. Ostertag, (1999), The role of tumor resection in the treatment of glioblastoma multiforme in adults. Cancer, 86(10): 2117-23. 32. Laws, E.R., I.F. Parney, W. Huang, F. Anderson, A.M. Morris, A. Asher, K.O. Lillehei, M. Bernstein, H. Brem, A. Sloan, M.S. Berger, S. Chang, (2003), Survival following surgery and prognostic factors for recently diagnosed malignant glioma: data from the Glioma Outcomes Project. J Neurosurg, 99(3): 467-73. 33. Lazar, M., D.M. Weinstein, J.S. Tsuruda, K.M. Hasan, K. Arfanakis, M.E. Meyerand, B. Badie, H.A. Rowley, V. Haughton, A. Field, A.L. Alexander, (2003), White matter tractography using diffusion tensor deflection. Hum Brain Mapp, 18(4): 306-21. 34. Le Bihan, D., E. Breton, D. Lallemand, P. Grenier, E. Cabanis, M. LavalJeantet, (1986), MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders. Radiology, 161(2): 401-7. 35. Lu, S., D. Ahn, G. Johnson, S. Cha, (2003), Peritumoral diffusion tensor imaging of high-grade gliomas and metastatic brain tumors. AJNR Am J Neuroradiol, 24(5): 937-41. 36. Mandonnet, E., A. Nouet, P. Gatignol, L. Capelle, H. Duffau, (2007), Does the left inferior longitudinal fasciculus play a role in language? A brain stimulation study. Brain, 130(Pt 3): 623-9. 37. Merhof, D., M. Richter, F. Enders, P. Hastreiter, O. Ganslandt, M. Buchfelder, C. Nimsky, G. Greiner, (2006), Fast and accurate connectivity analysis between functional regions based on DT-MRI. Med Image Comput Comput Assist Interv Int Conf Med Image Comput Comput Assist Interv, 9(Pt 2): 225-33. 38. Mikuni, N., T. Okada, N. Nishida, J. Taki, R. Enatsu, A. Ikeda, Y. Miki, T. Hanakawa, H. Fukuyama, N. Hashimoto, (2007), Comparison between motor evoked potential recording and fiber tracking for estimating pyramidal tracts near brain tumors. J Neurosurg, 106(1): 128-33. 58 39. Minematsu, K., L. Li, M. Fisher, C.H. Sotak, M.A. Davis, M.S. Fiandaca, (1992), Diffusion-weighted magnetic resonance imaging: rapid and quantitative detection of focal brain ischemia. Neurology, 42(1): 235-40. 40. Mori, S., B.J. Crain, V.P. Chacko, P.C. van Zijl, (1999), Three-dimensional tracking of axonal projections in the brain by magnetic resonance imaging. Ann Neurol, 45(2): 265-9. 41. Mori, S., J. Zhang, (2006), Principles of diffusion tensor imaging and its applications to basic neuroscience research. Neuron, 51(5): 527-39. 42. Nabavi, A., P.M. Black, D.T. Gering, C.F. Westin, V. Mehta, R.S. Pergolizzi, Jr., M. Ferrant, S.K. Warfield, N. Hata, R.B. Schwartz, W.M. Wells, 3rd, R. Kikinis, F.A. Jolesz, (2001), Serial intraoperative magnetic resonance imaging of brain shift. Neurosurgery, 48(4): 787-97; discussion 797-8. 43. Nimsky, C., O. Ganslandt, M. Buchfelder, R. Fahlbusch, (2006), Intraoperative visualization for resection of gliomas: the role of functional neuronavigation and intraoperative 1.5 T MRI. Neurol Res, 28(5): 482-7. 44. Nimsky, C., O. Ganslandt, S. Cerny, P. Hastreiter, G. Greiner, R. Fahlbusch, (2000), Quantification of, visualization of, and compensation for brain shift using intraoperative magnetic resonance imaging. Neurosurgery, 47(5): 1070-9; discussion 1079-80. 45. Nimsky, C., O. Ganslandt, R. Fahlbusch, (2006), Implementation of fiber tract navigation. Neurosurgery, 58(4 Suppl 2): ONS-292-303. 46. Nimsky, C., O. Ganslandt, P. Hastreiter, R. Fahlbusch, (2001), Intraoperative compensation for brain shift. Surg Neurol, 56(6): 357-64; discussion 364-5. 47. Nimsky, C., O. Ganslandt, P. Hastreiter, R. Wang, T. Benner, A.G. Sorensen, R. Fahlbusch, (2005), Intraoperative diffusion-tensor MR imaging: shifting of white matter tracts during neurosurgical procedures--initial experience. Radiology, 234(1): 218-25. 48. Nimsky, C., P. Grummich, A.G. Sorensen, R. Fahlbusch, O. Ganslandt, (2005), Visualization of the pyramidal tract in glioma surgery by integrating diffusion tensor imaging in functional neuronavigation. Zentralbl Neurochir, 66(3): 133-41. 49. O'Donnell, L.J., M. Kubicki, M.E. Shenton, M.H. Dreusicke, W.E. Grimson, C.F. Westin, (2006), A method for clustering white matter fiber tracts. AJNR Am J Neuroradiol, 27(5): 1032-6. 59 50. Ogawa, S., T.M. Lee, (1990), Magnetic resonance imaging of blood vessels at high fields: in vivo and in vitro measurements and image simulation. Magn Reson Med, 16(1): 9-18. 51. Parker, G.J., S. Luzzi, D.C. Alexander, C.A. Wheeler-Kingshott, O. Ciccarelli, M.A. Lambon Ralph, (2005), Lateralization of ventral and dorsal auditory-language pathways in the human brain. Neuroimage, 24(3): 656-66. 52. Piepmeier, J., S. Christopher, D. Spencer, T. Byrne, J. Kim, J.P. Knisel, J. Lacy, L. Tsukerman, R. Makuch, (1996), Variations in the natural history and survival of patients with supratentorial low-grade astrocytomas. Neurosurgery, 38(5): 872-8; discussion 878-9. 53. Provenzale, J.M., P. McGraw, P. Mhatre, A.C. Guo, D. Delong, (2004), Peritumoral brain regions in gliomas and meningiomas: investigation with isotropic diffusion-weighted MR imaging and diffusion-tensor MR imaging. Radiology, 232(2): 451-60. 54. Rajagopalan, P., K.R. Krishnan, T.J. Passe, J.R. Macfall, (1995), Magnetic resonance imaging using deoxyhemoglobin contrast versus positron emission tomography in the assessment of brain function. Prog Neuropsychopharmacol Biol Psychiatry, 19(3): 351-66. 55. Rorden, C., M. Brett, (2000), Stereotaxic display of brain lesions. Behav Neurol, 12(4): 191-200. 56. Serletis, D., M. Bernstein, (2007), Prospective study of awake craniotomy used routinely and nonselectively for supratentorial tumors. J Neurosurg, 107(1): 1-6. 57. Schonberg, T., P. Pianka, T. Hendler, O. Pasternak, Y. Assaf, (2006), Characterization of displaced white matter by brain tumors using combined DTI and fMRI. Neuroimage, 30(4): 1100-11. 58. Sobottka, S.B., J. Bredow, B. Beuthien-Baumann, G. Reiss, G. Schackert, R. Steinmeier, (2002), Comparison of functional brain PET images and intraoperative brain-mapping data using image-guided surgery. Comput Aided Surg, 7(6): 317-25. 59. Soza, G., Registration and Simulation for the Analysis of Intraoperative Brain Shift, in Technische Fakultät. 2005, University of ErlangenNuremberg. 60 60. Stadlbauer, A., C. Nimsky, S. Gruber, E. Moser, T. Hammen, T. Engelhorn, M. Buchfelder, O. Ganslandt, (2007), Changes in fiber integrity, diffusivity, and metabolism of the pyramidal tract adjacent to gliomas: a quantitative diffusion tensor fiber tracking and MR spectroscopic imaging study. AJNR Am J Neuroradiol, 28(3): 462-9. 61. Steinmeier, R., S.B. Sobottka, G. Reiss, J. Bredow, J. Gerber, G. Schackert, (2002), Surgery of low-grade gliomas near speech-eloquent regions: brainmapping versus preoperative functional imaging. Onkologie, 25(6): 552-7. 62. Vernooij, M.W., M. Smits, P.A. Wielopolski, G.C. Houston, G.P. Krestin, A. van der Lugt, (2007), Fiber density asymmetry of the arcuate fasciculus in relation to functional hemispheric language lateralization in both right- and left-handed healthy subjects: a combined fMRI and DTI study. Neuroimage, 35(3): 1064-76. 63. Vigneau, M., V. Beaucousin, P.Y. Herve, H. Duffau, F. Crivello, O. Houde, B. Mazoyer, N. Tzourio-Mazoyer, (2006), Meta-analyzing left hemisphere language areas: phonology, semantics, and sentence processing. Neuroimage, 30(4): 1414-32. 64. Westin, C.F., S.E. Maier, H. Mamata, A. Nabavi, F.A. Jolesz, R. Kikinis, (2002), Processing and visualization for diffusion tensor MRI. Med Image Anal, 6(2): 93-108. 65. Witwer, B.P., R. Moftakhar, K.M. Hasan, P. Deshmukh, V. Haughton, A. Field, K. Arfanakis, J. Noyes, C.H. Moritz, M.E. Meyerand, H.A. Rowley, A.L. Alexander, B. Badie, (2002), Diffusion-tensor imaging of white matter tracts in patients with cerebral neoplasm. J Neurosurg, 97(3): 568-75. 66. Wood, J.R., S.B. Green, W.R. Shapiro, (1988), The prognostic importance of tumor size in malignant gliomas: a computed tomographic scan study by the Brain Tumor Cooperative Group. J Clin Oncol, 6(2): 338-43. 67. Yamada, K., O. Kizu, S. Mori, H. Ito, H. Nakamura, S. Yuen, T. Kubota, O. Tanaka, W. Akada, H. Sasajima, K. Mineura, T. Nishimura, (2003), Brain fiber tracking with clinically feasible diffusion-tensor MR imaging: initial experience. Radiology, 227(1): 295-301. 61 Abkürzungen 2D – zweidimensional 3D – dreidimensional AG – angular gyrus BA – Brodmann-Areal BOLD – blood oxygen level dependent DES – direkte elektrische Stimulation DICOM – Digital Imaging and Communications in Medicine DNET - dysembryoplastischer neuroepithelialer Tumor DTI – Diffusion Tensor Imaging – Diffusion-Tensor-Bildgebung DW-MRI – diffusion weighted magnetic resonance imaging FA – funktionelle Anisotropie fMRT – funktionelle Magnetresonanztomographie ILF – inferior longitudinal fascicle IOFF – inferior occipitofrontal fascicle MRI – magnetic resonance imaging MEP - motorisch evozierte Potentiale NCBI - National Center for Biotechnology Information PNET – primitiv neuroektodermaler Tumor PT – Planum temporale ROI – region of interest ROIs – regions of interest SLF – superior longitudinal fascicle SMG – supramarginal gyrus TE - Echozeit TI - Inversionszeit TR - Relaxationszeit vPMC – ventral premotor cortex PET – Positronen-Emissions-Tomographie MEG – Magnetoenzephalographie 62 Danksagung Mein Dank gilt allen, die an der Entstehung dieser Arbeit teilhatten, insbesondere Herrn Prof. Dr. Nimsky und Herrn Dr. Weigel für die gute und geduldige Betreuung. 63 Lebenslauf Name Zolal Vorname Amir Geboren am 14.1.1981 in Pilsen Adresse Americká 20 301 00 Pilsen Tschechische Republik Ing. Eva Zolalová Eltern Ing. Taher Zolal CSc. Geschwister Ing. Lejla Zolalová Adam Zolal Aram Zolal Mariam Zolalová Aida Zolalová Staatsangehörigkeit tschechisch Bildungsweg 1987-1992 Grundschule, 21. Základní škola, Pilsen 1992-2000 Gymnasium, Gymnázium Plzeň, Mikulášské náměstí, Pilsen Abitur im Mai 2000 WS 2000 Beginn des Studiums der Humanmedizin an der KarlsUniversität Prag, Medizinische Fakultät in Pilsen 2004 Sommerpraktikum Deutsches Herzzentrum München, 4 Wochen WS 2004 Aristotle University of Thessaloniki, in Rahmen eines Erasmus-Studentenaustausches, 1 Semester WS 2005 Rheinische Friedrich-Wilhelms-Universität Bonn, in Rahmen eines interuniversitären Studentenaustausches, 1 Semester 64 16. Mai 2006 Abschluss-Staatsexamen, Humanmedizin, erworbener Titel: MUDr. (Medicinae Universae Doctor) 2006-2007 Promotionsstudium an der Friedrich-Alexander-Universität Erlangen-Nürnberg seit 2007 Assistenzarzt, Neurochirurgische Klinik, J.E. Purkyne Universität und Masaryk-Krankenhaus in Ústí nad Labem Publikationen als Erstautor 1. Zolal A., Vachata P., Hejcl A., Malucelli A., Bartos R., Sames M., (2010), Identification of the large descending tracts using diffusion tensor imaging in Chiari III malformation. Childs Nerv Syst., 26(7): 867-70. 1. Zolal A., Sameš M., Vachata P., Bartoš R., Nováková M., Derner, M., (2007), The Use of Diffusion Tensor Imaging in Neuronavigation during Brain Tumor Surgery: Case Reports. Cesk Slov Neurol N, 71/104(3): 352-357. 2. Zolal A., Sameš M., Vachata P., Bartoš R., Nováková M., Kopáček R., Derner M., (2009) The Use of the BOLD Effect when Examining Cerebrovascular Reserve Capacity. Cesk Slov Neurol N, 72/105(5): 476-480 Publikationen als Koautor 1. Bartoš R, Ceé J, Zolal A, Hejčl A, Bolcha M, Prokšová J, Sameš M., (2008), Extraoperative Mapping by Means of Cortical Grid before Resection of Diffuse Oligodendroglioma in Dominant Hemisphere – an Alternative of Awake Craniotomy – a Case Report. Cesk Slov Neurol N, 71/104(6): 718721. 2. Bartos R, Jech R, Vymazal J, Petrovický P, Vachata P, Hejcl A, Zolal A, Sames M, (2009), Validity of primary motor area localization with fMRI versus electric cortical stimulation: a comparative study. Acta Neurochir (Wien). 151(9): 1071-80. 3. Sameš M, Zolal A, Radovnický T, Vachata P, Bartoš R, Derner M., (2009) The Use of Magnetic Resonance for Assessing Cerebrovascular Reserve Capacity. Cesk Slov Neurol N, 72/105(4): 323-330 65 4. Bartoš R, Sameš M, Zolal A, Radovnický T, Hejčl A, Vachata P, (2009), Resection of Insular Gliomas - Volumetric Assessment of Radicality; Cesk Slov Neurol N, 72/105(6): 534-541 5. Sameš M., Bartoš R., Vachata P., Zolal A., Cihlář F., Derner M., Pavlov V. (2009): Assessment of Cerebrovascular Reserve Capacity after EC-IC bypass with TCD. Cesk Slov Neurol N, 72/105(4): 359-363