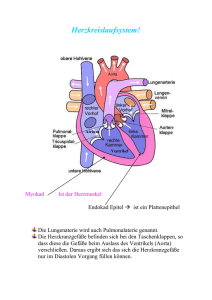
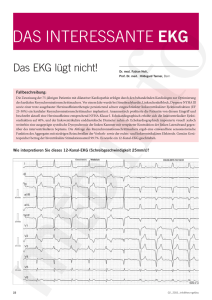
Dokument_9.
Werbung

Aus der Medizinischen Klinik 2 Friedrich-Alexander-Universität Erlangen-Nürnberg Direktor: Prof. Dr. med. W. G. Daniel Segmentale Synchronität und Volumenänderung des linken Ventrikels während ventrikulärer Schrittmacherstimulation – Ultraschallbasierte Analyse durch Real Time 3D Echokardiographie Inaugural – Dissertation zur Erlangung der Doktorwürde an der Medizinischen Fakultät der Friedrich – Alexander - Universität Erlangen – Nürnberg vorgelegt von Barbara Marlene Johanna Geier aus Erlangen Gedruckt mit Erlaubnis der Medizinischen Fakultät der Universität Erlangen - Nürnberg Dekan: Prof. Dr. med. Dr. h.c. Jürgen Schüttler Referent: Prof. Dr. med. Dieter Ropers Koreferent: Prof. Dr. med. Werner G. Daniel Tag der mündlichen Prüfung: 29. und 30.11.2011 Meiner Mutter gewidmet „Wege entstehen dadurch, dass man sie geht“ (Franz Kafka) Inhaltsverzeichnis 1 Zusammenfassung ............................................................................... 1 1.1 Zusammenfassung (deutsch) ......................................................... 1 1.1.1 Hintergrund .............................................................................. 1 1.1.2 Methoden ................................................................................. 1 1.1.3 Ergebnisse ............................................................................... 2 1.1.4 Zusammenfassung................................................................... 2 1.2 Summary (english) ......................................................................... 3 1.2.1 Background .............................................................................. 3 1.2.2 Methods ................................................................................... 3 1.2.3 Results ..................................................................................... 4 1.2.4 Conclusion ............................................................................... 4 2 Einleitung .............................................................................................. 5 2.1 Erregungsphysiologie des Herzens................................................ 5 2.1.1 Elektromechanische Koppelung am Herzen ............................ 7 2.2 Schrittmacherpatienten in Deutschland.......................................... 8 2.3 Zusammenhang zwischen Schrittmachertherapie, Verminderung der Ejektionsfraktion und Desynchronisation des Ventrikelmyokards .................................................................................. 9 2.4 Indikationen für ein permanentes kardiales Pacing........................ 9 2.4.1 Indikationsklassen und Evidenzkategorien ............................ 10 2.5 Stimulationsmodi und Schrittmachertypen ................................... 14 2.6 Wahl des Schrittmachersystems .................................................. 16 2.7 Grundlagen der Echokardiographie ............................................. 17 2.7.1 Impuls-Echo-Verfahren .......................................................... 17 2.7.2 Doppler-Effekt ........................................................................ 18 2.7.3 Methoden der Signaldarstellung ............................................ 18 2.7.3.1 A-Mode-Verfahren .......................................................... 18 2.7.3.2 B-Mode-Verfahren .......................................................... 19 2.7.3.3 M-Mode-Verfahren.......................................................... 19 2.7.3.4 PW-Doppler .................................................................... 20 2.7.3.5 CW-Doppler .................................................................... 20 2.7.3.6 Real Time 2D-Modus ...................................................... 21 2.7.3.7 Real Time 3D-Modus ...................................................... 25 2.8 Die Bedeutung der Real Time 3D-Echokardiographie ................. 27 3 Material und Methoden ....................................................................... 30 3.1 Auswahl des Patientenkollektivs .................................................. 30 3.2 Technische Anforderung der verwendeten Real Time 3DEchokardiographie ................................................................................ 31 3.3 Echokardiographische Untersuchung .......................................... 32 3.4 QLAB® .......................................................................................... 33 3.5 Zusätzliche Messwerte in der dreidimensionalen echokardiographischen Untersuchung ................................................. 36 3.6 Echosignalverstärker .................................................................... 41 3.7 Durchführung der Untersuchungen .............................................. 42 3.8 Statistik ......................................................................................... 43 4 Ergebnisse.......................................................................................... 44 4.1 Patientendaten ............................................................................. 44 4.2 Grunddaten der echokardiographischen Untersuchungen........... 45 4.3 Vergleich der Volumina, Ejektionsfraktion und Klappengradienten im Eigenrhythmus und während Schrittmacherstimulation....................................................................... 56 4.4 Vergleich der Ergebnisse der zwei- und dreidimensio-nalen echokardiographischen Untersuchungen ............................................. 59 4.5 Vergleich der segmentalen Synchronität im 6-, 12- und 16Segmentmodell ..................................................................................... 62 4.5.1 Vergleich der Segmentmodelle .............................................. 63 4.6 Vergleich der Patientendaten hinsichtlich Stimulationshäufigkeit ........................................................................... 66 5 Diskussion .......................................................................................... 70 5.1 Material und Methoden................................................................. 70 5.1.1 Auswahl des Patientenkollektivs ............................................ 70 5.1.2 Wahl der Real Time 3D-Echokardiographie als Untersuchungsverfahren ................................................................... 71 5.1.3 Auswertungsverfahren ........................................................... 71 5.1.4 Veränderung der Ejektionsfraktion unter Schrittmacher-Stimulation.................................................................. 72 5.1.5 Zunahme der Desynchronisation des Ventrikelmyokards unter Schrittmacherstimulation............................ 73 5.1.6 Vergleich der Messwerte in der 2D- und der Real Time 3DEchokardiographie............................................................................. 75 5.1.7 Stimulationsrate versus Synchronität..................................... 76 6 Literaturverzeichnis............................................................................. 77 7 Abkürzungsverzeichnis....................................................................... 87 8 Danksagung........................................................................................ 90 1 1 Zusammenfassung 1.1 Zusammenfassung (deutsch) 1.1.1 Hintergrund Es ist bekannt, dass eine ventrikuläre Schrittmacherstimulation zu einer Abnahme der Ejektionsfraktion und auch zu einer Verschlechterung der linksventrikulären Synchronität führt. Eine genaue 3D Evaluierung und segmentale Analyse des linken Ventrikels wurde bisher nicht durchgeführt, da die dazu geeignete MRT-Diagnostik bei Schrittmacherträgern kontraindiziert ist. In der vorliegenden Studie untersuchten wir die Veränderung von globalen und segmentalen linksventrikulären Parametern unter Schrittmacherstimulation im Vergleich zum Eigenrhythmus durch real time 3D Echokardiographie. 1.1.2 Methoden Wir untersuchten 27 Patienten (71 ± 13 Jahre), die unter Eigenrhythmus eine normale oder nur geringgradig eingeschränkte linksventrikuläre Pumpfunktion aufwiesen und zum Untersuchungszeitpunkt eine ausreichend hohe Eigenfrequenz (>40/min) hatten. Zunächst erfolgte eine Ultraschalluntersuchung im Eigenrhythmus und danach unter rechtsventrikulärer Stimulation (VVI-Modus), welche 15 Herzschläge über der Grundfrequenz programmiert wurde. Zur Echokardiographie benutzen wir ein 4D fähiges Ultraschallgerät (Philips Sonos 7500 mit x4 Schallkopf), das nativ oder – bei schlechter Schallqualität - auch Kontrastmittel-gestützt (mechanical index 0,5; repetitive Bolusgabe von 0,5ml SonoVue®) eingesetzt werden konnte, und zeichneten einen kompletten Datensatz zur off-line Analyse auf (Q-Lab®, Philips). Durch eine manuell korrigierte, halbautomatische Endokarderkennung wurden die enddiastolischen und endsystoli- 2 schen linksventrikulären Volumina berechnet und durch eine Bild-für-BildKorrektur die Endokardbewegung im Herzzyklus analysiert. Das Maß der Synchronität wurde durch den Zeitversatz der segmentalen Volumenverkürzung in einem 16-Segment-Model bestimmt (time-to-minimal- segmental-volume - Tmsv 16). 1.1.3 Ergebnisse Die Herzfrequenz lag in Ruhe bei 67 ± 11/min und unter VVI-Stimulation bei 77 ± 11/min. Während sich sowohl in den enddiastolischen (Ruhe 133 ± 40ml vs. Stimulation 124 ± 38ml, n.s.) als auch in den endsystolischen linksventrikulären Volumina (Ruhe 60 ± 28ml vs. Stimulation 65 ± 28ml, n.s.) keine signifikante Änderung ergab, zeigte sich in der Ejektionsfraktion eine signifikante Abnahme während ventrikulärer Stimulation (Ruhe 56 ± 11% vs. Stimulation 49 ± 10%, p<0,01). Die Analyse der Synchronität (Tmsv 16) erbrachte eine hoch signifikante linksventrikuläre Deformation mit Anstieg des segmentalen Zeitversatzes (Ruhe 35% ± 11% vs. Stimulation 56% ± 17%, p<0,0005). Den größten Zeitversatz konnten wir vor allem in den apikoseptalen Abschnitten beobachten. 1.1.4 Zusammenfassung Die rechtsventrikuläre Herzschrittmacherstimulation führt im Vergleich zum Eigenrhythmus zu einer deutlichen Abnahme der Ejektionsfraktion und Verschlechterung der linksventrikulären Synchronität. Dabei erlaubt die real time 3D Echokardiographie eine genaue Analyse der linksventrikulären Deformierung und kann somit eine suffiziente Methode beim Management der Resynchronisationstherapie sein. 3 1.2 Summary (english) 1.2.1 Background It is already known that ventricular pacing decreases ejection fraction and may worsen left ventricular synchrony. However, accurate 3D quantification and segmental assessment has not been possible to be done so far, because MRI as a 3D-method is contraindicated in patients with pacemakers. In this study we tried to assess these global and segmental left ventricular parameters by real time 3D echocardiography at rest and during ventricular pacing. 1.2.2 Methods We examined 27 patients (age 71 ± 13) with normal to minimally limited left ventricular function whose own heart rhythm was higher than 40/min during examination. After baseline examination, pacing with a heart rate 15 bpm above baseline was performed (VVI). For echocardiography we used a 4D modus (Philips Sonos 7500 with x4 transducer) in conventional as well as in contrast enhanced mode (mechanical index 0.5; repetitive boli of 0.5ml SonoVue® followed by saline) and recorded a complete cardiac volume set for off-line analysis (Q-Lab®, Philips). By semiautomatic and hand-corrected border detection we calculated end-diastolic and endsystolic volumes and analysed endocardial motion frame by frame. For assessment of synchrony we assigned the time offset of peak segmental volumetric shortening in a 16 segment model (time-to-minimal-segmentalvolume - Tmsv 16). 4 1.2.3 Results Heart rate at rest was 67 ± 11bpm and 77 ± 11bpm during VVI-stimulation. While left ventricular volumes showed no significant differences in enddiastolic (rest 133 ± 40ml vs. stimulation 124 ± 38ml, n.s.) and end-systolic volumes (rest 60 ± 28ml vs. stimulation 65 ± 28ml, n.s.), ejection fraction decreased significantly during ventricular pacing (rest 56 ± 11% vs. stimulation 49 ± 10%, p<0,01). Analysis of synchrony (Tmsv 16) provided a high significant deformation of the left ventricle with increased segmental time offset (rest 35% ± 11% vs. stimulation 56% ± 17%, p<0,0005). This was particularly pronounced in the apical septal segments. 1.2.4 Conclusion Right ventricular pacing decreased ejection fraction and worsened left ventricular synchrony. Real time 3D echocardiography allows an accurate assessment of segmental synchrony and volumetric changes during ventricular pacing and may be a helpful method in management of resynchronisation therapy. 5 2 Einleitung 2.1 Erregungsphysiologie des Herzens Die Funktionselemente des Herzens sind die Herzmuskelfasern. Dabei lassen sich zwei Grundtypen von Herzmuskelfasern unterscheiden: Das Arbeitsmyokard, welches die Hauptmasse des Herzens ausmacht und das für die mechanische Pumparbeit zuständig ist, sowie die Fasern des Erregungsbildungs- und Leitungssystems. Die Herzmuskelzellen besitzen ein Ruhepotential von ca. -90mV und sind in der Lage, Aktionspotentiale ohne Abschwächung (Dekrement) fortzuleiten. Der Sinusknoten ist mit seiner Schrittmacherfunktion Ausgangspunkt der Erregung. Die Ruhefrequenz des Sinusknotens liegt bei 60-90 bpm. Die Erregung breitet sich dann über das Vorhofmyokard bis hin zum AVKnoten aus. Hier erfolgt eine Verzögerung der Überleitung von ca. 90ms. Über das His-Bündel, die Tawara-Schenkel und die Purkinje Fasern breitet sich das Aktionspotential gleichmäßig über das Ventrikelmyokard aus. Die Glanzstreifen, welche die Zellgrenzen zwischen den Herzmuskelzellen darstellen, bilden kein Hindernis für die Erregungsfortleitung. Über sogenannte gap junctions, bestehend aus zwei miteinander verbundenen hexameren Halbkanälen, sind die Kardiomyozyten hier elektrisch miteinander gekoppelt. Die Muskulatur der Vorhöfe und Ventrikel entspricht daher einem funktionellen Synzytium. Bei Ausfall des Sinusknotens entstehen so genannte Ersatzrhythmen, die vom AV-Knoten oder im Vorhof- oder Ventrikelmyokard generiert werden. Die Frequenzen der junktionalen Ersatzrhythmen sind mit 40-60/min bei einem durch den AV-Knoten generierten Rhythmus oder einem Kammerersatzrhythmus von 30-40/min wesentlich langsamer als der des Sinusknotens. 6 1: Sinusknoten 2: AV-Knoten 3: His-Bündel 4: Rechter Tawara-Schenkel 5: Linker Tawara-Schenkel 6: Anteriorer Faszikel 7: Posteriorer Faszikel 8: Purkinje-Fäden Abbildung: Schema des Erregungsbildungs- und Leitungssystems; Quelle: Schmidt, Thews, Lang: Physiologie des Menschen, 28. Auflage, S.473 Das Aktionspotential der Herzmuskelzelle beginnt mit einer raschen Depolarisation, gefolgt von einer Umpolarisation über den Nullwert bis auf etwa +30mV hinaus, dem so genannten overshoot. Dieser Aufstrich, verursacht durch schnellen Natriumeinwärtsstrom, dauert nur wenige Millisekunden. Die darauf folgende Repolarisationsphase unterteilt sich in drei Abschnitte: die initiale Spitze ist eine erste Repolarisation, in der sich das Membranpotential dem Nullwert annähert; darauf folgt eine länger andauernde Plateauphase, bedingt durch verzögert einsetzende und langsam abklingende Öffnung von Calciumkanälen sowie einer Verminderung der Kaliumleitfähigkeit; zuletzt erfolgt der Übergang in die Repolarisationsphase, basierend auf einer Abnahme der Kalziumkonzentration, dem verzögerten Öffnen von Kaliumkanälen sowie dem Wiederanstieg der Ruhe-KaliumLeitfähigkeit, in der sich das Ruhepotential von -90mV wieder einstellt. Das Ruhepotential ist überwiegend ein Kaliumpotential, begründet auf einer spezifischen Kaliumleitfähigkeit der Membran. Die Gesamtdauer eines Aktionspotentials der Herzmuskulatur beträgt rund 200-400ms. 7 Abbildung: Aktionspotential einer Herzmuskelzelle; Quelle: leifi.physik.uni-muenchen.de An ein Aktionspotential schließt sich die Refraktärzeit an. Diese ist unterteilt in eine absolute Refraktärperiode, während welcher keine Neuerregung möglich ist, und der relativen Refraktärperiode, in der durch höhere Reizpotentiale Erregungen auslösbar sind. Ursache des refraktären Verhaltens ist eine Inaktivierung der Natriumkanäle bei andauernder Depolarisation. Erst wenn die Repolarisation eines Aktionspotentials wieder einen Wert von -40 mV erreicht hat, wird die Inaktivierung der Natriumkanäle aufgehoben. Die Dauer der Refraktärzeit steht in engem Zusammenhang zur Dauer eines Aktionspotentials. Je länger ein Aktionspotential dauert, desto länger ist auch die anschließende Refraktärzeit. Sinn dieser refraktären Periode ist es, das Einfallen kreisender Erregungen zu verhindern, die den rhythmischen Wechsel von Kontraktion und Erschlaffung des Myokards stören würden. Des Weiteren wird verhindert, dass die Pumpfunktion des Herzens durch eine zu schnelle Neuerregung beeinträchtigt wird [7; 41; 43; 44; 45; 46]. 2.1.1 Elektromechanische Koppelung am Herzen Im Gegensatz zur Skelettmuskulatur ist das Myokard nicht tetanisierbar. Wichtige Funktionsträger der elektromechanischen Koppelung sind das 8 sarkoplasmatische Retikulum, das transversale Tubulussystem und Kalzium. Der Einstrom von Kalzium über die Zellmembran während des Aktionspotentials führt zur Freisetzung größerer Mengen Kalzium aus dem sarkoplasmatischen Retikulum, wodurch die Kontraktion der Myofilamente des Myokards ermöglicht wird. Während der Diastole dissoziiert das Kalzium von den Myofilamenten ab und wird teilweise wieder zurück ins sarkoplasmatische Retikulum gepumpt, aber auch durch Natrium-KalziumAustauscher aus der Zelle transportiert. Veränderungen der Aktionspotentialdauer gehen daher mit entsprechenden Modifikationen des Kalziumeinwärtsstroms einher. All diese Prozesse verbrauchen ein hohes Maß an Energie in Form von Adenosintriphospaht (ATP), das über oxidative Phosphorylierung in Mitochondrien bereitgestellt wird. Der funktionell und ökonomisch entscheidende Punkt der elektromechanischen Koppelung ist das Erreichen einer linksventrikulär idealen Kontraktionsform im Sinne einer optimierten Synchronität um eine effiziente und effektive Hämodynamik zu erzielen. Dieser Zusammenhang von Erregungsausbreitung und Kontraktionsablauf ist bei Störungen der Erregungsausbreitung modifiziert und führt so zu entscheidenden Änderungen der ventrikulären Leistung [17; 18; 42; 49]. 2.2 Schrittmacherpatienten in Deutschland In Deutschland leben derzeit geschätzte 500.000 Herzschrittmacherpatienten. Jährlich werden an die 95.000 Neuimplantationen durchgeführt. Das Durchschnittsalter bei Erstimplantation liegt bei Frauen bei 77,5 Jahren, bei Männern bei 73,8 Jahren. Als häufigster Implantationsgrund für einen Herzschrittmacher liegt ein Sick-Sinus-Syndrom zugrunde; an zweiter Stelle steht der AV-Block III. Grades [28]. Dabei steht dem Bonus einer durch Schrittmacher gesicherten Erregungsüberleitung der Malus einer möglicherweise verschlechterten Herzleistung und damit einer induzierten 9 Herzinsuffizienz gegenüber. Die Herzinsuffizienz stellt wiederum eine nicht unwesentliche volkswirtschaftliche Belastung innerhalb der Gesundheitsökonomie dar. 2.3 Zusammenhang zwischen Schrittmachertherapie, Verminderung der Ejektionsfraktion und Desynchronisation des Ventrikelmyokards Es wurde schon länger vermutet, dass ein permanentes kardiales Pacing zu einer Verschlechterung der linksventrikulären Pumpfunktion und zu einer Desynchronisation des Ventrikelmyokards führt. So ergaben klinische Versuche [37; 53] eine Verschlechterung der linksventrikulären Funktion während konventioneller rechtsventrikulärer apikaler Stimulation. Es wird angenommen, dass der Grund der verschlechterten linksventrikulären Funktion eine Desynchronisation mit abnormen Kontraktionen und veränderten Relaxationsphasen des Ventrikels während der Stimulation mit der Folge einer Verminderung der Ejektionsfraktion ist. Bereits in einer 2007 veröffentlichten Studie mit 60 älteren Personen mit einem Zweikammerschrittmacher konnte mittels tissue-Doppler-Verfahren und farbkodierter m-mode-Echokardiographie eine geringgradige Verminderung der linksventrikulären systolischen Funktion sowie Zeichen beeinträchtigter ventrikulärer Relaxation festgestellt werden [6]. Auch bei Kindern und Jugendlichen ist unter Langzeit- Schrittmachertherapie eine signifikante Verminderung der Ejektionsfraktion nachweisbar, die ebenfalls auf eine Desynchronisation der Ventrikel (sowohl interventrikulär als auch intraventrikulär) zurückzuführen ist [50]. 2.4 Indikationen für ein permanentes kardiales Pacing Bei Patienten mit einer symptomatischen Bradykardie ist in der Regel eine Schrittmacherimplantation indiziert [23]. Nach Ausschluss passagerer Ur- 10 sachen einer Bradykardie - wie zum Beispiel Elektrolytentgleisung oder entzündlicher Herzerkrankung – als auch medikamentös induzierter Bradykardien, besteht prinzipiell die Indikation zur Implantation eines permanenten Schrittmacheraggregates. Bei Patienten mit Einschränkung der linksventrikulären Pumpfunktion wird die Indikation zur Schrittmachertherapie meist früher gestellt [23]. Die häufigsten Indikationen für einen Herzschrittmacher sind AVBlockierungen, Sinusknotendysfunktionen und Vorhofflimmern mit unklaren Synkopen. Naturgemäß erfolgt in der Gruppe der AV-Blockierungen eine gehäufte ventrikuläre Stimulation (extrinsische Überleitung), während atriale induzierte Bradykardien meist noch über den intakten AV-Knoten auf das Kammermyokard übergeleitet werden. 2.4.1 Indikationsklassen und Evidenzkategorien Der Empfehlungsgrad der Therapie wird nach der Definition der deutschen Gesellschaft für Kardiologie in zwei Indikationsklassen eingeteilt. Dabei entspricht die Klasse I einer gesicherten Indikation und die Klasse II einer relativen Indikation. Die Klasse III, welche laut Vorschlag der deutschen Gesellschaft für Kardiologie nicht mehr aufgeführt wird, entspricht keiner Indikation. Klasse I: „Evidenz oder allgemeine Übereinkunft, dass eine Therapieform oder eine diagnostische Maßnahme effektiv, nützlich oder heilsam ist.“ [23] Klasse II: „Widersprüchliche Evidenz und/oder unterschiedliche Meinungen über den Nutzen bzw. die Effektivität einer Therapieform oder einer diagnostischen Maßnahme.“ [23] Klasse IIa: „Evidenz/Meinungen favorisieren den Nutzen bzw. die Effektivität einer Maßnahme.“ [23] Klasse IIb: „Nutzen/Effektivität einer Maßnahme ist weniger gut durch Evidenz/Meinungen belegt.“ [23] 11 Zu den Klasse I-Indikationen zählen: - Ein symptomatischer (Schwindel, Synkopen, Leistungsintzoleranz) AV-Block II. oder III. Grades; - Ein alternierender Schenkelblock, NYHA-Stadium III/IV mit einem Linksschenkelblock mit einer QRS-Breite >150 ms und Sinusrhythmus, ein AV-Block II. Grades Typ Mobitz oder III. Grades, der mehr als 2 Wochen nach einem Infarktereignis besteht; - Ein Vorhofflimmern mit langsamer Kammerfrequenz (<40/min) oder langen Pausen (>3s tagsüber und >4s nachts) spontan oder infolge einer erforderlichen Medikation mit eindeutigem Zusammenhang zur klinischen Symptomatik inklusive der symptomatischen chronotropen Inkompetenz; - Ein Vorhofflimmern mit langsamer regelmäßiger Kammerfrequenz und breiten QRS-Komplexen und gegebenenfalls im Zusammenhang mit einer geplanten AV-Knoten-Ablation; - Eine Sinusknotendysfunktion (Herzfrequenz <40/min, Pausen >3s), spontan oder infolge einer erforderlichen Medikation, mit eindeutigem Zusammenhang zur klinischen Symptomatik, inklusive der symptomatischen chronotropen Inkompetenz; - Rezidivierende Synkopen, die in eindeutigem Zusammenhang mit einer Reizung des Karotissinus stehen und die durch Alltagsbewegungen (z.B. Drehen des Kopfes) auslösbar sind und dadurch zu einer Asystolie von >3 s führen. Zu den Klasse IIa-Indikationen zählen: - Ein intermittierender AV-Block Grad III außerhalb von Schlafphasen oder bei eingeschränkter LV-Funktion; - Ein asymptomatischer AV-Block Grad III mit Ersatzrhythmus >40/min; - Ein asymptomatischer AV-Block Grad II mit Blockierung im HisPurkinje System; - Patienten mit neuromuskulären Erkrankungen und AV-Block Grad II; 12 - Ein bifaszikulärer Block bei Patienten mit Verdacht auf kardiale Synkopen, vor allem ventrikuläre Tachyarrythmien bei Patienten mit kardialer Grunderkrankung; - NYHA-Stadium III/IV mit Linksschenkelblock, einer QRS-Breite 120150ms und Sinusrhythmus oder mit einer QRS-Breite >150ms und Vorhofflimmern; - Ein passagerer AV-Block Grad II oder III mit konsekutivem persistierenden Schenkelblock; - Ein Vorhofflimmern mit langsamer Kammerfrequenz (<40/min) oder langen Pausen (>3s tags und >4s nachts) mit vermutetem Zusammenhang zur klinischen Symptomatik; - Ein Vorhofflimmern mit langsamer unregelmäßiger Kammerfrequenz (<40/min) oder langen Pausen (>3s tags, >4s nachts)und breiten QRS-Komplexen oder ein Vorhofflimmern mit langsamer regelmäßiger Kammerfrequenz und schmalen QRS-Komplexen insbesondere bei kardialer Grunderkrankung, ohne Symptomatik; - Hoch symptomatische, medikamentös refraktäre paroxysmale Vorhoftachyarrhythmien vor geplanter AV-Knoten Ablation; - Rezidivierende, anderweitig nicht erklärbare Synkopen ohne eindeutig auslösbare Alltagsbewegungen, aber mit positivem Nachweis eines symptomatischen hypersensitiven Karotissinus-Reflexes; - Rezidivierende (≥5/Jahr) vasovagale Synkopen oder schwere synkopenbedingte Verletzungen bei Patienten über 40 Jahre mit kardioinhibitorischen Pausen >3s, z.B. im Rahmen einer Kipptischuntersuchung, mit unzureichendem Ansprechen auf andere Maßnahmen. Zu den Klasse IIb-Indikationen zählen: - Ein AV-Block Grad I mit deutlich verlängerter AV-Überleitung (>300ms) bei Patienten mit linksventrikulärer Dysfunktion und symptomatischer Herzinsuffizienz, bei denen eine Verkürzung des AV-Intervalls zur hämodynamischen Verbesserung führt; - Ein intermittierender AV-Block Grad III ohne Symptomatik und andere Kriterien; 13 - Patienten mit neuromuskulärer Erkrankung und AV-Block Grad I oder faszikulärem Block unabhängig von Symptomen; - NYHA-Stadium III/IV und einer QRS-Breite >120ms ohne Linksschenkelblock; - NYHA-Stadium II mit Linksschenkelblock, einer QRS-Breite >150ms und Sinusrhythmus; - Ein vorbestehender Schenkelblock mit transientem AV-Block Grad II (Mobitz) oder III; - Ein Vorhofflimmern mit chronischen Herzfrequenzen <40/min oder längeren asystolischen Pausen (>3-4s) und schmalen QRSKomplexen außerhalb von Schlafphasen, bei herzkranken Patienten mit eingeschränkter LV-Funktion; - Patienten mit medikamentös refraktären, bradykardieassoziierten paroxysmalen Vorhoftachyarrhythmien - Rezidivierende vasovagale Synkopen mit dokumentierter Bradykardie (z.B. im Rahmen einer Kipptischuntersuchung), mit unzureichendem Ansprechen auf andere Maßnahmen [23; 39]. Weitere Indikationen für eine Schrittmachertherapie: - Hypertrophisch obstruktive Kardiomyopathie (HOCM): Ziel, die klinische Symptomatik zu verbessern, den intraventrikulären Druckgradienten zu reduzieren, die diastolische Funktion zu verbessern und eine eventuelle Mitralinsuffizienz zu vermindern [11]. Akut- und Langzeiteffekte werden jedoch diskrepant beurteilt [38; 48]. 14 2.5 Stimulationsmodi und Schrittmachertypen Zur Charakterisierung der Schrittmachermodi wird der NBG- (NASPE/BPEG) Code für die antibradykarde, frequenzadaptive und multifokale Stimulation verwendet. Die erste Kodierungsstelle gibt den Ort der Stimulation (pacing) an, wobei A für Atrium, V für Ventrikel und D für dual (Vorhof und Ventrikel) steht. Die zweite Kodierungsstelle gibt den Ort der Detektion (sensing) an, die Kodierung entspricht derer der ersten Stelle. 0 bedeutet hier keine Detektion. Die dritte Kodierungsstelle betrifft die Reaktion des Schrittmachers auf eine detektierte Herzaktion. I bedeutet, dass der Schrittmacher dadurch inhibiert wird, D dass er sowohl auf eine detektierte Herzaktion im Atrium im Ventrikel getriggert stimulieren oder auch inhibiert werden kann. Die fakultative vierte Kodierungsstelle gibt an, ob beim Schrittmacher ein Sensor einprogrammiert ist, der die Simulationsfrequenz unter Belastung ansteigen lässt (R für rate-adaptive pacing). Unterschieden wird zwischen Einkammer-Schrittmacher-Systemen (AAI und VVI) und Zweikammer-Schrittmacher-Systemen (VDD und DDD). Der AAI- oder VVI-Modus bedeutet, dass der Schrittmacher im Atrium oder im Ventrikel sowohl stimulieren als auch Eigenpotentiale erkennen kann und, falls Eigenaktivität des Herzens vorliegt, durch diese inhibiert wird und nicht zusätzlich stimuliert. Für den DDD-Schrittmacher gilt dasselbe in beiden Kammern. Eine Sonderform des pacings stellt der VDD-Schrittmacher dar, der im Atrium nur detektieren kann, aber dort nicht stimuliert und daher eine intakte Sinusknotenfunktion voraussetzt. 15 NBG-Code: Buchstabe 1 2 3 4 Ort der Ort der Betriebsart Frequenz- Stimulation Wahrnehmung adaptation O = Keine O = Keine O = dauerhaft A = Atrium A = Atrium T = getriggert V = Ventrikel V = Ventrikel I = Inhibiert D = Doppelt D = Doppelt (A + V) (A + V) D = Doppelt (T + I) R = Frequenzadaptation ("rate modulation") Wird eine so genannte „Hysteresefrequenz“ programmiert, bedeutet dies, dass der Puls bis zu einer bestimmten Frequenz abfallen darf (=Hysteresefrequenz) bevor eine Stimulation erfolgt. Eine mode-switchFunktion führt dazu, dass bei atrialen Tachyarrythmien eine automatische Modusumstellung von VDD/DDD auf VDI/DDI erfolgt und somit eine tachykarde, AV-sequentielle Überleitung verhindert wird (z.B. beim Vorhofflimmern). 16 2.6 Wahl des Schrittmachersystems Bei der Systemwahl müssen Art und Häufigkeit der zugrundeliegenden Rhythmusstörung, kardiale Grunderkrankung, Hämodynamik, Medikation, Alter, Allgemeinzustand und Prognose des Patienten berücksichtigt werden. Von der Deutschen Gesellschaft für Kardiologie gibt es zur Wahl des Systems folgende Empfehlung: Diagnose Sinusknotensyndrom 1. ohne tachykarde Phasen 2. BradykardieTachykardie-Syndrom, intermittierendes Vorhofflimmern AV-Block 1. permanent 2. intermittierend Zweiknotenerkrankung 1. chronotrope Inkompetenz ohne tachykarde Phasen 2. Vorhofarrhythmien Bradyarrhythmie bei chronischem Vorhofflimmern Karotissinus-Syndrom und Vasovagales Syndrom Optimal AAI(R) DDD(R) + Spezialalgorithmen (1) DDI(R) DDD(R) + ModeSwitching (2) DDI(R) Akzeptabel Ungeeignet VVI(R) VDD(R) VVI <45/min (4) AAI(R) VVI(R) VDD(R) DDD(R) ohne ModeSwitching (2) DDD DDD + Spezialalgorithmen (1) VDD DDD VDD VVI <45/min (4) VVI(R) VVI(R) DDI(R) DDDR DDD VVI(R) VDD(R) DDD(R) + ModeSwitching (2) VDD(R) + ModeSwitching (2) VVI(R) - DDI(R) DDD(R) und VDD(R) ohne ModeSwitching (2) DDD(R) VDD(R) VVI + Hysterese (5) AAI(R) VDD(R) VVI(R) VVI(R) DDD (+ Spezialalgorithmen (3)) DDI (+ Hysterese) DDD (+ Hysterese) (1) z. B.: automatischer Moduswechsel von AAI nach DDD oder AV-Zeit-Hysterese (2) automatischer Moduswechsel, z.B. von DDD nach DDI, oder andere frequenzbegrenzende Algorithmen (3) z. B.: spezieller Frequenzanstieg während der Kardioinhibition (4) nur akzeptabel bei seltenen asystolischen Pausen (5) nur bei fehlender retrogader Leitung während Kardioinhibition und bei niedrig programmierter Interventionsfrequenz. Quelle: www.dkg.org/Leitlinien/Herzschrittmacher 17 Einen Überblick über einige Krankheitsbilder mit den entsprechenden EKG-Veränderungen und dem EKG nach passender Schrittmacherimplantation zeigt die folgende Abbildung. Abbildung: Links: Das Erregungsbildungs- und Reizleitungssystem des menschlichen Herzens. SK: Sinusknoten; AVK: Atrioventrikulärer Knoten. Mitte: typische EKG-Morphologie bei Funktionsstörungen des Sinus- und AV-Knotens. Der Bradyarrhythmia absoluta bei Vorhofflimmern liegt eine kombinierte Funktionsstörung des Sinusknotens, des Reizleitungssystems der Vorhöfe und des AV-Knotens zugrunde. Rechts: Typische EKGMorphologie nach Korrektur der bradykarden Rhythmusstörung durch „maßgeschneiderte“ Schrittmacherversorgung. Zusätzlich angegeben ist die Kurzbezeichnung der Schrittmacher-Betriebsarten. Quelle: Deutsche Zeitschrift für Sportmedizin, Jahrgang 52, Nr.6 (2001), S.223 2.7 Grundlagen der Echokardiographie 2.7.1 Impuls-Echo-Verfahren Die Entstehung eines Ultraschallbildes erfolgt durch die Aussendung einer kurzen Serie von Ultraschallwellen, die an einer Grenzfläche teilweise oder vollständig gestreut oder reflektiert wird. Die Ultraschallimpulse entstehen durch einen Piezokristall, der schwingende Druckwellen abgibt [21; 22]. Ein zurücklaufendes Echo wird im Schallkopf in ein elektrisches Signal umgewandelt, welches verstärkt und als Bild an einem Monitor dargestellt wird. Misst man die Zeit zwischen Aussenden der Welle und Eintreffen des Echos, also die Schallgeschwindigkeit, kann man die Entfernung des 18 Gewebes vom Schallkopf bestimmen. Wichtig für die Qualität des Ultraschallbildes sind eine ausreichende Eindringtiefe sowie ein möglichst hohes Auflösungsvermögen. Bei einer durchschnittlichen Schallausbreitung von 1540 m/s im menschlichen Gewebe ist ein Wellenlängenbereich von 1,5 bis 0,15 mm erforderlich. Nach der Formel errechnet sich daraus ein für die Ultraschalluntersuchung optimaler Frequenzbereich von 1-10 MHz. Da das Herz von der Hautoberfläche gemessen ungefähr 15 cm tief im menschlichen Körper liegt, ist die bei der Herzechokardiographie klassischerweise verwendende Frequenz 3,5 MHz. 2.7.2 Doppler-Effekt Der Doppler-Effekt, benannt nach dem Erstbeschreiber Christian Doppler (1842), tritt immer dann auf, wenn sich Schallsender und Schallempfänger relativ zueinander bewegen. Durch diese Relativbewegung ändert sich die Frequenz der empfangenen Schallwellen. Zur Bestimmung der Flussgeschwindigkeit des Blutes wird das von den Erythrozyten reflektierte Echosignal detektiert. Das reflektierte Signal ist gegenüber dem ausgesandten Signal verschoben. Diese Signalverschiebung ist die sogenannte Dopplerfrequenz [20; 40]. 2.7.3 Methoden der Signaldarstellung 2.7.3.1 A-Mode-Verfahren Der A-Mode beschreibt den Amplitudenmodulations-Mode. Das von der Ultraschallsonde empfangene Echo wird in einem Diagramm dargestellt, wobei auf der x-Achse die Eindringtiefe und auf der y-Achse die Echostärke angegeben wird. Grundlage hiervon ist die Amplitudenauslenkung in 19 einer einzeiligen Darstellung. Heutzutage findet der A-Mode so gut wie keine Verwendung mehr [20; 40]. 2.7.3.2 B-Mode-Verfahren Grundlage des Brightness-Mode ist die Erzeugung eines zweidimensionalen Schnittbildes, welches durch eine Vielzahl ausgesandter Einzelstrahlen zeilenförmig aufgebaut wird und Informationen über den Grauwert eines Bildpunktes liefert. Dies ist möglich, indem die Echointensität in Helligkeit umgesetzt wird. Die reflektierten und verstärkten Impulse werden also als Lichtpunkte längs der Schallrichtung vom Wandler, der senkrecht über die Hautfläche des Patienten geführt wird, aufgezeichnet. Die den Echos entsprechenden Lichtpunkte reihen sich aneinander und so entsteht in Echtzeit ein Schnittbild, das eine zweidimensionale Orientierung erlaubt [20; 40]. 2.7.3.3 M-Mode-Verfahren Der Motion-Mode wird zur Darstellung von Bewegungsabläufen vor allem in der Kardiologie eingesetzt. Es handelt sich hierbei um eine eindimensionale Ultraschallmessung in Abhängigkeit von der Zeit, die sich aufgrund hoher zeitlicher und vor allem räumlicher Auflösung besonders zur Beurteilung bewegter Strukturen und Ausmessung der Herzkammern eignet. Bei diesem Verfahren werden der Abstand einzelner Herzstrukturen und ihre Bewegung gegen die Zeit aufgetragen, so dass die bewegten Herzanteile als Wellenlinien registriert werden. Hierbei wird eine Bildzeile aus dem B- Bild bei unbewegtem Schallkopf in schneller Folge aneinandergereiht und so die Bewegung der Grenzflächen über ein Ort-Zeit-Diagramm aufgezeichnet. Die Aufzeichnungsgeschwindigkeit beträgt normalerweise 25 oder 50 mm/s. Der M-Mode Strahl wird heutzutage grundsätzlich vom 2D-Bild geleitet und simultan mit ihm eingestellt [20; 40]. 20 Abbildung: Vergleich A-,B-,M-Mode; Quelle: G.Schmidt, C.Görg, Kursbuch Ultraschall, Thieme Verlag, 4.Auflage 2004, S. 16 2.7.3.4 PW-Doppler Beim PW-Doppler (puls wave) wird nur ein piezoelektrisches Element verwendet, welches alternierend als Sender und Empfänger dient. Tiefe und Weite des Messvolumens (sample volume) werden bestimmt sowie ein Blutfluss ortsselektiv erfasst . 2.7.3.5 CW-Doppler Im CW-Doppler (continous wave) werden im Gegensatz zum PW-Doppler zwei piezoelektrische Elemente verwendet, wobei ein Quarzkristall kontinuierlich sendet, ein anderer die reflektierten Ultraschallimpulse permanent empfängt und in elektrische Signale transformiert. Strömungsgeschwindigkeiten und Flussrichtung können ermittelt werden, eine Tiefenlokalisation ist nicht möglich. Anwendungsgebiet ist überwiegend die Diagnostik von Stenosen oberflächennaher Gefäße sowie die Erfassung hoher Flussgeschwindigkeiten im Herzen [40]. 21 2.7.3.6 Real Time 2D-Modus Die Entwicklung der Echokardiographie ist eng mit dem Mediziner Inge Edler [8] und dem Physiker Carl Hellmuth Hertz [4] verbunden, die bereits Mitte Dezember 1953 ihre ersten Resultate in Erlangen veröffentlichten [9]. Darüber hinaus sollte im Zusammenhang mit der Anwendung von Schallwellen am Herzen zur Visualisierung der Herzfunktion auch der Erlangener Professor Wolf-Dieter Keidel erwähnt werden, der in Bezug auf den Zeitpunkt der Publikation noch weit vor Inge Edler über Herzultraschall berichtete und als eigentlicher Inaugurator der Echokardiographie gelten sollte. Bereits 1950 verwendete Keidel Ultraschall im M-Mode Verfahren zur Volumenbestimmung [29]. Edler stellte 1961 das erste Echokardiographiegerät vor. Neben dem MMode-Verfahren gewann durch die Entwicklung von multi-array- und phased-array-Systemen auch die real time-Untersuchung des Herzens immer mehr an Bedeutung. Ein rascher Wandel vollzog sich, als 1965 Walter Krause und Richard Soldner ein schnelles B-Mode-Gerät entwickelten und 1971 Nicolaas Bom die Technik des transducerarrays (viele aneinander gereihte Wandler) etablierte. Damit waren die Vorraussetzungen für real-time-Geräte geschaffen. Die manuelle Verschiebung des Schallkopfes zur Erstellung eines statischen Bildes wurde nun durch eine elektronisch gesteuerte Verschiebung der Aussenderichtung des Sendepulses ersetzt. Durch die zweidimensionale Schnittbild-Echokardiographie ist nun eine weitgehend anatomische Abbildung der Herzstrukturen möglich. Der zugehörige Schallkopf enthält eine Vielzahl von Einzelelementen, die sehr schnell in einer bestimmten Reihenfolge sequenziell angeregt werden (phased-array). Die Bildentstehung im real-time 2D Modus wird durch automatische Verkippung des Messstrahls und Synchronisierung der B-Mode- Darstellung in Echtzeit erzeugt. Das Schnittbild wird dabei aus einzelnen Linien zusammengesetzt, wobei für jede Linie ein Strahl ausgesendet und empfangen werden muss. Die Form des erzeugten Bildes hängt dabei vom eingesetzten Sondentyp ab. Der 2D-Echtzeitmodus kann mit anderen Verfahren wie dem M-Mode oder der Dopplersonografie gekoppelt wer- 22 den. Je nach Eindringtiefe und Sondentyp können nur einige wenige oder bis über hundert zweidimensionale Bilder pro Sekunde dargestellt werden [19]. 2D enddiastolisches linksventrikuläres Cavum 2D endsystolisches linksventrikuläres Cavum 23 CW-Doppler: Transvalvulärer Aortenklappengradient während DDI-Stimulatiion PW-Doppler: Transmitrales Füllungsprofil des linken Ventrikels unter DDI-Stimulation 24 CW-Doppler: Transvalvulärer Aortenklappengradient während Sinusrhythmus Triplane Echtzeit-Echokardiographie: Näherungsweise Volumetrie durch Interpolierung aus verschiedenen Ebenen 25 2.7.3.7 Real Time 3D-Modus Die ersten 3D-Bilder erhielt man mit Hilfe der computergesteuerten Rekonstruktion. Dazu mussten 2D-Bilder, EKG- und atemgetriggert, jeweils über mehrere Herzzyklen in mehreren Schnittebenen akquiriert werden. Die naturgemäße Wiedergabe der Rekonstruktionen in Echtzeit war hier nicht möglich und es bestand ein erheblicher zeitlicher, manueller und technischer Aufwand, so dass sich die Methode für den breiteren klinischen Einsatz erst nach Verbesserung von Geräten, Schallköpfen und Software etablieren konnte. Erst zu Beginn der 90er Jahre wurde von Olaf von Ramm [35; 36] und Steven W. Smith [47; 25] die real time 3D-Echokardiographie an der Duke University, Center for Emerging Cardiovascular Technology (Durham, North Carolina, USA), entwickelt. Dies ist das erste echokardiographische Verfahren, bei dem dreidimensionale Datensätze des Herzens in Echtzeit, das heißt ohne Zeitverzögerung, EKG- und Atemtriggerung, aufgezeichnet werden konnten [3]. Die Echtzeit 3D-Echokardiographie beruht auf einer neuen Schallkopftechnologie. Durch Entwicklung entsprechender Matrix-Schallköpfe wurde die Echtzeitakquisition pyramidenförmiger Schallvolumina statt herkömmlicher 2D-Sektoren möglich. Mittels Parallelverschiebung durch zwei oder mehrere Prozessoren ist es möglich, pyramidenförmige Schallvolumina von ca. 90° lateraler Ausdehnung und 30° Breite (Elevation) abzutasten und die Ultraschallbildinformation in Echtzeit darzustellen. Die Echtzeit 3D-Datensätze können während der Untersuchung beliebig rotiert und geschnitten werden, um so eine optimale Perspektive auf die zu untersuchenden Strukturen am Herzen zu erhalten [2]. Ein Nachteil dieser neuen Schallkopftechnologie ist ein relativ kleiner Winkel, sodass nicht das gesamte Herz erfasst werden kann. Daher ist zur Beurteilung der globalen linksventrikulären Funktion eine Messdauer von 4 Herzzyklen notwendig, was z.B. bei der absoluten Arrhythmie ein Problem darstellen kann. 26 Abbildung: Bildaufbau durch Parallelverschiebung im Matrix-Schallkopf zur real time-3D-Echokardiographie Abbildung: Generierung eines dreidimensionalen linksventrikulären Volumenkörpers 27 2.8 Die Bedeutung der Real Time 3D-Echokardiographie Die Geometrie des linken Ventrikels als Systemventrikel und die damit für den großen Kreislauf entscheidende Herzhöhle ist komplex und auch für den geübten Untersucher in der zweidimensionalen Ultraschalldiagnostik oft insuffizient fassbar. Eine objektive Analyse der linksventrikulären Funktion ist durch eine dreidimensionale Untersuchung zweifelsohne vorteilhaft. Die zu jedem beliebigen Zeitpunkt im Herzzyklus mögliche Berechung des linksventrikulären Cavums, dessen Volumen und dessen Oberfläche erlaubt in der Echtzeitaufnahme eine schnelle und exakte Analyse von Volumenänderungen einerseits und Bewegungen des Myokards andererseits. Gerade die Koordination der Bewegungen an der Cavumoberfläche - die dem Endokard entspricht - hat eine wesentliche Bedeutung für die funktionelle Synchronität des Bewegungsablaufs und kann durch die dreidimensionale Echokardiographie gut und schnell erfasst werden. Rein praktisch ist der linke Ventrikel zur Analyse der Wandbewegung in 16 Segmente unterteilt (ASE/ESE-Kriterien), bei isolierter Betrachtung des Apex wird daraus ein 17-Segment-Modell. Grundlage dieser allgemein anerkannten Segmenteinteilung ist die 2D-Echokardiographie und die damit relativ einfache Zuteilung von Segmenten zu koronaren Versorgungsgebieten. In der Analyse der linksventrikulären Synchronität findet dieses 16- bzw. 17-Segment-Modell ebenso Anwendung, ist aber keinesfalls zwingend [12]. Daher werden beispielsweise auch andere Einteilungen wie basale versus mittlere Drittel (Tmsv-12) oder nur basale Drittel (Tmsv-6) oder septale versus laterale Segmente (Tmsv s-l) zur Analyse der Synchronität herangezogen. Andere Autoren bevorzugen eine höhere Auflösung von bis zu 1000 Untersegmenten [28]. 28 Abbildung: 17-Segmentmodell des linken Ventrikels (linkes Bild) mit segmentalen Kontraktionskurven (segmentale Verkürzung im zeitlichen Verlauf, Bild rechts unten) und graphischer Darstellung im sogenannten bulls-eyeplot (Bild rechts oben) Quelle: heart.bmj.com/content/ 95/22/1881.full Abbildung: bulls-eye-plot eines desynchronisierten linken Ventrikels mit Bereichen einer verfrühten Kontraktion (hier blau dargestellt) und Bereichen mit verspäter Kontraktion (rot dargestellt) 29 Die kardiale Resynchronisationstherapie ist ein wichtiger Pfeiler bei Patienten mit linksventrikulärer mechanischer Desynchronisation. Um eine Desynchronisation zu diagnostizieren und deren Grad zu quantifizieren ist die real-time 3D-Echokardiographie wahrscheinlich ein bedeutender Fortschritt im Vergleich zu den bisherigen Methoden der 2D- Echokardiographie. Mit Hilfe der real time 3D-Echokardiographie ist es möglich, Zeit-Volumen-Analysen für segmentale und globale linksventrikuläre Volumina bereitzustellen. Möglicherweise können damit Herzerkrankungen diagnostiziert werden, welche eine Resynchro- nisationstherapie erforderlich machen, die mittels anderer Untersuchungsmethoden nicht erkannt worden wären. Darüber hinaus gibt es bereits Hinweise, dass die Methode gegebenenfalls den Erfolg einer Resynchronisationstherapie voraussagen kann und somit responder von non-respondern zu unterscheiden vermag [26; 16]. Des Weiteren ist die real time 3D-Echokardiographie wahrscheinlich äußerst sinnvoll zur Optimierung einer Resynchronisationstherapie [18; 49] womit eine Verringerung der Desynchronität und somit eine Verbesserung der linksventrikulären Funktion erreicht wird [32]. 30 3 Material und Methoden 3.1 Auswahl des Patientenkollektivs Wir untersuchten ein Patientenkollektiv von 27 Schrittmacherpatienten der Herzschrittmacherambulanz der Friedrich-Alexander-Universität Erlangen im Alter von 48 bis 93 Jahren (Mittelwert 71 ± 13 Jahre), darunter 15% weiblichen, 85% männlichen Geschlechts. Alle untersuchten Patienten hatten zum Zeitpunkt der Untersuchung einen Eigenrhythmus von ≥40 Schläge pro Minute, damit während der echokardiographischen Untersuchung das Aggregat kurzzeitig deaktiviert werden konnte, um einen Vergleich der Ejektionsfraktion sowie der Synchronität der Ventrikelpumpfunktion mit und ohne Schrittmacherstimulation zu bekommen. Als Schrittmacher-Indikation lag bei 42% des Patientenkollektivs ein Sick-Sinus-Syndrom, bei 58% ein AV-Block zweiten oder dritten Grades vor. Verwendet wurden Ein- als auch Zwei-Kammer Systeme. Das Auslesen der Daten der letzten 6 Monate der Herzschrittmacher erbrachte im Mittel eine ventrikuläre Stimulation von 56%, eine atriale Stimulation von 18% und einen Eigenrhythmus von 65 Schlägen pro Minute (Median 82 bpm). An Vitalparametern wurden Größe, Gewicht, Blutdruck sowie Puls erfasst. Als kardiovaskuläre Risikofaktoren wurden Diabetes mellitus, arterielle Hypertonie, Hyperlipidämie und Nikotinkonsum erfragt. Weiter wurde auch die Medikation erfasst. Bei 29% der Patienten fand sich in der Vorgeschichte ein Myokardinfarkt, ebenfalls 29% litten unter einer koronaren Herzkrankheit. Bei 23% der Patienten war eine Mitralklappeninsuffizienz diagnostiziert. Zur Endanalyse eingeschlossen wurden nur Patienten mit normaler oder leichtgradig reduzierter linksventrikulärer Funktion (>45%). Zum Vergleich wurden auch zwei Patienten mit höhergradig eingeschränkter linksventrikulärer Funktion mitgeführt. 31 3.2 Technische Anforderung der verwendeten Real Time 3D-Echokardiographie Die Untersuchungen wurden mit dem Gerät Sonos 7500 3D von Philips durchgeführt. Der 3D-Echtzeitbetrieb für eine Volumen-Darstellung der kardialen Anatomie basiert auf 3.000 physischen Bildgebungskanälen. Es verfügt des Weiteren über 57.600 dedizierte Bildgebungskanäle. Das Gerät ist mit einem RGB-Bildschirm ohne Zeilensprungverfahren, 240x180 mm-Bild mit einer Auflösung von 640 Punkten pro Zeile und einer Punktteilung von 0,28mm, Bildschirmdiagonale 15 Zoll, ausgestattet. Betriebsart- und preset-abhängige Messungen und Berechnungen können auf 2D-, M-Mode-, PC/CW-Doppler-, Farbdoppler-, Angio-, AQ-, StudienManager- oder DSR-Standbildern oder auf laufenden oder pausierten Videorekorderbildern durchgeführt werden. Für die real-time 3D-Aufnahmen verwendeten wir den Matrix-Schallkopf x4 (2-4 MHz Fusion Betrieb, 3D-Echtzeitbetrieb 4 MHz, Frequenzbereich 1,6-4,0 MHz). Der x4 Matrix Schallkopf macht die Leistung von über 150 Computerschaltkarten nutzbar, ist in der Größe jedoch mit einem Standardschallkopf vergleichbar [33]. Bei den Matrix-Sonden der heutigen high-end Ultraschallsysteme sind etwa 3000 Elemente in mehreren Reihen angeordnet. Die Bildgenerierung erfolgt bereits im Schallkopf. Daher haben Matrix-Schallköpfe eine größere Auflagefläche und sind weniger ergonomisch geformt als die Sektor- oder phased-array transducer für die konventionelle ein- oder zweidimensionale Echokardiographie [19; 24; 51]. Für die 2D-Aufnahmen wurde der Sektor-Schallkopf s4 (2-4 MHz Fusion Betrieb, Frequenzbereich 2-4,2 MHz) verwendet [33]. 32 3.3 Echokardiographische Untersuchung Zur Ultraschall-Diagnostik wurden die Patienten zunächst in konventioneller 2D-Technik untersucht. Wir aquirierten parasternale Langachsenschnitte um daraus die enddiastolische Größe des linken Ventrikels, das Septum und die Größe des linken Vorhofs zu bestimmen; in den apikalen Anlotebenen wurden jeweils EKG-getriggert digitale Schleifen des Vier-Kammer-Blicks, Zwei-Kammer-Blicks und Drei-Kammer-Blicks aufgezeichnet, so dass daraus off-line die linksventrikulären Volumina und die Ejektionsfraktion bestimmt werden konnten (biplane Ejektionsfraktionsberechnung aus 2D nach Simpson). Weiter erfolgte die Analyse des transmitralen Einstroms durch PW-Doppler-Messung und des transaortalen Ausstroms durch Bestimmung des time-velocity-integrals durch CW-DopplerMessung im Vier- bzw. Fünf-Kammer-Blick. Für die 3D-Aufzeichung untersuchten wir die Patienten ebenso in Linksseitenlage wobei unter Atemmanöver (exspiration hold) ein Datensatz über 4 Herzzyklen in apikaler Anlotposition registriert wurde. Dieser Datensatz wurde digital gespeichert und später off-line analysiert (QLAB®). Abbildung: Kompletter 3D-Datensatz über 4 Herzzyklen getriggert 33 3.4 QLAB® Zur Auswertung der aufgezeichneten 3D-Sequenzen unter Schrittmacherstimulation und im Eigenrhythmus verwendeten wir das Programm QLAB® von Philips Medical Care. Mit der Cardiac-3D-Quantification Funktion (Cardiac 3DQ) ist es möglich, Echtzeit 3D-Aufnahmen wiederzugeben, zu bearbeiten und erweiterte Messungen auf mehreren Ebenen wie Berechnung der Ejektionsfraktion oder Bestimmung der Dicke des Kammermyokards durchzuführen. Um exakte Volumenbestimmungen durchzuführen wird die Ventrikelfüllung in der Systole sowie der Diastole in zahlreichen Schnitten ausgemessen. Anhand einiger von Hand vorgegebener Punkte (Mitralklappenebene und linksventrikulärer Apex) generiert das Programm durch Endokardabgrenzung zunächst automatisch das Volumen des Ventrikels, welches dann noch manuell durch lokale Korrektur der Endokardgrenzen optimiert werden kann. In dieser halbautomatischen Weise wird die systolische und diastolische Ventrikelfüllung berechnet. Anschließend werden entsprechend einem adaptierten Algorithmus für jedes weitere im Herzzyklus erzeugte Bild die Endokardgrenzen automatisch berechnet und angepasst. Anhand dieser Daten kann die exakte Ejektionsfraktion berechnet und eine Volumen/Zeit-Kurve für den Herzzyklus bestimmt werden. Die i-slice-Ansicht ermöglicht das gleichzeitige Betrachten von 4 bis zu 25 Schichten der kurzen Achse des linken Ventrikels, um sich einen schnellen Überblick über die Computer-generierte Endokardabgrenzung zu verschaffen und frei Hand Korrekturen vorzunehmen. Die automatische Endokarderkennung basiert auf einer speckle- technique. Hierbei werden Grauwertsignale des Myokards bzw. des linksventrikulären Cavums fokussiert und Bild für Bild im Herzzyklus vergliechen, um so das Endokard abzugrenzen (Tissue-Motion-Quatification TMQ und Advanced-Tissue-Motion-Quantification). In der Analyse kann dadurch ein „Ausguß“ des linken Ventrikels zu jedem Zeitpunkt des Herzzyklus generiert werden. Durch eine Aufteilung dieses Ausgusses in ein mehrere-Segment-Modell lassen sich additiv Aussagen über regionale und lokale linksventrikuläre Herzfunktionen treffen [34]. Im 34 Vordergrund steht dabei die Verformung des Ventrikels, unabhängig von Kontraktion oder Relaxation, unabhängig von aktiven oder passiven Mechanismen. Nach Empfehlungen der amerikanischen Gesellschaft für Echokardiographie wurde auch für unsere Messungen der linke Ventrikel zunächst in 16 Grund-Segmente eingeteilt [22; 13]. Die Aufteilung des 16-Segmentmodells geschah wie folgt: Basale Segmente Mittlere Segmente Apikale Segmente 1=Basal Anteroseptal 7=Mid Anteroseptal 13=Apikal Anterior 2=Basal Anterior 8=Mid Anterior 14=Apikal Lateral 3=Basal Lateral 9=Mid Lateral 15=Apikal Inferior 4=Basal Posterior 10=Mid Posterior 16=Apikal Septal 5=Basal Inferior 11=Mid Inferior (17= Apex isoliert) 6=Basal Septal 12=Mid Septal (Flachskampf, Praxis der Echokardiographie 2007, Georg Thieme Verlag KG,.181-83.) Unabhängig vom 16-Segment-Grundmodell wurden auch Minorvarianten untersucht. Im 12-Segmentmodell wurden vier der sechs basalen Segmente weggelassen. Somit konzentrieren sich die Berechnungen überwiegend auf die mittleren und apikalen Segmente. Im 6-Segmentmodell hingegen betrachteten wir nur die sechs basalen Segmente, die mittleren und apikalen Segmente wurden hierbei vernachlässigt. 35 Abbildung 3D-Datensatz mit off-line Analyse: Automatische Endokardabgrenzung und manuelle Korrektur in verschiedenen Ebenen zur Berechung des linksventrikulären Volumens und Generierung einer Volumen/ZeitKurve durch Berechnung des linksventrikulären Volumens zu jedem Zeitpunkt im Herzzyklus (unten). Quelle: www.healthcare.philips.com/main/products/ultrasound/technologies/qlab/cardiac 36 3.5 Zusätzliche Messwerte in der dreidimensionalen echokardiographischen Untersuchung Für die segmentale Analyse stehen im QLAB® verschiedene Methoden zur Verfügung: Zunächst wurde der Ventrikel in 16 Grund-Segmente eingeteilt und für jedes Segment eine Volumenpyramide berechnet, wobei die Basis der Pyramide die jeweilige endokardiale Segmentfläche und die Spitze den Mittelpunkt des linken Ventrikels darstellt. Daraus lässt sich für jedes Segment ein individuelles Volumen bzw. eine Volumenänderung im Verlauf des Herzzyklus berechnen (Volumen-Zeit-Kurve). Dabei wird für jedes Segment der Zeitpunkt des minimalen Volumens berechnet (time-tominimal-systolic-volume – Tmsv). Ist dieser Zeitpunkt für jedes Segment gleich - besteht also kein Zeitversatz - dann ist ein synchroner Kontraktionsablauf anzunehmen. Je weiter auseinander der Zeitpunkt des minimalen Volumens für die jeweiligen Segmente liegt, desto ausgeprägter ist die Desynchronität. Berechnet wurde dabei der zeitliche Abstand zwischen dem frühesten und dem am spätesten liegenden Segment. Da dabei ein einzelnes Segment aber bereits eine massive Beeinträchtigung bzw. Verlängerung der Tmsv bewirken kann, wird zur Beurteilung der Gesamtsynchronität aller Segmente die Standardabweichung der Tmsv herangezogen. Da der gesamte Prozess auch noch von der Herzfrequenz abhängt (niedrige Herzfrequenz mit mehr Zeitversatz, höhere Herzfrequenz mit weniger Zeitversatz), wurde der segmentale Unterschied des Zeitpunkts des minimalen Volumens auch Herzfrequenz-korrigiert in Form von Prozent angegeben. 37 Der Parameter time-to-minimal-systolic-volume (Tmsv) wurde in verschiedenen, unten angeführten Segmentmodellen analysiert. Folgende Parameter wurden zur Auswertung eingeschlossen: Tmsv 12-DIF (%) Relative Differenz des Tmsv für die 6 basalen und 6 mittleren Segmente des linken Ventrikels. Tmsv 12-DIF (ms) Absolute Differenz des Tmsv für die 6 basalen und 6 mittleren Segmente des linken Ventrikels. Tmsv 12-SD (%) Relative Standardabweichung des Tmsv für die 6 basalen und 6 mittleren Segmente des linken Ventrikels. Tmsv 12-SD (ms) Absolute Standardabweichung des Tmsv für die 6 basalen und 6 mittleren Segmente des linken Ventrikels. Tmsv 16-DIF (%) Relative maximale Differenz des Tmsv für die 6 basalen, 6 mittleren und 4 apikalen Segmente des linken Ventrikels. Der Apex wird nicht berücksichtigt. Tmsv 16-DIF (ms) Absolute maximale Differenz des Tmsv für die 6 basalen, 6 mittleren und 4 apikalen Segmente des linken Ventrikels. Der Apex wird nicht berücksichtigt Tmsv 16-SD (%) Relative Standardabweichung der Zeitspanne bis zum Tmsv für die 6 basalen, 6 mittleren und 4 apikalen Segmente des linken Ventrikels. Der Apex wird nicht berücksichtigt. Tmsv 16-SD (ms) Absolute Standardabweichung der Zeitspanne bis zum Tmsv für die 6 basalen, 6 mittleren und 4 apikalen Segmente des linken Ventrikels. Der Apex wird nicht berücksichtigt Tmsv 6-DIF (%) Relative Differenz des Tmsv für die 6 basalen Segmente des linken Ventrikels. Tmsv 6-DIF (ms) Absolute Differenz des Tmsv für die 6 basalen Segmente des linken Ventrikels. Tmsv 6-SD (%) Relative Standardabweichung des Tmsv für die 6 basalen Segmente des linken Ventrikels. Tmsv 6-SD (ms) Absolute Standardabweichung des Tmsv für die 6 basalen Segmente des linken Ventrikels Tmsv S-L (%) Relative Differenz des Tmsv zwischen den basal septalen und lateralen Segmenten des linken Ventrikels. Tmsv S-L (ms) Absolute Differenz des Tmsv zwischen den basal septalen und lateralen Segmenten des linken Ventrikels. Tmsv S-P (%) Relative Differenz des Tmsv zwischen den basal septalen und posterioren Segmenten des linken Ventrikels. Tmsv S-P (ms) Absolute Differenz des Tmsv zwischen den basal septalen und posterioren Segmenten des linken Ventrikels. Tab. 1: zusätzliche Messwerte der dreidimensionalen echokardiographischen Untersuchung 38 Abbildung zur weiteren Analyse des 3D-Datensatzes: Nach Generierung eines 3DAusgußpräperates des linken Ventrikels wird dieser in 16 Segmente unterteilt. Linkes Bild unter Eigenrhythmus (Sinusrhythmus, SR), rechtes Bild unter Schrittmacherstimulation (VVI 90/min): Bereits visuell zeigt sich eine deutliche Desynchronisation unter rechtsventrikulärem pacing (obige Bildreihe entsprechend einem 4-Kammer-Blick, untere Bildreihe mit Blickrichtung auf den linksventrikulären Apex, Abbildung unten zu endsystolischem Zeitpunkt mit korrespondierendem enddiastolischen Rahmengitter): SR 70/min. VVI 90/min. 39 Abbildung zur weiteren Analyse des 3D-Datensatzes: Generierung von Volumen-ZeitKurven für die jeweiligen Segmente mit Markierung des Zeitpunkts des segmental kleinsten Volumens (rote Pfeile). Bild oben unter Eigenrhythmus (Sinusrhythmus – SR) mit parallel verlaufenden Kurven, Bild unten unter Schrittmacherstimulation (VVI 90/min) mit desynchronem Kurvenverlauf und Betonung der apikalen, apikoseptalen und septalen Segmente. SR 70/min. ----------------------------Funktionelle Systole------------------ VVI 90/min. apikal ------------Funktionelle Systole---------apikoseptal septal 40 Abbildung zur Analyse der Globalfunktion des linken Ventrikels anhand der Messwerte aus dem linksventrikulären Volumenausgußpräperat (oberes Bild unter Eigenrhythmus/Sinusrhythmus, unteres Bild unter Schrittmacherstimulation (VVI)). Unter Schrittmacherstimulation zeigt sich eine Abnahme des enddiastolischen Volumens (EDV), des Schlagvolumens (SV) und somit auch der Ejektionsfraktion (EF). 41 3.6 Echosignalverstärker Bei zwei der untersuchten Patienten lag eine unter nativen Bedingungen zu schlechte Schallqualität vor, so dass wir zur Echosignalverstärkung ein linksherzgängiges Echokontrastmittel einsetzen (SonoVue®, Firma Bracco, Ultraschallkontrastmittel der zweiten Generation). Die Herstellung der Lösung erfolgt durch Zugabe von 0,9% Kochsalzlösung zu einem lyophilisierten Pulver. Durch vorsichtiges Schütteln entstehen Mikrobläschen aus Schwefelhexaflourid. Die Mikrobläschen haben einen mittleren Durchmesser von etwa 2,5 µm, wobei 90% einen Durchmesser <6µm und 99% einen Durchmesser <11 µm haben. Jeder Milliliter der hergestellten Lösung enthält 8 µl der Mikrobläschen. Die Grenzfläche zwischen dem Schwefelhexaflouridbläschen und dem wässrigen Medium wirkt als Reflektor des Ultraschallstrahls. Dies führt zu einer Verstärkung der Blutechogenität und erhöht den Kontrast zwischen Blut und dem umgebenden Gewebe. Der Reflexionsgrad ist allerdings von der Konzentration der Mikrobläschen und der Frequenz des Ultraschallstrahls abhängig. Bei einer B-ModeUntersuchung in der Echokardiographie hält dieser Effekt etwas mehr als 2 Minuten, bei Doppleruntersuchungen des Gefäßsystems 3 bis 8 Minuten an. Da wir repetitive Gaben des Kontrastmittels nach Möglichkeit vermeiden wollten, war daher das Zeitfenster für die echokardiographische Untersuchung begrenzt. Bei Schwefelhexaflourid handelt es sich um ein inertes, ungiftiges Gas, welches in wässriger Lösung schwer löslich ist. Schwefelhexaflourid löst sich im Blut und wird anschließend abgeatmet. An gesunden Probanden beträgt die mittlere Halbwertszeit 12 Minuten. Häufige unerwünschte Wirkungen von SonoVue sind Kopfschmerzen, veränderte Empfindung an der Injektionsstelle, Übelkeit, Flush, Parästhesien und Geschmacksstörungen [14]. 42 3.7 Durchführung der Untersuchungen Wir bestellten die 27 ausgewählten Patienten zu einer außerordentlichen Schrittmacherkontrolle in die Schrittmacherambulanz des Universitätsklinikums Erlangen ein. Anhand eines kurzen Fragebogens wurden wichtige Daten der Patienten wie derzeitige Medikamenteneinnahme, kardiale Vorerkrankungen, Grund der Schrittmacherimplantation und kardiale Risikofaktoren erfasst. In Folge bestimmten wir Körpergröße, aktuelles Gewicht und den Blutdruck der Probanden. Beim anschließenden Auslesen der Herzschrittmacher galt unser besonderes Augenmerk der Grundfrequenz sowie den prozentualen Anteilen der Schrittmacheraktivität (pacing) innerhalb der letzten sechs Monate. Erfasst wurden Daten von Ein- als auch Zwei-Kammer-Systemen der Firmen Biotronik, St. Jude Medical und Medtronic. 49,2% der Patienten zeigten im letzten 6-Monats-Zeitraum eine Schrittmacheraktivität. Dabei lagen die durchschnittlichen Stimulationsraten atrial bei 32,6% (0%-97%) und ventrikulär bei 33,1% (0%-68%). Die übrigen 50,8% der Patienten zeigten im 6-Monats-Zeitraum keine Schrittmacherstimulation. Zum Untersuchungszeitpunkt zeigten alle Patienten einen Eigenrhythmus. Im Anschluss wurde bei den Probanden unter EKG-Kontrolle eine zweiund dreidimensionale echokardiographische Untersuchung in der Eigenfrequenz und dann während Schrittmacherstimulation durchgeführt. Die anschließende PC-Auswertung erfolgte mittels des oben beschriebenen Programms QLAB® der Firma Philips. 43 3.8 Statistik Nach Auswertung der Daten im Excel-Tabellenkalkulationsprogramm wurden Konfidenzintervalle und Korrelationen bestimmt. Bei einigen Bestimmungen wie dem Zusammenhang der Stimulationshäufigkeit und der Desynchronisation ist die Aussagekraft aufgrund der für Beweisbarkeit eines derartigen Zusammenhangs nötigen zu geringen Datenmenge limitiert. In der Analyse wurde ein gepaarter T-Test verwendet, das Signifikanzniveau lag bei p<0,05. 44 4 Ergebnisse 4.1 Patientendaten Verschiedenste kardiale Risikofaktoren wurden bei den Probanden dokumentiert. So litten 11% der untersuchten Patienten unter einem Diabetes mellitus, 72% unter arterieller Hypertonie, 33% unter Hyperlipidämie und 39% gaben einen regelmäßigen Nikotinkonsum an. Die Medikamentenanamnese ergab bei 64% der Probanden eine Dauermedikation mit β-Blockern. Einer Therapie mit Calciumantagonisten unterlagen 7% der Patienten, mit Digitalis wurden 23% der Patienten behandelt und ACEHemmer wurden von 62% der Probanden regelmäßig eingenommen. BASISDATEN n männlich Alter body-mass-index (BMI) Größe (cm) Gewicht (kg) RR sys (mmHg) RR dia (mmHg) Puls (bpm) Risikofaktoren Medikamente chronische KHK Mitralklappeninsuffizienz Linkes Atrium (mm) LVEDD (mm) Indikation Diabetes Hyperonie Hyperlipid Nikotin Beta-Blocker Ca-Blocker Digitalis ACE-Hemmer SSS AV-Block ventr. Stimulation (6 Mo.) atriale Stimulation (6 Mo.) Tab. 2: Basisdaten; MV = Mittelwert, SD = Standardabweichung 27 85% 71 ±13 28 ± 4 172 ± 9 83 ± 13 137 ± 24 78 ± 9 77 ± 13 11% 72% 33% 39% 64% 7% 23% 62% 29% 23% 38 ± 6 51 ± 6 42% 58% 28% 30% MV±SD MV±SD MV±SD MV±SD MV±SD MV±SD MV±SD MV±SD MV±SD 45 4.2 Grunddaten der echokardiographischen Untersu- chungen Unten angeführte Tabelle zeigt die Ergebnisse der Messungen unter Eigenrhythmus. Angeführt sich dabei zunächst aus dem 3D-Datensatz berechnetes enddiastolisches Volumen (EDV), Herzfrequenz (HF), Ejektionsfraktion (EF), endsystolisches Volumen (ESV), Schlagvolumen (SV), time-to-minimalsystolic-volume (Tmsv) für ein 12-Segment-Modell (Tmsv 12), ein 16Segment-Modell (Tmsv 16), ein 6-Segment-Modell (Tmsv 6), ein septaleslaterales Modell (Tmsv SL) und ein septales-posteriores Modell (Tmsv SP). Anschließend folgen aus dem konventionellem 2D-Datenbild berechnete Werte für das linksventrikulär enddiastolische Volumen (LVEDV), die Ejektionsfraktion (EF), das biplan berechnete Schlagvolumen (SV plan), das time-velocity-integral des Aortenklappenausstroms (AK) und des Mitralklappeneinstroms (MK), das über Flußgradienten berechnete Schlagvolumen (SV flow) 46 RUHE/EIGENRHYTHMUS 3D EDV HF EF ESV SV bpm Tmsv Tmsv Tmsv Tmsv 12-Dif 12-Dif 12-SD 12-SD (%) (ms) (%) (ms) Patient 1 128 64 68 41 87 22,43 177 5,76 48 2 110 58 64 40 70 12,77 127 2,45 29 3 145 70 62 55 90 19,4 155 4,03 32 4 87 64 62 33 54 14,97 153 5,7 57 5 120 53 52 58 62 4,05 46 1,3 15 6 129 70 62 49 80 13,8 144 6,42 62 7 160 80 50 80 80 68,54 501 17,81 130 8 145 78 62 55 90 20,67 168 5,98 51 9 98 70 57 42 56 24,77 212 6,24 53 10 128 75 61 50 78 18,57 180 7,3 71 11 119 92 62 45 74 30,63 204 13,72 91 12 103 64 58 43 60 51,36 482 13,33 125 13 160 57 46 86 74 0,73 5 0,29 2 14 115 68 62 44 71 44,8 396 12,14 107 15 92 60 56 40 52 15,11 107 5,35 38 16 219 56 38 136 83 42,73 325 16,08 122 17 89 69 54 41 48 21,56 188 7,77 68 18 192 76 45 106 86 8,22 67 2,8 23 19 200 61 56 88 112 33,4 329 12,77 126 20 120 53 74 31 89 31,63 275 10,48 91 21 115 86 49 59 56 28,67 200 8,91 62 22 118 64 66 40 78 22,48 163 8,77 63 23 110 86 53 52 58 14,63 102 5,45 38 24 124 60 65 43 81 37,6 220 12,94 89 25 243 52 55 109 134 47,23 403 17,8 132 26 142 52 20 114 28 32,76 378 10,3 119 27 88 60 65 31 57 15,03 101 13,1 90 MV 133 67 56 60 74 26 215 9 72 SD 40 11 11 28 21 Tab. 3: Daten der 3D-Messungen, Eigenrhythmus in Ruhe 47 RUHE/EIGENRHYTHMUS 3D (Fortsetzung) Tmsv Tmsv Tmsv Tmsv Tmsv Tmsv Tmsv Tmsv 16-Dif 16-Dif 16-SD 16-SD 6-Dif 6-Dif 6-SD 6-SD (%) (ms) (%) (ms) (%) (ms) (%) (ms) 1 22,43 177 4,33 54 7,88 31 4,2 15 2 18,43 169 3,2 46 6,22 21 2,94 17 3 20,06 172 5,5 48 6,01 20 3,1 19 4 24,88 220 5,8 50 18,45 177 13,81 89 5 24,9 221 6,3 53 2,58 29 1,01 11 6 21,4 225 7,2 76 14,33 140 6,8 70 7 69,88 511 17,85 131 26,88 197 12,33 90 8 23,5 178 4,9 58 8,2 34 5,32 17 9 24,77 212 5,56 48 24,77 212 9,05 78 10 19,83 192 7,02 68 17,3 167 8,16 79 11 57,78 333 18,02 104 30,63 204 11,76 78 12 74,4 698 22,97 215 18,72 176 8,47 79 13 16,9 103 4,21 26 0 0 0 0 14 46,28 408 14,36 127 14,64 129 6,89 61 15 15,11 107 5,72 40 6,14 43 2,51 18 16 42,73 325 14,85 113 42,73 325 17,52 133 17 44,08 383 11,28 98 8,15 71 3,58 31 18 11,31 92 3,3 27 6,17 50 2,63 21 19 93,15 810 25,71 224 32,48 320 14,36 141 20 60,85 529 14,92 130 20,12 175 8,93 78 21 33,44 233 9,64 67 28,67 200 10,77 75 22 22,48 163 7,85 57 21,9 158 10,07 73 23 19,31 135 5,88 41 12,29 86 5,46 38 24 42,57 367 15,7 115 20,15 174 8,65 75 25 52,55 412 19,33 160 23,77 243 9,44 89 26 37,44 432 11,76 136 17,94 207 6,46 75 27 15,03 101 13,1 90 4,72 41 2,89 18 MV 35 293 11 89 16 134 7 58 Patient SD Tab. 3: Daten der 3D-Messungen, Eigenrhythmus in Ruhe (Forts.) 48 RUHE/EIGENRHYTHMUS 3D (Fortsetzung) TmsvSL TmsvSL TmsvSP TmsvSP (%) (ms) (%) (ms) 1 2,56 12 1,29 5 2 0 0 0 0 3 0 0 0 0 4 13,81 89 2,89 26 5 2,58 29 2,21 25 6 8,6 64 7,4 52 7 0 0 0 0 8 5,32 17 2,98 11 9 -0,52 -3 0 0 10 16,46 159 16,46 159 11 28,75 192 26,25 175 12 17,28 162 18,72 176 13 0 0 0 0 14 13,69 121 10,39 92 15 -5,19 -36 -6,14 -42 16 -42,73 -324 -4,53 -33 17 2,4 21 8,15 71 18 -2,06 -16 -3,6 -28 19 -14,64 -143 -32,03 -314 20 15,81 138 -0,48 -3 21 28,67 200 14,33 100 22 -1,73 -12 -21,9 -157 23 11,71 82 9,95 69 24 12,66 143 12,66 143 25 9,89 91 12,54 114 26 5,46 63 156 18 27 0 0 0 0 MV 5 39 9 24 Patient SD Tab. 3: Daten der 3D-Messungen, Eigenrhythmus in Ruhe (Forts.) 49 RUHE/EIGENRHYTHMUS 2D LVEDV EF SV (plan) IVS LVEDD ml (%) (ml) 1 110 62 68 11 54 2 93 58 54 10 53 3 131 54 71 12 56 4 62 60 37 11 45 5 115 58 67 11 43 6 125 62 78 12 39 7 111 63 70 12 56 8 139 54 75 10 56 9 92 57 52 12 48 10 124 64 79 10 55 11 111 69 77 13 47 12 99 64 63 14 43 13 101 59 60 12 43 14 84 52 44 9 56 15 85 71 60 11 41 16 300 34 102 12 62 17 94 52 49 11 53 18 190 42 80 12 52 19 181 58 105 13 60 20 104 71 74 11 51 21 98 52 51 12 48 22 99 72 71 11 53 23 119 57 68 12 49 24 107 64 68 10 56 25 249 58 144 13 58 26 140 23 32 11 57 27 86 64 55 9 48 MV 124 58 69 11 51 SD 52 11 22 1 6 Patient Tab. 4: Daten der 2D-Messungen, Eigenrhythmus in Ruhe 50 RUHE/EIGENRHYTHMUS 2D (Fortsetzung) Aorta LA AK MK AK SV (flow) (VTI) (VTI) Diameter (ml) Patient 1 28 38 28 25 19 79 2 25 39 41 24 18 104 3 28 47 30 34 19 85 4 26 41 21 15 19 60 5 24 38 25 20 19 71 6 23 38 22 19 18 56 7 37 36 23 21 24 104 8 30 36 21 19 22 80 9 28 39 23 19 21 80 10 27 39 24 22 22 91 11 36 44 28 24 24 127 12 30 41 37 16 19 105 13 30 32 24 24 22 91 14 31 39 21 16 22 80 15 32 21 68 25 12 77 16 37 44 27 24 26 143 17 27 35 27 20 21 94 18 23 40 35 20 21 121 19 30 51 22 26 23 91 20 28 31 26 16 21 90 21 29 40 19 27 23 79 22 27 33 19 19 21 66 23 24 33 22 20 20 69 24 32 32 23 15 22 87 25 28 42 27 26 25 133 26 27 43 22 20 22 84 27 25 32 32 22 19 91 MV 29 38 27 21 21 90 SD 4 6 10 4 3 21 Tab. 4: Daten der 2D-Messungen, Eigenrhythmus in Ruhe (Forts.) 51 Im Weiteren werden unten die Ergebnisse der Messungen unter Schrittmacherstimulation (VVI 90/min) aufgelistet. Angeführt sind dabei zunächst aus dem 3D-Datensatz berechnetes enddiastolisches Volumen (EDV), Herzfrequenz (HF), Ejektionsfraktion (EF), endsystolisches Volumen (ESV), Schlagvolumen (SV), time-to-minimalsystolic-volume (Tmsv) für ein 12-Segment-Modell (Tmsv 12), ein 16Segment-Modell (Tmsv 16), ein 6-Segment-Modell (Tmsv 6), ein septaleslaterales Modell (Tmsv SL) und ein septales-posteriores Modell (Tmsv SP). Anschließend folgen aus dem konventionellem 2D-Datenbild berechnete Werte für das linksventrikulär enddiastolische Volumen (LVEDV), die Ejektionsfraktion (EF), das biplan berechnete Schlagvolumen (SV plan), das time-velocity-integral des Aortenklappenausstroms (AK) und des Mitralklappeneinstroms (MK), das über Flußgradienten berechnete Schlagvolumen (SV flow). 52 STIMULATION 3D EDV HF EF ESV SV bpm Tmsv Tmsv Tmsv Tmsv 12-Dif 12-Dif 12-SD 12-SD (%) (ms) (%) (ms) Patient 1 109 75 59 45 64 59,2 312 15,2 88 2 94 68 58 39 55 28,66 276 5,32 62 3 132 82 55 59 73 30,62 207 13,41 92 4 84 75 60 34 50 28,6 277 9,7 110 5 115 65 50 58 58 23,56 267 8,09 92 6 120 80 55 54 66 19,48 182 10,5 88 7 144 90 45 79 65 82,6 551 30,08 201 8 116 88 55 52 64 42,77 328 10,41 106 9 91 77 42 53 38 42,7 278 8,76 66 10 118 88 56 52 66 76,05 608 29,18 233 11 92 100 52 44 48 57,78 333 18,51 107 12 87 75 55 39 48 66,75 400 16,9 101 13 152 68 40 91 61 13,68 144 5,33 56 14 102 78 55 46 56 67,17 517 22,62 174 15 86 85 43 49 37 47,97 267 18,62 103 16 204 74 32 139 65 50,48 541 18,83 202 17 91 78 38 56 35 59,21 363 16,43 101 18 187 84 48 97 90 16,89 133 4,89 39 19 183 69 50 92 92 82,8 720 21,29 185 20 118 60 64 42 76 49,32 558 17,55 199 21 110 98 37 69 41 17,53 104 5,86 35 22 115 82 49 59 56 45,78 429 16,7 157 23 107 90 47 57 50 23,68 163 9,94 69 24 120 72 59 49 71 42,78 265 18,4 106 25 220 60 52 106 114 57,54 450 19,3 145 26 167 60 17 139 28 76,68 648 20,91 177 27 90 70 45 50 41 32,89 251 18,26 176 MV 124 77 49 65 59 46 355 15 121 SD 38 11 10 28 19 Tab. 5: Daten der 3D-Messungen, Schrittmacher-Stimulation 53 STIMULATION 3D (Fortsetzung) Tmsv Tmsv Tmsv Tmsv Tmsv Tmsv Tmsv Tmsv 16-Dif 16-Dif 16-SD 16-SD 6-Dif 6-Dif 6-SD 6-SD (%) (ms) (%) (ms) (%) (ms) (%) (ms) 1 45,2 387 9,16 197 18,32 75 9,2 42 2 32,56 402 7,01 84 11,3 53 6,02 39 3 73,89 490 24,7 154 12,01 42 8,2 76 4 55,3 430 11,6 107 30,4 280 19 151 5 53,37 604 13,43 152 19,51 221 7,66 87 6 48,04 452 22,6 152 30,6 201 10,77 77 7 82,6 551 29,94 200 32,45 216 13,25 88 8 46,9 392 10,43 201 17,44 71 10,5 42 9 59,74 466 15,46 120 32,56 285 2,1 20 10 87,28 698 31,87 255 69,42 555 31,35 251 11 73,75 492 22,46 150 57,78 333 24,9 144 12 66,75 400 17,87 107 54 324 18,73 112 13 21,37 225 7,11 75 13,68 144 6,74 71 14 89,92 692 26,8 206 37,92 292 19,62 151 15 62,12 345 20,1 112 46,74 260 19,98 111 16 68,83 738 21,41 229 33,04 354 15,72 168 17 59,21 363 15,21 93 31,31 192 11,33 69 18 16,89 133 5,47 43 6,86 54 2,72 21 19 54,44 536 16,01 157 36,74 320 14,34 125 20 49,32 558 15,61 177 48,95 554 22,23 252 21 51,9 308 11,15 66 17,53 104 6,9 41 22 45,78 429 15,15 142 45,33 425 20,86 196 23 23,68 163 8,87 61 5,92 41 2,36 16 24 63,66 399 10,26 201 18,58 78 10,65 82 25 51,67 410 23,64 199 38,89 390 10,21 96 26 89,46 756 20,58 174 75,61 639 24,89 210 27 39,28 288 18,99 179 12,56 112 4,94 52 MV 56 448 17 148 32 244 13 103 Patient SD Tab. 5: Daten der 3D-Messungen, Schrittmacher-Stimulation (Forts.) 54 STIMULATION 3D (Fortsetzung) TmsvSL TmsvSL TmsvSP TmsvSP (%) (ms) (%) (ms) Patient 1 6,1 28 4,1 13 2 16,7 142 14,8 133 3 16,46 152 16,46 152 4 28,93 191 12,6 142 5 19,14 217 1,47 17 6 15,88 147 13,05 143 7 21,5 156 21,5 156 8 11,05 46 6,23 25 9 -21,91 -187 2,86 25 10 -62,78 -501 -49,51 -395 11 57,78 333 42,61 246 12 54 324 29,25 176 13 0 0 12,4 131 14 -37,38 -287 -37,92 -291 15 -30,75 -170 -30,75 -170 16 -24,78 -265 -32,58 -348 17 4,76 29 -2,04 -12 18 6,86 54 4,22 33 19 -3,11 -26 -36,74 -319 20 -32,76 -370 -29,08 -328 21 1,4 8 0 0 22 -34,67 -324 -36,89 -345 23 4,14 29 4,74 33 24 18,66 77 18,66 77 25 10,15 94 10,15 94 26 13,85 117 -19,7 -165 27 12,33 111 12,33 111 MV 3 5 -2 -25 SD Tab. 5: Daten der 3D-Messungen, Schrittmacher-Stimulation (Forts.) 55 STIMULATION 2D LVEDV EF SV (plan) AK MK SV (flow) ml (%) (ml) (VTI) (VTI) (ml) 1 97 55 53 24 20 68 2 86 50 43 23 20 59 3 122 50 61 25 28 71 4 60 58 35 19 14 54 5 110 55 61 22 18 62 6 117 50 59 20 17 51 7 98 48 47 18 15 81 8 143 42 60 15 18 57 9 80 50 40 13 17 45 10 116 52 60 18 14 68 11 99 64 63 19 17 86 12 105 55 58 30 17 85 13 95 64 61 21 12 80 14 82 38 31 19 12 72 15 80 52 42 58 21 66 16 290 32 93 23 13 122 17 87 48 42 20 14 69 18 164 37 61 31 14 107 19 153 56 86 14 17 58 20 87 57 50 29 21 100 21 95 50 48 22 24 91 22 89 49 44 18 15 62 23 97 47 46 21 16 66 24 102 60 61 21 14 80 25 187 51 95 22 14 108 26 136 21 29 20 18 76 27 87 56 49 33 16 94 MV 113 50 55 23 17 76 SD 45 9 17 9 4 19 Patient Tab. 6: Daten der 2D-Messungen, Schrittmacher-Stimulation 56 4.3 Vergleich der Volumina, Ejektionsfraktion und Klappengradienten im Eigenrhythmus und während Schrittmacherstimulation In der zweidimensionalen echokardiographischen Aufzeichnung ist eine Abnahme des linksventrikulären enddiastolischen Füllungsvolumens unter Schrittmacherstimulation im Vergleich zum Eigenrhythmus von durchschnittlich 124 ml ± 52 ml auf 113 ml ± 45 ml um 8,9% (= 11 ml) zu beobachten. Es besteht allerdings keine Signifikanz. Ähnliche Ergebnisse liegen bei der Ejektionsfraktion vor. Hier ist eine Abnahme von 58% ± 11% im Eigenrhythmus auf 50% ± 9% unter Schrittmacherstimulation festzustellen, was einer Reduktion von 8 % entspricht. Es zeigt sich hier aber ein signifikanter Zusammenhang (p < 0,01). Bei der Betrachtung des planimetrischen Schlagvolumens, berechnet über die Ejektionsfraktion aus der Flächenkurve, erkennt man eine signifikante Abnahme von durchschnittlich 69 ml ± 22 ml auf 55 ml ± 17 ml. Bei dem über den Fluss gerechneten Schlagvolumen ergibt sich mit einer Abnahme von durchschnittlich 90 ml ± 21 ml im Eigenrhythmus auf 76 ml ± 19 ml unter Schrittmacherstimulation ein vergleichbarer Wert. Die real time 3DAufzeichnungen bestätigten diese Ergebnisse. So kann hier eine Abnahme des linksventrikulären enddiastolischen Füllungsvolumens um durchschnittlich 6,8% von 133 ml ± 40 ml im Eigenrhythmus zu 124 ml ± 38 ml unter Schrittmacherstimulation beobachtet werden (nicht signifikant). Bei der Ejektionsfraktion ist ähnlich wie zuvor in der zweidimensionalen Messung eine signifikante Abnahme der um 7% von ursprünglich 56% ± 11% im Eigenrhythmus auf 49% ± 10% während Schrittmacherstimulation zu erkennen. Beim planimetrisch gerechneten Schlagvolumen ist eine signifikante Abnahme von 74 ml ± 21 ml im Grundrhythmus auf 59 ml ± 19 ml während Schrittmacherstimulation, also um 20,27%, zu erkennen. Ebenso wie das über den Fluss gemessene Schlagvolumen wurde das velocity-time-integral (VTI) über der Aorten- und Mitralklappe nur in der zweidimensionalen echokardiographischen Untersuchung bestimmt. Bei der VTI-Bestimmung über der Aortenklappe konnte eine nicht signifikante 57 Abnahme des VTI um durchschnittlich 4 cm von 27 cm ± 10 cm während der Untersuchung im Eigenrhythmus auf 23 cm ± 9 cm während Schrittmacherstimulation verzeichnet werden. Im Gegensatz dazu zeigte die Messung des VTI über der Mitralklappe eine hochsignifikante Reduktion unter Schrittmacherstimulation (p < 0,01). So ist eine Abnahme von durchschnittlich 4 cm von 21cm ± 4 cm im Eigenrhythmus zu 17 cm ± 4 cm unter Schrittmacherstimulation gemessen worden. VERGLEICH EIGENRHYTHMUS VS. SCHRITTMACHERSTIMULATION SMStimulation Eigenrhythmus Puls (bpm) 2D 3D p-Wert MV SD MV SD 67 11 77 11 0,001 LVEDV EF SV SV (flow) VTI (av) VTI (mv) (ml) (%) (ml) (ml) (cm) (cm) 124 58 69 90 27 21 52 11 22 21 10 4 113 50 55 76 23 17 45 9 17 19 9 4 0,430 0,008 0,012 0,010 0,083 0,0001 n.s. LVEDV EF SV (ml) (%) ml 133 56 74 40 11 21 124 49 59 38 10 19 0,397 0,010 0,012 n.s. Tmsv 12 Tmsv 12 Tmsv 16 Tmsv 16 Tmsv 6 Tmsv 6 Tmsv SL Tmsv SL Tmsv SP Tmsv SP % ms % ms % ms % ms % ms 26 215 35 293 23 134 5 39 9 24 9 72 11 89 7 58 46 355 56 448 32 244 3 5 -2 -25 15 121 17 148 13 103 0,0002 0,001 0,0005 0,002 0,001 0,005 0,719 0,456 0,177 0,250 n.s. n.s. n.s. n.s. n.s. Tab. 7: Vergleich der Gesamtdaten von Eigenrhythmus vs. Schrittmacher-Stimulation (VVI) mit Angabe von Mittelwert (MV) und Standardabweichung (SD) 58 Abbildungen zum Vergleich der Ejektionsfraktion im Grundrhythmus versus VVISchrittmacherstimulation in der 3D-Analyse: Die obere Abbildung zeigt bei allen Probanden eine Abnahme der Ejektionsfraktion. Auch die beiden - nicht in die Endauswertung eingegangenen, aber mitgeführten - Patienten mit einer höhergradig eingeschränkten linksventrikulären Ausgangsfunktion zeigten unter Schrittmacherstimulation eine weitere Verschlechterung der Ejektionsfraktion. 1 = Grundrhythmus; 2 = Schrittmacherstimulation 59 4.4 Vergleich der Ergebnisse der zwei- und dreidimensionalen echokardiographischen Untersuchungen Betrachtet man das linksventrikuläre enddiastolische Füllungsvolumen, so ergeben sich in der zweidimensionalen Messung durchschnittlich 124 ml ± 52 ml im Eigenrhythmus und 113 ml ± 45 ml unter Schrittmacherstimulation. Bei den dreidimensionalen Messungen ergeben sich im Eigenrhythmus durchschnittliche Werte von 133 ml ± 40 ml, was einer Abweichung gegenüber den zweidimensional gemessenen Werten um 9 ml oder 7,25% entspricht, und 124 ml ± 38 ml unter Schrittmacherstimulation, also 11 ml oder 9,73% mehr Volumen in den 3D- verglichen zu den 2DMessungen. Allgemein erhält man bei den dreidimensionalen Aufnahmen höhere Werte für das linksventrikuläre enddiastolische Volumen als in den zweidimensionalen Messungen. Bei einem Korrelationskoeffizienten von r=0,74 korrelieren die Werte der 2D- und 3D-Volumen-Messungen tendenziell gut miteinander, erreichen aber kein suffizientes Signifikanzniveau. 60 Im Vergleich der Ejektionsfraktion zeigt sich kein signifikanter Unterschied zwischen zweidimensionaler oder dreidimensionaler Berechnung. Da sich sowohl die enddiastolischen als auch die endsystolischen Volumina bei der dreidimensionalen Bestimmung als höher erwiesen, war der bias der Ejektionsfraktionsberechnung sowohl im Zähler als auch im Nenner unidirektional verändert, was mathematisch einer automatischen Korrektur entspricht, so dass im Ergebnis die Ejektionsfraktion keinen wesentlichen Unterschied zwischen 2D-Berechnung oder 3D-Berechnung aufwies. Aufgrund der Kumulation der berechneten Ejektionsfraktionen in einem relativ kleinen Fenster (Standardabweichungen aller Ejektionsfraktionsberechnungen 9-11%) ist die Korrelation der Ejektionsfraktion im Vergleich von 2D zu 3D geringer als beim Volumenvergleich. So ergibt sich in den zweidimensionalen Aufnahmen ein Durchschnittswert von 58% ± 11% für die Ejektionsfraktion im Eigenrhythmus und 50% ± 9% während Schrittmacherstimulation. Bei dreidimensionaler Berechnung ist der Wert für die Ejektionsfraktion nur marginal geringer. Bei Eigenrhythmus beträgt die Differenz lediglich 2%-Punkte (56% Ejektionsfraktion bei 3D vs. 58% bei 2D); unter Schrittmacherstimulation zeigte sich nur ein 1% Unterschied (49% Ejektionsfraktion bei 3D vs. 50% bei 2D). 61 62 4.5 Vergleich der segmentalen Synchronität im 6-, 12und 16-Segmentmodell Bei der Bestimmung der Synchronität respektive Desynchronisation des linken Ventrikels unter Schrittmacherstimulation durch Messung der Zeit zum kleinsten systolischen Volumen (time-to-minimal-systolic-volume, Tmsv) in der dreidimensionalen echokardiographischen Untersuchung erschlossen sich die Werte im 6-(Tmsv 6), 12-(Tmsv 12) und 16-(Tmsv 16) Segmentmodell wie folgt: Bei der relativen Bestimmung des Tmsv 12 ergab sich im Eigenrhythmus ein Mittelwert von 26% ± 9%. Unter Schrittmacherstimulation stieg der Mittelwert auf 46% ± 15%. Hierbei zeigt sich bei einem p-Wert von 0,0002 ein hochsignifikanter Zusammenhang. Die Berechnung des absoluten Wertes für das Tmsv 12 in Millisekunden erbrachte ebenfalls einen signifikanten Zusammenhang (p-Wert 0,001). Im Eigenrhythmus errechneten sich für das Tmsv 12 215 ms ± 72 ms Verzögerung zwischen dem frühesten und dem am spätesten liegenden Segment, unter Schrittmacherstimulation war der Mittelwert mit 355 ms ± 121 ms deutlich verlängert. Bei der prozentualen Bestimmung des Tmsv 16 errechnete sich im Eigenrhythmus ein Mittelwert von 35% ± 11%. Unter Schrittmacherstimulation ergab sich ein Mittelwert von 56%, ± 17%. Auch hier ist der Zusammenhang bei einem p-Wert hoch signifikant (p<0,001). Bei der Berechnung des absoluten Wertes des Tmsv 16 in Millisekunden zeigte sich im Grundrhythmus ein Mittelwert von 293 ms ± 89 ms und während Schrittmacherstimulation ein Mittelwert von 448 ms ± 148 ms. Der Zusammenhang ist bei einem p-Wert von 0,002 ebenfalls signifikant. Demnach ist festzustellen, dass sich ähnliche Messergebnisse bei der Betrachtung des Tmsv 12 als auch des Tmsv 16 mit jeweils hoch signifikanter Zunahme der zeitlichen Verzögerung der segmentalen Kontraktionen zeigen. Bei der relativen Berechnung des Tmsv 6 ergibt sich im Eigenrhythmus ein Mittelwert von 23% ± 7% und bei Schrittmacherstimulation ein Mittelwert von 32% ± 13% (p<0,001). Bei der Berechnung des Absolutwertes 63 des Tmsv 6 errechneten sich Werte von 134 ± 58ms im Grundrhythmus und 244 ± 103ms unter Schrittmacherstimulation, p<0,005 (Tab. 3, Tab. 5, Tab. 7). Die Messergebnisse des Tmsv im 12-, 16- und 6-Segmentmodell in der dreidimensionalen echokardiographischen Untersuchung beweisen eine signifikante Desynchronisation unter Schrittmacherstimulation. Nicht-signifikante Ergebnisse erbrachte der Vergleich des Tmsv SL im Eigenrhythmus und während Schrittmacherstimulation. Bei der relativen Berechnung in Prozent errechnete sich ein Wert von 5% im Grundrhythmus und 3% unter Schrittmacherstimulation. Die absolute Berechnung in Millisekunden ergab Werte von 39 ms im Eigenrhythmus und 5 ms unter Schrittmacherstimulation. Ebenfalls nicht signifikante Zusammenhänge ergab die Berechnung des Tmsv SP. Die relative Berechnung erbrachte Werte von 9% im Grundrhythmus und -2% während Schrittmacherstimulation. Die absoluten Werte waren 24 ms im Eigenrhythmus und -25 ms bei Schrittmacherstimulation (Tab. 3, Tab. 5, Tab. 7). 4.5.1 Vergleich der Segmentmodelle Während ein 16-Segment-Model für den klinischen Alltag eher aufwändiger und unpraktisch erscheint ist das Verwenden von weniger-SegmentModellen attraktiver. In unserem Ansatz wurde daher ein Vergleich von einem 16-Segment-Modell mit einem 12-Segment-Modell und einem 6Segment-Modell untersucht. Darüber hinaus wurde ein noch primitiveres System getestet, bei dem nur zwei Myokardzonen verglichen wurden. Diese orientierten sich an den Abschnitten mit dem vermeintlich größten Zeitversatz unter Stimulation: Bei rechtsapikaler Stimulation scheint der linksventrikuläre Kontraktionsablauf zunächst apikoseptal zu beginnen und in den lateralen und posterioren Abschnitten zu enden. Daher wurde bei dem einfachsten Modell das gesamte Septum mit der gesamten lateralen Wand (Tmsv SL) oder der gesamten posterioren Wand verglichen (Tmsv SP). 64 1 = Grundrhythmus; 2 = SM-Stimulation Vergleicht man die Messwerte des Tmsv 16 mit denen des Tmsv 12, so zeigt sich in beiden Modellen bei Schrittmacherstimulation eine Verschlechterung der Synchronität mit Anstieg des Zeitversatzes sowohl in absoluten als auch relativen Werten (Tmsv 16 448 ± 148ms vs. Tmsv 12 355 ± 121ms, (Tab. 5, Tab. 7). Da im 12-Segment-Modell die apikalen Ab- 65 schnitte nicht erfasst werden und dieses Modell im Vergleich zum 16Segment-Modell einem um 93ms kürzeren Zeitversatz aufweist, ist Schluss zu folgern, dass ein wesentlicher Anteil der Desynchronisation der linksventrikulären Kontraktion in einer apikalen Störung begründet liegt. Im Vergleich zum 6-Segment-Modell wird dieser Sachverhalt noch viel klarer. So zeigt sich dabei unter Schrittmacherstimulation ein absoluter Zeitversatz von 244 ± 103ms. Dieser ist im Vergleich zum 16-Segment-Modell um 204ms und im Vergleich zum 12-Segment-Modell um 111ms geringer ausgeprägt und beweist damit eine deutliche Desynchronisation der apikalen zu den basalen Abschnitten unter Schrittmacherstimulation (Tab. 5, Tab. 7). p=0,00117 Der direkte Vergleich des 16-Segment-Modells mit dem 6-SegmentModell, das ja nur die basalen Abschnitte erfasst, lässt aber noch weitere Rückschlüsse zu, insbesondere wenn man die Ausgangswerte unter intrinsischer Überleitung mit ein bezieht. Im 16-Segment-Modell verlängert sich das Maß der Synchronität (Tmsv) durch Stimulation um durchschnittlich 155ms, im 6-Segment-Modell verlängert sich die Tmsv durch Stimulation um durchschnittlich 110ms. Bei Umrechnung würde dies bedeuten, dass beinahe 71% der Schrittmacher-induzierbaren Desynchronisation 66 (absolut 110ms) in der basaler Ebene bedingt sind und nur 29% (absolut 45ms) durch die Deformierung von apikal nach basal verursacht werden (Tab. 3, Tab. 5, Tab. 7). p=0,00016 4.6 Vergleich der Patientendaten hinsichtlich Stimula- tionshäufigkeit In unserem Patientenkollektiv zeigten sich hinsichtlich aller gemessenen Parameter weder in den zweidimensionalen noch in den dreidimensionalen echokardiographischen Untersuchungen signifikante Zusammenhänge zwischen der 6-Monats-Stimulationsrate und der Abnahme der Ejektionsfraktion, der Veränderung des LVEDV oder des Grades der Desynchronisation (Tab. 3, Tab. 4, Tab. 7). Unter Schrittmacherstimulation war der Kontraktionsablauf desynchron und bei den meisten Patienten mit höherer Stimulationsrate war auch nach Abschalten des Schrittmachers eine linksventrikuläre Desynchronisation zu verzeichnen. Bei Patienten mit einer Stimulationsrate von weniger als 50% in den letzten sechs Monaten ergab sich im Eigenrhythmus ein Mittelwert von 133 ± 36ml für das linksventrikuläre enddiastolische Füllungsvolumen und 123ml 67 (Standardabweichung 33ml) unter Schrittmacherstimulation. Hinsichtlich der Ejektionsfraktion betrugen die durchschnittlichen Messwerte im Eigenrhythmus 58% (Standardabweichung 9%) und 50% (Standardabweichung 9%) während Schrittmacherstimulation. Vergleicht man diese Werte mit den Daten der Patienten, bei denen eine Stimulationshäufigkeit von über 50% in den letzten sechs Monaten vorlag, so ergeben sich für das LVEDV im Eigenrhythmus durchschnittlich Werte von 134ml (Standardabweichung 48ml) und unter Schrittmacherstimulation 127ml (Standardabweichung 47ml) (Tab. 3-6, Tab. 8). Bei der Messung der Ejektionsfraktion betrug der Mittelwert im Grundrhythmus 54% (Standardabweichung 13%) und 46% (Standardabweichung 12%) während Schrittmacherstimulation. Bei diesen Messwerten war aber keine Signifikanz erkennbar, d.h. wenngleich ein Patient im Langzeitprofil häufiger stimuliert wurde und dadurch auch bei Eigenrhythmus noch eine leichte Desynchronisation aufwies, zeigte er trotzdem keine signifikant veränderte Ejektionsfraktion und keine signifikant veränderten linksventrikulär enddiastolische Volumina (Tab. 3-6, Tab. 8). In der Analyse der Synchronität zeigte sich ein tendenzieller Unterschied zwischen Patienten mit häufiger und geringer Stimulationsrate. Dieser war besonders in der Gegenüberstellung der septalen mit den lateralen bzw. posterioren Segmenten nachweisbar. So zeigte sich bei Patienten, die im 6-Monatszeitraum häufiger als 50% stimuliert wurden und dann im Eigenrhythmus untersucht wurden eine Tmsv septal zu lateral von 68ms, wohin gegen Patienten mit einer Stimulationsrate von weniger als 50% nur 22ms aufwiesen. Im Vergleich der septalen mit den posterioren Segmenten war dies noch auffälliger (häufig stimuliert 52ms vs. 8ms bei wenig Stimulation), jedoch nicht signifikant (Tab. 3-6, Tab. 8). Dies ist durchaus Hinweis auf einen elektrischen remodelling-Effekt, der im untersuchten Patientengut über mehrere Monate nachweisbar war. 68 69 VERGLEICH PATIENTEN MIT HOHER UND GERINGER STIMULATIONSRATE (ZEITRAUM: 6 MONATE) Stimulation < 50% Stimulation > 50% MV SD MV SD bpm (ml) (%) % ms % ms % ms % ms % ms 67 133 58 25 194 36 290 28 130 3 22 1 8 12 36 9 8 67 10 83 8 58 66 134 54 28 251 34 298 16 152 8 68 22 52 11 48 13 9 9 11 99 7 58 0,723 0,986 0,376 0,606 0,316 0,71 0,911 0,346 0,74 0,286 0,23 0,214 0,213 n.s. n.s. n.s. n.s. n.s. n.s. n.s. n.s. n.s. n.s. n.s. n.s. n.s. bpm (ml) (%) % ms % ms % ms % ms % ms 79 123 50 48 373 57 459 32 245 0 -23 -5 -54 11 33 9 16 130 17 157 15 116 75 127 46 43 324 55 431 32 245 7 52 3 26 11 47 12 13 106 17 133 11 82 0,392 0,812 0,4 0,543 0,489 0,796 0,687 0,984 0,993 0,497 0,343 0,405 0,263 n.s. n.s. n.s. n.s. n.s. n.s. n.s. n.s. n.s. n.s. n.s. n.s. n.s. CUTT-OFF 50% BASELINE HF LVEDV EF Tmsv 12 Tmsv 12 Tmsv 16 Tmsv 16 Tmsv 6 Tmsv 6 Tmsv SL Tmsv SL Tmsv SP Tmsv SP p SM-STIMULATION HF LVEDV EF Tmsv 12 Tmsv 12 Tmsv 16 Tmsv 16 Tmsv 6 Tmsv 6 Tmsv SL Tmsv SL Tmsv SP Tmsv SP Tab. 8: Vergleich der Patienten mit hoher (cutt-off > 50%) und geringer Stimulationsrate über einen Zeitraum von 6 Monaten 70 5 Diskussion 5.1 Material und Methoden 5.1.1 Auswahl des Patientenkollektivs Zur klinischen dreidimensionalen echokardiographischen Untersuchung von Schrittmacherpatienten hinsichtlich Synchronität und Volumenänderung während ventrikulärer Stimulation wurden Probanden mit einem Ein- oder Zweikammerschrittmacher und einer noch vorhandenen Eigenfrequenz von ≥40 Schlägen pro Minute ausgewählt. Dies ist insofern relevant, als es bei zu geringer Herzfrequenz verstärkt zu Symptomen der Bradykardie mit Gefahr einer Synkope kommt. Von einer Bradykardie spricht man ab einer Herzfrequenz von weniger als 60 Schlägen pro Minute. Da bei gesunden Individuen und vor allem auch bei Sportlern eine Ruhefrequenz von weniger als 60 bpm physiologisch sein kann, ist eine Einteilung der Bradykardie in eine solche mit Symptomen oder ohne Symptome sinnvoll. Zu diesen zählen Schwindel, Synkopen sowie Schwäche. Ebenso kann eine ventrikuläre Extrasystolie durch eine Bradykardie hervorgerufen werden [10; 30]. Um also mögliche Komplikationen währen den Untersuchungen zu vermeiden und das Wohlbefinden der Probanden zu gewährleisten war es sinnvoll, Patienten mit noch tolerierbaren Grundfrequenzen zu rekrutieren. Damit vergleichbare Daten gewonnen werden konnten, war unabhängig von der eigenen Grundfrequenz eine Stimulationsfrequenz von 15 Schlägen über dem Eigenrhythmus programmiert worden. Es kamen Einals auch Zwei-Kammer Schrittmachersysteme der Firmen Biotronik, Medtronic und St. Jude Medical zur Anwendung. Im Hinblick auf die Untersuchungsparameter abweichenden Ergebnisse. ergaben sich hierbei keine voneinander 71 Da bei den Untersuchungen vor allem auch die Beurteilung der linksventrikulären Ejektionsfraktion eine entscheidende Rolle spielte, war es notwendig, Patienten mit normaler oder nur geringgradig eingeschränkter linksventrikulärer Pumpfunktion zu untersuchen. Nur dann ist die Volumenänderung unter Schrittmacherstimulation der Funktion des Herzschrittmachers zuzuschreiben. 5.1.2 Wahl der Real Time 3D-Echokardiographie als Untersuchungsverfahren Mittlerweile hat sich die real time 3D-Echokardiographie als Untersuchungsmethode zur Evaluation der linksventrikulären Pumpfunktion im klinischen Alltag etabliert [53]. So liefert die real time 3D- Echokardiographie genauere Werte für die linksventrikuläre Pumpfunktion als die traditionelle 2D-Echokardiographie [55]. Um eine möglichst fundierte Aussage hinsichtlich Volumenänderung und Quantifizierung der linksventrikulären Pumpfunktion während ventrikulärer Stimulation zu erhalten, war eine rea time 3D-Untersuchung zweckmäßig. Im Vergleich zu den 3D-Messungen wurden noch Untersuchungen im traditionellen 2D-Modus durchgeführt. Unsere Ergebnisse bestätigten die bisher bekannte Aussage, dass die 2D- Echokardiographie zur Bestimmung der Ejektionsfraktion zwar vergleichbare, allerdings viel ungenauere Werte liefert [1]. 5.1.3 Auswertungsverfahren Zur Auswertung der aufgezeichneten real time 3D-Sequenzen wurde das Programm QLAB® der Firma Phillips verwendet. Nach Markierung des Apex und der AV-Klappe berechnet das Programm selbst das ventrikuläre Füllungsvolumen und gibt die Grenze des Ventrikelmyokards zum intraventrikulären Blutvolumen vor. Da der automatische Modus einem relativ stringentem Algorhythmus folgt und insbesondere die geringen Abweichungen in der Synchronität des Kontrationsablaufs bei automatisierter 72 Analyse nicht adäquat erfasst wurden, musste die Endokardgrenze regelmäßig per Hand in der cardiac-3D-Quantifikation und der i-slice-Ansicht bearbeitet werden. Von großem Nachteil ist dabei, dass das Programm nur Messpunkte in einem vorgegebenen Bereich toleriert und Adaptation daher erschwert wird. 5.1.4 Veränderung der Ejektionsfraktion unter Schrittmacher-Stimulation Sowohl in der zweidimensionalen echokardiographischen Untersuchung als auch in der real time 3D-Aufzeichnung ist bei allen untersuchten Patienten eine Abnahme der Ejektionsfraktion unter Schrittmacherstimulation zu verzeichnen. In der 2D-Berechnung ist die Abnahme der EF um 8% von 58% auf 50% minimal größer als in der 3D-Messung (Abnahme um 7% von 56% auf 49%). Beide Untersuchungen zeigen eine relevante Verschlechterung der linksventrikulären Pumpfunktion unter Schrittmacherstimulation. Dieses Ergebnis ist darauf zurückzuführen, dass der physiologische Erregungsablauf und die elektromechanische Koppelung am Myokard gestört sind. Die myokardiale Kontraktion findet nicht mehr synchron statt und der Grad der Desynchronisation nimmt zu. Daraus resultiert eine Reduzierung der linksventrikulären Pumpfunktion, was wiederum eine signifikante Abnahme der Ejektionsfraktion zur Folge hat. Die Abnahme der Ejektionsfraktion ist möglicherweise auch auf das unter Schrittmacherstimulation geringere linksventrikuläre enddiastolische Füllungsvolumen zurückzuführen. Es zeigte sich sowohl in der 2D- als auch der 3D-Messung eine nicht-signifikante Abnahme des LVEDV unter Schrittmacher-Stimulation im Vergleich zum Grundrhythmus (Grundrhythmus 124 ± 52ml vs. 113 ± 45ml unter Stimulation, n.s.;). Ein tendenzieller Zusammenhang ist erkennbar. Das LVEDV steht in enger Verbindung mit einem synchronen Kontraktionsablauf am Ventrikelmyokard. Nur bei synchronen Kontraktionsabläufen ist eine maximale Dehnung des Ventrikelmyokards möglich und damit ein maximales linksventrikuläres enddiastolisches Füllungsvolumen erreichbar [5]. Sobald der Kontraktionsablauf de- 73 synchron ist, wird eine maximale Relaxation des Ventrikelmyokards nicht mehr erreicht, da sich manche Segmente im relaxierten Zustand noch nach außen, andere sich bereits kontrahierend nach innen bewegen. Eine Abnahme des LVEDV und der Ejektionsfraktion sind die Folge. Unsere Ergebnisse, die eine signifikante Abnahme der Ejektionsfraktion unter rechtsventrikulär apikaler Schrittmacherstimulation zeigten, bestätigen vorangegangene Untersuchungen anderer Autoren, die bei 2D-basierender Messung auch eine Abnahme fanden [54]. Dabei zeigte sich bei Wolber et al. eine Abnahme um durchschnittlich 6% unter Schrittmacherstimulation und ist damit mit einer bei uns gemessenen Verschlechterung um 8% bei 2D-Auswertung vergleichbar [54]. 5.1.5 Zunahme der Desynchronisation des Ventrikel- myokards unter Schrittmacherstimulation Die Untersuchungen des Erregungsablaufs während SchrittmacherStimulation in der real time 3D-Echokardiographie haben gezeigt, dass es im Vergleich zum Grundrhythmus zu einer signifikanten Abnahme des synchronen Kontraktionsablaufs kommt. So ist im Vergleich des absoluten und relativen Tmsv 12- als auch 16-Wertes eine hoch signifikante Zunahme der gemessenen Werte unter Schrittmacherstimulation zu verzeichnen (p ≤ 0,002). Am deutlichsten ist dies bei den Messungen des Tmsv 16 zu erkennen. Die Zunahme des Tmsv während Schrittmacherstimulation um 139 ± 121ms im 12-Segment-Modell und um 156 ± 185ms im 16Segment-Modell bestätigt eine zunehmende Desynchronisation der Ventrikelkontraktion unter Schrittmacherstimulation. Das ist darauf zurückzuführen, dass die physiologische Erregungsausbreitung am Ventrikelmyokard bei Schrittmacherstimulation gestört ist. Der Erregungsablauf ist verzögert und abnorm. Physiologisch hat der Sinusknoten die Schrittmacherfunktion; die Weiterleitung erfolgt über den AV-Knoten, die His-Bündel und die Tawara-Schenkel. Die Erregung breitet sich also von den Vorhöfen gleichmäßig über die Herzkammern anterograd aus. Die Sonden der Herzschrittmacher befinden sich hingegen an anderen Stellen. Klassi- 74 scherweise im rechten Vorhofohr als atriale Sondenlokalisation und im apikalen rechten Ventrikel als ventrikuläre Sondenposition. Hier wird nun das Aktionspotential generiert und setzt sich vom Kontaktpunkt der Schrittmachersonden über das Vorhof- oder Ventrikelmyokard fort. Diese unphysiologische, teils retrograde Erregungsausbreitung hat im Zuge der elektromechanischen Koppelung eine Desynchronisation der Myokardkontraktion zur Folge. Dabei zeigen sich im Vergleich der absoluten als auch der relativen Werte des Tmsv 12 mit denen des Tmsv 16 nur geringfügige Unterschiede. Die Messwerte korrelieren gut miteinander, was die Aussage zulässt, dass der Großteil Segmente einen gleichen Anteil am Ausmaß der Gesamtdesynchronisation aufweisen. Betrachtet man hingegen die absoluten und relativen Messwerte des Tmsv 6, welches nur die 6 basalen Segmente des Ventrikels beschreibt, findet man unter Schrittmacherstimulation eine relativ gesehen viel ausgeprägteres Maß von Desynchronisation (Tmsv 6 unter Eigenrhythmus bei 134 ± 58ms vs. 244 ± 103ms unter Schrittmacherstimulation, p = 0,005). Die gemessenen Werte korrelieren nicht direkt mit den Messergebnissen des Tmsv 12 und des Tmsv 16. Es ist damit fast zwingend zu vermuten, dass ein nicht unbeträchtlicher Anteil an der Desynchronisation unter Schrittmacherstimulation innerhalb der basalen Segmente abläuft und nicht ausschließlich durch die - visuell so auffällige - apikoseptale Deformierung bedingt ist. Wir postulieren daher einen großen Anteil der Schrittmacher-induzierten Desynchronität nicht nur durch eine longitudinale, sondern auch durch eine transversale Deformierung der Segmente. Weiterhin ist aber auch festzustellen, dass die 6 basalen Segmente nicht stellvertretend für alle 16 Segmente betrachtet werden können, und die Desynchronisation von apikal nach basal (lange Achse) nicht direkt mit der Desynchronisation innerhalb einer Kurzachsenebene verglichen werden kann. Eine abnormale, bzw. inverse Längenverkürzung von apikal nach basal konnte auch bei anderen Autoren in bis zu 58% aller Patienten mit rechtsventrikulärem pacing bestätigt werden [54]. Prinzipiell ist das Maß der Synchronität durch den Tmsv als alleinigen Wert limitiert. Der Tmsv misst die Synchronität des Zeitpunkts des minimalen segmentalen Volumens für definierte Segmente, d.h. sowohl die Dauer 75 der Kontraktion als auch der Beginn der Kontraktion werden nicht erfasst. Darüber hinaus werden bei einer Bildfrequenz von durchschnittlich 15Hz je nach Frequenz etwa 12-18 Einzelbilder pro Herzzyklus generiert, was im Vergleich zur konventionellen Echokardiographie wenig ist (50-70Hz, im Gewebedoppler bis 200Hz), so dass der tatsächlich minimale Volumenzeitpunkt nicht ganz genau erfasst und die Methode damit limitiert wird. 5.1.6 Vergleich der Messwerte in der 2D- und der Real Time 3D-Echokardiographie Vergleicht man die Messwerte für das linksventrikuläre enddiastolische Füllungsvolumen in den 2D-Aufzeichnungen mit denen der real time 3DAufzeichnung, so sind die Werte in der 2D-Aufzeichnung im Grundrhythmus um 6,8% geringer als in der 3D-Aufzeichnung. Unter Schrittmacherstimulation ist das LVEDV im 2D-Modus um 8,9% geringer als im 3DModus. Diese Differenz lässt sich damit begründen, dass die Bestimmung des LVEDV in der real time 3D-Messung genauer ist, da eine wesentlich größere Anzahl an Messpunkten als im Vergleich zur 2D-Messung zu Verfügung steht. In der 2D-Messung wird das LVEDV somit unterschätzt. Das Phänomen, dass dreidimensional bestimmte Volumina stets etwa größer als zweidimensional bestimmte ausfallen, wurde bereits durch mehrere Autoren bestätigt [17]. Dabei zeigte Jenkins et al. bei der dreidimensionalen Bestimmung ein durchschnittlich um 50ml höheres enddiastolisch linksventrikuläres Volumen und ist damit gut zu unseren Werten vergleichbar [15]. Analysiert man die Ejektionsfraktion im 2D- und im 3DModus, so ist nur ein geringer Unterschied zu erkennen. Im Grundrhythmus ist die Ejektionsfraktion im 3D-Modus um 3,4% geringer als im 2DModus. Unter Schrittmacher-Stimulation ist die Differenz mit einer im 3DModus um nur 2% geringeren Ejektionsfraktion als im 2D-Modus noch weniger signifikant. Die Werte korrelieren eng miteinander. 76 5.1.7 Stimulationsrate versus Synchronität Sowohl in der Analyse der Ejektionsfraktion als auch in der Analyse der Synchronität ergab sich in unserem Patientengut kein signifikanter Nachweis eine Verschlechterung bei Patienten mit erhöhter Stimulationshäufigkeit. Bei der genaueren Analyse der Tmsv SL und Tmsv SP, also dem Vergleich aller septaler mit allen lateralen bzw. posterioren Segmenten zeigt sich aber eine Tendenz bei der Patienten mit einer hohen Stimulationsrate (>50% in den letzten 6 Monaten) im Vergleich zu Patienten mit einer niedrigen Stimulationsrate auch unter Eigenrhythmus ein erhöhtes Maß an Desynchronität aufwiesen (Tmsv SL 68ms bei häufiger Schrittmacherstimulation vs. 22ms bei geringerer Stimulationshäufigkeit). Im Vergleich der septalen mit den posterioren Segmenten war diese Tendenz noch ausgeprägter (52ms vs. 8ms bei wenig Stimulation). In keinem Modell wurde allerdings eine Signifikanzniveau erreicht, wobei die Anzahl der Patienten für diese spezielle Fragestellung limitierend erscheint. Dennoch ist damit ein Hinweis auf einen elektrischen remodelling-Effekt gelungen, der in der Literatur häufig diskutiert wird [31]. Er beschreibt das Phänomen, dass sich das Herz bei langfristiger Schrittmacherstimulation an die abnorme Erregungsausbreitung anpasst und diese internalisiert, so dass auch nach Beendigung einer Schrittmachertherapie ein dauerhaft gestörter Erregungsablauf und damit gestörter Kontraktionsablauf sichtbar ist. Ob dieser Effekt und wenn ja, wie lange anhält, ist in der Literatur nicht geklärt und kann auch durch unsere Untersuchungen nicht beantwortet werden. Perspektivisch ist dieser Effekt des elektrischen remodelling aber ein interessanter Ansatzpunkt in der kardialen Resynchronisationstherapie, so dass perspektivisch nach ausreichend langer biventrikulärer Stimulation eine dauerhafte Synchronität auch nach Abschalten der Stimulation bestehen bleiben könnte. 77 6 Literaturverzeichnis [1] Abramov D, Helmke S, Rumbarger Lel-K, King DL, Maurer MS, (2010), Overestimation of left ventricular mass and misclassification of ventricular geometry in heart failure patients by two-dimensional echocardiography in comparison with three-dimensional echocardiography. Echocardiography. Mar;27(3):223-9. [2] Bartel T, Müller S. Echokardiographie Lehrbuch und Atlas, Urban und Fischer, München, 2007, S. 22. [3] Berger K. Real-time 3D-Echokardiographie des Herzens: Validierung der in vitro Volumenbestimmung, Validierung der Flächenbestimmung an künstlichen Defekten sowie Flächenbestimmung bei natürlichen Vorhofseptumdefekten, Med. Diss., Freiburg, 2004, S. 7. [4] Bom B, Lancee CR, Honkoop J, (1971), Ultrasonic viewer for cross sectional analysis of moving cardiac structures Biomed Engin. 6: 560. [5] Cai JF, Wang RX, Li XR, Dai M, Zhang CY, Liu XY, Qian DJ, (2010), Evaluation on left ventricular systolic synchronicity and cardiac function in patients with permanent cardiac pacing by real-time three-dimensional echocardiography. Zhonghua Xin Xue Guan Bing Za Zhi. Mar;38(3):215-9. 78 [6] Chiladakis JA, Koutsogiannis N, Kalogeropoulos A, Alexopoulos D, (2007), Long-term effects of atrial synchronous ventricular pacing on systolic and diastolic ventricular function in patients with normal left ventricular ejection fraction. Cardiology; 108 (4): 290-6. [7] Dhein S, Hagen A, Jozwiak J, Dietze A, Garbade J, Barten M, Kostelka M, Mohr FW, (2010), Improving cardiac gap junction communication as a new antiarrhythmic mechanism: the action of antiarrhythmic peptides. Naunyn Schmiedebergs Arch Pharmacol. Mar;381(3):221-34. Epub 2009 Nov 27. Review. [8] Edler J, Hertz CH, (2004), The use of ultrasonic reflectoscope for the continuous recording of the movements of heart walls. 1954. Clin Physiol Funct Imaging. May; 24 (3): 118-36. [9] Edler I, Lindström K, (2004), The history of echocardiography. Ultrasound Med Biol. Dec; 30 (12): 1565-644. [10] Erdmann E. Klinische Kardiologie, 7. Auflage, Springer Verlag, Köln, 2009, S.84. [11] Fananapazir L, Epstein ND, Curiel RV, Panza JA, Tripodi D, McAreavey D, (1994), Long-term results of dual-chamber (DDD) pacing in obstructive hypertrophic cardiomyopathy. Evidence for progressive sympto-matic and hemodynamic improvement and reduction of left ventricular hypertrophy. Circulation. Dec; 90 (6): 2731-42. 79 [12] Flachskampf F. Praxis der Echokardiographie, 2. Auflage, Georg Thieme Verlag Stuttgart, 2007, S.181-82 [13] Flachskampf F. Praxis der Echokardiographie, 2. Auflage, Georg Thieme Verlag Stuttgart, 2007, S.181-83 [14] Greis C, (2005), Technology overview: SonoVue. European Radiology Supplements, oct; 14 (8): 11-5. Und aus: Sono Vue® Produktinformation, Bracco International B.V., Amsterdam [15] Jenkins C, Moir S, Chan J, Rakhit D, Haluska B, Marwick TH, (2009), Left ventricular volume measurement with echocardiography: a comparison of left ventricular opacification, three-dimensional echocardiography, or both with magnetic resonance imaging. Eur Heart J. 30:98-106) [16] Kapetanakis S, Kearney MT, Siva A, Gall N, Cooklin M, Monaghan MJ, (2005), Real-time three-dimensional echocardiography: a novel technique to quantify global left ventricular mechanical dyssynchrony. Circulation. Aug 16; 112 (7): 992-1000. 80 [17] Kataoka A, Funabashi N, Takahashi A, Yajima R, Takahashi M, Uehara M, Takaoka H, Saito M, Yamaguchi C, Lee K, Nomura F, Komuro I, (2010), Quantitative evaluation of left atrial volumes and ejection fraction by 320-slice computed-tomography in comparison with three- and twodimensional echocardiography: A single-center retrospective-study in 22 subjects. Int J Cardiol. Sep 6. [Epub ahead of print] [18] Kohl P, Day K, Noble D, (1998), Cellular meachanisms of cardiac mechano-electric feedback in a mathematik model. Can. J Cardiol;14(1): 111-9. [19] Kunert M, Ulbricht LJ. Praktische Echokardiographie, 2. Auflage, Deutscher Ärzte Verlag, Köln, 2006, S. 1. [20] Kunert M, Ulbricht LJ. Praktische Echokardiographie, 2. Auflage, Deutscher Ärzte Verlag, Köln, 2006, S. 5. [21] Kunert M, Ulbricht LJ. Praktische Echokardiographie, 2. Auflage, Deutscher Ärzte Verlag, Köln, 2006, S. 6. [22] Kunert M, Ulbricht LJ. Praktische Echokardiographie, 2. Auflage, Deutscher Ärzte Verlag, Köln, 2006, S. 274 [23] Lemke B, Nowak B, Pfeiffer D, (2005), Leitlinien zur Herzschrittmachertherapie. Zeitschrift für Kardiologie, Oct; 94 (10): 704-20. 81 [24] Leondes C. Medical Imaging Systems Technology, Methods in Cardiovascular and Brain Systems, World Scientific, Singapore, 2005, S. 162. [25] Magosaki E, Schäfer D, Magosaki N, Handke M, Heinrichs G, Schöchlin A, Brinkl I, Bode C, Geibl A, (2004), Optimal number of image slices for reliable measurement of left ventrikular volumes and ejection fraction by three-dimensional transesophageal echocardiography. Journal of Medical Ultrasonics, June; 31 (2): 59-65. [26] Marsan NA, Bleeker GB, Ypenburg C, Van Bommel RJ, Ghio S, Van de Veire NR, Delgado V, Holman ER, van der Wall EE, Schalij MJ, Bax JJ, (2008), Real-time three-dimensional echocardiography as a novel approach to assess left ventricular and left atrium reverse remodeling and to predict response to cardiac resynchronization therapy Heart Rhythm. Sep; 5 (9): 1257-64. [27] Markewitz A. Deutsches Herzschrittmacher Register (www.pacemaker- register.de), Deutsche Gesellschaft für Kardiologie, Herz-und Kreislaufforschung, Jahresbericht 2006, S. 2-13. [28] Monaghan M, Bax J, Franke A, Kamp O, Kuehl H, Nihoyannopoulos P, Tencate F, (2009), 3-dimensional echocardiographic assessment of left ventricular dyssynchrony: an alternative viewpoint. JACC Cardiovasc Imaging. Nov;2 (11):1334-5; author reply 1335-6. 82 [29] Nixdorff U, (2009), The inaugurator of transmitted echocardiography: Prof. Dr WolfDieter Keidel. Eur J Echocardiogr. Jan; 10 (1): 48-9. [30] Orso F, Baldasseroni S, Maggioni AP, (2009), Heart Rate in Coronary Syndromes and Heart Failure. Prog Cardiovasc Dis., Jul-Aug; 52 (1): 38-45. [31] Paslawska U, Gajek J, Kiczak L, Noszczyk-Nowak A, Skrzypczak P, Bania J, Tomaszek A, Zacharski M, Sambor I, Dziegiel P, Zysko D, Banasiak W, Jankowska EA, Ponikowski P, (2010), Development of porcine model of chronic tachycardia-induced cardiomyopathy. Int J Cardiol. Sep 28. [32] Porciani MC, Rao CM, Mochi M, Cappelli F, Bongiorno G, Perini AP, Lilli A, Ricciardi G, Hashtroudi L, Silvestri P, Barold SS, Padeletti L, (2008), A real-time three-dimensional echocardiographic validation of an intracardiac electrogram-based method for optimizing cardiac resynchronization therapy Pacing Clin Electrophysiol. Jan; 31 (1): 56-63. [33] Philips Produktinformation Sonos 7500, (2004), Aus: Philips Sonos 7500 – Philips Echokardiographie System, technische Daten, S. 1-10. [34] Philips Produktinformation QLAB®, (2004-2009), Aus: Produktinformation QLAB®, www.healthcare.philips.com/main/products/ultrasound/technologies/ qlab/cardiac. 83 [35] von Ramm OT, Smith SW, Pavy HR, (1991), High-speed ultrasound volumetric imaging system. II. Parallel processing and image display. IEEE Trans Ultrason Ferroelectr Freq Control, 38 (2): 100-8. [36] von Ramm OT, Smith SW, Pavy HR, (1991), High-speed ultrasound volumetric imaging system. II. Parallel processing and image display. IEEE Trans Ultrason Ferroelectr Freq Control, 38 (2): 109-15. [37] Saad EB. Marrouche NF, Martin DO, Cole CR, Dresing TJ, Perez-Lugones A, Saliba W, Schweikert RA, Wilkoff BL, Tchou P, Natale A, (2002), Frequency and associations of symptomatic deterioration after dualchamber defibrillator implantation in patients with ischemic or idiopathic dilated cardiomyopathy. Am J Cardiol. Jul 1; 90 (1): 79-82. [38] Sadoul N, Simon JP, de Chillou C, Dodinot B, Aliot E, Slade AK, Saumarez RC, Prasad K, Camm AJ, (1995), Dual chamber pacemaker therapy in obstructive hypertrophic cardiomyopathy. Circulation, Aug 15; 92 (4): 1062-4. [39] Schaer B, Sticherling C, Osswald S, (2004), Indikationen für ein permanentes, kardiales Pacing. Schweiz Med Forum, (4): 1133-37. [40] Schmidt G, Görg C. Ultraschall Kursbuch. Nach den Richtlinien der DEGUM und der KBV, 4. Auflage, Thieme Verlag, Stuttgart, 2003, S. 13-9. 84 [41] Schmidt R, Thews G, Lang F. Physiologie des Menschen, 28. Auflage, Springer, Berlin, Heidelberg, New York, 2000, S. 472-78. [42] Schmidt R, Thews G, Lang F. Physiologie des Menschen, 28. Auflage, Springer, Berlin, Heidelberg, New York, 2000, S. 479-81. [43] Schmidt R. Physiologie Kompakt, 4. Auflage, Springer, Berlin, Heidelberg, New York, 2001, S. 14. [44] Schmidt R. Physiologie Kompakt, 4. Auflage, Springer, Berlin, Heidelberg, New York, 2001, S. 189-200. [45] Silbernagel S, Despopoulos A. Taschenatlas der Physiologie, 5. Auflage, Thieme, Stuttgart, New York, 2001, S. 68. [46] Silbernagel S, Despopoulos A. Taschenatlas der Physiologie, 5. Auflage, Thieme, Stuttgart, New York, 2001, S. 192-95. [47] Smith SW, Lopath PD, Adams DB, Walcott GP, (1995), Cardiac ultrasound phantom using a porcine heart model, Ultrasound Med Biol.; 21 (5): 693-7. [48] Spirito P, McKenna WJ, Schultheiss HP, (1995), DDD pacing in obstructive HCM. Circulation, Sep 15; 92 (6): 1670-3. 85 [49] Taggart P, Lab M, (2008), Cardiac mechano-electric feedback and electrical restitution in humans. Prog Biophys Mol Biol. Jun-Jul;97(2-3):452-60. Epub 2008 Feb 16. [50] Tantengco MV, Thomas RL, Karpawich PP, (2001), Left ventricular dysfunction after long-term right ventricular apical pacing in the young J Am Coll Cardiol. Jun 15; 37 (8): 2093-100. [51] Tobias R, Skrodzki M, Schneider M. Kleintierkardiologie kompakt, Schlütersche, Hannover, 2008, S. 106. [52] Varnero S, Santagata P, Pratali L, Basso M, Gandolfo A, Bellotti P, (2008), Head to head comparison of 2D vs real time 3D dipyridamole stress echocardiography Cardiovasc Ultrasound, Jun 20; 6:31. [53] Wilkoff BL, Cook JR, Epstein AE, Greene HL, Hallstrom AP, Hsia H, Kutalek SP, Sharma A, (2002), Dual-chamber pacing or ventricular backup pacing in patients with an implantable defibrillator: the Dual Chamber and VVI Implantable Defibrillator (DAVID) Trial. Dual Chamber and VVI Implantable Defibrillator Trial Investigators JAMA Dec 25; 288 (24): 3115-23. 86 [54] Wolber T, Haegeli L, Huerlimann D, Brunckhorst C, Lüscher TF, Duru F, (2010), Altered Left Ventricular Contraction Pattern during Right Ventricular Pacing: Assessment Using Real-Time Three-Dimensional Echocardiography. Pacing Clin Electrophysiol. 2010 Oct 14. [55] Yang NI, Wang CH. Hung MJ, Chen YC, Wu IW, Lee CC, Wu MS, Kuo LT, Cheng CW, Cherng WJ, (2010), Real-time three-dimensional echocardiography provides advanced haemodynamic information associated with intra-dialytic hypotension in patients with autonomic dysfunction. Nephrol Dial Transplant. Jan;25(1):249-54. Epub 2009 Aug 8. 87 7 Abkürzungsverzeichnis ACE angiotensin converting enzyme AV aortic valve (= Aortenklappe) AV-Knoten atrioventrikular-Knoten A-Mode Amplitudenmodulations-Mode AHA American Heart Assoziation A Atrium AP Aktionspotential BMI body mass index B-Mode brightness-mode bpm beats per minute β-Blocker Beta-Blocker cm Zentimeter cw-Doppler continous-wave Doppler DSR Digital Satellite Radio EF Ejektionsfraktion EKG Elektrokardiogramm ESV Endsystolisches Volumen GR Grundrhythmus HF Herzfrequenz HOCM hypertrophisch obstruktive Kardiomyopathie HNOCM hypertrophisch nicht obstructive Kardiomyopathie IMC Intermediate Care Unit KHK Koronare Herzkrankheit LA linker Vorhof LV linker Ventrikel LVEDV links ventrikuläres enddiastolisches Volumen LV-Funktion linksventrikuläre Funktion 88 MHz Megahertz MI Mitralinsuffizienz Mid middle min Minute MK Mitralklappe ml Mililiter mm Milimeter M-Mode motion-mode mo Monate MV mitral valve MW Mittelwert µm Mikrometer n Anzahl ns nicht signifikant NBG NASPE/BPEG Generic Code NYHA New York Heart Association p statistische Signifikanz pw-Doppler puls-wave Doppler RA rechter Vorhof RR Blutdruck RT real time RV rechter Ventrikel s Sekunde s-l septale Segmente s-p posteriore Segmente SA Standardabweichung SAS Subakutstation SM Schrittmacher SSS Sick Sinus Syndrom SV Schlagvolumen Tmsv time to minimal systolic volume TMQ tissue motion Quantifikation vs versus VTI velocity time integral 89 ZNA Zentrale Notaufnahme 2D zweidimensional 3D dreidimensional % Prozent ° Grad > größer als < kleiner als 90 8 Danksagung Mein ganz besonderer Dank gilt Herrn Dr. med. Gerald Wasmeier für die Überlassung des Themas, die freundliche und großzügige Unterstützung der Arbeit sowie die Hilfe bei den Patientenuntersuchungen. Sehr herzlich möchte ich mich bei allen Patientinnen und Patienten bedanken, die sich für die Untersuchungen zur Verfügung gestellt haben, ohne die diese Arbeit nicht möglich geworden wäre. Allen Mitarbeiterinnen und Mitarbeitern der Echoabteilung der Medizinischen Klinik 2 der Friedrich-Alexander-Universität Erlangen-Nürnberg sowie den immer hilfsbereiten Mitarbeiterinnen des Archivs sei an dieser Stelle gedankt.