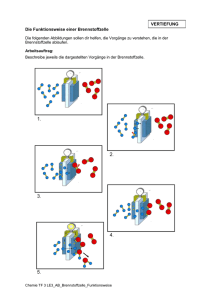
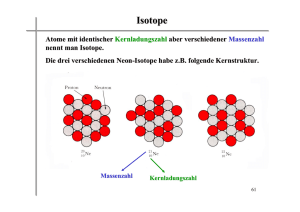
Die Bindungen zwischen Atomen in ausgewählten Elementen
Werbung

Name: ________________ Klasse: ________________ Die Bindungen zwischen Atomen in ausgewählten Elementen Eine Unterrichtsreihe zum eigenverantwortlichen Arbeiten Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen Einleitung Wieso gibt es Wasserstoff-Moleküle? Wie leiten Metalle elektrischen Strom? Warum sind Diamanten so hart? Weshalb ist Stickstoff so reaktionsträge? Du kennst viele chemische Elemente und den Aufbau der Atome, aus denen sie bestehen. Um ihre Eigenschaften erklären zu können, muss man wissen, wie die Atome in den elementaren Stoffen zusammenhalten. Dies wirst du in den folgenden Stationen kennen lernen. Station Inhalt Offene Fragen 1. Grundlagen - chemische Elemente 2. Wasserstoff I - mit Wasserstoff schweißen? 3. Wasserstoff II - vom Atom zum Molekül 4. Stickstoff - Hauptbestandteil der Luft 5. Kohlenstoff - in seiner schönsten Form 6. Metalle - elektr. Leitfähigkeit 7. Zusammenfassung - was ich gelernt habe Arbeitsauftrag: 1. Arbeite mit deiner Gruppe. 2. Nehmt euch eine Station mit Materialen und den jeweiligen Arbeitsblättern (Nummer 1 sollte die erste, Nummer 7 die letzte Station sein). Diskutiert die Fragen und Aufgaben auf den Arbeitsblättern, führt die Arbeitsaufträge durch und dokumentiert eure Ergebnisse und Antworten ausführlich. 3. Experimentiert sorgfältig und umsichtig! Tragt eine Schutzbrille! 4. Ergänze in der Tabelle (s.o.) den Inhalt der Station und noch offene Fragen. 5. Stellt die Materialien zurück, vermerkt es auf dem Plakat und wechselt zur nächsten Station. 6. Wenn alle Stationen bearbeitet sind, werdet ihr eine Station präsentieren (Losverfahren). Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen 1. Grundlagen – chemische Elemente Mit den folgenden Stationen wirst du verstehen lernen, wie man Eigenschaften von chemischen Elementen aufgrund der Bindungen zwischen den Atomen erklären kann. Dafür ist es notwendig, einen Überblick über die wichtigsten Eigenschaften ausgewählter Elemente zu haben und jeweils den Aufbau der Atome in diesen Elementen zu kennen. I. Bist du fit? Schätze dich ein: kann ich gut kann ich teilweise ich bin unsicher ich habe Probleme a) Ich kann die Aufbauprinzipien des Periodensystems der Elemente beschreiben, das PSE als Ordnungs- und Klassifikationsschema nutzen, Haupt- und Nebengruppen unterscheiden. b) Ich kann Protonen, Neutronen, Elektronen als Bausteine von Atomen nennen und ihre charakteristischen Eigenschaften angeben. c) Ich kann Atome mithilfe eines differenzierten Kern-Hülle-Modells beschreiben. d) Ich kann chemische Reaktionen energetisch differenziert beschreiben, z.B. mithilfe eines Energiediagramms. e) Ich kann Reaktionen zum Nachweis chemischer Stoffe einsetzen (Knallgasprobe, Kalkwasserprobe, Wassernachweis, Glimmspanprobe) II. Prüfe: a) Was ist ein chemisches Element? b) Beschreibe die folgenden Stoffe mit ihren typischen Eigenschaften. Erstellt in eurer Gruppe zu den Elementen jeweils Steckbriefe mit den Stoffeigenschaften, ergänzt mit einem kleinen Bild. Nichtmetalle: Wasserstoff Sauerstoff Stickstoff Chlor Kohlenstoff/Diamant Metalle: Magnesium Kupfer Edelgas: Neon c) Beschreibe den Bau von Atomen nach dem Bohr´schen Atommodell jeweils am Beispiel der oben angegebenen Elemente und beschreibe die Position des Atoms im PSE. Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen 2. Wasserstoff I – mit Wasserstoff schweißen? Wasserstoff-Gas besteht aus zweiatomigen Wasserstoff-Molekülen H2 . Warum sind es nicht einzelne Wasserstoff-Atome H ? Notiere deine Vermutungen: ___________________________________________ _________________________________________________________________ _________________________________________________________________ Versuch: Wasserstoff und Wasserstoff im Entstehen - gibt es Unterschiede? Versuchsaufbau: Geräte und Chemikalien: Schutzbrille ! 2 Reagenzgläser, 2 Reagenzgläser mit seitlichem Ansatz, Gummistopfen, 2 Glasrohre, 2 kurze Gummischläuche, Spatel, Pipette Eisenpulver (F, R 11), Salzsäure 10% (Xi, R36/37/38, S 1/2 -26-45), stark verd. Methylenblau-Lösung Versuchsdurchführung: (nach C.C. Buchner, Stoff, Formel, Umwelt, Chemie 1, 2006) V1 Gib in ein Rggl. eine Spatelspitze Eisenpulver und ca. 3 ml Salzsäure. Leite das Gas mit einem Röhrchen in Methylenblau-Lösung ein. V2 Gib in ein Rggl. eine Spatelspitze Eisenpulver und ca. 3 ml Salzsäure. Füge, sobald die Reaktion einsetzt, ca. 1,5 ml Methylenblau-Lösung hinzu. V3 Vereinige in einem Rggl. ca. 3 ml Salzsäure mit ca. 1,5 ml Methylenblau-Lösung. Entsorgung: Die Lösungen werden in einem Becherglas gesammelt, die Reagenzgläser mit Wasser gespült. Aufgaben: 1. Skizziere jeweils den Aufbau, führe die Versuche durch und notiere deine Beobachtungen: V1: V2: V3: 2. Bei der Reaktion von Salzsäure mit Eisen entsteht das Gas Wasserstoff. Welche Beobachtungen deuten darauf hin und wie kann man dieses Produkt eindeutig nachweisen? Beschreibe eine entsprechende Versuchsdurchführung. Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen 3. Der Farbstoff Methylenblau MB (MB ist eine Abkürzung) wird entfärbt, wenn jedes MethylenblauMolekül mit zwei Wasserstoff-Atomen reagiert und sich in Leuko-Methylenblau MBH2 umwandelt. Nutze diese Informationen um die Versuchsbeobachtungen zu erklären. V1: V2: V3: 4. Welche Schlussfolgerungen kannst du aufgrund der Versuche über die Existenz und über die Reaktivität von Wasserstoff-Atomen im Vergleich zu Wasserstoff-Molekülen ziehen? 5. In der Abbildung sind die relativen Energien von Wasserstoff-Atomen und E Wasserstoff-Atome Wasserstoff-Molekülen dargestellt. Erläutere das Diagramm und erkläre damit die Reaktion von Wasserstoff mit Methylenblau. Wasserstoff-Moleküle 6. Die Energie, die bei der Reaktion von Wasserstoff-Atomen zu Wasserstoff-Molekülen entsteht, kann man nutzen. Durch geschickte Versuchsbedingungen können sehr hohe Temperaturen erzeugt werden, die man zum Schweißen dünner Metallbleche nutzen kann. Irving Langmuir entwickelte hierzu die sog. Langmuir-Fackel, Erkundige dich und stelle in einem kurzen Zeitungsartikel die Langmuir-Fackel einer großen Leserschaft vor. Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen 3. Wasserstoff II – vom Atom zum Molekül Bei Raumtemperatur sind im Wasserstoff-Gas nur Wasserstoff-Moleküle H2 vorhanden. Wie kann man sich im Atom-Modell die Bildung von Wasserstoff-Molekülen aus Wasserstoff-Atomen vorstellen? Hast du eine Idee? Notiere /skizziere: Modell-Versuch: Aus zwei Wasserstoff-Atomen entsteht ein Wasserstoff-Molekül Versuchsaufbau: Geräte 2 Overhead-Projektoren, 2 DIN A3-Bögen mit größerem Loch, 2 Papier-Modelle in Form eines Kreuzes, 2 Papier-Modelle in Form einer Ellipse Versuchsdurchführung: 1. Erzeuge mit Hilfe der DIN A3-Bögen auf den zwei Overhead-Projektoren zwei getrennte, etwa gleich große Lichtkegel an der Wand. 2. Platziere die kleinen Papier-Modelle so auf den Overhead-Projektoren, dass jeweils die Kreuzform in der Mitte des Lochs, die Ellipse im Umkreis liegen. 3. Erkläre, was im Licht- und Schattenspiel an der Wand den Atomkern, die Elektronenhülle und das Elektron eines Wasserstoff-Atoms symbolisiert. 4. Bewege die Overhead-Projektoren so, dass sich die beiden Lichtkegel langsam einander nähern. Überlegt gemeinsam, wie sich jeweils die Elektronen verhalten und wo sie sich aufhalten könnten. Die Lage der beiden Atomkerne, also die Lage der beiden Protonen, soll dabei unverändert in der Mitte bleiben. 5. Wähle den günstigsten Abstand. Aufgaben: 1. Führt den Modell-Versuch gemeinsam durch. Ergänze die folgenden Skizzen und notiere eure Überlegungen zum Aufenthaltsort der Elektronen. Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen Skizze Aufenthaltsort der Elektronen, Begründung Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen 2. Gib eine begründete Vermutung zum günstigsten Abstand zweier Wasserstoff-Atome im WasserstoffMolekül. 3. Schneide die Beschreibungen (s.u.) aus, klebe sie im folgenden Raster in eine sinnvolle Reihenfolge und skizziere jeweils die Lage der Wasserstoff-Atome mit ihrem Proton und Elektron. Aus zwei Wasserstoff-Atomen entsteht ein Wasserstoff-Molekül Beschreibung Skizze Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen 4. Welche Informationen enthalten die verschiedenen Formel-Schreibweisen für das WasserstoffMolekül? Molekülformel H2 Elektronenpunktformel H:H Valenzstrichformel H−H 5. Beurteile die Anwendbarkeit des Modells der zwei OHP-Lichtkegel. Wo liegen Vor- und Nachteile? Zu Aufgabe 3: Die Atome sind näher beieinander. Die Elektronen werden von beiden Protonen angezogen. Die Anziehung der Elektronen durch beide Protonen und die Abstoßung beider Protonen bilden einen Gleichgewichtszustand. Die Atome nähern sich. Ein Elektron wird etwas vom Proton des anderen Atomkerns angezogen. Die Wasserstoff-Atome haben einen großen Abstand zueinander. Die Elektronen halten sich in der Atom-Hülle auf. Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen 4. Stickstoff – Hauptbestandteil der Luft Die Luft enthält zu 78% Stickstoff. Menschen und Tiere atmen ihn ein und wieder aus, ohne dass Stickstoff eine Reaktion auslöst. Nur wenige Bakterien können Stickstoff umsetzen. Um den Stickstoff aus der Luft z.B. mit Wasserstoff zu einer Reaktion zu bringen, benötigt man sehr hohe Temperaturen und einen hohen Druck, also sehr viel Energie. Warum ist Stickstoff so reaktionsträge? Information: Elektronenpaarbindung Ein Wasserstoff-Atom besitzt ein Elektron. Im Wasserstoff-Molekül hat jedes Wasserstoff-Atom zwei Elektronen Wasserstoff-Atom hat damit im in seiner Elektronenhülle. Wasserstoff-Molekül die Jedes gleiche Elektronenanzahl und –anordnung wie ein Helium-Atom. Ein Chlor-Atom besitzt sieben Elektronen auf der Außenschale. Im ChlorMolekül gehören zwei Elektronen beiden Atomen an. So erhält jedes ChlorAtom acht Elektronen auf der äußeren Schale und hat damit die gleiche Elektronenanzahl und -anordnung wie ein Argon-Atom. Ein Sauerstoff-Atom besitzt sechs Elektronen auf der Außenschale. Im Sauerstoff-Molekül gehören vier Elektronen beiden Atomen an, so dass jedes Sauerstoff-Atom acht Elektronen auf der äußeren Schale hat. Damit hat im Sauerstoff-Molekül jedes Sauerstoff-Atom die gleiche Elektronenanzahl und – anordnung wie ein Neon-Atom. Merksatz: Wenn Atome zu Molekülen reagieren, erreichen sie dieselbe Elektronenanzahl und anordnung wie ein Edelgas-Atom (Edelgaskonfiguration). Diesen Satz nennt man auch Edelgasregel. Die Elektronenpaare, die zu beiden Atomen gehören, nennt man gemeinsame oder bindende Elektronenpaare. Wasserstoff- und Chlor-Moleküle besitzen ein gemeinsames Elektronenpaar, dies nennt man eine Einfachbindung. Sauerstoff-Moleküle besitzen eine Doppelbindung, weil sie zwei gemeinsame Elektronenpaare haben. Es gibt auch Dreifachbindungen zwischen Atomen. Elektronenpaare, die nur einem der beiden Atome angehören nennt man freie oder nichtbindende Elektronenpaare. Elektronenpaare kann man zur Vereinfachung auch durch einen Strich darstellen. Wenn dieser Strich zwischen den Atomsymbolen steht, kennzeichnet er das bindende Elektronenpaar. Valenzstrichformel / Strukturformel: H−H O=O Wasserstoff Sauerstoff Cl − Cl Chlor Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen Aufgaben: 1. Die Atome erreichen im Molekül die Elektronenkonfiguration eines Edelgases. Nenne jeweils das Edelgas, dessen Elektronenkonfiguration die Wasserstoff-Atome, die Chlor-Atome und die SauerstoffAtome erreichen: 2. Wieso besteht im Chlor-Molekül eine Einfach-Bindung zwischen den Atomen, im Sauerstoff-Molekül hingegen eine Doppel-Bindung? 3. Was symbolisieren die Buchstaben H, Cl und O in den Stickstoff-Molekül (N2) vorstellen? Zeichnungen und in der Valenzstrichformel/Strukturformel? 4. Wie kann man sich das Zeichne die entsprechende Valenzstrichformel / Strukturformel und überprüfe ggfs. in deinem Chemie-Buch. 5. Erstelle mit dem Molekülbaukasten jeweils ein Wasserstoff-Molekül, ein Chlor-Molekül, ein SauerstoffMolekül und ein Stickstoff-Molekül. Beachte dabei nur die Elektronenpaare, die an der Bindung beteiligt sind. Zeichne eure Modelle: Wasserstoff Sauerstoff Chlor Stickstoff Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen 6. Erhitzt man die Gase sehr stark, zerfällt ein Teil der Moleküle in ihre Atome. Bei 777°C sind 1% der Chlor-Moleküle in Atome zerfallen. Aber 1% der Stickstoff-Moleküle sind erst bei 2677°C in Atome zerfallen. Wie kann man das erklären? 7. Warum ist Stickstoff ein reaktionsträger Stoff? 8. Zusatzaufgabe: Kohlenstoffdioxid ( CO2 ) ist auch in der Luft enthalten. Welchen prozentualen Anteil vermutest du? Wie könnte die Strukturformel eines Kohlenstoffdioxid-Moleküls aussehen? Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen 5. Kohlenstoff – in seiner schönsten Form Reiner Kohlenstoff kann in verschiedenen Formen (Modifikationen) vorkommen, eine sehr kostbare ist Diamant. Diamant ist auch das härteste Mineral. Warum ist es so stabil? Wieso ist man erstaunt, dass Diamant aus Kohlenstoff besteht? __________________________________________________________________ __________________________________________________________________ __________________________________________________________________ Versuchsplanung: Bestehen Diamanten wirklich nur aus Kohlenstoff? Versuchsaufbau: Geräte und Chemikalien Diamanten, Aufgaben: 1. Plane einen Versuch, mit dessen Hilfe du zeigen kannst, dass Diamanten nur aus Kohlenstoff bestehen. Skizziere den Versuchsaufbau im Kasten und begründe deinen Vorschlag. 2. Recherchiere und vergleiche Deinen Vorschlag mit dem Vorgehen von Antoine Laurent Lavoisier im 18. Jahrhundert. Notiere Gemeinsamkeiten und Unterschiede. Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen 3. Wie sind die Kohlenstoff-Atome im Diamant miteinander verbunden? Zeichne die Valenzstrichformel / Strukturformel. Erkläre, warum jedes Kohlenstoff-Atom mit jeweils vier weiteren Kohlenstoff-Atomen verbunden ist. 4. Erstelle mit Hilfe des Molekülbaukastens ein dreidimensionales Modell von Diamant. Überlege dir Gründe, warum die vier Kohlenstoff-Atome immer in Form eines Tetraeders um das zentrale Kohlenstoff-Atom angeordnet sind. Notiere die Gründe. 5. Ergänze: Ein Diamant besteht ausschließlich aus ______________-Atomen. Jedes Kohlenstoff-_____________ ist dabei von ____ anderen Kohlenstoff-_____________ umgeben. Da jedes Kohlenstoff-Atom _____ Elektronen auf der ____________ Schale hat, können von jedem Atom ____ gleiche Einfachbindungen ausgehen. Um zwischen den Elektronenpaaren der Bindung einen größtmöglichen Abstand zueinander zu haben, sind diese _________bindungen jeweils tetraedrisch angeordnet. Daraus ergibt sich ein sehr ___________ Gitter. Die Bindungswinkel betragen ________. Die Härte des __________________ beruht darauf, dass alle Außenelektronen eines Kohlenstoff-Atoms durch Elektronenpaarbindungen / Atombindungen miteinander verbunden sind. 6. Ein Werbeslogan sagt „Ein Diamant ist unvergänglich“. Was meinst Du hinsichtlich der fachlichen Richtigkeit? 7. Diamanten können künstlich hergestellt werden. Informiere dich und erkläre das Verfahren. 8. Zusatzaufgabe: Informiere dich über weitere Kohlenstoff-Modifikationen: a) Graphit, b) Fullerene. Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen 6. Metalle – elektrische Leitfähigkeit Stromkabel bestehen aus Metallen. Warum? Wie funktioniert die Stromleitung? Versuch: Die elektr. Leitfähigkeit verschiedener Materialien Geräte und Chemikalien: Batterien, Stromkabel, Klemmen, Glühlampe, Motor, Messgerät, Schutzbrille Kupfer-Blech, Magnesium-Band (F, R:11-15, S: 2-7/8-43), Kunststoffprobe Versuchsplanung: Überlege eine Apparatur zur Messung der elektrischen Leitfähigkeit verschiedener Materialien. Skizziere! Versuchsdurchführung: Bau deine Apparatur zur Messung der elektrischen Leitfähigkeit verschiedener Stoffe auf und untersuche die vorliegenden Stoffe auf ihre Leitfähigkeit. Entsorgung: Räume alles wieder in den Korb zurück. Aufgaben: 1. Plane den Versuch mit einer Skizze im Kasten, führe ihn durch und notiere deine Beobachtungen. 2. Wenn Strom fließt, bewegen sich Elektronen. Zeichne in deiner Versuchs-Skizze einen Weg der Elektronen und beschreibe ihn. Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen 3. Wie könnte man den Stromfluss z. B. im Magnesium-Band erklären? Was vermutest du? 4. Erkundige dich nach dem Modell der elektrischen Leitfähigkeit von Metallen in deinem Chemie-Buch und im Internet unter www.ltam.lu/chimie/Metallbindung.html und www.chemie-interaktiv.net „Die Metallbindung“. Erkläre die Stromleitung im Magnesium-Band! Zeichne eine ausführliche Modell-Vorstellung mithilfe deiner Informationen. Erkläre, warum im Magnesium Magnesium-Atome jeweils zwei Elektronen abgeben und zu positiv geladenen „Atomrümpfen“ werden. 5. Beurteile die Informationen zur elektrischen Leitfähigkeit kritisch. 6. Warum bestehen Stromkabel aus Metallen wie z.B. Kupfer? Wie funktioniert das? Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen 7. Zusammenfassung – was ich gelernt habe I. Bist du fit? Schätze dich ein: kann ich gut kann ich teilweise ich bin unsicher ich habe Probleme a) Ich kann chemische Bindungen in einigen Elementen zwischen den Atomen (Metallbindung, Elektronenpaarbindung) mithilfe geeigneter Modelle erklären. b) Ich kann den Zusammenhang zwischen Stoffeigenschaften und Bindungsverhältnissen bei chemischen Elementen erklären. II. Bist du fit? Strukturiere dein neu erworbenes Wissen. Strukturiere die Inhalte der einzelnen Stationen: Schneide dazu untenstehende Begriffe aus und ordne sie sinnvoll in einem Begriffsnetz auf ein DINA3 Blatt an. Ergänze gegebenenfalls offensichtliche Lücken und beschrifte die Verbindungslinien sinnvoll. (Begriffe können mehrfach verwendet werden) Chem. Element PSE Nichtmetall Metall Edelgas Stoff-TeilchenBeziehung StrukturEigenschaftsBeziehung Struktur der Materie gasförmig fest Energie Atom Molekül bindendes Elektronen-paar nichtbindendes Elektronenpaar Einfachbindung Doppelbindung Dreifachbindung Tetraeder AußenElektronen Atomrümpfe Elektronenkonfiguration reaktionsträge hart elektr. Leitfähigkeit gemeinsames Elektronenpaar reaktiv Elektronen Protonen Neutronen Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen III. Prüfe: 1. Beschreibe modellhaft den submikroskopischen Bau folgender Stoffe. Besprich anschließend mit deinem Nachbarn/deiner Nachbarin. a) Wasserstoff b) Stickstoff c) Kohlenstoff/Diamant d) Magnesium e) Fluor f) Natrium 2. Erstelle eine Tabelle: Die chemischen Elemente gliedern sich in drei große Gruppen, den Metallen, z.B. Aluminium, den Nichtmetallen, z. B. Brom, und den Edelgasen, z.B. Argon. Nenne typische Eigenschaften der elementaren Stoffe und erkläre die Struktur und den Zusammenhalt der Atome. 3. Erkläre (schriftlich): a) Warum besteht Wasserstoff-Gas aus zweiatomigen Wasserstoff-Molekülen H2 ? b) Wie kann man sich im Atom-Modell die Bildung von Wasserstoff-Molekülen aus WasserstoffAtomen vorstellen? Name: ___________________ Die Bindungen zwischen Atomen in ausgewählten Elementen c) Warum ist Stickstoff so reaktionsträge? d) Diamant ist das härteste Mineral. Warum ist es so stabil? e) Stromkabel bestehen aus Metallen. Warum? Wie funktioniert die Stromleitung? 4. Eine Anzeige für ein neues Deo, speziell für Männer, warb mit folgendem Slogan: „Action im Blut, Silber im Deo. Antibakterielle Silbermoleküle: - keine Bakterien – kein Körpergeruch - 24h Antitranspirant-Schutz“. Was meinst du hinsichtlich der fachlichen Richtigkeit?