Cholinerges System - alexander
Werbung

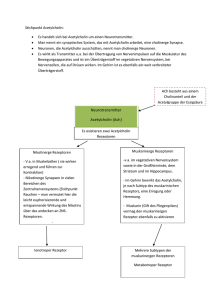
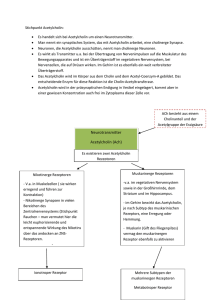
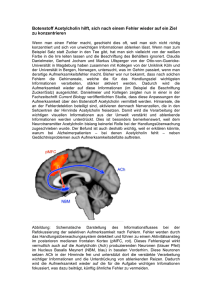
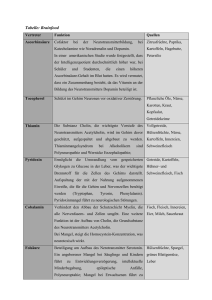
Pharmakologie und Toxikologie Cholinerges System M und N-Cholinozeptoren M- Acetylcholin als Transmitter Acetylcholin ist einer der wichtigsten Neurotransmitter des Menschen. Die quartäre Ammoniumverbindung (Abb. 1) wird durch das Enzym Cholinacetyltransferase aus dem Aminoalkohol Cholin und dem Acetyl-CoA CoA im Cytosol der Nervenendigungen gebildet und anschließend über einen Protonen/Acetylcholin-Antiporter Protonen/Acetylcholin in neurosekretorische Speichervesikel aufgenommen. Durch das Enzym Acetylcholinesterase kann extrazelluläres Acetylcholin nach Freisetzung in den synaptischen Spalt S und Abb.1: Strukturformel Acetylcholin Rezeptorbindung hydrolytisch in einen Acetyl-Rest Acetyl und Cholin gespalten werden. Cholin + wird über einen Na /Cholin-Kotransporter Kotransporter in die präsynaptische Endigung aufgenommen und zur Neusynthese von Acetylcholin wiederverwendet. Die Wiederaufnahme von Cholin aus dem Extrazellularraum ins Axoninnere kann durch Hemicholinium-3 gehemmt werden. Acetylcholin ist der Transmitter aller präganglionären Neurone des Sympathikus und Parasympathikus sowie der postganglionär-parasympathischen Neurone des Vegetativums. Cholinerg sind außerdem zahlreiche Neurone des enterischen Nervensystems und die sympathische Innervation der Schweißdrüsen, während alle anderen postganglionären Neurone des Sympathikus Noradrenalin als Transmittersubstanz verwenden. Die Zellen des Nebennierenmarks Nebennierenmarks werden direkt von präganglionären Neuronen versorgt und somit cholinerg innerviert. Auch die Erregungsübertragung Erregungsübertragung an den neuromuskulären Endplatten wird von Acetylcholin vermittelt. Zwei weitere zentrale cholinerge Systeme sind das Corpus striatum s mit cholinergen Interneuronen, welche normalerweise durch nigro-striatale nigro striatale Dopaminneurone gehemmt werden, und cholinerge Fasersysteme, die vom Nucleus basalis Meynert zur Großhirnrinde und von der Formatio septalis medialis zum Hippocampus ziehen und un an Lernen und Gedächtnis Beteiligung finden. Nicotinischer Acetylcholinrezeptor Abb.2: Aufbau des nikotinischen Acetylcholinrezeptors Seit 1914 unterscheidet man zwei Gruppen von Cholinozeptoren, die nach ihren selektiven Agonisten benannt werden: Nicotinrezeptoren (Nicotin als Alkaloid der Tabakpflanze Nicotiana tabacum) und Muscarinrezeptoren (Muscarin als Gift in Pilzen der Gattung Inocybe). Nikotinische Acetylcholinrezeptoren sind membranständige Rezeptoren mit Ionenkanalfunktion in Skelettmuskel- und Nervenzellen und werden zu den ionotropen Rezeptoren (= ligandengesteuerte Ionenkanäle) gezählt, welche in drei Klassen eingeteilt sind: sin • pentamere Rezeptoren der nikotinischen Acetylcholin-Rezeptor Acetylcholin Rezeptor-Superfamilie • tetramere ionotrope Glutamatrezeptoren • trimere ATP-Rezeptoren ATP der P2X-Familie Für die Nicotinrezeptoren können folgende Strukturmerkmale Strukturmerkmale (Abb. 2) beschrieben werden: • Pentamere mit fünf Proteinuntereinheiten: Proteinuntereinheiten: für den Muskeltyp (α1)2β1δε (Hinweis: fetale Nikotinrezeptoren enthalten anstelle der ε-Untereinheit heit die γ-Untereinheit) und für den Neuronentyp (α4) ( 2 (β2)3 • jede dieser dieser Untereinheiten besteht aus einem integralen Membranprotein mit vier Transmembranhelices (M1-M4) (M1 • die M2-Transmembrandomänen M2 Transmembrandomänen (rot) der fünf Untereinheiten (UE) bilden eine Pore • zwei Acetylcholinmoleküle (blau) binden zwischen den α-- und γ-UE sowie zwischen den α- und δ-UE des Rezeptors • N- und C-Terminus liegen extrazellulär Nicotinische Acetylcholinrezeptoren findet man an den Muskelendplatten quergestreifter Muskulatur (muskulärer Typ), in den autonomen Ganglien, im ZNS und im Nebennierenmark (neuronaler Typ) . Nach Bindung zweier Acetylcholinmoleküle kommt es durch Ladungsverschiebungen und allosterische Formveränderungen zu einer Weitung der Kanalpore auf 0,65 nm und der + + + unspezifische Kationenkanal wird für Na - und K -Ionen Ionen durchgängig. Da das Gleichgewichtspotential für Na -Ionen bei +55 mV liegt und das Membranpotential der postsynaptischen Zelle zwischen -60 mV und -80 80 mV beträgt, besteht eine starke treibende + Kraft für Na -Ionen Ionen ins Zellinnere zu strömen und die Zelle zu depolarisieren. Gleichzeitig wird der Kaliumausstrom der Depolarisation leicht entgegenwirken. Dennoch überwiegt netto der Einstrom positiver Ladungen und generiert ein exzitatorisches postsynaptisches Potential otential (EPSP), (EPSP), welches an der neuromuskulären Endplatte als Endplattenpotential bezeichnet wird. Erreicht das EPSP durch passive elektrotonische Ausbreitung den Axonhügel oder wird das d Schwellenpotential + erreicht, öffnen spannungsabhängige Na -Kanäle Kanäle und die Zelle bildet ein Aktionspotential aus, welches bei einer Muskelzelle eine Kontraktion in Form einer Einzelzuckung auslöst. Der ligandenbesetzte Rezeptor kommt in zwei Konformationszuständen vor: geschlossen und offen. Die geschlossene Form kann dabei vorübergehend in eine inaktivierte Konformation übergehen, bis die Acetylcholinmoleküle abdiffundiert sind. sind Nach Absinken der Acetylcholinkonzentration durch die Aktivität der Acetylcholinesterase regeneriert der Rezeptor zur ursprünglichen, aktivierbaren Konformation. Cholinesterase-Inhibitoren bilden entweder nur einen Komplex (nicht( veresternde Inhibitoren,, wie Donepezil) oder carbamylieren (Physostigmin, Neostigmin, Rivastigmin) und phosphorylieren darüber hinaus das Enzym (Organophosphate, wie Parathion Parathion = E605, Sarin, Tabun), womit die Acetylcholinkonzentration im synaptischen Spalt ansteigt. Diese Wirkung nutzt man therapeutisch bei der Autoimmunerkrankung Myasthenia gravis, gravis bei der Autoantikörper gegen den nicotinischen Acetylcholinrezeptor zu einer fortschreitenden fortschreitenden Muskelschwäche führen. © November 2009 200 by Alexander Jörk Friedrich--Schiller-Universität Jena 1 Pharmakologie und Toxikologie Cholinerges System M und N-Cholinozeptoren M- Neuromuskulär blockierende Stoffe Nicotinischer Acetylcholinrezeptor Die nikotinischen Acetylcholinrezeptoren können kompetitiv durch das nicht-depolarisierende Muskelrelaxans d-Tubocurarin gehemmt werden, wobei die Herztätigkeit und das ZNS aufgrund aufgrun der undurchlässigen Blut-Hirn--Schranke für das lipophobe dTubocurarin unbeeinflusst bleiben. Aufgrund ungünstiger Nebenwirkungen (Histaminfreisetzung, (Histaminfreisetzung, Ganglienblockade) werden in der Anästhesie anstelle des Tubocurarins Nachfolgersubstanzen, wie Atracurium, Vecuronium oder Mivacurium verabreicht. Das Schlangengift α-Bungarotoxin hemmt irreversibel die Anlagerung von Acetylcholinmolekülen an den Nicotinrezeptor. Als depolarisierendes Muskelrelaxans ist Suxamethonium bekannt, welches sich als Agonist an den de Nicotinrezeptor bindet, ihn + aktiviert und die postsynaptische Membran depolarisiert. Aufgrund der Inaktivierung spannungsabhängiger Na -Kanäle wird das Sarkolemm unerregbar. Dieser Depolarisationsblock lässt sich mit Cholinesterase-Inhibitoren Cholinesterase Inhibitoren nicht aufheben. aufh Eine Muskellähmung induziert auch Botulinumtoxin, Botulinumtoxin, welches insbesondere das Synaptobrevin als Protein des VesikelfusionsVesikelfusions Apparates spaltet und die Exozytose der transmittergefüllten Vesikel in den synaptischen Spalt verhindert. Agonisten und -Antagonisten Neuronal wirkende Nicotinrezeptor-Agonisten Nikotin, Coniin (Alkaloid des Schierlings), Cystisin und Lobelin sind Agonisten und das Hexamethonium als Ganglienblocker Antagonist des Nikotinrezeptors vom neuronalen Typ. Muskarinischer Acetylcholinrezeptor Cholinerge Rezeptoren in den postsynaptischen postsynapt Membranen der parasympathisch innervierten Erfolgsorgane sowie der sympathisch innervierten Schweißdrüsen sind muskarinische Acetylcholinrezeptoren. Acetylcholinrezeptoren Diese membranständigen Rezeptorproteine stellen selbst keinen Ionenkanal dar und zählen somit zu den metabotropen Rezeptoren. Rezeptoren Bindungsstellen für die Transmitter und Effektorproteine liegen getrennt lokalisiert und sind über eine G-Protein Protein-vermittelte Signalkaskade miteinander verknüpft (Abb. 3). Für die Muskarinrezeptoren vom Typ M1 bis M5 können folgende folgen Strukturmerkmale und Funktionscharakteristika beschrieben werden: • G-Protein-gekoppelte gekoppelte Rezeptoren, die die Plasmamembran mit sieben Transmembrandomänen durchspannen und daher als heptahelikale oder Serpentin-Rezeptoren Serpentin bezeichnet werden • der N-Terminus liegt iegt extrazellulär, der C-Terminus C intrazellulär • desweiteren eine große intrazelluläre Schleife zwischen der 5. und 6. Transmembrandomäne • am Signaltransduktionsmechanismus sind immer heterotrimere (α,β,γ) ( G-Proteine Proteine beteiligt, die mittels kovalenter Verknüpfung pfung mit hydrophoben Molekülen (Myristoylierung, Palmitoylierung) in der Zellmembran verankert sind • der ligandenaktivierte Rezeptor dient als guanine nucleotide exchange factor (GEF) und bewirkt GDP->GTP GDP an α-UE • das aktivierte G-Protein Protein zerfällt in seine α- und βγ-Untereinheit, Untereinheit, welche mit den Effektorproteinen assoziieren Die Ligandenbindung des first messengers an extrazelluläre Regionen muss über Konformationsänderungen in ein cytoplasmatisches Signal übersetzt werden, womit eine Signalkaskade initiiert wird: • M1, M3, M5: Gq-gekoppelt -> > Stimulation der Phospholipase C-β, welche PIP2 in IP3 und DAG spaltet • M2 und M4: Gi-gekoppelt -> > Öffnen von K-Kanälen K Kanälen und Hemmung der Adenylatcyclase, wodurch die cAMPKonzentration abfällt und die Aktivität der Proteinkinase Proteinki A und der CNG-Kationenkanäle Kationenkanäle herunterreguliert werden Abb.3: Signaltransduktion trimerer G-Proteine Proteine Muskarinerge Rezeptoren vom Typ M1 kommen typischerweise auf Neuronen uronen des Corpus striatum vor, während die M2Rezeptoren die negativ dromo-, chrono-- und d inotropen Wirkungen am Herzen vermitteln und an den postganglionärpostganglionär sympathischen pathischen Vasokonstriktoraxonen die Freisetzung von Noradrenalin und seinen Cotransmittern hemmen. M3-Rezeptoren findet man an glatten Muskelzellen, Drüsenzellen und Gefäßendothelien, Gefäßendothelien, wo sie speziell die Synthese von NO anregen. Die Wirkung des M2-Rezeptorsubtyps Rezeptorsubtyps in den Schrittmacherzellen des Herzens wird über zwei Mechanismen erreicht: Die Gβγ-UE öffnet GIRK-Kaliumkanäle Kaliumkanäle und führt neben einer schnelleren Repolarisation zur Stabilisierung Stabilisierung und Negativierung des diastolischen Potentials. Die Gα-UE UE hemmt die Adenylatcyclase und der geringe cAMP-Spiegel cAMP verringert die Offenwahrscheinlichkeit der HCN-Kanäle, Kanäle, wodurch der Schrittmacherstrom gehemmt wird. © November 2009 200 by Alexander Jörk Friedrich--Schiller-Universität Jena 2 Pharmakologie und Toxikologie Cholinerges System M und N-Cholinozeptoren M- M-Cholinozeptoragonisten Muskarinischer Acetylcholinrezeptor Da die Muskarinrezeptor-Agonisten die Wirkungen des Parasympathikus nachahmen, nennt man sie Parasympathomimetika. Zu den Agonisten gehören Acetylcholin,, welches aber einem schnellen Abbau unterliegt, und die Carbaminsäureester Carbachol und Bethanechol, Bethanechol welche gegen die Acetylcholinesterasen resistent sind. Neben Muscarin als Hauptgift des ziegelroten iegelroten Risspilzes gehören das schweißtreibende und speichelflussanregende Alkaloid Pilocarpin und das euphorisierende und halluzinogene Wirkung ausübende Arecolin der Betelnusss zur Agonistengruppe. M-Cholinozeptorantagonisten Diese als Parasympatholytika wirkenden Substanzen haben keine intrinsische Aktivität und sind kompetitive Antagonisten gegen freigesetztes Acetylcholin. Atropin und Scopolamin sind natürliche Alkaloide der er Tollkirsche, des Bilsenkrauts und des Stechapfels. Aufgrund der lang andauernden mydriatischen Wirkung des Atropins bedient man sich in der Augenheilkunde an den kürzer wirkenden Mydriatika Cyclopentolat und Tropicamid. Neben den nicht subtypselektiven Antagonisten Butylscopolamin und Ipratropium hat Pirenzepin eine Präferenz für den M1-Rezeptortyp und Darifenacin und Tiotropium für den M3-Rezeptortyp. Zusammenfassung der cholinergen Signaltransduktion Hemmung der Freisetzung von Acetylcholin durch Calcium-Mangel, Magnesium-Überschuss, Lokalanästhetika und Botulinusneurotoxine Blockade der Cholin-Carrier durch Hemicholinium-3 führt zur Verarmung an Acetylcholin Hemmung der Anlagerung von Acetylcholin-Molekülen an den Nicotin-Rezeptor durch α-Bungarotoxin Blockade der Cholinesterasen durch Donepezil, Physostigmin oder Alkylphosphate Aktivierung der nicotinischen AcetylcholinRezeptoren durch Nicotin und Suxamethonium Blockade der nicotinischen Acetylcholin-Rezeptoren durch d-Tubocurarin und Hexamethonium Aktivierung der muskarinische Acetylcholin-Rezeptoren durch Muskarin, Carbachol, Bethanechol, Pilocarpin und Arecolin Blockade der Muskarinrezeptoren durch Atropin und Scopolamin © November 2009 200 by Alexander Jörk Friedrich--Schiller-Universität Jena 3