Das Zusammenspiel der Gene
Werbung
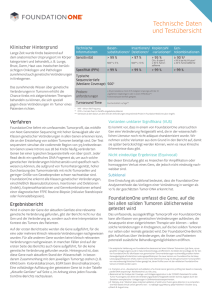
BIOsp_SH:001_052_BIOsp_SH_2007_neu.qxd 8 10.08.2007 14:22 Uhr Seite 8 G E NO M I C S Systemgenetik Das Zusammenspiel der Gene KLAUS SCHUGHART 1 UND HANNES SCHLENDER 2 EXPERIMENTELLE MAUSGENETIK, HELMHOLTZ-ZENTRUM FÜR INFEKTIONSFORSCHUNG, BRAUNSCHWEIG, UND TIERÄRZTLICHE HOCHSCHULE HANNOVER, 2 ÖFFENTLICHKEITSARBEIT, HELMHOLTZ-ZENTRUM FÜR INFEKTIONSFORSCHUNG, BRAUNSCHWEIG 1 ABTEILUNG Wie beeinflussen sich die Gene in einem Organismus gegenseitig? Welche Rolle spielen dabei Umwelteinflüsse? Welche Bedeutung haben Gennetzwerke für Erkrankungen, und lässt sich das komplexe Zusammenspiel der Gene vollständig am Computer simulieren? Solchen Fragen widmet sich ein neuer Forschungszweig: Die Systemgenetik. ó Bei den meisten Erbgängen, und vor allem bei vielen menschlichen Erkrankungen, spielt nicht nur die Veränderung in einem einzigen Gen eine Rolle, sie werden vielmehr von einer Vielzahl von Erbanlagen beeinflusst. Vor allem bei Herz-Kreislauf-Erkrankungen, neurologischen Beschwerden und Allergien ist das komplexe Zusammenspiel einer Vielzahl individueller Genvarianten für die Ausbildung der Krankheit verantwortlich. Auch ob ein Wirt empfindlich oder unempfindlich auf eine Infektion reagiert, bestimmt eine ganze Armada von Genen. Dabei können sich Gene und ihre Varianten in einem Individuum gegenläufig oder gleichsinnig beeinflussen, sodass ein defektes Gen durch weitere Gene ¯ Sytemgenetik am Beispiel der Untersuchungen der Wirtsantwort nach einer Influenza-Infektion. Mäuse von verschiedenen Familien werden mit dem Influenza A Virus infiziert (A) und dann phänotypisch untersucht (B). Die unterschiedlichen Phänotypmerkmale korreliert man mit den Genotypen der Familien und identifiziert auf diese Weise genetische Regionen, die für die Empfindlichkeit gegenüber dem Pathogen eine wichtige Rolle spielen (Pfeil in C). Aus genomweiten Genexpressionsmustern lassen sich regulatorische Netzwerke von Genen ableiten (D). (Abbildung D aus Li et al., Inferring gene transcriptional modulatory relations: a genetical genomics approach, Human Molecular Genetics, 2005, Vol. 14, No. 9, 1119–1125, mit Genehmigung von Oxford University Press) BIOspektrum | Sonderheft zur Biotechnica 2007 | 13. Jahrgang BIOsp_SH:001_052_BIOsp_SH_2007_neu.qxd 10 10.08.2007 14:22 Uhr Seite 10 G E NO M I C S ¯ Im GeNeSys-Netzwerk haben sich Partner aus zehn verschiedenen Institutionen zusammengeschlossen. (Bildquellen: S. aureus, Sepsis: HZI, Manfred Rhode; Leberfibrose: Frank Lammert; L. donovani: Werner Solbach; Neurogenese: Gerd Kempermann; Influenza: HZI, Miessen; M. tuberculosis: CDC, George Kubica; Y. enterocolitica: CDC; Fettleibigkeit: Gudrun Brockmann.) kompensiert wird – oder umgekehrt, sich Gendefekte gegenseitig verstärken. Mäuse: Inzuchtstämme mit neuen Genkombinationen Welche Gene sich untereinander steuern, untersuchen Wissenschaftler an Mäusen. Seit Beginn des vergangenen Jahrhunderts haben sie viele verschiedene Mausstämme gezüchtet. Die meisten stammen von einer Mischung der Subspezies Mus musculus musculus und Mus musculus domesticus ab. Da die verschiedenen Mausstämme untereinander verpaart werden können, lassen sich neue Stämme mit neu kombinierten Genmerkmalen züchten. Die unterschiedlichen Inzuchtstämme der Mäuse können wir als Familien betrachten, die jeweils eine bestimmte Kombination von Genvarianten (Allelen) enthalten und sich damit genetisch von anderen Familien unterscheiden. Den Forschern steht somit eine große Population von Individuen zur Verfügung, mit denen sich, ähnlich wie beim Menschen, Assoziationsstudien zwischen den phänotypischen Eigenschaften und genetischen Merkmalen herstellen lassen. Der große Vorteil von Mauspopulationen gegenüber Studien beim Menschen ist jedoch, dass diese experimentell behandelt werden können. So kann man beispielsweise die Wirtsantwort auf eine Infektionen mit einem Pathogen studieren, was sich beim Menschen verbietet. Da die Mausfamilien nachgezüchtet werden können, steht den Forschern eine unbegrenzte Anzahl von genetisch identischen Individuen zur Verfügung, sodass sie immer wieder neue Hypothesen testen können. Systemgenetiker netzwerken in GeNeSys Ein einzelnes Forschungsteam oder gar ein Forscher allein kann eine solche Herkulesaufgabe wie die Analyse komplexer genetischer Erbgänge nicht bewältigen. Deshalb haben sich Forschergruppen zu Netzwerken zusammen geschlossen, in denen sie auf gemeinsame Mauspopulationen zugreifen und die Datenerfassung sowie die Bioinformatik-Analysen zentral durchführen. Ein solches Netzwerk ist GeNeSys, ein virtuelles Institut der Helmholtz-Gemeinschaft (German Network of Systems Genetics, www.helmholtz-hzi.de/en/research_groups/ experimental_mouse_genetics/). Die GeNeSys-Forscher untersuchen die komplexe Genetik von Humanerkrankungen in der Maus. Hierzu gehören Infektionen mit Staphylococcus aureus, Mycobacterium tuberculosis, Yersinia enterocolitica, Leishmania donovani und Influenza A. Auch die Reaktion auf den experimentell induzierten septischen Schock, die Empfänglichkeit für Diabetes und Leberfibrose sowie die Fähigkeit, im adulten Stadium Gehirnzellen zu regenerieren, wollen die Forscher des Netzwerks aufklären. Von der komplexen Genetik zur Systemgenetik Mit modernen gentechnischen Methoden untersucht man aber nicht nur einzelne Phänotypen wie die Empfindlichkeit gegenüber einer Infektion. Mikrochips erlauben heute die Erfassung genomweiter Expressionsdaten. In den Maus-Familien lassen sich daher auch die Expressionsmuster in verschiedenen Organen, Geweben oder isolierten Zell- populationen analysieren. Die Varianz in der Stärke der Expression der Gene kann nun wiederum als Phänotyp interpretiert und mit den zugehörigen Genotypen korreliert werden. So identifizieren die Wissenschaftler unter anderem Genregionen, welche die Expression anderer Gene steuern, und Regulatorregionen, die Regulatoren beeinflussen. Auf diese Weise können sie ganze Netzwerke von Genen studieren. Da alle Daten, sowohl die der klassischen phänotypischen Analyse als auch die der Expressionsanalyse, in einer gemeinsamen Datenbank gesammelt werden, lassen sich phänotypische Eigenschaften wie die Infektions-Empfindlichkeit oder Diabetes mit dem regulatorischen Netzwerk von Genen in den verschiedenen Organen des Wirts korrelieren. Die Verknüpfung vieler Phänotypen mit den zahlreichen Genotypen der Mausfamilien bezeichnet man als Systemgenetik. Basierend auf den zahlreichen Laborergebnissen lassen sich anschließend genetische Netzwerke im Computer modellieren. Diese Modelle können bestimmte Szenarien wie die Erhöhung oder Erniedrigung der Aktivität einzelner Gene simulieren und deren Bedeutung für das Gesamtnetzwerk vorhersagen. Im Experiment mit einer entsprechenden Mausfamilie lässt sich dann die Prognose testen. Der Zusammenschluss von Forschergruppen in koordinierten Netzwerke und virtuellen Instituten, die dieselben Mausfamilien studieren und ihre Daten miteinander verknüpfen, hilft, das komplexe Zusammenspiel der Gene bei der Entstehung von Krankheiten beim Menschen zu verstehen. ó Korrespondenzadresse: Prof. Dr. Klaus Schughart Abteilung Experimentelle Mausgenetik Helmholtz-Zentrum für Infektionsforschung Inhoffenstraße 7 D-38124 Braunschweig Tel.: 0531-6181-1100 Fax: 0531-6181-1099 [email protected] www.helmholtz-hzi.de BIOspektrum | Sonderheft zur Biotechnica 2007 | 13. Jahrgang