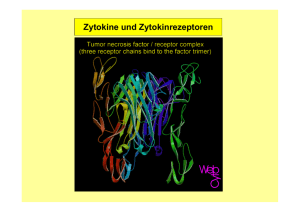
T-Zell-vermittelte Aktivierung Natürlicher Killerzellen
Werbung

Aus dem Institut für Medizinische Mikrobiologie und Hygiene des Universitätsklinikums in Ulm Ärztlicher Direktor: Prof. Dr. Steffen Stenger T-Zell-vermittelte Aktivierung Natürlicher Killerzellen Dissertation zur Erlangung des Doktorgrades der Medizin der Medizinischen Fakultät der Universität Ulm vorgelegt von Valeska Knoll aus Göttingen 2010 Meinen Eltern Amtierender Dekan: Prof. Dr. Thomas Wirth 1. Berichterstatter: Prof. Dr. Steffen Stenger 2. Berichterstatter: Prof. Dr. Thomas Barth Tag der mündlichen Prüfung: 20.05.2011 I Inhaltsverzeichnis Abkürzungsverzeichnis III 1. Einleitung 1.1. Natürliche Killerzellen 1 1.1.1. Rolle bei der Immunabwehr 1 1.1.2. Effektormechanismen und Subpopulationen 2 1.1.3. Aktivierung 3 1.2. Induktion einer adaptiven Immunantwort 5 1.3. Fragestellung der Arbeit 7 2. Material und Methoden 2.1. 2.2. Material 2.1.1. Arbeitsgeräte 9 2.1.2. Arbeitsmaterial 9 2.1.3. Chemikalien 10 2.1.4. Medien und Puffer 11 2.1.5. Zytokine und Antikörper 11 2.1.6. Antigene 12 Methoden 2.2.1. Isolierung peripherer mononukleärer Zellen 13 2.2.2. Isolierung Natürlicher Killerzellen 14 2.2.3. Generierung unreifer dendritischer Zellen 15 2.2.4. Durchflusszytometrie 16 2.2.5. Proliferationsmessung 16 2.2.6. Kultur in Transwell-Platten 18 2.2.7. Statistische Auswertung 19 3. Ergebnisse 3.1. Identifikation proliferierender Natürlicher Killerzellen 20 3.1.1. Optimierung der Proliferationsmessung für primäre humane Blutzellen 20 3.1.1.1. Konzentration des Fluorochroms 20 3.1.1.2. Konzentration der Lymphozyten 21 II 3.1.1.3. Auswahl des Stimulus zur Induktion der Lymphozytenproliferation 3.1.1.4. 22 Bedeutung dendritischer Zellen für die Lymphozytenproliferation 23 3.1.2. Phänotypische Charakterisierung proliferierender Zellen 26 3.1.3. Nachweis der Proliferation aufgereinigter Natürlicher Killerzellen 28 3.1.3.1. Anreicherung Natürlicher Killerzellen 3.1.3.2. Einfluss von PPD auf die Proliferation Natürlicher Killerzellen 3.2. 28 30 Mechanismus der Aktivierung Natürlicher Killerzellen 32 3.2.1. Rolle löslicher Faktoren für die Proliferation Natürlicher Killerzellen 33 3.2.2. Identifikation aktivierender Zytokine 35 3.2.2.1. Einfluss von Zytokinen dendritischer Zellen 36 3.2.2.2. Einfluss von T-Zell-Zytokinen 38 3.2.2.3. Rolle von Interleukin-2 auf die Proliferation Natürlicher Killerzellen 40 4. Diskussion 4.1. Bedeutung der Proliferation Natürlicher Killerzellen bei der Immunantwort 4.2. 44 Bedeutung von Interleukin-2 bei der Immunantwort und in der Krebstherapie 46 4.3. Interaktion von T-Zellen und Natürlichen Killerzellen 49 4.4. Natürliche Killerzellen als Teil des adaptiven Immunsystems 51 5. Zusammenfassung 55 6. Literaturverzeichnis 57 Anhang 68 III Abkürzungsverzeichnis APZ Antigenpräsentierende Zellen CD Cluster of differentiation CFSE Carboxyfluoreszein Succinimidyl Ester DZ Dendritische Zellen EDTA Ethylendiamin-Tetraacetat FITC Fluorescein-Isothiocyanat GM-CSF Granulocyte macrophyge colonystimulating factor IFN-γ Interferon-γ IL Interleukin MACS Magnetic Activated Cell Sorting MCMV Murine Cytomegalie Virus MHC Haupthistokompatibilitätskomplex MTB-Extrakt Extrakt von Mycobacterium tuberculosis M.tb Mycobacterium tuberculosis NK-Zellen Natürliche Killerzellen NKT Natürliche Killer T-Zellen PBMZ mononukleäre Zellen aus dem peripheren Blut PE Phycoerythrin PerCP Peridinin Chlorophyll Protein PPD Purified Proteine Derivative TH1-Zelle T-Helfer-1-Zelle TH2-Zelle T-Helfer-2-Zelle TLR Toll-like-Rezeptor TNF-α Tumornekrosefaktor-α TT Tetanus-Toxoid TZR T-Zell-Rezeptor 1 Einleitung 1. Einleitung 1.1 Natürliche Killerzellen 1.1.1 Rolle bei der Immunabwehr 1975 wurden erstmalig Lymphozyten beschrieben, die Tumorzellen lysieren konnten, jedoch keine T-Lymphozyten waren. Das Besondere an diesen Lymphozyten war ihre unmittelbare Aktivierung ohne vorherige Differenzierung in Effektorzellen, wie es vom adaptiven Immunsystem bekannt ist. Aufgrund dieser Eigenschaft wurden sie von Eva Klein „Natürliche Killer“ genannt (Kiessling et al. 1975). Nach der klassischen Einteilung zählen Natürliche Killerzellen (NK-Zellen) zum angeborenen Immunsystem und grenzen sich von den zum adaptiven Immunsystem gehörenden B- und T-Lymphozyten ab (Janeway et al. 2002). Sie schützen den Körper bereits in der Anfangsphase der Immunantwort gegen eindringende Pathogene, während das adaptive Immunsystem erst aktiviert werden muss. NK-Zellen erkennen infizierte, transformierte oder Antikörper-markierte Zellen Rezeptor-vermittelt. Sie induzieren den apoptotischen Tod der Zielzelle durch Freisetzung lytischer Effektormoleküle sowie Apoptose-induzierenden Liganden wie Fas-Ligand und TRAIL (Smyth et al. 2001). Eine wichtige immunregulatorische Aufgabe ist die Sekretion der Zytokine Interferon-γ (IFN-γ) , Tumor Nekrose Faktor-α (TNF-α) und Granulocyte macrophage stimulatory factor (GM-CSF). Zytotoxizität und Zytokinsekretion stehen sofort nach Aktivierung bereit, da sowohl zytotoxische Granula präformiert in Vesikeln vorliegen als auch IFN-γ-Transkripte in NK-Zellen gespeichert sind. Dieser „ready to go“-Mechanismus (Lanier 2005) prädispositioniert NK-Zellen für die Abwehr von Organpathogenen in der frühen Phase der Immunantwort. Zellen des angeborenen Immunsystems besitzen invariante, keimbahnkodierte Rezeptoren, mit denen nur eine limitierte Anzahl konservierter 2 Einleitung Oberflächenstrukturen auf Krankheitserregern erkannt wird (Janeway et al. 2002). Die unveränderlichen Rezeptoren und das begrenzte Rezeptorrepertoire ermöglichen den NK-Zellen nur eine unspezifische Bekämpfung eingedrungener Erreger. Deshalb werden sie als Teil des angeborenen Immunsystems betrachtet. Trotz der eingeschränkten Variabilität verhindert das angeborene Immunsystem im Regelfall eine Infektion (Strowig et al. 2008). Reichen die angeborenen Schutzmechanismen nicht aus, wird das adaptive Immunsystem unterstützend aktiv. Dies erfordert ca. eine Woche nach erstmaligem Antigenkontakt, da es durch dendritische Zellen (DZ) im Lymphknoten aktiviert wird (Janeway 1989b, Mempel et al. 2004) und die Ausdifferenzierung von antigenspezifischen Lymphozyten zu Effektorzellen erfolgen muss. Bis dahin limitiert das angeborene Immunsystem die Infektion. Als Folge der adaptiven Immunantwort nimmt die Frequenz der NK-Zellen am Ort der Infektion unter dem Einfluss antiproliferativer Zytokine ab (Zhao et al. 2009). Im Gegensatz zum angeborenen Immunsystem entwickelt das adaptive Immunsystem ein immunologisches Gedächtnis. Gedächtniszellen werden noch nach Monaten und Jahren durch eine Infektion mit demselben Pathogen aktiviert und wehren dieses sofort und spezifisch ab. Dagegen bekämpfen NK-Zellen als Teil des angeborenen Immunsystems auch wiederkehrende Infektionen mit den ihnen eigenen Mechanismen (O'Leary et al. 2006). 1.1.2 Effektorfunktionen und Subpopulationen NK-Zellen entwickeln sich zusammen mit anderen Lymphozyten aus der gemeinsamen CD34+ hämatopoetischen Vorläuferzelle im Knochenmark (Freud et al. 2006a). Nachdem sie das Knochenmark verlassen haben, sind sie in Blut, Milz, Leber, Uterus und in geringer Anzahl im sekundären Lymphgewebe nachweisbar (Yokoyama et al. 2004). Sie definieren sich durch ihren Oberflächenrezeptor Cluster of differentiation (CD) 56 bei gleichzeitigem Fehlen des T-Zell-spezifischen CD3-Rezeptors. Ihre Frequenz im peripheren Blut beträgt ca. 10% (Fehniger et al. 3 Einleitung 2003). Es werden zwei NK-Zell-Subpopulationen entsprechend ihrer CD56Rezeptordichte und Funktion unterschieden. Die niedrig CD56-exprimierenden „CD56dim NK-Zellen“ bilden einen Anteil von 90% der NK-Zellen im peripheren Blut. Sie tragen den für die Antikörperabhängige zellvermittelte Zytotoxizität benötigten CD16-Rezeptor. Sie sind zytotoxisch, produzieren aber deutlich weniger Zytokine als die CD56bright NKZell-Subpopulation. Die Frequenz der CD56bright NK-Zellen beträgt 10% der gesamten peripheren NK-Zell-Population (Strowig et al. 2008). CD56bright NKZellen zeichnen sich durch eine hohe CD56-Rezeptordichte aus und bilden die Mehrheit der NK-Zellen in den Lymphknoten. Diese erreichen sie mit Hilfe ihrer Rezeptoren L-Selektin und CCR7 (Campbell et al. 2001, Frey et al. 1998). Sie exprimieren wenige zytotoxische Rezeptoren und tragen kaum CD16 auf ihrer Oberfläche. Ihre Hauptaufgabe besteht in der Synthese von IFN-γ und TNF-α, wodurch sie das Immunsystem modulieren. Im Lymphknoten können sie auf diese Weise mit DZ und T-Zellen interagieren und die adaptive Immunantwort formen (Fehniger et al. 2003). CD56bright NK-Zellen werden erst unter Interleukin (IL)-2-Einfluss zytotoxisch. Phänotypisch entsprechen sie dann den CDdim NK-Zellen, weshalb man annimmt, dass es sich bei den CDdim NK-Zellen um eine Differenzierungsstufe der CDbright NK-Zellen handelt (Freud et al. 2006b). 1.1.3. Aktivierung Die natürliche Zytotoxizität der NK-Zellen wird durch das komplexe Zusammenspiel von inhibitorischen und aktivierenden Rezeptoren vermittelt. Liganden für inhibitorische Rezeptoren sind Haupthistokompatibilitätskomplex (MHC)-Klasse-I-Moleküle. Diese werden von gesunden Zellen ubiquitär exprimiert und schützen vor der NK-Zell-vermittelten Lyse. Liganden für aktivierende Rezeptoren werden in Pathogen-infizierten transformierten Zellen exprimiert (Lanier 2005). oder maligne 4 Einleitung NK-Zellen erkennen Veränderungen in Oberflächenmolekülstrukturen durch Ausbildung immunologischer Synapsen mit Zellen in ihrer Umgebung (Orange 2008). In der Regel überwiegen die inhibitorischen Signale, die über MHC-KlasseI-Moleküle in die NK-Zelle geleitet werden. Dadurch löst sich die gebundene Zelle aus dem Verband und wird nicht zerstört. Die natürliche Zytotoxizität der NKZellen wird ausgelöst wenn, 1. die MHC-I-Expression auf der Zelloberfläche infolge einer Virusinfektion oder Transformation verändert ist. Folglich werden nicht genügend hemmende Signale in die Zelle geleitet und die Ausschüttung zytotoxischer Granula induziert. Dieses Phänomen wurde bereits 1985 von Klas Kärre mit der „Missing-self“-Hypothese erklärt, welche besagt, dass Zellen ohne körpereigene Erkennungsmerkmale (MHC-I-Moleküle) eliminiert werden (Ljunggren et al. 1985). 2. eine Zelle zwar eine regelrechte MHC-I-Molekül-Expression aufweist, die Signale, die über aktivierende Rezeptoren in die NK-Zelle geleitet werden aber dominieren. Dies geschieht, wenn Zellen infolge von Transformation oder Infektion überwiegend aktivierende Liganden auf ihrer Oberfläche tragen. Zur Induktion der natürlichen Zytotoxizität muss eine Reihe synergistisch wirkender Rezeptoren gebunden werden. Im Gegensatz dazu reicht die selektive Bindung des CD16-Rezeptors von der Antikörper-markierten Zelle aus, um die Antikörper-abhängige zellvermittelte Zytotoxizität auszulösen (Bryceson et al. 2006b). Die NK-Zell-Aktivität wird nicht nur über aktivierende und inhibierende Rezeptoren auf Körperzellen reguliert. Auch Immunzellen steuern über lösliche Faktoren und Zell-Zell-Kontakt die NK-Zell-Aktivität. Von aktivierten T-Zellen freigesetztes IL–2 induziert die Proliferation und erhöht die Zytotoxizität in CDbright NK-Zellen über deren hoch affinen IL-2 Rezeptor (Carson et al. 1997). 5 Einleitung Eine NK-Zell-Aktivierung kann ebenfalls durch die Monokine IL-12 und IL-15 erfolgen. Diese werden sowohl von Monozyten (Yu et al. 2006) als auch von DZ sezerniert, wenn Toll-like Rezeptoren (TLR) auf ihrer Oberfläche gebunden werden. TLR erkennen konservierte molekulare Strukturen, die auf diversen pathogenen Mikroorganismen zu finden sind und tragen entscheidend zur Aktivierung des angeborenen Immunsystems bei (Luster 2002). IL-12 induziert die IFN-γ-Sekretion in NK-Zellen, fördert deren Zytotoxizität und wirkt proliferativ (Strowig et al. 2008, Ferlazzo et al. 2003). IL-15 spielt eine wichtige Rolle bei der NK-Zell-Reifung, der Induktion der IFN-γ-Freisetzung sowie der Proliferation von NK-Zellen (Ferlazzo et al. 2004b). Die Proliferation der NK-Zellen wird auch unabhängig von Zytokinen durch ZellZell-Kontakt mit DZ ausgelöst (Amakata et al. 2001). NK-Zellen besitzen eine Vielzahl an TLR auf ihrer Oberfläche. Deshalb wird diskutiert, ob eine direkte Aktivierung auch über TLR möglich ist. So wurde z.B. eine NK-Zell-Aktivierung (IFN-γ und TNF-α-Produktion) über TLR-2 durch das Lipophosphoglykan von Leishmanien beschrieben (Becker et al. 2003). Noch ist allerdings offen, ob die Aktivierung direkt über TLR oder indirekt durch Zytokine TLR-aktivierter Antigenpräsentierender Zellen (APZ) induziert wurde (O'Connor et al. 2006). Auch TNF-α aktiviert NK-Zellen und trägt zur NK-Zell-Reifung bei. Zusammen mit IL-15 induziert TNF-α die IFN-γ-Produktion (Lee et al. 2009). Die Neutralisation von TNF-α führt zu einer signifikanten Abnahme der IL-2 vermittelten Proliferation (Innins et al. 1992), was eine proliferative Wirkung von TNF-α zeigt. IFN-γ führt indirekt zu einer NK-Zell-Aktivierung, da es die IL-12Ausschüttung in DZ induziert (Schroder et al. 2004). 1.2. Induktion einer adaptiven Immunantwort Im Gegensatz zu NK-Zellen gehören T-Zellen zum adaptiven Immunsystem und erkennen aufgrund ihrer großen Rezeptorvielfalt viele unterschiedliche Antigene. 6 Einleitung Diese Variationsbreite entsteht durch Genumlagerungen während der Entwicklung und hat die Expression je eines individuellen Rezeptors in jedem TLymphozyten zur Folge (Chaplin 2010). Dadurch eliminiert das adaptive Immunsystem Pathogene mit höherer Spezifität und Effektivität als das angeborene Immunsystem (Janeway et al. 2002). Unabdingbare Voraussetzung für die Entwicklung der T-Zell-Effektorfunktionen ist die Aktivierung durch DZ im Lymphknoten. Unreife DZ befinden sich ubiquitär im peripheren Gewebe und phagozytieren Pathogene und infizierte Zellen. Nach Aktivierung durch Antigen-Kontakt, wandern DZ in das sekundäre Lymphgewebe und differenzieren sich zu APZ (Guermonprez et al. 2002). Reife DZ präsentieren die aufgenommenen Peptidantigene an naive T-Zellen. Erkennt eine T-Zelle das Antigen mit ihrem T-Zell-Rezeptor (TZR), wird sie aktiviert und setzt IL-2 frei. Dies führt zur klonalen Expansion, so dass nach 4-5 Tagen große Mengen an T-Zellen mit identischem TZR im Lymphknoten akkumulieren. Anschließend differenzieren sie zu Effektorzellen (Janeway 1989b). Je nach Zytokinmilieu im Lymphknoten entwickeln sich CD4-positive T-Helfer (TH)Zellen oder CD8-positive zytotoxische T-Zellen. In Anwesenheit der Zytokine IFN-γ und IL-12, die nach Invasion intrazellulärer Bakterien freigesetzt werden, differenzieren sich TH-Zellen weiter zu TH1-Zellen. Zu den Aufgaben der TH1Zellen gehört die Aktivierung von Makrophagen durch IFN-γ. Dies stimuliert die Effektivität der Makrophagen gegen intrazelluläre Bakterien (Abbas et al. 1996). Weiterhin leiten TH1-Zellen an B-Zellen kostimulatorische Signale, die daraufhin Antikörper vom Immunglobulin (Ig) G-Typ produzieren und extrazelluläre Bakterien opsonisieren. Dominiert das Zytokin IL-4 im Lymphknoten, wie es z.B. bei Wurminfektionen oder auch als Reaktion auf Allergene aus der Umwelt der Fall ist, differenzieren sich T-Zellen zu TH2-Zellen. Diese induzieren in B-Zellen den Wechsel zur Klasse der IgE-Antikörper. IgE bietet zum einen Schutz gegen parasitäre Wurminfektionen, ist aber auch für die Ausbildung allergischer Reaktionen verantwortlich. Welcher Subtyp an T-Helferzellen sich entwickelt, ist für den 7 Einleitung Erfolg einer Immunantwort von entscheidender Bedeutung. Bei einer Infektion mit intrazellulären Bakterien begünstigt die selektive Bildung von TH2-Zellen einen schweren Krankheitsverlauf. Da das Wirkspektrum von Antikörpern auf den extrazellulären Raum begrenzt ist, hat die Antikörperproduktion keinen Nutzen bei der Eliminierung intrazellulärer Erreger (Mosmann et al. 1989) . Differenzierte Effektorzellen erreichen lympho- oder hämatogen den Ort der Infektion, wo sie eine effiziente Infektabwehr gewährleisten. 4. Fragestellung dieser Arbeit Bisher wurden angeborene und erworbene Immunität überwiegend als hintereinander geschaltete Abwehrmechanismen interpretiert. In der frühen Phase der Immunantwort dominieren NK-Zellen des angeborenen Immunsystems. In der Folge übernehmen T-Zellen des adaptiven Immunsystems die Kontrolle der Krankheitserreger. Die Parallelschaltung Zusammenspiel von NK-Zellen und beider Systeme z.B. durch ein T-Zellen wurde nur unzureichend berücksichtigt. Unsere Beobachtung, dass T-Zellen und NK-Zellen gleichzeitig von bakteriellen Antigenen aktiviert werden, gab die Initialzündung für diese Arbeit. In Experimenten zur T-Zell-Aktivierung durch Antigene von Mycobacterium tuberculosis (M. tb) wurde gezeigt, dass neben T-Zellen auch NK-Zellen antigenspezifisch proliferieren (Abb. 1) (Bastian et al. 2008). Da NK-Zellen keine antigenspezifischen Rezeptoren besitzen, ist der Mechanismus der Proliferation ungeklärt. Wir entwickelten die Hypothese, dass NK-Zellen indirekt durch TZellen aktiviert werden. Ziel dieser Arbeit war daher zu untersuchen, durch welche Mechanismen mikrobielle Antigene die Aktivierung von NK-Zellen induzieren. 8 Einleitung A unstimuliert B Totallipid Proliferierte, CD3negative Lymphozyten Abbildung 1: Mykobakterielle Antigene aktivieren T-Zellen und NK-Zellen. CFSEgefärbte PBMZ wurden mit autologen DZ und Totallipid stimuliert und die Proliferation an Tag 6 mit dem Durchflusszytometer bestimmt. (A) Die Abbildung zeigt unstimulierte PBMZ, deren Hauptanteil von CD3-positiven (CFSEhigh) T-Zellen gebildet wird. Sie proliferieren nicht, was durch ihren hohen CFSE-Farbstoffgehalt deutlich wird. (B) Die Abbildung zeigt die Proliferation stimulierter PBMZ, was durch die CFSEFarbstoffabnahme (CFSElow) ersichtlich ist. Neben CD3-positiven T-Zellen proliferieren auch CD3-negative Lymphozyten. CD: Cluster of differentiation; CFSE: Carboxyfluoreszein Succinimidyl Ester; DZ: Dendritische Zellen; NK-Zellen: Natürliche Killerzellen; PBMZ: mononukleare Zellen aus dem peripheren Blut. 9 Material und Methoden 2. Material und Methoden 2.1 Material 2.1.1. Arbeitsgeräte Cäsium-137 Strahlenquelle Molsgaard Medical FACScalibur Durchflusszytometer Becton Dickinson Laminair-Werkbank Heraeus Lichtmikroskop Olympus Neubauerzählkammer Schubert & Weiss Pipetus akku Hirschmann Ultraschallbad T310-H Roth, Karlsruhe VarioMACS Seperator Miltenyi Biotec Vortexer Heidolph Wasserbad Köttermann Zellkulturinkubator Heraeus Zentrifuge 5810R Eppendorf 2.1.2 Arbeitsmaterial Gewebekulturplatten, 24-Well Becton Dickenson Röhrchen für die Durchflusszytometrie Becton Dickenson Gewebekulturplatten, 96-Well Rundboden Nunc Kunststoffpipetten (5ml, 10ml und 25ml) Costar Kulturflaschen, 15 ml Becton Dickenson MACS Sepreation Columns Miltenyi Biotec Pasteurpipetten Brand 10 Material und Methoden Pipettenspitzen 0,5-10µl Brand Pipettenspitzen 2-200µl Roth Pipettenspitzen 100-1000µl Sarstedt, Nümbrecht Schraubröhrchen, 15 ml Becton Dickenson Schraubröhrchen, 50 ml Becton Dickenson Transwelleinsätze für 24-Well Platte, 0,4µm Costar 2.1.3 Chemikalien Buffy-Coat-Präparationen DRK Blutspendedienst Badenwürttemberg-Hessen, Ulm Bovines Serumalbumin Sigma CFSE Alexis EDTA Sigma Ficoll-Paque Plus GE Healthcare Bio Sciences Fötales Kälberserum Sigma-Aldrich Hepes Biochrom AG Humanserum AB Bio Whittaker L-Glutamin PAA Natriumazid Roth PBS PAA Penicillin/Streptomycin Biochrom AG PPD (Tuberkulin GT) Chiron Behring RPMI 1640 Gibco 11 Material und Methoden Trypanblau Biochrom AG 2.1.4 Medien und Puffer Komplettes Medium: RPMI 1640, 10 mM Hepes, 2 mM L-Glutamin, 60 µg/ml Penicillin, 100µg/ml Streptomycin Zellkulturmedium: Komplettes Medium + 5% hitzeinaktiviertes Humanserum (HS) Puffer für die Durchflusszytometrie: PBS, 2% FCS, 0,1% Natriumazid Waschserum: PBS (400ml) + komplettes Medium (100ml) + 2% FCS CFSE-Waschpuffer: PBS + 2%FCS MACS-Puffer: PBS, 0,5% BSA, 2mM EDTA 2.1.5 Zytokine und Antikörper anti-hu-CD3-PerCP (Maus IgG1) Becton Dickinson Maus-anti-IgG1 PerCP Becton Dickinson anti-hu-CD56-PE (Maus IgG1) Becton Dickinson Maus-anti-IgG1 PE Becton Dickinson anti-hu-MHC-II-FITC (Maus IgG2b) Invitrogen Maus-anti IgG2b FITC Becton Dickinson anti-hu-IFN-γ (Maus-IgG2b) R&D Systems 12 Material und Methoden anti-hu-IL-2 (Maus IgG1) R&D Systems anti-hu-TNFα (Maus IgG1) Pierce Endogen anti-hu-IL-12 (Maus IgG1) R&D Systems anti-hu-IL-15 (Maus IgG1) R&D Systems rhu IFN-γ R&D Systems GM-CSF Berlex rhu TNF-α Strathmann rhu IL-12 R&D Systems rhu IL-15 R&D Systems rhu IL-2 Chiron rhu IL-4 Strathmann NK Cell Biotin Antibody Cocktail human Miltenyi Biotec NK Cell MicroBead Cocktail human Miltenyi Biotec Maus-anti IgG1 R&D Systems 2.1.6. Antigene MTB-Extrakt: Virulente Mycobakterien (H37Rv) wurden durch Bestrahlung (25kGy) inaktiviert und anschließend in PBS resuspendiert. Es folgte die 3-malige Behandlung im Ultraschallbad mit anschließender Zentrifugation für 1 Stunde bei 150 000 xg, um die Bakterien in ihre Bestandteile zu zerlegen. Der Überstand wurde abgenommen und die Proteinkonzentration durch den Bicinchoninic (BCA) Protein Assay (Pierce) ermittelt. Totallipid: Lipidantigene eines virulenten Mykobakterien-Stamms (H37Rv) wurden mithilfe einer Chloroform-Methanol-Mischung (2:1) extrahiert und bei 13 Material und Methoden 70°C gelagert. Um Totallipid in Experimenten zu verwenden, wurde die gewünschte Menge im Vakuum getrocknet und durch Ultraschall im warmen Wasserbad in Zellkulturmedium gelöst. PPD (Tuberculin GT) Chiron Behring Staphylokokken Enterotoxin B Sigma-Aldrich Tetanus-Toxoid Chiron Behring 2.2 Methoden 2.2.1 Isolierung peripherer mononukleärer Zellen mithilfe eines Ficoll-HypaqueDichte-Gradienten Buffy-Coat-Präparationen (Antikoagulanz: Natriumcitrat) wurden zu einem Endvolumen von 100 ml mit PBS verdünnt und jeweils 25 ml dieser Zellsuspension vorsichtig auf 15 ml Ficoll-Paque-Plus (1,077 g/ml) in 50 ml Schraubröhrchen geschichtet. Die 4 Röhrchen wurden für 30 Minuten (min) bei 1600 U/min ohne Bremse zentrifugiert. Dabei sammelten sich aggregierte Erythrozyten und Granulozyten in einem Pellet an, Lymphozyten, Monozyten und Thrombozyten bildeten eine Interphase zwischen Ficoll und Serum. Die Interphase wurde zusammen mit dem Serum abgenommen und auf zwei 50 ml Schraubröhrchen verteilt. Diese wurden für 10 min bei 1800 U/min zentrifugiert, um die Zellen vom restlichen Ficoll-Paque-Plus zu befreien. Zur Entfernung der Thrombozyten folgten 10-minütige Waschschritte mit jeweils 20 ml Waschpuffer bei 1300 U/min, bei 1000 U/min und dreimal bei 800 U/min. Vor dem letzten Waschschritt wurden die Zellen aus beiden Röhrchen gepoolt und gezählt. Die auf diese Weise gewonnenen peripheren mononukleären Blutzellen (PBMZ) wurden auf eine Konzentration von 100×106 pro ml in Zellkulturmedium eingestellt. Die Zellzahl nach PBMZ-Isolierung wurde in der Neubauer-Zählkammer bestimmt. Gleichzeitig konnten durch das Verdünnen der Zellsuspension mit Trypanblau tote Zellen identifiziert werden. Da der Farbstoff die Zellmembran 14 Material und Methoden geschädigter Zellen penetriert, färbten sie sich blau an und wurden von der Zählung ausgeschlossen. 10 µl der Zellsuspension wurden mit 100 µl Trypanblau verdünnt und 10 µl der Mischung zwischen Kammer und Deckglas pipettiert. Unter dem Mikroskop wurden 4 große Felder ausgezählt und der Mittelwert bestimmt. Ein großes Feld enthält ein Volumen von 0,1 µl, so dass sich die Zellzahl pro ml Flüssigkeit durch die Multiplikation mit 11×104 errechnet. 2.2.2 Isolierung von NK-Zellen Die NK-Zell-Isolierung erfolgte aus frisch isolierten PBMZ mithilfe des Miltenyi NK Cell Isolation Kit II entsprechend den Angaben des Herstellers: 100×106 PBMZ wurden in 100 µl MACS (Magnetic Activated Cell Sorting)-Puffer aufgenommen und mit 50 µl der biotinylierten Antikörper-Mischung gegen CD 3, CD 4, CD 14, CD 15, CD 19, CD 36, CD 123 und Glycophorin A im Dunkeln auf Eis inkubiert. Nach 30 min wurden die PBMZ mit 150 µl MACS-Puffer resuspendiert und der Zweitantikörper, 100 µl Fe2+-haltige anti–Biotin-Mikrobeads, dazu gegeben. Weitere 30 min später wurden die nicht gebundenen Antikörper und Mikrobeads durch einen 10-minütigen Waschschritt bei 1300 U/min entfernt und die Zellsuspension in 500 µl MACS-Puffer aufgenommen. Die Antikörper-markierten PBMZ wurden durch eine Säule in einem magnetischen Feld geschickt und 2 × mit jeweils 500 µl MACS-Puffer gespült. Antikörper-markierte Zellen blieben in der Säule hängen während NK-Zellen die Säule passierten, da sie keine der oben genannten Rezeptoren auf ihrer Oberfläche tragen (Abb. 2). Die NK-Zellen wurden gezählt, in Zellkulturmedium aufgenommen und im DurchflussZytometer auf ihre Reinheit kontrolliert. 15 Material und Methoden PBMZ E< D Markierung mit biotinylierten Antikörpern und Fe2+-haltigen anti– Biotin-Mikrobeads d D d E< E<d E<d d D Fe+-markierte Zellen bleiben in der Magnetsäule hängen E< Magnet E<d d E< E< E< Abbildung 2: Aufreinigung von NK-Zellen aus PBMZ. Mit Ausnahme der NK-Zellen werden PBMZ mit Fe+-Kügelchen konjugiert. Die markierten Zellen bleiben aufgrund des Magnetfeldes in der Säule hängen. NK-Zellen passieren die Säule und werden in einem Röhrchen aufgefangen. B: B-Zelle; M: Monozyt; NK: Natürliche Killer-Zelle; NKT: Natürliche Killer-T-Zelle; PBMZ: mononukleäre Zellen aus dem peripheren Blut; T: T-Zelle 2.2.3 Generierung dendritischer Zellen Unmittelbar nach der PBMZ-Isolierung wurden 7×106 PBMZ in kleinen Kulturflasche in Zellkulturmedium inkubiert. Dies führt zu einer selektiven Adhärenz von Monozyten, während Lymphozyten in Suspension bleiben. Nach 1 h wurden die PBMZ abgenommen und bis zur Verwendung am nächsten Tag in kleinen Kulturflaschen im Brutschrank inkubiert. Durch dreimaliges Waschen mit PBS wurden die restlichen nicht adhärenten PBMZ entfernt. Die verbliebenen Monozyten wurden für 24 Stunden in Zellkulturmedium mit GM-CSF (100 ng/ml) und IL-4 (2,5 ng/ml) kultiviert. Dadurch entwickeln sich unreife dendritische Zellen, die mithilfe von Ethylendiamin-Tetraacetat (EDTA) (1 mM) 16 Material und Methoden abgelöst werden. Vor der Verwendung in Experimenten wurden die DZ mit 30 Gy bestrahlt. 2.2.4 Durchflusszytometrie Zur Detektion von Oberflächenantigenen wurden ca. 1-2×105 Zellen in 200 µl Puffer für die Durchflusszytometrie aufgenommen und mit Fluorochromgekoppelten Antikörpern für 30 min im Kühlschrank inkubiert. Mithilfe einer Titration wurde für jeden Antikörper die zu verwendende Menge ermittelt, die für ein optimales Fluoreszenzsignal erforderlich ist (Tabelle 1). Ungebundene Antikörper wurden durch Waschen mit 2 ml Puffer für die Durchflusszytometrie bei 1300 U/min entfernt. Die gefärbten Zellen wurden in 200 µl Puffer aufgenommen und 1×104 Zellen am Durchlusszytometer analysiert. Die Auswertung der Daten erfolgte mit dem Programm WinMDI 2.8 (Joe Trotter). Tabelle 1: Mengen verwendeter Antikörper CD: Cluster of Differentiation; FITC: Fluorescein-Isothiocyanat; MHC-II: Haupthistokompatibilitätskomplex-Klasse-II-Molekül; PE: Phycoerythrin; PerCP: Peridinin Chlorophyll Protein. Antikörper CD3 CD56 MHC-II Fluorochrom PerCP PE FITC M enge 3µl 5µl 1µl 2.2.5 Proliferationsmessung Zum Nachweis der Zellproliferation wurde eine CFSE (Carboxyfluoreszein Succinimidyl Ester)-Verdünnungstest durchgeführt. CFSE ist ein fluoreszierender Farbstoff, welcher passiv die Zellmembran permeiert und intrazellulär stabil an Proteine bindet. Bei jeder Zellteilung wird der Farbstoff gleichmäßig auf beide Tochterzellen verteilt, so dass die Farbstoffmenge pro Zelle bei fortwährenden Zellteilungen immer geringer wird. Die Verdünnung von CFSE und die damit 17 Material und Methoden verbundene Abnahme der Fluoreszensintensität kann als Indikator von Zellteilungen mit dem Durchflusszytometer detektiert werden (Lyons et al. 1994) Für die CFSE-Färbung wurden 1-2×106 Zellen in 500 µl CFSE-Waschpuffer aufgenommen und für 10 min im 37°C warmen Wasserbad mit dem Farbstoff inkubiert. Nach zwei Waschschritten mit CFSE-Waschpuffer bei 1300 U/min wurden die Zellen in Zellkulturmedium aufgenommen und stimuliert. Nach 6tägiger Inkubation im Brutschrank bei 37°C und 5% CO2 wurde die Intensität der CFSE-Färbung als Maß für die Proliferation der Zellen mit dem Durchflusszytometer analysiert. Zellen, die sich nicht geteilt hatten, besaßen noch die ursprüngliche Farbstoffmenge und waren CFSE-positiv. In proliferierten Zellen hatte sich der Farbstoff verdünnt, weshalb sie als CFSE-negativ bezeichnet wurden. Zur Charakterisierung der proliferierten Zellen wurden die Oberflächenantigene der PBMZ im Anschluss an die 6-tägige Stimulation gefärbt. Die bereits CFSEmarkierten Zellen wurden in Röhrchen für die Durchflusszytometrie überführt und nach einem Waschschritt mit anti-CD3- und anti-CD56-Antikörpern im Kühlschrank inkubiert. Anschließend wurden die Zellen noch einmal bei 1300 U/min für 10 min gewaschen und am Durchflusszytometer analysiert. Durch dieses Vorgehen konnte die Expression von CD3, CD56 und die CFSE-Intensität gleichzeitig auf Einzelzellebene überprüft werden. 18 Material und Methoden PBMZ E< d D Zellanalyse mit dem Durchflusszytometer E<d nur Zellen aus R1 SSC + CFSE unstimuliert E<d D E<d D d E< Inkubation für 6 Tage im Brutschrank ϯϳΣ E< d 10 min Wasserbad + Antigen PPD E<d D d E< FSC Zϭ FSC CFSE SSC FSC R1 FSC StreulichtDotplot proliferierte Zellen CFSE FluoreszensDotplot Abbildung 3: Prinzip des CFSE-Verdünnungstests. PBMZ werden mit dem Farbstoff CFSE gefärbt und anschließend unstimuliert oder mit dem Antigen PPD im Brutschrank inkubiert. Nach 6 Tagen erfolgt die Proliferationsmessung mit dem Durchflusszytometer. (A) In dieser Abbildung sind die Dotplots unstimulierter Lymphozyten dargestellt. Die Lymphozyten haben sich nicht geteilt, was durch die homogenen CFSE-positiven Zellpopulationen, sowohl im StreulichtDotplot als auch im Fluoreszenz-Dotplot erkenntlich wird. (B) In dieser Abbildung ist die Proliferation der PBMZ infolge von PPD-Stimulation dargestellt. Sowohl im Streulicht-Dotplot als auch im Fluoreszenz-Dotplot erkennt man ruhende, CFSE-positive und proliferierte CFSEnegative Lymphozyten. B: B-Zelle; CFSE: Carboxyfluoreszein Succinimidyl Ester; FSC: Forward Scatter; M: Monozyt; NK: Natürliche Killer-Zelle; NKT: Natürliche Killer-T-Zelle; PBMZ: mononukläre Zellen aus dem peripheren Blut; PPD: Purified Proteine Derivative; R1: Region 1; SSC: Sideward Scatter; T: T-Zelle 2.2.6 Kultur in Transwellplatten Zur Untersuchung, ob die Aktivierung von Zellen über lösliche Faktoren oder Zell-Zell-Kontakt vermittelt wird, wurden Transwell-Systeme etabliert. Wir verwendeten ein Transwell-System aus einer 24-Well-Platte, in welche kleine Einsätze (Transwells) mit semipermeablen Böden eingehängt wurden (Abb. 4). Die Zellen im unteren Well und Transwell kommunizieren nur über lösliche Faktoren, da Zell-Zell-Kontakt durch die Membran der Porengröße von 0,4 µm verhindert wird. Es wurden 6×105 PBMZ und 2×105 DZ pro Well in 400 µl Zellkulturmedium kultiviert. Je nach Versuchsansatz erfolgte die Stimulation mit Purified Proteine Derivative (PPD) (10 µg/ml) oder neutralisierende Antikörper gegen Zytokine. In 19 Material und Methoden die Transwelleinsätze wurden 2×105 NK-Zellen in 200 µl Zellkulturmedium pipettiert. Nach 6 Tagen wurden sowohl die PBMZ des unteren Kompartiments als auch die NK-Zellen des oberen Kompartiments am Durchflusszytometer analysiert. NK-Zellen E< lösliche E< E< E< E< Moleküle? d d WW d E< d semipermeable Membran PBMZ + unreife DZ + PPD Abbildung 4: Kultivierung von Zellen in Transwellplatten. sind von den NK-Zellen der oberen Kammer durch PBMZ der unteren Kammer eine semiper meable Me mbran getrennt. Kommunikati on kann lediglich über lösliche Faktoren, nicht jed och über Zell Zell-Kontakt erfolgen. DZ: Dendritische Zelle; NK: Natürliche Killer-Zelle; PBMZ: mononukleäre Zellen aus dem peripheren Blut; PPD: Purified Protein Derivative. 2.2.7 Statistische Auswertung Die Daten der Balkendiagramme wurden als Mittelwerte ± Standardabweichung dargestellt. Einzelne Daten wurden als repräsentative Resultate den Diagrammen vorangestellt. Zur Bestimmung der statistischen Signifikanz p zwischen zwei unterschiedlich behandelten Kulturen, wurde der Student´s t Test angewandt. Die Unterschiede wurden als signifikant betrachtet wenn p≤0,05 (*), sehr signifikant wenn p≤0,01 (**) und hoch signifikant wenn p≤0,001 (***). 20 Ergebnisse 3. Ergebnisse 3.1 Identifikation von proliferierenden Natürlichen Killerzellen T-Lymphozyten expandieren klonal, wenn sie mit ihrem spezifischen Antigen stimuliert werden. Um zu klären, ob neben T-Lymphozyten auch NK-Zellen proliferieren, wurde ein CFSE-Verdünnungstest mit frisch isolierten PBMZ etabliert. Anschließend wurden die proliferierten Zellen phänotypisch charakterisiert. 3.1.1 Optimierung des CFSE-Verdünnungstests für primäre humane Blutzellen 3.1.1.1 Konzentration des Fluorochroms PBMZ wurden mit dem fluoreszierenden Farbstoff CFSE gefärbt und für 6 Tage mit Extrakt von Mycobacterium tuberculosis (MTB-Extrakt) stimuliert. Bei proliferierten Zellen halbiert sich der Farbstoff bei jeder Zellteilung und die Abnahme der Fluoreszensintensität wird am Durchlusszytometer detektiert. Die CFSE-Konzentration von 1 µM führte zu einem starken Fluoreszenzsignal, so dass die Grenzen der gefärbten Zellpopulation nicht dargestellt werden konnten (Abb.5A). Um zwischen ruhenden und sich teilenden Zellen zu unterscheiden, ist die Darstellung der gesamten Zellpopulation notwendig. Daher wurde die CFSEKonzentration im folgenden Experiment auf 0,5 µM halbiert. Dadurch verringerte sich die Fluoreszenzintensität der Zellen, die daraufhin besser abgrenzbar und beurteilbar wurden (Abb. 5B). In nachfolgenden Experimenten wurde daher eine CFSE-Konzentration von 0,5 µM verwendet. 21 Ergebnisse A CFSE: 1µM B 2% CFSE: 0,5µM 5% FSC FSC CFSE CFSE Abbildung 5: Einfluss der CFSE-Konzentration auf die Färbeintensität. 2×106 PBMZ wurden in einer 24-Well-Platte in einem Volumen von 400µl mit dem Antigen MTBExtrakt (10µg/ml) stimuliert. An Tag 6 wurden 1×104 Zellen am Durchflusszytometer hinsichtlich der Proliferation analysiert. (A) Zur Färbung wurde eine CFSE-Konzentration von 1µM verwendet. (B) Zur Färbung wurde eine CFSE-Konzentration von 0,5µM verwendet. CFSE: Carboxyfluoreszein Succinimidyl Ester; FSC: Forward Scatter; MTB-Extrakt: Extrakt von Mycobacterium tuberculosis; PBMZ: mononukleäre Zellen aus dem peripheren Blut. 3.1.1.2 Konzentration der Lymphozyten Um den Anteil der proliferierenden Zellen (Abb. 5) zu vergrößern, wurde die Zellkonzentration verändert. Dazu wurden anstatt 2×106 PBMZ in einer 24-WellPlatte 1,5×105 PBMZ in einer 96-Well-Rundbodenplatte kultiviert, wodurch sich die Zellzahl von 1×104 pro mm2 auf 1,4×103 Zellen pro mm2 verringerte. Beide Ansätze wurden mit PPD stimuliert und die Proliferation am Durchflusszytometer an Tag 6 gemessen. In 6 voneinander unabhängigen Experimenten wurde eine Steigerung der Proliferation von durchschnittlich 13% auf 27% (p=0,03) erreicht (Abb. 6). Die Identifikation von Subpopulationen innerhalb proliferierender Zellen wird durch eine hohe Teilungsrate erleichtert, so dass die nachfolgenden Experimente stets mit einer Konzentration von 1,4×103 Zellen pro mm2 in einer 96-Well-Rundbodenplatte durchgeführt wurden. 22 Ergebnisse A 1×104 Zellen/mm2 B 9% 1,4×103 Zellen/mm2 29% FSC FSC CFSE CFSE Abbildung 6: Einfluss der Zellkonzentration auf die Proliferation. Nach einer 6tägigen Stimulation mit PPD (10µg/ml) wurden 1×104 PBMC mit dem Durchflusszytometer hinsichtlich ihrer Proliferation analysiert. (A) Der Dotplot zeigt das Ergebnis der Proliferationsmessung, wenn 1×104 Zellen/mm2 in einer 24-Well-Platte inkubiert werden. (B) Der Dotplot zeigt das Ergebnis der Proliferationsmessung, wenn 1,4×103 Zellen/mm2 in einer 96-Well-Rundbodenplatte inkubiert werden. Die Abbildung zeigt ein repräsentatives Experiment von 6 mit ähnlichem Ergebnis. CFSE: Carboxyfluoreszein Succinimidyl Ester; FSC: Forward Scatter; PBMC: mononukleäre Zellen aus dem peripheren Blut; PPD: Purified Protein Derivative. 3.1.1.3 Auswahl eines Stimulus zur Induktion der Lymphozytenproliferation Um die Proliferation von NK-Zellen und T-Zellen zu untersuchen, musste ein Stimulans gefunden werden, welches zuverlässig zu einer T-Zell-Aktivierung führt. Die Proliferation von T-Zellen lässt sich durch folgende Substanzen induzieren: 1. Interleukine (z.B. IL-2) vermitteln eine antigenunabhängige Proliferation über Zytokinrezeptoren. 2. Mikrobielle Antigene (MTB-Extrakt, PPD) werden von APZ präsentiert und lösen eine MHC-restringierte T-Zell-Proliferation aus. 3. Superantigene (z.B. Staphylokkoken-Enterotoxin-B (SEB)) führen zur antigenunabhängigen Aktivierung aller T-Zellen, deren TZR aus einer bestimmten Vβ - Kette besteht. Ein geeignetes Stimulans wurde ermittelt, indem CFSE-gefärbte PBMZ mit IL-2, PPD oder SEB inkubiert wurden. An Tag 6 erfolgte die Proliferationsmessung am Durchflusszytometer. Es wurde eine antigenunabhängige Proliferation von 29% auf die Stimulation mit IL-2 bzw. 65% auf die Stimulation mit SEB, sowie eine 23 Ergebnisse antigenspezifische Proliferation auf PPD von 11% beobachtet (Abb. 7). In 4 voneinander unabhängigen Experimenten zeigte sich eine durchschnittliche Proliferation von 29% (IL-2), 69% (SEB) und 8% (PPD). Die Inkubation in Zellkulturmedium alleine diente als Negativkontrolle und induzierte keine Aktivierung. Erwartungsgemäß war SEB ein besserer Stimulus als das mikrobielle Antigen PPD. Diese Ergebnisse unterstreichen die Validität der Methode, da sie eine vergleichende Analyse verschiedener Stimulatoren erlaubt. unstimuliert PPD IL-2 0,1% CFSE CFSE FSC FSC FSC 65% 11% 29% FSC SEB CFSE CFSE Abbildung 7: Aktivierung von PBMC durch unterschiedlichen Stimulanzien. Jeweils 1,5×105 PBMC wurden in einer 96-Well-Rundbodenplatte mit IL-2 (1000 U/ml), PPD (10µg/ml) und SEB (5µg/ml) stimuliert. An Tag 6 wurde die Proliferation von 1×104 je Ansatz mit dem Durchflusszytometer untersucht. Die Abbildung zeigt ein repräsentatives Experiment von 4 mit ähnlichem Ergebnis. CFSE: Carboxyfluoreszein Succinimidyl Ester; FSC: Forward Scatter; IL-2: Interleukin-2; MTB-Extrakt: Extrakt von Mycobacterium tuberculosis; PBMC: mononukleäre Zellen aus dem peripheren Blut; PPD: Purified Protein Derivative; SEB: Staphylokokken-Enterotoxin-B Als Stimulans für alle folgenden Versuche wurde das Antigen PPD ausgewählt, da die NK-Zell-Proliferation im Zusammenhang mit der antigenspezifischen TZell-Aktivierung untersucht werden sollte. 3.1.1.4 Bedeutung von DZ für die Lymphozytenproliferation Um die NK-Zell-Proliferation zu untersuchen ist eine ausgeprägte T-ZellAktivierung erforderlich. Zur Optimierung der T-Zell-Aktivierung wurden PBMZ zusammen mit unreifen DZ inkubiert. DZ sind sehr potente APZ und stimulieren nicht nur den TZR, sondern liefern über die CD80/CD28-Interaktion 24 Ergebnisse kostimulatorische Signale, wodurch die T-Zell-Aktivierung entscheidend verstärkt wird. Um DZ zu gewinnen wurden Monozyten aus PBMZ isoliert und separat mit IL-4 und GM-CSF zu unreifen DZ stimuliert. Nach 24 h wurden die differenzierten unreifen DZ wieder mit den verbliebenen PBMZ kokultiviert und mit PPD stimuliert. Um die T-Zell-Aktivierung von Monozyten und DZ miteinander zu vergleichen, wurden PBMZ mit und ohne Zugabe von DZ mit verschiedenen Antigenen stimuliert und die Proliferation nach 6 Tagen gemessen. Pro Ansatz wurden 1,5×105 PBMZ alleine oder 1×105 PBMZ zusammen mit 3×104 bestrahlten unreifen DZ in einer 96- Well-Rundbodenplatte inkubiert. Für diese Versuche wurden unterschiedliche Antigene ausgewählt. Zur Stimulation verwendeten wir PPD, MTB-Extrakt, Totallipid und Tetanus-Toxoid (TT). PPD ist ein Peptidantigen, welches aus den wasserlöslichen Fraktionen von Mycobakterium avis bzw. Mycobakterium bovis gewonnen wird. MTB-Extrakt ist ebenfalls ein Peptidantigen und besteht aus den Eiweissbestandteilen von M.tb. Eine Proliferationsreaktion auf diese Peptidantigene wird in Spendern erwartet, die bereits Kontakt mit Mykobakterien hatten, so dass sich Gedächtniszellen bilden konnten. Ein immunologisches Gedächtnis wird sowohl durch eine Infektion mit „typischen“ oder „atypischen“ Mykobakterien als auch nach früherer Tuberkulose-Schutzimpfung mit Bacille Calmette-Guérin induziert. Dagegen besteht Totallipid ausschliesslich aus freien Lipiden, die aus Mykobakterien-Lysaten durch Chloroform-Mathanol gewonnen wurden. Bisher ist noch nicht abschliessend geklärt, ob die Immunantwort gegen M. tb auch die Reaktion auf Lipide beinhaltet. TT ist ein Peptid, welches als Impfantigen gegen Clostridium tetani verwendet wird. Daher verfügen die meisten Spender über TTspezifische Gedächtniszellen, so dass nach Stimulation mit TT eine Proliferation in den meisten Proben zu erwarten ist. Im CFSE-Verdünnungstest zeigte sich nach 6-tägiger Inkubation, dass DZ in allen Ansätzen zu einer signifikanten Proliferationssteigerung im Vergleich zu nicht DZ-exponierten PBMZ führten (Abb.8). In 6 voneinander unabhängigen 25 Ergebnisse Experimenten stieg der Anteil proliferierter Zellen nach MTB-Extrakt-Stimulation von 14% auf 33% (p=0,03) und nach Totallipid-Stimulation von 3% auf 16% (p=0,02). Durch die Kokultur mit DZ erhöhte sich die Proliferation nach PPDStimulation von 5% auf 27% (p=0,007). Auch die Stimulation auf das Antigen TT hob die Proliferation in Anwesenheit von DZ von 5% auf 12% an (p=0,047). Daraus folgt, dass DZ unabhängig vom Antigen sehr gute APZ sind. unstimuliert 0% A B FSC TT PPD Totallipid MTB 24% 10% 2% 1% 51% 36% 41% 23% + DZ CFSE In diesem Experiment wurde die Proliferation von PBMZ alleine mit der Proliferation von PBMZ zusammen mit DZ auf die Stimulation mit unterschiedlichen Antigenen verglichen. Nach 6-tägiger Inkubation wurden je Ansatz 1×104 Zellen am Durchflusszytometer analysiert. (A) Diese 5 Dotplots zeigen die Ergebnisse der Proliferationsmessung, wenn PBMZ mit MTB-Extrakt (10µg/ml), Totallipid (10µg/ml), PPD (10µg/ml) und TT (10µg/ml) stimuliert werden. (B) Diese Dotplots zeigen die Ergebnisse der Proliferationsmessung wenn PBMZ zusammen mit DZ mit oben genannten Antigenen inkubiert werden. Die Abbildung zeigt ein repräsentatives Experiment von 6 mit ähnlichem Ergebnis. Abbildung 8: Bedeutung von DZ auf die Lymphozytenproliferation: CFSE: Carboxyfluoreszein Succinimidyl Ester; DZ: Dendritische Zellen; FSC: Forward Scatter; MTB: Extrakt von Mycobacterium tuberculosis; PBMZ: mononukleäre Zellen aus dem peripheren Blut; PPD: Purified Proteine Derivative; TT: Tetanustoxoid. Auf Basis dieser Versuche, wurden für die nächsten Experimente folgende Standardbedingungen definiert: 1. Zur Zellfärbung wurde eine 0,5 µM CFSE-Lösung verwendet. 2. Die Inkubation der PBMZ mit DZ erfolgte in einer 96-Well- Rundbodenplatte. 3. Zur Stimulation wurde das mykobakterielle Antigen PPD verwendet. 4. PBMZ wurden im Verhältnis 1:0,3 mit DZ kokultiviert. 26 Ergebnisse Mit diesem standardisierten Versuchsaufbau wurde in 18 voneinander unabhängigen Experimenten die PPD-spezifische Proliferation nachgewiesen. Durchschnittlich proliferierten 25% ± 9,15% (p< 0,001) der PPD-stimulierten PBMZ (Abb.9B). PPD Medium A 23й 0,7% FSC FSC CFSE B CFSE ΎΎΎ 40 35 30 25 20 15 10 5 0 Medium PPD Abbildung 9: PPD-spezifische Lymphozytenproliferation nach Standardisierung der5 Bedingungen. Als Standardbedingung für alle weiteren Experimente gelten: 1×10 4 PBMZ und 3×10 unreife bestrahlte DZ wurden mit PPD (10µg/ml) inkubiert. Nach 6 Tagen erfolgte die Analyse von 1×104 Zellen am Durchflusszytometer. Als Negativkontrolle diente die Inkubation in Medium ohne Zusatz (A) Diese Abbildung zeigt ein repräsentatives Ergebnis, wenn PBMZ nach Standardbedingungen stimuliert werden. (B) In dieser Abbildung ist die durchschnittliche Proliferation(―) sowie die Einzelmessungen (●) der PPD-stimulierten Lymphozyten in 18 voneinander unabhängigen Experimenten dargestellt. CFSE: Carboxyfluoreszein Succinimidyl Ester; DZ: Dendritische Zellen; FSC: Forward Scatter; PBMZ: mononukleäre Zellen aus dem peripheren Blut; PPD: Purified Protein Derivative; ● : 1 Experiment; ― : Mittelwert; ***: hochsignifikantes Ergebnis 3.1.2 Phänotypische Charakterisierung proliferierender Zellen 27 Ergebnisse Nachdem eine valide Methode zur Messung der PPD-spezifischen Proliferation von PBMZ etabliert worden war, war das nächste Ziel die phänotypische Charakterisierung der aktivierten Zellen. Insbesondere sollten NK-Zellen und TZellen innerhalb der proliferierten Zellen anhand ihrer Oberflächenmarker identifiziert werden. PBMZ wurden mit CFSE gefärbt und 6 Tage mit PPD stimuliert. Anschließend wurden fluoreszierende Antikörper zur Darstellung des T-Zell-spezifischen CD3Rezeptors und des NK-Zell-spezifischen CD56-Rezeptors verwendet. Am Durchflusszytometer wurden die Proliferation (CFSE-Färbung) und die Oberflächenmarker simultan detektiert. Dazu wurde ein Fenster auf die proliferierten CFSE-niedrigen Zellen gelegt und die ausgewählten Zellen anhand ihrer Oberflächenmarker dargestellt. Es zeigte sich, dass von den proliferierten Zellen 60% T-Zellen, 26% NK-Zellen und 7% NKT-Zellen waren (Abb. 10). A B PPD nur Zellen aus R1 T-Zellen 60% 26% NKT-Zellen 7% CD3 FSC Rϭ NK-Zellen 26% CD56 CFSE Abbildung 10: Charakterisierung der proliferierten Zellen innerhalb der PBMZ. PBMZ wurden für 6 Tage mit PPD stimuliert und anschließend sowohl die Proliferation als auch die Oberflächenmarker der proliferierten Lymphozyten bestimmt. Dazu wurden 1×104 Zellen am Durchflusszytometer analysiert. (A) In diesem Dotplot wurde ein Fenster auf die proliferierten PBMZ gelegt. Die proliferierten Lymphozyten stellen sich somit in der Region 1 (R1) dar. (B) Der Dotplot zeigt nur die proliferierten Zellen aus R1. Zusätzlich werden die einzelnen Lymphozytenpopulationen anhand einer CD3/CD56-Oberflächenfärbung identifiziert. Die Abbildung zeigt ein Experiment von 10 mit vergleichbarem Ergebnis. CD: Cluster of differentiation; CFSE: Carboxyfluoreszein Succinimidyl Ester; FSC: Forward Scatter; NK: Natürliche Killer-Zelle; NKT: Natürliche Killer-T-Zelle; PBMZ: mononukleäre Zellen aus dem peripheren Blut; R1: Region 1; SSC: Sideward Scatter; T: T-Zelle. 28 Ergebnisse Bei 10 unabhängigen Spendern wurden vergleichbare Ergebnisse erzielt: Tabelle 2: Durchschnittliche Proliferation der einzelnen Subpopulationen innerhalb der PBMZ mit Standardabweichung und Spannweite in 10 voneinander unabhängigen Experimenten. NK-Zellen: Natürliche Killerzellen; NKT-Zellen: Natürliche Killer T-Zellen; PBMZ: mononukleäre Zellen aus dem peripheren Blut Zellpopulation M ittelwert Standardabweichung Spanne T-Zellen 54% ±10% 35 bis 74% NK-Zellen 20% ±14% 5 bis 38% NKT-Zellen 13% ±10% 1 bis 42% Dieser Ausgangspunkt leitete zur Kernfrage der vorliegenden Arbeit: Was ist der Mechanismus hinter der NK-Zell-Aktivierung nach Stimulation von PBMZ mit mikrobiellen Antigenen? 3.2.3 Nachweis der Proliferation aufgereinigter NK-Zellen Zunächst wurde die Möglichkeit geprüft, dass NK-Zellen direkt durch PPD aktiviert werden. Eine Aktivierung könnte z.B. über die Bindung an TLR oder bisher unbekannte Mechanismen erfolgen. Deshalb wurden aufgereinigte NKZellen mit PPD inkubiert und die Proliferation im CFSE-Verdünnungstest bestimmt. Voraussetzung für dieses Experiment war die Isolation von NK-Zellen aus PBMZ. 3.2.3.1 Anreicherung der NK-Zellen Ziel der NK-Zell-Isolierung war es, eine aufgereinigte CD56-positive Population mit einem sehr hohen NK-Zell-Anteil zu gewinnen. Gleichzeitig sollte der Anteil an CD3-positiven Zellen äusserst gering sein, um eine mögliche Reaktion auf die Aktivität von NK-Zellen und nicht auf T-Zell-Verunreinigungen zurückführen zu können. Dazu wurden alle Zellen der PBMZ - abgesehen der NK-Zellen - mit Fe2+ 29 Ergebnisse haltigen Antikörpern markiert. Durch die Passage durch ein Magnetfeld gelang die Separation von Antikörper-markierten Zellen und NK-Zellen. Vor der NKZell-Depletion wurde die Ausgangspopulation der PBMZ mit dem Durchflusszytometer auf ihren NK-Zell-Anteil untersucht. Dieser betrug in 43 voneinander unabhängigen Experimenten durchschnittlich 9% (Abb. 11A). Die durchflusszytometrische Untersuchung nach der NK-Zell-Aufreinigung zeigte einen durchschnittlichen NK-Zell-Anteil von 91% (Abb. 11B). Der Anteil an TZellen in der aufgereinigten Population war vernachlässigbar (<0,5%). Mit diesem Verfahren konnte zuverlässig eine für unsere Zwecke ausreichend reine NK-ZellPopulation gewonnen werden. 30 Ergebnisse PBMZ vor NK-ZellAufreinigung A CD3 aufgereinigte NK-Zellen CD3 11,7% CD56 CD56 C 94,2% 100 % ni ne lle -ZK N 80 60 40 20 0 vor Aufreinigung nach Aufreinigung Abbildung 11: Reinheit der NK-Zellen nach Aufreinigung. Aus 100×106 PBMZ wurden durch magnetische Aufreinigung NK-Zellen isoliert. (A) In diesem Dotplot werden PBMZ vor der Aufreinigung auf ihre Zellzusammensetzung analyisert. NK-Zellen sind CD56positiv, T-Zellen CD3-positiv und NKT-Zellen CD3- und CD56-positiv. (B) Hier ist die NK-Zell-Ausbeute nach magnetischer Aufreinigung eines repräsentiativen Spenders dargestellt. (C) Die Abbildung zeigt den durchschnittlichen NK-Zell-Anteil vor und nach Aufreinigung in 43 voneinander unabhängigen Experimenten mit Darstellung des Standardfehlers. CD: Cluster of differentiation; NK-Zellen: Natürliche Killerzellen; PBMZ: mononukleäre Zellen aus dem peripheren Blut. 3.1.3.2 Einfluss von PPD auf die Proliferation der NK-Zellen Aufgereinigte NK-Zellen sind in vitro schwierig zu kultivieren. Falsch negative Messergebnisse als Folge von absterbenden NK-Zellen, mussten daher durch eine Positivkontrolle ausgeschlossen werden. Dazu eignet sich das proliferativ wirksame Zytokin IL-2. Die optimale IL-2-Konzentration, wurde durch eine Titration ermittelt (Abb. 12). 31 Ergebnisse A IL-2 (100 U/ml) 42% unstimuliert 1,2% IL-2 (1000 U/mlͿ 54% IL-2 (10.000 U/ml) 58% FSC CFSE B 80 % in 60 n ell eZ K 40 N et re ir efi 20 lo rp 0 Ύ ΎΎΎ 0 100 U/ml 1000 U/ml 10.000 U/ml Abbildung 12: Einfluss der IL-2-Konzentration auf die NK-Zell-Proliferation. CFSEgefärbte NK-Zellen wurden mit IL-2 Konzentrationen von 100 - 10.000 U/ml stimuliert und die Proliferation nach 6 Tagen durchflusszytometrisch ermittelt. (A) Darstellung der NK-Zell-Proliferation auf unterschiedliche IL-2-Konzentrationen von einem repräsentativen Experiment (B) Durchschnittliche NK-Zell-Proliferation auf unterschiedliche IL-2 –Konzentration in 4 voneinander unabhängigen Experimenten. CFSE: Carboxyfluoreszein Succinimidyl Ester; FSC: Forward Scatter; IL-2: Interleukin-2; NK-Zellen: Natürliche Killerzellen; *:signifikantes Ergebnis; ***: hochsignifikantes Ergebnis. CFSE-gefärbte NK-Zellen wurden mit IL-2-Konzentrationen von 100 U/ml bis 10.000 U/ml stimuliert. Die Ergebnisse zeigen eine signifikante Steigerung der NK-Zell-Proliferation bei Erhöhung der IL-2-Konzentration auf 100 U/ml (p=0,008) und 1000 U/ml (p=0,01). Eine weitere Steigerung der Konzentration bis auf 10.000 U/ml IL-2 hatte keinen zusätzlichen Effekt. Daher wurde in nachfolgenden Experimenten die Positivkontrolle mit einer IL-2-Konzentration von 1000 U/ml durchgeführt. Um jetzt den Effekt von PPD auf aufgereinigte NK-Zellen zu untersuchen, wurden CFSE-gefärbte NK-Zellen mit PPD (10µg/ml) inkubiert. Nach 6 Tagen wurde die CFSE-Verdünnung am Durchflusszytometer untersucht. Die Auswertung zeigte, 32 Ergebnisse dass NK-Zellen durch PPD alleine nicht proliferieren (Abb. 13). Somit wurde eine direkte Aktivierung der NK-Zellen durch PPD ausgeschlossen. A Medium IL-2 PPD 24% FSC FSC CFSE B FSC CFSE ΎΎ 30 % n i 25 n ell eZ 20 K 15 N et re 10 ir efi lo 5 rp 0 CFSE Medium IL-2 PPD Abbildung 13: Einfluss von PPD auf die NK-Zell-Proliferation. 1×105 CFSE-gefärbte NK-Zellen wurden mit PPD stimuliert und die Proliferation an Tag 6 gemessen. Als Negativkontrolle diente die Inkubation in Medium, als Positivkontrolle wurden die Zellen mit IL-2 stimuliert. (A) Die Abbildung zeigt die NK-Zell-Proliferation nach Stimulation mit PPD und IL-2 in einem repräsentativen Experiment. (B) Durchschnittliche NK-ZellProliferation in 3 voneinander unabhängigen Experimenten mit Darstellung des Standardfehlers. CFSE: Carboxyfluoreszein Succinimidyl Ester; FSC: Forward Scatter; IL-2: Interleukin-2; PPD: Purified Protein Derivative; n: Anzahl der Experimente; ** : sehr signifikantes Ergebnis. 3.2 Mechanismus der NK-Zell-Aktivierung Wir entwickelten 3 Hypothesen, die eine NK-Zell-Aktivierung innerhalb der PBMZ erklären könnten: 33 Ergebnisse 1. Während der Aktivierung der PBMZ durch PPD kommt es zur Freisetzung löslicher Faktoren, welche die Proliferation induzieren. 2. Direkte Zell-Zell-Kontakte zwischen PBMZ oder DZ und NK-Zellen bewirken die Aktivierung. 3. Sowohl lösliche Faktoren als auch Zell-Zell-Kontakte sind erforderlich, um NK-Zellen zu aktivieren. 3.2.1 Rolle löslicher Faktoren für die NK-Zell-Proliferation Um zu klären, ob lösliche Faktoren die NK-Zell-Proliferation verursachen, wurde ein Transwell-System verwendet (Abb. 14A). Die Kultivierung von PPDstimulierten DZ mit PBMZ und NK-Zellen erfolgte im selben Nährmedium, aber durch eine semipermeable Membran voneinander getrennt. Auf diese Weise interagieren die Zellen ausschließlich über lösliche Faktoren und nicht über ZellZell-Kontakt. Sowohl PBMZ in der unteren Kammer als auch NK-Zellen im Transwell wurden mit CFSE gefärbt und die Proliferation nach 6 Tagen gemessen. Es proliferierten 27% der PBMZ (Abb.14B) und 34% der NK-Zellen (Abb.14C). Diese Beobachtung wurde in 7 voneinander unabhängigen Experimenten bestätigt. Durchschnittlich proliferierten 16% der PBMZ und 31% der NK-Zellen (Abb.14D). 34 Ergebnisse NK-Zellen aus dem Transwell B FSC NK-Zellen A lösliche Moleküle? E< E< D E< WW d Tag 6 Messung ĚĞƌ Proliferation E< E< E< 34% d semipermeable Membran PBMZ + DZ + PPD CFSE C PBMZ der unteren Kammer 27% FSC CFSE 40 % n i 35 n lel 30 eZ 25 ter 20 ei re 15 ifl or 10 p 5 0 NK-Zellen aus dem Transwell PBMZ PBL Abbildung 14: Einfluss aktivierter PBMZ auf die Proliferation der NK-Zellen: 5×105 CFSE-gefärbte PBMZ werden mit 1×105 DZ in einer 24-Well-Platte inkubiert und mit PPD stimuliert. In das Transwell darüber werden 2×105 CFSE-gefärbte NK-Zellen pipettiert, die durch eine semipermeable Membran von den PBMZ getrennt sind. Nach 6 Tagen werden sowohl die NK-Zellen aus dem Transwell als auch PBMZ der unteren Kammer auf ihre Proliferation mit dem Durchflusszytometer untersucht. (A) Schematischer Versuchsaufbau (B) Ergebnis der NK-Zell-Proliferation im Transwell (C) Ergebnis der PBMZ-Proliferation aus der unteren Kammer. (D) Durchschnittliche Proliferation von NK-Zellen und PBMZ in 7 voneinander unabhängigen Experimenten mit Angabe des Standardfehlers. B: B-Zelle; CFSE: Carboxyfluoreszein Succinimidyl Ester; DZ: Dendritische Zellen; FSC: Forward Scatter; NK, NK-Zellen: Natürliche Killerzellen; M: Monozyt; PBMZ: mononukleäre Zellen aus dem peripheren Blut; PPD: Purified Protein Derivative; T: T-Zelle ͘ 35 Ergebnisse Dies zeigt, dass die NK-Zell-Proliferation unabhängig von direktem Zell-ZellKontakt zu PBMZ stattfindet. Sie muss folglich durch lösliche Faktoren vermittelt werden. Unsere erste Hypothese wurde somit bestätigt und die Hypothesen 2 und 3 wurden verworfen. 3.2.2 Identifikation aktivierender Zytokine Um das lösliche Molekül zu identifizieren, welches die NK-Zell-Proliferation induziert, wurde eine Literatur-basierte Liste potentieller Kandidaten erstellt. Dabei fokussierten wir uns in erster Linie auf diejenigen Zytokine, die von antigenaktivierten PBMZ und DZ produziert werden: 1. Monokine wie TNF-α, IL-12 oder IL-15 2. TH1-Lymphokine wie IL-2 oder IFN-γ PBMZ wurden mit PPD aktiviert und in jedem Ansatz jeweils die Funktion der Zytokine durch neutralisierende Antikörper inhibiert. Anschließend wurde die Frequenz proliferierender Zellen gemessen. Um zunächst die inhibitorische Funktion der Antikörper zu prüfen, wurde exemplarisch die Wirkung des IFN-γ-Antikörpers auf die MHC-II-Expression der Monozyten untersucht. Monozyten wurden für 24 h entweder alleine, nur mit IFN-γ oder mit IFN-γ plus IFN-γ−Antikörper inkubiert und anschließend die Expression der MHC-Klasse-IIMoleküle auf der Oberfläche im Durchflusszytometer bestimmt. Im unstimulierten Ansatz exprimierten 39% der Monozyten MHC-II. Dieser Anteil erhöhte sich durch die IFN-γ-Behandlung auf 70% und reduzierte sich in Anwesenheit des IFN-γ-Antikörpers wieder auf 31% (Abb.15). Dies zeigte, dass IFN-γ-Antikörper die Funktion von IFN-γ zuverlässig inhibieren. 36 Ergebnisse Monozyten in R1 A SSC R1 FSC nur Zellen aus R1 unstimuliert B + IFN-γ 39% + IFN-γ + IFN-γ -Ak 70% 31% FSC MHC-II-Molekül-Expression Abbildung 15: Wirkung der IFN-γ -Antikörper auf die IFN-γ -vermittelte Hochregulation von MHC-II-Molekülen auf Monozyten. 5×105 PBMZ wurden in einer 24-Well-Platte für 24 h mit IFN- γ (10µg/ml) oder mit IFN- γ und IFN- γ-Antikörpern (10µg/ml) stimuliert. Als Negativkontrolle diente die Inkubation von PBMZ in Zellkulturmedium alleine. Anschließend wurde die MHC-II-Expression auf der Monozytenoberfläche mithilfe des Durchflusszytometers bestimmt. Dabei wurden jeweils 1×104 Zellen analysiert. (A) Auf die Monozyten innerhalb der PBMZ wird ein Fenster gelegt, so dass sich die Monozyten in Region 1 (R1) darstellen. (B) Nur die Monozyten und deren MHC-II-Molekül-Expression nach Stimulation mit IFN-γ sowie IFN-γ und IFNγ-Antikörper werden dargestellt. Die Abbildung zeigt ein repräsentives Experiment. FSC: Forward Scatter; IFN-γ: Interferon-gamma; IFN-γ -Ak: anti-Interferon-γ -Antikörper; MHC-II: Haupthistokompatibilitätskomplex-Klasse-II-Molekül; PBMZ: mononukleäre Zellen aus dem peripheren Blut; R1: Region 1; SSC: Sideward Scatter; 3.2.2.1 Einfluss von Zytokinen Dendritischer Zellen Als erstes untersuchten wir die Wirkung von Zytokinen, die von DZ sezerniert werden. Dazu wurden PBMZ in einer 96-Well-Rundbodenplatten mit PPD stimuliert und zu jedem Ansatz entweder ein Antikörper gegen TNF-α, IL-12 oder IL-15 gegeben. Um auszuschließen, dass IgG-Antikörper-Moleküle aktivierende Rezeptoren binden und somit die Proliferation beeinflussen, wurden IsotypAntikörper als Negativkontrolle verwendet. 37 Ergebnisse Die Inkubation mit den o.g. Zytokinantikörpern hatte keinen Effekt auf die PPDinduzierte Proliferation der PBMZ (Abb.16A). Im Gegenteil – die Inkubation mit den Zytokinantikörpern führte sogar zu einer geringen, aber signifikanten Steigerung der Proliferation. Die Proliferation der PPD-stimulierten PBMZ lag bei durchschnittlich 25%. In Anwesenheit des TNF-α-Antikörpers proliferierten 31%, mit dem IL-12-Antikörper 34% und mit dem IL-15-Antikörper 32% der stimulierten Zellen. Die Isotypkontrolle beeinflusste die Proliferation der PBMZ hingegen nicht. TNF-α, IL-12 und IL-15 schieden damit als Kandidaten für die Aktivierung von NK-Zellen aus. 38 Ergebnisse A PPD 29% PPD + IgG1 PPD + anti-TNF-α PPD + anti-IL-12 PPD + anti-IL-15 27% 30% 36% 36% FSC CFSE B ΎΎ ΎΎ 50 % in 40 n ell eZ 30 et re 20 ir efi lo 10 rp 0 ΎΎ ΎΎ Medium PPD PPD + IgG1 PPD + PPD + anti-TNF-α anti-IL-12 PPD + anti-IL-15 Abbildung 16: Einfluss der Zytokine Dendritischer Zellen auf die Proliferation. PBMZ werden mit PPD stimuliert und zu jedem Ansatz ein Zytokinantikörper gegeben. Auf diese Weise wird die Bedeutung der Zytokine TNF-α , IL-12 und IL-15 auf die Proliferation der PBMZ überprüft. Zur Kontrolle diente die Stimulation der PBMZ mit PPD alleine sowie mit PPD und dem Isotyp-Antikörper (IgG1). Nach 6 Tagen wurde die Proliferation mit dem Durchflusszytometer analysiert (A) Ergebnis der Proliferationsmessungen von PPD-stimulierten PBMZ im Gegenwart von Zytokinantikörpern eines repräsentativen Spenders (B) Durchschnittliche Proliferation der PBL ohne Stimulation, mit PPD, IgG1 und in Anwesenheit der Zytokinantikörper in 7 voneinander unabhängigen Experimenten. CFSE: Carboxyfluoreszein Succinimidyl Ester; FCS: Forward Scatter; IgG1: Immunglobulin G1, IL-12: Interleukin-12, IL-15: Interleukin-15; PBMZ: mononukleäre Zellen aus dem peripheren Blut; TNF-α: Tumornekrosefaktor-alpha. 3.2.2.2 Einfluss von T-Zell-Zytokinen Als nächstes testeten wir auf gleiche Weise die T-Zell-Zytokine IFN-γ und IL-2. Die Neutralisation von IFN-γ führte wie bei den DZ-Zytokinen zu einer signifikanten (p=0,005) Steigerung der Proliferation. 19% der PBMZ proliferierten nach Zugabe von PPD, während es in Gegenwart des IFN-γ-Antikörpers 30% (Abb. 17C) waren. 39 Ergebnisse Die Inkubation mit IL-2-Antikörpern resultierte hingegen in der nahezu vollständigen Hemmung der Proliferation (Abb. 17B). Daraus folgt, dass die Proliferation der PBMZ IL-2 abhängig ist. Der Anteil proliferierter Zellen wurde von durchschnittlich 14% auf 3,7% (p=0,01) gesenkt und entsprach damit beinahe dem Messwert unstimulierter PBMZ, der bei 2,9% lag. Die geringe Proliferation der PBMZ von durchschnittlich 14% (vgl. Abb.9, Abschnitt 3.1.1.4) ist mit der Verwendung einer 24-Well-Platte in diesem Versuch zu erklären. Durch diese Experimente wurde bewiesen, dass IL-2 die Proliferation von NKZellen nach Stimulation von PBMZ mit mikrobiellen Antigenen verursacht. 3.2.2.3 Die Rolle von IL-2 auf die Proliferation aufgereinigter NK-Zellen Die vorangegangenen Experimente hatten gezeigt, dass die Proliferation der PBMZ IL-2 vermittelt ist. Daraus wurde geschlossen, dass IL-2 auch für die NKZell-Proliferation verantwortlich ist. Abschließend sollte geprüft werden, ob eine NK-Zell-Proliferation im Transwell ohne IL-2 möglich ist. Dazu wurden PPDstimulierte PBMZ durch eine semipermeable Membran von NK-Zellen getrennt kultiviert. Zusätzlich wurden die PPD-stimulierten PBMZ mit IL-2-Antikörpern inkubiert (Abb. 18A). Um auszuschließen, dass NK-Zellen die 6-tägige Kultivierung in einem Transwell nicht überlebten, wurde als Positivkontrolle ein Ansatz mit IL-2 durchgeführt. Hierzu wurde die untere Kammer mit IL-2-haltigem Medium, das Transwell mit aufgereinigten NK-Zellen gefüllt. Die Analyse an Tag 6 zeigte eine NK-ZellProliferation von 52%, wodurch ein Absterben der NK-Zellen im Transwell ausgeschlossen wurde (Abb. 18B). Die Messung der Proliferation am Durchflusszytometer zeigte, dass weder PBMZ in der unteren Kammer noch NK-Zellen in der oberen Kammer in Anwesenheit von IL-2-Antikörpern proliferierten (Abb. 18A). 40 Ergebnisse A NK-Zellen +IL-2 NK-Zellen 52% FSC E< E< E< E< E< CFSE B E< anti-IL-2 C 0,2% NK-Zellen D E< E< E< E< WW d E< d Tag 6 Messung der Proliferation FSC PPD-stimulierte PBMZ ) % ( 40 W T im 30 no it ar efi 20 lo rP -l 10 eZ -K N 0 2,5% CFSE ΎΎ über PPD-stimulierten PBMZ über PPD-stimulierten PBMZ mit anti-IL-2 Abbildung 18: Einfluss von anti-IL-2-Antikörpern auf die NK-Zell-Proliferation. CFSE-gefärbte PBMZ werden in Gegenwart von IL-2-Antikörpern mit PPD stimuliert. Gleichzeitig werden CFSE-gefärbte NK-Zellen durch eine semipermeable Membran getrennt, im Transwell inkubiert. An Tag 6 werden die Proliferation der PBMZ und der NK-Zellen bestimmt. Als Positivkontrolle werden CFSE-gefärbte NK-Zellen im Transwell über einem IL-2-haltigen Medium inkubiert. (A) Proliferation der NK-Zellen im Transwell und IL-2-haltigem Medium. (B) Schematischer Versuchsaufbau sowie Ergebnisse der Proliferationsmessung von PBMZ und NK-Zellen eines repräsentativen Experiments. (C) Vergleich der NK-Zell-Proliferation über PPD-stimulierten PBMZ mit der NK-ZellProliferation über PPD-stimulierten PBMZ in Gegenwart von anti-IL-2-Antikörpern. Das Säulendiagramm zeigt die durchschnittliche Proliferation in 6 voneinander unabhängigen Experimenten mit Angabe des Standardfehlers (p=0,003). anti-IL-2: anti-Interleukin-2-Antikörper; B: B-Zelle; CFSE: Carboxyfluoreszein Succinimidyl Ester; DZ: Dendritische Zellen; FSC: Forward Scatter; IL-2: Interleukin-2; M: Monozyt; NK, NK-Zelle: Natürliche Killerzelle; PBMZ: mononukleäre Zellen aus dem peripheren Blut; PPD: Purified Protein Derivative; T: T-Zelle; TW: Transwell; **: sehr signifikantes Ergebnis 41 Ergebnisse In Anwesenheit der IL-2-Antikörper wurde die NK-Zell-Proliferation in 6 voneinander unabhängigen Experimenten von 31% auf 1,9% (Abb. 18C) reduziert, so dass IL-2 auch für die NK-Zell-Proliferation verantwortlich ist. Zusammenfassend zeigen die erhobenen Daten, dass die Proliferation der NKZellen innerhalb der PBMZ von antigenspezifisch stimulierten T-Zellen induziert wird. 42 Diskussion 4. Diskussion 4.1 Bedeutung der NK-Zell-Proliferation bei der Immunantwort Bisher ist noch nicht vollständig geklärt, ob NK-Zellen bei einer Infektion expandieren bzw. wodurch die Expansion ausgelöst wird. Gut untersucht ist hingegen die mit der Proliferation der NK-Zellen verbundene quantitative und qualitative Steigerung ihrer Effektorfunktionen. Dies wird in der um das 50-fach gesteigerten Zytokinsekretion sowie in der Elimination eines breiten Pathogenspektrums deutlich (Warren 1999). Die Proliferation von NK-Zellen während einer Infektion ist für die effiziente Immunantwort essentiell (Warren 1996). In vorliegender Arbeit wurde neben der bekannten T-Zell-Aktivierung durch mykobakterielle Antigene auch die antigenspezifische Proliferation von NKZellen nachgewiesen (Abb. 10). Dieser Befund ist bemerkenswert, da man klassischerweise davon ausgeht, dass NK-Zellen aufgrund ihrer keimbahnkodierten Rezeptoren lediglich teilspezifisch auf Pathogene reagieren (Bloom 1982, Janeway 1989a, Janeway et al. 2002, Lanier 2005). So galt bisher das Dogma, dass nur Zellen des adaptiven Immunsystems antigenspezifisch proliferieren. Diese müssen sich im Rahmen einer optimalen Immunantwort exponentiell vermehren, da aufgrund der hohen Rezeptordiversität unter 104-106 Zellen nur eine den passenden Antigenrezeptor aufweist. Zwar besitzen NKZellen ebenfalls ein diverses Rezeptorexpressionsmuster, doch werden die meisten aktivierenden Rezeptoren von allen NK-Zellen exprimiert (Bryceson et al. 2006a). Eine Infektion führt zur schnellen Rekrutierung einer großen Anzahl gleichartiger, aktivierter NK-Zellen. Es gehört demnach nicht zu den physiologischen Abwehrmechanismen der NK-Zellen, ihre Effektivität durch klonale Expansion zu steigern (Biron 2010). Obwohl es bisher nur wenige Studien gibt, die eine effektive antibakterielle Aktivität von NK-Zellen belegen, weist die hier aufgezeigte Mykobakterienspezifische Aktivierung auf eine Beteiligung von NK-Zellen bei der Abwehr bakterieller Infektionen hin. 43 Diskussion Die Proliferation von NK-Zellen im Rahmen der Immunabwehr gegen Viren ist unbestritten (Andoniou et al. 2006, Lodoen et al. 2006). Neben der unspezifisch vermittelten NK-Zell-Proliferation durch IFNα/β und IL-15 (Biron et al. 1999) ist auch ein Rezeptor-abhängiger Mechanismus aktiv. Maus-NK-Zellen tragen den LyH-Rezeptor, der spezifisch ein Protein erkennt, welches vom Murine Cytomegalie Virus (MCMV) kodiert wird. Im Verlauf der Abwehrreaktion gegen MCMV proliferieren nur die LyH-positiven NK-Zellen, die somit die erfolgreiche Infektabwehr bewirken (Dokun et al. 2001). Auf humanen NK-Zellen bindet der NKG2C/CD94-Rezeptor ein Protein, welches für das Humane Cytomegalie Virus spezifisch ist. Auch hier wurde die selektive Proliferation von NKG2C/CD94Rezeptor-positiven NK-Zellen gezeigt (Guma et al. 2006). In diesen Arbeiten wurde erstmals die antigenspezifische und Rezeptor-vermittelte Proliferation von NK-Zellen nachgewiesen. NK-Zellen zeigen somit ein Reaktionsmuster, von dem man bisher angenommen hatte, es sei charakteristisch für das adaptive Immunsystem. Das Fehlen von NK-Zellen bei CMV-Infektionen korreliert mit einer deutlich erhöhten Viruslast, wodurch die Relevanz der NK-Zellen verdeutlicht wird (Orange et al. 1996). In einigen Studien wurde eine direkte NK-Zell-Aktivierung durch Bakterien gezeigt. Die Stimulation mit extrazellulärem Bacille Calmette-Guérin, einem attenuierten Antigen-Stamm von Mycobacterium bovis, führt zur Proliferation sowie zu erhöhter IFN-γ-Produktion und Zytotoxizität in NK-Zellen. Die Neutralisation der Zytokine IL-2 und IL-12 reduzierte die Proliferation der NKZellen nicht, so dass über einen Rezeptor-vermittelten Mechanismus spekuliert wird (Esin et al. 2004). Weiterhin werden NK-Zellen durch Lipopolysacharid aktiviert. Sie proliferieren, wenn sie mit unreifen DZ und Lipopolysacharid inkubiert werden (Vitale et al. 2004). Die spezifische Aktivierung der NK-Zellen durch Lipopolysacharid ist ein weiteres Indiz für eine antibakterielle Funktion der NK-Zellen. Vor diesem Hintergrund der Bakterien-vermittelten NK-ZellAktivierung gibt die in dieser Arbeit nachgewiesene Mykobakterien-spezifische 44 Diskussion NK-Zell-Proliferation einen wichtigen Hinweis auf eine NK-Zell-Beteiligung in der antibakteriellen Infektabwehr. 4.2. Bedeutung von Interleukin-2 in der Aktivierung von NK-Zellen und in der Krebstherapie Die Stimulation von NK-Zellen durch mykobakterielle Antigene wird nach den Ergebnissen der vorliegenden Arbeit durch IL-2 vermittelt (Abb. 18). Noch ist unklar, ob unsere in vitro-Beobachtung auch in vivo Bedeutung hat. Einerseits messen einige Autoren der NK-Zell-Aktivierung durch IL-2 in vivo keine Bedeutung bei, da IL-2 erst während der Aktivierung des adaptiven Immunsystems, gebildet wird. NK-Zellen als Teil des angeborenen Immunsystems sind zu diesem Zeitpunkt bereits durch IFNα/β von infizierten Zellen aktiviert. Zudem konkurrieren aktivierte T-Zellen mit NK-Zellen um freigesetztes IL-2. T-Zellen sind gegenüber NK-Zellen im Vorteil, da sie den hochaffinen IL-2 Rezeptor exprimieren, wohingegen NK-Zellen nur mit einem mittelaffinen IL-2 Rezeptor ausgestattet sind (Biron et al. 1999). Ein weiteres Argument, das gegen eine Funktion von IL-2 bei der NK-Zell-Aktivierung spricht, ist die auf die Lymphknoten beschränkte IL-2-Produktion während des T-ZellPrimings (Prlic et al. 2003). In Lymphknoten sind NK-Zellen jedoch nur in niedriger Frequenz zu finden; sie kumulieren in Blut, Milz, Leber und Uterus (Yokoyama et al. 2004). Andererseits finden sich vermehrt Hinweise, dass IL-2 auch in vivo NK-Zellen stimuliert. Darauf deutet der Nachweis hin, dass die Subpopulation der CD56bright NK-Zellen in Lymphknoten vorkommt. Dort repräsentieren sie mit 75-95% den Großteil der NK-Zellen (Fehniger et al. 2003, Ferlazzo et al. 2004a). Zwar befinden sich lediglich 1-5% des NK-Zell-Pools in den Lymphknoten, doch diese umfassen 40% der Gesamtlymphozyten und stellen somit ein großes NK-Zell-Reservoir dar (Poli et al. 2009). Im Vergleich dazu finden sich nur 2% der Lymphozyten im Blut. Die im Lymphknoten vorherrschenden CD56bright NK-Zellen tragen den 45 Diskussion hochaffinen IL-2-Rezeptor und konkurrieren mit T-Zellen um IL-2, auf welches sie schon in geringen Konzentrationen reagieren (Caligiuri et al. 1990, Freud et al. 2006a). Auch die konstitutive IL-2-Rezeptor-Expression auf NK-Zellen (Carson et al. 1994) und die aktivierenden Effekte durch IL-2-Exposition in NK-Zellen, sprechen für eine Bedeutung von IL-2 auf NK-Zellen in vivo. Zu den aktivierenden Effekten gehört die IL-2-induzierte Zytotoxizitätserhöhung, bekannt als „Phänomen der Lymphokin-aktivierten Killer Zellen“ (Grimm et al. 1982). Aktivierte Lymphozyten lysieren sowohl solide Tumorzellen als auch hämatopoetische Tumorzelllinien. Dabei beruht die Zunahme der Zytotoxizität im Wesentlichen auf der erhöhten NK-Zell-Aktivität (Phillips et al. 1986). Auch die IFN-γ-Produktion in NK-Zellen wird durch Kombination von IL-2 und IL-12 ausgelöst (Carson et al. 1997, Fehniger et al. 2003, Robertson 2002). IL-2-aktivierte NK-Zellen lösen ferner die Reifung von DZ durch einen Zell-Zell-Kontaktabhängigen Mechanismus aus (Gerosa et al. 2002). Die IL-2 vermittelte Aktivierung der NK-Zellen könnte für die Therapie bösartiger Tumoren ausgenutzt werden. Folgende Überlegungen stützen diese potentielle Strategie. Die verbesserte Lyse von Tumorzellen durch NK-Zellen nach IL-2-Exposition (van den Broek et al. 1995, Medvedev et al. 1997) führte versuchsweise zur IL-2Applikation in der Krebstherapie. Erste Erfolge wurden mit der Hochdosis IL-2Monotherapie in der Behandlung des metastasierten Nierenzellkarzinoms und des metastasierten malignen Melanoms erzielt (Fisher et al. 2000, Atkins et al. 2000). Hohe IL-2-Konzentrationen aktivieren nicht nur NK-Zellen, sondern auch TZellen, B-Zellen und Monozyten, die „nur“ mittelaffine IL-2-Rezeptoren besitzen. Die Aktivierung des Immunsystems durch Hochdosis-IL-2-Therapie ist deshalb mit erheblichen Nebenwirkungen wie Hypotension und Capillary-Leak- ausschließlich zur Sättigung Syndrome verbunden (Smith 1997). Niedrige IL-2-Konzentrationen führen der hochaffinen IL-2-Rezeptoren von CD56bright NK-Zellen oder aktivierten T-Zellen. Durch die Niedrigdosis-IL-2-Therapie wird selektiv die Proliferation von NK 46 Diskussion Zellen induziert. Zwar ist diese Therapieform nebenwirkungsarm, jedoch wird die für eine Lyse von Tumorzellen erforderliche Steigerung der Zytotoxizität nicht erreicht. Schließlich überwiegend werden durch immunregulatorische die niedrigen CD56bright IL-2-Konzentrationen NK-Zellen und nicht die zytotoxischen CD56dim NK-Zellen aktiviert (Fehniger et al. 2002). Von der Niedrigdosis-IL-2-Therapie profitieren daher nur folgende Patientengruppen: • Patienten, denen wegen Leukämien T-Zell-depletiertes Knochenmark transplantiert wurde; sie erlitten weniger Rückfällen und überlebten länger krankheitsfrei (Soiffer et al. 1994). • Patienten mit HIV-assoziierten malignen Erkrankungen und CD4Zellzahlen unter 200/mm2; diese Patienten wiesen erhöhte NK-Zell-Zahlen im Blut auf und erkrankten während der IL-2-Therapie nicht an opportunistischen Infektionen (Bernstein et al. 1995). Ein weiterer Versuch, für die Krebstherapie wirksame NK-Zellen ohne wesentliche Toxizität zu generieren, ist die Kombination von kontinuierlich appliziertem IL-2 in niedriger Dosierung mit hochdosiertem IL-2 im Bolus. Ziel dabei war es, zuerst eine NK-Zell-Expansion und nachfolgend eine Zytotoxizitätserhöhung zu induzieren. Auch der adoptive Transfer von ex vivo aktivierten NK-Zellen war eine vielversprechende Möglichkeit, ohne toxische Systemwirkungen die Effektorfunktionen der NK-Zellen möglichst zu optimieren. Die hohen Erwartungen der Kombinations-Immuntherapie mit IL-2 wurden jedoch nicht erfüllt (Burns et al. 2003): 37 an Lymphom oder Mamma-Karzinom erkrankte Patienten wurden mit niedrig dosiertem IL-2 behandelt. Anschließend folgten Bolusapplikationen von hochdosiertem IL-2 oder Infusionen von ex vivo IL-2-aktivierten Zellen. Gegenüber der Kontrollgruppe, die eine autologe Blutoder Knochenmarktransplantation erhielt, zeigte sich in der IL-2- Behandlungsgruppe hinsichtlich Überlebensverlängerung oder Rückfallquote kein Vorteil. Daher ist die niedrig dosierte Gabe von IL-2 als Therapie maligner Erkrankungen suboptimal. Grund dafür ist am ehesten, dass durch die IL-2-Gabe 47 Diskussion vorwiegend die Expansion immunregulatorischer CD56bright NK-Zellen ausgelöst wird (Sutlu et al. 2009). Der adoptive Transfer von Lymphokin-aktivierten NK-Zellen ist bei denjenigen Patienten mit metastasiertem Nierenzellkarzinom erfolgreich, die sich nach Hochdosis-IL-2-Therapie in Partialremission befinden. Bei 6 von 10 Patienten wurde ein komplettes Ansprechen erreicht (Escudier et al. 1994). Die Befunde sprechen dafür, dass Lymphokin-aktivierte NK-Zellen prinzipiell geeignet sind, um in vivo Tumorzellen zu eliminieren. Allerdings wird die Steigerung der Zytotoxizität nicht durch exogen verabreichtes IL-2 erreicht. Die hierfür erforderlichen Dosen sind zu hoch und deren Toxizität nicht tolerierbar. Daher müssen andere Wege gesucht werden, um die Killer-Aktivität in NK-Zellen zu erhöhen. Möglicherweise induziert endogen produziertes IL-2 von T-Zellen die Aktivierung zu zytotoxischen NK-Zellen. Eine ausschließlich auf den Lymphknoten beschränkte, hohe endogene IL-2 Konzentration ist möglicherweise weniger toxisch als die systemische Gabe. Dies könnte aber dennoch ausreichend sein, um die Differenzierung in CD56dim NK-Zellen und die damit verbundene Steigerung der Zytotoxizität zu induzieren. Eine Option wäre, die eigenen TZellen zur IL-2-Produktion zu stimulieren. Dies könnte mit exogen applizierten, reifen DZ geschehen, die bereits Antigen augenommen haben. Auf diese Weise würden NK-Zellen im Lymphknoten zu zytotoxischen NK-Zellen heranreifen, um in der Peripherie Tumorzellen zu lysieren. In der Summe überwiegen die Hinweise für eine NK-Zell-aktivierende Funktion von IL-2 auch in vivo. 4.3. Interaktion von T-Zellen und NK-Zellen Die in dieser Arbeit gezeigte NK-Zell-Proliferation wird indirekt durch T-Zellen vermittelt, da IL-2 im Menschen ausschließlich von aktivierten T-Zellen produziert wird (Olejniczak et al. 2008, Smith 1988). Zwar konnten Maus-DZ und humane DZ in vitro ebenfalls zur IL-2 Sekretion stimuliert werden (Feau et al. 2005, Granucci et 48 Diskussion al. 2004); ob dieser Befund beim Menschen von Bedeutung ist, bleibt fraglich. Unsere Interpretation, für die Aktivierung der NK-Zellen, ist wie folgt: DZ phagozytieren mikrobielles Antigen und stimulieren MHC-vermittelt naive TZellen. Aktivierte antigenspezifische T-Zellen sezernieren IL-2 und induzieren dadurch ihre eigene klonale Expansion aber auch die Proliferation der NK-Zellen. Dabei erfordert die Aktivierung des angeborenen Immunsystems durch das adaptive weder zusätzlichen Zell-Zell-Kontakt noch Koaktivierung durch weitere Zytokine (Abb. 14, 16). Die Aktivierung von NK-Zellen durch T-Zellen wurde bereits in früheren Arbeiten diskutiert. Insbesondere wurde eine Interaktion von adaptiven und angeborenen Immunsystem im Lymphknoten postuliert (Ferlazzo et al. 2003, Fehniger et al. 2003). Dieses Postulat basiert auf Experimenten, die zeigten, dass NK-Zellen über einen IL-2-abhängigen Mechanismus von T-Zellen zur IFN-γProduktion aktiviert werden. Ähnliches wurde auch bei einer Infektion mit Plasmodium falciparum beschrieben: aktivierte T-Zellen produzierten IL-2, welches die IFN-γ-Produktion in NK-Zellen stimulierte. Dass NK-Zellen innerhalb der ersten 36 Stunden alleine für die IFN-γ-Produktion verantwortlich waren, unterstreicht die Bedeutung der NK-Zellen bei der Infektabwehr (Horowitz et al. 2010). Ein vergleichbares Phänomen wurde auch als Reaktion auf die Infektion mit Influenza Virus A beobachtet. Neben T-Zellen produzierten innerhalb Virusexponierter PBMZ auch NK-Zellen IFN-γ. Dieser Effekt war IL-2-abhängig, da er durch neutralisierende anti-IL-2-Antikörper aufgehoben wurde (He et al. 2004). Zusammenfassend wird die T-Zell-vermittelte NK-Zell-Aktivierung durch unterschiedliche Klassen von Mikroorganismen (Bakterien, Viren, Parasiten) ausgelöst. Neben M. tb, Plasmodium falciparum und Influenza A wurde in eigenen Experimenten auch eine NK-Zell-Proliferation nach Stimulation mit TT, dem Toxin von Clostridium tetani, beobachtet (Daten nicht gezeigt). Dies ist ein deutlicher Hinweis darauf, dass NK-Zellen während der Aktivierung des adaptiven Immunsystems unspezifisch en passant aktiviert werden. 49 Diskussion Eine mögliche Erklärung für die gleichzeitige Aktivierung von NK-Zellen und TZellen ist die Freisetzung von IFN-γ durch aktivierte NK-Zellen. IFN-γ fördert die Differenzierung naiver T-Zellen in TH1-Zellen (Bradley et al. 1996) und damit die Entwicklung der zellulären Immunität. In Mäusen, die mit Leishmania major infiziert wurden, sind NK-Zellen von entscheidender Bedeutung, um die TH1Differenzierung zu gewährleisten. Werden NK-Zellen depletiert, entwickeln sich aufgrund des IFN-γ-Mangels TH2-Zellen und die infizierten Mäuse sterben an der ansonsten selbstlimitierenden Infektion (Scharton et al. 1993). Außerdem entwickeln NK-Zell-knock-out-Mäuse nach Infektion mit Leishmania major keine suffiziente TH1-Antwort (Martin-Fontecha et al. 2004). Weiterhin wurden IFN-γproduzierende NK-Zellen in der Nähe von spezifischen CD4-positiven Zellen im äußeren Parakortex des Lymphknoten gefunden (Bajenoff et al. 2006). Daher ist die in unseren Experimenten gezeigte IL-2-induzierte Aktivierung der NK-Zellen in vivo möglicherweise an der Entwicklung der zellulären Immunität beteiligt. 4.4. NK-Zellen als Teil des adaptiven Immunsystems Unsere Experimente zeigen, dass NK-Zellen nicht nur von Zellen des angeborenen Immunsystems oder virusinfizierten Zellen aktiviert werden, sondern auch durch T-Zellen des adaptiven Immunsystems. Diese Befunde weisen darauf hin, dass die Effektorfunktionen der NK-Zellen auch zu einem späteren Zeitpunkt an der Elimination von Pathogenen beteiligt sind. Wie könnte die hier dargestellte T-Zellvermittelte NK-Zell-Aktivierung zur effektiven Infektabwehr beitragen? Neben der bereits erwähnten Steigerung der Zytotoxizität in NK-Zellen durch IL-2 (Phillips et al. 1986, Warren 1996, Warren et al. 1996) mehren sich die Hinweise, dass NK-Zellen im sekundären Lymphgewebe ausreifen (Freud et al. 2006b). Diese Hypothese wird dadurch gestützt, dass die im Blut vorherrschende CD56dim NK-Zell-Population kürzere Telomere besitzt als die CD56bright NK-Zellen im Lymphknoten (Romagnani et al. 2007). Telomere sind die Chromosomenenden, die mit zunehmenden Zellteilungen an Länge verlieren. Daher wird an ihrer Länge das Zellalter abgeschätzt. Während der Reifung entwickeln sich die 50 Diskussion vorwiegend Zytokin-produzierenden CD56bright NK-Zellen zu zytotoxischen CD56dim NK-Zellen (Frey et al. 1998). Zytotoxische NK-Zellen definieren sich unter anderem durch die Expression von Rezeptoren, mit denen nur noch die Migration in entzündetes Gewebe, nicht jedoch ins Lymphgewebe möglich ist. Weiterhin wurde gezeigt, dass die Reifung zu zytotoxischen NK-Zellen im Lymphknoten durch IL-2 induziert wird (Ferlazzo et al. 2004c). Daher fördern TZellen, die während einer Infektion IL-2 produzieren, möglicherweise die Reifung von NK-Zellen. Dies führt schließlich zu einer Mobilisation zytotoxischer NKZellen aus dem Lymphknoten in den Blutkreislauf (Ferlazzo et al. 2004c). Aus der Blutbahn gelangen NK-Zellen in entzündete Gewebe, wo sie zusammen mit den Effektormechanismen des adaptiven Immunsystems zur Abwehr von Mikroorganismen beitragen. Möglicherweise unterstützen NK-Zellen zytotoxische T-Zellen in der Peripherie. NK-Zellen eliminieren Zellen, die infolge einer Virusinfektion oder malignen Transformation zu wenige MHC-Moleküle exprimieren und deshalb von zytotoxischen T-Zellen nicht erkannt werden (Gumperz et al. 1995). In unseren Experimenten wurden die Oberflächenrezeptoren auf den proliferierenden NK-Zellen nicht untersucht, so dass keine eigenen Daten zur Expression zytotoxischer Rezeptoren nach IL-2Exposition zur Verfügung stehen. Die ursprünglich als Nebenbefund aufgefallene NK-Zell-Aktivierung durch IL-2 könnte ihre physiologische Bedeutung am ehesten in der NK-Zell-Reifung durch T-Zellen haben. Unsere Daten zur T-Zell-vermittelten Aktivierung von NK-Zellen unterstützen die These, dass NK-Zellen auch in der späten Phase der Immunabwehr aktiv sind. 51 Diskussion B IL-2 E< A d E< d d WW d E< E< d E< E< njLJƚŽƚŽdž E< njLJƚŽƚŽdž E< njLJƚŽƚŽdž E< njLJƚŽƚŽdž IFN-γ IL-12 E< njLJƚŽƚŽdž C d,ϭ d,ϭ d,ϭ d,ϭ D d,ϭ E< njLJƚŽƚŽdž E< d,ϭ njLJƚŽƚŽdž d,ϭ E< njLJƚŽƚŽdž Abbildung 19: Mögliche NK-Zell-Funktionen in der späten Phase der Immunantwort. (A) Naive T- Zellen werden im Lymphknoten von DZ mit Antigen stimuliert. Die aktivierten T-Zellen produzieren daraufhin IL-2, welches nicht nur ihre eigene Proliferation, sondern auch die der NK-Zellen auslöst. (B) IL-2-aktivierte NK-Zellen sind zum einen potente IFN-γ -Produzenten, zum anderen induziert IL-2 die NKZell-Reifung, welche mit Erhöhung der NK-Zell-Zytotoxizität einhergeht. (C) Umgekehrt nehmen NKZellen ebenfalls Einfluss auf die T-Zell-Entwicklung. IFN- γ bewirkt zusammen mit IL-12, welches von Antigen-stimulierten DZ produziert wird, die Differenzierung von naiven T-Zellen in TH1 Zellen. Damit fördern sie die Ausbildung der zellulären Immunität. (D) Ausgereifte Lymphozyten (zytotoxische NKZellen und TH1-Zellen) gelangen über efferente Gefäße zum Ort der Infektion, wo sie zur Pathogenelimination benötigt werden. DZ: dendritische Zelle; IFN- γ: Interferon-gamma; IL-2: Interleukin-2; IL-12: Interleukin-12; NK: Natürliche Killerzelle; NK zytotox: zytotoxische Natürliche Killerzelle; T: T-Zelle; TH1: T-Helfer-1-Zelle Es gibt vielversprechende Veröffentlichungen, die einen Paradigma-Wechsel propagieren und NK-Zellen zum adaptiven Immunsystem zählen (Sun et al. 2009b). Zu diesem Schluss führen folgende Befunde, in denen NK-Zellen zunehmend Charakteristika des adaptiven Immunsystems zeigen: • Zum einen besitzen NK-Zellen antigenspezifische Rezeptoren für ein von MCMV kodiertes Protein (Arase et al. 2002), werden aktiviert und tragen entscheidend zur Abwehr von MCMV-Infektionen bei (Dokun et al. 2001). 52 Diskussion • Zum anderen bilden auch NK-Zellen ein immunologisches Gedächtnis aus (O'Leary et al. 2006). Eine T- und B-Zell-depletierte Maus zeigte 4 Wochen nach erstmaliger Antigenexposition eine Hypersensitivitätsreaktion, wenn sie erneut mit Allergen in Kontakt kam. Möglicherweise besitzen NK-Zellen Eigenschaften vom angeborenen und adaptiven Immunsystem und wir beginnen erst jetzt allmählich die Eigenschaften des angeborenen Immunsystems zu verstehen (Sun et al. 2009a). 53 Zusammenfassung 5. Zusammenfassung Angeborenes und erworbenes Immunsystem wurden bisher überwiegend als getrennte funktionelle Einheiten betrachtet. Obwohl sich Natürliche Killerzellen und T-Zellen aus der gleichen Vorläuferzelle entwickeln, schützen Natürliche Killerzellen den Organismus in der frühen Phase der Infektion unspezifisch, wohingegen T-Zellen die hochspezifische Abwehr in der späten Phase übernehmen. Aus diesem Grunde überraschte unsere Beobachtung, dass Natürliche Killerzellen und T-Zellen nach Stimulation mit Antigenen von Mycobacterium tuberculosis gleichzeitig aktiviert werden. Im Gegensatz zu TZellen besitzen Natürliche Killerzellen keine antigenspezifischen Rezeptoren, die eine direkte Aktivierung erklären. Ziel der vorliegenden Arbeit war es aufzuklären, wie mikrobielle Antigene die Aktivierung von Natürlichen Killerzellen induzieren. Periphere Lymphozyten wurden aus dem Vollblut gesunder Spender isoliert und mit dendritischen Zellen sowie Antigenen von Mycobacterium tuberculosis stimuliert. Die Separation Natürlicher Killerzellen aus peripheren mononukleären Blutzellen erfolgte mithilfe von ferro-magnetisch gekoppelten Antikörpern. Die Proliferation der peripheren Blutlymphozyten und der Natürlichen Killerzellen wurde anhand eines Verdünnungsassays mit dem Farbstoff Carboxyfluoreszein Succinimidyl Ester am Durchflusszytometer bestimmt. Zur phänotypischen Charakterisierung der proliferierten Zellen wurden die Oberflächenrezeptoren angefärbt und anschließend ebenfalls am Durchflusszytometer analysiert. Die Unterscheidung zwischen Zell-Aktivierung durch Zytokine und Aktivierung durch Zell-Zell-Kontakt gelang durch Experimente mit semipermeablen Membranen, die nur für lösliche Faktoren durchgängig waren. Natürliche Killerzellen proliferieren simultan mit T-Zellen, wenn periphere Blutlymphozyten mit mykobakteriellen Antigenen stimuliert werden. Dagegen lösen mykobakterielle Antigene in einer Kultur, die ausschließlich Natürliche Killerzellen enthält, keine Proliferation aus. Folglich reagieren Natürliche Killerzellen nicht direkt auf Antigen, sondern benötigen die Unterstützung 54 Zusammenfassung weiterer Zellpopulationen. Die hier vorgestellten Daten zeigen, dass zur Aktivierung Natürlicher Killerzellen kein Zell-Zell-Kontakt erforderlich ist. Stattdessen sind lösliche Faktoren für die Proliferation Natürlicher Killerzellen verantwortlich. Aus der Vielzahl möglicher Kandidaten wurde Interleukin-2 als Stimulans Natürlicher Killerzellen ermittelt. Natürliche Killerzellen werden durch bakterielle Antigene aktiviert. Dieser Befund deutet auf eine Funktion Natürlicher Killerzellen bei der Immunabwehr gegen Infektionserreger hin. In dieser Arbeit wurde Interleukin-2 als Zytokin identifiziert, welches die Proliferation von NK-Zellen induziert. T-Zellen sind demnach indirekt für die Aktivierung Natürlicher Killerzellen verantwortlich. Die physiologische Bedeutung der T-Zell-vermittelten Aktivierung Natürlicher Killerzellen könnte sein: 1. Interleukin-2-induzierte Ausschüttung von Interferon-γ durch Natürliche Killerzellen - dadurch wird die Differenzierung von naiven T-Zellen in THelfer-1-Zellen begünstigt. 2. Interleukin-2-induzierte Reifung von immunregulatorischen Natürlichen Killerzellen im Lymphknoten zu zytotoxischen Natürlichen Killerzellen. Die gleichzeitige Aktivierung von Natürlichen Killerzellen des angeborenen Immunsystems und T-Zellen des adaptiven Immunsystems legt nahe, dass Natürliche Killerzellen in der frühen- aber auch in der späten Phase der Immunantwort zur Abwehr von Infektionen beitragen. 55 Literaturverzeichnis 6. Literaturverzeichnis 1. Abbas A K, Murphy K M, Sher A: Functional diversity of helper T lymphocytes. Nature, 383: 787-793 (1996) 2. Amakata Y, Fujiyama Y, Andoh A, Hodohara K, Bamba T: Mechanism of NK cell activation induced by coculture with dendritic cells derived from peripheral blood monocytes. Clin.Exp.Immunol., 124: 214-222 (2001) 3. Andoniou C E, Andrews D M, Degli-Esposti M A: Natural killer cells in viral infection: more than just killers. Immunol.Rev., 214: 239-250 (2006) 4. Arase H, Mocarski E S, Campbell A E, Hill A B, Lanier L L: Direct recognition of cytomegalovirus by activating and inhibitory NK cell receptors. Science, 296: 1323-1326 (2002) 5. Atkins M B, Kunkel L, Sznol M, Rosenberg S A: High-dose recombinant interleukin-2 therapy in patients with metastatic melanoma: long-term survival update. Cancer J.Sci.Am., 6 Suppl 1: 11-14 (2000) 6. Bajenoff M, Breart B, Huang A Y, Qi H, Cazareth J, Braud V M, Germain R N, Glaichenhaus N: Natural killer cell behavior in lymph nodes revealed by static and real-time imaging. J.Exp.Med., 203: 619-631 (2006) 7. Bastian M, Braun T, Bruns H, Rollinghoff M, Stenger S: Mycobacterial lipopeptides elicit CD4+ CTLs in Mycobacterium tuberculosis-infected humans. J.Immunol., 180: 3436-3446 (2008) 8. Becker I, Salaiza N, Aguirre M, Delgado J, Carrillo-Carrasco N, Kobeh L G, Ruiz A, Cervantes R, Torres A P, Cabrera N, Gonzalez A, Maldonado C, Isibasi A: Leishmania lipophosphoglycan (LPG) activates NK cells through toll-like receptor-2. Mol.Biochem.Parasitol., 130: 65-74 (2003) 56 Literaturverzeichnis 9. Bernstein Z P, Porter M M, Gould M, Lipman B, Bluman E M, Stewart C C, Hewitt R G, Fyfe G, Poiesz B, Caligiuri M A: Prolonged administration of lowdose interleukin-2 in human immunodeficiency virus-associated malignancy results in selective expansion of innate immune effectors without significant clinical toxicity. Blood, 86: 3287-3294 (1995) 10. Biron C A: Expansion, maintenance, and memory in NK and T cells during viral infections: responding to pressures for defense and regulation. PLOS Pathog., 6: 1-4 (2010) 11. Biron C A, Nguyen K B, Pien G C, Cousens L P, Salazar-Mather T P: Natural killer cells in antiviral defense: function and regulation by innate cytokines. Annu.Rev.Immunol., 17: 189-220 (1999) 12. Bloom B R: Natural killers to rescue immune surveillance? Nature, 300: 214-215 (1982) 13. Bradley L M, Dalton D K, Croft M: A direct role for IFN-gamma in regulation of Th1 cell development. J.Immunol., 157: 1350-1358 (1996) 14. Bryceson Y T, March M E, Ljunggren H G, Long E O: Activation, coactivation, and costimulation of resting human natural killer cells. Immunol.Rev., 214: 7391 (2006a) 15. Bryceson Y T, March M E, Ljunggren H G, Long E O: Synergy among receptors on resting NK cells for the activation of natural cytotoxicity and cytokine secretion. Blood, 107: 159-166 (2006b) 16. Burns L J, Weisdorf D J, DeFor T E, Vesole D H, Repka T L, Blazar B R, Burger S R, Panoskaltsis-Mortari A, Keever-Taylor C A, Zhang M J, Miller J S: IL-2based immunotherapy after autologous transplantation for lymphoma and breast cancer induces immune activation and cytokine release: a phase I/II trial. Bone Marrow Transplant., 32: 177-186 (2003) 57 Literaturverzeichnis 17. Caligiuri M A, Zmuidzinas A, Manley T J, Levine H, Smith K A, Ritz J: Functional consequences of interleukin 2 receptor expression on resting human lymphocytes. Identification of a novel natural killer cell subset with high affinity receptors. J.Exp.Med., 171: 1509-1526 (1990) 18. Campbell J J, Qin S, Unutmaz D, Soler D, Murphy K E, Hodge M R, Wu L, Butcher E C: Unique subpopulations of CD56+ NK and NK-T peripheral blood lymphocytes identified by chemokine receptor expression repertoire. J.Immunol., 166: 6477-6482 (2001) 19. Carson W E, Fehniger T A, Caligiuri M A: CD56bright natural killer cell subsets: characterization of distinct functional responses to interleukin-2 and the c-kit ligand. Eur.J.Immunol., 27: 354-360 (1997) 20. Carson W E, Giri J G, Lindemann M J, Linett M L, Ahdieh M, Paxton R, Anderson D, Eisenmann J, Grabstein K, Caligiuri M A: Interleukin (IL) 15 is a novel cytokine that activates human natural killer cells via components of the IL-2 receptor. J.Exp.Med., 180: 1395-1403 (1994) 21. Chaplin D D: Overview of the immune response. J.Allergy Clin.Immunol., 125: 3-23 (2010) 22. Dokun A O, Kim S, Smith H R, Kang H S, Chu D T, Yokoyama W M: Specific and nonspecific NK cell activation during virus infection. Nat.Immunol., 2: 951-956 (2001) 23. Escudier B, Farace F, Angevin E, Charpentier F, Nitenberg G, Triebel F, Hercend T: Immunotherapy with interleukin-2 (IL2) and lymphokineactivated natural killer cells: improvement of clinical responses in metastatic renal cell carcinoma patients previously treated with IL2. Eur.J.Cancer, 30A: 1078-1083 (1994) 58 Literaturverzeichnis 24. Esin S, Batoni G, Pardini M, Favilli F, Bottai D, Maisetta G, Florio W, Vanacore R, Wigzell H, Campa M: Functional characterization of human natural killer cells responding to Mycobacterium bovis bacille Calmette-Guerin. Immunology, 112: 143-152 (2004) 25. Feau S, Facchinetti V, Granucci F, Citterio S, Jarrossay D, Seresini S, Protti M P, Lanzavecchia A, Ricciardi-Castagnoli P: Dendritic cell-derived IL-2 production is regulated by IL-15 in humans and in mice. Blood, 105: 697-702 (2005) 26. Fehniger T A, Cooper M A, Caligiuri M A: Interleukin-2 and interleukin-15: immunotherapy for cancer. Cytokine Growth Factor Rev., 13: 169-183 (2002) 27. Fehniger T A, Cooper M A, Nuovo G J, Cella M, Facchetti F, Colonna M, Caligiuri M A: CD56bright natural killer cells are present in human lymph nodes and are activated by T cell-derived IL-2: a potential new link between adaptive and innate immunity. Blood, 101: 3052-3057 (2003) 28. Ferlazzo G, Morandi B, D'Agostino A, Meazza R, Melioli G, Moretta A, Moretta L: The interaction between NK cells and dendritic cells in bacterial infections results in rapid induction of NK cell activation and in the lysis of uninfected dendritic cells. Eur.J.Immunol., 33: 306-313 (2003) 29. Ferlazzo G, Munz C: NK cell compartments and their activation by dendritic cells. J.Immunol., 172: 1333-1339 (2004a) 30. Ferlazzo G, Pack M, Thomas D, Paludan C, Schmid D, Strowig T, Bougras G, Muller W A, Moretta L, Munz C: Distinct roles of IL-12 and IL-15 in human natural killer cell activation by dendritic cells from secondary lymphoid organs. Proc.Natl.Acad.Sci.U.S.A., 101: 16606-16611 (2004b) 31. Ferlazzo G, Thomas D, Lin S L, Goodman K, Morandi B, Muller W A, Moretta A, Munz C: The abundant NK cells in human secondary lymphoid tissues 59 Literaturverzeichnis require activation to express killer cell Ig-like receptors and become cytolytic. J.Immunol., 172: 1455-1462 (2004c) 32. Fisher R I, Rosenberg S A, Fyfe G: Long-term survival update for high-dose recombinant interleukin-2 in patients with renal cell carcinoma. Cancer J.Sci.Am., 6 Suppl 1: 55-57 (2000) 33. Freud A G, Caligiuri M A: Human natural killer cell development. Immunol.Rev., 214: 56-72 (2006a) 34. Freud A G, Yokohama A, Becknell B, Lee M T, Mao H C, Ferketich A K, Caligiuri M A: Evidence for discrete stages of human natural killer cell differentiation in vivo. J.Exp.Med., 203: 1033-1043 (2006b) 35. Frey M, Packianathan N B, Fehniger T A, Ross M E, Wang W C, Stewart C C, Caligiuri M A, Evans S S: Differential expression and function of L-selectin on CD56bright and CD56dim natural killer cell subsets. J.Immunol., 161: 400-408 (1998) 36. Gerosa F, Baldani-Guerra B, Nisii C, Marchesini V, Carra G, Trinchieri G: Reciprocal activating interaction between natural killer cells and dendritic cells. J.Exp.Med., 195: 327-333 (2002) 37. Granucci F, Zanoni I, Pavelka N, Van Dommelen S L, Andoniou C E, Belardelli F, Degli Esposti M A, Ricciardi-Castagnoli P: A contribution of mouse dendritic cell-derived IL-2 for NK cell activation. J.Exp.Med., 200: 287-29 (2004) 38. Grimm E A, Mazumder A, Zhang H Z, Rosenberg S A: Lymphokine-activated killer cell phenomenon. Lysis of natural killer-resistant fresh solid tumor cells by interleukin 2-activated autologous human peripheral blood lymphocytes. J.Exp.Med., 155: 1823-1841 (1982) 60 Literaturverzeichnis 39. Guermonprez P, Valladeau J, Zitvogel L, Thery C, Amigorena S: Antigen presentation and T cell stimulation by dendritic cells. Annu.Rev.Immunol., 20: 621-667 (2002) 40. Guma M, Budt M, Saez A, Brckalo T, Hengel H, Angulo A, Lopez-Botet M: Expansion of CD94/NKG2C+ NK cells in response to human cytomegalovirus-infected fibroblasts. Blood, 107: 3624-3631 (2006) 41. Gumperz J E, Parham P: The enigma of the natural killer cell. Nature, 378: 245248 (1995) 42. He X S, Draghi M, Mahmood K, Holmes T H, Kemble G W, Dekker C L, Arvin A M, Parham P, Greenberg H B: T cell-dependent production of IFN-gamma by NK cells in response to influenza A virus. J.Clin.Invest., 114: 1812-1819 (2004) 43. Horowitz A, Newman K C, Evans J H, Korbel D S, Davis D M, Riley E M: Cross-Talk between T Cells and NK Cells Generates Rapid Effector Responses to Plasmodium falciparum-Infected Erythrocytes. J.Immunol., 184: 1-10 (2010) 44. Innins E K, Gatanaga M, Van Eden M, Knudsen K L, Granger G A, Gatanaga T: The autocrine role of tumor necrosis factor in the proliferation and functional differentiation of human lymphokine-activated T killer cells (T-LAK) in vitro. Cytokine, 4: 391-396 (1992) 45. Janeway C A: Natural killer cells: a primitive immune system. Nature, 341: 108111 (1989a) 46. Janeway C A, Jr: The priming of helper T cells. Semin.Immunol., 1: 13-20 (1989b) 47. Janeway C A,Jr, Medzhitov R: Annu.Rev.Immunol., 20: 197-216 (2002) Innate immune recognition. 61 Literaturverzeichnis 48. Kiessling R, Klein E, Wigzell H: "Natural" killer cells in the mouse. I. Cytotoxic cells with specificity for mouse Moloney leukemia cells. Specificity and distribution according to genotype. Eur.J.Immunol., 5: 112-117 (1975) 49. Lanier L L: NK cell recognition. Annu.Rev.Immunol., 23: 225-274 (2005) 50. Lee J, Lee S H, Shin N, Jeong M, Kim M S, Kim M J, Yoon S R, Chung J W, Kim T D, Choi I: Tumor necrosis factor-alpha enhances IL-15-induced natural killer cell differentiation. Biochem.Biophys.Res.Commun., 386: 718-723 (2009) 51. Ljunggren H G, Karre K: Host resistance directed selectively against H-2deficient lymphoma variants. Analysis of the mechanism. J.Exp.Med., 162: 1745-1759 (1985) 52. Lodoen M B, Lanier L L: Natural killer cells as an initial defense against pathogens. Curr.Opin.Immunol., 18: 391-398 (2006) 53. Luster A D: The role of chemokines in linking innate and adaptive immunity. Curr.Opin.Immunol., 14: 129-135 (2002) 54. Lyons A B, Parish C R: Determination of lymphocyte division by flow cytometry. J.Immunol.Methods, 171: 131-137 (1994) 55. Martin-Fontecha A, Thomsen L L, Brett S, Gerard C, Lipp M, Lanzavecchia A, Sallusto F: Induced recruitment of NK cells to lymph nodes provides IFNgamma for T(H)1 priming. Nat.Immunol., 5: 1260-1265 (2004) 56. Medvedev A E, Johnsen A C, Haux J, Steinkjer B, Egeberg K, Lynch D H, Sundan A, Espevik T: Regulation of Fas and Fas-ligand expression in NK cells by cytokines and the involvement of Fas-ligand in NK/LAK cell-mediated cytotoxicity. Cytokine, 9: 394-404 (1997) 62 Literaturverzeichnis 57. Mempel T R, Henrickson S E, Von Andrian U H: T-cell priming by dendritic cells in lymph nodes occurs in three distinct phases. Nature, 427: 154-159 (2004) 58. Mosmann T R, Coffman R L: TH1 and TH2 cells: different patterns of lymphokine secretion lead to different functional properties. Annu.Rev.Immunol., 7: 145-173 (1989) 59. O'Connor G M, Hart O M, Gardiner C M: Putting the natural killer cell in its place. Immunology, 117: 1-10 (2006) 60. O'Leary J G, Goodarzi M, Drayton D L, von Andrian U H: T cell- and B cellindependent adaptive immunity mediated by natural killer cells. Nat.Immunol., 7: 507-516 (2006) 61. Olejniczak K, Kasprzak A: Biological properties of interleukin 2 and its role in pathogenesis of selected diseases--a review. Med.Sci.Monit., 14: 79-89 (2008) 62. Orange J S: Formation and function of the lytic NK-cell immunological synapse. Nat.Rev.Immunol., 8: 713-725 (2008) 63. Orange J S, Biron C A: Characterization of early IL-12, IFN-alphabeta, and TNF effects on antiviral state and NK cell responses during murine cytomegalovirus infection. J.Immunol., 156: 4746-4756 (1996) 64. Phillips J H, Lanier L L: Dissection of the lymphokine-activated killer phenomenon. Relative contribution of peripheral blood natural killer cells and T lymphocytes to cytolysis. J.Exp.Med., 164: 814-825 (1986) 65. Poli A, Michel T, Theresine M, Andres E, Hentges F, Zimmer J: CD56bright natural killer (NK) cells: an important NK cell subset. Immunology, 126: 458465 (2009) 63 Literaturverzeichnis 66. Prlic M, Blazar B R, Farrar M A, Jameson S C: In vivo survival and homeostatic proliferation of natural killer cells. J.Exp.Med., 197: 967-976 (2003) 67. Robertson M J: Role of chemokines in the biology of natural killer cells. J.Leukoc.Biol., 71: 173-183 (2002) 68. Romagnani C, Juelke K, Falco M, Morandi B, D'Agostino A, Costa R, Ratto G, Forte G, Carrega P, Lui G, Conte R, Strowig T, Moretta A, Munz C, Thiel A, Moretta L, Ferlazzo G: CD56brightCD16- killer Ig-like receptor- NK cells display longer telomeres and acquire features of CD56dim NK cells upon activation. J.Immunol., 178: 4947-4955 (2007) 69. Scharton T M, Scott P: Natural killer cells are a source of interferon gamma that drives differentiation of CD4+ T cell subsets and induces early resistance to Leishmania major in mice. J.Exp.Med., 178: 567-577 (1993) 70. Schroder K, Hertzog P J, Ravasi T, Hume D A: Interferon-gamma: an overview of signals, mechanisms and functions. J.Leukoc.Biol., 75: 163-1892 (2004) 71. Smith K A: Rational interleukin-2 therapy. Cancer J.Sci.Am., 3 Suppl 1: 137-140 (1997) 72. Smith K A: Interleukin-2: inception, impact, and implications. Science, 240: 1169-1176 (1988) 73. Smyth M J, Cretney E, Takeda K, Wiltrout R H, Sedger L M, Kayagaki N, Yagita H, Okumura K: Tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) contributes to interferon gamma-dependent natural killer cell protection from tumor metastasis. J.Exp.Med., 193: 661-670 (2001) 74. Soiffer R J, Murray C, Gonin R, Ritz J: Effect of low-dose interleukin-2 on disease relapse after T-cell-depleted allogeneic bone marrow transplantation. Blood, 84: 964-971 (1994) 64 Literaturverzeichnis 75. Strowig T, Brilot F, Munz C: Noncytotoxic functions of NK cells: direct pathogen restriction and assistance to adaptive immunity. Journal of Immunology, 180: 7785-7791 (2008) 76. Sun J C, Beilke J N, Lanier L L: Adaptive immune features of natural killer cells. Nature, 457: 557-561 (2009a) 77. Sun J C, Lanier L L: Natural killer cells remember: an evolutionary bridge between innate and adaptive immunity? Eur.J.Immunol., 39: 2059-2064 (2009b) 78. Sutlu T, Alici E: Natural killer cell-based immunotherapy in cancer: current insights and future prospects. J.Intern.Med., 266: 154-181 (2009) 79. van den Broek M F, Kagi D, Zinkernagel R M, Hengartner H: Perforin dependence of natural killer cell-mediated tumor control in vivo. Eur.J.Immunol., 25: 3514-3516 (1995) 80. Vitale M, Della Chiesa M, Carlomagno S, Romagnani C, Thiel A, Moretta L, Moretta A: The small subset of CD56brightCD16- natural killer cells is selectively responsible for both cell proliferation and interferon-gamma production upon interaction with dendritic cells. Eur.J.Immunol., 34: 17151722 (2004) 81. Warren H S: Using carboxyfluorescein diacetate succinimidyl ester to monitor human NK cell division: analysis of the effect of activating and inhibitory class I MHC receptors. Immunol.Cell Biol., 77: 544-551 (1999) 82. Warren H S: NK cell proliferation and inflammation. Immunol.Cell Biol., 74: 473-480 (1996) 83. Warren H S, Kinnear B F, Kastelein R L, Lanier L L: Analysis of the costimulatory role of IL-2 and IL-15 in initiating proliferation of resting (CD56dim) human NK cells. J.Immunol., 156: 3254-3259 (1996) 65 Literaturverzeichnis 84. Yokoyama W M, Kim S, French A R: The dynamic life of natural killer cells. Annu.Rev.Immunol., 22: 405-429 (2004) 85. Yu J, Wei M, Becknell B, Trotta R, Liu S, Boyd Z, Jaung M S, Blaser B W, Sun J, Benson D M,Jr, Mao H, Yokohama A, Bhatt D, Shen L, Davuluri R, Weinstein M, Marcucci G, Caligiuri M A: Pro- and antiinflammatory cytokine signaling: reciprocal antagonism regulates interferon-gamma production by human natural killer cells. Immunity, 24: 575-590 (2006) 86. Zhao J, Yang X, Auh S L, Kim K D, Tang H, Fu Y X: Do adaptive immune cells suppress or activate innate immunity? Trends Immunol., 30: 8-12 (2009) 66 Anhang Danksagung Herrn Professor Steffen Stenger danke ich sehr herzlich für die Vergabe dieses spannenden Themas und die ausgezeichnete Betreuung sowohl im Labor als auch beim Schreiben der Arbeit. Bei Dr. Max Bastian bedanke ich mich ausdrücklich für seine unbegrenzte und tatkräftige Unterstützung sowie die hervorragende Betreuung des praktischen Teils meiner Arbeit. Für die sehr freundliche und hilfsbereite Einarbeitung bedanke ich mich bei Kiki. Durch die Zusammenarbeit mit Daniel, Heiko, Anja, Max, Kiki, Martin, Benny, Bettina und Michaela wurde die Arbeit im Labor zu einer sehr schönen und unvergesslichen Zeit. Vielen Dank Euch! Mein besonderer Dank gilt meinen Eltern und meiner Schwester Alexandra für die uneingeschränkte Unterstützung bei jeder Tages- und Nachtzeit.