Kapitel 2: Periodensystem
Werbung

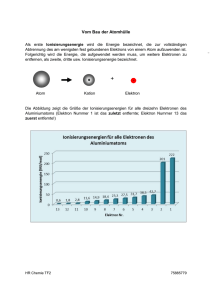
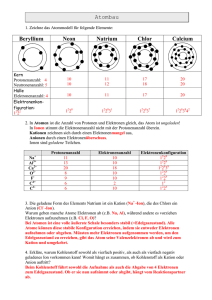
2. Periodensystem 2 Periodensystem ...............................................................................................2 2.1 Elektronenspin .........................................................................................2 2.2 Pauli-Prinzip ............................................................................................2 2.3 Hund’sche Regel......................................................................................3 2.4 Elektronenkonfigurationen ......................................................................3 2.4.1 Valenzorbitale ...................................................................................4 2.4.2 Voll besetzte Schalen........................................................................4 2.5 Systematik und Nomenklatur im Periodensystem...................................5 2.6 Ionisierungsenergie..................................................................................6 2.6.1 1. Ionisierungsenergie .......................................................................6 2.6.2 2. Ionisierungsenergie .......................................................................6 2.6.3 Voll besetzte Unterschalen ...............................................................7 2.6.4 Halb besetzte Unterschalen...............................................................7 2.6.5 Anstieg der Ionisierungsenergien innerhalb einer Periode...............7 2.6.6 n-te Ionisierungsenergien..................................................................8 2.6.7 Periodizität ........................................................................................8 2.7 Atom- und Ionen-Radien .........................................................................8 2.7.1 Kovalenz-Radien...............................................................................9 2.7.2 Ionen-Radien.....................................................................................9 2.8 Elektronenaffinität .................................................................................10 2.9 Lanthanoiden-Kontraktion.....................................................................11 2.10 Index ...................................................................................................12 1 2. Periodensystem 2 Periodensystem Was aus Kapitel 1 bekannt ist: Oberstes Ordnungsprinzip: Kernladung Z. Da Atome neutrale Teilchen sind, entspricht Z notwendig auch der Anzahl der in einem Atom vorhandenen Elektronen. Chemie wird von den Elektronen gemacht. Die Elektronen „sitzen“ in Orbitalen, die so aussehen, wie sie für das Wasserstoffatom beschrieben wurden. 2.1 Elektronenspin Zu den drei Quantenzahlen: Hauptquantenzahl n = 1 ,2 ,3 , ..., entsprechend K, L, M-Schale Nebenquantenzahl l = 0, s; l = 1, p; l = 2, d; l = 3, f; Magnetische Quantenzahl m = -l ...0...+l (Orientierung der 2l + 1 Orbitale) ist eine vierte Quantenzahl notwendig. Diese Quantenzahl ist die Spinquantenzahl s = +1/2, -1/2 Das Elektron hat einen Drehimpuls. Damit ist verbunden, dass es ein magnetischer Dipol ist, oder, anders gesagt, ein magnetisches Moment besitzt.(Ein makroskopisches Beispiel für ein System mit einem magnetischen Moment ist eine Magnetnadel.) Das Elektron kann sich in einem Magnetfeld nicht beliebig orientieren, sondern hat nur zwei Möglichkeiten der Einstellung relativ zu einem von außen wirkenden Magnetfeld. Das kommt daher, dass Drehimpuls-Änderungen nur in Einheiten von h/2 π erfolgen können (Siehe Kapitel 1). Die beiden Einstellmöglichkeiten, die das Elektron hat, werden mit der Spinquantenzahl s = +1/2 bzw. s = -1/2 bezeichnet. Um den Zustand eines Elektrons in einem Atom vollständig zu charakterisieren braucht man also insgesamt vier Quantenzahlen: n, l, m und s. 2.2 Pauli-Prinzip (Wolfgang Pauli 1900 – 1958) Für die Elektronen in einem Atom gilt streng: 2 Elektronen können nicht in allen Quantenzahlen übereinstimmen, d.h. jedes der Elektronen in einem Atom ist durch einen Satz von vier Quantenzahlen eindeutig bezeichnet und es gibt kein anderes Elektron in diesem Atom, das durch den gleichen Satz von Quantenzahlen charakterisiert wäre. Daraus folgt, dass in einem Orbital nur maximal zwei Elektronen Platz haben! „Ungepaarte Elektronen“ sind Elektronen die einzeln in einem Orbital sitzen. Sind zwei Elektronen in einem Orbital, dann sind ihre Spins „gepaart“. Sie sind zusammen ein „Elektronenpaar“. 2 2. Periodensystem 2.3 Hund’sche Regel (Friedrich Hund 1896 – 1997) Elektronen besetzen die Niveaus so, dass möglichst viele ungepaarte Elektronen vorhanden sind. Deutung: Beispiel a) Elektronen in einem und demselben Orbital halten sich im gleichen Raumbereich auf. Das ist wegen der Coulomb’schen Abstoßung energetisch ungünstig. b) Wechselwirkung der Elektronen in verschiedenen Orbitalen: Maximale „Multiplizität“ am günstigsten (Ergebnis aus Quantenmechanik) Zu a) Vergleiche: Besetzung der Tische in einer „Wirtschaft“! 2.4 Elektronenkonfigurationen Nomenklatur: Symbole wie z.B. 2p3 besagen: Die Elektronen gehören zu einem Orbital der Hauptquantenzahl 2 Die Elektronen besetzen die p- Orbitale Drei, 3, Elektronen sitzen in den p-Orbitalen Die Abfolge der Energie der Orbitale ist bei den Atomen, die Mehrelektronen-Systeme sind, etwas gegenüber ihrer Abfolge beim Wasserstoffatom geändert. 3 2. Periodensystem Erste Zweite Periode ValenzElektronen ValenzElektronen ValenzElektronen ValenzElektronen ValenzElektronen Valenz2s,2p Elektronen Valenz1s Elektronen 2+6 Anzahl der Elektronen 2 =8 Dritte Vierte Fünfte Sechste Siebte 7s,5f,6d,7p 6s,4f,5d,6p 5s, 4d,5p 4s,3d,4p 3s,3p 2+6 =8 2+10+6 =18 2+10+6 =18 2+14+10+6 2+14+10+6 =32 = 32 So ist die dritte Periode schon nach Auffüllen der 3s- und 3p-Niveaus abgeschlossen. Die 3d-Orbitale, die ja auch noch zur Hauptquantenzahl 3 gehören, liegen zunächst energetisch noch höher als das 4s-Orbital. Wenn das 4s-Orbital aber aufgefüllt ist – was ja bedeutet, dass zwei weitere Kernladungseinheiten dazugekommen sind - dann werden die 3d-Orbitale energetisch so weit abgesenkt, dass sie als nächste gefüllt werden. Die 4p-Orbitale sind ihrerseits erst dann stabil genug um aufgefüllt zu werden, wenn die Kernladung – im Zuge der Auffüllung der 3d-Orbitale um 10 Einheiten gestiegen ist. Ganz analog sind die Abfolgen der Orbitalenergien und deren Besetzung in den Perioden Fünf bis Sieben zu interpretieren. 2.4.1 Valenzorbitale Valenzorbitale nennt man diejenigen Orbitale, die in der jeweiligen Periode bei der höchsten Energie liegen, und die bei den Elementen, die zu dieser Periode gehören, Zug um Zug besetzt werden. In der Tabelle (siehe oben) sind jeweils nur die Signaturen der Valenzorbitale eingetragen. Alle energetisch darunter liegenden Orbitale (Siehe Tabelle) sind jeweils voll besetzt. Für die Chemie sind die Elektronen in den Valenzorbitalen entscheidend. 2.4.2 Voll besetzte Schalen Voll besetzte „Schalen“ entsprechen besonders stabilen Elektronenkonfigurationen. In der ersten Periode (Wasserstoff, H, Helium, He) ist die 1s Schale bereits beim Vorhandensein von 2 Elektronen vollständig gefüllt. Das Element Helium ist mit seiner voll besetzten Schale sehr reaktionsträge. Es ist ein „Edelgas“. 4 2. Periodensystem In der zweiten Periode: (Li, (Lithium), Be, (Beryllium), B (Bor), C (Kohlenstoff), N (Stickstoff), O (Sauerstoff), F (Fluor), Ne (Neon)) ist für Neon mit der Elektronenkonfiguration 2s22p6 die Valenzschale ebenfalls vollständig gefüllt. Auch Neon ist ein Edelgas. Die Gesamtelektronenkonfiguration von Neon ist 1s22s22p6. Für die Chemie wichtig sind jedoch immer nur die Valenzelektronen, so dass man bei der Angabe der Elektronenkonfiguration die Angaben über energetisch darunter liegende voll besetzte Schalen meist weg lässt. In den weiteren Perioden sind entsprechend die Elemente, in denen die Valenzorbitale vollständig gefüllt sind, jeweils Edelgase: 1s2 2s22p6 3s23p6 4s23d104p6 5s24d105p6 6s24f145d106p6 He Ne Ar Kr Xe Ra (Helium) (Neon) (Argon) (Krypton) (Xenon) (Radon) In die Valenzschalen der Elemente passen also: 2 8 8 18 18 32 32 Elektronen Elektronen Elektronen Elektronen Elektronen Elektronen Elektronen 1. Periode 2. Periode 3. Periode 4. Periode 5. Periode 6. Periode 7. Periode Das letzte Element in jeder Periode ist ein Edelgas. Die Eigenschaften der Elemente werden durch die Anzahl der Elektronen, die sie jeweils in ihrer Valenzschale haben, ganz wesentlich bestimmt. Daraus resultiert die Einteilung der Elemente in einzelne Gruppen im Periodensystem. 2.5 Systematik und Nomenklatur im Periodensystem Das Wesentliche findet sich in allen Lehrbüchern eingehend beschrieben: Hauptgruppen Nebengruppen Lanthanoiden Aktinoiden 5 2. Periodensystem Bezifferung der Gruppen: 1. bis 7. Hauptgruppe 1.bis 8. Nebengruppe (Drei Elemente in der 8. Nebengruppe) Alternative Zählweise: Gruppen 1 – 18 Bezeichnung einzelner Gruppen: Alkali-Elemente Erdalkali-Elemente Halogene Chalkogene Gruppennummer und Elektronenkonfiguration 2.6 Ionisierungsenergie 2.6.1 1. Ionisierungsenergie Die chemischen Eigenschaften der Elemente ändern sich nicht kontinuierlich mit steigender Kernladungszahl der Elemente sondern periodisch. Noch lange bevor eine Theorie entwickelt war, welche dies verständlich macht, sind die Elemente in Gruppen eingeteilt worden, die sie nach jeweils ähnlichem chemischem Verhalten geordnet hat. Die Ursache für das chemisch ähnliche Verhalten der Elemente in einer Gruppe des Periodensystems liegt in ihrer jeweils analogen Valenzelektronen-Konfiguration. Die Ionisierungsenergie ist die Energie, die notwendig ist, um ein Elektron aus einem Atom (ins Unendliche!) zu entfernen. Bei Atomen mit mehreren Elektronen kann man mehrere Elektronen nacheinander entfernen. Es ist deshalb wichtig, anzugeben, welche Ionisierungsenergie man meint. Die Energie, die für die Ablösung des ersten Elektrons nötig ist, nennt man die 1. Ionisierungsenergie: Energie + E → E+ + e- (E = irgendein Element). 2.6.2 2. Ionisierungsenergie Die 2. Ionisierungsenergie bezieht sich dann auf den Vorgang: Energie + E+ → E2+ + eUnd entsprechend für alle weiteren Ionisierungsenergien. 6 2. Periodensystem Die im Diagramm aufgetragenen Energien entsprechen jeweils der 1.Ionisierungsenergie. Edelgase geben sehr „ungern“ ein Elektron ab (Hohe Ionisierungsenergie, abgeschlossene Schale). Alkalielemente geben sehr „leicht“ ein Elektron ab (Niedrige Ionisierungsenergie). Abgabe eines Elektrons führt zu der Elektronenkonfiguration des im Periodensystem jeweils vorhergehenden Edelgases und damit zu einer besonders stabilen Elektronenkonfiguration. 2.6.3 Voll besetzte Unterschalen Voll besetzte Unterschalen sind offenbar auch besonders stabil: Im Vergleich zu den jeweils nachfolgenden Elementen der dritten Hauptgruppe (Elektronenkonfiguration s2p1 ) haben die Erdalkalielemente (Elektronenkonfiguration s2), das sind die Elemente der zweiten Hauptgruppe, höhere Ionisierungsenergien (Siehe Diagramm). 2.6.4 Halb besetzte Unterschalen Halb besetzte Unterschalen sind ebenfalls energetisch bevorzugt: Die Elemente mit der Elektronenkonfiguration s2p3 , das sind die Elemente der fünften Hauptgruppe (N, P, As, Sb, Bi, Elektronenkonfiguration s2p4 ) haben, jedenfalls für die Vertreter Stickstoff bis Arsen, im Vergleich zu den im Periodensystem nachfolgenden Elementen (6. Hauptgruppe, O, S, Se, Te) höhere Ionisierungsenergien (Siehe Diagramm): Die halb gefüllte p-Schale, die nach der Hund’schen Regel mit drei Elektronen mit parallelem Spin, je eines in jedem der drei p-Orbitale, bei den Elementen der fünften Hauptgruppe realisiert ist, ist vergleichsweise energetisch bevorzugt. 2.6.5 Anstieg der Ionisierungsenergien innerhalb einer Periode Die Ionisierungsenergien steigen innerhalb einer Periode an. Deutung hierfür ist , dass innerhalb der Periode bei jedem weiteren Element die Kernladung um eine Einheit steigt. Das Atom bleibt zwar neutral, da mit jeder neuen Kernladung auch ein neues Elektron dazukommt. Die Elektronen in den - innerhalb der Periode ja immer nur teilweise besetzten - Valenz-Schalen können die vergrößerte Kernladung nur teilweise abschirmen. Dadurch steigt die Energie, die zur Ablösung eines Elektrons nötig ist. Zugleich wird der Radius des Atoms kleiner (s.u.). 7 2. Periodensystem 2.6.6 n-te Ionisierungsenergien Die Ablösung eines Elektrons lässt das Atom mit einer zusätzlichen positiven Ladung zurück. Je höher diese positive Ladung ist, desto schwerer lassen sich weitere Elektronen ablösen (Coulomb-Anziehung). Dies zeigt sich in den entsprechend ansteigenden n-ten Ionisierungsenergien. 2.6.7 Periodizität Periodizität: Elektronen aus den unterhalb der Valenzorbitale gefüllten abgeschlossenen Schalen lassen sich wesentlich schwerer ablösen als solche aus der Valenzschale (Siehe Diagramm). 2.7 Atom- und Ionen-Radien Innerhalb einer Periode: Radien nehmen mit zunehmender Kernladung ab („von links nach rechts“). Deutung: s.o.! Innerhalb einer Gruppe: Radien nehmen mit steigender Kernladungszahl („von oben nach unten“) zu. Deutung: 1. Die abgeschlossenen Schalen, die mit jeder neuen Periode neu dazukommen, schirmen die Kernladung gut ab. 8 2. Periodensystem 2. Die Ausdehnung der Valenzorbitale wird durch die Hauptquantenzahl bestimmt, die sich mit jeder neuen Periode erhöht. Die Radien von negativ geladenen Ionen (Anionen) sind größer als die Radien der neutralen Elemente. Deutung: Die Elektronen verspüren weniger Kernladung. Die Radien von positiv geladenen Ionen (Kationen) sind kleiner als die Radien der neutralen Elemente. Deutung: Die verbleibenden Elektronen verspüren die Kernladung stärker. 2.7.1 Kovalenz-Radien Das sind Radien, die man den Elementen auf folgende Weise zuordnet: Der Abstand, den zwei Elemente voneinander in einer Verbindung haben wird halbiert. Das kommt der Vorstellung gleich, die Elemente verhielten sich wie Kugeln, die in der Verbindung aneinander stoßen. Den Abstand kann man durch Beugungsexperimente (s.v.) quantitativ bestimmen. 2.7.2 Ionen-Radien Das sind Radien, die man den von den Elementen gebildeten Ionen zuordnet. Die Hypothese ist dabei, dass „salzartige“ Verbindungen sich so beschreiben lassen, als seien sie aus Ionen (Kationen: Positiv geladen; Anionen: Negativ geladen) aufgebaut. In dieser Vorstellung werden die Verbindungen dann durch die Coulomb-Kräfte zwischen den entgegengesetzt geladenen Ionen zusammengehalten. Die Ionen selbst werden dabei als Kugeln beschrieben, die im Kristall zusammenstoßen, so dass aus der Struktur des Salzes auf den Ionenradius geschlossen werden kann. Die Struktur wird jeweils durch Beugungsexperimente ermittelt. (Siehe Kapitel 3: “Chemische Bindung“). 9 2. Periodensystem 2.8 Elektronenaffinität Die Elektronenaffinität bezeichnet die Energie, die umgesetzt wird, wenn ein Element ein Elektron aufnimmt: E + e- → E- + Energie (E = irgendein Element, Atome in der Gasphase) Ihrem Betrag nach entspricht diese Energie der Ionisierungsenergie des entsprechenden Anions: E- + Energie → E + e(E = irgendein Element, Atome in der Gasphase) Die Elektronenaffinitäten haben durchwegs kleinere Beträge als die Ionisierungsenergien. Die größte Elektronenaffinität hat Fluor: F + e- → F- + Energie; EA = 328 kJmol-1 . Häufig muss Energie aufgewendet werden, um einem Element ein Elektron zuzuführen (positive Werte in der Tabelle). 10 2. Periodensystem Um einem Anion E- eine weiteres Elektron unter Bildung von E2- aufzuprägen (In der Tabelle nicht gezeigt) ist immer Energie notwendig (z.B. O2- , S2- , die nur in der Stabilisierung in ionischen Festkörpern vorkommen). Die Elektronenaffinitäten sind am größten für die Halogene. Deutung: a) Die Radien der Halogenatome sind die kleinsten in der jeweiligen Periode (s.v.) und die Anziehung durch den Kern ist damit am größten. b) Halogenatome haben die Elektronenkonfiguration s2p5 , es fehlt ihnen also ein Elektron, um die Elektronenkonfiguration des im Periodensystem nachfolgenden Edelgases s2p6 zu erreichen. Die im Anion erreichte voll gefüllte Schale macht das Anion stabil und die Elektronenaffinität der Halogene damit groß. 2.9 Lanthanoiden-Kontraktion Die f-Schale ist erst nach Einbau der 6s –Elektronen sowie eines 5d – Elektrons stabil genug um aufgefüllt zu werden. Auf Lanthan, Elektronenkonfiguration 6s25d1, das damit ein Element der dritten Nebengruppe ist, folgen die 14 Lanthanoiden-Elemente. Da der Radius der Orbitale außer durch die Kernladung durch die Hauptquantenzahl bestimmt wird, sind die 4f – Orbitale kleiner als die 5d und 6s – Orbitale. Die Chemie dieser Elemente wird durch die drei äußeren Elektronen s2d1 bestimmt. Der Radius der Lanthanoiden-Elemente nimmt dabei mit zunehmender Kernladung von Cer bis Lutetium ab, so dass die im Periodensystem folgenden d- Elemente Hafnium bis Quecksilber und Thallium bis Bismuth kleinere Radien haben, als nach einer Extrapolation innerhalb der Radien der Elemente ihrer jeweiligen Gruppe zu erwarten wäre. 11 2. Periodensystem 2.10 Index A M Anionen .................................................... 9 Magnetische Quantenzahl .........................2 D N Drehimpuls ............................................... 2 Nebenquantenzahl.....................................2 E P Edelgas...................................................... 4 Elektronenpaar.......................................... 3 Pauli ..........................................................2 G Spinquantenzahl ........................................2 Gesamtelektronenkonfiguration ............... 5 S U H Ungepaarte Elektronen..............................2 Hauptquantenzahl ..................................... 2 Hund ......................................................... 3 Hund’schen Regel..................................... 7 V Valenzelektronen ......................................5 K Kationen.................................................... 9 12