31 bis 40
Werbung
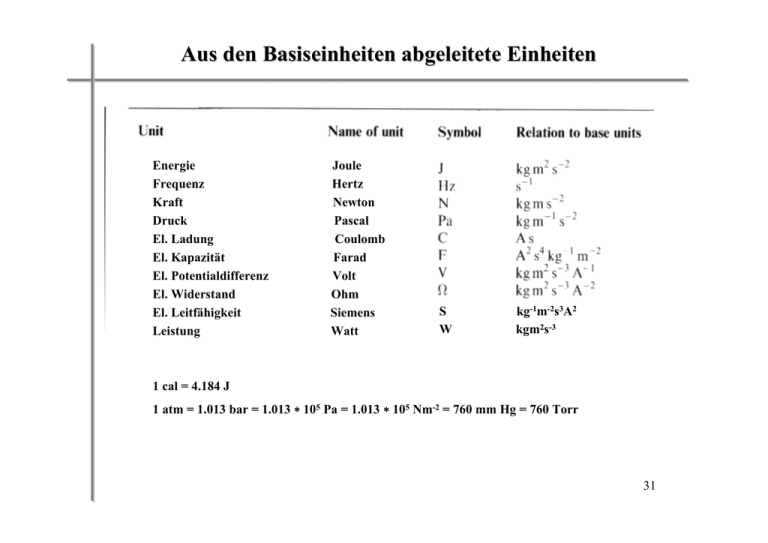
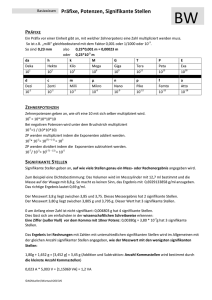
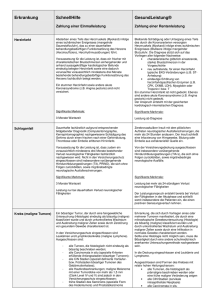
_________________________ Aus den Basiseinheiten abgeleitete Einheiten __________________________________ Energie Frequenz Kraft Druck El. Ladung El. Kapazität El. Potentialdifferenz El. Widerstand El. Leitfähigkeit Leistung Joule Hertz Newton Pascal Coulomb Farad Volt Ohm Siemens Watt S W kg-1m-2s3A2 kgm2s-3 1 cal = 4.184 J 1 atm = 1.013 bar = 1.013 ∗ 105 Pa = 1.013 ∗ 105 Nm-2 = 760 mm Hg = 760 Torr 31 _________________________ Bezug zwischen älteren und neueren Maßeinheiten __________________________________ 1 pound (lb) = 453,6 g 1 Zoll (´´) = 1 inch (in) = 2,54 cm 1 quart (qt) = 0,946 L 1 US pint = 0.473 L 1 engl. pint = 0,569 L 1 Gallone = 3,78 L 1 Fuß = 0,305 m 1 Yard = 0,914 m 1 Meile = 1,61 km 1 Seemeile = 1,85 km (1 Knoten = 1 Seemeile /Stunde) Titanic: max. Geschwindigkeit 22,3 Knoten 1 Unze (1 oz) = 28,35 g 1 Feinunze = 31,104 g (für Edelmetallhandel) 24 Karat (Kt) Gold = 100% Gold (18 Karat: enthält 18 Teile Gold + 6 Teile andere Metalle etc.) aber 1 Karat: 0,2 g (für Handel mit Diamanten und Edelsteinen) 32 _________________________ Präfixe im SI-System __________________________________ 33 _________________________ Vergleich verschiedener Temperaturskalen __________________________________ Kelvin (K) Celsius (°C) Fahrenheit (°F) 373.15 K 310.15 K 273.15 K K = °C + 273.15 °C = 5/9 (°F -32) oder °F = 9/5 (°C) + 32 34 _________________________ Abgeleitete Maßeinheiten __________________________________ Volumen = Länge x Breite x Höhe d.h. ein Würfel von 1 m Kantenlänge hat eine Volumen von 1 m3 Dichte = Masse pro Volumeneinheit d (ρ ) = Masse g = 3 = gcm −3 Volumen cm 35 _________________________ Extensive und Intensive Eigenschaften __________________________________ Bei einer extensiven Eigenschaft hängt der erhaltene Messwert von der Größe der betrachteten Probe ab. Bei einer intensiven Eigenschaft ist der erhaltene Messwert von der Größe der Probe unabhängig. Masse: extensive Eigenschaft Temperatur: intensive Eigenschaft 36 _________________________ Auswertung von Messungen __________________________________ • • • Umrechnungsfaktoren Genauigkeit und Präzision von Messwerten Signifikante Stellen (Messwerte werden generell so wiedergegeben, dass nur die letzte Stelle unsicher ist) • Prozentualer Masseanteil 37 _________________________ Exakte und Nichtexakte Zahlen Signifikante Stellen ↔ Unsicherheit von Messungen __________________________________ • • • • exakte Zahlen: 12 in einem Dutzend, 1000 g in 1 kg Zahlen von Messwerten sind immer nichtexakt, d.h. sie enthalten eine Ungenauigkeit alle Stellen eines Messwertes, inklusive der ersten unsicheren Stelle, sind signifikante Stellen Bedeutung von Nullen: • Nullen zwischen Nicht-0 Stellen sind immer signifikant (z.B.: 1005 kg → vier signifikante Stellen 1.03 cm → drei signifikante Stellen) • Nullen zu Beginn einer Zahl sind nicht signifikant, d.h. sie bestimmen nur die Position des Dezimalpunktes (z.B.: 0.02 g → eine signifikante Stelle 0.0026 cm → zwei signifikante Stellen) • Nullen am Ende einer Zahl sind signifikant, wenn die Zahl einen Dezimalpunkt enthält (0.0200 g → drei signifikante Stellen) 38 _________________________ Präzision (precision): ist ein Maß, wie gut Einzelmessungen übereinstimmen Genauigkeit (accuracy): ist ein Maß wie gut Einzelmessungen mit dem wahren Wert übereinstimmen 39 _________________________ Der Aufbau der Materie __________________________________ Ein Atom ist das kleinste Teilchen, in das sich ein chemisches Element zerlegen lässt, und das dabei noch alle chemischen Eigenschaften dieses Elementes aufweist. Ein chemisches Element ist ein Stoff, der nur aus Atomen mit gleichen chemischen Eigenschaften aufgebaut ist. Wir werden feststellen, dass sich Atome aus noch kleineren, subatomaren Teilchen aufbauen und Atome verschiedener Elemente diese Teilchen in unterschiedlicher Zahl enthalten. 40