Vorlesung 1 - TU Chemnitz
Werbung

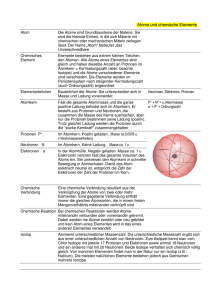
Allgemeine Chemie 1 Skript Allgemeine und Anorganische Chemie Inhaltsverzeichnis: 1. Atome............................................................................................................................................3 A Elektronen ................................................................................................................................3 B Protonen....................................................................................................................................4 C Neutronen .................................................................................................................................5 D Aufbau von Atomen .................................................................................................................5 E Isotope.......................................................................................................................................6 F Radioaktivität ............................................................................................................................6 2. Stöchiometrie..............................................................................................................................11 A Moleküle.................................................................................................................................11 B Ionen .......................................................................................................................................12 C Empirische Formel .................................................................................................................12 D Avogadro – Zahl.....................................................................................................................12 3. Elektronen/ Atommodelle ...........................................................................................................13 A Elektromagnetische Strahlung................................................................................................13 B Welle – Teilchen Dualismus...................................................................................................16 C Wellenfunktion .......................................................................................................................17 D Quantenzahlen und Orbitale...................................................................................................20 E Elektronenstruktur von Atomen mit mehr als einem Elektron ...............................................23 F Das Periodensystem ................................................................................................................26 4. Chemische Bindungen ................................................................................................................31 A Ionische Bindung....................................................................................................................31 B Kovalente Bindung, Lewis Formeln.......................................................................................32 C Ausnahmen der Oktettregel ....................................................................................................34 D Vergleich ................................................................................................................................35 E Dissoziationsenergie ...............................................................................................................36 5. Räumliche und elektronische Struktur von Molekülen...............................................................37 A VSEPR-Modell.......................................................................................................................37 B Valence-Bond (VB) – Theorie ...............................................................................................42 C Hybridorbitale.........................................................................................................................44 D Molekülorbitale ......................................................................................................................44 6. Gase............................................................................................................................................47 A Druck ......................................................................................................................................48 B Gesetz von Boyle....................................................................................................................48 C Gesetz von Gay-Lussac ..........................................................................................................48 D Ideales Gasgesetz ...................................................................................................................49 E Daltonsches Gesetz für Partialdrücke .....................................................................................50 F Reale Gase...............................................................................................................................51 Allgemeine Chemie 2 7. Flüssigkeiten...............................................................................................................................52 A Intermolekulare Kräfte ...........................................................................................................52 B Wasserstoffbrückenbindung ...................................................................................................55 C Struktur von Flüssigkeiten......................................................................................................57 8. Festkörper ..................................................................................................................................58 A Amorphe Festkörper...............................................................................................................59 B Ionenkristalle ..........................................................................................................................59 C Metallkristalle.........................................................................................................................60 D Molekülkristalle und Vernetzte Festkörper............................................................................61 9. Thermodynamik – 1. Hauptsatz..................................................................................................62 A Begriffe...................................................................................................................................62 B Reversible und Irreversible Vorgänge ....................................................................................63 C Wärme ....................................................................................................................................64 D Der 1. Hauptsatz der Thermodynamik ...................................................................................65 E Enthalpie .................................................................................................................................66 F Standardbildungsenthalpien ....................................................................................................67 10. Thermodynamik – 2. und 3. Hauptsatz.....................................................................................68 A Spontane Prozesse ..................................................................................................................68 B Entropie und freie Enthalpie G (Gibbssche freie Energie).....................................................68 11. Lösungen ..................................................................................................................................70 A Auflösungsprozess..................................................................................................................70 B Lösungsenthalpie ....................................................................................................................71 C Prinzip des kleinsten Zwangs .................................................................................................72 D Konzentration von Lösungen .................................................................................................72 12. Das chemische Gleichgewicht..................................................................................................72 A Die Gleichgewichtskonstante .................................................................................................74 B Thermodynamik und Gleichgewicht ......................................................................................76 13. Säuren und Basen.....................................................................................................................77 A Definition nach Brønstedt-Lowry ..........................................................................................77 B Lewis-Säuren/Basen ...............................................................................................................79 C pH-Wert ..................................................................................................................................80 D Starke und schwache Säuren und Basen ................................................................................82 14. Redoxreaktionen.......................................................................................................................85 A Oxidationszahlen (OZ) ...........................................................................................................86 B Redoxreaktionen.....................................................................................................................87 15. Reaktionskinetik .......................................................................................................................88 A Momentane Geschwindigkeit + Konzentrationsabhängigkeit ...............................................89 B Zeitabhängigkeit der Konzentration .......................................................................................90 Allgemeine Chemie 3 1. Atome • gr. atomos = unteilbar • heute: Atome sind teilbar, aber das fällt in die Physik John Dalton (1766 - 1844): • Jedes Element besteht aus kleinsten, nicht teilbaren Teilchen. • Alle Atome eines Elements sind gleich. Alle Atome von verschiedenen Elementen sind verschieden. • Bei chemischen Reaktionen werden Atome verbunden oder getrennt. Es werden keine Atome zerstört oder umgewandelt. • Eine chemische Verbindung resultiert aus der Verknüpfung von Atomen jeweils der gleichen Sorte in einem festen Mengenverhältnis. ⇒ Gesetz der Erhaltung der Masse: Die Summe der Masse der Reaktanden ist gleich der Summe der Masse der Produkte. „Teilen“ von Atomen (Atome bestehen aus subatomaren Teilchen) Elektronen, e- Protonen (2 up und 2 down Quarks) A Elektronen • negative Ladung: e ≡ 1,6022 ⋅10 −19 C e … elementare Ladung • sehr geringe Masse: m = 9,1094 ⋅ 10− 28 g ≡ 0,0055 u Neutronen (1 up und 1 down Quarks) Allgemeine Chemie • Erzeugung: Vakuum _ _ _ _ + Anode Kathode Kathodenstrahl Abbildung 1: Elektronenerzeugung mit Hilfe eines Kathodenstrahls B Protonen • Ladung: q = +1e • Masse: m = 1,6726 ⋅ 10− 24 g ≈ 1,07276 u • Erzeugung: Vakuum e- ⋅H + Kanalstrahl _ Kathode + Anode Abbildung 2: Erzeugung von Protonen 4 Allgemeine Chemie C Neutronen • keine Ladung • Masse: m = 1,6749 ⋅10 −24 g D Aufbau von Atomen . Radius Kern ≈ 1 fm = 10 -15 m Radius Atom ≈ 100 - 400 pm = 100 - 400 ⋅ 10 -12 m • Kerne bestehen (mit Ausnahme von 11 H ) aus Protonen und Neutronen • Anzahl der Elektronen entspricht der Anzahl der Protonen ⇒ Ladung eines Atoms ist neutral: q = 0, wenn q ≠ 0, dann Ionen A Z Atomsymbol z.B. 35 17 Cl Ladung A Z AtomsymbolAnzahl z.B. 37 17 Cl − Z… Anzahl der Protonen; Kernladungszahl, Ordnungszahl A… Anzahl der Neutronen + Z; Kernmasse 5 Allgemeine Chemie 6 E Isotope Gleiche Anzahl von Protonen und Elektronen , aber unterschiedliche Anzahl von Neutronen ⇒ gleiche chemische Eigenschaften, aber unterschiedliche Masse Bsp.: Urananreicherung 235 U Anteil von 0,7 % 238 U → kommt in UF6 vor F Radioaktivität 1896 entdeckt von Henri Becquerel Name der Art der Strahlung Strahlung 1. α - Strahlung 2. β - Strahlung 3. γ - Strahlung 4.* Positron Strahlung Geschwindigkeit Teilchenstrahlung ( He ⇒ α − Teilchen ) 4 2 Teilchenstrahlung (e − ⇒ β − Teilchen ) elektromagnetische Strahlen (Photonen) – β+ (Positron) 1 1 6.* n - Strahlung n Neutron Abschirmung v < 10% c Papier, Haut v < 90% c 3 mm Aluminium v=c v < 90% c H − Kern, Proton 5.* p - Strahlung Reichweite/ v < 10% c v < 10% c *4. – 6. sind besondere Strahlungsarten, die seltener auftreten Tabelle 1: Strahlungsarten mehrere cm Blei, 1 m Beton 3 mm Aluminium