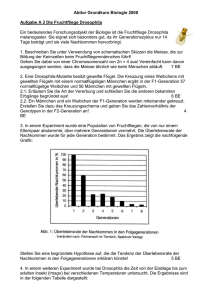
ZIP
Werbung

Altern von Gastrophysa viridula (DE GEER). Modifikationen durch biotische und abiotische Faktoren (Diapause, Fortpflanzung und Freilandbedingungen). Dissertation zur Erlangung des akademischen Grades doctor rerum naturalium ( Dr.rer.nat.) im Fach Biologie eingereicht an der Fakultät für Biologie, Institut für Biologie I (Zoologie) der Albert‐Ludwigs‐Universität Freiburg. von THOMAS BRAUN (Freiburg i. Brsg) November 2008 Dekan der Fakultät: Prof. Dr. Ralf Reski Promotionsvorsitzender: Prof. Dr. Eberhard Schäfer Betreuer der Arbeit: Prof. Dr. Klaus‐Günter Collatz Koreferent: Prof. Dr. Gerhard Bauer 3. Prüfer: PD Dr. Gerhard Leubner Tag der mündlichen Prüfung: 25. August 2009 Zusammenfassung ZUSAMMENFASSUNG In der vorliegenden Arbeit wurde die Modifizierbarkeit des Alterns durch Variation bioti‐ scher und abiotischer Faktoren am grünen Ampferblattkäfer Gastrophysa viridula untersucht. Bei einer Reduktion der Lichtlänge auf 7 Stunden ging G. viridula, trotz einer konstanten Temperatur von 20°C, in eine reproduktive Imaginaldiapause. In dieser Phase zeigten die Überlebenskurven der untersuchten Tiere einen exponentiellen Verlauf, wie er für eine nicht alternde Population charakteristisch ist. Die maximale Lebensdauer der Käfer war in Dia‐ pause um bis zu 300 Prozent erhöht. Der Stoffwechsel der Käfer war unter Diapausebedingungen stark reduziert. Die spezifi‐ schen Aktivitäten von Schlüsselenzymen der Glykolyse (Phosphofructokinase und Pyruvat‐ kinase) waren ebenso reduziert, wie die Aktivität der Glykogen‐Phosporylase. Die spezifi‐ sche Aktivität des muskelphysiologisch relevanten Enzyms Argininphosphokinase wurde während der Diapause ebenfalls reduziert. Wurde die Diapause durch Induktion von Langtagbedingungen nach 60 bzw. 120 Tagen gebrochen, lebten die Käfer anschließend einen normalen diapausefreien 60tägigen Langtag‐ zyklus, in welchem sich die Tiere auch reproduzierten. Der Alterungsprozess war bei G. viridula von der Umgebungstemperatur abhängig. Die Lebensdauer war negativ mit einer zunehmenden Temperatur korreliert. Die Reproduktion beeinflusste ebenfalls das Altern der Tiere. Kopulationen verringerten ihre Lebensdauer. Die Eiproduktion hatte keinen Einfluss auf die Lebensdauer der Käfer‐ weibchen. Nahrungsentzug, durchgeführt als intermittierende Fütterung, hatte eine erhöhte Mortali‐ tätsrate sowohl bei Männchen als auch bei Weibchen zur Folge. Unter Freilandbedingungen wiesen die Tiere eine erhöhte Lebensdauer auf. Die Käfer hatten im Vergleich zu Laborpopulationen eine reduzierte Stoffwechselrate. Freilandbedin‐ gungen hatten keinen Einfluss auf die tägliche Eiablage der Weibchen. Schlagworte: Gastrophysa viridula; Altern; Diapause; Reproduktion Abstract ABSTRACT In the present study the modifiability of ageing in the chrysomelid beetle Gastrophysa viridula by variations of biotic and abiotic factors was investigated. When the daylight was reduced to 7 hours, G. viridula entered an imaginale diapause in spite of an environmental temperature of 20°C. In this phase the survival curves of the bee‐ tles showed an exponential progression as is typical for a non‐ageing population. During diapause the maximum life span increased 300 percent. The metabolism of the beetles was drastically reduced during diapause. The specific ac‐ tivities of key glycolytic enzymes (phosphofructo‐kinase and pyruvate kinase) were reduced as well as the activity of the glycogen phosphorylase. The specific activity of muscle relevant enzyme arginine phospho‐kinase was also significantly lowered. When the diapause was broken after 60 and 120 days by induction of long‐day conditions, the beetles lived a normal 60‐day long‐day cycle during which they reproduce. The ageing process of G. viridula depended on the surrounding temperature. Its lifespan was negatively correlated with temperature. The reproduction also influenced the process of ageing. Copulations decreased the life span of the animals. In contrast the egg production did not effect the lifespan of female beetles. Food deprivation via intermittent feeding increased the mortality rate of both males and females. Under outdoor conditions life span is higher than in laboratory populations. Compared to laboratory conditions the beetles had a reduced metabolism. Outdoor conditions had no effect on the daily oviposition of the females. Keywords: Gastrophysa viridula, Aging, Diapause, Reproduction Abkürzungen ABKÜRZUNGEN ADP Adenosindiphosphat AMP Adenosinmonophosphat APK Argininphosphokinase ATP Adenosintriphosphat BSA Bovines Serumalbumin EDTA Ethylendiamintetraacetat L/D Licht/Dunkel NAD/NADH Nicotinamidadenindinukleotid NADP/NADPH Nicotinamidadenindinukleotidposphat PEP Phosphoenolpyruvat PFK Phosphofructokinase PK Pyruvatkinase TRA‐Puffer Triethanolamin‐Puffer Tris‐Puffer Trishydroxymethyl‐Amminomethan‐Puffer Inhaltsverzeichnis INHALTSVERZEICHNIS I. Einleitung 1 1 2. Programmierter Tod und potentielle Unsterblichkeit 2 3. Altern, Seneszenz und evolutive Alternstheorien 3 4. Altern bei Insekten 5 5. Auswirkungen von Umwelteinflüssen auf das Altern 6 5.1. BIOTISCHE FAKTOREN ‐ Kopulation und Reproduktion 6 5.2. ABIOTISCHE FAKTOREN – Temperatur und Licht 7 1. Der Alterungsprozess 6. Dormanzerscheinungen 8 7. Dormanz und Altern 12 8. Altern unter Freilandbedingungen 12 9. Der grüne Ampferblattkäfer, Gastrophysa viridula (DeGeer) 13 10. Fragestellung 16 18 II. Material und Methoden A. Allgemeiner Teil 18 1. Versuchstiere 18 1.1. ALLGEMEINE HALTUNG UND ZUCHT 19 2. Überlebenskurven 21 3. Kohlendioxidbestimmung 21 3.1. TESTPRINZIP 21 3.2. DURCHFÜHRUNG 22 3.3. AUSWERTUNG 23 VI Inhaltsverzeichnis 4. Reproduktionsleistung 4.1. EIGRÖßEN 23 23 23 B. Spezieller Teil: Abiotische Faktoren 24 1. Diapause 5. Statistik 24 24 1.1.1. Sensitive Phase 24 1.1.2. Kritische Photoperiode 24 1.1. VORVERSUCHE 1.2. DIAPAUSE 25 1.2.1. Haltung und Zucht 25 25 2. Physiologische Reaktionen in Diapause 26 2.1. KOHLENDIOXID ALS PARAMETER FÜR DIE STOFFWECHSELAKTIVITÄT 26 2.2. BESTIMMUNG DER AKTIVITÄT DER GLYKOGEN‐PHOSPHORYLASE 26 1.3. FRAßLEISTUNG 26 2.2.2. Bestimmung der Aktivität der Phosphorylase 27 2.3. BESTIMMUNG DER AKTIVITÄT DER PHOSPHOFRUCTOKINASE (PFK) 28 2.2.1. Homogenatherstellung 2.3.1. Homogenatherstellung 28 2.3.2. Bestimmung der Aktivität der Phosphofructokinase 28 2.4. BESTIMMUNG DER AKTIVITÄT DER PYRUVATKINASE (PK) 29 29 2.4.2. Bestimmung der Aktivität der Pyruvatkinase 30 2.5. BESTIMMUNG DER AKTIVITÄT DER ARGININPHOSPHOKINASE (APK) 31 2.4.1 Homogenatherstellung 2.5.1 Homogenatherstellung 31 2.5.2. Bestimmung der Aktivität der Argininphosphokinase 31 2.6. PROTEINBESTIMMUNG 32 2.6.1.Testprinzip der Proteinbestimmung 32 2.6.2. Durchführung und Messung 33 VII Inhaltsverzeichnis 2.7. LIPIDBESTIMMUNG 33 2.7.1. Testprinzip der Lipidbestimmung 33 2.7.2. Durchführung und Auswertung 33 3. Unterbrechung der Diapause 35 35 35 35 4.1. PRÄPARATION DER HODEN UND HODENGRÖßE 35 4.2. SPERMIENPRODUKTION 35 5. Einfluss der Temperatur 36 5.1. VERSCHIEDENE TEMPERATUREN 36 C. Spezieller Teil: Biotische Faktoren 36 1. Geschlechtspartner 36 1.1. VIRGINELLE UND VERPAARTE POPULATIONEN 36 3.1. DIAPAUSEBRUCH 3.2. KOHLENDIOXIDPRODUKTION 4. Status der Männchen in Diapause 1.1.1. Kohlendioxidproduktion 36 1.1.2. Reproduktionsleistung 36 1.2. VERZÖGERTE KOPULATIONEN 37 37 1.3. VERSCHIEBUNG DES GESCHLECHTERVERHÄLTNISSES 2. Nahrung 37 2.1. INTERMITTIERENDE FÜTTERUNG 37 2.2. NAHRUNGSMENGE 38 D. Spezieller Teil: Altern unter Freilandbedingungen 38 1. Freilandbedingungen 38 1.1. FREILANDVERSUCHE 38 1.2. KOHLENDIOXIDPRODUKTION 40 1.3. REPRODUKTIONSLEISTUNG 40 VIII Inhaltsverzeichnis III. Ergebnisse 41 Teil A: Abiotische Faktoren 41 1. Diapause 41 41 1.1.1. Sensitive Phase 41 42 43 1.3. FRAßLEISTUNG DER KÄFER IN DIAPAUSE 45 2. Physiologische Reaktionen in Diapause 47 1.1. VORVERSUCHE 1.1.2. Kritische Tageslänge 1.2. ÜBERLEBENSKURVEN 2.1. STOFFWECHSELRATEN 47 2.2. GLYKOGEN‐PHOSPHORYLASE 48 2.3. PHOSPHOFRUCTOKINASE (PFK) 49 2.4. PYRUVATKINASE (PK) 51 2.5. ARGININPHOSPHOKINASE (APK) 53 2.6. LIPIDBESTIMMUNG 54 3. Unterbrechung der Diapause 56 56 58 4. Status der Männchen unter Kurztagbedingungen 59 3.1. DIAPAUSEBRUCH 3.2. KOHLENDIOXIDPRODUKTION 4.1. HODENGRÖßE 59 4.2. SPERMIEN 61 5. Einfluss der Temperatur 63 5.1. ÜBERLEBENSKURVEN 63 IX Inhaltsverzeichnis Teil B: Biotische Faktoren 66 1. Geschlechtspartner 66 1.1. VIRGINELLE UND VERPAARTE POPULATIONEN 66 1.1.1. Überlebenskurven 66 1.1.2. Kohlendioxidproduktion 68 1.1.3. Eiablage 70 1.1.4. Eigröße 73 1.2. VERZÖGERTE KOPULATION 74 1.3. EINS ZU DREI VERPAARUNG 76 78 2.1. INTERMITTIERENDE FÜTTERUNG 78 80 2. Nahrung 2.2. FRAßLEISTUNG BEI INTERMITTIERENDER FÜTTERUNG Teil C: Altern unter Freilandbedingungen 82 1. Freilandversuche 82 1.1. ÜBERLEBENSKURVEN 82 85 1.2. KOHLENDIOXIDPRODUKTION IV. Diskussion 87 Teil A: Abiotische Faktoren 87 1. Diapauseinduktion 87 2. Diapause 88 2.1. ÜBERLEBENSKURVEN 88 2.2. FRAßMENGE 89 90 91 2.3. KOHLENDIOXIDPRODUKTION 2.4. ENZYMAKTIVITÄTEN WÄHREND DER DIAPAUSE 2.4.1. Glykogen‐Phosphorylase 92 2.4.2. Phosphofructokinase 92 X Inhaltsverzeichnis 2.4.3. Pyruvatkinase 93 2.4.4. Argininphosphokinase 93 94 2.6. INDUZIERTER BRUCH DER DIAPAUSE 95 2.7. MÄNNCHEN IN DIAPAUSE 2.5. LIPIDBE 96 98 3.1. EINFLUSS DER UMGEBUNGSTEMPERATUR 98 3. Temperatur Teil B: Biotische Faktoren 99 1. Geschlechtspartner 99 99 1.2. VERPAARUNG UND STOFFWECHSELRATE 102 1.3. EIABLAGE UND LEBENSDAUER 102 1.4. KOPULATION UND LEBENSDAUER 104 105 105 1.1. KOPULATION UND VERPAARUNG 2. Nahrung 2.1. INTERMITTIERENDE FÜTTERUNG UND LEBENSDAUER Teil C: Wechselbedingungen im Freiland 107 1. Freilandbedingungen 107 1.1. ÜBERLEBENSKURVEN 107 1.2. STOFFWECHSELRATE 108 108 1.3. EIABLAGE UNTER FREILANDBEDINGUNGEN Teil D: Abschließende Betrachtung 110 V. Literatur 113 126 Anhang XI Einleitung I. EINLEITUNG 1. Der Alterungsprozess Der Prozess des Alterns bewegt und bewegte die Menschen zu allen Zeiten. Im heutigen Sprachgebrauch wird A l t e r gewöhnlich im Sinne von Lebensjahren, Lebensabschnitt und als Gegenwort zu Jugend verwendet. Die Bedeutungspole des Wortfeldes in ihrer heutigen Anwendung sind stark reduziert. Die indogermanische Wurzel „al“ bedeutete ursprünglich: wachsen, wachsen machen, nähren. Der etymologische Hintergrund ist den modernen wissenschaftlichen Beschreibungen der Alterungsprozesse verblüffend ähnlich, vergleicht man ihn etwa mit der Definition von BÜRGER, der 1960 Altern als eine irreversible, zeitabhängige Ver‐ änderung von Strukturen und Funktionen lebendiger Systeme beschrieb. Bei einem Blick auf die Vielfältigkeit der Lebensformen in Flora und Fauna wird deutlich, wie schwierig es ist, den biologischen Alterungsprozess allgemein zu definieren; denn es finden sich Organismen, die anscheinend nicht altern, oder einem so langsamen Alterungsprozess unterliegen, dass man bisher nicht in der Lage ist, ihn zu messen. Das Wachstum, die Reproduktion sowie Differenzierungs‐ und Speichervorgänge sind elementare Prozesse, die das Leben eines Organismus beeinflussen. Diese Pro‐ zesse wirken sich auf das Altern aus – direkt und indirekt. Im Zusammenhang des Alterns bzw. bei der Beschreibung des Alterns wird häufig von der „life‐history“ einer Art, die die Lebenslaufstrategie beschreibt, gesprochen (STEARNS, 1992). Verschiedene Phasen innerhalb einer Lebenszyklusstrategien können zueinander in Konkurrenz stehen und sind deshalb oft negativ miteinander korreliert, da die vorhandenen Ressourcen begrenzt sind. Zwangsläufig führt dies dazu, dass jeder Organismus Kompromisse (trade‐offs) in der Verteilung von vorhandenen Res‐ sourcen eingehen muss (KIRKWOOD und HOLLIDAY, 1979). Diese Annahme stellt die Basis für die Disposable‐Soma‐Theorie (siehe Seite 5) dar. 1 Einleitung Auch Umwelteinflüsse haben einen wesentlichen Anteil an der intraspezifischen Varianz der Lebensspanne von Organismen und verleihen ihnen somit zum Teil eine erhebliche Plastizität. Die Umwelteinflüsse können entweder biotischer Natur, also der belebten Umwelt entstammen, wie z.B. Konkurrenz, Feinddruck, Nahrung und Geschlechtspartner; oder abiotischer Natur, also aus der unbelebten Umwelt entspringen, wie bei‐ spielsweise Temperatur, Licht, Luftfeuchte oder der Salzgehalt im wässrigen Milieu. Die Umgebungstemperatur beeinflusst das Altern von Insektenindividuen we‐ sentlich (LOEB und NORTHROP, 1917). Zahlreiche Arbeiten belegen dies, UGINE et al. (2007) beschrieben an der Sumpffliege Scatella tenuicosta, dass sich sowohl die Ent‐ wicklungszeit als auch die mittlere und maximale Lebensdauer bei einer Erhöhung der Umgebungstemperatur verringerten. Auch die Qualität der Nahrung kann sich auf den Lebenszyklus eines Individu‐ ums auswirken. WILKER (2000) konnte über die Veränderung der Verfügbarkeit von Proteinen als notwendiges Substrat zur Oogenese eine lebensverlängernde re‐ spektive lebensverkürzende Wirkung auf die Schmeißfliege Phormia terraenovae nachweisen. 2. Programmierter Tod und potentielle Unsterblichkeit Synchrones Sterben ist im Tierreich nicht selten. Es handelt sich hierbei um semel‐ pare Tiere, die sich in ihrem Leben nur einmal fortpflanzen, wie z.B. der pazifische Lachs oder auch viele Insekten. In diesem Zusammenhang kann von einem Fortpflanzungstod gesprochen werden. Dies verdeutlicht die enge Beziehung zwi‐ schen Reproduktion und Sterben. Manche Organismen scheinen auf den ersten Blick unsterblich zu sein, man spricht hier auch von einer somatischen Unsterblichkeit. Beispiele dafür sind Bakterien oder alle sich vegetativ vermehrende Invertebraten (MARTINEZ, 1997). Gerade im Pflanzenreich finden sich viele Arten, die anscheinend nicht altern. Ein mehrtausendjähriger Baum, z.B. ein Mammutbaum oder eine Eiche, setzt Blätter und 2 Einleitung Früchte von immer derselben Qualität an: Nicht Altern, sondern äußere Einflüsse wie z.B. Brände oder Pilzbefall lassen den Baum zu Grunde gehen. Bei nichtalternden Organismen ist die Wahrscheinlichkeit des Todes zu jedem Zeitpunkt gleich groß. Die alternsspezifische Mortalitätsrate ist konstant. Die dazugehörigen Überlebenskurven werden durch eine Exponentialfunktion beschrie‐ ben (KIRKWOOD und ROSE, 1991). 3. Altern, Seneszenz und evolutive Alternstheorien Schon WEISMANN (1882) wies auf die begrenzte Teilungsfähigkeit somatischer Zellen im Gegensatz zu den potentiell unsterblichen Keimbahnzellen hin. Er versuchte den Tod auf die beschränkte Vermehrungsfähigkeit der somatischen Zellen zurück‐ zuführen. Diese konnte später in vitro bewiesen werden (HAYFLICK, 1998). Es wird auch von einer replikativen Seneszenz, d.h. von einer verminderten Leistungsfähig‐ keit mit zunehmendem Alter gesprochen. COLLATZ und WILPS (1983) gehen bei Seneszenz – im Gegensatz zu Altern ‐ von einer stochastischen Anhäufung degenerativer Schäden vor allem nach der Reproduktionsphase, aus. Eine generelle Abnahme der Adaptationsfähigkeit eines Organismus gegenüber Umwelteinflüssen kennzeichnet das Altern. COLLATZ (1986) sieht den Beginn des Alterns mit dem Verschmelzen der Gameten, wobei hier Entwicklung und Altern untrennbar miteinander verknüpft sind. Für HAYFLICK (1998) beginnt der Alterungsprozess erst nach dem Zeitpunkt der sexuellen Reife und äußert sich dann durch einen Anstieg physiologischer Fehlfunktionen. Die Folgen des Alterns vor einer Fortpflanzung, also der Lebensspanne, auf die ein Selektionsdruck am stärksten wirkt, würden sich negativ auf das Individuum auswirken. Alterungsprozesse lassen sich generell in zwei Kategorien einteilen, das Zeitaltern (inneres oder intrinsisches Altern) und das Umweltaltern (äußeres oder extrinsisches Altern). Wichtige Faktoren, die das extrinsische Altern beeinflussen sind bei Wildpo‐ pulationen: Fressfeinde, Parasiten und Parasitoide. 3 Einleitung Wie bereits erwähnt lässt sich mit BÜRGER (1960) allgemein sagen, dass Altern eine Funktion der Zeit ist, und sich in der belebten Natur durch nicht umkehrbare Ver‐ änderungen ausdrückt. Welche Veränderungen man nun dem Altern zuordnet, bleibt Interpretationssache. Den unterschiedlichen Versuchen einer allgemein gültigen Definition der Alterungs‐ prozesse folgten eine Vielzahl von unterschiedlichen Alternstheorien (MEDVEDEV, 1990), die alle auf der fundamentalen Vorstellung beruhen, dass sich Altern durch einen Anstieg molekularer Fehlfunktionen äußert (HAYFLICK, 1998; HUGHES et al., 2002). Bei der Frage nach dem Grund des Alterns gibt es proximate und ultimate Theorien. WEISMANN (1882) sah im Tod einen Selektionsvorteil. Er spricht von der „Zweck‐ mäßigkeit des Todes“. Abgenutzte Individuen seien wertlos, sogar schädlich für die Population, indem sie jüngeren den Platz wegnehmen. Außerdem sei die Gefahr einer Überbevölkerung des Lebensraums groß (WEISMANN, 1891). In der angelsächsischen Literatur ist die gängige Lehrmeinung, dass die Entsteh‐ ung von Altern und Tod eine unabänderliche Konsequenz evolutionsbiologischer Mechanismen darstellt (TANNER, 1999). Das Phänomen des Alterns sei „non‐adaptiv“, d.h. ihm liegt weder eine Anpassung noch etwas Positives zugrunde. Altern ergibt sich aus der Tatsache, dass der „junge“ Organismus optimiert wird, möglichst viele überlebensfähige Nachkommen zu produzieren. Dieser Umstand ist beim „alten“ Organismus nicht mehr der Fall. In einer späten Lebensphase wird nicht mehr gegen eine nachteilige Eigenschaft selektioniert. Damit akkumuliert je‐ der Organismus genetisch festgelegte Minus‐Eigenschaften (MEDAWAR, 1952; Muta‐ tions‐Akkumulationstheorie). Die von G.C. WILLIAMS (1957) formulierte antagonistische Pleiotropie‐Theorie geht davon aus, dass Gene, die zu Beginn der Entwicklung einen positiven Effekt haben, von der Evolution bevorzugt werden, auch wenn sie mit fortschreitendem Alter ne‐ gative Auswirkungen zeigen. 4 Einleitung Die von KIRKWOOD (1977) postulierte Disposable‐Soma‐Theorie bezieht sich auf die Begrenztheit der natürlichen Ressourcen. Ein Organismus kann entweder in Langle‐ bigkeit des Somas oder in eine hohe Reproduktionsrate investieren. Aufgenommene Nährstoffe und damit Energie, welche von einem dieser Prozesse verbraucht wird, steht den anderen Prozessen nicht mehr zur Verfügung. Umweltbedingungen spielen hierbei eine wesentliche Rolle. Eine hohe exogene Sterblichkeit führt zur Evolution einer hohen intrinsischen Sterblichkeit in Verbindung mit früher Repro‐ duktionsfähigkeit und umgekehrt (COLLATZ, 2003). Auf zellulärer Ebene sagt die Disposable‐Soma‐Theorie aus, dass die Effektivität der Erhaltungs‐ und Reparatur‐ mechanismen direkt mit der Lebensspanne korreliert. 4. Altern bei Insekten Vergleicht man die Lebensdauer verschiedener Insektenarten, kann diese sich um das 5000fache unterscheiden (COLLATZ, 2003). Dies zeigt deutlich die Schwierigkeit innerhalb der Gruppe der Insekten, Altern generell zu diskutieren. Eine Besonderheit der Insekten ist die Tatsache, dass die Zellerneuerung und die Reparatur von Schäden des Exoskeletts nur sehr begrenzt möglich sind. Ein vollständiger Wundverschluss ist beispielsweise erst dann gegeben, wenn die Kutikula über der Wunde regeneriert wurde. Dies ist nur nach einer Häutung möglich, was somit bei adulten Tieren entfällt. Speziell die Möglichkeit der raschen Zellerneuerung, wie sie bei Schwämmen und anderen sich asexuell fortpflanzenden Organismen zu finden ist, stellt den Schlüssel zur Langlebigkeit dar. Da sich die meisten adulten Insekten in einem postmitotischen Stadium befinden, ist bei ihnen das Risiko für irreparable Schäden sehr hoch. Gerade die zerbrechlichen Flügel, Antennen und andere Teile des Exoskeletts sind hiervon betroffen (SEPULVEDA et al., 2008). COMFORT (1979) bezeichnet dies als mechanische Seneszenz, welche zu einem Verlust an Hämolymphe, die Wasser und Nährstoffe transportiert, führt. Dieser Nährstoffmangel kann die Lebensspanne verkürzen. 5 Einleitung Mechanische Seneszenz erhöht nicht zuletzt auch das Risiko einem Fressfeind zum Opfer zu fallen (DUNLAP‐PIANKA et al., 1977). 5. Auswirkungen von Umwelteinflüssen auf das Altern 5.1. BIOTISCHE FAKTOREN – Kopulation und Reproduktion Die artspezifische Lebensdauer eines Individuums ist mit der Art und Weise der Fortpflanzung verknüpft (COLLATZ, 1999 A). So entwickelten die unterschiedlichen Arten als Reaktion auf verschiedene Umweltparameter, verschiedenste Fort‐ pflanzungsstrategien. Der Begriff der r‐ und K‐Strategie versucht dies populations‐ biologisch zu beschreiben, wobei sich „r“ auf die Wachstumsrate bezieht. Die Konstante „K“ orientiert sich an der Tragekapazität eines Lebensraums. Tiere, deren Ressourcen begrenzt und deren Nahrungsangebot unvorhersagbar ist, pflanzen sich explosionsartig fort und investieren sehr viel Energie in die Reproduktion, was auch als r‐Strategie bezeichnet wird (COLLATZ, 2003). Diese Tiere sind oft semelpar und leben in einer sich schnell verändernden Umwelt. Meist weisen sie variable Mortalitätsraten auf. Investiert der Organismus hingegen viel Energie in seinen eigenen Körper und kann sich über einen längeren Zeitraum fortpflanzen, ist dieser Organismus ein K‐Stratege und oft iteropar. Die Umwelt eines typischen K‐ Strategen ist mehr oder weniger konstant und vorhersagbar. Extreme r‐ bzw. K‐ Strategen sind in der Natur selten, die meisten Tiere bewegen sich in r‐K Kontinuum (PIANKA, 1970). Reproduktion ist unabdingbar mit der Lebensspanne der meisten Tiere verknüpft. Gerade Weibchen investieren große Mengen an Energie und Reserven in die Nach‐ kommenschaft. Die Kosten einer Verpaarung, sind vielseitig und können teilweise enorm hoch sein. Notwendige Verhaltensweisen wie Partnerfindung, Balz oder Signalgebung führen zu einem Verlust an Energie oder Zeit, die dann für andere Prozesse, wie z.B. Nahrungsfindung verloren gehen (WATSON et al., 1998). Paarungsaktivitäten können 6 Einleitung auch das Risiko erhöhen, einem Fressfeind zum Opfer zu fallen (KOTIAHO et al., 1998). Dies sind aber extrinsische Kosten, die immer vorhanden sind. Etliche Studien zeig‐ ten einen negativen Effekt der Fortpflanzung auf die Lebensdauer, vor allem bei Weibchen (CHAPMAN et al., 2003; CHAPMAN, 2006). Nicht nur die Fortpflanzung, sondern schon die Kopulation kann einen negativen Effekt auf die Lebensdauer ausüben. Bei der Dungfliege Sepsis cynipsea werden die Weibchen bei der Kopulation von den Männchen verletzt, was die Lebenserwartung der Weibchen erheblich vermindert. (TEUSCHL et al., 2007). Auch die Häufigkeit der Kopulationen kann die Lebenserwartung verringern. Bei Weibchen der Fruchtfliege Drosophila war die Kopulationshäufigkeit negativ mit der Lebensdauer verknüpft (PATRIDGE et al., 1987). 5.2. ABIOTISCHE FAKTOREN – Temperatur und Licht Der Einfluss abiotischer Faktoren auf die Lebensspanne eines Individuums kann beträchtlich sein, was etliche Arbeiten zu dieser Thematik belegen (MIRONIDIS und SAVOPOULOU‐SOULTANI, 2008). Hohe Umwelttemperaturen beschleunigen generell alle chemischen Prozesse im Stoffwechsel, dazu gehört auch die Entwicklung eines Insekts (UGINE et al., 2007). Nicht zuletzt ist die Temperatur einer der wichtigsten Faktoren, welche bei Insekten eine Dormanz auslösen kann (MÜLLER, 1970). Licht als ein weiterer abiotischer Faktor kann ebenfalls bestimmend für die Ent‐ wicklung und das Altern sein. Im Extremfall kann es zu einem Lichttod kommen. Verantwortlich hierfür ist vor allem die kurzwellige Strahlung. Diese schädigt die Chitin‐, Horn‐ und Hautschichten sowie Schalen aller landlebender Tiere. Die Zunahme der Tageslänge kann viele biologische Reaktionen hervorrufen. Licht ist ein Signal für viele Vögel und Säuger und aktiviert viele Taginsekten. Bei nachtaktiven Tieren, wie z.B. Fledermäusen oder vielen Insekten, wirkt die Licht‐ abnahme in der Dämmerung ebenfalls als Signal. Die Photoperiodik ändert sich in den gemäßigten Breiten innerhalb der Jahreszeiten (Kurz‐ und Langtag). Allgemein 7 Einleitung gelten ein Hell/Dunkel Rhythmus von 12/12 Stunden, oder noch kürzere Lichtlängen als Kurztag. In manchen Fällen wirkt sich die Tageslänge auch direkt auf das Altern aus, wie z.B. bei der Wanze Orius thyestes (CARVALHO et al., 2006). Eine Reduktion der Lichtphase unter 9 Stunden reduzierte die Lebenserwartung der Tiere erheblich. SHEEBA et al. (2000) beschreiben ebenfalls die Wirkung unterschiedlicher Lichtlän‐ gen auf das Altern der Fruchtfliege Drosophila melanogaster. Dauerlicht verkürzte im Vergleich zu Populationen, die unter einem L/D Zyklus von 12:12 Stunden lebten, die Lebenserwartung der Fliegen. 6. Dormanzerscheinungen Außerhalb des Tropengürtels müssen sowohl ektotherme, als auch endotherme Tiere Strategien entwickeln, um jahreszeitlich bedingte schlechte Umweltbedingungen überdauern zu können. Nur wenige Insekten sind in der Lage, diesen ungünstigen Perioden durch weite Wanderungen auszuweichen. Hierzu zählen viele mittel‐ europäische Wanderfalter, wie z.B. der Admiral (Vanessa atalanta) oder der Distel‐ falter (Vanessa cardui), die in den Wintermonaten nach Südeuropa oder Nordafrika ziehen. Aber der weitaus größere Teil der Organismen kann nur dann weiterexistieren, wenn drastische Veränderungen im Stoffwechsel und Energiebedarf vorgenommen werden. Es kommt zu einer Drosselung der Stoffwechselaktivität, des Wachstums und der Reproduktion. Weit‐läufig wird hierfür der Begriff „Diapause“ verwendet. Ursprünglich verwendete WHEELER (1893) die Bezeichnung Diapause für die Unterbrechung der Embryogenese bei der Heuschrecke Xiphidium ensiferum. Es zeigte sich, dass der Diapausebegriff für die große Anzahl von Dormanz‐ phänomenen nicht ausreichend war. MÜLLER (1965, 1970, 1976) stellte erstmals ein brauchbares System für diese Phänomene auf. Jede Unterbrechung des Ent‐ wicklungsverlaufs durch eine Anpassung an ungünstige Umweltbedingungen wird als Dormanz bezeichnet (MÜLLER, 1970). 8 Einleitung Dormanz kann in eine konsekutive und in eine prospektive Form eingeteilt werden. Konsekutive Dormanz kennzeichnet alle Organismen, welche erst nach einer Verschlechterung eines Umweltparameters mit einer Entwicklungsverzögerung. Bei der konsekutiven Dormanz lassen sich Quieszenz und Oligopause theoretisch voneinander trennen. Bei einer Quieszenz als einfachster Form ist, wie bei der schwarzen Bohnenlaus Aphis fabae, eine sofortige Reaktion des Entwicklungstempos auf die Umweltbedingungen, etwa der Änderung der Temperatur zu beobachten (MÜLLER, 1966). Die Quieszenz gestattet eine rasche Ausnutzung optimaler Verhältnisse. Bei der Oligopause, als weiterer Form der konsekutiven Dormanz, tritt eine Reak‐ tion auf eine Verschlechterung der Umweltverhältnisse mit Verzögerung auf. Auch der auslösende Faktor muss längere Zeit gegeben sein, um eine Oligopause auszu‐ lösen. So wird die Larvalentwicklung der Dörrobstmotte Plodia interpunctella, die bei 30°C sehr zügig abläuft, bei Temperaturen zwischen 18 und 20°C ganz allmählich verlangsamt; eine deutliche Dormanz tritt aber erst im letzten Larvenstadium auf (TSUJI, 1963). Im Gegensatz zur konsekutiven ist bei der prospektiven Dormanz die Induktion der Dormanz deutlich vor der Verschlechterung der Bedingungen, dadurch kann die Überdauerungsmöglichkeit auf ein ganz bestimmtes Entwicklungsstadium begrenzt werden. Der Organismus ist befähigt, auf Informationen über bevor‐ stehende ungünstige Lebensbedingungen rechtzeitig mit einer Umstellung des Stoffwechsels zu reagieren. Bei der prospektiven Dormanz wird zwischen Parapause und Eudiapause (oder Diapause i.e.S.) unterschieden (MÜLLER, 1970). Parapause findet sich bei Arten mit nur einer Generation im Jahresverlauf. Die Entwicklung vieler Arthropoden kann nur dann ungehindert ablaufen, wenn ein saisonaler Wechsel im Bereich des entscheidenden Faktors, beispielsweise der Temperatur, zu einer Zeit erfolgt, in der er ontogenetisch erforderlich ist. Bleibt der entscheidende Faktor aus, kommt es zwangsläufig zu einer Entwicklungshemmung, da die nächste Entwicklungsphase 9 Einleitung obligatorisch ein anderes Niveau der reizgebenden Parameter verlangt. Die Parapause endet, wenn sich der Valenzbereich des bestimmenden Umwelt‐ parameters ändert. Häufig sind thermische Parapausen, bei denen auf‐ einanderfolgende Entwicklungsstadien nur in unterschiedlichen Temperatur‐ bereichen ablaufen können, wie z.B. die Larvalentwicklung der Feldgrille Gryllus campestris (FUZEAU‐BRAESCH, 1964). In diesem Fall ist während des letzten Larvenstadiums eine Temperaturabnahme erforderlich, bevor die Entwicklung unter hohen Temperaturen wieder weiterlaufen kann. Unter Eudiapause, oder Diapause i.e.S., versteht man Dormanzerscheinungen, die an ein definiertes Entwicklungsstadium gebunden sind, deren Aufhebung immer durch einen anderen Faktor erfolgt, der nicht der induzierende Faktor war(MÜLLER, 1970). Es können puppale, embryonale, larvale, nymphale oder imaginale Diapausen unterschieden werden (HENNEGUY, 1955). Eine Entwicklungshemmung in der Ooge‐ nese der Weibchen oder der Geschlechtsdrüsen der Männchen wird als reproduktive Diapause bezeichnet. Sie ist mit einer Unterbrechung des Paarungsverhaltens ver‐ bunden (TATAR und YIN, 2001). Typische reproduktive Diapausen finden sich bei dem Rüsselkäfer Pissodes strobi (TRUDEL et al., 2002), der grünen Reiswanze Nezara viridula (MUSOLIN und NUMATA, 2003), und dem in dieser Arbeit untersuchten Blatt‐ käfer Gastrophysa viridula. In manchen Fällen kommt eine Sekundärdiapause vor. Beim Eichenprozessionsspinner Thaumetopoea processionea kommt neben einer em‐ bryonalen auch eine puppale Diapause vor (PFLUNGENFELDER, 1958). Manche Tier‐ arten zeigen eine Sommer und Winterdiapause (XUE et al., 2002). Heutige Definitionen beschreiben Diapause als eine genetisch verankerte, an ein bestimmtes Entwicklungsstadium gebundene Unterbrechung der Entwicklung, mit drastischen Einschränkungen des Stoffwechsels (TAUBER et al., 1986; LI et al., 2002). Die genetischen bzw. molekularen Prozesse, welche dabei ablaufen sind aber nur bei einigen wenigen Spezies und dann meist lückenhaft bekannt (DENLINGER, 2002). Die Diapause dient in den gemäßigten Breiten zum Überdauern kalter Jahreszeiten, in 10 Einleitung warmen Gebieten oft zur Überbrückung von Trockenzeiten (Aestivation), wie z.B. bei dem Aaskäfer Nicrophorus quadripunctatus aus Japan (NISIMURA et al., 2002). Eudiapausen finden sich bei potentiell polyvoltinen Arten, die eine konti‐ nuierliche Abfolge von Generationen ausbilden, solange die Umweltbedingungen es gestatten. In einem bestimmten Ontogeniestadium, welches vor dem zur Dormanz fähigen Stadium liegt, befindet sich die sensible Phase für ein exogenes Signal. Der Tag/Nacht Wechsel hat einen astronomisch präzisen jahreszeitlichen Verlauf. Mit der Tageslichtdauer (Photophase) sind in den gemäßigten Breiten auch der Temperaturverlauf und die Vegetationsperiode korreliert. Die Länge der Vegeta‐ tionsperiode ist für phytophage Insekten ein wichtiges Maß für die Verfügbarkeit von Nahrung. Werden große Areale bewohnt, weisen die einzelnen Populationen unterschiedliche kritische Photoperioden auf. Als kritische Photoperiode einer Population wird der Zeitpunkt angesehen, bei dem 50% der Tiere noch mit Nondiapause, die anderen 50% bereits mit Diapauseentwicklung reagieren. Der Punkt des Umschlages zwischen Diapause und Nondiapause ist sehr eng begrenzt, so dass die Lichteinwirkung als eine sigmoide Kurve aufgetragen werden kann, diese wird auch als photoperio‐ dische Wirkungskurve bezeichnet (SAUER, 1977; 1980). SPIETH (1985) konnte am Beispiel des Großen Kohlweißling (Pieris brassicae) nachweisen, dass die kritische Photoperiode sogar bei Populationen, die annähernd die gleiche geographische Breite bewohnen, unterschiedlich sein kann. Der Status der männlichen Tiere in Diapause ist oft unklar und unterscheidet sich teilweise völlig von dem der Weibchen (PENER, 1992; PIELOOR und SEYMOUR, 2001). In vielen Fällen ist es bei den Männchen nicht möglich, von einer reproduktiven Diapause zu sprechen, da sie voll entwickelte Gonaden besitzen und potentiell paar‐ ungsbereit sind. Diapausen werden hormonell reguliert. Das Schlüsselhormon hierbei ist das Juvenil‐ hormon aus den Corpora allata (DENLINGER, 1985). Dies konnten Untersuchungen 11 Einleitung am Blattkäfer Aulacophora nigripennis bestätigen (WATANABE und TANAKA, 2000). FUJITA et al. (2006) zeigten, dass ein Juvenilhormon‐Antagonist die Diapause bei Gastrophysa atrocyanae verhindert. Des Weiteren konnte ein spezielles Diapause‐ hormon (DH) bei einigen Insektenarten nachgewiesen werden. Der Maulbeerspinner Bombyx mori reguliert seine Embryonaldiapause ausschließlich über die Produktion von DH (YAMASHITA, 1996). 7. Dormanz und Altern Im Zustand der Dormanz lässt sich eine große Variation der Lebensspanne fest‐ stellen. Gerade bei sonst kurzlebigen Arten ist der Effekt der Lebensverlängerung be‐ sonders deutlich. Auch Pflanzen können Dormanzformen ausbilden. Hierbei kann die lebensverlängernde Wirkung wie beispielsweise bei Canna compacta, deren Samen noch nach 500 Jahren auskeimten, extrem lang sein (LERMAN und CIGLIANNO, 1971). Auch im Tierreich findet man extrem langlebige Überdauerungsstadien, die mancher Bärtierchen (Tardigradia) können älter als 100 Jahre werden (MARGULIS und SCHWARTZ, 1988). Eine lebensverlängernde Wirkung einer Dormanz auf das bereits adulte Stadium, wurde beim Nematoden Caenorhabditis elegans beschrieben (JOHNSON et al., 1984). Beispiele aus dem Insektenreich sind ebenfalls nicht selten. Überwinternde Bienen‐ arbeiterinnen (Apis mellifera) leben sechs mal länger als ihre Schwestern im Sommer (WINSTON, 1987). ZANNOU et al. (2003) beschreiben den lebensverlängernden Effekt einer Imaginaliapause bei Samenkäfern (Bruchidae). 8. Altern unter Freilandbedingungen Unter Freilandbedingungen ändern sich abiotische und biotische Umweltparameter laufend. Dies kann bei der vergleichenden Untersuchung von Entwicklungs‐ und Alternsvorgängen zu Widersprüchlichkeiten mit Laborbeobachtungen unter kons‐ tanten Umweltbedingungen führen. Vor allem extrinsische Einwirkungen wie z.B. Fressfeinde oder Parasitoide verändern die Strukturen einer Freilandpopulation. 12 Einleitung Deshalb sind bisher auch nur wenige Arbeiten über das Altern unter Freilandbeding‐ ungen erschienen, wobei meist kleine Populationen der Versuchsobjekte in Käfigen untersucht wurden (DAVIES, 2006). Dadurch konnte eine Dezimierung durch Preda‐ toren ausgeschlossen und ausschließlich die intrinsische Mortalität untersucht werden. Schmeißfliegen der Gattung Calliphora und Lucilia zeigten unter Beding‐ ungen im Freiland ein völlig anderes Reproduktionsverhalten als es bisher unter Laborbedienungen beschrieben wurde (DAVIES, 2006). Auch die Entwicklungszeiten und Körpergrößen können im Freiland schwanken. Daraus können eventuell falsche Schlussfolgerungen zur Biologie der Art resultieren (KINGSOLVER und NAGLE, 2007). 9. Der grüne Ampferblattkäfer, Gastrophysa viridula (DeGeer) Die Gattung Gastrophysa umfasst ein Dutzend Arten, deren Verbreitungsschwer‐ punkt in der holarktischen Region liegt. Nur in Mexiko und Hinterindien dringen Arten der Gattung weiter nach Süden vor. Nach G. polygoni hat G. viridula die größte geographische Verbreitung. Dass es sich bei G. viridula um eine ursprünglich montane Art handelt, die erst in jüngerer Zeit Tieflagen besiedelt, bestätigte JOLIVET (1951). REITTER (1912) beschreibt als Aufenthaltsort von G. viridula verschiedene Ampferarten entlang von Sennhütten. Im Tiefland sind die Käfer durch ihre Hauptfraßpflanzen (Rumex‐Arten), die feuchte bis nasse Standorte bevorzugen, an niederschlags‐ oder gewässerreiche Gebiete gebunden (HILTERHAUS, 1965). OCHS (1920) fand erstmals ein Exemplar 1914 bei Frankfurt am Main. Obwohl G. viridula weiter‐hin als Rarität galt (FRANCK, 1935), konnte LINDEMUTH (1949) bereits 1936 über ein Massenauftreten im Kreis Rendsburg berichten. Wie die Ausbreitung der Tiere in kurzer Zeit erfolgte, ist unklar, da die Käfer nur gelegentlich und nur über sehr kurze Distanzen fliegen können. Gravide Weibchen sind völlig flugunfähig. Die primären Futterpflanzen, welche von Larven und Adulten gleichermaßen gefressen werden, gehören zu verschiedenen Rumex‐Arten (Fam. Polygonaceae). JUDENKO (1943), JOLIVET (1951) und ENGEL (1956) nennen Rumex acetosa, R. acetosella, R. obtusifolius, R. alpinus, R. auqaticus, R. arifolius, R. conglomeratus, R. hydrolapthum, R. 13 Einleitung maritimus, R. patienta, R. scutatus und R. crispus als mögliche Futterpflanze. Auch können diverse Arten aus den Gattungen Polygonum und Rheum als Nahrung dienen (ENGEL ,1956). Allen diesen Pflanzen ist gemein, dass sie einen hohen Oxalsäurege‐ halt aufweisen, welcher für die Käfer ein Fraßstimulans darstellt (RENNER, 1970). Die im Boden überwinternden Käfer verlassen ihr Winterquartier zwischen März und April. Wenige Tage nach Erscheinen der Käfer auf den Futterpflanzen können die ersten Kopulationen beobachtet werden. Die Eier werden immer auf der Blattun‐ terseite, meist im Bereich zwischen Basis und Mitte, abgelegt. Dies stellt einen not‐ wendigen Schutz vor Austrocknung durch die Sonne dar (REMAUDIERE, 1948). Je nach Temperatur ist die Embryonalentwicklung nach 5 bis 14 Tagen abgeschlossen und die Larven schlüpfen. Bis zur Verpuppung durchläuft G. viridula drei Larvensta‐ dien. Die Larvalentwicklung ist temperaturabhängig und beträgt 15 bis 30 Tage. Die Altlarven wandern an der Pflanze abwärts, um sich im Boden zu verpuppen. Die Puppenruhe dauert zwischen 10 und 15 Tagen. Nach dem Schlupf der Imagines beginnen die Käfer mit einem 5 bis 10‐tägigem Reifefraß, während dessen Verlauf schwillt das Abdomen der Weibchen stark an (Physogastrie, Abb.1). Kopulationen finden während und nach dem Reifefraß statt. Abb.1: Physiogastrie bei einem weiblichen Käfer von Gastrophysa viridula. (Foto: Dr. C. Gack) 14 Einleitung Der gesamte Lebenszyklus von G. virdula spielt sich auf der Futterpflanze, bzw. in unmittelbarer Nähe am Boden ab. Je nach Witterungsverhältnissen können in einem Jahr zwei bis drei Generationen, die schwach ineinander verschachtelt sind, erscheinen. Die Käfer der letzten Genera‐ tion pflanzen sich nicht mehr fort, sondern ziehen sich zwischen Ende September und Mitte Oktober in den Boden zurück. Bei G. viridula kann eine fakultative Imaginaldiapause durch die Photoperiode aus‐ gelöst werden. Die Induktion der Diapause erfolgt schon vor dem Ende der Vege‐ tationsperiode. Die Tageslängen werden von den Larven registriert, und falls die Tageslängenschwelle unterschritten wird, reagieren die Tiere mit einer Diapauseent‐ wicklung. Da aber jede Tageslänge in einem Jahr zweimal realisiert ist, kommt der Temperatur als zweitem wichtigen Auslöser einer Diapause ebenfalls Bedeutung zu. HILTERHAUS (1965) zeigte, dass unter Langtagbedingungen und einer Temperatur von 15°C bereits Diapause ausgelöst wird. 15 Einleitung 10. Fragestellung In der vorliegenden Arbeit wurden der Alternsverlauf und die möglichen Modifi‐ kationen des Lebensprogramms durch abiotische bzw. biotische Faktoren am Blatt‐ käfer Gastrophysa viridula vergleichend untersucht. Im ersten Teil sollte geklärt werden, in wieweit abiotische Faktoren sich auf das Altern der Blattkäfer auswirken. Der Schwerpunkt war dabei das Altern während der Imaginaldiapause. Folgende Fragen sollten beantwortet werden: 1. Wieweit lässt sich die Lebensdauer der Tiere in einer Diapause verlängern? Hierfür wurde zunächst die für eine Diapause notwendige sensitive Phase, sowie die kritische Photoperiode ermittelt. 2. Wie wirkt sich eine Diapause auf die Stoffwechselintensität und die Aktivität wichtiger Enzyme des Energiestoffwechsels (Glykogen‐Phosphorylase, Phos‐ phofructokinase, Pyruvatkinase und Argininphosphokinase) aus? 3. Ist ein normales Lebensprogramm nach Beendigung der Diapause noch möglich? • Weiterhin wurde versucht den Status der Männchen in Diapause zu klären. Hodenpräparationen und Spermienuntersuchungen sollten hierbei Aufschluss geben. • Die Wirkung der Temperatur auf das Altern verschiedener Käferpopulationen wurde untersucht. 16 Einleitung In einem zweiten Teil der Arbeit wurden biotische Modifikationen auf das Altern von G. viridula genauer untersucht. Von Interesse war hierbei die Fortpflanzungsbio‐ logie der Tiere: 1. Unterscheidet sich die Lebensdauer von verpaarten und virginellen Tieren? 2. Gibt es Unterschiede in der Reproduktionsrate? 3. Ist die Eiproduktion oder die Verpaarung ein limitierender Faktor für die Lebensdauer der Käfer? • Ferner wurde die Reproduktionsrate der Weibchen bestimmt. Darauf basier‐ end sollte die Frage geklärt werden, ob die weiblichen Käfer einen Kompro‐ miss zwischen Reproduktion und ihrer Lebensdauer eingehen, sowie es die „Disposable‐Soma‐Theorie“ fordert. • Am Beispiel der Nahrungsverfügbarkeit wurde ein weiterer biotischer Faktor betrachtet. Inwiefern wirkt sich eine intermittierende Fütterung auf das Altern der Tiere aus? In einem dritten Teil wurde das intrinsische Altern bei G. viridula unter Freilandbe‐ dingen untersucht. Folgende Fragen sollten geklärt werden: 1. Wie verändert sich die Lebensspanne der Tiere unter den wechselnden klima‐ tischen Bedingungen im Freiland? 2. Gibt es Unterschiede in der Stoffwechsel‐ und der Reproduktionsrate im Ver‐ gleich zu Laborpopulationen? 17 Material und Methoden II. MATERIAL UND METHODEN A. Allgemeiner Teil 1. Versuchstiere Alle Versuche wurden an Blattkäfern der Art Gastrophysa viridula (Insecta, Coleo‐ ptera, Chrysomelidae) durchgeführt. Die Versuchstiere entstammten einer etablierten, institutseigenen Zucht. Einmal pro Jahr wurden Freilandtiere in die Zucht einge‐ kreuzt, um Inzuchteffekte zu vermeiden. Diese Käfer wurden ausnahmslos aus einer bestehenden Population am Opfinger Baggersee bei Freiburg gefangen. Eine kurze Entwicklungszeit von circa 30 Tagen und ihre Anspruchslosigkeit bezüglich der Nahrung macht Gastrophysa viridula zu einem guten Versuchsobjekt für alterns‐ biologische Fragestellungen. Im Übrigen sind die Geschlechter leicht voneinander zu unterscheiden (Abb.2). Durch leichten Druck auf das Abdomen kann unter einer Stereolupe bei 16‐facher Vergrößerung der hervortretende männliche Aedeagus von den weiblichen Paraprokten unterschieden werden. Aedeagus Paraprokten Weibchen Männchen Abb.2: Unterscheidung der Geschlechter (verändert nach ALBONETTI,2004). Die Wirtspflanzen von G. viridula, verschiedene Ampferarten (Rumex spec.), sind bei‐ nahe das ganze Jahr über im Freiland zu finden. Die Blätter wurden immer am selben Standtort in Gundelfingen bei Freiburg gesammelt und stammten ausschließ‐ lich von Rumex obtusifolius, dem Sumpfblättrigem Wiesenampfer. Die zuvor mit 18 Material und Methoden Wasser befeuchteten Blätter wurden in Plastiktüten aufbewahrt und bei konstanten 4°C im Kühlhaus gelagert. Unter diesen Bedingungen hielten sich die Blätter bis zu einem Monat frisch. Pflanzen der Gattung Rumex werden des Öfteren von Pilzen der Gattung Uromyces spec. befallen. Dies zeigt sich sichtbar an roten Stellen auf den Blättern. Es wurde immer darauf geachtet, nie befallene Blätter an Larven oder Käfer zu verfüttern, da die infizierten Blätter einen negativen Einfluss auf die Larval‐ entwicklung und die Fruchtbarkeit von G. viridula ausüben (HATCHER et al., 1994). In den Wintermonaten von November bis März wurde auf Pflanzen aus dem Gewächshaus zurückgegriffen. Diese wurden im Spätsommer an verschiedenen Stellen in Gundelfingen bei Freiburg ausgegraben und mitsamt der Muttererde in Plastiktöpfe (∅30cm) gesetzt. Hinterher wurden die Pflanzen stark zurück geschnit‐ ten, um möglichst wenige Schädlinge, wie z.B. Blattläuse, ins Gewächshaus mit einzuschleppen. Die Temperatur im Gewächshaus betrug durchschnittlich 8°C. Bei dieser Temperatur war das Wachstum der Pflanzen reduziert. Dies garantierte aber, dass Schädlinge sich nicht oder nur sehr langsam reproduzieren konnten. Stiegen die Temperaturen im Frühjahr an, waren die Pflanzen nach circa 10 Tagen stark mit Blattläusen befallen. Da für deren Entfernung keinerlei chemische Substanzen ver‐ wendet werden durften, mussten die Parasiten mechanisch mit einer weichen Bürste entfernt werden. Versuche, die Schädlinge durch biologische Bekämpfung mit Flor‐ fliegen (Fam. Chrysopidae) und deren Larven zu entfernen, blieben erfolglos. 1.1. ALLGEMEINE HALTUNG UND ZUCHT Um konstante Umweltbedingungen zu garantieren, wurden die Käfer in Klima‐ schränken (RUMED® Typ 3201) bei einer Temperatur von 20°C und einem Hell‐ Dunkelzyklus von 16:8 Stunden gehalten. Untergebracht wurden sie in Glaspetri‐ schalen mit einer Größe von 20x120 mm. Die Schalen wurden mit mehreren Lagen Zellstoff ausgelegt, um die Feuchtigkeit der Blätter aufzusaugen. Es wurde darauf geachtet, dass sich in einer Schale nicht mehr als 20 Tiere befanden, da sich eine zu hohe Populationsdichte negativ auf die Lebensspanne auswirken kann (GRAVES und 19 Material und Methoden MUELLER, 1993). Täglich wurde mit neuem Ampfer gefüttert, die Petrischalen gerei‐ nigt, tote Tiere entfernt und, wenn nötig, der Zellstoff ausgewechselt. Für die Zucht von G. viridula wurden Eier in die oben beschriebenen Glaspetri‐ schalen überführt und der Zellstoff mit einigen Tropfen Wasser leicht befeuchtet, um ein Austrocknen der Gelege zu verhindern. Bei einer Temperatur von 20°C schlüpf‐ ten nach 4 bis 6 Tagen die Larven. Bei guter Fütterung durchliefen sie die drei Larvenstadien in 14 Tagen. Nahrung im Überfluss war bei der Zucht von ent‐ scheidender Bedeutung, da es sonst bei den adulten Käfern zu kleinen Hungermor‐ phen kommt. Anschließend vergruben sich die Larven zur Verpuppung im Zellstoff. In dieser Phase war es unbedingt nötig, jegliche Störung, vor allem mechanischer Natur, zu vermeiden, nur so ließen sich Schlupfraten zwischen 90 bis 100 Prozent erzielen. Nach circa 6 Tagen Puppenruhe schlüpften die adulten Käfer, die nach einem Reifefraß von 4 Tagen mit der Kopulation begannen. Die Bestimmung der Geschlechter war auch nur kurz nach dem Schlupf möglich, da die Tiere noch nicht völlig aussklerotisiert waren. War das Exoskelett ausgehärtet, bestand zwar immer noch die Möglichkeit, die Geschlechter voneinander zu trennen, dann aber immer mit der Gefahr, die Tiere durch zu starkes Drücken auf den Hinterleib ernstlich zu schädigen oder zu zerdrücken. 20 Material und Methoden 2. Überlebenskurven Die verstorbenen Tiere wurden täglich ausgezählt und aus diesen Daten die Überle‐ benskurven erstellt. Um die Überlebenskurven erstellen zu können wurden die oben gewonnenen Daten in eine Lebenstafel übertragen (LAMB, 1977). Die Anzahl der überlebenden Individuen zu Beginn eines jeden Altersintervalls wurde wie folgt berechnet: lx = Nx / N0 lx = Anzahl der Überlebenden zu Beginn des Altersintervalls x Nx = Anzahl der Überlebenden im Altersintervall x N0 = Anzahl der Überlebenden im Altersintervall 0 Die altersspezifische Mortalitätsrate ergibt sich aus: qx = dx / lx lx = Zahl der Überlebenden zu Beginn des Altersintervalls x dx = Zahl der im Altersintervall x gestorbenen Tiere: dx = lx – l(x+1) Am Lebensende jeder Population wurden, neben den Überlebenskurven und den entsprechenden Mortalitätsraten, auch die L50‐, die L5‐ Werte (das Alter, das 50%, bzw. 5% einer Population erreichen) und die maximale Lebensdauer berechnet. 3. Kohlendioxidbestimmung 3.1. TESTPRINZIP Das Messgerät S 151 Infrared CO2 Analyzer (IRGA, Fa. Qubit Systems) benutzt eine nicht dispersive Infrarotmessung zur Detektion von Kohlendioxid. Kohlendioxid hat die Eigenschaft, Licht im infraroten Bereich zu absorbieren. Der Lichtstrahl wird von einer Infrarotlampe erzeugt. Im Messgerät wird dieser dann durch die Absorption von Kohlendioxid geschwächt. Dies wird vom Detektor im fließenden Luftstrom 21 Material und Methoden gemessen. Die Abschwächung ist proportional zur vorhandenen Gaskonzentration. Der gemessene Wert ist direkt am Messgerät in parts per million (ppm) abzulesen. 3.2. DURCHFÜHRUNG Zu Beginn jeder Messung wurde ein Nullwert bestimmt, indem die Apparatur für circa 10 Minuten ohne Tiere betrieben wurde. Dazu wurde ein Luftsack mit einem Volumen von 30 Litern mit Druckluft gefüllt. Um sicherzustellen, dass die eingefüllte Luft sowenig Kohlendioxid wie möglich enthielt, wurde sie während des Befüllens des Luftsacks über Natriumkalk gefiltert. Dieser entzieht das in der Luft enthaltene Kohlendioxid. Durch eine kleine Pumpe wurde im ganzen System ein kontinuier‐ licher Luftstrom erzeugt; ein Durchflussmesser gab die Möglichkeit, den Luftstrom einzustellen. Bei allen Versuchen war dieser auf 90ml pro Minute justiert. Die ausströmende Luft wurde zusätzlich, bevor sie das Messgerät erreichte, über wasser‐ freies Kalziumsulfat oder Magnesiumperchlorat gefiltert, um dem fließenden Gas‐ strom Wasser zu entziehen. Kalziumsulfat bietet den Vorteil, dass es wiederverwen‐ det werden kann, wenn es in einem Ofen eine Stunde lang bei 210˚C getrocknet wird: Wasser ist ein Dipol und hat wie Kohlendioxid die Eigenschaft infrarotes Licht zu absorbieren; außerdem schädigt Wasser das Messgerät. Durch dieses Verfahren war sichergestellt, dass kein Gas außer Kohlendioxid einen Einfluss auf die Messung hatte. Je fünf Käfer wurden in die Messkammer gesetzt und die normalerweise durch‐ sichtige Kammer abgedunkelt, damit sich die Tiere beruhigten. Nach 15 Minuten wurde die Kammer mit den Käfern an das Messgerät angeschlossen und mit der kohlendioxidfreien Druckluft durchströmt. Das Programm Logger Pro Version 1.1 oder 2.1 nahm alle 10 Sekunden Messwerte auf. Nach einer Stunde wurde die Messung beendet und die Versuchstiere gewogen. 22 Material und Methoden 3.3. AUSWERTUNG Die über einen Zeitraum von einer Stunde aufgezeichneten Messwerte wurden als Verlaufskurve dargestellt und ausgewertet. Die zuvor gemessenen Nullwerte und die eigentlichen Messwerte wurden gemittelt und anschließend voneinander subtra‐ hiert, um auf die Kohlendioxidproduktion der Käfer schließen zu können. Die Werte wurden in μl pro Stunde umgerechnet und auf das Gewicht der Tiere in Milligramm bezogen. 4. Reproduktionsleistung Als Indikator für die Reproduktionleistung wurden die abgelegten Eier verwendet. In Versuchen wurden die Weibchen dazu einzeln (virginell) oder zusammen mit einem oder drei Männchen in Glaspetrischalen gehalten. Die abgelegten Eier wurden dann täglich unter einer Stereolupe (Leica, MZ 8) ausgezählt. 4.1. EIGRÖßEN Zum Vergleich befruchteter und unbefruchteter Eier wurde ein Quotient aus der Länge eines Einzeleis und der Breite berechnet. Einzelne befuchtete bzw. unbefruch‐ tete Eier wurden unter einer Sterolupe (Leica, MZ 8) mit Hilfe einer Eichskala ver‐ messen. 5. Statistik Soweit dies möglich war, wurden alle Versuche statistisch ausgewertet. Da die Daten weder normalverteilt noch abhängig voneinander waren, wurden nichtparametri‐ sche Tests verwendet. Wurden zwei Datensätze miteinander verglichen, wurde der Mann‐Whitney‐U‐Test durchgeführt (KÖHLER et al., 2002). Sollten mehr als zwei Datensätze überprüft werden, wurde der Kruskal‐Wallis H‐Test mit anschließendem Posthoc Test nach Tukey (SACHS, 1999) eingesetzt. Zur Auswertung der Daten aus den Überlebenskurven wurde der Log‐Rang‐Test (ZIEGLER et al., 2004) benutzt. Mit 23 Material und Methoden diesem Testverfahren ist es möglich, Unterschiede in den Mortalitätsrisiken zweier oder mehrerer Gruppen zu überprüfen. Die Daten zeigen eine Signifikanz, falls die Irrtumswahrscheinlichkeit p für die Ablehnung der Nullhypothese kleiner 5% (0,05) ist. Ein Unterschied wird als hoch signifikant bezeichnet, wenn p kleiner 0,01 ist und als höchst signifikant, falls p kleiner 0,001. Wurden dieselben Datensätze mehr als einmal miteinander verglichen, wurde das Signifikanzniveau mit Hilfe der Bonfer‐ roni‐Korrektur entsprechend angepasst (BONFERRONI, 1936). Für alle Tests wurde das Computerprogramm SPSS für Windows Version 14.0 (© 2005 SPSS Inc.) benutzt. B. Spezieller Teil: Abiotische Faktoren 1. Diapause 1.1. VORVERSUCHE 1.1.1. Sensitive Phase Zuerst sollte untersucht werden, in welchem Stadium der Entwicklung G. viridula sensitiv auf Kurztagbedingungen reagiert. Hierfür wurden Eier, verschiedene Lar‐ venstadien, Puppen sowie adulte Käfer einem Zyklus von 7 Stunden Licht und 17 Stunden Dunkelheit ausgesetzt. Die Temperatur betrug immer 20°C ± 0,5°C. Hatten die verschiedenen Stadien ihre Entwicklung bis zum Käfer abgeschlossen, wurden die männlichen Tiere ausgesondert und die Anzahl der Weibchen, welche sich in Diapause befanden, gezählt. Weibliche Tiere, welche mit Nondiapause rea‐ gierten, wurden ebenfalls entfernt: nicht diapausierende Weibchen werden physio‐ gastrisch. 1.1.2. Kritische Photoperiode In einem weiteren Versuch sollte die kritische Photoperiode der für den Lichtreiz sensitiven Entwicklungsstadien bestimmt werden. Die Larven wurden unter ver‐ 24 Material und Methoden schiedenen Tageslängen aufgezogen. Die Temperatur war auf konstant 20°C einge‐ stellt. Die Lichtstunden wurden im Stundenintervall zwischen 3 bis 16 Stunden Licht eingestellt. Nach der Verpuppung zum Käfer wurden die männlichen Tiere wiederum ausgesondert. An jeweils 100 Weibchen wurde beobachtet, wie viele Tiere in Diapause gingen. Es wurden nur Weibchen verwendet, da diese in Diapause nicht reproduktiv sind. Dies war somit ein gutes Kriterium dafür, ob sich die Tiere in Diapause befanden oder nicht. Der Anteil der Tiere, die mit Nondiapause reagierten, wurde prozentual aufgetragen, um die kritische Tageslänge graphisch darstellen zu können. Aufgrund der Ergebnisse wurden bei allen weiteren Versuchen zur Diapause die Lichtverhältnisse auf 7:17 (L/D) Stunden eingestellt. Dies garantierte einen möglichst hohen Anteil an Käfern in Diapause. 1.2. DIAPAUSE 1.2.1. Haltung und Zucht Gezüchtet und gehalten wurden die Käfer wie unter II.A.1. beschrieben. Die Eigelege wurden in einen Klimaschrank bei 20°C und Kurztagbedingungen überführt und die Larven bis zu ihrer Verpuppung aufgezogen. Die geschlüpften Käfer wurden nach Geschlechtern getrennt. Weibchen, welche mit Nondiapause reagierten, wurden aus dem Experiment entfernt. Die Tiere wurden zu Beginn der Diapause täglich, später nur noch nach Bedarf mit frischem Ampfer gefüttert. Die Schalen wurden täglich kontrolliert und die toten Tiere ausgezählt. 1.3. FRAßLEISTUNG Um die Menge, die ein einzelnes Tier pro Tag fraß, messen zu können, wurden zunächst Scheiben mit einer Stanze (∅42mm) aus den Ampferblättern ausgestanzt. Die Mittelrippe des Blattes wurde hierbei immer ausgelassen, da sie von den Käfern nicht gefressen wird. Anschließend wurde das Blattstück in eine Petrischale gegeben und ein einzelner Käfer dazugesetzt. Nach 24 Stunden wurde die Blattscheibe 25 Material und Methoden entfernt und eingescannt. Mit dem Computerprogramm Adobe Photoshop® 7.0 wurde das Bild später bearbeitet und als 150dpi Schwarz/Weiß‐Fotografie ge‐ speichert. Die gefressene Blattoberfläche wurde mit dem Programm NIH‐Image 1.61 (für Macintosh) berechnet und das Ergebnis in inch2 angegeben. Die Ergebnisse wurden später in cm2 umgerechnet. Vorversuche, die das Gewicht der ausgefres‐ senen Fläche zu berücksichtigen versuchten, zeigten erhebliche Fehler. Es war nicht möglich, die exakte Dicke der Blätter zu bestimmen; daraus resultierten große Schwankungen im Ergebnis. Deshalb konnte für die Fraßmenge nur die gefressene Oberfläche berücksichtigt werden. 2. Physiologische Reaktionen in Diapause 2.1. KOHLENDIOXID ALS PARAMETER FÜR DIE STOFFWECHSELAKTIVITÄT Für die Messung der Kohlendioxidproduktion der Diapause‐Käfer wurde wie unter II.A.3. beschrieben vorgegangen. Da der Raum, in welchem die Messapparatur stand, klimatisiert und auf 20°C eingestellt war, konnten eventuelle Temperaturef‐ fekte auf die diapausierenden Käfer ausgeschlossen werden. 2.2. BESTIMMUNG DER AKTIVITÄT DER GLYKOGEN‐PHOSPHORYLASE 2.2.1. Homogenatherstellung Jeweils 5 Tiere wurden in einem Reagenzglas mit 2ml TRA‐Puffer mit einem Ultra‐ Turrax‐Homogenisator (Fa. Janke & Kunkel) bei einer Drehzahl von 8000Upm circa 20 Sekunden lang homogenisiert. Das Homogenat wurde in ein Zentrifugenröhrchen überführt und bei einer Temperatur von 6°C mit 5000g 10 Minuten lang zentrifugiert. Aus dem Überstand wurden die Proteine mit einer 30%igen Ammoniumsulfat‐ fällung gefällt. Die ausgefallenen Proteine 30 Minuten bei 7400g und 4°C abzentrifugiert und der Überstand für die Aktivitätsbestimmung verwendet. 26 Material und Methoden 2.2.2. Bestimmung der Aktivität der Phosphorylase (verändert nach BERGMEYER,1974) Testprinzip Durch die Phosphorylase wird Glucose aus Glykogen phosphoryliert. Hierbei ent‐ steht Glucose‐1‐phosphat. Dies wird durch die Phosphoglucomutase (PGM) und Glucose‐6‐Phosphat‐Dehydrogenase (G‐6‐PDH) unter NADPH/H+‐Bildung zu Gluconat‐6‐phosphat. Die Aktivität der Phosphorylase wird hierbei indirekt über die Zunahme von NADPH/H+ gemessen. Durchführung und Messung Die Messung erfolgte in Halbmikroküvetten bei einer Wellenlänge von 340nm in einem Photometer (Fa. Pharmacia Biotech Ultrospec 3000). Pipettierschema: Substanz μl Phosphatpuffer 450 Imidazol 10 Mercaptoethanol 20 EDTA 20 NaF 20 Mg‐Acetat 10 Glykogen 30 Glu‐1,6‐diphosphat 10 NADP 10 G‐6‐PDH 5 PGM 5 AMP 10 Die Reaktion wurde nach Zusatz von 50 μl Homogenat gestartet. Nach einer Vorlauf‐ zeit von 8 Minuten wurde die Messung gestartet. 27 Material und Methoden Auswertung Die Aktivität des Enzyms wurde als Units pro Milligramm (U/mg) Protein ange‐ geben. Die spezifische Aktivität der Enzyme [U] wurde folgendermaßen berechnet: A = (V * ΔE) / (ε * d*v* Δt) = [U] V = Gesamtvolumen in der Küvette [ ml ] ΔE = Extinktionsänderung ε = molarer Extinktionskoeffizient von NADH ( hier 6,3 ) [cm2/μmol ] (nach BERGMEYER, 1983) d = Schichtdicke der Küvette [ cm ] V = Volumen der Probe [ ml ] Δt = Zeitdifferenz [ min ] 2.3. BESTIMMUNG DER AKTIVITÄT DER PHOSPHOFRUCTOKINASE (PFK) 2.3.1. Homogenatherstellung Je fünf Käfer wurden in einem Reagenzglas mit 2ml Tris‐Puffer wie in Kapitel II. B.2.2.1 beschrieben homogenisiert. Das Homogenat wurde in ein Zentrifugenröhr‐ chen überführt und für 20 Minuten bei 4000g und 10°C zentrifugiert, der Überstand dekandiert und 50 μl Fructose‐1,6‐diphosphat zur Stabilisierung zugegeben und anschließend auf Eis aufbewahrt. 2.3.2. Bestimmung der Aktivität der Phosphofructokinase (verändert nach BERGMEYER,1974) Testprinzip Die Phosphofructokinase katalysiert die Überführung von Fructose‐6‐phoshat und ATP in Fructose‐1,6‐diphosphat und ADP. Im Test reagiert das ADP mit der Pyruvatkinase, dem Phosphoenolpyruvat, und der Lactatdehydrogenase. NAD ist direkt proportional zur gebildeten ADP‐Menge. 28 Material und Methoden Durchführung und Messung Die Messung erfolgte in Halbmikroküvetten bei einer Wellenlänge von 340nm. Pipettierschema: Substanz μl Tris‐Puffer 600 MgSO4 20 KCl 20 PEP 20 Fruc‐6‐phosphat 10 Fruc‐1,6‐diphosphat 10 ATP 20 NADH 20 LDH 5 PK 5 Aqua bidest. 220 Zur weiteren Stabilisierung des Ansatzes wurden 5μl Dithiothreiol zugegeben. Nach einer Inkubationszeit von 3 Minuten bei Zimmertemperatur wurden 50 μl Homogenat zugesetzt. Mit der Messung wurde unverzüglich begonnen. Auswertung Bei der Auswertung ist zu berücksichtigen, dass in der Indikatorreaktion 2 NADH Moleküle oxidiert werden, folglich ist ∆E/2 auszuwerten. (siehe II. B. 2.2.2. Phosphorylase) 2.4. BESTIMMUNG DER AKTIVITÄT DER PYRUVATKINASE (PK) 2.4.1. Homogenatherstellung Für die Homogenatherstellung wurde wie in II. B. 2.2.1. (Phosphorylase) verfahren. Der Überstand wurde dekantiert und für die Pyruvatkinase‐Aktivitätsbestimmung zunächst auf Eis aufbewahrt. 29 Material und Methoden 2.4.2. Bestimmung der Aktivität der Pyruvatkinase Testprinzip Die Pyruvatkinase katalysiert die Abspaltung eines Phosphatrestes von Phosphoenolpyruvat und Übertragung auf ADP. Da die Aktivität der Pyruvatkinase nicht direkt in einem optischen Test ermittelt werden kann, wird als Hilfsenzym die Lactatdehydrogenase (LDH) verwendet. Die LDH katalysiert die Umsetzung des von der PK gebildeten Pyruvats zu Lactat. Dabei wird NADH zu NAD oxidiert. Die Oxidation des NADH ist direkt proportional zur gebildeten Pyruvatmenge. Durchführung und Messung Die Messung erfolgte in Halbmikroküvetten bei einer Wellenlänge von 340nm. Pipettierschema: Substanz μl TRA‐Puffer 500 MgSO4 25 KCl 25 PEP 25 NADH 25 ADP 25 LDH 25 Aqua bidest. 325 Es wurde 25 μl Homogenat zugesetzt, um die Reaktion zu starten. Mit der Messung wurde sofort begonnen. Auswertung (siehe II. B. 2.2.2. Phosphorylase) 30 Material und Methoden 2.5. BESTIMMUNG DER AKTIVITÄT DER ARGININPHOSPHOKINASE (APK) 2.5.1. Homogenatherstellung Jeweils 5 Käfer wurden in ein Reagenzglas mit 2ml TRA‐Homogenatpuffer gegeben und mittels Ultra‐Turrax‐Homogenisator bei einer Drehzahl von 8000Upm etwa 20 Sekunden homogenisiert. Das Homogenat wurde in ein Zentrifugenröhrchen überführt und 20 Minuten bei 5000g und 4°C zentrifugiert. Der Überstand wurde in ein neues Röhrchen dekantiert und für die Argininphosphokinase‐Aktivitäts‐ bestimmung auf Eis aufbewahrt. 2.5.2. Bestimmung der Aktivität der Argininphosphokinase (verändert nach BLETHEN, 1970) Testprinzip Die Argininphosphokinase dient der Übertragung einer Phosphatgruppe auf Arginin bei einer gleichzeitigen Spaltung eines ATP‐Moleküls. In dem Test wurde die Pro‐ duktion von ADP mit Hilfe von Phosphoenolpyruvat (PEP), Pyruvatkinase (PK), NADH und Lactatdehydrogenase gemessen. Die Oxidation des NADH ist direkt proportional zu der gebildeten ADP‐Menge. 31 Material und Methoden Durchführung und Messung Die Messung erfolgte in Halbmikroküvetten bei einer Wellenlänge von 340 nm. Pipettierschema: Substanz μl TRA‐Puffer 740 MgSO4 20 KCL 20 ATP 20 NADH 20 PEP 20 LDH 5 PK 5 Arginin 100 Nach einer Inkubationszeit von 3 Minuten bei Zimmertemperatur wurde 50μl Homogenat zugegeben, um die Reaktion zu starten. Die Messung wurde unver‐ züglich begonnen. Auswertung (siehe II. B. 2.2.2. Phosphorylase) 2.6. PROTEINBESTIMMUNG (BRADFORD, 1976) 2.6.1. Testprinzip der Proteinbestimmung Der Farbstoff Serva Blau (Fa. Sigma) kann an Proteine binden. In Gegenwart von Proteinen und im sauren Milieu verschiebt sich das Absorptionsmaximum des Coomassiereagenz von 465 nach 595nm. Der Farbstoff bindet unspezifisch an kation‐ ische und nicht polare, hydrophobe Seitenketten der Proteine. Somit ist es möglich diese Farbveränderung quantitativ zu erfassen und die Menge der Proteine in einer Lösung zu bestimmen. 32 Material und Methoden 2.6.2. Durchführung und Messung Eichgerade Die Eichgerade wurde im Bereich von 2‐18μg Protein/ml mit Hilfe eines BSA‐ Standards erstellt. Das Homogenat wurde mit Aqua bidest. 1:20 verdünnt. Von je‐ der Standardstufe wurden drei Messungen durchgeführt. Es wurde folgendermaßen pipettiert: Für die Eichgerade: Für die zu testende Probe: Substanz μl Substanz μl Coomassie‐Reagenz 900 Coomassie‐Reagenz 900 BSA‐Standard 10‐90 Homogenat 50 Aqua bidest. 90‐10 Aqua bidest. 50 Proteinbestimmung der Probe Es wurden von jeder Probe drei Ansätze nach dem oben genannten Schema durch‐ geführt. 2.7. LIPIDBESTIMMUNG 2.7.1. Testprinzip der Lipidbestimmung Die Lipidkonzentration des Käferhomogenats wurde mittels einer Phospho‐Vanillin‐ Reaktion bestimmt. Die Lipide reagieren mit Vanillin in einem Medium aus Schwe‐ felsäure und Phosphorsäure zu einem Chromogen, dessen Konzentration colori‐ metrisch bei 546nm erfasst werden kann(Pharmacia Biotech, Typ Ultrospec 2000). 2.7.2. Durchführung und Auswertung (BARNES und BLACKSTOCK, 1973, modifiziert nach ALBONETTI, 2004) Bei der Lipidbestimmung war es wichtig, darauf zu achten, dass ausschließlich mit Glasbehältern gearbeitet wurde. Das Chloroform löst einen kleinen Teil der Lipide im Plastik auf und verfälscht die Ergebnisse. Zur quantitativen Lipidbestimmung 33 Material und Methoden wurde ein Standard aus Käferlipid hergestellt. Dazu wurden einmalig 20 Diapause‐ käfer in 6ml eines Chloroform/Methanol‐Gemisches im Verhältnis 2:1 bei 13500Upm homogenisiert. Der Überstand wurde dekantiert und das Sediment nochmals mit 3ml des Chloroform/Methanol‐Gemisches gewaschen. Der Überstand wurde mit 3ml Aqua bidest. gewaschen, die Wasserphase verworfen und die Chloroformphase eingedampft. Der Lipidextrakt wurde mit Hexan gewaschen, abgedampft und abge‐ wogen. 20mg des so erhaltenen Käferlipids wurden in 200ml Hexan gelöst und Aliquots in verschließbare Glaskolben gefüllt, welche bis zur Verwendung bei –30°C gelagert wurden. Die Eichkurve wurde für 5 – 100μg Lipid erstellt. Um den Fettgehalt der Tiere bestimmen zu können, wurden Einzelbestimmungen an jeweils drei Käfern beiderlei Geschlechts durchgeführt. Die gewogenen Tiere wurden in einem Chloroform/Methanol‐Gemisch im Verhältnis 2:1 abgetötet. und anschließend bei 13500 Upm homogenisiert. Die Chloroform/ Methanol‐Lösung wurde abdekantiert und das Sediment nochmals mit einem Milliliter des gleichen Gemisches gespült und beide Extrakte miteinander vereinigt. Anschließend wurde mit 3ml Aqua bidest. ausgeschüttelt. In der unteren Phase befanden sich das Chloroform und die gelösten Lipide, in der oberen Phase Methanol und Wasser. Die untere Phase wurde abpipettiert und das Chloroform im Abzug abgedampft. Der Lipidfilm wurde in 5ml Hexan aufgenommen, davon jeweils 20μl abgedampft, wieder in 400μl konzentrierter Schwefelsäure gelöst und 10 Minuten lang bei 90°C im Wasserbad erhitzt. Nachdem das Gemisch abgekühlt war, wurden hiervon jeweils 50μl in einer Küvette mit 1050μl Phospho‐Vanillin‐ Reagenz 20 Minuten lang bei Raumtemperatur inkubiert und anschließend bei 546nm gegen Luft gemessen. Die Eichgerade wurde für jeden Messtag neu erstellt und die Ergebnisse in mg Lipid pro g Käfergewicht angegeben. 34 Material und Methoden 3. Unterbrechung einer Diapause 3.1. DIAPAUSEBRUCH Um den Einfluss der Diapause auf das Altern einer Käferpopulation genauer ver‐ stehen zu können, wurde die Diapause nach einem zuvor festgesetzten Zeitpunkt gebrochen. Nach 60 bzw. 120 Tagen unter Diapausebedingungen wurden die Be‐ dingungen im Klimaschrank auf Langtag eingestellt. Der Zeitraum von 60 Tagen wurde gewählt, weil er der durchschnittlichen maximalen Lebensdauer unter Lang‐ tagbedingungen gehaltener Käfer entspricht. Für diese Experimente wurden ausschließlich weibliche Tiere verwendet. 3.2. KOHLENDIOXIDPRODUKTION Es wurde wie oben beschrieben (II. A. 3.) verfahren. 4. Status der Männchen unter Kurztagbedingungen 4.1. PRÄPARATION DER HODEN UND HODENGRÖßE Für die Präparation der inneren männlichen Geschlechtsorgane wurden die Käfer zunächst mit Kohlendioxid betäubt und dekapitiert. Anschließend wurden die Tiere in 70%igem Ethanol aufbewahrt, der Genitalapparat unter einer Stereolupe (Leica, MZ8) entfernt und der Hodendurchmesser mit einer Eichskala bestimmt. Die Bild‐ aufnahmen wurden mit einer an der Stereolupe (Leica, MZ 12) angebrachten Kamera (Axiocam, Zeiss) aufgenommen. 4.2. SPERMIENPRODUKTION Um feststellen zu können, ob die Männchen in Diapause Spermien besitzen, wurden den Tieren wie oben beschrieben die inneren Geschlechtsorgane entfernt. Die Hoden wurden abpräpariert und unter einem Lichtmikroskop (Axioskop 2, Zeiss) als Quetschpräparat betrachtet. 35 Material und Methoden 5. Einfluss der Temperatur 5.1. VERSCHIEDENE TEMPERATUREN Um einen Einfluss der Temperatur auf das Altern einer Käferpopulation feststellen zu können, wurde eine Gruppe einer konstant kühlen Temperatur von 15°C ausge‐ setzt und eine andere Gruppe einer konstant hohen Temperatur von 25°C. Die Licht‐ bedingungen waren auf Langtag eingestellt. Die Gruppengröße wurde auf 200 Tiere festgesetzt. Als Vergleichsgruppe diente eine Population, welche bei 20°C gehalten wurden. Täglich wurde gefüttert und die toten Tiere entfernt. C. Spezieller Teil: Biotische Faktoren 1. Geschlechtspartner 1.1. VIRGINELLE UND VERPAARTE POPULATIONEN Die Tiere wurden bis zur Metamorphose zum Käfer in einem Klimaschrank bei 20°C gehalten. Anschließend wurden sie nach Geschlechtern getrennt. Eine Gruppe be‐ stand aus virginellen Männchen und Weibchen, eine zweite Gruppe wurde im Verhältnis 1:1 verpaart. Die anfängliche Gruppengröße wurde immer auf 200 Tiere festgesetzt. Täglich wurde diese gefüttert und die Toten ausgezählt und in eine Lebenstafel eingetragen. 1.1.1. Kohlendioxidproduktion Für die Bestimmung der abgebenden Kohlendioxidmenge wurde wie in Kapitel II.A.3.beschrieben verfahren. 1.1.2. Reproduktionsleistung (siehe Kapitel II.A.4.) 36 Material und Methoden 1.2.VERZÖGERTE KOPULATIONEN Um einen eventuellen schädlichen Einfluss der Kopulation auf die Tiere quantifi‐ zieren zu können, wurden die Käfer für 25 Tage virginell gehalten. Dieser Zeitpunkt wurde willkürlich gewählt und bei allen Gruppen beibehalten. Nach diesem Zeit‐ punkt wurden die Tiere 1:1 verpaart. Als Vergleichsgruppe diente eine Population virgineller Männchen und Weibchen. Die anfängliche Gruppengröße wurde immer auf 200 Tiere festgesetzt. Täglich wurden diese gefüttert und die Toten ausgezählt und in eine Lebenstafel eingetragen. 1.3. VERSCHIEBUNG DES GESCHLECHTERVERHÄLTNISSES Für diese Verpaarungsversuche wurden die Käfer nach der Verpuppung zuerst nach Geschlechtern getrennt. Die Versuchsgruppen setzten sich wie folgt zusammen: a.) virginelle Tiere, b.) Käfer, die im gleichen Verhältnis miteinander verpaart wurden (1:1) und c.) eine Gruppe in welcher der Anteil der Männchen um das dreifache erhöht wurde (1:3). Es wurden je fünf Weibchen mit fünfzehn Männchen in einer Glaspetri‐ schale gehalten. Starb ein Weibchen, wurden die überzähligen Männchen entfernt, um das Verhältnis von 1:3 nicht zu verändern. Die Populationsgröße wurde auf 200 Tiere festgelegt. Die Käfer wurden unter Langtagbedingungen bei 20°C gehalten. Täglich wurde mit Ampfer gefüttert und die toten Käfer ausgezählt und in eine Lebenstafel eingetragen. 2. Nahrung 2.1. INTERMITTIERENDE FÜTTERUNG Um feststellen zu können, wie G. viridula auf Nahrungsentzug reagiert, wurden die Tiere intermittierend gefüttert. Hierfür wurden drei Gruppen gebildet. Der ersten Gruppe stand jeden Tag ausreichend Nahrung zur Verfügung (ad libitum), der zweiten Gruppe wurde jeden zweiten Tag das Futter komplett entzogen (24 h) und 37 Material und Methoden eine dritte Gruppe wurde nur alle drei Tage gefüttert (48 h). Die Gruppengröße wurde auf 200 Tiere festgesetzt. Die Umweltbedingungen waren auf Langtag ein‐ gestellt. Um das Ergebnis durch Paarung und Kopulationen nicht zu beeinflussen, wurden nur virginelle Tiere verwendet. 2.2. NAHRUNGSMENGE Eine intermittierende Fütterung muss nicht zwangsläufig eine Reduktion der aufge‐ nommenen Nahrung bedeuten. Um diesen Umstand prüfen zu können, wurden die gefressene Blattfläche einer ab libitum Population und einer 24 Stunden hungernden Population bestimmt. Verfahren wurde wie in Kapitel II. B. 1.3. beschrieben. D. Spezieller Teil: Altern unter Freilandbedingungen 1. Freilandbedinungen 1.1. FREILANDVERSUCHE Die Larven wurden bis zu ihrer Verpuppung im Klimaschrank bei 20°C ±0,5°C gehalten. Nach ihrer Metamorphose wurden je 15 männliche und 15 weibliche Tiere in eine Plastikbox mit den Maßen 17×12×7,5 cm untergebracht (Abb.3). Diese Boxen waren an allen sechs Seiten ausgeschnitten und mit handelsüblichem Fliegendraht bespannt, um einen möglichst guten Luftaustausch mit der Umgebung zu ermög‐ lichen und um Staunässe zu vermeiden. Außerdem konnte somit sichergestellt werden, dass keine Fraßfeinde einwandern konnten 38 Material und Methoden Abb.3: Plastikboxen zur Unterbringung der Käfer im Freiland. Aufgestellt wurde der Versuchsaufbau auf einer freien Fläche in Gundelfingen bei Freiburg. Am Standtort selbst wuchs R. obtusifolius. G. viridula war allerdings nicht vorhanden. Die Boxen wurden zusätzlich auf einen Gitterrost gestellt (Abb.4), damit bei Regen das Wasser schnell ablaufen konnte. Gefüttert wurde täglich mit Ampfer‐ blättern, dabei wurde der Stängel der Blätter in ein mit Wasser gefülltes Eppendorf‐ Cap gesteckt, um ein schnelles Verwelken der Blätter zu verhindern. Die toten Käfer wurden täglich ausgezählt. Die anfänglichen Populationsgrößen bestanden aus 200 Männchen und 200 Weibchen. Die Klimadaten wurden zu Beginn der Experimente Mitte April 2004 kontinuierlich durch einen Messlogger (Testostor 175) der Firma Testo aufgezeichnet und ausgewertet. Der Datenlogger befand sich stets in einer der Plastikboxen. Abb.4: Gitterrost zum Aufstellen der Plastikboxen im Freiland. 39 Material und Methoden 1.2. KOHLENDIOXIDPRODUKTION Von den Käfern, welche unter Freilandbedingungen gehalten wurden, sollte die abgegebene Menge an Kohlendioxid bestimmt werden. Hierfür wurden einige Käfer aus dem Freiland ins Labor mitgenommen und nach der Messung wieder zurück in ihre Boxen gesetzt. Die Messung erfolgte wie in Kapitel II.A.3. beschrieben. 1.3. REPRODUKTIONSLEISTUNG Die täglich abgelegte Menge Eier einzeln gehaltener Weibchen wurde ausgezählt. Dazu war es nötig die Boxen für die Freilandversuche zu unterteilen. 40 Ergebnisse III. ERGEBNISSE Teil A: Abiotische Faktoren 1. Diapause 1.1. VORVERSUCHE 1.1.1. Sensitive Phase Zu Beginn der Versuche unter Kurztag (Diapause)‐Bedingungen musste zunächst die für eine Diapause sensitive Phase der Tiere ermittelt werden (Abb.5). Ab dem zehnten Tag legten die Weibchen, welche nicht in Diapause waren Eier und konnten von den diapausierenden Weibchen getrennt werden. % Weibchen nicht in Diapause 100 80 Eier 60 Larven 89 40 20 31 0 95 Puppen geschl. Käfer 31 1 Abb.5: Die für eine Diapause sensitive Phase bei G. viridula bei 20°C, n= je 100 Tiere. Die sensitiven Stadien der Käfer waren die Eier bzw. die Larven. Wurden die Eier oder die Larven Kurztagbedingungen ausgesetzt, reagierten circa 70% der Käfer mit Diapauseentwicklung. Wurden die Puppen oder die bereits geschlüpften Käfer Kurz‐ 41 Ergebnisse tagbedingungen ausgesetzt, war nur noch ein kleiner Bruchteil der Tiere in der Lage, in Diapause zu gehen. Aufgrund dieser Erkenntnisse wurden für allen weiteren Diapauseversuche bereits die Eier Kurztagbedingungen ausgesetzt. 1.1.2. Kritische Tageslänge Damit für die weitergehenden Experimente eine möglichst hohe Anzahl an diapau‐ sierenden Käfern zur Verfügung stand, wurde an weiblichen Käfern die kritische Photoperiode bei konstanter Temperatur von 20°C bestimmt. % Weibchen nicht in Diapause 100 90 80 70 60 50 40 30 20 10 0 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Lichtstunden [h] Abb.6: Kritische Tageslänge von G. viridula Weibchen bei konstant 20°C, n= je 100 Tiere. Die kritische Tageslänge, welche die Lichtstunden angibt bei denen 50% der Population in Diapause sind, lag bei G. viridula Weibchen bei 10,5 Lichtstunden (Abb.6). Den größten Anteil diapausierender Weibchen findet man bei 7 Licht‐ stunden. Unter diesen Lichtbedingungen waren 70% einer Käferpopulation, die ausschließlich aus Weibchen besteht, in einer reproduktiven Diapause. Um den Anteil an diapausierenden Tieren zu optimieren, wurde für alle weiteren Versuche zur Diapause ein Licht‐Dunkelzyklus von 7:17 (L/D) Stunden verwendet. 42 Ergebnisse 1.2. ÜBERLEBENSKURVEN Zehn Tage nach dem Schlupf begannen die Weibchen, welche nicht in Diapause waren, Eier zu legen und konnten deshalb stets von den diapausierenden Tieren ge‐ trennt werden. Die Überlebenskurven der Weibchen beginnen daher erst ab dem zehnten Lebenstag. Nach und nach beendeten manche Weibchen die Diapause und begannen nach einem Reifefraß Eier zu legen; diese Tiere wurden ebenfalls aussor‐ tiert und nicht weiter berücksichtigt. Die Überlebenskurven der Käfer in Diapause zeigen den typischen Verlauf einer Zerfallskurve, der sich durch eine konstante Sterberate ergibt. Dies bedeutet, dass die Wahrscheinlichkeit jedes einzelnen Tieres zu sterben zu jedem Zeitpunkt gleich groß ist. Die Überlebenskurven der Vergleichsgruppen unter Langtagbedingungen zeigen den typischen sigmoidalen Verlauf der Kurven, der sich durch eine geringe Sterbe‐ rate in den ersten und letzten Lebenstagen ergibt. Im mittleren Lebensbereich ist hin‐ gegen eine hohe Sterblichkeit festzustellen (Abb.7). Die diapausierenden Tiere hatten eine deutlich erhöhte Gesamtlebensdauer als Gruppen unter Langtagbedingungen. Männchen, welche unter Kurztagbedingungen gehalten wurden, lebten deutlich länger als vergleichbare Tiere unter Langtag‐ bedingungen (Log‐Rang‐Test, p< 0,001). Dies zeigte sich auch bei einem Vergleich der weiblichen Käfer (Log‐Rang‐Test, p< 0,001). Einen Unterschied im Mortalitäts‐ risiko zwischen diapausierenden Männchen und Weibchen konnte nicht festgestellt werden. 43 Ergebnisse 100 Überlebende [%] 80 Weibc hen DP 60 Männc hen DP Weibc hen LT 40 Männc hen LT 20 0 1 21 41 61 81 101 121 141 161 181 201 Lebensalter [d] Abb.7: Überlebenskurven männlicher und weiblicher Käfer in Diapause und ihre entsprechenden Vergleichsgruppen unter Langtagbedingungen (DP, n= 4 Populationen; LT, n= 4 Populationen; jede Population mit je 200 Tieren). L‐Werte der Überlebenskurven Tab.1: L50, L5 und Lmax-Werte der Käfer in Diapause und Langtag. Population L50 L5 Lmax ♂ Diapause 50 158 220 ♀ Diapause 53 162 190 ♂ Langtag 29 59 70 ♀ Langtag 24 42 50 Die L50 und L5‐Werte, also die Zeitpunkte bei der noch 50% und 5% der Population lebten, waren bei den diapausierenden Populationen, im Vergleich zu den Langtag‐ populationen, erhöht (Tab.1). Die maximale Lebensdauer der männlichen Tiere war gegenüber der Population unter Langtagbedingungen um 314% erhöht. Bei den weiblichen Tieren in Diapause waren es sogar 380%. 44 Ergebnisse 1.3 FRAßLEISTUNG DER KÄFER IN DIAPAUSE Die Käfer nahmen in Diapause Nahrung auf, wenn diese angeboten wurde. Diese Menge wurde quantifiziert, und mit einer Vergleichsgruppe unter Langtagbeding‐ ungen verglichen. Männchen in Diapause nahmen weniger Nahrung zu sich als eine Langtag‐ vergleichsgruppe (Abb.8; Mann‐Whitney‐U‐Test, p< 0,001). Erkennbar ist auch, dass sowohl diapausierende Männchen, als auch die Vergleichsgruppe zu Beginn etwa gleich viel Nahrung zu sich nahmen (Mann‐Whitney‐U‐Test, p> 0,10). Im Verlauf der nächsten 20 Tage sank der Nahrungskonsum beider Gruppen stetig ab, und pendelte sich bei den Langtagmännchen auf circa 1 cm2 Blattfläche ein. Auch bei den Männchen in Diapause sank die Nahrungsaufnahme stark ab. Ab dem 50. Lebenstag nahmen die Tiere kaum noch Nahrung zu sich. Die Werte liegen unter 0,1 cm2 Blattfläche. Ähnliche Ergebnisse zeigten sich bei den Weibchen (Abb.9). Auch hier nahmen die Weibchen in Diapause weniger Nahrung auf, als die unter Langtag lebenden Weib‐ chen (Mann‐Whitney‐U‐Test, p< 0,001). Bei beiden Weibchenpopulationen nahm die Nahrungsaufnahme in den ersten Tagen zu. Nach diesem Reifefraß sank die tägliche Nahrungsaufnahme der Langtagweibchen kontinuierlich ab. Wie auch bei den dia‐ pausierenden Männchen nahmen die Weibchen ab dem 50. Lebenstag kaum mehr Nahrung zu sich; die Werte liegen unterhalb 0,1 cm2 gefressener Blattfläche. Bei einem Vergleich der aufgenommenen Menge an Nahrung der Langtagmänn‐ chen und Langtagweibchen zeigte sich deutlich, dass die weiblichen Käfer mehr Nahrung zu sich nahmen (Mann‐Whitney‐U‐Test, p< 0,001). Wurde die Fraßmenge der Männchen und Weibchen, welche sich in Diapause be‐ fanden, über die gesamte Lebenszeit miteinander verglichen, zeigten sich keine Un‐ terschiede in der Menge an aufgenommenen Blättern. Betrachtet man aber die Menge an gefressenen Blättern der Diapausetiere bis zum 50. Lebenstag, nahmen die Weib‐ chen im Vergleich zu den Männchen signifikant mehr Nahrung zu sich (Mann‐Whit‐ ney‐U‐Test, p< 0,01). 45 Ergebnisse Fraßmenge [cm 2 ] 5 4 3 Männchen LT Männchen DP 2 1 0 0 50 100 150 200 250 Tage [d] 2 Abb.8: Fraßmenge (cm Blattfläche) männlicher Käfer unter Diapause- (DP) und Langtagbedingungen (LT); (LT, n= 2 Populationen; DP, n= 2 Populationen). Fraßmenge [cm 2 ] 5 4 3 Weibchen LT Weibchen DP 2 1 0 0 50 100 150 200 250 Tage [d] 2 Abb.9: Fraßmenge (cm Blattfläche) weiblicher Käfer unter Diapause- (DP) und Langtagbedingungen (LT); (LT, n= 2 Populationen; DP, n= 2 Populationen). 46 Ergebnisse 2. Physiologische Reaktionen in Diapause 2.1. STOFFWECHSELRATEN Ein Vergleich männlicher Käfer mit weiblichen in Diapause zeigte, dass Männchen in Diapause mehr Kohlendioxid produzierten als Weibchen. (Abb.10; Mann‐Whitney‐ U‐Test, < 0,05). In den ersten 30 Tagen sank die Produktion in beiden Geschlechtern von Werten über 1 μl/h/mg auf Werte bis zu 0,2 μl/h/mg ab. Im weiteren Verlauf des Lebens stieg die Kohlendioxidproduktion in beiden Geschlechtern wieder leicht an. Männchen und Weibchen Käfer unter Langtagbedingungen produzierten mehr Kohlendioxid, als die entsprechenden Diapausetiere (Abb.10; Mann‐Whitney‐U‐Test, p< 0,001; in beiden Fällen). In beiden Langtagpopulationen war deutlich ein Anstieg der Produktion an Kohlendioxid zu Beginn des Lebens festzustellen. Um den 20. Lebenstag sank diese stetig bis zum Lebensende ab. Kohlemdioxidproduktion [µl/h*mg] 2 1,6 Männchen LT 1,2 Weibchen LT Männchen DP 0,8 Weibchen DP 0,4 0 0 20 40 60 80 100 120 140 160 Lebensalter [d] Abb.10: Kohlendioxidproduktion männlicher und weiblicher Käfer in Diapause und unter Langtagbedingungen bei konstanten 20°C (LT, n= 2 Populationen; DP, n= 2 Populationen, jeder Messpunkt repräsentiert 5 Tiere). 47 Ergebnisse 2.2. GLYKOGEN‐PHOSPHORYLASE Die Phosphorylaseaktivität von Männchen unter Langtagbedingungen war generell höher als während der Diapause (Abb.11; Mann‐Whitney‐U‐Test, p< 0,001). Sie nahm bei ihnen bis zum 20. Lebenstag zu und sank dann wieder bis zum Lebensende. In Diapause veränderte sich der Wert kaum und lag im Mittel bei 2,4 U/mg Protein. Bei den Weibchen zeigte sich (Abb.12), dass die Langtagpopulation eine höhere Aktivität aufwies als die Diapausetiere (Mann‐Whitney‐U‐Test, p< 0,001). Die Aktivität der Langtagweibchen stieg zu Beginn des Lebens leicht an, blieb dann aber, im Vergleich zu den Männchen, stabil. Auch bei den Diapauseweibchen war die Aktivität nach einem Absinken zu Beginn des Lebens im Mittel bei 2,3 U/mg Protein konstant. spez. Aktivität [U/mg Protein] 4,3 3,8 3,3 Männc hen LT Männc hen DP 2,8 2,3 1,8 0 20 40 60 80 100 Lebensalter [d] Abb.11: Spezifische Aktivität der Phosphorylase männlicher Käfer in Diapause (DP) und unter Langtagbedingungen (LT). Dargestellt sind Median sowie Interquartilbereich. Jeder Messpunkt repräsentiert je 5Tiere aus 4 Populationen. 48 Ergebnisse spez. Aktivität [U/mg Protein] 4,3 3,8 3,3 Weibchen LT Weibchen DP 2,8 2,3 1,8 0 20 40 60 80 100 Lebensalter [d] Abb.12: Spezifische Aktivität der Phosphorylase weiblicher Käfer in Diapause (DP) und unter Langtagbedingungen (LT). Dargestellt sind Median sowie Interquartilbereich. Jeder Messpunkt repräsentiert je 5Tiere aus 4 Populationen. 2.3. PHOSPHOFRUCTOKINASE (PFK) In Abbildung 13 ist die spezifische Aktivität der PFK bei diapausierenden und unter Langtagbedingungen lebenden Männchen zu sehen. Sie ist im Langtag höher als in Diapause (Mann‐Whitney‐U‐Test, p< 0,05). Ein leichter Anstieg der Aktivität, welcher am 20. Lebenstag sein Maximum hat, gefolgt von einer steten Abnahme zum Lebensen‐de hin ist kennzeichnend für den Kurvenverlauf der Langtagmännchen. Bei der Diapausepopulation war eine Abnahme der Aktivität zu Beginn des Lebens sichtbar; diese stieg aber zum Lebensende hin wieder an. Die Aktivitäten waren bei den Langtagweibchen im Vergleich zu den Diapause‐ weibchen deutlich erhöht (Abb.14; Mann‐Whitney‐U‐Test, p< 0,001).Die PFK‐ Aktivitäten der Langtagweibchen sanken bis zum Ende des Lebens ab. Dies ist auch bei den Diapauseweibchen bis zur Lebensmitte der Fall; danach stieg die Aktivität wieder an. 49 Ergebnisse spez. Aktivität [U/mg Protein] 60 50 40 Männc hen LT Männc hen DP 30 20 10 0 20 40 60 80 100 120 Lebensalter [d] Abb.13: Spezifische Aktivität der Phosphofructokinase männlicher Käfer in Diapause (DP) und Langtagbedingungen (LT). Dargestellt sind Median sowie Interquartilbereich. Jeder Messpunkt repräsentiert je 5Tiere aus 4 Populationen. spez. Aktivität [U/mg Protein] 60 50 40 Weibc hen DP Weibc hen LT 30 20 10 0 20 40 60 80 100 120 Lebensalter [d] Abb.14: Spezifische Aktivität der Phosphofructokinase weiblicher Käfer in Diapause (DP) und Langtagbedingungen (LT). Dargestellt sind Median sowie Interquartilbereich. Jeder Messpunkt repräsentiert je 5Tiere aus 4 Populationen. 50 Ergebnisse 2.4 PYRUVATKINASE (PK) Die Aktivitäten der Pyruvatkinase männlicher diapausierender Tiere im Vergleich zu Langtagtieren unterschieden sich nicht (Abb.15; Mann‐Whitney‐U‐Test, p> 0,10). In beiden Populationen stieg die Aktivität zu Beginn des Lebens stark an, erreichte ein Maximum und sank danach wieder zum Lebensende hin ab. Auffällig war, dass der Anstieg der spezifischen Aktivität bei den Tieren in Diapause zeitversetzt zu dem der Langtagmännchen war. Das Maximum der spezifischen Aktivität lag bei den Langtagmännchen vor dem 20. Lebenstag, das der Diapausemännchen um den 50. Lebenstag, also zu einem Zeitpunkt, an dem die meisten Individuen der Langtag‐ population nicht mehr am Leben war. Weibliche Käfer, die unter Langtagbedingungen gehalten wurden, hatten eine höhere PK‐Aktivität, als Weibchen in Diapause (Abb.16; Mann‐Whit‐ney‐U‐Test, p< 0,001).Wie bei den Männchen zeigte sich ein Anstieg der Enzymaktivität bis zum Erreichen eines Maximums, gefolgt von einer Abnahme der Aktivität zum Lebensende hin. Der beschriebene zeitversetzte Anstieg der Enzymaktivität der Diapausetiere war bei den Weibchen nicht zu beobachten. Sowohl Langtag‐ als auch die Diapausetiere zeigten ein Maximum in der Enzymaktivität um den 30. Lebenstag. 51 Ergebnisse spez.Aktivität [U/mg Protein] 40 30 Männc hen LT 20 Männc hen DP 10 0 0 20 40 60 80 100 Lebensalter [d] Abb.15: Spezifische Aktivität der Pyruvatkinase männlicher Käfer in Diapause (DP) und Langtagbedingungen (LT). Dargestellt sind Median sowie Interquartilbereich. Jeder Messpunkt repräsentiert je 5Tiere aus 4 Populationen. spez.Aktivität [U/mg Protein] 40 30 Weibchen LT 20 Weibchen DP 10 0 0 20 40 60 80 100 Lebensalter [d] Abb.16: Spezifische Aktivität der Pyruvatkinase weiblicher Käfer in Diapause und unter Langtagbedingungen. Dargestellt sind Median sowie Interquartilbereich. Jeder Messpunkt repräsentiert je 5Tiere aus 4 Populationen. 52 Ergebnisse 2.5. ARGININPHOSPHOKINASE (APK) Unter Langtagbedingungen wiesen männliche Tiere höhere spezifische Aktivitäten auf als vergleichbare Käfer unter Kurztagbedingungen (Abb.17; Mann‐Whitney‐U‐ Test, p< 0,05). Die Aktivität stieg bis zum Lebensende hin kontinuierlich an und erreichte am 35. Lebenstag mehr als 300 Prozent des Anfangswertes. Anfänglich nahm auch die Enzymaktivität der Diapausemännchen zu, blieb aber ab dem 17. Lebenstag konstant bis zum Lebensende der Population. Auch bei den Weibchen war die spezifische Enzymaktivität der APK im Langtag im Vergleich zu den Diapauseweibchen deutlich erhöht (Abb.18; Mann‐Whitney‐U‐ Test, p< 0,001). Im Gegensatz zu den Langtagmännchen veränderten sich die Aktivi‐ täten bei den Langtagweibchen nur wenig. Auch bei den unter Diapause lebenden Weibchen blieb die spezifische Enzymaktivität über das ganze Leben hinweg mit einem mittleren Wert von 19 U/mg Protein konstant. spez.Aktivität [U/mg Protein] 80 70 60 50 Männchen LT Männchen DP 40 30 20 10 0 10 20 30 40 50 60 70 Lebensalter [d] Abb.17: Spezifische Aktivität der Argininphosphokinase männlicher Käfer in Diapause (DP) und Langtagbedingungen (LT). Dargestellt sind Median sowie Interquartilbereich. Jeder Messpunkt repräsentiert je 5Tiere aus 4 Populationen. 53 Ergebnisse spez. Aktivität [U/mg Protein] 80 70 60 50 Weibc hen LT Weibc hen DP 40 30 20 10 0 10 20 30 40 50 60 70 Lebensalter [d] Abb.18: Spezifische Aktivität der Argininphosphokinase weiblicher Käfer in Diapause und Langtagbedingungen. Dargestellt sind Median sowie Interquartilbereich. Jeder Messpunkt repräsentiert je 5Tiere aus 4 Populationen. 2.6. LIPIDBESTIMMUNG Die Ergebnisse der Gesamtlipidbestimmungen entstammen aus einer Kooperation mit einer ehemaligen Diplomandin aus dem selben Labor, siehe auch ALBONETTI (2004). Der Gesamtlipidgehalt der Weibchen stieg in der ersten Lebenshälfte bis zum 70. Lebenstag an und erreichte Höchstwerte von 456 mg pro g Frischgewicht (Abb.19; Mann‐Whitney‐U‐Test, p< 0,001). Der Lipidgehalt der männlichen Käfer stieg eben‐ falls bis zum 50. Lebenstag auf 410 mg/g Frischgewicht an (Mann‐Whitney‐U‐Test, p< 0,001). Der Fettgehalt nicht diapausierender Weibchen war deutlich niedriger als der Lipidgehalt männlicher und weiblicher Käfer in Diapause (Kruskal‐Wallis‐H‐ Test, p< 0,001). 54 Ergebnisse Lipidgehalt (mg/g FG) 500 Männc hen in Diapause 400 Weibc hen in Diapause 300 diapausefreie Weibc hen 200 100 0 0 50 100 150 Lebensalter [d] 200 250 Trendlinie der Weibc hen in Diapause Trendlinie der Männc hen in Diapause Trendlinie diapausefreie Weibc hen Abb.19: Lipidgehalt männlicher und weiblicher Käfer in Diapause, sowie nicht diapausierender Weibchen. Jeder Messpunkt repräsentiert 5Tiere. 55 Ergebnisse 3. Unterbrechung der Diapause 3.1. DIAPAUSEBRUCH Nach 60 bzw. 120 Tagen in Diapause wurden die Lichtbedingungen geändert, um die Diapause zu brechen. Die Männchen hatten im Vergleich zu den Weibchen eine höhere Lebensdauer (Abb.20; Log‐Rang‐Test, p< 0,001). Bis zum Bruch der Diapause am 60. Lebenstag war der Verlauf der Überlebenskurven eine typische Zerfallskurve, wie sie auch schon in Abbildung 7. zu sehen ist. Nach dem Bruch der Diapause war eine typische sigmoide Überlebenskurve zu erkennen. Die Überlebenskurven der Männchen und Weibchen mit einem Bruch in der Dia‐ pause nach 120 Tagen sind in der Abbildung 21 zu sehen. Die Lebensdauer unter‐ schied sich in diesem Fall nicht (Log‐Rang‐Test, p> 0,10). Nach dem Bruch in der Dia‐ pause war ebenfalls der typische sigmoide Verlauf der Kurven zu sehen. 100 Überlebende [%] 80 60 Männc hen Weibc hen 40 20 0 0 20 40 60 80 100 120 140 Lebensalter [d] Abb.20: Überbenskurven männlicher und weiblicher Käfer, welche bis zum 60. Lebenstag unter Kurztagbedingungen, danach unter Langtagbedingungen gehalten wurden, um die Diapause zu brechen (Männchen und Weibchen, n= 2 Populationen mit je 200 Tieren). Der Pfeil markiert den Zeitpunkt des Wechsels der Lichtverhältnisse. 56 Ergebnisse 100 Überlebende [%] 80 60 Männchen Weibchen 40 20 0 0 40 80 120 160 200 Lebensalter [d] Abb.21: Überbenskurven männlicher und weiblicher Käfer, welche bis zum 120. Lebenstag unter Kurztagbedingungen, danach unter Langtagbedingungen gehalten wurden, um die Diapause zu brechen (Männchen und Weibchen, n= 1 Population mit je 200 Tieren). Der Pfeil markiert den Zeitpunkt des Wechsels der Lichtverhältnisse. 57 Ergebnisse 3.2. KOHLENDIOXIDPRODUKTION In Abbildung 22 ist die Kohlendioxidproduktion während einer 60‐tägigen Diapause mit anschließendem Wechsel der Lichtbedingungen auf Langtag zu sehen. Wie auch Abbildung 10. zeigt, sank die Kohlendioxidproduktion während einer Diapause zu Beginn stark ab und pendelte sich auf einem konstanten Wert (0,2μl/h/mg) ein. Nach dem Wechsel der Lichtlängen wurde die Diapause gebrochen, und die Kohlen‐ dioxidproduktion stieg innerhalb von 10 Tagen stark an (Mann‐Whitney‐U‐Test, p< 0,001). Die hohen Werte unter Langtagbedingungen fielen zum Lebensende hin wie‐ der leicht ab. Kohlendioxidproduktion [µl/h*mg] 1,6 1,2 Weibchen 0,8 0,4 0 0 20 40 60 80 100 120 Lebenstage [d] Abb.22: Kohlendioxidproduktion weiblicher Käfer, welche bis zum 60. Lebenstag unter Diapausebedingungen, danach unter Langtagbedingungen gehalten wurden, um die Diapause zu brechen (n= 2 Populationen, jeder Messpunkt repräsentiert 5 Tiere). Der Pfeil markiert den Zeitpunkt des Wechsels der Lichtverhältnisse. 58 Ergebnisse 4. Status der Männchen unter Kurztagbedingungen 4.1. HODENGRÖßE Um den Status der Männchen unter Kurztagbedingungen genauer definieren zu können, wurden die männlichen inneren Geschlechtsorgane untersucht. Hodengröße respektive Hodendurchmesser und Spermiennachweis waren hierfür gut geeignet. Abbildung 23 zeigt ein Schema der männlichen Geschlechtsorgane von G. viridula. Der Doppelpfeil gibt den Hodendurchmesser an. In der Abbildung 24 sind die inneren männlichen Geschlechtsorgane photographisch abgebildet. Insgesamt wurden bei drei verschiedene Gruppen der Hodendurchmesser ermit‐ telt: a.) Männchen in Diapause, b.) verpaarte Männchen, und c.) virginelle Männ‐ chen. Es wurde immer der linke und rechte Hoden vermessen. Ein Vergleich zeigte, dass es bezüglich der Hodengrößen keine Unterschiede gab (Abb.25; Kruskal‐Wallis‐ H‐Test, Folgetest nach Tukey p>0,10). Der durchschnittliche Hodendurch‐messer lag in allen Gruppen bei 1,4 mm. 59 Ergebnisse AD D.ej. T V.s. Vs T. V.d. Vd A.D. D.ej. Ae. Abb.23: Innere, männliche Geschlechtsorgane. A.D.: Akzessorische Drüsen, Ae.: Aedeagus, D.ej.: Ductus ejaculatorius, T.: Hoden, V.d.: Vas deferens, V.s.: Vesicula seminalis. Der Pfeil gibt den Durchmesser der Hoden an. T. T. A.D. V.d. D.ej. A.D. D.ej. Ae. Abb.24: Innere männliche Geschlechtsorgane. A.D.: Akzessorische Drüsen, Ae.: Aedeagus, D.ej.: Ductus ejaculatorius, T.: Hoden, V.d.: Vas deferens, V.s.: Der Pfeil gibt den Durchmesser der Hoden an. 60 Ergebnisse Hodendurchmesser (mm) 1,6 1,2 Hodendurc hmesser links 0,8 Hodendurc hmesser rec hts 0,4 0 Diapause nicht Diapause, nicht Diapause, verpaart virginell Gruppe Abb.25: Hodendurchmesser der linken und rechten Hoden von männlichen Käfern in Diapause, Nondiapause verpaarte Männchen und Nondiapause virginelle Männchen (n= 12). Mittelwerte und Standardabweichungen. 4.2. SPERMIEN Quetschpräparate der Hoden diapausierender und nichtdiapausierender Tiere soll‐ ten Aufschluss über die Spermienproduktion der Käfer geben. Abbildung 26 zeigt den Zustand in Diapause. Deutlich ist die austretende Spermienwolke im Quetsch‐ präparat zu erkennen. Das gleiche Ergebnis ist in der Abbildung 27 bei Langtagbe‐ dingungen zu beobachten. In Abbildung 28 sind einzelne Spermien von G. viridula dargestellt. 61 Ergebnisse austretende Spermien Hoden Abb.26: Lichtmikroskopische Aufnahme eines Hodens mit austretenden Spermien, im Dunkelfeld. Der Käfer wurde unter Diapausebedingungen gehalten. austretende Spermien Hoden Abb.27: Lichtmikroskopische Aufnahme eines Hodens mit austretenden Spermien, im Dunkelfeld. Der Käfer wurde unter Langtagbedingungen gehalten. 62 Ergebnisse Abb.28: Einzelne Spermien von G. viridula. Lichtmikroskopische Aufnahme im Dunkelfeld. 5. Einfluss der Temperatur 5.1. ÜBERLEBENSKURVEN Um den Einfluss der Umgebungstemperatur auf das Altern von G. viridula bestim‐ men zu können, wurden die Überlebenskurven männlicher und weiblicher Käferpopulationen bei 15°C und 25°C mit der üblichen Hälterungstemperatur von 20°C verglichen. Die Lichtbedingungen waren auf 16:8 (L/D) Lichtstunden eingestellt. Männchen, welche bei 15°C gehalten wurden, lebten deutlich länger als Männchen der Kontrollgruppe (Abb.29; Log‐Rang‐Test, p< 0,001). Bei einer Tem‐ peratur von 25°C hatten die Tiere, im Vergleich zu der 20°C Population, ein erhöhtes Mortalitätsrisiko (Abb.29; Log‐Rang‐Test, p< 0,01). Auch bei den Weibchen lebten die Tiere, welche bei niederen Temperaturen gehalten wurden, deutlich länger als die 20°C Vergleichspopulation (Abb.30; Log‐ Rang‐Test, p< 0,001). Wie auch bei den Männchen hatten die Weibchen bei 25°C das höchste Mortalitätsrisiko im Vergleich zur 20°C Gruppe (Abb.30; Log‐Rang‐Test, p< 0,01). 63 Ergebnisse 100 Überlebende [%] 80 60 Männchen 20°C Männchen 25°C Männchen 15°C 40 20 0 0 20 40 60 80 100 120 140 Lebensalter [d] Abb.29: Überlebenskurven männlicher Käfer bei drei unterschiedlichen Temperaturen (n= 2 Populationen mit je 200 Tieren). 100 Überlebende [%] 80 60 Weibchen 20°C Weibchen 25°C Weibchen 15°C 40 20 0 0 20 40 60 80 100 120 140 Lebensalter [d] Abb.30: Überlebenskurven weiblicher Käfer bei drei unterschiedlichen Temperaturen (n= 2 Populationen mit je 200 Tieren). 64 Ergebnisse L‐Werte der Überlebenskurven Tab.2: L50, L5 und Lmax-Werte der Käfer bei unterschiedlichen Haltungstemperaturen. Population L50 L5 Lmax ♂ 20°C 40 55 76 ♂ 15°C 56 120 131 ♂ 25°C 26 37 44 ♀ 20°C 26 35 62 ♀ 15°C 51 110 119 ♀ 25°C 19 25 30 In der Tabelle 2 sind L50, L5 und die Lmax – Werte zu sehen. Hier wird nochmals deut‐ lich, dass die männlichen Käfer, die unter 15°C lebten, eine fast doppelt so hohe Gesamtlebenszeit aufwiesen wie die Kontrollgruppe. Die Gesamtlebenszeit der Tiere, welche unter 25°C lebten, war bezüglich der Kontrollgruppe um 60% reduziert. Auch bei den weiblichen Käfern konnten die oben genannten Beobachtungen ge‐ macht werden. Hier war die Gesamtlebenszeit der 15°C‐Gruppe in Bezug zur 20°C‐ Gruppe um 91% erhöht; bei der 25°C‐Gruppe um 50% erniedrigt. 65 Ergebnisse Teil B: Biotische Faktoren 1. Geschlechtspartner 1.1. VIRGINELLE UND VERPAARTE POPULATIONEN 1.1.1. Überlebenskurven Die Tiere wurden bei 20°C unter Langtagbedingungen gehalten. Männliche Käfer, welche nie die Gelegenheit zur Kopulation hatten, zeigten ein deutlich verringertes Mortalitätsrisiko, als eine Population, die mit Weibchen zusammen lebte (Abb.31; Log‐Rang‐Test, p< 0,001). Die Überlebenskurven zeigen den typischen sigmoidalen Verlauf einer Seneszenzkurve. Auch bei den Weibchen (Abb.32) zeigte sich, dass die virginelle Population eine höhere Lebensdauer, im Vergleich zu einer gemischten Gruppe, aufwies (Log‐Rang‐ Test, p< 0,001). Ein Vergleich zwischen Männchen und Weibchen erbrachte, dass sowohl verpaarte als auch virginelle männliche Käfer länger lebten als die jeweilige Weibchengruppe (in beiden Fällen, Log‐Rang‐Test, p< 0,001). 66 Ergebnisse 100 Überlebende [%] 80 60 Männchen verpaart Männchen virginell 40 20 0 0 20 40 60 80 100 Lebensalter [d] Abb.31: Überlebenskurven verpaarter und virgineller Männchen unter Langtagbedingungen (n= 2 Populationen mit je 200 Tieren). 100 Überlebende [%] 80 60 Weibchen verpaart Weibchen virginell 40 20 0 0 20 40 60 80 100 Lebensalter [d] Abb.32: Überlebenskurven verpaarter und virgineller Weibchen unter Langtagbedingungen (n= 2 Populationen mit je 200 Tieren). 67 Ergebnisse L‐Werte der Überlebenskurven Tab.3: L50, L5 und Lmax-Werte verpaarter und virgineller männlicher und weiblicher Käfer. Population L50 L5 Lmax ♂ verpaart 29 59 70 ♂ virginell 47 84 100 ♀ verpaart 24 42 49 ♀ virginell 31 63 75 In der Tabelle 3 sind die L‐Werte aus den Überlebenskurven dargestellt. Die virgi‐ nelle männliche Gruppe hatte mit 100 Tagen, eine um 30% erhöhte maximale Lebensdauer, im Vergleich zu den verpaarten Männchen. Auch bei den virginellen Weibchen war die maximale Lebensdauer um 35% erhöht. Generell hatten Männ‐ chen eine höhere maximale Lebensdauer als Weibchen. Die maximale Lebensdauer virgineller männlicher Tiere war um 25 und die der verpaarten Männchen um 30 Prozent verlängert. 1.1.2. Kohlendioxidproduktion Zwischen virginellen und verpaarten Männchen zeigten sich keine Unterschiede bezüglich ihrer Produktion an Kohlendioxid (Abb.33; Mann‐Whitney‐U‐Test, p> 0,10). Es zeigte sich aber, dass die Kohlendioxidproduktion mit zunehmendem Alter, sowohl bei der verpaarten, als auch bei der virginellen Gruppe abnahm (in beiden Fällen, Mann‐Whitney‐U‐Test, p< 0,05). Bei den Weibchen gab es ebenfalls keine Unterschiede in der CO2‐Produktion (Mann‐ Whitney‐U‐Test, p> 0,10). Die produzierte Menge an Kohlendioxid sank ebenfalls mit zunehmendem Alter ab (Mann‐Whitney‐U‐Test, p< 0,05). Unabhängig vom Kopulationsstatus produzierten Weibchen generell mehr CO2 als Männchen (Mann‐Whitney‐U‐Test, p< 0,001). 68 Ergebnisse Kohlendioxidproduktion [µl/h*mg] 2 1,6 1,2 Männchen VP Männchen Virg 0,8 0,4 0 0 10 20 30 40 50 60 Lebensalter [d] Abb.33: Kohlendioxidproduktion verpaarter (VP) und virgineller (Virg), männlicher Käfer. Dargestellt sind Median und Interquartilbereich. Jeder Messpunkt repräsentiert je 5 Tiere aus 3 Populationen Kohlendioxidproduktion [µl/h*mg] 2 1,6 1,2 Weibc hen VP Weibc hen Virg 0,8 0,4 0 0 10 20 30 40 50 60 Lebensalter [d] Abb.34: Kohlendioxidproduktion verpaarter (VP) und virgineller (Virg), weiblicher Käfer. Dargestellt sind Median und Interquartilbereich. Jeder Messpunkt repräsentiert je 5Tiere aus 3 Populationen 69 Ergebnisse 1.1.3. Eiablage In den folgenden Abbildungen sind die Beziehungen zwischen Eiablage und Le‐ bensdauer bei verpaarten, virginellen und unter Freilandbedingungen gehaltenen Käfern dargestellt. In Abbildung 35 ist die Gesamtzahl an abgelegten Eiern eines Weibchens gegen seine Lebensdauer aufgetragen. Verpaarte Weibchen lebten kürzer als virginelle und Weibchen unter Freilandbedingungen. In dieser Zeit produzierten sie weniger Eier als die beiden anderen Weibchenpopulationen. Generell zeigte sich, dass je länger die Käfer lebten, sie umso mehr Eier produzierten. In der Abbildung 36 wurde die abgelegte Menge an Eiern pro Tag gegen die Lebensdauer der Tiere aufgetragen. In allen drei Populationen war die Menge an gelegten Eiern pro Tag gleich und änderte sich auch mit fortschreitendem Alter nicht. 2500 Gesamteimenge 2000 1500 Weibchen VP Weibchen Virg Weibchen FL 1000 500 0 0 10 20 30 40 50 60 Tage Abb.35: Gesamteimenge der Einzeltiere einer verpaarten (VP), einer virginellen (Virg) und einer Population unter Freilandbedingungen (FL); (VP, n= 55, Virg, n= 52, FL, n= 56). 70 Ergebnisse mittlere Eimenge 80 60 Weibchen VP Weibchen Virg Weibchen FL 40 T L Weibchen VP T L Weibchen Virg T L Weibchen FL 20 0 0 10 20 30 40 50 60 Tage Abb.36: Mittlere Eimenge der Einzeltiere einer verpaarten (VP), einer virginellen (Virg) und einer Population unter Freilandbedingungen (FL); (VP, n= 55, Virg, n= 52, FL, n= 56). Die durchschnittlichen Gesamteimengen einer verpaarten, einer virginellen und einer Population unter Freilandbedingungen sind in der Abbildung 37 dargestellt. Es zeigte sich, dass Weibchen, welche unter Freilandbedingungen lebten, die meisten Eier produzierten (Kruskal‐Wallis‐H‐Test, Folgetest nach Tukey, p< 0,01). Die mitt‐ lere Eimenge der abgelegten Eier pro Tag ist in der Abbildung 38 zu sehen. Ein Vergleich der drei Gruppen erbrachte, keinen Unterschied (Kruskal‐Wallis‐H‐Test, Folgetest nach Tukey, p> 0,10). 71 Ergebnisse durchschnittliche Gesamteizahl 2000 1600 1200 Weibchen VP Weibchen Virg Weibchen FL 800 1463 1215 400 902 0 1 Abb.37: Durchschnittliche Gesamteimenge einer verpaarten (VP), einer virginellen (Virg) und einer Population unter Freilandbedingungen (FL). Mittelwerte und Standardabweichungen. 50 mittlere Eimenge 46 42 Weibchen VP Weibchen Virg Weibchen FL 38 34 30 43 41 40 1 Abb.38: Durchschnittliche mittlere Eimenge einer verpaarten (VP), einer virginellen (Virg) und einer Population unter Freilandbedingungen (FL). Mittelwerte und Standardabweichungen. 72 Ergebnisse 1.1.4. Eigröße Der Verpaarungsstatus keinen Einfluss auf den Ei‐Quotienten (Abb.39; Mann‐Whit‐ ney‐U‐Test, p> 0,10). Der mittlere Wert beider Populationen lag bei 2,3. Ei‐Quotient (Länge/Breite) 2,5 2,4 Weibchen VP 2,3 Weibchen Virg 2,2 2,1 0 5 10 15 20 25 30 35 40 Weibchen Nr Abb.39: Ei-Größen-Quotient, berechnet aus Länge/Breite des jeweiligen Einzeleis einer verpaarten (VP) und einer virginellen (Virg) Population (VP, n= 40, Virg, n= 40). 73 Ergebnisse 1.2. VERZÖGERTE KOPULATION Nach 25 Tagen wurden virginellen Männchen Weibchen in gleicher Anzahl zu‐ gesetzt (Kop VZ). Bei einem Vergleich der Mortalitätsrisiken zeigten sich keine Unterschiede zwischen den beiden Männchenpopulationen (Abb.40; Log‐Rang‐Test, p> 0,10). In Abbildung 41 sind die entsprechenden Weibchenpopulationen zu sehen. Ein Ver‐ gleich der Mortalitätsrisiken ergab, dass das Mortalitätsrisiko der verpaarten Weib‐ chen im Vergleich zu den verzögert kopulierten Weibchen erhöht war (Log‐Rang‐ Test, p< 0,01). Nach dem Zusatz von Männchen zu virginellen Weibchen fällt die Überlebenskurve ab. Zu diesem Zeitpunkt waren noch 76% der Population am Leben; bei den schon zu Beginn verpaarten Weibchen waren es nur noch 46% der Ausgangspopulation (siehe Tab.4). 100 Überlebende [%] 80 60 Männchen Kop VZ Männchen VP 40 20 0 0 20 40 60 80 Lebensalter [d] Abb.40: Überlebenskurven männlicher Käfer, die erst nach 25 Tagen kopulierten (Kop VZ) und einer verpaarten (VP) Vergleichsgruppe (Kop VZ, n= 3 Populationen; VP, n= 2 Populationen, mit je 200Tieren). Der Pfeil markiert den Zusatz von Weibchen. 74 Ergebnisse 100 Überlebende [%] 80 60 Weibchen Kop VZ Weibchen VP 40 20 0 0 20 40 60 80 Lebensalter [d] Abb.41: Überlebenskurven weiblicher Käfer, die erst nach 25 Tagen kopulierten (Kop VZ) und einer verpaarten (VP) Vergleichsgruppe (Kop VZ, n= 3 Populationen; VP, n= 2 Populationen, mit je 200 Tieren). Der Pfeil markiert den Zusatz von Männchen. L‐Werte der Überlebenskurven Tab.4: L50, L5 und Lmax-Werte kopulationsverzögerter und verpaarter männlicher und weiblicher Käfer. Population L50 L5 Lmax ♂ verpaart 34 60 85 ♂ verpaart nach 25 d 32 58 75 ♀ verpaart 24 42 55 ♀ verpaart nach 25 d 29 45 56 In Tabelle 4 sind die L‐Werte aus den Überlebenskurven dargestellt. Alle L‐Werte sind bei den verzögert kopulierten Tieren leicht erhöht. 75 Ergebnisse 1.3. EINS ZU DREI VERPAARUNG Die Überlebenskurven verpaarter Männchen in unterschiedlichen Geschlechterver‐ hältnissen sind in der Abbildung 42 dargestellt. Die Männchenpopulation, welche 1:1 verpaart wurde, dient als Vergleich. Gegenüber der Kontrollgruppe, wiesen die 1:3 verpaarten Tiere eine deutlich geringere Lebensdauer auf (Log‐Rang‐Test, p< 0,001). Virginelle Männchen hatten ein deutlich verringertes Mortalitäts‐risiko, nach 100 Tagen waren noch 6% am Leben (Log Rang‐Test, p< 0,001). Bei den Weibchen zeigte sich ein deutlich erhöhtes Mortalitätsrisiko der 1:3 ver‐ paarten Gruppe im Vergleich mit der Kontrollgruppe (Abb.43; Log‐Rang‐Test, p< 0,001). Die virginellen Weibchen hatten die höchste Lebensdauer (Log‐Rang‐Test, p< 0,001). 100 Überlebende [%] 80 60 Männchen verpaart 1:1 40 Männchen virginell Männchen verpaart 1:3 20 0 0 20 40 60 80 100 Lebensalter [d] Abb.42: Überlebenskurven 1:1 verpaarter, 1:3 verpaarter und virgineller, männlicher Käfer (n= 2 Populationen mit je 200 Tieren). 76 Ergebnisse 100 Überlebende [%] 80 60 Weibchen verpaart 1:1 Weibchen verpaart 1:3 Weibchen virginell 40 20 0 0 20 40 60 80 100 Lebensalter [d] Abb.43: Überlebenskurven 1:1 verpaarter, 1:3 verpaarter und virgineller, weiblicher Käfer (n= 2 Populationen mit je 200 Tieren). L‐Werte der Überlebenskurven Tab.5: L50, L5 und Lmax-Werte eins zu eins verpaarter, eins zu drei und virgineller männlicher und weiblicher Käfer. Population L50 L5 Lmax ♂ verpaart 1:1 36 66 75 ♂ verpaart 1:3 17 40 59 ♂ virginell 70 101 112 ♀ verpaart 1:1 36 55 65 ♀ verpaart 1:3 19 41 48 ♀ virginell 45 68 80 Tabelle 5 zeigt die L‐Werte aus den Überlebenskurven. Virginelle Männchen hatten eine doppelt so hohe Lebensdauer, wie Tiere welche 1:3 verpaart wurden. Bei den Weibchen war diese um 70% verlängert. 77 Ergebnisse 2. Nahrung 2.1. INTERMITTIERENDE FÜTTERUNG Die Überlebenskurven verschieden gefütterter Männchenpopulationen sind in Ab‐ bildung 44 dargestellt. Die ad libitum Population diente hierbei als Kontrolle. Alle Tiere waren unverpaart. Bei einer intermittierenden Fütterung von 24 bzw. 48 Stun‐ den gab es keinen Unterschied bezüglich der Mortalitätsrisiken innerhalb der beiden Populationen (Log‐Rang‐Test, p> 0,10). Die Lebensdauer war gegenüber der täglich gefütterten Population verringert (Log‐Rang‐Test, p< 0,001). Ein Unterschied der Mortalitätsrisiken zwischen den beiden Hungerpopulationen der Weibchen war nicht vorhanden (Abb.45; Log‐Rang‐Test, p> 0,10). Die Lebens‐ dauer ad libitum gefütterter Weibchen war erhöht (Abb.45; Log‐Rang‐Test, p< 0,001). 100 Überlebende [%] 80 60 Männchen 24h Männchen 48h Männchen ad lib. 40 20 0 0 20 40 60 80 100 Lebensalter [d] Abb.44: Überlebenskurven männlicher Käfer, die intermittierend im 24 bzw. 48 Stundenrhythmus gefüttert wurden und einer ad libitum gefütterte Vergleichsgruppe (n= 2 Populationen mit je 200 Tieren). 78 Ergebnisse 100 Überlebende [%] 80 60 Weibchen 24h Weibchen 48h Weibchen ad lib. 40 20 0 0 20 40 60 80 100 Lebensalter [d] Abb.45: Überlebenskurven weiblicher Käfer, die intermittierend im 24 bzw. 48 Stundenrhythmus gefüttert wurden und einer ad libitum gefütterte Vergleichsgruppe (n= 2 Populationen mit je 200 Tieren). Tab.6: L50, L5 und Lmax-Werte unterschiedlich gefütterter männlicher und weiblicher Käfer. Population L50 L5 Lmax ♂ ad libitum 47 84 100 ♂ 24 h Hunger 16 67 75 ♂ 48 h Hunger 16 54 60 ♀ ad libitum 31 63 75 ♀ 24 h Hunger 17 29 43 ♀ 48 h Hunger 16 29 52 Tabelle 6 zeigt die L‐Werte aus den Überlebenskurven. Die durchschnittliche maxi‐ male Lebensdauer intermittierend gefütterter Männchen ist um 32, bei den Weibchen um 36% erniedrigt. 79 Ergebnisse 2.2. FRAßLEISTUNG BEI INTERMITTIERENDER FÜTTERUNG Es zeigte sich, dass nach 24 Stunden Hungern die männlichen Tiere stets mehr Nah‐ rung zu sich nahmen als die ad libitum Gruppe (Abb.46; Mann‐Whitney‐U‐Test, p< 0,01). Bei den Weibchen (Abb.47) war die Fraßmenge der 24 Stunden hungernden Tiere im Vergleich zu der ad libitum Gruppe erniedrigt (Mann‐Whitney‐U‐Test, p< 0,01). Weibliche Käfer nahmen durchschnittlich mehr Nahrung auf als Männchen der gleichen Fütterungsgruppe (in beiden Fällen, Mann‐Whitney‐U‐Test, p< 0,01). Fraßmenge [cm 2 ] 5 4 3 Männchen ad lib. Männchen 24h 2 1 0 0 5 10 15 20 25 Tage [d] 2 Abb.46: Durchschnittliche Fraßmenge (cm Blattfläche) männlicher Käfer, welche ad libitum und alle 24 Stunden gefüttert wurden (n= 15). 80 Ergebnisse 5 Fraßmenge [cm 2 ] 4 3 Weibchen ab lib. Weibchen 24h 2 1 0 0 5 10 15 20 25 Tage [d] 2 Abb.47: Durchschnittliche Fraßmenge (cm Blattfläche) weiblicher Käfer, welche ad libitum und alle 24 Stunden gefüttert wurden (n= 15). 81 Ergebnisse Teil C: Altern unter Freilandbedingungen 1. Freilandversuche 1.1. ÜBERLEBENSKURVEN Mehrere Käferpopulationen wurden in den Jahren 2004 und 2005 unter Freilandbe‐ dingungen vergleichend alternsbiologisch untersucht. Die gesammelten relativen Temperatur‐und Luftfeuchtigkeitswerte am Standort der Käfige sind im Anhang aufgezeigt. Die Überlebenskurven dreier Generationen Männchen aus den Jahren 2004 und 2005, die unter Freilandbedingungen lebten, sind in Abbildung 48 zu sehen. Als Ver‐ gleich diente eine Männchenpopulation, die bei konstant 20°C und einem L/D‐ Zyklus von 16:8 Stunden im Klimaschrank gehalten wurde. Innerhalb der Männchengruppen aus dem Freiland waren die Mortalitätsrisiken gleich (Log‐Rang‐Test, p> 0,10). Männchen und Weibchen unter Freilandbeding‐ ungen lebten länger als die Vergleichsgruppen aus dem Klimaschrank (Abb.48 und 49; in beiden Fällen Log‐Rang‐Test, p< 0,001). Bei den Weibchen (Abb. 49) zeigte sich, dass die beiden Freilandpopulationen aus dem Jahr 2004 keinerlei Unterschiede bezüglich ihrer Mortalitätsrisiken aufwiesen (Log‐Rang‐Test, p> 0,10), eine Ausnahme machten die Weibchen aus dem Jahr 2005. 82 Ergebnisse 100 Überlebende [%] 80 Männc hen 2004 I 60 Männc hen 2004 II Männc hen 2005 I 40 Männc hen LT 20 0 0 15 30 45 60 75 90 105 120 135 Lebensalter [d] Abb.48: Überlebenskurven der Männchen, welche unter Freilandbedingungen gehalten wurden und einer Männchenpopulation, die unter Langtagbedingungen (LT) bei konstant 20°C lebten (n= 1 Population mit je 200 Tieren). 100 Überlebende [%] 80 Weibc hen 2004 I 60 Weibc hen 2004 II Weibc hen 2005 I 40 Weibc hen LT 20 0 0 15 30 45 60 75 90 105 120 135 Lebensalter [d] Abb.49: Überlebenskurven der Weibchen, welche unter Freilandbedingungen gehalten wurden und einer Weibchenpopulation, die unter Langtagbedingungen (LT) bei konstant 20°C lebten (n= 1 Population mit je 200 Tieren). 83 Ergebnisse L‐Werte der Überlebenskurven Tab.7: L50, L5 und Lmax-Werte der Käfer im Freiland und Langtagbedingungen im Klimaschrank. Population L50 L5 Lmax. ♂ FL 2004 I 87 124 134 ♂ FL 2004 II 88 124 141 ♂ FL 2005 I 82 129 141 ♂ LT 20°C 30 65 81 ♀ FL 2004 I 77 100 103 ♀ FL 2004 II 73 101 112 ♀ FL 2005 I 53 77 91 ♀ LT 20°C 24 44 59 Tabelle 7 zeigt die L‐Werte aus den Überlebenskurven. Männliche Käfer, welche unter Freilandbedingungen lebten hatten eine durchschnittliche maximale Lebens‐ dauer von 139 Tagen, also 70% höher als eine Population im Klimaschrank. Bei weiblichen Käfern lag die durchschnittliche maximale Lebensdauer unter Freiland‐ bedingungen bei 102 Tagen, sie war damit im Vergleich zu der Klimaschrank‐ population um 70% erhöht. Innerhalb der Männchenpopulationen aus dem Freiland gab es nur minimale Unterschiede. Auch bei den Weibchenpopulationen aus dem Freiland des Jahres 2004 waren die Unterschiede zwischen den L‐Werten ebenfalls minimal. Bei der Weibchenpopulation des Jahres 2005 waren L50, L5 und der Lmax‐ Wert im Vergleich zu den Gruppen auf dem Jahr 2004 erniedrigt. 84 Ergebnisse 1.2. KOHLENDIOXIDPRODUKTION Die abgegebene Menge an Kohlendioxid einer Männchen‐ und Weibchenpopulation, welche unter Freilandbedingungen lebten wurde, bestimmt. Als Vergleich dienten Populationen, die unter Langtagbedingungen bei 20°C im Klimaschrank gehalten wurden. Männchen, welche unter Freilandbedingungen lebten produzierten weniger Kohlendioxid als die Vergleichsgruppe unter konstanter Temperatur (Abb.50; Mann‐Whitney‐U‐Test, p< 0,01). In beiden Populationen nahm die Kohlendioxidproduktion zum Lebensende hin ab. Bei den Weibchen war die Kohlendioxidproduktion der Klimaschranktiere eben‐ falls höher als bei der Population aus dem Freiland (Abb.51; Mann‐Whitney‐U‐Test, p< 0,01). Mit fortschreitendem Alter nahm in beiden Weibchenpopulationen die Kohlendioxidproduktion ab. Sowohl bei den Männchen als auch bei den Weibchen fiel auf, dass ‐ abgesehen vom Niveau ‐ sich die Kohlendioxidproduktionen über die gesamte Lebenszeit bei Tieren aus dem Klimaschrank und Tieren unter Freiland‐ bedingungen, in ihrem Verlauf ähneln. Kohlendioxidproduktion [µl/h*mg] 2 1,6 1,2 Männchen KL Männchen FL 0,8 0,4 0 0 10 20 30 40 50 60 70 Lebensalter [d] Abb.50: Kohlendioxidproduktion männlicher Käfer unter Freiland- und konstanten Klimaschrankbedingungen. Jeder Messpunkt repräsentiert 5 Tiere aus einer Population mit 200 Tieren. 85 Ergebnisse Kohlendioxidproduktion [µl/h*mg] 2 1,6 1,2 Weibchen KL Weibchen FL 0,8 0,4 0 0 10 20 30 40 50 60 70 Lebensalter [d] Abb.51: Kohlendioxidproduktion weiblicher Käfer unter Freiland- und konstanten Klimaschrankbedingungen. Jeder Messpunkt repräsentiert 5 Tiere aus einer Population mit 200 Tieren. 86 Diskussion IV. DISKUSSION Teil A: Abiotische Faktoren 1. Diapauseinduktion Der erste Teil der vorliegenden Arbeit behandelte die Auswirkungen abiotischer Faktoren auf das Altern von Gastrophysa viridula. Der Kern der Untersuchungen lag hierbei auf Versuchen, die sich mit den Alterungsprozessen der Tiere in Diapause befassten. Die Voraussetzung für diese Experimente war, dass bei einer konstanten Temperatur von 20°C eine Diapause ausschließlich durch Manipulation der Photo‐ periode induziert wurde. In einer sogenannten „sensiblen Phase“ reagierten die Tiere in ihrer Entwicklung auf einen Diapause auslösenden Stimulus. Um für diese Testreihe möglichst viele Käfer zur Verfügung zu haben, war es also notwendig, diese sensible Phase genauer zu untersuchen. Nach Müller (1970) ist die Photoperiode oft der induzierende Faktor einer Diapause. Im Fall von G. viridula war die sensible Phase eindeutig in der frühen Entwicklung nachzuweisen. Waren Eier und Larven Kurztagbedingungen ausgesetzt, reagierten die adulten Käfer mit Diapause. Im Gegensatz dazu reagierten Puppen oder auch frisch geschlüpfte Käfer unter Kurztagbedingungen mit Non‐ diapause. Eine sensible Phase im Larvalstadium ist bei vielen Käfern anzutreffen (MÜLLER, 1970), wohingegen Änderungen der Photoperiode während und nach der Verpuppung völlig wirkungslos bleiben. Nach DANKS (1987) ist die Photoperiode der wichtigste und verlässlichste induzierende Faktor einer Diapause in den gemäßigten Breiten. Sie ist über einen langen Zeitraum voraussagbar, so dass sich alle Individuen einer Population vor Eintritt der ungünstigen Umweltbedingungen anpassen kön‐ nen. Die Photoperiode ist aber auch eng mit der Temperatur verknüpft; diese kann in Tropen sogar wichtigster Induktor einer Diapause sein (LEES, 1955). 87 Diskussion Um die Anzahl an Diapausetieren für spätere Versuche zu maximieren, musste die Belichtungsdauer optimal eingestellt sein. Deshalb wurde die kritische Tageslänge bei einer konstanten Temperatur von 20°C ermittelt. Es wurde ausschließlich mit weiblichen Käfern gearbeitet, da Nondiapausetiere durch die einsetzende Physio‐ gastrie leicht zu erkennen waren. Die Ergebnisse zeigten, dass die kritische Photoperiode bei 10,5 Lichtstunden lag. Der maximale Anteil der Tiere ging bei 7 Lichtstunden in Diapause. Unter diesen Bedingungen waren nur 30% der Population reproduktiv. Wurde die Belichtungsdauer weiter reduziert, stieg der Anteil an Non‐ diapausetieren wieder an. Durch die kurze Tageslänge wurde vermutlich das interne Programm gestört und die Tiere konnten sich nicht anpassen. Diese Beobachtungen machten auch SAUNDERS und CYMBOROWSKI (2003) an der Schmeißfliege Calliphora vicina. Verkürzte sich hier die Tageslänge auf weniger als 6 Stunden, reagierten die Fliegen ebenfalls zunehmend mit Nondiapause. Da die Photoperiode als Diapause induzierender Faktor eng mit der Umgebungs‐ temperatur verknüpft ist, gab es einen gewissen Prozentsatz an Tieren, die nicht in Diapause zu versetzen waren, oder die Diapause brachen. Etwa 25% der dia‐ pausierenden Weibchen brachen nach dem 50. Lebenstag die Diapause, und wurden reproduktiv. Durch die hohen konstanten Hochsommertemperaturen im Klima‐ schrank entsteht eine externe Desynchronisation, die ihrerseits im Diapauseablauf eine interne Störung erzeugt, welche zu chronopathologischen Reaktionen führen kann (SAUNDER, 1997). 2. Diapause 2.1. ÜBERLEBENSKURVEN Die gewonnen Daten belegen eine Verlängerung der mittleren und maximalen Le‐ benserwartung der Tiere durch eine Diapause. Sowohl männliche als auch weibliche Käfer lebten dreimal länger als Tiere unter den gegebenen Langtagbedingungen. Dass ein Diapausestadium die Lebensdauer erhöhen bzw. den Alterungsprozess unterbrechen kann, zeigten schon HOUTHOOFD et al. (2002) an dem Fadenwurm 88 Diskussion Caenorhabditis elegans und ZANNOU et al. (2003) an dem Samenkäfer Callosobruchus maculatus. Kennzeichnend für die Überlebenskurven der Käfer in Diapause ist der Verlauf in Form einer Zerfallskurve, wie sie auch von anorganischen Systemen bekannt ist. Nach LAMB (1977) ist dieser Kurvenverlauf bei organismischen Strukturen typisch für eine nicht alternde Population. Zu jedem Zeitpunkt des Lebens ist die Wahrscheinlichkeit zu sterben für das einzelne Individuum gleich groß. Bei den Vergleichspopulationen unter Langtagbedingungen ist der charakteristische sigmoide Verlauf einer alternden Population, welche nicht durch externe Mortalitätsrisiken wie z.B. Fressfeinde bedroht wird, deutlich zu erkennen. Die Wahrscheinlichkeit zu sterben ist in einer solchen Population im mittleren Bereich der Lebenszeit erhöht, während das Mortalitätsrisiko zu Beginn der Lebenszeit verringert ist. Am Ende der Lebenszeit ist der Kurvenverlauf oft exponentiell und entspricht damit wiederum der genannten Zerfallskurve. 2.2. FRAßMENGE Viele Tiere durchlaufen unter Diapausebedingungen eine sogenannte „prädiapau‐ sale Periode“, bevor sie in das eigentliche Stadium der Diapause eintreten (DE WILDE, 1969; SENANAYAKE, 2000). In dieser Phase nehmen sie Nahrung zu sich und reichern Reserven an. Lipide sind hierbei die wichtigsten Reservestoffe (HAHN und DENLINGER, 2007). Auch beide Geschlechter von G. viridula durchliefen eine solche prädiapausale Phase, und die aufgenommene Futtermenge entsprach der Nah‐ rungsaufnahme nichtdiapausierender Tiere. Nach etwa 10 Tagen sank die Fraß‐ menge stark ab und pendelte sich auf ein Minimum ein, da die Käfer durch den reduzierten Stoffwechsel (siehe Seite 90) kaum Nahrung benötigten. Diese deutliche Reduktion der Nahrungsmenge unter Diapausebedingungen im Vergleich zu einer Langtagpopulation konnten auch NIVA und TAKEDA (2003) an der Wanze Halyo‐ morpha halys nachweisen. 89 Diskussion Die Weibchen von G. viridula nahmen generell mehr Nahrung zu sich als die Männ‐ chen. Bei den Gruppen unter Langtagbedingungen ist dies durch die Tatsache zu erklären, dass die Weibchen täglich eine große Menge an Eiern ablegten und somit auch einen höheren Energiebedarf aufwiesen. 2.3 KOHLENDIOXIDPRODUKTION Als Maß für die Stoffwechselaktivität der Tiere wurde die abgegebene Menge an Kohlendioxid bestimmt. Unter den gegebenen experimentellen Bedingungen war dies sinnvoll, da eine Kohlendioxidmessung um den Faktor 100 empfindlicher ist als eine vergleichbare Sauerstoffmessung. Da die Käfer fast ausschließlich Kohlenhy‐ drate in Form von Blättern fraßen, war ein Respiratorischer Quotient nahe 1 zu erwarten. Die weiblichen Käfer wiesen in allen Versuchsansätzen eine höhere Stoffwechselrate als die entsprechende Männchenpopulation auf. Käferpopulationen in Diapause hatten im Vergleich zu den jeweiligen Langtagpopulationen stets eine signifikant reduzierte Kohlendioxidproduktion. Entsprechendes konnte schon von DING et al. (2003) an Puppen der Kohleule Mamestra brassicae nachgewiesen werden. Die erhöhte Lebenserwartung der Individuen während einer Diapause kann durch die Theorie der Lebensrate (PEARL, 1928) erklärt werden. Danach ist die Stoff‐ wechselrate negativ mit der Lebensdauer korreliert. Durch die Reduzierung des Stoffwechsels während der Diapause kommt es zu einer gesteigerten Lebensdauer. VAN VOORHIES und WARD (1999) bestätigten diesen Umstand an dem Fadenwurm C. elegans. Aber auch an Insekten, wie z.B. der Diptere Phormia regina konnte diese Verlängerung der Lebensdauer beschrieben werden (COLLATZ, 2003). Die CO2‐Rate der Diapausepopulationen war zu Beginn der Versuche ähnlich der der Langtagpopulationen, sank dann in den folgenden Tagen aber stark ab. Diese Ergebnisse sprechen wiederum für eine prädiapausale Phase (siehe oben). Anschließend gruben sich die Käfer in die Zellstofflagen ein, und die Stoffwechsel‐ aktivität sank auf ein Minimum (Abb.10). Mit fortlaufendem Alter stieg aber die Kohlendioxidproduktion der Tiere wieder an. Mit diesem Anstieg, der ab dem 50. 90 Diskussion Lebenstag begann, ging einher, dass Weibchen teilweise die Diapause beendeten und reproduktiv wurden. Diese Ergebnisse bestätigen HODEK (1983), der eine Zunahme des Stoffwechsels am Ende der Diapause an der Feuerwanze Pyrrohocoris apterus beschreibt. Die Umgebungstemperatur spielt hier eine entscheidende Bedeutung. Hohe Tem‐ peraturen beeinflussten die Käfer in Diapause deutlich. Offensichtlich ist nach einer gewissen Zeitspanne der Lichtreiz nicht mehr stark genug, die Tiere in Diapause zu halten. 2.4. ENZYMAKTIVITÄTEN WÄHREND DER DIAPAUSE Die meisten Dormanzformen bedingen eine deutliche Reduktion des Stoffwechsels. Dieser hypometabole Stoffwechsel erlaubt es den Organismen, wie bereits erwähnt, schlechte Umweltbedingungen besser zu überstehen. Vor allem die Aktivitäten vieler Enzyme des Intermediärstoffwechsels werden reduziert und sind bei der, der Dia‐ pause nicht unähnlichen, Aestivation meist bekannt (BROOKS und STOREY, 1997; STOREY, 2002). Es gibt eine Reihe von Mechanismen, die es ermöglichen Enzyme bzw. Enzymaktivi‐ täten zu regulieren. Allosterische Effekte, Substratreduktion, Bildung von Iso‐ enzymen, sowie die reversible Phosphorylierung sind hierbei zu nennen. Die reversible Phosphorylierung von Enzymen gehört zu den wichtigsten zellu‐ lären Kontrollmechanismen eines Organismus. Enzyme aus den Gruppen der Kinasen und Phosphatasen sind hierfür verantwortlich. Durch Bindung einer Phos‐ phatgruppe mittels einer Kinase können Enzyme von einer aktiven in eine inaktive Form oder umgekehrt wechseln. Die Phosphatgruppe bewirkt meist sterische bzw. elektrostatische Effekte, die dann zu einer Konformationsänderung der Proteine führen. Das katalytische Zentrum wird hierbei verändert. Wird die Phosphatgruppe durch eine Phosphatase wieder hydrolytisch abgespalten, kann das Enzym wieder Substrat umsetzen. Dieser Mechanismus kommt auch bei der „Downregulation“des 91 Diskussion Stoffwechsels winterschlafender Säugetiere zum Tragen (STOREY, 1987). Es wird im Wesentlichen ein neues Gleichgewicht auf niederem Niveau aufgebaut. Die Aktivitätsmessungen wichtiger Enzyme der Glykolyse und des Kohlenhydrat‐ stoffwechsels, sowie die Bestimmung der Aktivität der Argininphosphokinase, konnten die physiologischen Vorgänge im Käfer während einer Diapause ver‐ deutlichen. 2.4.1. Glykogen‐Phosphorylase Die Glykogen‐Phosphorylase nimmt eine Schlüsselstellung im Kohlenhydratabbau ein. Das Enzym kann in einer aktiven Form und einer inaktiven Form vorliegen. Kälte ist ein Stimulus für die Transformierung der aktiven in die inaktive Enzym‐ form (ZIEGLER et al., 1979). Eine Aktivierung der Phosphorylase sollte eine Hem‐ mung der Pyruvatkinase (PK) und der Phosphofructokinase (PFK) nach sich ziehen (LI et al., 2002 B). Stattdessen kommt es zu einer Aktivierung der für die Glycerol‐ synthese notwendigen Enzyme. Dies konnte in der vorliegenden Arbeit nicht bestätigt werden. Sowohl Männchen als auch Weibchen hatten in Diapause eine verminderte Aktivität der aktiven Phospho‐ rylase Form. Dies kann mit der Tatsache zusammenhängen, dass die Käfer keinem Kältereiz ausgesetzt waren. Dieser Kätestimulus ist aber für die Synthese von Glycerol, als wichtiger Frostschutz, notwendig. Fehlt dieser Reiz besteht keine Not‐ wendigkeit den Stoffwechsel dahingehend umzubauen. 2.4.2. Phosphofructokinase Die spezifischen Aktivitäten der Phosphofructokinase waren in beiden Geschlechtern bei den Diapausepopulationen reduziert. STOREY und STOREY (1981) nehmen an, dass für eine Überwinterung, in der hauptsächlich Glycerol als Frostschutzmittel dient, eine Aktivierung der PFK essentiell sei. Dies konnte durch die vorliegenden Ergeb‐ nisse nicht bestätigt werden. LI et al. (2002 A) konnten ebenfalls keine erhöhten PFK 92 Diskussion Aktivitäten in diapausierenden Larven des Schmetterlings Chilo supressalis feststellen. Wie auch bei G. viridula waren die Tiere hier keinem Kältereiz ausgesetzt. 2.4.3. Pyruvatkinase Als weiteres Schlüsselenzym der Glykolyse diente die Pyruvatkinase. Bei der Kata‐ lyse wird von Phosphoenolpyruvat eine energiereiche Phosphatgruppe auf ADP übertragen. Bei den spezifischen Aktivitäten der Pyruvatkinase sind die gewonnenen Ergebnisse uneinheitlich. Eine Reduktion der Aktivität des Enzyms konnte bei männlichen Käfern in Diapause nicht festgestellt werden. Dies zeigten auch LI et al. (2002 A) an diapausierenden Schmetterlingslarven. Bei G. viridula kam es in beiden Gruppen in der Lebensmitte zu einem Maximum der Aktivität der PK. Die Kurven beider Männ‐ chengruppen scheinen zeitversetzt zu sein. Offensichtlich kam es bei den Männchen in Diapause zu einem langsameren Anstieg der Pyruvatkinase. Im Gegensatz hierzu war die spezifische Aktivität der PK weiblicher G. viridula in Diapause im Vergleich mit Langtagpopulationen reduziert. Ein zeitversetzter An‐ stieg der Aktivität, wie dem der Diapausemännchen, war bei weiblichen Käfern in Diapause nicht zu beobachten. Der Grund für die unterschiedlichen Aktivitäten zwischen Männchen und Weibchen in Diapause bleibt unklar. 2.4.4. Argininphosphokinase Die Argininphosphokinase (APK) dient zur Übertragung von Phosphatgruppen aus dem Energiespeichermolekül Argininphosphat auf ADP. Dieser Weg der ATP‐Bild‐ ung ist eine der wichtigsten Reaktionen zur Mobilisierung von Energie im Insekten‐ muskel. Die APK ist somit eine wichtige Kenngröße in der Muskelphysiologie von Insekten. Die Aktivität der APK nimmt bei Männchen unter Langtagbedingungen bis zum Lebensende stetig zu. Dies konnte auch in früheren Arbeiten an der Schmeiß‐ fliege Phormia terraenovae gezeigt werden (COLLATZ und WILPS, 1986; WILKER, 2000;). 93 Diskussion In beiden Geschlechtern hat eine Diapause eine deutliche Verminderung der Aktivi‐ tät dieses Enzyms zur Folge. Die spezifische Enzymaktivität der APK stellt somit ein gutes Maß für die Geschäftigkeit der Tiere dar. Männchen hatten stets höhere Enzymaktivitäten als Weibchen. Männliche Käfer sind auf der Suche nach Weibchen, oder verteidigen diese gegen Konkurrenten. Dafür benötigen sie mehr Energie, was sich in einer erhöhten Aktivität der APK wiederspiegeln könnte. Da sich die Tiere in Diapause selten bewegen und kaum Energie verbrauchen, ist die Aktivität der APK dementsprechend erniedrigt. Bei den männlichen Käfern in Diapause war ein Anstieg der Aktivität zu Beginn des Lebens deutlich zu beobach‐ ten. In dieser Zeit waren die Tiere viel agiler und nahmen Nahrung zu sich. Welcher der oben genannten Mechanismen zur Enzymregulation bei G. viridula verwirklicht wird, konnte in der vorliegenden Arbeit nicht geklärt werden. 2.5. LIPIDBE Der Fettgehalt der Käfer in Diapause stieg in der ersten Lebenshälfte auf bis zu 46% des Körperfrischgewichts an. Es ist den Tieren möglich Reserven anzulegen, was auch bei vielen anderen Insekten bekannt ist (SENANAYAKE, 2000). Der hohe Lipid‐ gehalt ist deshalb typisch für ein Insekt in Diapause (NIVA und TAKEDA, 2003; BEAN et al., 2007). Einen sehr hohen Fettanteil von bis zu 50% des Körperfrischgewichts erwähnt auch DANKS (1987) bei diapausierenden Insekten. In der zweiten Lebens‐ hälfte der diapausierenden Käfer sank der Gesamtlipidgehalt auf unter 14% ab. Dies macht deutlich, dass diese Fettreserven in Diapause verbraucht werden. Bei dem Rüsselkäfer Anthonomus grandis sinkt der Fettgehalt von 25% zu Beginn der Dia‐ pause, auf 5 bis 10% des Körpergewichts ab (DANKS, 1987). Der Fettgehalt nicht diapausierender Weibchen betrug maximal 10% des Frisch‐ gewichts. Auch frisch geschlüpfte Tiere wiesen mit durchschnittlich 4% einen gering‐ en Gesamtlipidgehalt auf, der nach dem Reifefraß leicht anstieg. Diese Ergebnisse decken sich mit denen von DANKS (1987) gewonnenen Daten, wonach frisch ge‐ 94 Diskussion schlüpfte Käfer einen Fettgehalt von 2 bis 6% aufweisen, der nach einiger Zeit auf 18 bis 25% ansteigt. 2.6. INDUZIERTER BRUCH DER DIAPAUSE Die durchschnittliche Lebensdauer von G. viridula betrug, bei Langtagbedingungen und einer konstanten Temperatur von 20°C, 50‐60 Tage. Unter kontinuierlichen Diapausebedingungen erhöhte sich die Lebenserwartung beträchtlich (siehe Seite 88). Wurde die Diapause nach 60 Tagen unterbrochen und die Tiere unter Lang‐ tagbedienungen gehalten, lebte die Population zusätzlich einen „normalen“ Lang‐ taglebenszyklus von circa 60 Tagen. Die Käfer nahmen nach der Umstellung des Lichtprogramms wieder vermehrt Nahrung zu sich und begannen nach kurzer Zeit mit der Reproduktion. Dies bekräftigt nochmals die Tatsache, dass der Alterungs‐ prozess der Tiere in Diapause unterbrochen ist. Die Tiere sind nach Beendigung der Diapause mit frisch geschlüpften Käfern vergleichbar, und wie diese legten sie auch einen Reifefraß ein, um die in der Diapause verbrauchten Reserven aufzufrischen. Auch die Verdoppelung der Diapausenlänge auf 120 Tage zeigte, dass Käfer unter Langtagbedingungen den zusätzlichen Langtaglebenszyklus von 60 Tagen durch‐ liefen. Dies hat durchaus seine Bedeutung, da Käfer nach Beendigung der Diapause im Freiland noch in der Lage sein müssen, sich erfolgreich fortzupflanzen. Eine dergestalt experimentell erzeugte Diapause von 120 Tagen kommt der Dauer, welche die Käfer unter Freilandbedingungen diapausieren sehr nahe (siehe I.9.). Die Ergebnisse der Kohlendioxidmessung verdeutlichen die Diapausesituation. Der Stoffwechsel wurde kurz nach dem Schlupf stark reduziert und pendelte sich auf einem niederen Niveau ein (siehe Seite 90). Nach der Umstellung der Lichtlänge auf Langtagbedingungen, also einem Bruch der Diapause nach 60 Lebenstagen, war deutlich eine Veränderung der Stoffwechselrate der Tiere zu erkennen. Eine maxi‐ male Aktivierung des Stoffwechsels war innerhalb von nur 10 Tagen abgeschlossen. Waren die Tiere an die neuen Umweltbedingungen angepasst, wurden sie nach einem kurzen zweiten Reifefraß reproduktiv. In den nächsten 60 Tagen sank die 95 Diskussion Kohlendioxidproduktion wieder leicht ab. Dies deckt sich auch mit den Beo‐ bachtungen der Populationen unter konstanten Langtagbedingungen (Abb.10). Die Daten machen deutlich, dass die Käfer nach einer Diapause in der Lage sein müssen, ihren Stoffwechsel so schnell wie möglich auf die neuen Umweltbedingungen einzustellen, um sich erfolgreich fortzupflanzen zu können. 2.7. MÄNNCHEN IN DIAPAUSE Die Untersuchungen der inneren männlichen Geschlechtsorgane zeigten, dass männliche Käfer unter Diapausebedingungen voll entwickelte Hoden mit einer normalen Spermienproduktion besaßen. Das Juvenilhormon, welches in der Haupt‐ sache die Diapause regelt, kontrolliert scheinbar nicht vollständig die Sperma‐ togenese (ICHIMORI et al., 1990). BRAZZEL und NEWSOM (1959) beschreiben bei männlichen Rüsselkäfern der Gattung Anthonomus verkümmerte Hoden und akzessorische Drüsen während einer Adultdiapause. Eine durch Diapause bedingte Reduktion der Hoden findet sich auch bei dem Käfer Hyopera postica (TOMBES, 1964). POLANSKA et al (2005) beschreiben eine Degeneration der Keimzellen in den Hoden diapausierender Wachsmotten (Galleria mellonella). Andere Untersuchungen zeigen hingegen, dass viele Käfermännchen aus der Familie der Blattkäfer (Chrysomelidae) in Diapause voll ausgebildete Geschlechts‐ organe aufweisen (TEOFILOVIC, 1969). Auch die Ergebnisse der vorliegenden Arbeit bestätigen dies. Anderseits konnten ICHIMORI et al. (1987) an Gastrophysa atrocyanea beobachten, dass männliche Käfer in Diapause unreife Hoden aufwiesen und sich in einem Stadium der Präspermatogenese befanden. Es wird vermutet, dass das reproduktive System bei G. atrocyanea unabhängig vom Diapauseablauf ist. Allerdings ist die Diapause dieser Gastrophysa‐Art, im Gegensatz zu der von G. viridula, obligatorisch und damit maßgeblich für die weitere Entwicklung der Tiere. Es wird deutlich, dass die männliche Adultdiapause schwerer einzuordnen ist, als die der Weibchen. 96 Diskussion PENER (2000) beschreibt die reproduktive Diapause männlicher Käfer als eine An‐ passung bzw. eine Coadaptation an das weibliche Diapauseverhalten. Hierzu stellt er ein System vor, dass in drei Typen untergliedert werden kann (PENER, 1992): 1. Die weiblichen Tiere sind nur in der ersten Hälfte der Diapause empfänglich und kopulieren. Die Männchen legen keine Diapause und sterben kurz nach der Kopu‐ lation. Die Spermien werden während der Diapause in der weiblichen Spermathek gespeichert. Ein Beispiel hierfür wären die überwinternden Königinnen vieler eu‐ sozialer Insektenstaaten. 2. Eine zweite Möglichkeit ist, dass Weibchen während der gesamten Diapause paarungsbereit sind. Die Eientwicklung ist aber unterbrochen, und die Spermien werden ebenfalls in der weiblichen Spermathek gespeichert. Dieser Typus findet sich bei vielen Orthopteren, wie z.B. der Kurzfühlerschrecke Anacridium aegyptium. Auch hier treten in der Regel keine Männchen in Diapause auf (NORRIS, 1965). 3. Die Weibchen können aber auch während der gesamten Zeit der Diapause paarungsunwillig sein. In dieser Gruppe gibt es eine reproduktive männliche Dia‐ pause. Die Ergebnisse dieser Arbeit zeigten, dass die Weibchen von G. viridula während der Diapause ebenfalls nicht kopulationsbereit waren. Unter Diapausbedingungen konn‐ ten nie Kopulationen beobachtet werden. Wurden dagegen den Männchen, welche unter Diapausebedingungen lebten, paarungsbereite Langtagweibchen angeboten, kam es sofort zu Kopulationen (pers. Beobacht.). CONNIN und HOOPINGARNER (1971) beschreiben dies auch am Getreidehähnchen Oulema melanopus (Chrysomelidae). Die Männchen sind in Diapause bei Anwesenheit diapausierender Weibchen offenbar sexuell inaktiv. Bei der Präsenz eines paarungsbereiten Weibchens ändert sich dies sofort, und die Tiere werden sexuell aktiv. Um sich den veränderten Bedingungen anzupassen, sollte der Stoffwechsel der Männchen sehr schnell und stark ansteigen. 97 Diskussion Ob dies der Fall ist, wurde in der vorliegenden Arbeit nicht überprüft. Auch die Frage der Geschlechtererkennung konnte in dieser Arbeit nicht geklärt werden. Vorversuche zur innerartlichen Erkennung über kutikulare Kohlenwasserstoffe zeigten eine große Ähnlichkeit der einzelnen Chromatogramme beider Geschlechter. Die Ergebnisse lassen den Schluss zu, dass die männliche reproduktive Diapause weniger intensiv zu sein scheint, als die der weiblichen Käfer. Die Diapause der Männchen wird wahrscheinlich von der Fruchtbarkeit der Weibchen reguliert. Die Strategie der Männchen besteht darin, einen Kompromiss zwischen einer Reduktion des gesamten Stoffwechsels und einem potenten Auftreten gegenüber den Weibchen einzugehen. Sobald die Weibchen paarungsbereit sind, müssen die Männchen kop‐ ulieren. Die beste ökonomische Lösung für die Männchen besteht darin, sich komplett an die Weibchen anzupassen, um somit die Möglichkeit einer Kopulation und Befruchtung zu maximieren. 3. Temperatur 3.1. EINFLUSS DER UMGEBUNGSTEMPERATUR Der Einfluss der Umgebungstemperatur auf ektotherme Organismen ist vielfältig. Veränderungen der Entwicklungszeiten und der Lebensdauer sind unter anderem möglich. Breits 1917 zeigten LOEB und NORTHROP, dass eine Erhöhung der Umge‐ bungstemperatur einen negativen Effekt auf die Lebensdauer und eine Verkürzung der Entwicklung der Fruchtfliege Drosophlia melanogaster zur Folge hat. Dies konnte in vielen weiteren Arbeiten an weiteren Insekten bestätigt werden (EL‐HALIM, 2004; VALENZANO et al., 2006). Bei G. viridula war die Lebensdauer ebenfalls negativ mit der Umgebungstemperatur korreliert (Abb.30). Hohe Temperaturen hatten bei Männchen und Weibchen eine gesteigerte Mortalität zur Folge. HONEK et al. (2003) beschrieben in diesem Zusammenhang, dass auch die larvale Mortalität bei G. viridula mit steigender Temperatur zunahm. Die Entwicklungszeiten verlängerten sich mit abnehmenden 98 Diskussion Temperaturen, aber die zeitlichen Proportionen der einzelnen Entwicklungsstadien zueinander blieben von der Temperatur unbeeinflusst. Es gibt viele physiologische Gründe für die gesteigerte Mortalität bei zunehmender Umgebungstemperatur; teilweise sind die Mechanismen noch ungeklärt. Generell beeinflusst die Temperatur die Stoffwechselrate und somit auch den Alterungs‐ prozess (PEARL, 1928; MILLER, 1998). Teil B: Biotische Faktoren 1. Geschlechtspartner 1.1. KOPULATION UND VERPAARUNG In einem zweiten Teil dieser Arbeit wurden die Auswirkungen von Modifikationen biotischer Faktoren auf das Altern von G. viridula Populationen untersucht. Fortpflanzung, also Kopulation und Reproduktion, wirken sich auf die Lebens‐ dauer eines Organismus aus. Oft sind maximale Lebensdauer und Reproduktion negativ miteinander korreliert. Bei einer Vielzahl von Insekten konnte dies beschrie‐ ben werden (AIGAKI und OHBA, 1984; PARTRIGDE et al., 1986; CHAPMAN et al., 1998; GOTOH und TSUCHIYA, 2008). Es gibt aber auch interessante Ausnahmen. So ist trotz Kopulation und regelmäßiger Reproduktion das Lebensalter vieler eusozialer Insekt‐ enköniginnen im Vergleich zu ihren genetisch nah verwandten Schwestern um ein vielfaches erhöht (HEINZE und SCHREMPF, 2008). In diesem Fall scheinen Kopulation und Reproduktion keine Auswirkungen auf den Prozess des Alterns bei den Tieren zu haben. Bei G. viridula zeigten die Ergebnisse einen eindeutigen negativen Effekt der Verpaarung auf die Lebensdauer der Tiere. Männchen und Weibchen, welche verpaart waren, hatten stets eine höhere Mortalitätsrate im Vergleich zu Käfern, die virginell lebten. Die Ursachen einer verkürzten Lebensdauer durch Verpaarungen sind unter anderem, dass sich die Weibchen während einer Kopulation innere und äußere Ver‐ 99 Diskussion letzungen zuziehen. Beispielsweise sind die männlichen Kopulationsorgane der Dungfliege Sepsis cynipsea mit sklerotisierten Dornen besetzt, die bei einer Kopula‐ tion den Genitaltrakt des Weichens schädigen (BLANKENHORN et al., 2002). Mit zunehmender Kopulationsfrequenz werden die weiblichen Genitaltrakte immer stärker beschädigt (EADY et al., 2007). In wieweit sich die Weibchen von G. viridula Schäden der inneren Geschlechtsorgane bei der Kopulation zuziehen, wurde in der vorliegenden Arbeit nicht geklärt. Die Lebensdauer der Weibchen kann aber auch durch äußere Verletzungen während der Kopulation reduziert sein. Bettwanzen haben oft eine extragenitale Befruchtung; dabei sticht das Männchen durch die Kutikula des Weibchens und fügt ihm somit eine äußerliche Verletzung zu. Hier ist ebenfalls die Kopulationshäufigkeit negativ mit der Lebensdauer korreliert (MORROW und ARNQVIST, 2003). Ein weiterer Faktor für eine eventuelle verkürzte Lebensdauer ist die Tatsache, dass mit den Spermien weitere, gegebenenfalls schädliche Substanzen übertragen werden können. Verschiedene Proteine im Ejakulat, aus den akzessorischen Drüsen der Männchen wirkten sich negativ auf die Lebensdauer von Drosophila melanogaster Weibchen aus (WIGBY und CHAPMAN, 2005). Des Weiteren kann sich die Eiproduktion in manchen Fällen ebenfalls negativ auf die Lebensdauer auswirken, da dem Tier hierbei erhebliche energetische Kosten entstehen können. Bei Weibchen des Samenkäfers Callosobruchus maculatus war eine gesteigerte Eiproduktion mit einer verminderten Lebensdauer verknüpft (EADY et al., 2007). Oft halten die Männchen viel länger Kontakt zum Weibchen als es zum Zweck der Befruchtung notwendig wäre. Vielmals werden die Weibchen nach einer Kopulation von den Männchen noch eine Zeit lang bewacht (ALCOCK, 1994). Dies kann Stress und teilweise auch zusätzliche energetische Kosten für das Weibchen bedeuten (WATSON et al., 1998). Sind mehrere Männchen anwesend, wird auch heftig um die Ressource „Weibchen“ gekämpft, was ebenfalls Stress verursacht. G. viridula Männchen versuchen ihre Kon‐ 100 Diskussion kurrenten zu vertreiben, indem sie ihr Gegenüber in die Antennen beißen und dann den Widersacher wegziehen (HILTERHAUS, 1965; pers. Beobacht.). Teilweise kämpfen bis zu vier Männchen auf dem Rücken eines Weibchens. Diese Situation stellt für das Weibchen eine zusätzliche Belastung dar, welche sich negativ auf die Lebensdauer auswirken könnte. An weiblichen Wasserläufern konnte beispielhaft gezeigt werden, dass sowohl der Transport von Männchen auf dem Rücken als auch Aktivitäten zur Abwehr einen erhöhten Energieaufwand für das Weibchen bedeuteten (WATSON et al., 1998). Der Schwerpunkt der meisten Untersuchungen über die Einflüsse der Paarung auf die Lebensdauer liegt eindeutig bei den Weibchen. Dies mag mit der Tatsache zu‐ sammenhängen, dass die Ergebnisse bei den Männchen nicht eindeutig sind. Wie auch bei G. viridula Männchen konnte am Beispiel des männlichen Dungkäfers On‐ thophagus binodis eine verkürzte Lebenserwartung verpaarter Individuen beschrie‐ ben werden (KOTIAHO und SIMMONS, 2003). Andererseits zeigten sich bei der karibischen Fruchtfliege Anastrepha suspensa keinerlei Effekte einer Verpaarung auf die Lebensdauer der Männchen (SIVINSKI, 1993). Dies konnten PEREZ‐STAPLES und ALUJA (2006) an derselben Art nochmals be‐ stätigen. Auch bei den Männchen wäre eine Verkürzung der Lebensdauer durch mechanische Beschädigung des Genitalapparates denkbar. Hinweise hierzu finden sich bei MEIER (2007) an männlichen Totengräbern Nicrophorus vespilloides. Ebenso ist die Produktion von Samenflüssigkeit mit energetischen Kosten verbun‐ den und könnte die Lebensdauer beeinflussen (MARTIN und HOSKEN, 2004). Im Fall von G. viridula wurde in dieser Arbeit nicht die Kopulationshäufigkeit un‐ tersucht, sondern lediglich der Zustand der Verpaarung, also ob die Tiere über ihr ganzes Leben Zugang zu Geschlechtspartnern hatten. 101 Diskussion 1.2. VERPAARUNG UND STOFFWECHSELRATE Die negativen Auswirkungen einer Verpaarung lassen sich bei G. viridula nicht durch eine Erhöhung des Stoffwechsels erklären. Die Ergebnisse zeigten deutlich, dass es zwischen verpaarten und virginellen Tieren keine Unterschiede in der Stoffwech‐ selrate gab. Dies gilt sowohl für Männchen als auch für die Weibchen. Generell lässt sich sagen, dass weibliche Tiere eine höhere Stoffwechselrate aufwiesen. Dies liegt wohl an der täglichen Eiproduktion verpaarter aber auch virgineller Tiere. 1.3. EIABLAGE UND LEBENSDAUER Die Anzahl der Eier die ein G. viridula Weibchen in seiner Lebenszeit produziert hängt direkt von seiner Lebensdauer ab. Dies galt sowohl für verpaarte, virginelle, als auch für verpaarte Tiere unter Freilandbedingungen. Je länger ein Tier lebte, desto mehr Eier wurden produziert. Oft ist dies bei Insekten nicht der Fall; Schmeiß‐ fliegen der Gattung Phormia legten 80% ihrer Eier in den ersten zwei Wochen ihres 4wöchigen Lebens ab (COLLATZ, 1996). Die mittlere Eimenge pro Tag, also die An‐ zahl der Eier, die ein Weichen durchschnittlich am Tag ablegte, blieb immer gleich und änderte sich auch mit fortschreitendem Alter nicht. Dies konnte in allen Ver‐ suchsansätzen, sowohl im Labor als auch im Freiland, beobachtet werden. Auch bei tropischen Blattkäfern der Gattungen Laccoptera und Cassida konnten NAKAMURA et al. (1994) zeigen, dass die täglich von den Käferweibchen abgelegte Menge an Eiern über die gesamte reproduktive Periode hinweg gleich blieb. Ein Vergleich der Eigrößen verpaarter und virgineller Weibchen zeigte, dass es keine Unterschiede in der Größe der abgelegten Eier gab. Es wäre denkbar gewesen, dass virginelle Weibchen zwar Eier produzieren, diese aber in ihrer Größe von be‐ fruchteten Eiern variieren und somit weniger Kosten für das Weibchen entstehen. Die Eiablage als solche ist also kein limitierender Faktor für die Lebensdauer der Weibchen, die Tiere gehen offensichtlich keinen Kompromiss zwischen Eiablage und 102 Diskussion Lebensdauer ein. FOWLER und PARTRIDGE (1989) zeigten denselben Effekt an der Fruchtfliege Ceratitis capitata. Zu gegenteiligen Ergebnissen kamen COLLATZ und WILPS (1985) bei Untersuchungen an der Schmeißfliege Phormia terraenovae. Die Menge an abgelegten Eiern verpaarter Weibchen war doppelt so hoch wie die virgineller Tiere, bei gleichzeitig verkürzter Lebensdauer. REED et al. (2008) beschreiben ein „trade‐off“ zwischen Eiablage und Lebensdauer bei Vögeln. Bei der Trottellumme (Uria aalge) ist eine hohe Eiproduk‐ tion ebenfalls mit einer verminderten Lebensdauer korreliert. Dies entspricht auch den Aussagen der Disposable‐Soma‐Theorie. Wie bereits er‐ wähnt, beschäftigt sich diese Theorie mit der Frage wie die aufgenommenen Energie‐ ressourcen optimal investiert und verteilt werden sollten. In der Abbildung 52 soll dies nochmals grob zusammengefasst werden. begrenzte Ressourcen trade‐offs Außenrisiko hoch Körperinvestition Reproduktions‐ investition Lebensdauer niedrig Körperinvestition Reproduktionsinvestition Lebensdauer r‐ Strategie K‐ Strategie semelpar iteropar Abb.52: „Disposable Soma-Theorie, r-und K-Strategie und Lebensdauer (nach COLLATZ, 1999 B). Bezüglich der Eiablage als Maß für die Reproduktionsleistung konnten die gewon‐ nenen Ergebnisse die Disposable‐Soma‐Theorie bei G. viridula nicht bestätigen. Vorangegangene Untersuchungen zeigten auch, dass die Weibchen nur 10 Prozent ihrer Gesamtenergie (ohne die Kutikula) in die tägliche Eiproduktion investieren 103 Diskussion (PFÄFFLE, 2006). Das tägliche Energiedefizit kann durch die Nahrungsaufnahme leicht ausgeglichen werden, da die Tiere immer Zugang zu ausreichend Nahrung besitzen. Bemerkenswert ist die Tatsache, dass die täglich abgelegte Mengen an Eiern gleich bleibt, und offensichtlich nicht durch Einflüsse der belebten bzw. unbelebten Umwelt lenkbar ist. NAKAMURA et al. (1994) sehen in einer langen reproduktiven Phase, gepaart mit immer verfügbaren Nahrungsressourcen, den Grund für diese konstante Reproduktionsrate. Nach NAKAMURA sollte dies den Tieren weiterhin ermöglichen sich an Habitate anzupassen, welche oft aber unvorhersagbar gestört werden. 1.4. KOPULATION UND LEBENSDAUER Eine Verzögerung der Kopulation sollte weitere Aufschlüsse geben. Die Ergebnisse zeigten, dass eine Kopulationsverzögerung von 25 Tagen keinen Einfluss auf die Lebensdauer der männlichen Tiere hatte. Zum gleichen Ergebnis kam PFÄFFLE (2006). Dass eine Verzögerung des ersten Kopulationszeitpunkts die Lebensdauer männ‐ licher Tiere durchaus Erhöhen kann, zeigte WILKER (2000) an Schmeißfliegen der Gattung Phormia. Im Gegensatz zu den Männchen erhöht eine Verzögerung der Kopulation die Le‐ bensdauer der Weibchen. Diese Gruppe hatte eine höhere Lebensdauer als eine Gruppe, welche schon zu Beginn des Lebens kopulierten. Dies bestätigten auch PARTRIDGE et al. (1986) an Weibchen der Fruchtfliege Drosophila melanogaster. Nach 18 Tagen, in denen die Weichen virginell lebten, wurden Männchen zugesetzt. Allgemein lässt sich sagen, dass ein verminderter Kontakt der Weibchen mit Männ‐ chen die maximale Lebensdauer der weiblichen Tiere erhöhen kann. Bei G. viridula stieg die Mortalitätsrate der Weibchen kurz nach der Verpaarung stark an. Dies zeigt eindeutig den negativen Einfluss einer Kopulation auf die Le‐ bensdauer der Tiere. 104 Diskussion Die Ergebnisse der unterschiedlichen Verpaarungsversuche (1:1 und 1:3) festigen die Annahme, dass der lebensverkürzende Faktor bei einer Paarung die Kopulation selbst ist. Das Geschlechterverhältnis wurde zugunsten der Männchen verschoben, um den negativen Einfluss der Verpaarung besser darstellen zu können. Eine 1 zu 3 Verpaarung zeigte einen deutlichen Einfluss auf beide Geschlechter. Die Lebensdauer war bei den 1:3 verpaarten Gruppen stets erniedrigt. Da eine Verzögerung der Kopulation keinen Einfluss auf die Lebensdauer der Männchen hatte, ist anzunehmen, dass das erhöhte Mortalitätsrisiko bei einer Verschiebung des Geschlechterverhältnisses bei den Männchen hauptsächlich durch Konkurrenzstress bedingt ist. Dieser wurde durch die 1:3 Verpaarung gesteigert. Die Ergebnisse bestätigen die Untersuchungen von AIGAKI und OHBA (1984) an Drosophila virilis. Eine steigende Zahl männlicher Tiere innerhalb der Population, im Verhältnis zu den Weibchen, führte immer zu einer Reduktion der Lebensdauer der Weibchen. Durch eine Erhöhung des Männchenanteils nimmt auch die Frequenz der Kopulationen zu, dies erhöht ebenfalls das Mortalitätsrisiko (MANGAN, 1997; GOTOH und TSUCHIYA, 2008). 2. Nahrung 2.1. INTERMITTIERENDE FÜTTERUNG UND LEBENSDAUER Eine Reduktion der Nahrung bei Erhalt der essentiellen Nahrungsbestandteile, kann wie bei zahlreichen Organismen bekannt die Lebensdauer durchaus verlängern (FINKEL, 2003; PIPER et al., 2005). Es ist nicht unerheblich, auf welche Weise die Re‐ duktion der Nahrung erfolgt. Eine intermittierende Fütterung stellt für den Orga‐ nismus immer eine Hungersituation dar, die Auslöser für massiven physiologischen Stress sein kann. Viele Säuger passen sich an solche Hungerphasen an, indem sie bei einer Fütterung vermehrt Nahrung zu sich nehmen (MERRY, 2005). Um dies zu vermeiden wird in entsprechenden Experimenten Versuchstieren oft täglich kalo‐ rienreduzierte Nahrung verfüttert (MATTISON et al., 2003). 105 Diskussion In der vorliegenden Arbeit wurde eine intermittierende Fütterungsweise gewählt, da nicht die Reduktion der Kalorien im Vordergrund stand, sondern vielmehr eine Stresssituation auf die Tiere erzeugt werden sollte. Sowohl Männchen als auch Weibchen wiesen unter einer solchen Hungerstressphase eine verminderte Lebens‐ dauer im Vergleich zu einer ad libitum gefütterten Population auf. Ein Unterschied der Mortalitätsraten zwischen 24 Stunden oder 48 Stunden, gehungerter Käfer war in beiden Geschlechtern nicht festzustellen. Dass die Tiere einfach nur verhungerten ist un‐wahrscheinlich, da männliche Käfer deutlich mehr fraßen, nachdem sie 24 Stunden hungern mussten (Abb.46). Es scheint vielmehr so zu sein, dass die Tiere durch den Wegfall der Nahrung, welche gleichzeitig ihren Lebensraum darstellt, sehr stark gestört wurden und dies letztendlich zu der verringerten Lebensdauer führte. Diese Stresssituation wird auch dadurch deutlich, dass die Käfer ohne Nahrung eine erhöhte Aktivität aufwiesen. Untersuchungen an der Schmeißfliege Phormia terrae‐novae bestätigen den lebensverkürzenden Effekt einer inter‐ mittierenden Fütterungsweise auf die männlichen Tiere (BRAUN, 2003). Auch hier konnte eine erhöhte Aktivität festgestellt werden. Dass G. viridula mit Ausbleiben der Nahrung eine Diapause einlegt, wie HILTERHAUS (1965) an den Käfern beschreibt, ist auszuschließen, da sich die adulten Käfer nicht mehr in einem für die Diapause sensitiven Stadium ihrer Entwicklung befinden. Ein Grund für den Stress bei einem Ausbleiben der Nahrung ist, wie oben bereits erwähnt der Umstand der Lebensbedingungen von G. viridula. Im Freiland leben die Tiere das ganze Jahr über in einem Nahrungskontinuum, in dem, abgesehen von den Winermonaten, nie Nahrungsmangel auftritt. MASORO und AUSTAD (1996) nehmen an, dass Organismen, welche in einer Umgebung leben, in der kaum oder niemals Nahrungsmangel auftritt, im Laufe der Evolution die Fähigkeit zu einer Reaktion auf Unterernährung verlieren werden. Solche Organismen müssen täglich Nahrung aufnehmen, um ihr Energiedefizit auszugleichen. Eine intermittierende Fütterung 106 Diskussion hat somit keinerlei lebensverlängernde Wirkung auf die Tiere (PARTRIDGE et al., 2005). Auch Organismen, welche die Fähigkeit besitzen, über weite Strecken zu fliegen und damit die Möglichkeit haben, jederzeit ihren Standort zu wechseln, sollten bei Ausbleiben der Nahrung nicht mit einer Verlängerung der Lebenszeit reagieren (LEBOURG und MINOIS, 2005). Dies ist bei G. viridula ohnehin auszuschließen, da die Tiere sehr standorttreu sind. Viel wahrscheinlicher ist, dass durch die hohe Wachs‐ tumsrate der Ampferpflanzen, die Tiere nie gezwungen sind, ihren Standort aus Gründen von Nahrungsmangel zu verlassen. Teil C: Wechselbedingungen im Freiland 1. Freilandbedigungen 1.1. ÜBERLEBENSKURVEN Im dritten Teil der Arbeit wurden die Auswirkungen von Wechselbedingungen auf das Altern von mehreren G. viridula Populationen untersucht. Dazu wurden die Käfer nach ihrem Schlupf ins Freiland überführt. Alle Gruppen waren 1:1 verpaart. Die untersuchten Freilandpopulationen hatten stets eine höhere Lebensdauer als vergleichbare Gruppen im Klimaschrank. ENGEL (1956) beschreibt für G. viridula im Freiland eine ungefähre Lebensdauer von 30 Tagen. Männliche Käfer sterben nach ENGEL meist etwas früher als die Weibchen. Diese Beobachtungen konnten in keiner untersuchten Population bestätigt werden. In allen durchgeführten Experimenten lebten männliche Käfer immer länger als weibliche Tiere. Zwar wurde immer nur die intrinsische Mortalität der Käfer berücksichtigt, aber selbst mit Prädationsdruck ist ein Lebensalter von 30 Tagen unwahrscheinlich. Die Überlebenskurven der im Freiland gehaltenen Tiere sind den Kurven der Käfer, welche bei 15°C im Klimaschrank gepflegt wurden, sehr ähnlich. Dies deckt sich auch mit den aufgenommenen Klimadaten (siehe Anhang); die durchschnittliche 107 Diskussion Temperatur am Versuchsstandort im Freiland lag bis auf einen Monat immer unter 20°C. 1.2. STOFFWECHSELRATE Kühlere Temperaturen bedingen eine geringere Stoffwechselrate. Dies konnte bei den Freilandtieren anhand der gemessenen Menge an produziertem Kohlendioxid bestätigt werden. Die untersuchten Käfer aus den Freilandkäfigen produzierten im‐ mer weniger Kohlendioxid als die Vergleichspopulationen im Klimaschrank. Allem Anschein nach stellt eine konstante Temperatur von 20°C eine Hochsom‐ mersituation für die Tiere dar, zumal es sich bei G. viridula um eine ehemalige alpine Art handelt. Weiterhin wäre aber auch denkbar, dass eine immer gleichbleibende Umgebungstemperatur als „Stressfaktor“ für die Käfer in Frage kommt. 1.3. EIABLAGE UNTER FREILANDBEDIGUNGEN Offenbar hatten die klimatischen Wechselbedingungen keinerlei Einfluss auf die Eiablage (siehe Seite 70). Die Tiere legten im Schnitt 40 Eier pro Tag und unter‐ schieden sich dadurch nicht von Tieren aus dem Klimaschrank. Die hohe Gesamteizahl von durchschnittlich 1400 war ausschließlich auf die erhöhte Lebensdauer der Weibchen unter Freilandbedingungen zurückzuführen. Gegenteiliges berichtet DAVIES (2006) an Schmeißfliegen der Gattungen Calliphora und Lucilia. Wurden die Tiere unter Freilandbedingungen gehalten, konnte eine verminderte Eiproduktion, bei gleichzeitiger Erhöhung der Lebensdauer, festgestellt werden. Dies zeigte sich auch unter Laborbedingungen an der Fliege Phormia (SCHNAITER, 2007). Eine Reduktion der Umgebungstemperatur verringerte die Eiproduktion und erhöhte die Lebensdauer der Tiere. Unter Wechselbedingungen ändern sich auch die Entwicklungszeiten eines Orga‐ nismus. KINGSOLVER und NAGLE (2007) zeigten an dem Schmetterling Manduca sexta, dass Tiere unter Laborbedingungen sich schneller entwickelten und sich mit einer geringeren Körpergröße stark von Tieren aus dem Freiland unterschieden. 108 Diskussion HOFFMANN (1976) zeigte an der Schmeißfliege Phormia, dass sich die Köperzusam‐ mensetzung von Lipiden und Proteinen einer Laborpopulation völlig von der einer Wildpopulation unterscheidet. Er nimmt ferner an, dass es möglich sei, von zwei genetisch unterschiedlichen Formen zu sprechen. Diese wenigen Beispiele machen deutlich, dass ein Vergleich der Entwicklungs‐ und Alterungsvorgänge zwischen Labor und Freiland durchaus problematisch ist. Insbesondere im Hinblick auf die „life‐history“ einer Spezies wird klar, dass ver‐ gleichende Aussagen zur der Biologie des Alterns zwischen Labor‐ und Freiland‐ bedingungen, schwer möglich sind. 109 Diskussion Teil D: Abschließende Betrachtung Im folgendem Schema (Abb.53.) wird versucht, ein Überblick über die Modifizier‐ barkeit der Lebensdauer durch Veränderungen der Umweltparameter zu geben. Gleichzeitig stellt es eine abschließende Betrachtung der gewonnen Ergebnisse dieser Arbeit dar. Bei einer Lichtlänge von 7 Stunden reagiert G. viridula mit Diapauseentwicklung, wenn Eier bzw. Junglarven diesen Bedingungen ausgesetzt werden. Die Entwicklung zum adulten Käfer dauert 30 Tage. Werden allerdings die Puppen bzw. die Imagines diesen Kurztagbedingungen ausgesetzt, sind diese Entwicklungsstadien nicht mehr in der Lage, mit einer Diapauseentwicklung zu reagieren. Käfer unter Kurztagbedingungen nehmen zu Beginn der Diapause Nahrung zu sich. Über den gesamten Lebensabschnitt in Diapause kommt es zu keinen Kopu‐ lationen. Der Stoffwechsel der Tiere ist drastisch reduziert, was anhand der Kohlendioxidproduktion bzw. der spezifischen Aktivitäten einiger Enzyme des Intermediärstoffwechsels deutlich wird. Bei einer Temperatur von 20°C beenden ~30% der Weibchen die Diapause und werden reproduktiv. Der restliche Anteil verbleibt in Diapause und kann ein maximales Lebensalter von 220 Tagen erreichen. Wird während der Diapause die Lichtlänge auf 16 Stunden verlängert, und werden somit Langtagbedingungen induziert, verlassen die Käfer die Diapause und werden reproduktiv. Der Stoffwechsel der Tiere wird innerhalb von 10 Tagen stark angehoben und die Käfer befinden sich wieder im „Langtagprogramm“. Bei einer konstanten Temperatur von 20°C und 16 Lichtstunden ist die gesamte Entwicklung bis zum adulten Käfer in 30 Tagen abgeschlossen. Wird den geschlüpft‐ en Käfern Nahrung angeboten, legen diese einen kurzen Reifefraß ein. Die Weibchen werden dann innerhalb von 10 Tagen reproduktiv. Sind Geschlechtspartner anwe‐ send, beginnen die Tiere dann auch zu kopulieren. Unter diesen Bedingungen, und wenn das Geschlechterverhältnis 1 zu 1 beträgt, werden die Käfer im Schnitt 60 Tage alt. 110 Diskussion Wird das Geschlechterverhältnis zu Gunsten der Männchen auf 1 zu 3 verschoben, erniedrigt sich die durchschnittliche Lebenserwartung sowohl bei Männchen als auch bei den Weibchen. Bleiben die Käfer virginell, verlängert sich die Lebenserwartung im Schnitt auf 90 Tage. Die Weibchen legen über das gesamte Leben unbefruchtete Eier ab. Werden die Käfer nach dem Schlupf alle 24 bzw. 48 Stunden intermittierend gefüttert reduziert dies die Lebenserwartung auf durchschnittlich 40 Tage. In das Schema sind auch noch die Käfer im Freiland miteinbezogen. Sie nehmen natürlich eine Sonderstellung ein, da sie ständigen klimatischen Wechselbedingung‐ en ausgesetzt waren. Werden die Käfer nach ihrer Entwicklung unter konstanten Laborbedingungen ins Freiland überführt, beträgt ihre maximale Lebenserdauer 120 Tage. Im Schema nicht aufgeführt sind die Ergebnisse durch eine Veränderung der Umge‐ bungstemperatur. Es zeigte sich, dass die Lebensdauer negativ mit einer Erhöhung der Temperatur verknüpft ist. 111 Diskussion Abb.53: Das Schema zeigt die Möglichkeiten zur Modifikation des Lebensprogramms durch Veränderungen abiotischer und biotischer Umweltbedingungen von G. viridula bei konstanter Temperatur von 20°C. Die blauen Linien zeigen einen Wechsel der Photoperiode. Rote Linien verdeutlichen die Reaktion eines Wechsels in der Photoperiode. Der rot gestrichelte Pfeil soll die Unmöglichkeit einer Diapauseinduktion im adulten Stadium zeigen. Die mit einem X markierten Wege sind nicht mehr mögliche Reaktionen auf sich verändernde Umweltbedingungen. Die Tage geben jeweils die durchschnittliche maximale Lebensdauer unter den gegebenen Umweltbedienungen an. Die Tiere im Freiland nehmen eine Sonderstellung ein, da es hier nicht möglich ist, abiotische Faktoren zu manipulieren. Diese Käfer wurden gleich nach dem Schlupf ins Freiland überführt, dies soll mit der grünen Linie angedeutet werden. 112 Literatur V. LITERATUR AIGAKI T. und OHBA S. (1984), Effect of mating status on Drosophila virilis lifespan. Experimental Gerontology 19: 267‐278. ALBONETTI T. (2004), Untersuchungen zu Alternsvorgängen während der Diapause des Blattkäfers Gastroidea viridula (De Geer). Diplomarbeit. Universität Freiburg. ALCOCK J. (1994), Postinsemination associations between males and females in insects: The Mate‐Guarding Hypothesis. Annual Review of Entomology 39: 1‐21. BARNES H. und BLACKSTOCK J. (1973), Estimation of lipids in marine animals and tissues: detailed investigation of the sulfophosphovanillin method for a total lipids. Journal of experimental marine biological Ecology 12: 103‐118. BEAN D.W., WANG T., BARTELT R.J. und ZILKOWSKI B.W. (2007), Diapause in the leaf beetle Diorhabda elongata (Coleoptera: Chrysomelidae), a biological control agent for tamarisk (Tamarix spp.). Environmental Entomology 36 (3): 531‐540. BERGMEYER H.U., GAWEHN K. und GRAßL M. (1974), Methoden der enzymatischen Analyse, Hrsg. Bergmeyer, Weinheim/Bergstr.: Verlag Chemie. BERGMEYER H.U. (1983), Methods of Enzymatic Analysis. Vol. I Fundamentals 284‐286. BLANCKENHORN W.U., HOSKEN D.J., MARTIN O.Y., REIM C., TEUSCHL Y. und WARD P.I. (2002), The cost of copulating in the dung fly Sepsis cynipsea. Behavioral Ecology 13: 353‐358. BLETHEN S. (1970), Argininkinase. In: Methods in Enzymology XVII, Hrsg. Kaplan, R. 330‐335, New York: Academic Press. BONFERRONI C. (1936), Theoria statistica classi e calcolo delle probabilità. Pub R Super Sci Econ Comm Fierenze 8: 1‐62. BRADFORD M.M. (1976), A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein‐Dye Binding. Analytical Biochemistry 72: 248‐254. BRAUN T., (2003), Versuche zur kalorischen Restriktion an der Schmeißfliege Phormia terraenovae (Robineau‐Desvoidy). Diplomarbeit Universität Freiburg. 113 Literatur BRAZZEL J.R. und NEWSOM L.D. (1959), Diapause in Anthonomus grandis. Journal of Economic Entomology 52: 603‐611. BROOKS S.P.J. und STOREY K.B. (1997), Glycolytic Controls in Estivation and Anoxia: A Comparsion of Metabolic Arrest in Land and Marine Molluscs. Comparative Biochemistry and Physiology 118A: 1103‐1114. BÜRGER M. (1960), Altern und Krankheit als Problem der Biomorphose. Leipzig. CARVALHO A.R., BUENO V.H.P., PEDROSO E.C., KON L.I., DINIZ A.J.F. und SILVA R.J. (2006), Influence of Photoperiod on Orius thyestes Herring (Hemiptera: Antho‐ coridae) Reproduction and Longevity. Neotropical Entomology 35(4): 489‐492. CHAPMAN T., MIYATAKE T., SMITH H.K. und PARTRIDGE L. (1998), Cost of mating in Drosophila melanogaster females is mediated by male accessory gland products. Nature 373: 241‐244. CHAPMAN T. (2006), Evolutionary Conflicts of Interest between Males and Females. Current Biology 16: 744‐754. CHAPMAN T., ARNQVIST, G., BANGHAM, J. und ROWE, L. (2003), Sexual conflict. Trends in Ecology and Evolution 18: 41‐47. COLLATZ K.‐G. und WILPS H. (1983), Altern bei Insekten, Naturwissenschaftliche Rundschau 36: 57‐63. COLLATZ K.‐G. und WILPS H. (1985), The quantitative relationship between life span, food ingestion, egg production, mating, and flight activity of protein‐fed blowfly Phormia terraenovae females. Experimental Gerontology 20: 247‐357. COLLATZ K.‐G. (1986), Fortpflanzung – Altern – Lebensdauer. Eine vergleichende bio‐ logiche Analyse. Zoologische Jahrbücher für Systematik 113: 293‐305. COLLATZ K.‐G. (1996), Altern und Entwicklung. In: Kompendium der Gerontologie 3.Erg. Lfg. 1/1996. COLLATZ K.‐G. (1999 A), Altern. Lexikon der Biologie, Band 1. Spektrum Akade‐ mischer Verlag Heidelberg, pp.232‐242. COLLATZ K.‐G. (1999 B), Fortpflanzung, Altern und Lebensdauer als genetisch fixierte Zyklen. Nova Acta Leopoldina 314: 291‐311. COLLATZ K.‐G. (2003), Aging and environmental conditions in Insects. Osiewacz (ed.) Aging of Organism. Kluwer Academic Publishers. 114 Literatur COMFORT A. (1979), The Biology of Senescence. 3d ed. Edinburgh and London: Chur‐ chill Livingstone. CONNIN R.V. und HOOPINGARNER R.A. (1971), Sexual behaviour and diapause in the cereal leaf beetle, Oulemna melanopus. Annals of the Entomological Society of America 64: 655‐660. DANKS H.V. (1987), Insect dormancy: an ecological perspective. Biological Survey of Canada Monograph Series No.1. DAVIES L. (2006), Lifetime reproductive output of Calliphora vicina and Lucilia sericata in outdoor caged and field populations; flight vs. egg production? Medical and Veterinary Entomology 20(4): 453‐458. DENLINGER D.L. (1985), Hormonal control of diapause. Comparative Insect physio‐ logy, biochemistry and pharmacology. 8: 353‐412. DENLINGER D.L. (2002), Regulation of Diapause. Annual Review of Entomology 47: 93‐122. DE WILDE J. (1969), Diapause and seasonal synchronization in the adult Colorado beetle. Symposium of the Society of Experimental Biology 23: Dormancy and Survival. Cambridge University Press, Cambridge UK. 263‐284. DING L., YIPING L. und GOTO M. (2003), Physiological and biochemical changes in summer and winter diapause and non‐diapause pupae of the cabbage armyworm Mamestra brassicae L. during long‐term cold acclimation. Journal of Insect Physio‐ logy 49: 1153‐1159. DUNLAP‐PIANKA H., BOGGS C.L. und GILBERT L.E. (1977) Ovarian dynamics in helico‐ niine butterflies: Programmed senescence versus eternal youth. Science 197: 487‐ 490. EADY P.E., HAMILTON L. und LYONS R.E. (2007), Copulation, genital damage and early death in Callosobruchus maculatus. Proceedings of the Royal Society B 274: 247‐252. EL‐HALIM A.S.A. (2004), The influence of temperature and feeding on development, adult longevity and larviposition of Parasarcophaga hirtipes Wiedemann (Diptera: Sarcophagidae). Journal of the Egyptian Society of Parasitology 34: 239‐254. ENGEL H. (1956), Beiträge zur Lebensweise des Ampferblattkäfers (Gastrophysa viridu‐ la Deg.). Zeitschrift für Angewandte Entomologie. 38: 322‐354. FINKEL T. (2003), A toast to long life. Nature 425: 132‐133. 115 Literatur FOWLER K. und PARTRIDGE L. (1989), A cost of mating in female fruitflies. Nature 338: 760‐761. FRANCK, P. (1935), Zur Verbreitung von Gastroidea viridula Deg. in Deutschland in älterer und neuerer Zeit. Entomologische Blätter 29: 51‐55. FUJITA K., SHIMOMURA K., YAMAMOTO K., YAMASHITA T. und SUZUKI K. (2006), A chitinase structurally related to the glycoside hydrolase family 48 is indispensable for the hormonally induced diapause termination in a beetle. Biochemical and Biophysical Research Communications 345(1): 502‐507. FUZEAU‐BRAESCH S. (1965), Analyse de la croissance d ´un insecte a diapause obliga‐ toire post‐embryonnaire: influence de la photoperiode et de la temperature sur les stades qui precedent la diapause. (Gryllus campestris L Orth Gryl.) Proc XII International Congress of Entomology. London. 1968‐1969. GOTOH T. und TSUCHIYA A. (2008), Effect of multiple mating on reproduction and longevity of the phytoseiid mite Neoseiulus californicus. Experimental and Applied Acarology 44(3): 185‐197. GRAVES J.L. und MUELLER L.D. (1993), Population density effects on longevity. Genetica 91: 99‐109. HAHN D.A. und DENLINGER D.L. (2007), Meeting the energetic demands of insect diapause: Nutrient storage and utilization. Journal of Insect Physiology 53(8): 760‐773. HATCHER P.E., PAUL N.D., AYRES P.G. und WHITTAKER J.B. (1994), Interactions between Rumex spp., herbivores and a rust fungus: Gastrophysa viridula grazing reduces subsequent infection by Uromyces rumicis. Functional Ecology 8: 265‐272. HAYFLICK L. (1998), How and why we Age. Experimental Gerontology 33: 639‐653. HEINZE J. und SCHREMPF A. (2008), Aging and Reproduction in Social Insects – A Mini Review. Gerontology 54: 160‐167. HENNEGUY L.F. (1955), Les Insects. Morphologie, reproduction, embryogénie. Paris. HILTERHAUS V. (1965), Biologisch‐ökologische Untersuchungen an Blattkäfern der Gattungen Lema und Gastroidea (Chrysomelidae, Col.). Zeitschrift für Angewandte. Zoologie 52: 257‐295. 116 Literatur HODEK I. (1983), Role of environmental factors and endogenous mechanisms in the seasonality of reproduction in insect diapausing as adults. In: Brown, V.K. und Hodek, I. (eds.). Diapause and life cycle strategies in insects. Dr W. Junk Publi‐ shers, The Hague/Boston/London: 9‐33. HOFFMANN K.H. (1976), Organic Body Constituents of Protophormia terraenovae (Dipt.) from Spitsbergen Compared with Flies from a Loboratory Stock. Oecologia (Berl.) 23: 13‐16. HONEK A., JAROSIK V. und MARTINKOVA Z. (2003), Effect of temperature on development and reproduction in Gastrophysa viridula (Coleoptera: Chrysome‐ lidae). European Journal of Entomology 100: 295‐300. HOUTHOOFD K., BRAECKMAN B.P., LENAERTS I., BRYS K., DE VREESE A., VAN EYGEN S. und VANFLETEREN (2002), Ageing is reserved, and metabolism is reset to young levels in recovering dauer larvae of C. elegans. Experimental Gerontology 37: 1015‐ 1021. HUGHES K.A., ALIPAZ J.A., DRNEVICH J.M. und REYNOLDS R.M. (2002), A test of evolutionary theories of aging. Proceedings of the National Academy of Science USA 99: 14286‐14291. ICHIMORI T., SUSUKI K. und KURIHARA M. (1987), Sexual difference in the termination of adult diapause of the leaf beetle, Gastrophysa atrocyanea, Motschulsky (Coleo‐ ptera: Chrysomelidae). Applied Entomology and Zoology 22: 107‐109. ICHIMORI T., OHTOMO R., SUSUKI K. und KURIHARA M. (1990), Specific protein related to adult diapause in the leaf beetle, Gastrophysa atrocyanea. Journal of Insect Phy‐ siology. 36:85‐91. JOHNSON T.E., MITCHELL D.H., KLINE S., KEMAL R. und FOY J. (1984), Arresting deve‐ lopment arrests aging in the nematode Caenorhabditis elegans. Mechanisms of Ageing and Development 28: 23‐40. JOLIVET P. (1951), Contribution a l`Etude du genre Gastrophysa. Chevrolat Inst Royal d sc nat. de Belgique, Bruxelles, XXVII, Nr.9, 1‐11, Nr.13, 1‐12, Nr.21, 1‐47. JUDENKO (1943), Bemerkungen über die Biologie und die Bekämpfung des Grünen Dickbauchs (Gastroidea viridula Deg.) Berichte Pullary, I: 177‐198. KINGSOLVER J.G. und NAGLE A. (2007), Evolutionary Divergence in Thermal Sensitivity and Diapause of Field and Laboratory Populations of Manduca sexta. Physiological and Biochemical Zoology 80(5): 473‐479. 117 Literatur KIRKWOOD T.B.L. (1977), Evolution of aging. Nature 270: 301‐304. KIRKWOOD T.B.L. und HOLLIDAY R. (1979), The evolution of aging and longevity. Proceedings of the Royal Society London Series B 205: 531‐546. KIRKWOOD T.B.L. und ROSE M.R. (1991), Evolution of senescense: late survival sacri‐ ficed for reproduction, Philosophical Transactions of the Royal Society London B 332: 15‐24. KÖHLER W., SCHACHTEL G. und VOLESKE P. (2002), Biostatistik. 3.Auflage, Springer Verlag, Berlin‐Heidelberg. KOTIAHO J.S., ALATALO R.V., MAPPERS J., NIELSEN M.G., PARRI S. und RIVERO A. (1998), Energetic costs of size and sexual signalling in a wolf spider. Proceedings of the Royal Society London Series B 265: 2203‐2209. KOTIAHO J.S. und SIMMONS L.W. (2003), Longevity cost of reproduction for males but no longevity cost of mating or courtship for females in the male‐dimorphic dung beetle Onthophagus binodis. Journal of Insect Physiology. 49: 817‐822. LAMB M.J. (1977), Biology of Ageing. Glasgow: Blackie & Son. LE BOURG E. (2005), Calorie restriction to retard aging and increase longevity. Presse medicale 34: 121‐127. LEES A.D. (1955), The physiology of diapause in Arthropods. Cambridge Mono‐ graphs in experimental biology. LERMAN J.C. und CIGLIANO E.M. (1971), New carbon‐14 evidence for six hundred years old Canna compacta seed. Nature 252: 568‐570. LI Y.P., GOTO M. und TSUMUKI H. (2002 A), Diapause development and acclimation regulating enzymes associated with glycerol synthesis in the Shonai ecotype of the rice stem borer larva, Chilo suppressalis Walker. Journal of Insect Physiology 48 (3): 303‐310. LI Y.P., DING L. und GOTO M. (2002 B), Seasonal changes in glycerol content and enzyme activities in overwintering larvae of the Shonai ecotype of the rice stem borer, Chilo suppressalis Walker. Archives of Insect Biochemistry and Physiology 50(2): 53‐61. LINDEMUTH K. (1949), Massenauftreten von Käfern in den letzten Jahren in der Provinz Schleswig‐Holstein. Entomologische Blätter 113: 41‐44. 118 Literatur LOEB J.und NORTHROP J.H. (1917), On the influence of food and temperature upon the duration of life. Journal of Biological Chemistry 32: 103‐121. MARGULIS L. und SCHWARTZ K.V. (1988), Five Kingdoms. 2d ed. New York: W.H. Freeman. MARTIN O.Y. und HOSKEN D.J. (2004), Copulation reduces male but not female longevity in Saltella sphondylli (Diptera: Sepsidae). Journal of Evolutionary Biology 17: 357‐362. MARTINEZ D.E. (1997), Mortality patterns suggest lack of senescence in hydra. Experimental Gerontology 33: 217‐225. MASORO E.J. und AUSTAD S.N. (1996), The evolution of the antiaging action of dietary restriction: a Hypothesis. The Journals of Gerontology, Series A. Biological Science and medical science. 51: 387‐391. MATTISON J.A., LANE M.A., ROTH G.S. und INGRAM D.K. (2003), Caloric restriction in rhesus monkeys. Experimental Gerontology 38: 35‐46. MEDAWAR P.B. (1952), An unsolved problem of biology. Lewis, London. MEDVEDEV Z.A. (1990), An attempt at a rational classification of theories of aging. Biological Reviews 65: 375‐398. MEIER T. (2007), Einfluss von Paarung und Fortpflanzung auf die Lebensdauer des Totengräbers Nicrophorus vespilloides Herbst (Coleoptera: Silphidae). Diplomarbeit. Universität Freiburg. MERRY B.J. (2005), Dietary restriction in rodents‐delayed or retarded ageing? Mecha‐ nisms of Ageing and Development 126: 951‐959. MILLER R.A. (1998), The biology of ageing and longevity. In: Hazzard W.R., Blass J.P., Ettinger W.H.Jr., Halter J. und Ouslander J.G. (ed.) Principles of geriatric medicine and gerontology, McGraw‐Hill, pp 3‐19. MIRONIDIS G.K. und SAVOPOULOU‐SOULTANI M. (2008), Development, Survivorship, and Reproduction of Helicoverpa armigera (Lepidoptera: Noctuidae) under Constant and Alternating Temperatures. Environmental Entomology 37(1): 16‐28. MORROW E.H. und ARNQVIST G. (2003), Costly traumatic insemination and a female counter‐adaptation in bed bugs. Proceedings of the Royal Society of London B 270: 2377‐2381. 119 Literatur MÜLLER H.J. (1965), Probleme der Insektendiapause. Verhandlungen der Deutschen Zoologischen Gesellschaft. Jena 1965 : 192‐222. MÜLLER H.J. (1966), Über die Ursachen der unterschiedlichen Resistenz von Vica faba L. gegenüber der Bohnenlaus Aphis fabae Scop.IX. Der Einfluss ökologischer Faktoren auf das Wachstum von Aphis fabae Scop. Entomologia Experimentalis et Applicata 9:42‐66. MÜLLER H.J. (1970), Formen der Dormanz bei Insekten. Nova Acta Leopoldina 35: 7‐27. MÜLLER H.J. (1976), Formen der Dormanz bei Insekten als Mechanismen öko‐ logischer Anpassung. Verhandlungen der Deutschen Zoologischen Gesellschaft 1976: 46‐52. MUSOLIN D.L. und NUMATA H. (2003), Photoperiodic and temperature control of diapause induction and colour change in the southern green stink bug Nezara viridula. Physiological Entomology 28 (2): 65. NAKAMURA K., NOERDJITO W.A. und ASWARI P. (1994), Life table parameters of Indonesian tortoise beetles under laboratory conditions. In: Jolivet, P.H., Cox, M.L. und Petitpierre, E. (eds.), Novel aspects of the biology of Chrysomelidae. Kluwer Academic Publishers: 573‐578. NISIMURA T., KON M. und NUMATA H. (2002), Bimodal life cycle of the burying beetle Nicrophorus quadripunctatus in relation to reproductive diapause. Ecological Entomology 27 (2):220. NIVA C.C. und TAKEDA M. (2003), Effects of photoperiod, temperature and melatonin on nymphal development, polyphenism and reproduction in Hylyomorpha halys. Zoological Science 20: (8) 963‐970. NORRIS M.J. (1965), Reproduction of the grasshopper Anacridium aegyptium L. in the laboratory. Proceedings of the Royal Entomological Society of London (A) 40: 19‐29. OCHS G. (1920), Kleine coleopterologische Mitteilungen. Entomologische Blätter 15: 128. PARTRIDGE L., FOWLER K., TREVITT S. und SHARP W. (1986), An examination of the effect of males on the survival and egg‐production rates of female Drosophila melanogaster. Journal of Insect Physiology 32: 925‐929. PARTRIDGE L., GREEN A. und FOWLER K. (1987), Effects of egg‐production and of exposure to males on female survival in Drosophila melanogaster. Journal of Insect Physiology 33: 745‐749. 120 Literatur PARTRIDGE L., PIPER M.D.W. und MAIR W. (2005), Dietary restriction in Drosophila me‐ lanogaster. Mechanisms of Ageing and Development 126: 938‐950. PEARL R. (1928), The rate of living. Knopf, New York. PENER M.P. (1992), Environnemental cues, Endocrine factors and reproductive dia‐ pause in male insects. Chronobiology International 9 (2): 102‐113. PENER M.P. (2000), A male view on reproductive diapause, or coadaptation of male reproductive strategies to diapause in female insects. Reproductive and develop‐ ment Symposium and Poster Session, Abstract Book II, XXI International Congress of Entomology, Brazil. PEREZ‐STAPLES D. und ALUJA M. (2006), Sperm allocation and cost of mating in a tropical tephritid fruit fly. Journal of Insect Physiology. 52(8): 839‐845. PFÄFFLE M. (2006), Fertilität, Energiebilanz und Lebensdauer beim Ampferblattkäfer Gastrophysa viridula (DeGeer). Diplomarbeit Universität Freiburg. PFLUNGENFELDER O. (1958), Entwicklungsbiologie der Insekten. Akademische Ver‐ lagsgesellschaft, 54‐66. PIANKA E.R. (1970), On r‐and K‐Selection. The American Naturalist 104:592‐597. PIELOOR M.J. und SEYMOUR J.E. (2001), Factors affecting adult diapause initiation in the tropical butterfly Hypolimnas bolina L. (Lepidoptera: Nymphalidae). Australian Journal of Entomology 40: 376‐379. PIPER M.D.W., MAIR W. und PARTRIDGE L. (2005), Counting the calories: The role of specific nutrients in extension of life span by food restriction. Journal of Geronto‐ logy 60: 549‐555. POLANSKA M.A., CIUK M.A., CYMBOROWSKI B. und BEBAS P. (2005), Germ cell death in the testis and its relation to spermatogenesis in the wax moth, Galleria mellonella (Lepipotera: Pyralidae), effects of facultative diapause. Journal of Experimental Zoology A 303 (11): 1013‐1029. REED T.E., KRUUK L.E., WANLESS S., FREDERIKSEN M., CUNNINGHAM E.J. und HARRIS M.P. (2008), Reproductive senescence in a long‐lived seabird: rates of decline in latelife performance are associated with varying costs of early reproduction. American Naturalist 171(2): 89‐101. 121 Literatur REITTER F. (1912), Fauna Germanica. Die Käfer des Deutschen Reiches. Vol. IV, 125 Verlag Lutz, Stuttgart. REMAUDIERE G. (1948), Ethologie de Gastroidea viridula. Rev Path veget. 27: 38‐53. RENNER K. (1970), Die Zucht von Gastroidea viridula Deg. (Col., Chrysomelidae) auf Blättern und Blattpulversubstraten von Rumex obtusifolius L. Zeitschrift für An‐ gewandte Entomologie 65: 131‐146. SACHS L. (1999), Angewandte Statistik. 9.Auflage Berlin: Springer Verlag. SAUER K.P. (1977), Die adaptive Bedeutung der genetischen Variabilität der photo‐ periodischen Reaktion von Panorpa vulgaris (Mecoptera, Panorpidae). Zoologische Jahrbücher Systematik 104: 489‐538. SAUER K.P. (1980), Klinale Unterschiede in der genetischen Variabilität der photope‐ riodischen Reaktion von Panorpa vulgaris (Mecoptera). Zoologische Jahrbücher Systematik 107: 113‐147. SAUNDERS D.S. (1997), Insect circadian rhythms and photoperiodism. Invert Neuro‐ science 3: (2‐3) 155.164. SAUNDERS D.S. und CYMBOROWSKI B. (2003), Selection for high diapause incidence in blow flies (Calliphora vicina) maintained under long days increases the maternal critical daylength: some consequences for the photoperiodic clock. Journal of Insect Physiology 49: 777‐784. SCHNAITER D. (2007), Einfluss verschiedener Haltungstemperaturen auf die Abfolge und Proportionalität physiologischer Parameter im Altersverlauf der Fliege Phormia terraenovae. Diplomarbeit Universität Freiburg. SENANAYAKE D., RADCLIFFE E.B. und HOLLIDAY N.J. (2000), Oviposition and Diapause behaviour in Colorado potato beetle. Populations from East central Minnesota and the valley of the red river of the North. Environmental Entomology 29: (6) 1123‐ 1132. SEPULVEDA S., SHOJAEIAN P., RAUSER C.L., JAFARI M., MUELLER L.D. und ROSE M.R. (2008), Interactions between injury, stress resistance, reproduction, and aging in Drosophila melanogaster. Experimental Gerontology 43(3): 136‐145. SHEEBA V., SHARMA V.K., SHUBHA K., CHANDRASHEKARAN M.K. und JOSHI A. (2000), The effect of different light regimes on adult life span in Drosophila melanogaster is partly mediated through reproductive output. Journal of Biological Rhythms 15: 380‐392. 122 Literatur SIVINSKI J.M. (1993), Longevity and fecundity in the caribbean fruit fly (Diptera: Tephritidae): Effects of mating, strain and body size. Florida Entomologist 76: 635‐ 644. SPIETH H. (1985), Die Anpassung des Entwicklungszykluses an unterschiedlich lange Vegetationsperioden beim Wanderfalter Pieris brassicae L. (Lepidoptera: Piridae). Zoologische Jahrbücher Systematik 112: 35‐69. STEARNS S.C. (1992), The Evolution of Life Histories. Oxford University Press. STOREY J.M. und STOREY K.B. (1981), Biochemical strategies of overwintering in the gall fly, Eurosta solidaginis: effect of low temperature acclimation on the activities of enzymes of intermediary metabolism. Journal of Comparative Physiology 144: 191‐199. STOREY K.B. (1987), Regulation of liver metabolism by enzyme phosphorylation du‐ ring mammalian hibernation. Journal of Biological Chemistry 262: 1670‐1673. STOREY K.B. (2002), Life in slow lane: molecular mechanisms of estivation. Comparative Biochemistry and Physiology 133A: 733‐754. TANNER W. (1999), Altern und Tod – “Der Tod der Individuen ist eine Bedingung der Evolution“ Jahrhundert Wissenschaft Biologie. Verlag C.H. Beck. München. TATAR M. und YIN C.M. (2001), Slow aging during insect redroductive diapause: why butterflies, grasshoppers and flies are like worms. Experimental Gerontology 36: 723‐738. TAUBER M.J., TAUBER C.A. und MASAKI S. (1986), Seasonal Adaptations of insects. Oxford University Press, New York. TEOFILOVIC Z.M. (1969), Contribution to the study on morphology and development of cereal leaf beetles (Oulema melanopus) and influence of the ecological factors on its life activity. Rev Res Works Inst. Small Grains Kragujevac Edit. IV: 29‐124. TEUSCHL Y., HOSKEN D.J. und BLANCKENHORN W.U. (2007), Is reduced female survival after mating a by‐product of male‐male competition in the dung fly Sepsis cynipsea? Evolutionary Biology 7: 194. TOMBES A.S. (1964), Structural changes in the reproductive organs of the alfalfa weevil. Annals of the Entomological Society of America 57: 422‐426. 123 Literatur TRUDEL R., LAVALLEE R., BAUCE E. und GUERTIN C. (2002), The effect of cold temp‐ erature exposure and long‐ day photoperiod in the termination of the reproductive diapause of newly emerged female Pissodes strobe (Col.: Curculioni‐ dae). Agricultural and Forest Entomology 4(4): 301. TSUJI H. (1963), Experimental studies on the larval diapause of the Indian meal moth, Plodia inerpunctella Hübner (Lepidoptera: Pyralidae). Tokyo: 1‐88. UGINE T.A., SANDERSON J.P. und WRAIGHT S.P. (2007), Development times and life tables for shore flies, Scatella tenuicosta (Diptera: Ephydidae), at three tempera‐ tures. Environmental Entomology 36(5): 989‐997. VALENZANO D.R., TERZIBASI E., CATTANEO A., DOMENICI L., CELLERINO A. (2006), Temperature affects longevity and age‐related locomotor and cognitive decay in the short‐lived fish Nothobranchius furzeri. Aging Cell 5: 275‐278. VAN VOORHIES W.A. und WARD S. (1999), Genetic an environmental conditions that increase longevity in Caenorhabditis elegans decrease metabolic rate. Proceedings of the National Academy of Science 96: 11399‐11403. WATANABE M. und TANAKA K. (2000), Hormonal control of diapause and over‐ wintering traits in a leaf beetle, Aulacophora nigripennis. Physiological Entomology 25 (4): 337‐345. WATSON P.J., ARNQVIST G. und STALLMANN R.R. (1998), Sexual conflict and the energetic costs of mating and mate choice in water striders. American Naturalist 151: 46‐58. WEISMANN A. (1891), Essays Upon Heredity and Kindred Biological Problems, Vol.1, second ed. Clarendon Press, Oxford. WEISMANN A. (1882), Über die Dauer des Lebens, Verlag Gustav Fischer, Jena. WHEELER W.M. (1893), A contribution to insect embryology. Journal of Morphology. 8. WIGBY S. und CHAPMAN T. (2005), Sex Peptide Causes Mating Costs in Female Drosophila melanogaster. Current Biology 15: 316‐321. WILLIAMS G.C. (1957), Pleiotropy, natural selection and the evolution of senescence. Evolution 11: 398‐411. WILKER L. (2000), Modifikation des Lebensprogrammes der Fliege Phormia terrae‐ novae durch Proteinverfügbarkeit und Reproduktion. Diplomarbeit. Universität Freiburg. 124 Literatur WINSTON M.L. (1987), The Biology of the Honey Bee. Cambridge, MA: Harvard Univ Press. XUE F., SPIETH H.R., AIQING L. und AI, H. (2002), The role of photoperiod and temperature in determination of summer and winter diapause in the cabbage beetle, Colaphellus bowringi (Coleoptera: Chrysomelidae). Journal of Insect Physio‐ logy 48(3): 279‐286. YAMASHITA O. (1996), Diapause hormone of the silkworm Bombyx mori: structure, gene expression and function. Journal of Insect Physiology 42: 669‐679. ZANNOU E.T., GLITHO I.A., HUIGNARD J. und MONGE J.P. (2003), Life history of flight morph females of Callosobruchus maculatus F: evidence of a reproductive diapause. Journal of Insect Physiology 49: 575‐582. ZIEGLER A., LANGE S. und BENDER R. (2004), Überlebenszeitanalyse: Der Log‐Rang‐ Test. Deutsche Medizinische Wochenschrift 129: T4‐T6. ZIEGLER R., ASHIDA M., FALLON A.M., WIMER L.T., WYATT S.S. und WYATT G.R. (1979) Regulation of glycogen phosphorylase in fat body of Cercopia silkmoth pupae. Journal of Comparative Physiology 131: 321‐332. 125 Anhang ANHANG Lösungen Lösungen für die Pyruvatkinase‐Bestimmung Alle Lösungen wurden mit bidestilliertem Wasser hergestellt. TRA‐Puffer (pH 7,6) 100 mM MgSO4 360 mM KCl 300 mM Lactatdehydrogenase 300 U/mg (fertige Suspension) Phosphoenolpyruvat 32 mM ADP 16 mM NADH+H+ 12 mM Lösungen für die Phosphorylase‐Bestimmung Alle Lösungen wurden mit bidestilliertem Wasser hergestellt. Phosphatpuffer (100 mM, pH 6,8) 8,71g K2HPO4 + 6,8g KH2PO4 ad 500ml Aqua bidest. Imidazol 300 mM Mercaptoethanol 40 mM EDTA 60 mM NaF 600 mM Mg‐Acetat 300 mM Glykogen 40mg/ml Glucose‐1,6‐biphosphat 1mg/ml NADP 36 mM G‐6‐PDH‐Suspension 1:3 in Phosphatpuffer PGM‐Suspension 1:30 in Phosphatpuffer AMP 180 mM 126 Anhang Lösungen für die Phosphofructokinase‐Bestimmung Alle Lösungen wurden mit bidestilliertem Wasser hergestellt. Tris‐Puffer (100 mM, pH 8,5) 100 mM MgSo4 320 mM KCl 750 mM Phosphoenolpyruvat 40 mM Fructose‐6‐phosphat 150 mM Fructose‐1,6‐dipdhosphat 80 mM ATP 150 mM NADH+H+ 12 mM Pyruvatkinase 200U/mg (fertige Suspension) Dithiothreiol 1 mM Lösungen für die Argininphosphokinase‐Bestimmung Alle Lösungen wurden mit bidestilliertem Wasser hergestellt. Homogenatpuffer (pH 7,5) TRA (100 mM) 9,28g + EDTA (10 mM) 1,86g ad 500 ml Aqua bidest. TRA‐Puffer (pH 8,6) 720 mM MgSO4 320 mM KCl 750 mM L‐Arginin 80 mM Lactatdehydrogenase 300 U/mg (fertige Suspension) Pyruvatkinase 200U/mg (fertige Suspension) Phosphoenolpyruvat 40 mM ATP 150 mM NADH+H+ 15 mM 127 Anhang Lösungen für die Protein‐Bestimmung nach BRADFORD (1976) Coomassiereagenz: BSA‐Stammlösung fertige BRADFORD‐Lösung der Firma Sigma‐Aldrich. 0,2% (2 mg Bovines Serum Albumin ad 10 ml Aqua bidest.). Lösungen für die Gesamtlipid‐Bestimmung Phospho‐Vanillin‐Reagenz 0,2 g Vanillin ad 20 ml Aqua bidet. (bei 40°C lösen) ad 80 ml 85 % O‐Phosphorsäure Methanol Hexan Chloroform Schwefelsäure konz. 128 Anhang Klimadaten 2004‐2005 Klimadaten 2004 25 mittlere Temperatur (°C) 2004 21,1 19,4 20 17,9 15,5 16,3 15 13,6 12,8 10 6,7 5 0 April Mai Juni Juli August September Oktober November Abb.54: Mittlere Temperaturen der Monate April bis November 2005 am Standtort der Freilandversuche. mittlere rel. Luftfeuchte (%) 2004 100 93,5 86,3 80 74,5 77,9 79,7 Juni Juli 92,0 89,9 69,4 60 40 20 0 April Mai August September Oktober November Abb.55: Mittlere Luftfeuchte der Monate April bis November 2005 am Standtort der Freilandversuche. 129 Anhang Klimadaten 2005 25 mittlere Temperatur (°C) 2005 21,0 19,2 20 20,1 15,4 14,1 15 13,5 10,8 10 7,2 5 0 April Mai Juni Juli August September Oktober November Abb.56: Mittlere Temperaturen der Monate April bis November 2005 am Standtort der Freilandversuche. 100 mittlere rel. Luftfeuchte (%) 2005 88,3 81,7 80 76,8 89,6 93,5 84,7 76,5 67,9 60 40 20 0 April Mai Juni Juli August September Oktober November Abb.57: Mittlere Luftfeuchte der Monate April bis November 2005 am Standtort der Freilandversuche. 130 Anhang Altersspezifische Mortalitätsraten (qx) Diapause alterspezifische Mortalitätsrate 1 0,8 0,6 Männchen DP Weibchen DP 0,4 0,2 0 0 50 100 150 200 250 Lebensalter [d] Abb.58: Alterspezifische Mortalitätsraten männlicher und weiblicher Käfer in Diapause. Bruch der Diapause altersspezifische Mortalitätsrate 1 0,8 0,6 Männchen Weibchen 0,4 0,2 0 0 20 40 60 80 100 120 140 Lebensalter [d] Abb.59: Alterspezifische Mortalitätsraten männlicher und weiblicher Käfer, deren Diapause nach 60 Tagen gebrochen wurde. 131 Anhang altersspezifische Mortalitätsrate 1 0,8 0,6 Männchen Weibchen 0,4 0,2 0 0 20 40 60 80 100 120 140 160 180 200 Lebensalter [d] Abb.60: Alterspezifische Mortalitätsraten männlicher und weiblicher Käfer, deren Diapause nach 120 Tagen gebrochen wurde. Unterschiedliche Haltungstemperaturen altersspezifische Mortalitätsrate 1 0,8 0,6 Männchen 20°C Männchen 25°C Männchen 15°C 0,4 0,2 0 0 20 40 60 80 100 120 140 Lebensalter [d] Abb.61: Altersspezifische Mortalitätsraten männlicher Käfer, welche bei unterschiedlichen Temperaturen gehalten wurden. 132 Anhang altersspezifische Mortalitätsrate 1 0,8 0,6 Weibchen 20°C Weibchen 25°C Weibchen 15°C 0,4 0,2 0 0 20 40 60 80 100 120 140 Lebensalter [d] Abb.62: Altersspezifische Mortalitätsraten weiblicher Käfer, welche bei unterschiedlichen Temperaturen gehalten wurden. Geschlechtspartner altersspezifische Mortalitätsrate 1 0,8 0,6 Männchen verpaart Männchen virginell 0,4 0,2 0 0 20 40 60 80 100 Lebensalter [d] Abb.63: Alterspezifische Mortalitätsraten verpaarter und virgineller, männlicher Käfer. 133 Anhang altersspezifische Mortalitätsrate 1 0,8 0,6 Weibchen verpaart Weibchen virginell 0,4 0,2 0 0 20 40 60 80 100 Lebensalter [d] Abb.64: Alterspezifische Mortalitätsraten verpaarter und virgineller, weiblicher Käfer. Verzögerte Kopulation altersspezifische Mortalitätsrate 1 0,8 0,6 Männchen Kop VZ Männchen VP 0,4 0,2 0 0 20 40 60 80 100 Lebensalter [d] Abb.65: Altersspezifische Mortalitätsraten männlicher Käfer, die erst nach 25 Tagen kopulierten (Kop VZ) und einer verpaarten Vergleichsgruppe. 134 Anhang altersspezifische Mortalitätsrate 1 0,8 0,6 Weibchen Kop VZ Weibchen VP 0,4 0,2 0 0 20 40 60 80 100 Lebensalter [d] Abb.66: Altersspezifische Mortalitätsraten weiblicher Käfer, die erst nach 25 Tagen kopulierten (Kop VZ) und einer verpaarten Vergleichsgruppe. Eins zu Drei Verpaarung altersspezifische Mortalitätsrate 1 0,8 0,6 Männchen verpaart 1:1 Männchen verpaart 1:3 Männchen virginell 0,4 0,2 0 0 20 40 60 80 100 120 Lebensalter [d] Abb.67: Altersspezifische Mortalitätsraten eins zu eins verpaarter, eins zu drei verpaarter und virgineller, männlicher Käfer. 135 Anhang altersspezifische Mortalitätsrate 1 0,8 0,6 Weibchen verpaart 1:1 Weibchen verpaart 1:3 Weibchen virginell 0,4 0,2 0 0 20 40 60 80 100 120 Lebensalter [d] Abb.68: Altersspezifische Mortalitätsraten, eins zu eins verpaarter, eins zu drei verpaarter und virgineller, weiblicher Käfer. Intermittierende Fütterung altersspezifische Mortalitätsrate 1 0,8 0,6 Männchen 24h Männchen 48h Männchen ad lib. 0,4 0,2 0 0 20 40 60 80 100 Lebensalter [d] Abb.69: Altersspezifische Mortalitätsraten männlicher Käfer, die intermittierend im 24 bzw. 48 Stundenrhythmus gefüttert wurden und eine ad libitum gefütterte Vergleichsgruppe. 136 Anhang altersspezifische Mortalitätsrate 1 0,8 0,6 Weibchen 24h Weibchen 48h Weibchen ad lib. 0,4 0,2 0 0 20 40 60 80 100 Lebensalter [d] Abb.70: Altersspezifische Mortalitätsraten weiblicher Käfer, die intermittierend im 24 bzw. 48 Stundenrhythmus gefüttert wurden und eine ad libitum gefütterte Vergleichsgruppe. Freilandbedingungen altersspezifische Mortalitätsrate 1 0,8 Männchen 2004 I 0,6 Männchen 2004 II Männchen 2005 I 0,4 Männchen LT 0,2 0 0 20 40 60 80 100 120 140 160 Lebensalter [d] Abb.71: Altersspezifische Mortalitätsraten der Männchen, welche unter Freilandbedingungen gehalten wurden und einer Männchenpopulation, die unter Langtagbedingungen bei konstant 20°C lebten. 137 Anhang altersspezifische Mortalitätsrate 1 0,8 Weibchen 2004 I 0,6 Weibchen 2004 II Weibchen 2005 I 0,4 Weibchen LT 0,2 0 0 20 40 60 80 100 120 140 160 Lebensalter [d] Abb.72: Altersspezifische Mortalitätsraten der Weibchen, welche unter Freilandbedingungen gehalten wurden und einer Weibchenpopulation, die unter Langtagbedingungen bei konstant 20°C lebten. 138 DANKSAGUNG Mein besonderer Dank gilt Herrn Prof. Dr. Klaus‐Günter Collatz für die Bereitstel‐ lung des Arbeitsplatzes, sowie für die vielen Anregungen und Diskussionen. Ich bedanke mich ausdrücklich für die Überlassung des Themas und vor allem für die Freiheit bezüglich eigener Ideen und Gedanken, die er mir über all die Jahre gewährte. Er hatte immer ein offenes Ohr für all die Probleme, die sich mir während meiner Arbeit in den Weg stellten. Weiterhin möchte ich Herrn Prof. Dr. Klaus Peschke meinen Dank aussprechen. Durch die Bereitstellung eines klimatisierten Arbeitsbereiches, war die Durchfüh‐ rung der Versuche zur Diapause überhaupt erst möglich. Tessy Balog‐Albonetti lieferte mir nicht nur unersetzliche Daten für meine Arbeit, sondern war mir stets eine gute Freundin und Wegbegleiterin. Herzlichen Dank. Bei der Deutsche Gesellschaft für Altersforschung (Prof. Dr. Dieter‐Platt‐Stiftung) möchte ich mich für die finanzielle Unterstützung meiner Arbeit bedanken. Zuletzt bedanke ich mich bei allen Andern, die mich während meiner Promotion unterstützt haben.