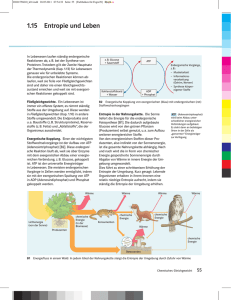
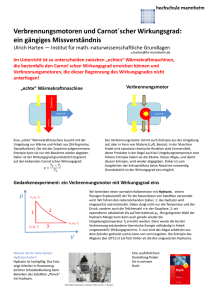
MEHR ALS SIE JE ÜBER ENTROPIE WISSEN WOLLTEN
Werbung

MEHR ALS SIE JE ÜBER ENTROPIE WISSEN WOLLTEN… Hans U. Fuchs Abteilung Mathematik und Physik, Departement T Zürcher Hochschule Winterthur, 2004 Abstract und Leitfaden 2 1 4 Einführung 1.1 Alltagsvorstellungen: Thermodynamik verstehen 1.2 Entropie, Zweiter Hauptsatz und Evolution 1.3 Übersicht über den Aufsatz 2 Phänomene und (Alltags-) Vorstellungen 5 2.1 Beispiele thermischer Prozesse 2.2 Metaphern und Analogien 2.3 Temperatur und Wärme 3 Formalisierung: Entropie, Temperatur und Energie 3.1 3.2 3.3 3.4 3.5 3.6 Temperatur Carnots Bild von Wärmekraftmaschinen La puissance du feu: Energie und thermische Leistung Entropie und Energie bei Heizen und Kühlen Energieaufwand bei Entropieproduktion Entropiebilanz: Speichern, Fliessen, Entstehen 4 Prozesse und Optimierung 4.1 4.2 4.3 4.4 4.5 Wärmetransporte: Leitung, Konvektion und Strahlung Wärmespeicherung und Temperatur Stoffe, Stoffumwandlung und Entropie Thermische Maschinen: Motoren und Wärmepumpen Entropieproduktion und Optimierung 5 Entropie und Strukturbildung 9 13 17 5.1 Der Zweite Hauptsatz 5.2 Beispiele dissipativer Prozesse 5.3 Prozesse in geschlossenen und offenen Systemen 6 Thermodynamik, Ökologie und Ökonomie 20 6.1 Nochmals der Zweite Hauptsatz: Wert der Energie 6.2 Ökologen, Ökonomen und die Thermodynamik 6.3 Eine Idee: Entropieproduktion besteuern 7 Zusammenfassung und Ausblick 25 Anmerkungen 26 Literaturverzeichnis 27 Anhang 29 Carnot und der Wärmestoff Clausius und Wärme als Energieform Statistische Modelle der Entropie Mehr als Sie je über Entropie wissen wollten Abstract und Leitfaden Wärmelehre gilt als der am schwierigsten zu verstehenden Teil der klassischen Physik. Macht man sich aber Alltagsvorstellungen und Metaphern zu Nutze, so ergibt sich eine Darstellungsmöglichkeit, die relativ einfach und “benutzerfreundlich” ist (Abschnitt 2). Man versteht dann Wärme als eine fluide Substanz, die in irreversiblen Prozessen erzeugt wird, die Materialien warm macht oder Eis schmilzt, und mit der man thermische Maschinen antreibt. Die Temperatur ist das thermische Niveau, und Temperaturunterschiede spielen die Rolle des Antriebs thermischer Prozesse. Es stellt sich heraus, dass dieser einfache Wärmebegriff das liefert, was in Physik und Technik offiziell Entropie heisst. Diese Darstellung der Thermodynamik lässt sich relativ leicht formalisieren (Abschnitt 3). Wenn man andere Vorgänge (hydraulische oder elektrische) als Analogie zu Rate zieht, so kann man thermodynamische Grundideen fast ohne nachzudenken hinschreiben. Diese Grundideen (Entropiebilanz; Beziehung zwischen Entropie, Temperatur und Energie) lassen sich dann analog zu anderen Prozessen auf die wichtigsten thermischen Vorgänge anwenden (Abschnitt 4). Ein wichtiges Resultat ist die Erkenntnis, dass das, was wir “Energieverlust” nennen, direkt mit der Erzeugung von Entropie verknüpft ist. Man erreicht also eine Optimierung von Prozessen, wenn man versucht, die Irreversibilitäten (Entropieproduktion) zu minimieren. Diese Ideen erlauben uns zu verstehen, was Thermodynamik mit Evolution zu tun hat (im Gegensatz zu oft gehörten Vorstellungen verbietet das Grundgesetz der Thermodynamik, der Zweite Hauptsatz, nicht die spontane Entstehung von Strukturen; Abschnitt 5). Schliesslich können wir auch Anwendungen der Thermodynamik und der Minimierung der Entropieproduktion in Ökologie und Ökonomie diskutieren (Abschnitt 6). Wir werden verstehen, was es mit der Vorstellung des Wertes von Energie auf sich hat, und wie ökologische und ökonomische Prozesse generell bewertet werden könnten. Der Aufsatz bildet eine Grundlage für eine Einführung in die Thermodynamik. Eines der Ziele ist ein fundiertes qualitatives Verständnis des Zweiten Hauptsatzes der Thermodynamik und seine Anwendung in Evolution, Ökologie und Ökonomie. Diese Darstellung der Physik bildet das Fundament für ein Beispiel der Evolution physikalischer Strukturen, nämlich Sternentwicklung. Diese Themen werden in weiteren Aufsätzen behandelt. Leitfaden 1. Lesen Sie diesen Aufsatz, um einen Überblick über die darin dargestellten Ideen zu erarbeiten. Insbesondere sollten Sie versuchen, die Ideen aus Abschnitt 5 und 6 zu verstehen. 2. Fragen: Lassen Sie sich von den folgenden Fragen bei der Auseinandersetzung mit dem Thema leiten. Versuchen Sie, einige zu bearbeiten. • Was misst man mit der Temperatur? • Warum zeigt das Schmelzen von Eis den Unterschied von Wärme und Temperatur? • Erklären Sie anhand von heissem Kaffee in einer Tasse den Unterschied zwischen Wärme und Temperatur. • Welche Eigenschaften hat der Wärmestoff? (Abschnitt 3) • Welche Typen von Metaphern könnten hinter Vorstellungen von Temperatur und Wärme stecken? Gibt es Analogien für Wärme und Temperatur? 2 Mehr als Sie je über Entropie wissen wollten • Sie wollen ein gekühltes Getränk möglichst lange kalt halten. Wickeln Sie die Flasche in einen Wollschal oder in Alufolie? • Ein Metall- und ein Holzlöffel, die beide sehr lange in der Küche lagen, fühlen sich verschieden warm an. Verstehen Sie, warum? • Was sind Ihre eigenen, ganz spontanen Vorstellungen von Wärme als physikalischer Grösse? Um das herauszufinden, schreiben sie einen ganz kurzen Aufsatz, in dem Sie in ein paar wenigen Sätzen festhalten, wie Sie das Wort Wärme benützen. Vergleichen Sie Ihre Vorstellungen mit den hier diskutierten. • Betrachten Sie die Antworten, die Sie selber auf den Fragebogen über Metaphern zu Wärmevorstellungen gegeben haben. Welche Vorstellungen stecken in den Sätzen im Fragebogen? Wie würden Sie jetzt reagieren? Warum? • Warum ist es eine Verschwendung, mit Feuer Wasser warm zu machen? • Energie kann man nicht vernichten. Was bedeutet dann der Ausdruck “Energieverlust”? • Was bedeuten die beiden Masse für Wirkungsgrad (Wirkungsgrad nach dem Ersten Hauptsatz und Wirkungsgrad nach dem zweiten Hauptsatz)? • Recherchieren Sie die Bedeutung des Begriffes Emergie (emergy), der von H. T. Odum eingeführt wurde, um den Energiegebrauch in Ketten von Systemen der Biosphäre zu verstehen. Braucht man den Begriff? Oder reicht das Verständnis der Eigenschaften der Entropie? • Suchen Sie Formulierungen des Zweiten Hauptsatzes (im Internet oder in Büchern). Versuchen Sie herauszufinden, ob und wie diese mit den hier gegebenen Grundlagen der Thermodynamik erklärbar sind. (Abschnitt 3 und Abschnitt 4) • Ist der folgende Vergleich eine Analogie, Metapher oder ein Gleichnis? Wir wissen, dass Wärme entsteht, wenn Wasser durch einen Schlauch fliesst. Wir wissen aus direkter Erfahrung, dass auch dann Wärme produziert wird, wenn Elektrizität fliesst, oder wenn Drall von einem rotierenden Rad durch die bremsende Hand abfliesst. Aber was ist, wenn Wärme durch eine Hauswand fliesst? • Gibt es eine metaphorische Basis für Vorstellungen darüber, dass bei allen Prozessen in der Natur immer Wärme produziert wird? 3. Aufgaben 1: Widersprechen die Gesetze der Thermodynamik der spontanen Entstehung von Leben? 4. Aufgaben 2: Wie kann man thermodynamische Ideen zur Bewertung ökologischer, technischer und ökonomischer Aktivitäten heranziehen? 3 Mehr als Sie je über Entropie wissen wollten 1 Einführung Obwohl die Darstellung der Physik als Systemwissenschaft (PSS) die einzelnen Gebiete gleich behandelt, spielt die Thermodynamik eine besondere Rolle. Das hat hauptsächlich mit der speziellen Eigenschaft der Wärme, nämlich ihrer Erzeugbarkeit, zu tun. Da sozusagen alle Prozesse irreversibel (dissipativ) sind, kommt Wärme immer und überall vor. Man kommt einfach um ein Verständnis der thermischen Vorgänge nicht herum. Darüber hinaus hat die Erzeugbarkeit der Wärme noch andere Folgen. Da Wärmeproduktion zu Verlust von Energie, die sonst für andere Vorgänge verfügbar wäre, führt, versucht man, Prozesse durch Minimierung der Wärmeproduktion zu optimieren. Interessanterweise macht die Natur das auch von selber. Des Weiteren steht das stete Fortschreiten der Zeit (wir können nicht mehr zurück) wahrscheinlich mit der Produktion von Wärme im Zusammenhang. Alles in Allem haben wir es bei der Wärme mit einem zentral wichtigen Phänomen zu tun. 1.1 Alltagsvorstellungen: Thermodynamik verstehen Die Thermodynamik hat sich auf eine Weise entwickelt, die sie zur Aussenseiterin der traditionellen Darstellung der Physik (TP) macht. Sie passt mit keiner der anderen Theorien der Physik (Elektrizität, Mechanik, Fluidmechanik, etc.) zusammen. Man behauptet sogar, sie könne keine dynamischen Vorgänge beschreiben. Unter anderem dadurch ist sie für fast alle Lernenden unverdaubar geworden. Um sie ranken sich dann auch Legenden—wie um Vieles, das man nicht versteht—und quasi-religiöse Vorstellungen von einer wundersamen und auf grossartige Weise besonderen Theorie sind verbreitet. Dazu beigetragen hat die Kreation des Begriffes Entropie, der wie kein anderer aus dem reichen Sortiment der Physik die Vorstellung der Menschen in Bann hält—man erschauert wohlig vor dem Mysterium der Physik.1 Wenn man sich nicht davon beirren lässt und einfach mal schaut, wie wir im Alltag über thermische Vorgänge reden und denken, so erkennen wir viel einfachere Strukturen, die auch mit Vorstellungen über andere Phänomene zusammen passen (siehe Fuchs, 2004b). Macht man sie zum Zentrum einer Beschreibung thermischer Prozesse, so lösen sich die wesentlichen Probleme: man erhält eine Theorie thermischer dynamischer Vorgänge, die auch noch verständlich ist. Metaphern und Analogien werden sich als Wegweiser zu einer menschenfreundlichen Thermodynamik erweisen. 1.2 Entropie, Zweiter Hauptsatz und Evolution In der modernen dynamischen Darstellung der Thermodynamik zeigt sich, dass der verwirrende Kunstbegriff Entropie mit dem identisch ist, was ein normaler Mensch im Alltag Wärme nennt (Calendar, 1911; Job, 1972; Fuchs, 1996).2 Wenn wir also Thermodynamik in den Rahmen der Physik als Systemwissenschaft (PSS) stellen, ergibt sich ein intuitives und bildhaftes Verständnis thermischer Vorgänge. Entropie verliert ihre geheimnisvolle Stellung und wird zu einem für das Verständnis und die Berechnung von thermischen Phänomenen unverzichtbaren Instrument. Die Bilanz der Wärmemenge, d.h. die Bilanz der Entropie, erweist sich als einfache und zusammenfassende Formulierung des Zweiten Hauptsatzes der Thermodynamik (dem anderen Mysterium der traditionellen Thermodynamik, über das schon viel Tinte vergossen wurde).3 Unter anderem verstehen wir auf einfache Weise, dass der Zweite Hauptsatz nichts gegen Evolution, d.h. die Entwicklung von Strukturen, einzuwenden hat.4 Im Gegenteil: Wärmeproduktion, die man lange als den Feind der Strukturbildung angesehen hatte, ist sehr direkt an allen strukturbildenden Prozessen beteiligt. 4 Mehr als Sie je über Entropie wissen wollten Die moderne Bedeutung des Zweiten Hauptsatzes wird plötzlich handfest. Die Entropiebilanz wird zum Rechenwerkzeug in den Händen derer, die herausfinden wollen, wie irreversibel die Prozesse sind, mit denen wir leben, und wie wir bestimmte Vorgänge durch Reduktion der Irreversibilitäten effizienter gestalten können. In den letzten zwanzig Jahren wurde die Thermodynamik immer häufiger zur Optimierung von Prozessen aus Technik, Umwelt und Wirtschaft eingesetzt. 1.3 Übersicht über den Aufsatz Dieser Aufsatz verfolgt mindestens diese beiden Ziele: Ihnen ein intuitives Verständnis thermischer Vorgänge zu ermöglichen und Sie auf die Diskussion um Thermodynamik, Evolution, Ökologie und Ökonomie vorzubereiten. Ich benutze dazu die makroskopischen Modelle der PSS. Die üblicherweise bei Diskussionen herbeigezogenen statistischen Modelle (regellose Bewegung kleiner Teilchen) werde ich nur am Rande streifen, soweit es nötig ist, mit ihnen zusammenhängende Missverständnisse aufzuklären. In Abschnitt 2 werden Alltagsvorstellungen, Metaphern und Analogien herangezogen, um eine Klärung der Begriffe Temperatur und Wärme zu erreichen. Für Wärme entwickeln wir das alte Wärmestoffbild, das dann direkt auf die Grösse passt, die in der offiziellen Sprechweise Entropie heisst. Das intuitive Verständnis der beiden Grundgrössen, mit denen wir thermische Phänomene beschreiben, wird in Abschnitt 3 formalisiert. Das heisst, wir lernen die wenigen Zusammenhänge kennen, die man braucht, wenn man auch formale Modelle thermischer Prozesse aufbauen möchte. Durch Carnots Wasserfallbild erhalten wir den Zusammenhang zwischen Entropie (Wärmestoff), Temperatur und Energie, der ausreicht, viele wichtige Berechnungen fast im Kopf durchzuführen. Die Grundideen der modernen Thermodynamik werden auf die Beschreibung einiger wichtiger Phänomene angewendet (Abschnitt 4). Wärmetransporte, Wärmespeicherung und Phasenumwandlungen gehören ebenso dazu wie thermische Maschinen.5 Wir werden ohne grosse Mühe erkennen, dass Entropieproduktion normalerweise ein Verlustgeschäft ist, und dass man technische und natürliche Prozesse verbessern kann, indem man die Wärmeproduktion zu minimieren versucht. Das führt uns zu einer Diskussion des Zusammenhangs zwischen Entropie, Entropieproduktion, Zweitem Hauptsatz und der Bildung von Strukturen (Abschnitt 5). Schliesslich wollen wir noch sehen, wie Thermodynamik bestimmte Vorstellungen in Gebieten, die wir normalerweise nicht mit ihr verbinden, beflügelt hat. Heute wird die Idee der thermischen Optimierung auf ökologische und ökonomische Prozesse angewendet (Abschnitt 6). 2 Phänomene und (Alltags-) Vorstellungen Wir haben umfangreiche aber nicht in jedem Fall konsistente Alltagsvorstellungen zu thermischen Phänomenen. Wie wir sehen werden, handelt es sich in den meisten Fällen um ein Bild von Wärme als eine Art Substanz, die in Körper hinein geht und sie heiss macht. Über Temperatur sprechen wir anders, mehr als eine Art Höhe. Trotzdem werden Wärme und Temperatur sehr oft durcheinander gebracht. Wenn wir thermische Phänomene etwas genauer beobachten und dann zu beschreiben versuchen, werden wir ein erstes Verständnis entwickeln, das sich schliesslich zu tragfähigen und immer noch intuitiven und bildlichen Vorstellungen ausbauen lässt. 5 Mehr als Sie je über Entropie wissen wollten 2.1 Beispiele thermischer Prozesse Neben den Phänomenen, die mit Fliessen von Wasser und Luft und Bewegung und Rotation zu tun haben, gehören thermische Vorgänge zu denen, die uns am häufigsten gegenübertreten. Tages- und Jahresrythmus, Sonne, Feuer, Eis und Schnee, Kochen, Heizen, Brauchwassererwärmung, Erwärmung durch Reibung und viele mehr sind für uns Alltagsphänomene. In unserer Zivilisation kommen dann noch Verbrennungsmotoren, Kühlschränke und thermische Kraftwerke dazu. Ich möchte hier nur einige ganz wenige Beispiele herausgreifen.6 Wenn wir heisses Wasser aufbereiten, so halten wir Wasser in einem Gefäss über ein Feuer oder stecken einen Tauchsieder hinein. Feuer oder Tauchsieder machen das Wasser wärmer. Wir sagen auch, dass Feuer und Tauchsieder Wärme erzeugen, und die macht dann das Wasser heisser. Bringt man zwei verschieden warme Körper in Kontakt (z.B. zwei Mengen Wasser in aneinanderliegenden Kammern eines Behälters, oder indem man einen kalten Kupferklotz in heisses Wasser steckt; siehe Fig. 1), so wird der heisse kühler und der kühle heisser, bis sie beide gleich warm sind. Man sagt auch, dass vom wärmeren Körper Wärme in den kälteren fliesst. Temperature / °C 100 75 50 25 X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X X [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ 0 0 Figur 1: 300 600 Time / s 900 1200 Werden zwei verschieden warme Körper (heisses und kaltes Wasser in zwei Kammern eines Gefässes, links) miteinander in Kontakt gebracht, so gleichen sich die Temperaturen (rechts) einander an. Der Vorgang läuft, solange es einen Unterschied in der dem Vorgang zugehörigen polaren Grösse (Temperatur), d.h. eine Spannung, gibt. Ein Kühlschrank ist ein interessantes Gerät. Es macht, dass es in einer warmen Küche einen abgeschlossenen Raum gibt, der kälter ist und auch kälter bleibt. Das ist nicht selbstverständlich. Auch wenn man den kalten Raum sehr gut wärmeisoliert, so wird er mit der Zeit doch gleich warm wie die Küche. Wir müssen also aus dem Innern des Kühlschranks die Wärme, die von aussen hinein fliesst, herausnehmen. Wenn man genau hinschaut, so sieht man, dass es hinten am Kühlschrank ziemlich warme Kühlschlangen gibt, die offensichtlich die Wärme aus dem Innern des Kühlschranks an die Küche abgeben. Bildlich gesprochen pumpt das Kühlgerät Wärme aus dem Innern des Kühlschranks in die Küche. Schliesslich betrachten wir noch eine Wärmekraftmaschine, wie sie in Verbrennungsmotoren oder thermischen Kraftwerken vorkommt (Fig. 2). Eine Wärmekraftmaschine wird von einer Wärmequelle angetrieben (Brennstoffe, Sonnenstrahlen oder Kernspaltung). Die Wärme wird in einem Kühler, z.B. in einem Kühlturm, wieder an die Umwelt abgegeben. Offensichtlich fliesst Wärme von einem heissen Ort (Feuer) zu einem kühlen (Umwelt). Ähnlich wie fliessendes Wasser ein Wasserrad antreibt, so treibt Wärme die Maschine an. 6 Mehr als Sie je über Entropie wissen wollten Figur 2: 2.2 Ein solarthermisches Kraftwerk in der Mojave Wüste in Kalifornien (der Kühlturm gehört zu einem anderen Kraftwerk). Das Sonnenlicht erzeugt Wärme in einem synthetischen Öl, das durch Rohre in der Brennlinie von Parabolrinnenspiegeln fliesst. Mit der Wärme des heissen Öls wird Dampf erzeugt, der eine Turbine antreibt. Wenn der Dampf aus der Turbine kommt, gibt er die Wärme in einem Kühlturm an die Umgebung ab. Metaphern und Analogien Ganz offensichtlich benützen wir bei der Beschreibung der Phänomene (Abschnitt 2.1) neben den Worten heiss, warm, und kalt die Begriffe Wärme und Temperatur. Heiss, warm und kalt gehören zu den ursprünglichsten Erfahrungen, die wir machen. Sie gehören zu einer Polarität, wie wir sie besonders im mythischen Denken antreffen. Zwischen den Extremen von heiss und kalt liegen unendliche viele verschiedene “Wärmegrade” (auf Englisch: hotness), die uns sagen, wie warm etwas ist. Wir haben also die Erfahrung einer eindimensionalen Grösse, deren Werte wir uns wie an einer Kette aufgereiht vorstellen können. Temperatur ist einfach der technische Begriff für einen Zahlenwert, der angibt, wie warm oder kalt etwas ist. Temperatur misst also den Ort auf der Kette. Die Vorstellung von Wärme ist im Alltag weniger gefestigt, oder vielleicht sollte man sagen, dass wir weniger mit einer konkreten Vorstellung von Wärme operieren. Das geht so weit, dass wir, wenn wir nicht scharf nachdenken, Wärme mit Temperatur verschmelzen lassen. Es ist dann plötzlich nicht klar, ob es sich um zwei verschiedene Begriffe handelt oder nur um zwei Worte für genau das Selbe.7 Darum ist es interessant nachzuforschen, wie wir—mehr oder weniger spontan—über Wärme und Temperatur sprechen. Vielleicht erscheinen dann Metaphern, über die wir zwar verfügen, deren wir uns aber nur bedingt bewusst sind, und aus denen wir im Alltag wenig machen. In einer Untersuchung, bei der kurze Sätze über Situationen, in denen die Worte Wärme und Temperatur gebraucht werden, haben 35 Befragte8 Aussagen, in denen Wärme als Substanz oder Menge oder als Verursacher auftritt, als eher richtig eingestuft (Dadurch ist viel Wärme entstanden, Wir speichern Wärme für den Winter, oder Wärme treibt den Motor an; Zustimmung 67%, respektive 77% bei einer theoretischen Erwartung von 100%; siehe Tabelle 1). Das Selbe gilt für Aussagen, bei denen Temperatur als Niveaugrösse erklärt wird (Die Temperatur ist niedrig, oder Die Temperatur ist über dem Niveau von gestern; Zustimmung 83%). Macht man hingegen Sätze, bei denen entweder Wärme als Niveau oder die Temperatur als Menge auftritt, so werden diese massiv abgelehnt (14% oder 9% Zustimmung). Die Zustimmung zu Aussagen über Wärme als Substanz oder Menge ist allerdings nicht hoch genug, um von einer 7 Mehr als Sie je über Entropie wissen wollten vollkommen eindeutigen Vorstellung sprechen zu können (allerdings liegt die Zustimmung bei neun von 30 Aussagen dieser Art zwischen 80% und 100%). Wie schon erwähnt, sind unsere Alltagsvorstellungen selten eindeutig, präzise und vollkommen stabil. Metaphorisches Verständnis ist oft durch eine Mehrzahl von Metaphern für ein und den selben Sachverhalt gekennzeichnet. Wir haben kein Problem damit, dass wir mehrfache Erklärungen liefern, die sich bei ganz genauem Hinsehen logisch widersprechen können (Lakoff and Johnson, 1980). Tabelle 1: Zustimmung zu bestimmten Aussagena a. als Menge als Verursacherin als Niveau Wärme 0.67 (1) 0.77 (1) 0.14 (0) Temperatur 0.09 (0) 0.09 (0) 0.83 (1) Zustimmung zu (1) oder Ablehnung von (0) Aussagen über Wärme und Temperatur. Hypothetisch zu erwartende Werte in Klammern. Auch wenn man Personen kleine Aufsätze zur Frage Was ist Wärme schreiben lässt, so erkennt man ähnliche Vorstellungen (Fuchs, 1987). Wieder ist nicht alles scharf und eindeutig, aber Substanzvorstellungen für Wärme scheinen durch: Wärme ist in Körpern enthalten, Wärme kann fliessen (fliesst von selber von heissen zu kalten Stellen) und kann erzeugt werden. Zusammenfassend kann man von einer Metapher Wärme ist eine fluide Substanz ausgehen. Wenn man motiviert durch Begriffe, die in Schemas und Metaphern zu räumlicher Orientierung und Substanzen wurzeln, thermische Phänomene etwas sorgfältiger untersucht und beschreibt, so erkennt man plötzlich Ähnlichkeiten zwischen diesen und ganz anderen Vorgängen (Fuchs, 2004b). Auf diesen Ähnlichkeiten lassen sich dann Analogien aufbauen. Unsere Kenntnis vom Speichern und Fliessen von Flüssigkeiten, die in formalen Modellen gipfelt, lassen sich sehr gezielt auf thermische Prozesse übertragen. Allerdings muss man das Bild in einer besonderen Hinsicht erweitern. Die Wärmesubstanz kann erzeugt werden, man kann sie aber nicht wieder vernichten (siehe auch Fuchs, 2004b). 2.3 Temperatur und Wärme Zusammenfassend können wir also sagen, dass aus unseren Alltagsvorstellungen folgendes Bild entsteht. Wir konstruieren zwei fundamentale thermische Grössen, mit denen wir Vorgänge beschreiben und erklären. Temperatur ist das Mass einer Niveaugrösse, des thermischen Niveaus. Wärme ist eine fluide substanzartige Grösse, die erzeugt, aber nicht vernichtet werden kann. Sie kann andere Prozesse antreiben, genauso wie Wasser ein Wasserrad antreibt. Damit das geht, braucht es eine Temperaturdifferenz; wir betrachten diese als den Antrieb thermischer Prozesse. Wärme wird in sogenannten irreversiblen oder dissipativen Prozessen erzeugt. Dazu gehören chemische Reaktionen (Feuer), Absorption von Sonnenlicht, Reibung, das Fliessen von Elektrizität durch Drähte und schliesslich das Fliessen von Wärme selber. Wir vergleichen also Temperatur mit Druck, elektrischem Potential oder Geschwindigkeit, Temperaturdifferenzen mit Druckdifferenzen, elektrischen Potentialdifferenzen (die man auch Spannung nennt) oder Geschwindigkeitdifferenzen. Wärme vergleichen wir mit Wassermengen, Elektrizität (elektrischer Ladung) oder Bewegungsmenge (Impuls). Siehe dazu die Beschreibungen in den Abschnitten 3 und 4 in Fuchs (2004b). 8 Mehr als Sie je über Entropie wissen wollten 3 Formalisierung: Entropie, Temperatur und Energie Indem wir von Analogien zwischen Hydraulik, Elektrizität und thermischen Phänomenen Gebrauch machen, wird es uns gelingen, eine intuitive aber formale Darstellung der Thermodynamik zu schaffen. 3.1 Temperatur Wie nun schon öfter angedeutet, misst die Temperatur eines Materials, wie warm dieses ist. Ernst Mach hat darum den Begriff Wärmegrad (Englisch: hotness) eingeführt, um eine intuitive Beschreibung der Grösse zu liefern, mit der wir eine ursprüngliche (mythische) Vorstellung verbinden. Wir wissen aus dem Alltag, dass sich bestimmte Eigenschaften von Materialien ändern, wenn sich ihr Wärmegrad ändert (Volumenänderung, Änderung des elektrischen Widerstandes, Farbänderungen, etc.). Man kann solche Zusammenhänge verwenden, um ein Mass für die Temperatur einzuführen. Temperaturmessung wurde im Laufe der Zeit immer mehr verfeinert. Untersuchungen haben gezeigt, was wir intuitiv schon immer angenommen haben: es gibt eine tiefstmögliche Temperatur, die man nicht unterschreiten kann (nichts kann kälter als saukalt sein…). Man führt für diese tiefste Temperatur den Wert Null auf der sogenannten Kelvinskala ein (die Kelvinskala ist im 273 Grad gegenüber der Celsiusskala verschoben). 3.2 Carnots Bild von Wärmekraftmaschinen Die früheste Untersuchung, in der ausgiebig von der Analogie mit Wasser Gebrauch gemacht wurde, ist die Arbeit von Sadi Carnot über Wärmekraftmaschinen. Lassen wir ihn selber zu Wort kommen (aus der Englischen Übersetzung seines Buches von 1824): Every one knows that heat can produce motion. That it possesses vast motive-power no one can doubt, in these days when the steam-engine is everywhere so well known. To heat also are due the vast movements which take place on the earth. It causes the agitations of the atmosphere, the ascension of clouds, the fall of rain and of meteors, the currents of water which channel the surface of the globe, and of which man has thus far employed but a small portion. Even earthquakes and volcanic eruptions are the result of heat. Nach diesen blumigen (romantischen?) Worten zur Bedeutung von Wärme fährt Carnot fort und beschreibt ein Bild, wie er sich die Funktionsweise einer Dampfmaschine vorstellt: According to established principles at the present time, we can compare with sufficient accuracy the motive power of heat to that of a fall of water … . The motive power of a fall of water depends on its height and on the quantity of the liquid; the motive power of heat depends also on the quantity of caloric used, and on what may be termed, on what in fact we will call, the height of its fall, that is to say, the difference of temperature of the bodies between which the exchange of caloric is made. In the fall of water the motive power is exactly proportional to the difference of level between the higher and lower reservoirs. In the fall of caloric the motive power undoubtedly increases with the difference of temperature between the warm and the cold bodies; but we do not know whether it is proportional to this difference. 9 Mehr als Sie je über Entropie wissen wollten Zur Rolle des Dampfes in der Dampfmaschine: The steam is here only a means of transporting the caloric … . The production of motive power is then due in steam-engines not to an actual consumption of caloric, but to its transportation from a warm body to a cold body. Ganz unzweifelhaft stellt sich Carnot die Wärme als eine fluide Substanz vor (man sprach damals von caloricum, dem Wärmestoff). Alle seine Worte belegen das. Wir erkennen die Metaphern, die schon bei der Beschreibung anderer Phänomene auftauchten. Aus bestimmten Gründen—unter anderem, weil die Forscher damals annahmen, dass Caloricum nicht erschaffen werden kann—wurde etwa 30 Jahre nach Carnot dieses Bild als unrealistisch abgetan und durch eine andere Vorstellung ersetzt (Wärme als eine energiebezogene Grösse). Die Alltagsgrösse, die wir bisher mit Wärme bezeichnet haben, kann man aber deswegen nicht aus der Welt schaffen. Was man verdrängt, kommt auf anderem Wege wieder an die Oberfläche—und verfolgt einem dann bis in die Albträume. Auf grossem Umweg hat um 1850 Rudolf Clausius eine formale Grösse in die Thermodynamik eingeführt, der er den Kunstnamen Entropie gab. Wir wissen heute, dass Entropie sehr gut auf unser Alltagsverständnis von Wärme oder des Wärmestoffs passt.2 3.3 La puissance du feu: Energie und thermische Leistung Wenn wir das intuitive Bild weiter führen, so können wir es mit der Rolle der Energie ergänzen (Fuchs, 2004b). In einer Wärmekraftmaschine fällt Wärme—die ich nun immer öfter Entropie nennen werde—bildlich gesprochen von einer hohen Temperatur, die durch den Ofen aufrechtgehalten wird, auf eine niedrige, bei der sie durch den Kühler wieder an die Umwelt abgegeben wird (Fig. 3). Entropie bleibt im Idealfall erhalten, geht also einfach durch die Maschine und treibt so den gewünschten Prozess an. (Im realen Fall wird noch mehr Entropie erzeugt, der Vorgang ist ja normalerweise wegen Wärmetransporten und Reibung dissipativ). Bei einer idealen Wärmekraftmaschine haben wir also eine perfekte Analogie zwischen Wasser und Entropie. Zur Analogie gehört, dass die Temperatur dem thermischen Niveau entspricht. SYSTEM Entropie Pth Entropie T1 Temperatur der Heizung Figur 3: T2 Temperatur des Kühlers Ein Wasserfall symbolisiert die Arbeitsweise einer Wärmekraftmaschine. Rechts das Prozess-Diagramm der fallenden Entropie. Fliesst Entropie von einem Ort höherer zu einem Ort tieferer Temperatur, so wird Energie mit einer bestimmte Rate freigesetzt. Diese Rate nennen wir (thermische) Leistung. Wie herunterfallendes Wasser so gibt herunterfallende Entropie Energie ab, und zwar um so mehr je grösser die Temperaturdifferenz zwischen Eingang und Ausgang ist, und je grösser der Entropiefluss durch die Maschine ist. Wenn wir die Analogie mit Wasser voll ausschöpfen, so muss die Rate, mit der in einer Wärmekraftmaschine Energie freigesetzt wird, gleich dem Pro10 Mehr als Sie je über Entropie wissen wollten dukt aus Temperaturdifferenz und Entropiestrom sein: Thermische Leistung = Temperaturdifferenz · Entropiestrom Das, was wir heute thermische Leistung nennen, hiess bei Sadi Carnot bildlich Die bewegende Kraft des Feuers (La puissance motrice du feu), in Analogie zur bewegenden Kraft des Wassers. Diesen Vorgang kann man umkehren: Entropie kann von Orten tieferer Temperatur zu Orten höherer Temperatur gepumpt werden. Dazu baut man Wärmepumpen, die man z.B. durch einen elektrischen Vorgang antreibt (Fig. 4). Wie kein anderes Wort zeigt dieses, was für eine Metapher wir für Wärme brauchen: Wärme (Entropie) ist eine fluide Substanz. Sie ist in Materialien drin, kann fliessen, kann beim Herunterfliessen andere Prozesse antreiben und kann mit Hilfe von Wärmepumpen gepumpt werden. In irreversiblen Prozessen wird sie erzeugt. WÄRMEPUMPE IW,Antrieb IW2 Pel IQ Pth IS IW1 T1 IS T2 Kühlraum Figur 4: 3.4 Heizraum Wärmepumpen und Kühlschränke pumpen Entropie von kalten Orten zu wärmeren. Natürlich muss man einen Prozess arbeiten lassen, damit das geht. Hier ist eine ideale Wärmepumpe dargestellt. Die ganze Energie, die im elektrischen Prozess frei wird, steht für das Pumpen von Entropie zur Verfügung. Entropie und Energie bei Heizen und Kühlen So wie man mit Wasser einem System Energie zuführen kann (oder umgekehrt Energie abführen kann), so überträgt man mit Entropie auch Energie (Fig. 5). Einem Körper Entropie zuführen heisst ja Heizen. Von Kühlen spricht man, wenn man einem Körper Entropie entzieht. Mit anderen Worten wird bei Heizen und Kühlen auch Energie übertragen. Aus diesem Grund können wir eine andere Metapher konstruieren: Entropie ist ein Energieträger bei den Prozessen von Heizen und Kühlen. SYSTEM IW IS T T Figur 5: Einem Entropiestrom in ein System (beim Heizen) oder aus dem System (beim Kühlen) ist immer ein Energiestrom zugeordnet, der mit dem Entropiestrom und der Temperatur des Systems zusammenhängt. Wir sprechen dann von einem Energiestrom, der den Entropiestrom bei Heizen und Kühlen begleitet. Genau wie beim Wasser gibt es den einfachen Zusammenhang zwischen Entropiestrom, Energiestrom und Niveau (Temperatur): Energiestrom bei Heizen und Kühlen = Temperatur · Entropiestrom 11 Mehr als Sie je über Entropie wissen wollten 3.5 Energieaufwand bei Entropieerzeugung Entropie wird in irreversiblen Prozessen erzeugt. Man muss aber arbeiten, d.h. ein anderer Prozess muss Energie freisetzen, damit das geschehen kann (Fig. 6). Es gibt einen einfachen Zusammenhang zwischen Energieaufwand und erzeugter Entropie: Dissipationsrate = Temperatur · Rate der Entropieerzeugung Die Rate, mit der Energie für Entropieproduktion verwendet wird, heisst Dissipationsrate. Man kann diese Beziehung zwischen Entropie, Temperatur und Energie aus den anderen beiden herleiten. Sie lässt sich aber auch bildlich motivieren. Entropie zu erzeugen ist als ob man die Entropie bei 0 Kelvin erzeugt und sie dann bei einer bestimmten Temperatur erscheinen lässt. Also ist es, als ob man sie von 0 K auf die Temperatur des Körpers pumpt, in dem sie sich zeigt. TAUCHSIEDER IW IW ΠS Pel IQ ϕ1 Figur 6: 3.6 IS Pdiss T ϕ2 Die im Tauchsieder im elektrischen Prozess abgegebene Energie wird ganz zur Erzeugung von Entropie gebraucht, d. h. sie wird bei der Entropieproduktion gebunden. Energie, die zur Entropieerzeugung verwendet wird, nennt man dissipiert. Entropiebilanz: Speichern, Fliessen, Entstehen Fassen wir die allgemeinen Eigenschaften der Entropie zusammen. Da wir uns Entropie ähnlich wie Wasser oder elektrische Ladung vorstellen—mit dem Unterschied, dass man diese Grösse erzeugen, aber nicht vernichten kann—muss sie ein Bilanzgesetz erfüllen (Fig. 7): Änderungsrate der Entropie eines Systems = Summe aller Entropieströme + Entropieerzeugungsrate Beachten Sie, dass die Entropieerzeugungsrate nicht negativ sein darf. Sie kann Null sein, allerdings nur bei reversiblen (idealen oder nicht-dissipativen) Prozessen. ENTROPIE Entropiestrom 1 Entropiestrom 2 Entropieproduktionsrate Figur 7: Das systemdynamische Diagramm, mit dem die Bilanz der Entropie dargestellt wird. Entropie kann gespeichert werden (stock), sie kann fliessen (flow), und sie kann erzeugt werden (in einem Systemdynamik-Werkzeug benutzt man dazu auch ein flow-Symbol). Die Bilanzgleichung der Entropie, wie sie hier gegeben ist, ist die moderne Form des Zweiten Hauptsatzes der Thermodynamik. Sie wird zum Beispiel bei der Diskussion um die Möglich- 12 Mehr als Sie je über Entropie wissen wollten keit spontaner Strukturbildung eine wichtige philosophische Rolle spielen. Natürlich ist sie in der Thermodynamik selber ein zentrales und praktisches Werkzeug. 4 Prozesse und Optimierung Mit den in Abschnitt 3 besprochenen Zusammenhängen haben wir die praktischen Werkzeuge in der Hand, um konkrete thermische Phänomene zu untersuchen und mit den Resultaten dynamische Modelle der Vorgänge zu erzeugen. 4.1 Wärmetransporte: Leitung, Konvektion und Strahlung Es gibt drei Mechanismen, mit denen Entropie tranportiert wird: Leitung, Konvektion und Strahlung. Bei Wärmeleitung fliesst Entropie durch Materialien hindurch von Stellen, die heisser sind zu solchen, die kühler sind. Die Temperaturdifferenz interpretieren wir bildlich als Antrieb für den Vorgang (Fig. 8). Das Material, durch das die Entropie fliesst, und die Dicke der Schichten entscheiden darüber, wie gut die Entropie fliesst. Fluid 1 TRANSFER LAYERS Solid Layers Fluid 2 T1 T2 Energy Energy Entropy Entropy T Entropy T1 Temperature of fluid 1 T1 T2 T2 Temperature of fluid 2 R1 Figur 8: R2 R3 R4 Bei Wärmeleitung fliesst Entropie von heissen zu kühlen Stellen in einem Material. Natürlich nimmt sie dabei auch Energie mit (linkes Bild). Beim Transport von Entropie durch verschiedene Schichten sinkt die Temperatur von Schicht zu Schicht. In Analogie zur Leitung von elektrischer Ladung durch Materialien spricht man bei den Schichten von thermischen Widerständen (R1 usw., rechtes Bild). Konvektion heisst der Vorgang, bei dem in Flüssigkeiten oder Gasen gespeicherte Entropie mit den Fluiden transportiert wird. Wenn heisses Wasser vom Ölofen zu den Radiatoren fliesst, oder wenn uns heisse Sahara-Luft um die Ohren weht, dann handelt es sich um so einen Vorgang. Hier ist der Antrieb die Druckdifferenz, die zum Fliessen von Wasser oder Luft führt. Körper, die wärmer als 0 Kelvin sind, strahlen elektromagnetische Strahlung aus, die wir Wärmestrahlung nennen. Mit dieser Strahlung, die wir uns als einen nicht-materiellen Stoff vorstellen können, werden Entropie und Energie vom strahlenden Körper abgeführt. Andere Körper nehmen dann diese Strahlung durch Absorption auf. Die Stärke und die Art der Strahlung hängt von der Temperatur des strahlenden Materials ab. Ein Haus oder ein Lebewesen strahlt hauptsächlich Infrarotstrahlung, während die Strahlung von der Oberfläche der Sonne hauptsächlich sichtbar ist. 13 Mehr als Sie je über Entropie wissen wollten Nun ist es Zeit, eine schon früher gestellte Frage zu beantworten (Fuchs, 2004b, Abschnitte 3.4 und 5.2). Wir wissen, dass bei vielen Transportprozessen Wärme, d.h. Entropie erzeugt wird. Wenn Wasser durch ein Rohr oder Elektrizität durch einen Draht fliesst, oder wenn Bewegungsmenge aus einem Klotz, der über eine Unterlage rutscht, durch diese Unterlage fliesst, dann wird immer Entropie erzeugt. Wir wissen auch, woher die Energie zur Entropieerzeugung kommt. Betrachten wir Wasser, das durch ein Rohr fliesst. Wegen der Reibung sinkt der Druck, und nun wird wegen des Druckgefälles Energie frei. Wie steht es aber mit Entropieleitung durch eine Wand? Der Fall ist genau analog. Die Temperatur sinkt in Flussrichtung (Fig. 9), also wird bei Wärmeleitung Energie frei. Ein wärmeleitendes Material macht aber normalerweise mit der freiwerdenenden Energie nichts Kreatives (es ist keine Maschine). Also steht die Energie für den Prozess zur Verfügung, der als “Notausgang” immer vorkommt: Dissipation, d.h. Entropieproduktion (Fig. 9). Wärmeleitung ist mit Verbrennung von Brennstoffen, anderen chemischen Umwandlungen und der Absorption von Licht der grösste Entropieproduzent in Natur und Technik. WAND Pth IW1 IS1 Pdiss 4.2 IS2 = IS1 + Π S ΠS T1 Figur 9: IW2 = IW1 T2 Fliesst Entropie wegen Wärmeleitung durch ein Material, so wird dabei zusätzlich Entropie erzeugt. Wärmespeicherung und Temperatur Wenn man einem Material Entropie zuführt, so wird es meistens wärmer (in Abschnitt 4.3 sehen wir, dass auch andere Dinge passieren können). Je mehr Entropie in einen Körper gesteckt wird, desto mehr steigt die Temperatur (Fig. 10). Wieviel Entropie man braucht, damit die Temperatur um ein Kelvin steigt, hängt vom Stoff und der Menge des Stoffs ab. 400 Temperature / K Ethylene Glycol 360 Water 320 280 0 200 400 600 800 1000 1200 1400 Specific Entropy / J/(K·kg) Figur 10: Trägt man die Temperatur eines Materials für eine Einheitsmenge gegen die gespeicherte Entropie auf, so hat man ein sogenanntes Temperatur-Entropie-Diagramm. Man kann daraus die Temperaturänderung für eine bestimme Entropieänderung (oder umgekehrt) ablesen. 4.3 Stoffe, Stoffumwandlung und Entropie Entropie kann Stoffe nicht nur wärmer machen. Das ist zwar, was wir intuitiv von Entropie (Wärme) erwarten, aber die Erfahrung lehrt, dass noch ganz andere Dinge passieren können, 14 Mehr als Sie je über Entropie wissen wollten wenn man einem Material Entropie zuführt (wenn man Entropie abführt, dann passiert normalerweise das Umgekehrte). Einer der wichtigsten Prozesse ist die Phasenumwandlung von Stoffen. Man braucht Wärme (Entropie), um Eis zu schmelzen oder Wasser zu verdampfen. Beim umgekehrten Vorgang kommt Entropie aus den Stoffen heraus. Faszinierend dabei ist, dass während der Phasenumwandlung, während also die Entropie zu- oder abnimmt, die Temperatur des Stoffes konstant bleibt! (Fig. 11) Da die Entropie nicht das macht, was man intuitiv erwartet, hat man für die Entropie bei Phasenumwandlungen den Begriff latente Entropie eingeführt. T Evaporation Melting Water Steam Ice S Figur 11: Schmelzen von Eis und Verdampfen von Wasser. Man muss der Substanz Entropie zuführen. Dabei bleibt aber die Temperatur des Materials konstant! Das sieht man im TS-Diagramm durch die horizontalen Linien. Phasenumwandlungen gehören zu den wichtigsten Vorgängen in Natur und Technik. Atmosphäre und lebende Systeme würden nicht so funktionieren, wie wir sie kennen, wäre es nicht wegen der Eigenschaften von Wasser, Eis und Wasserdampf. In der Technik machen wir in Kraftwerken und Kühlanlagen von Phasenumwandlungen Gebraucht, und Kerzen und Eiswürfel gehören zu unserem alltäglichen Leben. 4.4 Thermische Maschinen: Motoren und Wärmepumpen Die Funktionsweise einer Wärmepumpe (oder eines Kühlschranks) wurde schon in Fig. 4 dargestellt und erläutert. Eine Wärmepumpe befördert Entropie von einem kühlen zu einem wärmeren Ort. Zum Beispiel holt man Entropie aus der Erde im Garten oder aus einem nahen Gewässer, um im Winter Gebäude zu heizen. Natürlich fliesst Entropie nicht von selber von kalt zu heiss, man muss dazu arbeiten. Das bedeutet, dass man einen antreibenden Prozess braucht, der Energie abgibt. Diese Energie treibt den unfreiwilligen Vorgang des Pumpens von Entropie an. Das geht genau wie bei einer Wasserpumpe (Fig. 12). PUMPE WÄRMEPUMPE IW,Antrieb IW2 Pel IQ Pth Pel Phydr Iq ϕ1 IV ϕ2 P1 IS IW1 P2 T1 IS T2 Figur 12: Vergleich der Funktionsweise einer Wasserpumpe und einer Wärmepumpe (Entropiepumpe). Eine Wärmekraftmaschine funktioniert umgekehrt wie eine Wärmepumpe. Hier lässt man Entropie von einem heissen Ort zu einem kühlen fliessen. Entropie wird z.B. in einem Ofen durch Verbrennung erzeugt, kommt auf hoher Temperatur in die Maschine und fliesst, bildlich ge15 Mehr als Sie je über Entropie wissen wollten sprochen, hinunter zum Kühler, wo sie die Maschine in Richtung Umwelt verlässt. Beim Hinunterfallen setzt sie Energie mit einer Rate frei, die der Temperaturdifferenz zwischen Ofen und Kühler entspricht (Fig. 13). WKM mit GENERATOR IW,elektrisch Pel IQ Pth IW, vom Ofen IW, zur Umwelt IS, vom Ofen T1 Pdiss ΠS IS, zur Umwelt T2 Figur 13: Funktionsweise einer Wärmekraftmaschine mit Generator. Entropie fliesst von hoher zu tiefer Tempe- ratur. Dabei setzt sie Energie frei. Ein Teil der freigesetzten Energie treibt den gewünschten elektrischen Prozess an. Der Rest dient dazu, zusätzlich Entropie zu erzeugen. Diese Entropie verlässt zusammen mit der aus dem Ofen die Maschine an die Umwelt. IS: Entropieströme; IQ: elektrischer Ladungsstrom; IW: Energieströme; ΠS: Entropieproduktionsrate; P: Leistung. Die grosse Frage ist nun, was mit der freigesetzten Energie passiert. Im idealen Fall steht sie vollkommen für den gewünschten Prozess, d.h. für den Antrieb einer Welle oder eines Generators zur Verfügung. Der Wirkungsgrad ist dann hundert Prozent. Aber so etwas gibt es in der Natur nicht. Hauptsächlich wegen des Entropietransportes vom Ofen zur Maschine und von der Maschine durch den Kühler an die Umwelt wird sehr viel Entropie erzeugt (Abschnitt 4.1). Eine Wärmekraftmaschine ist typischweise hochgradig dissipativ (Fig. 13). Sie funktioniert alles andere als ideal, und ihr Wirkungsgrad ist weit vom Maximum entfernt. Der Wirkungsgrad des Kraftwerkes Leibstadt ist etwa 60%. Ich habe den Wirkungsgrad der Maschine auf die natürliche Art definiert: wieviel Prozent der durch die Entropie freigesetzten Energie werden für den gewünschten Zweck eingesetzt (im Diagramm der Fig. 13 ist das das Verhältnis von Pel zu Pth). Die natürliche Art ist aber nicht die gebräuchliche. Wenn man in den Büchern und Zeitungen vom Wirkungsgrad von thermischen Maschinen liest, so hört man eine andere Zahl, und zwar das Verhältnis von der Energie, die für den gewünschten Prozess benutzt wird zur Energie, die vom Ofen kommt (im Diagramm der Fig. 13 ist das das Verhältnis von IW,elektrisch zu IW,vom Ofen). Für Leibstadt ist die Zahl dann etwa 30%. Erst seit einigen wenigen Jahrzehnten wird es unter Ingenieuren gebräuchlich, zusätzlich zur traditionellen Zahl (die man den thermischen Wirkungsgrad oder Wirkungsgrad nach dem Ersten Hauptsatz9 nennt) auch das natürliche Mass des Wirkungsgrades zu benutzten (dieses nennt man dann Wirkungsgrad nach dem Zweiten Hauptsatz). 4.5 Entropieproduktion und Optimierung Die Entropieproduktion in einer Wärmekraftmaschine, d.h. die Dissipation oder Irreversibilität, führt zu einer Verminderung des Wirkungsgrades der gewünschten Prozesse. Also ist es naheliegend, diese Verminderung, die man auch als Energieverlust bezeichnet, mit der Entropieproduktion in Verbindung zu bringen. Mehr noch, man erkennt, dass man den Wirkungsgrad erhöhen, d.h. den Energieverlust vermindern kann, wenn man die Irreversibilität verkleinern könnte. Daraus ergibt sich die Idee, Prozesse durch Verminderung der Entropieproduktion zu optimieren. 16 Mehr als Sie je über Entropie wissen wollten Wie gross der Energieverlust wegen Entropieproduktion ist, lässt sich leicht angeben. Betrachten wir das Prozessdiagramm des Kraftwerkes in Fig. 13. Die in der Maschine erzeugte Entropie muss an die Umwelt abgegeben werden. Wir wissen, dass Entropie, die aus einem System abfliesst, Energie mitnimmt, und zwar eine Menge, die von der Temperatur abhängt. Also können wir aufgrund der Grundregeln der Thermodynamik (Abschnitt 3.4) sofort den Verlustenergiestrom (oder die Verlustleistung) angeben: Verlustenergiestrom = Umgebungstemperatur · Erzeugungsrate der Entropie Zusammenfassend kann man also sagen, dass eine Regel zur Optimierung von technischen oder natürlichen Prozessen darin besteht, die Entropieproduktionsraten zu minimieren. Null machen kann man sie nicht. Also gibt es kein Maximum der Prozesse, sondern nur ein Optimum. Ingenieure machen sich diese Regel im thermischen Design zu Nutze (Bejan, 1982, 1988, 1996; Fuchs, 1996; Bejan, Tsatsaronis and Moran, 1996; Sieniuticz and de Vos, 2000). Ein Beispiel anderer Art kommt aus der Natur. Man kann sich die Atmosphäre als thermische “Windmaschine” vorstellen. Wendet man die Regel der Minimierung der Entropieproduktionsrate auf ein solches Modell der Atmosphäre an, so kommt man auf eine recht gute Abschätzung des Energieumsatzes der Winde auf unserem Planeten (Gordon and Zarmi, 1989; Fuchs, 1999). 5 Entropie und Strukturbildung Es wird oft gesagt, der Zweite Hauptsatz der Thermodynamik verbiete die spontane Strukturbildung in der Natur. Diese Interpretation beruht auf dem weit verbreiteten Unverständnis thermischer Prozesse, das durch sogenannte statistische Modelle noch verstärkt wird. Ich möchte hier kurz auseinandersetzen, dass diese Sicht der Thermodynamik nicht stimmt. 5.1 Der Zweite Hauptsatz Als ich im Physikstudium zum ersten Mal mit dem zweiten Hauptsatz konfrontiert wurde, wurden sieben verschiedene Versionen präsentiert. Diese reichen von Wärme fliesst von selbst nur von heiss zu kalt bis zu Das Integral der reduzierten Wärme über einen Prozess ist kleiner oder gleich Null.10 Wie soll uns dabei klar werden, ob sie alle das Selbe bedeuten (wahrscheinlich tun sie es nicht), wie sie zusammenhängen, und ob sie zu einer einzigen Aussage integriert werden könnten? Für mich entsteht der Eindruck eines heillosen Durcheinanders, das einer Wissenschaft, die einigermassen konsolidiert sein soll, unwürdig ist. Wir beginnen zu spüren, dass es schwierig sein könnte, die Frage nach der Möglichkeit von Evolution mit Hilfe der Thermodynamik schlüssig zu beantworten. Tatsächlich sind die verschiedenen Formen des klassischen Zweiten Hauptsatzes verschiedene Folgerungen aus mehreren Ideen, die man in der modernen Thermodynamik als Grundannahmen nimmt. Dazu gehören die Entropiebilanz (Wärmebilanz, Abschnitt 3.6), dann der Zusammenhang zwischen Entropie und Energie (Abschnitt 3.3 - Abschnitt 3.5), und schliesslich noch die fundamentale Beobachtung, dass Wärme (Entropie) von selber nur von wärmeren zu kälteren Stellen fliesst. Welche Annahmen sind also gemeint, wenn behauptet wird, der Zweite Hauptsatz verbiete die spontane Entstehung und Entwicklung von Strukturen? Hier hilft ein anderes, weit verbreitetes Modell thermischer Vorgänge weiter. Spätesten seit Ru- 17 Mehr als Sie je über Entropie wissen wollten dolf Clausius (etwa um 1850) werden Wärmephänomene mit der “regellosen Bewegung kleiner Teilchen” in Verbindung gebracht. Auf dieser Vorstellung bauen die sogenannten statistischen Modelle thermischer Vorgänge auf. Entropie wird statistisch gedeutet. Sie ist in diesen Modellen ein Mass für die Zahl der möglichen Zustände oder Anordnungen der “kleinen Teilchen”. Je mehr Möglichkeiten es gibt, um so höher ist die Entropie. So ist zum Beispiel die mögliche Zahl der Anordnungen eines Gases doppelt so gross, wenn es sich—bei gleicher Temperatur—in einem doppelt so grossen Gefäss befindet. Die Gasteilchen haben doppelt so viel Platz. Ludwig Boltzmann führte Ende des 19. Jahrhunderts als formales Mass für die Entropie den Logarithmus dieser Zustandszahl—die man auch Wahrscheinlichkeit nennt—ein. Also muss bei einem einfachen Gas die Entropie proportional zu ln(2) zunehmen, wenn das Volumen des Gases bei gleicher Temperatur verdoppelt wird. Das gleiche Ergebnis ergibt sich aus der Wärmelehre, wo wir Entropie ja als das Mass für die Wärmemenge verstehen. Diese sehr formale Definition wird dann im Alltag salopp als “Mass für die Unordnung” umschrieben. Also bedeutet mehr Entropie mehr Unordnung, und Entropieproduktion bedeutet Erschaffung von Unordnung. Es wird also kühn behauptet, der Zweite Hauptsatz lasse nur die spontane Erzeugung von mehr Unordnung zu (siehe auch Abschnitt 5.3). 5.2 Beispiele dissipativer Prozesse Die Wirklichkeit zeigt, dass bei diesen Interpretationen etwas nicht stimmen kann. Strukturbildung findet auch heute noch statt—wir können sie auf jeden Fall wunderbar in physikalischen Situationen beobachten—und sie läuft immer in hochgradig dissipativen Prozessen ab. Das heisst, dass Strukturbildung und Entropieproduktion (Wärmeproduktion) Hand in Hand gehen. Nehmen wir nur mal das schon vorher erwähnte Beispiel der Erdatmosphäre. Sie ist alles Andere als ein total gleichförmiges, gut durchmischtes und totes Gebilde. In ihr laufen ständig Prozesse der Strukturbildung ab (Hochdruck- und Tiefdruckgebiete, Winde, Wolken). Dabei wird auch immer durch Reibung und durch Wärmetransporte sehr viel Entropie erzeugt. Das Selbe gilt für ein einfacheres System einer dünnen Schicht von Öl, die in einer Pfanne langsam von unten erwärmt wird, und in der dann schöne, gleichmässige Rollen und Zellen entstehen (Fig. 14; die Form der Zellen hängt von der Bodenbeschaffenheit der Pfanne ab). Figur 14: Rayleigh-Benard Zellen (pictures: http://www.etl.noaa.gov/eo/pdf/RBCells.html). Seit einigen Jahrzehnten kennt man Strukturbildung auch bei chemischen Reaktionen. Wir kennen chemische Reaktionen hauptsächlich so, dass sie in eine Richtung ablaufen und dann aufhören. Unter bestimmten Bedingungen können Reaktionen auch oszillieren, und Wellen erscheinen bei bestimmten Reaktionstypen (Fig. 15). 18 Mehr als Sie je über Entropie wissen wollten Figur 15: Belousov-Zhabotinsky Reaktion mit Wellenphänomen (online.redwoods.cc.ca.us/instruct/darnold/ DEProj/Sp98/Gabe/bzreact.htm). Alle diese Phänomene laufen irreversibel, das heisst, mit Entropieproduktion ab. Woher kommt denn die Vorstellung, dass die Gesetze der Thermodynamik mit ihrer Entropie und der Entropieproduktion keine (spontane) Strukturbildung zulassen? 5.3 Prozesse in geschlossenen und offenen Systemen Eine berühmte Formulierung des alten Zweiten Hauptsatzes ist die Aussage von Clausius, dass die Entropie der Welt nur zunehmen kann. Wenn wir Entropie als Mass für Unordnung nehmen (was man mit Vorsicht geniessen muss), dann hiesse das, dass in der Welt die Unordnung nur zu- aber nicht abnehmen kann. Wir brauchen nicht die ganze Welt, um zu verstehen, was gemeint ist. Schliesst man ein Objekt in ein Gefäss ein, das wärmeundurchlässig ist (also keine Entropie durchlässt), so kann die Entropie im Innern wegen Entropieproduktion nur zunehmen; Abnahme gibt es nicht, weil man Entropie nicht zerstören kann. Soweit ist die Wurzel der Aussage verständlich. Nur hat die Anwendung auf allgemeine Systeme eine entscheidende Schwachstelle: Systeme sind nicht geschlossen. Normalerweise erlauben Systeme den Austausch von Entropie mit der Umwelt durch die bekannten Formen der Entropietransporte (Abschnitt 4.1). Darum ist es im speziellen Fall für ein System durchaus möglich, seine Entropie zu vermindern. Es muss einfach die zugeführte und die produzierte Entropie (und noch ein bisschen mehr) nach aussen abgeben. So ist zum Beispiel die Erde ein weit offenes System. Wir empfangen mit der Sonnenstrahlung viel Energie mit wenig Entropie (die Temperatur der Sonnenstrahlung ist sehr hoch, etwa 6000 K). Also kann sehr viel Energie freigesetzt werden, die für ganz verschiedene Prozesse—physikalische, chemische und biologische—zur Verfügung steht. Dabei wird sehr viel Entropie produziert, fast 20 mal so viel, wie von der Sonne kommt. (Diese Zahl kommt daher, dass die Temperatur auf der Erdoberfläche, wo alle diese Prozesse ablaufen, mit 300 K etwa 20 mal kleiner ist als auf der Sonnenoberfläche.) Die ganze Entropie, empfangene wie produzierte, wird mit der Wärmestrahlung der Erde wieder ans Weltall abgegeben. In diesem von sehr viel freisetzbarer Energie durchfluteten offenen System finden offensichtlich die interessantesten strukturbildenden Prozesse statt. Die Entropie muss nicht einmal abnehmen, damit Strukturen gebildet werden. Ein kalter Leichnam hat weniger Entropie als der selbe lebende Körper. Sterne sind im Innern heiss und produzieren viel Entropie, und trotzdem laufen Prozesse der Strukturbildung ab. Wenn die Erdoberfläche viel kälter wäre, wäre die Entropie unserer Welt viel kleiner, aber es gäbe kein Leben. Was es braucht, sind offene Systeme und freisetzbare Energie; d.h. es braucht Spannun- 19 Mehr als Sie je über Entropie wissen wollten gen (Temperaturdifferenzen und andere Differenzen). Solange es sie gibt, läuft das Räderwerk der Natur. Als Symbol für diese Idee können wir das aus der ägyptischen Mythologie stammende Bild nehmen, in dem der Himmel über der Erde aufgespannt wird (Fig. 16). Figur 16: In der ägyptischen Mythologie trennt Shu (Luft) Nut (Himmel) und Geb (Erde). Der Himmel muss un- terstützt werden, damit er nicht einstürzt. http://www.civilization.ca/civil/egypt/egcrgg1e.html Sich die Entwicklung und die Zukunft der Natur und des Universums von diesem Gesichtspunkt her anzusehen, hat durchaus seinen Reiz. Es sieht beinahe so aus, als hätten wir es mit einem einmal—wir würden heute sagen: im Big Bang—aufgezogenen Uhrwerk zu tun. Langsam entspannt sich die Feder. Das Universum wird grösser, erhält mehr und mehr Entropie, und wird dabei noch kälter. Allerdings ist das Universum nicht homogen. Lokal, um Sterne herum, haben wir Zentren hoher Temperatur, die als Strahlungsquellen hochwertiger Energie (Energie mit wenig Entropie, d.h. bei hoher Temperatur) dienen. Um diese Zentren bilden sich auf Planetenoberflächen offene Systeme, auf denen Strukturbildungen ablaufen. Und auf einem davon sitzen wir, und versuchen immer noch, den Zweiten Hauptsatz zu verstehen… 6 Thermodynamik, Ökologie und Ökonomie Dass Thermodynamik auf physikalische und damit auch technische Systeme anwendbar ist, versteht sich von selbst. Schliesslich wurde die Wissenschaft der Wärme dort begründet. Wenn wir Chemie und Biologie auch noch zu den allgemeinen Naturwissenschaften zählen, so dürfen wir annehmen, dass Thermodynamik auch dort gelten muss. Mit der Biologie wird es für uns aber eventuell schon schwieriger zu akzeptieren, dass die Gesetze der Thermodynamik gleich wie bei anderen Vorgängen gelten sollen. Die Debatte um (biologische) Evolution und den Zweiten Hauptsatz legt davon Zeugnis ab. Wie viel schwieriger muss es da sein, anzunehmen, dass thermische Gesetze auch auf die von Menschen gestaltete Welt, z.B. unsere Wirtschaft, anwendbar sein soll. Es ist darum spannend zu sehen, dass das Interesse von Ökologen und Ökonomen an der Thermodynamik in den letzten Jahren stetig gewachsen ist. 20 Mehr als Sie je über Entropie wissen wollten 6.1 Nochmals der Zweite Hauptsatz: Wert der Energie Es gehört zu den tragikomischen Aspekten der traditionellen Thermodynamik, dass man sie zwar für sehr wichtig aber gleichzeitig für fast unzugänglich hält. Ein Verständnis des Begriffes Entropie wird für schwierig bis unmöglich gehalten. Darum versucht man alles, diesen Begriff zu umgehen und trotzdem zu einem Verständnis der wichtigen Zusammenhänge zu kommen. Zu einem dieser Versuche, Thermodynamik ohne Entropie zu verstehen, gehört die Idee des Wertes der Energie. Ich habe oben in Abschnitt 5.3 auch kurz von hochwertiger Energie gesprochen. Man hört oft, der Erste Hauptsatz (ein Spezialfall der Energiebilanz) habe mit der Menge an Energie zu tun, während der Zweite Hauptsatz vom Wert der Energie spreche. So sagt man, (1) die Energie, die in Badewasser steckt, habe wenig Wert, (2) die Energie einer Flamme aber viel, (3) elektrische Energie sei sehr wertvoll, (4) durch Reibung vermindere sich der Wert der Energie. Mit unserem einfachen Verständnis von physikalischen Vorgängen und der Entropie (Wärmestoff) können wir diese Aussagen verstehen. Es geht im Wesentlichen um ein Mass, was man mit Energie anfangen kann, wieviel von dem, was man kriegt, oder wofür man zahlt, nutzbar eingesetzt werden kann. Mit anderen Worten: es geht um die freisetzbare Energie, nicht um Energie an sich. Hier sind die Erklärungen der oben gemachten Aussagen. (1) Energie in lauwarmem Wasser kann nicht weit genutzt werden. Wenn wir mit dem warmen Wasser eine Wärmekraftmaschine antreiben, so wird sie, wegen der kleinen Temperaturdifferenz zur Umwelt, nur einen sehr kleinen thermischen Wirkungsgrad haben. Anders gesagt, die Entropie im Wasser kann nur eine kleine Differenz durchfallen, also nur wenig Energie freisetzen. Noch anders gesagt, pro gespeicherter Energiemenge ist auch viel Entropie gespeichert. (2) Für die Flamme gilt natürlich das Gegenteil. Ihre Temperatur ist sehr hoch. Die Entropie, die in der Flamme erzeugt wird, kann eine grosse Temperaturdifferenz durchfallen. Aus der Flamme kommt Energie mit relativ wenig Entropie, ähnlich wie bei Sonnenlicht. (Dann ist es aber natürlich eine Verschwendung, mit Feuer Wasser warm zu machen.) (3) Alle elektrisch zugeführte Energie ist in einem System nutzbar, d.h. freisetzbar. Energie, die mit Elektrizität zugeführt wird, kommt ohne Entropie. Also haben wir viel Energie mit wenig (keiner) Entropie. (4) Um Entropie zu produzieren, wird ein Teil freisetzbarer Energie “verbraucht”. Da die Entropie an die Umgebung abgegeben werden muss, geht auch die dafür verwendete Energie “verloren”. Wie schon vorher besprochen, sollte Entropieproduktion wenn immer möglich minimiert werden. Die hier diskutierten Aspekte haben eine direkte ökonomische Bedeutung. Energie, die wir mit Elektrizität beziehen, ist im Allgemeinen etwa drei mal so teuer wie Energie, die wir aus der Verbrennung von Brennstoffen erhalten. (Eine Kilowattstunde Energie aus Erdöl kostet heute etwa 4 Rappen; eine Kilowattstunde elektrische Energie etwa 10 bis 15 Rappen.) Wir können verstehen, warum das so ist. Wenn wir fossile Brennstoffe in einem Kraftwerk verfeuern, um elektrische Energie zu erhalten, werden zwei Drittel der bei der Verbrennung freigesetzten Energie mit der erzeugten Entropie an die Umwelt gehen. Nur ein Drittel treibt den elektrischen Prozess im Generator an. Die Diskussion um den “Wert der Energie” kann verkürzt auf folgenden Nenner gebracht werden. Nur freisetzbare Energie hat für uns eine Bedeutung. Um Energie freizusetzen braucht es Potentialdifferenzen (Niveaudifferenzen wie z.B. Temperaturdifferenzen, Druckdifferenzen, Differenzen des chemischen Potentials, etc.). Was wir brauchen sind “Spannungen”. Die Sonne erzeugt solche an der Erdoberfläche. In Maschinen machen wir die Natur nach, indem wir 21 Mehr als Sie je über Entropie wissen wollten Spannungen künstlich erzeugen. Es ist fast wie in der ägyptischen Mythologie, wo davon gesprochen wird, dass der Himmel unterstütz werden muss, damit er nicht einstürzt. Solange er oben bleibt, funktioniert die Welt (Fig. 16). 6.2 Ökonomen, Ökologen und die Thermodynamik Thermodynamische Prinzipien in der Ökonomie oder Ökologie zu benutzen ist ein relativ junges Unterfangen. Darum sind die Prinzipien auch noch alles andere als klar. Ich möchte hier zwei Autoren oder Autorenteams sprechen lassen. Zuerst ein Abschnitt aus dem Vorwort eines Buches von Faber, Niemes und Stephan (1995): Since the notion of entropy is very difficult to understand and at the same time of central importance for our approach, we devote the larger part of Chap. 3 to its introduction It is well known that economics has been strongly influenced by classical mechanics for about a century. The development of thermodynamics since the beginning of the nineteenth century, however, has remained largely unnoticed by economists (cf. MIROWSKI 1984). For this reason we have chosen to present in detail the thermodynamic relationships that are of importance for us. We hope that in this way we can highlight the difference between classical mechanics and thermodynamics. Thermodynamic processes are irreversible and thus process-dependent with respect to time; CLAUSIUS noticed this temporal aspect and introduced the notion of entropy, which stems from the Greek verb “turn over” (turn back, change). It can be argued that it was from classical mechanics that economists derived the attitude that economic processes are fully controllable once they have been fully described. Thus, in many models of growth theory the initial conditions and the growth rate suffice for a determination of the values of all variables at all times. The study of thermodynamic processes, however, shows that there are also uncontrollable variables in addition to controllable ones. Economists, of course, have noticed this, too. Wie üblich wird betont, wie schwierig das Entropiekonzept sein soll. Und schliesslich wird in den letzten Sätzen ein typisches Missverständnis zementiert, dass nämlich die Thermodynamik unkontrollierbare Aspekte in die Prozesse hineinbringe, im Gegensatz zur Mechanik, in der alles berechenbar und kontrollierbar sei. Wir haben heute ein anderes Verständnis dynamischer Systeme. Unkontrollierbarkeit, Chaos, gibt es schon in einfachen mechanischen Systemen, und thermische Prozesse sind nicht mehr und nicht weniger kontrollierbar als die mechanischen. Ein Autor, der sehr viel Konstruktives für die Integration von Thermodynamik mit anderen Gebieten getan hat, ist Matthias Ruth. Er und seine Mitarbeiter haben viele interessante dynamische Modelle entwickelt, die versuchen, die Bedeutung thermischer Prozesse in natürlichen und ökonomischen Systemen aufzuzeigen. Aus dem Vorwort zu seinem Buch über die Integration von Ökonomie, Ökologie und Thermodynamik (1993): Economies are open systems embedded in an ecosystem with which they exchange matter and energy. Interactions among these systems are vital for each system's performance and are constrained by the laws of physics. This volume pays tribute to economyenvironment interactions simultaneously from an economic, ecological and physical perspective. Integrating Economics, Ecology and Thermodynamics provides a first step in identifying and combining the principles of economics, ecology and thermodynamics on a fundamental level. Part I lays out the general context for the approach chosen. 22 Mehr als Sie je über Entropie wissen wollten Part II familiarizes readers with core concepts of, and methods used in, the three disciplines of economics, ecology and thermodynamics. Part III assesses ways in which these disciplines can be integrated to provide an improved understanding of economy-environment interactions. Part IV illustrates the integration of the three disciplines with a dynamic model of a human community interacting with its environment. In Part V the volume closes with a brief summary and a set of conclusions on the relevance of integrated, interdisciplinary approaches to economy-environment interactions. Zwei weitere Beispiele deuten darauf hin, dass unsere Schwierigkeiten mit der Thermodynamik auf die Diskussion ihrer Integration mit Ökonomie und Ökologie abfärben. Unverständnis führt zu Unzufriedenheit mit dem, was die Physik an Prinzipien zu bieten hat, also erfindet man neue. Das ist natürlich legitim, so hat sich schliesslich die ganze Wissenschaft entwickelt. Allerdings stellt sich in den beiden folgenden Beispielen die Frage, ob diese Theoriebildung tatsächlich nötig ist, oder ob sie überhaupt stimmen kann. Der bedeutende Ökologe T. H. Odum hat vor einigen Jahren ein Mass für eine Grösse eingeführt, die viel mit dem oben diskutierten “Wert der Energie” zu tun hat (Odum, 1995). Er nennt dieses Mass Emergie. Er hat es eingeführt, um den Weg der Energie von der Sonne durch ökologische und soziale Systeme zu beschreiben. Wir beobachten, dass in der Biosphäre immer komplexer geordnete Teilsysteme entstehen. Ein höher geordnetes System lebt von einem einfacheren. Bei jedem Schritt von einem einfacheren zu einem komplexeren System geht ein Teil der vom einfacheren System genutzten Energie “verloren”. In höheren und höheren Stufen steckt also ein immer kleinerer Prozentsatz der ursprünglich von der Sonne zur Verfügung gestellten Energie. Odum sagt das so: Emergy (spelled with an "m") evaluates the work previously done to make a product or service. Emergy is a measure of energy used in the past and thus is different from a measure of energy now.11 Der Gedanke ist wichtig. Wahrscheinlich genügt es aber, an Stelle von Emergie die Entropieproduktion heranzuziehen, um das zu quantifizieren, was Odum meint (siehe auch Abschnitt 6.3). Eine andere Beobachtung führte den Ökonomen N. Georgescu-Roegen (1906-1994) dazu, einen Vierten Hauptsatz der Thermodynamik zu postulieren.12,13 Wenn wir Substanzen wie Erze aus der Erdkruste abbauen und technisch nutzbar machen, so verteilen sich diese Substanzen mit der Zeit immer mehr. Waren sie ursprünglich konzentriert in der Erde vorhanden, so sind sie nun zerstreut, d.h. dissipiert. Diese “Zerstreuung” wird mit der Zerstreuung von Energie bei der Erzeugung von Wärme (Entropie) verglichen. So wie Entropie (als Mass für mehr “Zerstreuung”) nicht wieder vernichtet werden kann, so soll der Vierte Hautsatz aussagen, dass wir die Zerstreuung von Stoffen nie wieder rückgängig machen können. Das stimmt zwar in hohem Masse praktisch, ist aber von einem fundamentalen Punkt aus einfach falsch. Gerade die lebende Natur kann zerstreute Substanzen wieder konzentrieren. Denken Sie nur an die Anreicherung von Schwermetallen in der Nahrungskette: Schwermetalle, die wir in die Weltmeere kippen, und die dort sicher nur sehr verdünnt vorkommen, landen im Fisch angereichert wieder auf unseren Tellern. Wir müssen kein spezielles thermodynamisches Gesetz postulieren, um unsere Probleme mit der Dissipation von Substanzen in der Natur zu verstehen. 6.3 Eine Idee: Entropieprodiktion besteuern Vielleicht ist diese Idee unpraktisch, aber sie macht für mich Sinn: man sollte Entropieproduktion besteuern oder die Minimierung der Entropieproduktion (wirtschaftlich) belohnen. Wir haben gesehen, dass die Optimierung von Prozessen mit einer Minimierung der Dissipation 23 Mehr als Sie je über Entropie wissen wollten einher geht. Optimale Prozesse dürften sowohl für die Natur als auch für unsere Gesellschaft von Vorteil sein. Ohne Entropieproduktion könnte die von der Sonne gelieferte Energie vollständig in der Kette von Systemen weiter gereicht werden. Die Entropieproduktion beziffert also den “Verlust” von Schritt zu Schritt, womit wir auch Odums (1995) Idee des Energieaufwandes für ein Produkt verstehen, und was dann noch an Energie nach einer Reihe von Schritten vorhanden ist. Als Beispiele möchte ich die Bereitstellung von warmem Wasser und die elektrische Erzeugung von Licht besprechen. Warmes Wasser und Licht sollen dabei mit verschiedenen Technologien erzeugt werden. Warmes Wasser. Um einen Liter Wasser von 20°C auf 100°C zu erwärmen, braucht es ziemlich genau 1000 Ct Entropie (ich neheme den Namen von Carnot = Ct für die Entropieeinheit). Erzeugt man die nötige Entropie durch die Verbrennung eines Brennstoffs oder durch eine elektrische Heizung, so müsste man also Steuern auf 1000 Ct erzeugte Entropie zahlen. Falls wir nun den Liter Wasser mit 100°C in einem thermischen Sonnenkollektor erzeugten, so würden wir tatsächlich durch diesen technischen Prozess etwa 150 Ct weniger Entropie erzeugen, als das Sonnenlicht ohne uns auf der Erdoberfläche erzeugen würde. Diese Zahl kommt folgendermassen zsutande. Bei der Erwärmung von einem Liter Wasser von 20°C auf 100°C fliessen 336 kJ (Kilojoule) Energie mit der Entropie ins Wasser. Wenn soviel Energie—mit der Sonnenstrahlung zu uns gebracht—auf der Erdoberfläche dissipiert würden, so würden 336000 J / 293 K = 1150 Ct Entropie erzeugt. Das Sonnenlicht hat im Kollektor aber 1000 Ct für die Erwärmung des einen Liters Wasser erzeugt. Also haben wir 150 Ct Entropieproduktion “gespart”. Falls wir die Entropieproduktion durch Absorption von Sonenlicht auf der Erde als “normal” annehmen, so könnten wir für die 150 Ct Einsparung Steuern zurück fordern. Falls wir nun die Energie, die wir für die Wärmeerzeugung für unser Wasser brauchen, durch Photovoltaik bereit stellen wollen, so werden wir sogar 1150 Ct weniger an Entropie als die Erde erzeugen. Im ersten Moment könnten wir also für eine grosse Einsparung belohnt werden. Wenn wir dann aber mit der Elektrizität einen Liter Wasser wie vorher erwärmen, so erzeugen wir 1000 Ct, womit wir wieder bei einer gesamten Einsparung von 150 Ct sind. Nun könnten wir aber ganz clever sein, und die Elektrizität für den Betrieb einer Wärmepumpe für die Erwärmung unseres Wassers einsetzen. Mit einer vollkommen idealen Wärmepumpe (die es natürlich nicht gibt), könnten wir einige Liter Wasser von 20°C auf 100°C erwärmen, ohne mehr Entropie zu erzeugen. Im Vergleich zum Vorgehen, bei dem Brennstoffe eingesetzt werden, wäre die Verminderung der Entropieproduktion also sehr gross. Elektrisches Licht. Vergleichen wir einmal zwei verschiedene Methoden der Bereitstellung einer Energiemenge, die man braucht, um eine 100 W Glühbirne eine Stunde lang brennen zu lassen. Bei einem Kraftwerk wie Leibstadt werden etwa 2400 Ct Entropie erzeugt, damit wir die nötigen 0.1 kWh Energie für die Glühbirne kriegen. Bei einem der solaren Parabolrinnenkraftwerke in der Wüste Kaliforniens würden aber 1200 Ct weniger Entropie entstehen, als ohne das Kraftwerk von der Erde erzeugt würden! Der Unterschied ist also volle 3600 Ct, der Steuerunterschied also entsprechend gross. Falls wir die Entropieproduktion in der Glühbirne noch besteuern, so wäre das Resultat für jemanden, der die Elektrizität von Leibstadt bezieht, 3600 Ct erzeugte Entropie, für jemanden, der die Elektrizität vom solaren Kraftwerk hat, aber gerade Null. Kosten für die Anlagen. Natürlich muss man die Besteuerung von Entropieproduktion von den Kosten der Energieproduktion in den verschiedenen Anlagen unterscheiden. Zusammen erge24 Mehr als Sie je über Entropie wissen wollten ben die beiden Gesichtspunkte dann die Kosten für die Verbraucher und Verbraucherinnen. Bereitstellung von Elektrizität durch Photovoltaik ist immer noch sehr teuer, was zum Teil “Energiekosten” und damit vorhergehende Entropieproduktion reflektiert. Eine sinnvolle ökologische Steuerpolitik muss mehr Gesichtspunkte berücksichtigen, als ich mit diesen beiden Beispielen diskutieren konnte. 7 Zusammenfassung und Ausblick Thermodynamik ist nicht schwieriger zu verstehen als die einfachen hydraulischen oder elektrischen Prozesse. Gestützt auf Metaphern und Alltagsvorstellungen kann man eine feste Grundlage für ein intuitives, qualitatives und gleichzeitig formales Verständnis thermischer Vorgänge aufbauen. Wärme—die sich als die abstrakte Grösse Entropie entpuppt—vergleichen wir mit Wasser oder elektrischer Ladung, und Temperatur entspricht in ihrer Funktion dem Druck oder dem elektrischen Potential. So ausgerüstet können wir Modelle dynamischer thermischer Prozesse erstellen, die Prozesse durchrechnen und viel über sie lernen. Wärme (Entropie) hat eine wichtige Eigenschaft, die nicht jede der ihr analogen Grössen hat. Sie kann erzeugt aber nicht wieder vernichtet werden. Damit widerspiegelt und quantifiziert sie das, was wir Irreversibilität oder Dissipation nennen. Entropieproduktion begleitet fast alle Prozesse, sie ist unvermeidlich. Man kann Prozesse aber optimieren, indem man die Entropieproduktion minimiert. Mit dieser Idee ergeben sich mögliche Strategien für intelligente technische, ökologische und ökonomische Handlungen. Neben dem hier hauptsächlich verwendeten makroskopischen Modell thermischer Phänomene gibt es auch ein mikroskopisches. Darin erscheint die Entropie als Wahrscheinlichkeit oder als Mass für die Zahl mikroskopischer Zustände eines Systems. Da diese Vorstellung sehr oft salopp als Unordnung übersetzt wird, erhält man den Eindruck, in der Welt könne nur Unordnung spontan wachsen. Das wird dann als Argument gegen die Möglichkeit spontaner Entstehung von Strukturen verwendet. Das ist aber ein Missverständnis der Eigenschaften der Entropie und von Systemen. Falls nötig kann man Entropie aus Systemen entfernen (die Erde tut das mit der von ihr weggehenden Infrarotstrahlung). Überhaupt entstehen Strukturen in sogenannten offenen Systemen, die von viel freisetzbarer Energie durchflutet werden. Energie ist freisetzbar, wenn es Niveauunterschiede gibt. Solange es sie gibt, läuft die Maschine der Natur. Im Universum sind die Umgebungen von Sternen die Orte, wo mit Hilfe der Strahlung, die viel “wertvolle” Energie mit sich bringt, Niveauunterschiede aufrecht gehalten werden. An einem dieser Orte, auf der Erdoberfläche, leben wir. 25 Mehr als Sie je über Entropie wissen wollten Anmerkungen 1 Es gibt vermutlich keinen anderen Begriff aus der Physik, der häufiger in allen möglichen und unmöglichen Zusammenhängen verwendet wird, als Entropie. Von mathematischen und statistischen Abhandlungen oder Informationstheorie (wo Entropie etwas anderes bedeutet), über Management-Theorien (wo nicht klar ist, was Entropie bedeutet), über Religion bis hin zu Esoterik (wo man sich fragt, ob sie überhaupt etwas bedeuten kann) findet man Einträge im Internet. Es gibt sogar dot-com Websites, die Entropie im Namen verwenden. Man muss sich mal vorstellen, das Selbe würde über elektrische Ladung gemacht und geschrieben! http://www.math.psu.edu/gunesch/entropy.html http://www.2ndlaw.com/, http://www.entropylaw.com/ http://www.entropy.ch/home/ http://www.icr.org/pubs/imp/imp-141.htm http://www.charleswood.ca/reading/evolution.php http://www.geocities.com/satanicreds/entropy.html http://www.entropyzero.org/ 2 Das Wort Wärme wird verschieden gebraucht. Für uns sind die Alltagsbedeutung und die offizielle thermodynamische (aus der traditionellen Darstellung der Physik, TP) wichtig. Im Alltag verwenden wir das Wort Wärme am ehesten im Sinne einer fluiden Substanz. In TP wird Wärme im Sinne der bei Heizen und Kühlen übertragenen Energie gebraucht. Die beiden Benutzungsarten schliessen sich gegenseitig aus. Man muss also wissen, mit wem man spricht, und wovon man spricht, wenn man das Wort Wärme verwendet. 3 Was für Entropie gilt, gilt auch für den Zweiten Hauptsatz der Thermodynamik (im Zweiten Hauptsatz werden hauptsächlich Eigenschaften der Entropie zusammengefasst). Um ihn ranken sich mehr Fabeln und Missverständnisse als tatsächlich Brauchbares. Entsprechend zeigt sich denn auch ein verwirrendes Bild, zum Beispiel bei Internet Einträgen. Natürlich sind (die meisten) Beschreibungen des Zweiten Hauptsatzes in der Physik und Technik sauber. Sie befinden sich aber auf einem so hohen Abstraktionsniveau, dass kein brauchbares Alltagsverständnis daraus entstehen kann. 4 In bestimmte Kreisen wird der Zweite Hauptsatz als wissenschaftlicher Zeuge dafür bemüht, dass es keine (biologische) Evolution geben kann. Siehe z.B. http://www.icr.org/pubs/imp/imp-141.htm. 5 Lehrbücher, die eine moderne Darstellung der Thermodynamik geben, stammen von Herrmann (1993-2002, insbesondere Band I), Fuchs (1996), Borer et al. (2000). 6 Auf der CD ISLE_IV_Movies sind viele kleine Filme zu verschiedenen thermischen Phänomenen zu finden. Die Filme stammen von Fuchs, Ecoffey und Schütz (2002). 7 Es gibt Untersuchungen, die zeigen, dass kleine Kinder (im Alter vor etwa 7 oder 8 Jahren) zwischen Wärme und wie warm etwas ist, unterscheiden. Diese Unterscheidung geht dann verloren. Erst später, durch bewusste Schulung, erfährt man wieder vom Unterschied, der aber im Alltag für viele Menschen verschwommen bleibt. Siehe Strauss (1981), Strauss and Stavy (1982). 8 Untersuchung durchgeführt im 4. Semester des Studiengangs Journalismus und Organisationskommunikation, im Frühjahr 2004. 9 Der Erste Hauptsatz der Thermodynamik ist ein Spezialfall der allgemeinen Energiebilanz. In moderner Form könnten wir diese allgemeine Form als Ersatz für den klassischen Ersten Hauptsatz nehmen. 10 Einige Formen des klassischen Zweiten Hauptsatzes der Thermodynamik: (1) Wärme kann von selbst nur von einem wärmeren zu einem kälteren Körper fliessen. (2) Wärme kann von einem kälteren auf einen wärmeren Körper nur unter Aufwand mechanischer Arbeit übertragen werden. (3) Wärme kann nur dann in Arbeit umgewandelt werden, wenn zugleich ein Teil der Wärme von einem wärmeren auf einen kälteren Körper übergeht. (4) ∫δQrev/T ≤ 0. (5) In der direkten Umgebung jedes Gleichgewichtszustandes eines thermodynamischen Systems gibt es andere Zustände, die nicht durch adiabatische Prozesse von einem gegebenen Zustand aus erreicht werden können. (6) Die Entropie der Welt kann nur zunehmen. (7) Microsoft Encarta: The second law of thermodynamics gives a precise definition of a property called entropy. Entropy can be thought of as a measure of how close a system is to equilibrium; it can also be thought of as a measure of the disorder in the system. The law states that the entropy—that is, the disorder—of an isolated system can never decrease. Thus, when an isolated system achieves a configuration of maximum entropy, it can no longer undergo change: It has reached equilibrium. Nature, then, seems to 'prefer' disorder or chaos. It can be shown that the second law stipulates that, in the absence of work, heat cannot be transferred from a region at a lower temperature to one at a higher temperature. The second law poses an additional condition on thermodynamic processes. It is not enou- 26 Mehr als Sie je über Entropie wissen wollten gh to conserve energy and thus obey the first law. A machine that would deliver work while violating the second law is called a 'perpetual-motion machine of the second kind,' since, for example, energy could then be continually drawn from a cold environment to do work in a hot environment at no cost. The second law of thermodynamics is sometimes given as a statement that precludes perpetual-motion machines of the second kind. Da dies alles verschiedene mögliche Schlussfolgerungen aus mehreren Grundannahmen sind, kann man kaum eine einzige Formulierung als modernen Ersatz des Zweiten Hauptsatzes anbieten. Falls wir dabei bleiben wollen, einen Zweiten Hauptsatz zu verwenden, so würde ich die Entropiebilanz als Kandidatin vorschlagen. Sie deckt alleine aber natürlich nicht all die verschiedenen klassischen “Zweiten Hauptsätze” ab. 11 Internet Ressourcen: http://dieoff.org/page170.htm und http://dieoff.org/page17.htm. Siehe auch Jorgensen (2001). 12 In der Physik gibt es noch den Dritten Hauptsatz der Thermodynamik. Er besagt in etwa, dass der Entropieinhalt von perfekten kristallinen Materialien beim absoluten Nullpunkt der Temperatur Null sein muss. 13 Internet Ressourcen: http://www.geocities.com/combusem/ENTROPY.HTM; http://www.ihdp.uni-bonn.de/ html/publications/reports/report12/AppIV.htm. Literaturverzeichnis Bejan A. (1982): Entropy Generation Through Heat and Fluid Flow. John Wiley & Sons, New York. Bejan A. (1988): Advanced Engineering Thermodynamics. John Wiley & Sons, New York. Bejan A. (1996): Entropy Generation Minimization. The Method of Thermodynamic Optimization of Finite-Size Systems and Finite-Time Processes. CRC Press, Boca Raton. Bejan A., Tsatsaronis G., Moran M. (1996): Thermal Design and Optimization. John Wiley & Sons, New York. Borer T., P. Frommenwiler, H.U. Fuchs, H. Knoll, G. Kopacsy, W. Maurer, E. Schütz, K. Studer, U. Walker (2000): Physik: Ein systemdynamischer Zugang für die Sekundarstufe II. Sauerländer, Aarau. Callendar H. L. (1911): The caloric theory of heat and Carnot’s principle. Proc. Phys. Soc. (London) 23, 153–189. Carnot S. (1824): Refections on the Motive Power of Fire. Translated by R. H. Thurston, Dover Publications, New York, 1960. Clausius R. (1850): Über die bewegende Kraft der Wärme und die Gesetze, welche sich daraus für die Wärmelehre selbst ableiten lassen. Poggendorff’s Analen der Physik, 79. Faber M., Niemes H., Stephan G. (1995): Entropy, Environment and Resources. Second edition, Springer-Verlag. Fuchs H. U. (1987): Thermodynamics - A ‘misconceived’ theory. In J.D. Novak ed., Proceedings of the Second International Seminar on Misconceptions in Science and Mathematics (Cornell University, Ithaca, New York, 1987), Vols. I-III. Vol.III, p.160-167. Fuchs H. U. (1996): The Dynamics of Heat. Springer-Verlag, New York. Fuchs H. U. (1999): Optimization in a Simple Model of the Earth’s Atmosphere. Paper presented at the Department of Physics Didactics, University of Karlsruhe. http://home.zhwin.ch/~fuh/LITERATURE/Literature.html Fuchs H. U. (2004): Metaphern, Vorstellungskraft und Symbole: Fundamente des Fromalen Denkens. Aufsatz aus der Reihe Physik und Evolution, Studiengang JO, Zürcher Hochschule Winterthur, Winterthur. Fuchs H. U. (2004b): Mythos und Romantik in der Physik. Aufsatz aus der Reihe Physik und Evolution, Studiengang JO, Zürcher Hochschule Winterthur, Winterthur. Fuchs H. U., Ecoffey G., Schütz E. (2002): ISLE IV: The Dynamics of Heat. Materials for an Integrated Systemdynamics Learning Environment in thermal physics. Gordon J. M. and Zarmi Y. (1989): Wind energy as a solar-driven heat engine: A thermodynamic approach. Am. J. Phys. 57, 995–998. Herrmann F. (1993–2002): Der Karlsruher Physikkurs. Sekundarstufe I: 3 Bände plus Lehrerband; Sekundarstufe 2: 3 Bände. Aulis Verlag Deubner, Köln. Job G. (1972): Neudarstellung der Wärmelehre. Die Entropie als Wärme. Akademische Verlagsgesellschaft, Frankfurt am Main. Jorgensen S. E. (2001): Thermodynamics and Ecological Modeling. Lewis Publishers. Boca Raton. 27 Mehr als Sie je über Entropie wissen wollten Odum H. T. (1995): Environmental Accounting: Emergy and Environmental Decision Making. John Wiley & Sons, New York. Ruth M. (1993): Integrating Economics, Ecology and Thermodynamics (Ecology, Economy & Environment, Vol 3); Kluwer Academic Publishers, Amsterdam. Sieniutycz S., de Vos A. (2000): Thermodynamics of Energy Conversion and Transport. Springer-Verlag, New York. Strauss S. (1981): U-Shaped Behavioural Growth. Academic Press, Orlando and London. Strauss S., Stavy R. (1982): U-Shaped Behavioral Growth: Implications for Theories of Development. In W.W. Hartup (Ed.), Review of Child Development Research. Chicago: University of Chicago Press, 547-599. 28 Mehr als Sie je über Entropie wissen wollten Anhang 29