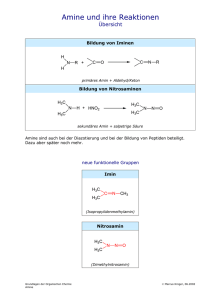
nucleophile Substitution
Werbung

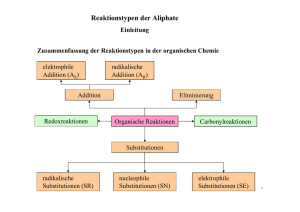
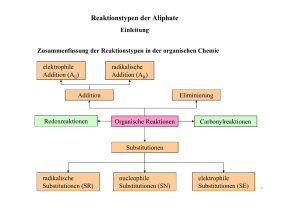
Reaktionstypen der Aliphate Klasse 8 Einleitung Reine Kohlenstoffketten, wie Alkane, Alkene und Alkine werden als Aliphate bezeichnet. Bei jeder chemischen Reaktion werden bestehende Verbindungen gebrochen und neue Bindungen erstellt. Chemische Reaktionen der Alkane Alkane sind aufgrund der starken Atombindung zwischen den C und H Atomen reaktionsträge. Ein Energiegewinn ergibt sich bei der Reaktion mit Sauerstoff. CH4 + 2 O2 CO2 + H2O ∆CH0 = -890kj/mol ∆H: Enthalpie: bei den meisten chemischen Reaktionen wird die Wärme ausgetauscht. Die bei einem konstanten Druck übertragene Wärmemenge ist gleich der Enthalpieänderung ∆H eines Systems. ∆H = Qp = ∆U + p · ∆V = Cp · ∆T Q: Wärmemenge, U: innere Energie, C: spezifische Wärmekapazität 1 Reaktionstypen der Aliphate Einleitung Weiterer Grund für die Reaktionsträgheit: Geringe Polarität der kovalenten Bindung ENC = 2,5; ENH = 2,1 Keine freien d – Orbitale zum Angriff für LEWIS Basen Reaktionsträgheit gegenüber polaren Reagenzien. Eine gemeinsame Eigenschaft aller Kohlenwasserstoffe ist ihre Brennbarkeit. Dabei entsteht Kohlenstoffdioxid und Wasser sowie Energie. C8H18 + 12,5 O2 8 CO2 + 9 H2O Die hohe Aktivierungsenergie wird jedoch von Halogenen aufgebracht. Die Halogenierung verläuft nach dem Mechanismus der radikalischen Substitution. CH4 + Cl2 CH3Cl + HCl Substitution 2 Reaktionstypen der Aliphate Einleitung Zusammenfassung der Reaktionstypen in der organischen Chemie elektrophile Addition (AE) radikalische Addition (AR) Addition Redoxreaktionen Eliminierung Organische Reaktionen Carbonylreaktionen Substitutionen radikalische Substitutionen (SR) nucleophile Substitutionen (SN) elektrophile Substitutionen (SE) 3 Reaktionstypen der Aliphate Substitutionsreaktionen Bei Substitutionsreaktionen werden Atome oder Atomgruppen in einem Molekül ausgetauscht. Wasserstoff wird durch ein Halogen ersetzt. Dabei ändert sich die Polarität einer Bindung. Man unterteilt in radikalische, nucleophile und elektrophile Substitutionen. Der Hybridisierungszustand der C – Atome bleibt erhalten. Radikalische Substitution (SR) Bsp.: Chlorierung von Methan CH4 + Cl2 CH3Cl + HCl Die Bindung in einem Molekül kann homolytisch gespalten werden: Die Elektronenpaarbindung wird so aufgeteilt, dass je ein Elektron auf die entstehenden Molekülteile übergeht. Dabei entstehen zwei Teilchen mit je einem ungepaarten Elektron, zwei Radikale. A–B ↔ A· + ·B 4 Reaktionstypen der Aliphate Substitutionsreaktionen Die nucleophile Substitution (SN) findet an Substraten statt, die an einem gesättigten, sp3 –hybridisierten Kohlenstoffatom eine polare Atombindung besitzen. Das Nucleophil tauscht eine an diesem sp3 C –Atom gebundene funktionelle Gruppe aus. Bei der bimolekularen nucleophilen Substitution (SN2) entsteht ein fünfbündiger Übergangszustand. Es werden keine Zwischenstufen gebildet. Die monomolekulare Substitution (SN1) findet in zwei Schritten statt. Zuerst wird die polare Atombindung gespalten, dann reagiert die nucleophile Reagenz mit dem Carbo-Kation. Nucleophile Substitutionsreaktionen laufen nach folgenden allgemeinen Gleichungen ab: X: + R─Y X:- + R─Y ↔ ↔ (nucleofuge Gruppe) R─X+ + :YR─X + :Y5 Reaktionstypen der Aliphate Substitutionsreaktionen Beispiele für nucleophile Substitutionsreaktionen: X:- + R─Y I- + H3C OH- + H3C─Br Cl R─X H3C H3C─OH CH3 CH3O- + H3C + Y- + Cl- + Br+ + I- CH3 I 1-Iod-2-methylpropan CN- I + H3C─Br Brommethan H3C OCH3 1-Methoxy-2-methylpropan H3C─CN Acetonitrit + Br- Ein Nucleophil X oder X- greift eine Verbindung R─Y an und verdrängt daraus den Substituenten Y-. Das Nucleophil muss ein freies Elektronenpaar besitzen, das für die Bildung der neuen R─X Bindung hergenommen werden kann. Das Elektronenpaar der R─Y Bindung geht auf die nucleofugen Gruppe Y über, die das Molekül als Y- verlässt. 6 Reaktionstypen der Aliphate Substitutionsreaktionen Beispiele für nucleophile Substitutionsreaktionen: + R─Y R─X+ + (C2H5)3N + CH3I (C2H5)3N+─CH3 + Triethylamin Iodmethan (CH3)2S + CH3Cl Dimethylsulfid Chlormethan X: + H2O + H3C HBr + H3C O Cl CH3 + H3C R─X+─H Bromethan Cl- Y:- H3C OH + H3C Br + CH3CH2OH + Bromethan Br + Trimethylsulfonium-Ion Diethylether NH3 (H3C)2S+─CH3 R─Y I- Methyltriethylammonium-Ion H─X Y- H3C NH2 R─X + H─Y HCl Ethanol + HBr Ethylamin 7



![6.3.1 1-Oxa-spiro[2.5]octan - Institut für Organische Chemie](http://s1.studylibde.com/store/data/001356875_1-96e669e5c88ad586db9f9f199d424d05-300x300.png)