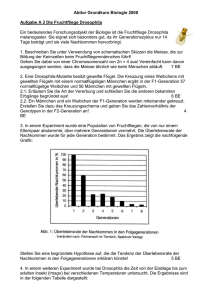
(Microcebus murinus, J.F. Miller 1777) in Nordwest
Werbung

Aus dem Institut für Zoologie der Tierärztlichen Hochschule Hannover Saisonale Aktivität und Reproduktionsbiologie von Grauen Mausmaki-Männchen (Microcebus murinus, J.F. Miller 1777) in Nordwest-Madagaskar INAUGURAL-DISSERTATION zur Erlangung des Grades eines DOCTOR MEDICINAE VETERINARIAE durch die Tierärztliche Hochschule Hannover Vorgelegt von Barthel Schmelting aus Münster Hannover 2000 Wissenschaftliche Betreuung: Univ.-Prof. Dr. E. Zimmermann 1. Gutachter: Univ.-Prof. Dr. E. Zimmermann 2. Gutachter: Univ.-Prof. Dr. A. Günzel-Apel Tag der mündlichen Prüfung: 22.11.2000 Die Dissertation wurde gefördert durch die Landesgraduiertenförderung Niedersachsen, den Deutschen Akademischen Austauschdienst und das Cusanuswerk. Meinen Eltern in Freude und Dankbarkeit INHALTSVERZEICHNIS 1 EINLEITUNG........................................................................................................... 1 2 LITERATURÜBERSICHT..................................................................................... 2 2.1 2.2 2.3 2.4 2.4.1 2.4.2 2.5 2.5.1 2.5.2 2.5.3 2.5.4 2.5.5 2.6 SAISONALITÄT .................................................................................................................2 NAHRUNGSÖKOLOGIE IM KONTEXT DER REPRODUKTION ...........................................5 BEDEUTUNG DER SCHLAFPLATZWAHL...........................................................................6 MÄNNLICHE REPRODUKTION .........................................................................................7 PRÄKOPULATIVER WETTBEWERB ...............................................................................8 POSTKOPULATIVER WETTBEWERB............................................................................11 DER GRAUE MAUSMAKI – STAND DER FORSCHUNG ...................................................13 SYSTEMATIK .............................................................................................................13 NAHRUNGSPEKTRUM ................................................................................................14 TORPORPHASEN ........................................................................................................14 SCHLAFPLÄTZE .........................................................................................................15 REPRODUKTIONSBIOLOGIE........................................................................................16 METHODISCHER HINTERGRUND UND ZIELSETZUNG ...................................................20 3 MATERIAL UND METHODEN.......................................................................... 24 3.1 3.1.1 3.1.2 3.1.3 3.2 3.3 3.4 3.4.1 3.4.2 3.4.3 3.5 3.5.1 3.5.2 3.5.3 UNTERSUCHUNGSGEBIET ..............................................................................................24 UNTERSUCHUNGSGEBIET JARDIN BOTANIQUE A .......................................................24 LEMUREN ..................................................................................................................24 PRÄDATOREN ............................................................................................................26 KLIMA............................................................................................................................26 UNTERSUCHUNGSZEITRAUM.........................................................................................27 TIERE .............................................................................................................................27 INDIVIDUELLE MARKIERUNG UND VERMESSUNG .....................................................27 REPRODUKTIONSSTATUS...........................................................................................27 BESENDERUNG VON TIEREN .....................................................................................28 POPULATIONSÖKOLOGIE ..............................................................................................29 FANG UND WIEDERFANG ..........................................................................................29 FALLENNUTZUNG......................................................................................................30 BESTIMMUNG DER POPULATIONSGRÖßE ...................................................................30 3.6 SENDERTIERE ................................................................................................................32 3.6.1 FALLENNUTZUNG DURCH SENDERMÄNNCHEN ..........................................................34 3.6.2 SCHLAFPLÄTZE .........................................................................................................34 3.6.3 RADIOTELEMETRIE ...................................................................................................35 3.6.4 VERHALTENSBEOBACHTUNGEN ................................................................................37 3.7 DATENVERARBEITUNG UND STATISTISCHE VERFAHREN.............................................42 4 ERGEBNISSE......................................................................................................... 43 4.1 SAISONALE DYNAMIK DER GESAMTPOPULATION........................................................43 4.1.1 FALLENNUTZUNG......................................................................................................44 4.1.2 FÄNGE UND WIEDERFÄNGE ......................................................................................45 4.1.3 GESCHLECHTERVERHÄLTNIS ....................................................................................45 4.1.4 POPULATIONSGRÖßE .................................................................................................46 4.1.5 SAISONALE DYNAMIK VON KÖRPERGEWICHT UND HODENVOLUMEN .......................47 4.2 SAISONALE DYNAMIK IM VERHALTEN DER SENDERMÄNNCHEN ................................50 4.2.1 FALLENNUTZUNG DURCH SENDERMÄNNCHEN ..........................................................50 4.2.2 SCHLAFPLÄTZE .........................................................................................................51 4.2.2.1 Saisonale Nutzungsunterschiede........................................................................51 4.2.2.2 Soziale Schlafkonstellationen ............................................................................54 4.2.2.3 Schlafplatzwahl und Prädatoren.........................................................................56 4.2.2.4 Konkurrenz um Schlafplätze..............................................................................56 4.2.3 VERHALTENSBEOBACHTUNGEN ................................................................................57 4.2.3.1 Aufenthaltshöhe .................................................................................................57 4.2.3.2 Nahrungsverhalten .............................................................................................58 4.2.3.3 Aktivitätsbudgets ...............................................................................................59 4.2.3.4 Markier- und Lautaktivität .................................................................................60 4.3 FORTPFLANZUNGSSTRATEGIEN DER SENDERMÄNNCHEN ...........................................63 4.3.1 KÖRPERGEWICHT UND HODENVOLUMEN DER SENDERMÄNNCHEN ...........................63 4.3.2 SOZIALE INTERAKTIONEN .........................................................................................64 4.3.3 AKTIONSRÄUME: SAISONALE DYNAMIK ...................................................................68 4.3.4 AKTIONSRAUMÜBERLAPPUNGEN ..............................................................................70 4.3.5 NACHTWANDERSTRECKEN ........................................................................................76 4.3.6 ZUGANG ZU WEIBCHEN ............................................................................................79 5 DISKUSSION.......................................................................................................... 81 5.1 METHODENVERGLEICH: NACHTWANDERSTRECKEN UND AKTIONSRÄUME...............81 5.2 SAISONALITÄT ...............................................................................................................83 5.2.1 POPULATIONSÖKOLOGIE ...........................................................................................83 5.2.1.1 Geschlechterverhältnis .......................................................................................85 5.2.1.2 Saisonaler Torpor...............................................................................................86 5.2.2 SCHLAFPLATZWAHL..................................................................................................86 5.2.2.1 Trockenzeit.........................................................................................................87 5.2.2.2 Schlafgemeinschaften am Ende der Trockenzeit ...............................................87 5.2.2.3 Regenzeit............................................................................................................89 5.2.2.4 Das Phänomen der Blattnester ...........................................................................90 5.2.3 NAHRUNGSSPEKTRUM ..............................................................................................91 5.2.4 MAUSMAKIS UND IHRE BEDEUTUNG ALS BLÜTENBESTÄUBER ..................................93 5.2.5 AUFENTHALTSHÖHEN ...............................................................................................94 5.3 REPRODUKTIONSBIOLOGIE DER MÄNNCHEN ..............................................................95 5.3.1 PAARUNGSZEIT .........................................................................................................95 5.3.2 PHYSISCHE KONDITION UND REPRODUKTIONSSTATUS .............................................98 5.3.3 MÖGLICHE REPRODUKTIONSSTRATEGIEN ...............................................................101 5.3.4 REPRODUKTIONSSTRATEGIEN VON M. MURINUS: EIN NEUES MODELL ....................103 5.4 AUSBLICK ....................................................................................................................106 6 ZUSAMMENFASSUNG...................................................................................... 107 7 SUMMARY ........................................................................................................... 109 8 LITERATURVERZEICHNIS ............................................................................ 111 9 ANHANGSTABELLE ......................................................................................... 129 Abkürzungsverzeichnis °C Grad Celsius Abb. Abbildung cm Zentimeter df Freiheitsgrad Fa. Firma g Gramm h Stunde ha Hektar JBA jardin botanique A Kap. Kapitel km Kilometer m Meter Max Maximum MHz Mega Hertz Min Minimum min Minute mm Millimeter MW Mittelwert N Anzahl der Tiere n.s. nicht signifikant NN Normal Null SD Standardabweichung sec Sekunde Std. Dev. Standard Deviation (Standardabweichung) Std. Err. Standard Error (Standardfehler) Tab. Tabelle 1 1 Einleitung Madagaskar zeichnet sich aufgrund der frühen erdgeschichtlichen Isolation vom afrikanischen Festland vor 120 bis 160 Millionen Jahren und der geographischen Lage durch eine ausgesprochen hohe biogeographische Diversität aus, die es zu einem der 12 „top megadiversity countries“ der Erde werden läßt (TATTERSALL 1993, MITTERMEIER et al. 1994). Durch die Vielzahl unterschiedlicher Habitate und die Abwesenheit vieler anderer auf dem Festland vorkommender Säugetierordnungen konnte sich dort eine große Anzahl von Lemurenspezies entwickeln (KAPPELER & GANZHORN 1993). Madagaskar hat mit mindestens 33 noch existierenden Lemurenarten die dritthöchste Primatendiversität der Welt (MITTERMEIER et al. 1994, ZIMMERMANN et al. 1998, GANZHORN et al. 1999). Doch die nur auf Madagaskar vorkommenden Lemuren sind durch die zunehmende Zerstörung ihres Lebensraumes, bedingt durch Abholzung und Brandrodung für landwirtschaftliche Zwecke, stark gefährdet. Viele von ihnen sind vom Aussterben bedroht, für die meisten fehlt das Wissen über genaue geographische Verbreitung, Populationsgrößen oder grundlegende biologische Parameter (GREEN & SUSSMANN 1990, HARCOURT & THORNBACK 1990, MITTERMEIER et al. 1992, 1994, GANZHORN et al. 1997). Für die erfolgreiche Etablierung von Arterhaltungsprogrammen und ihren Schutz ist aber ein detailliertes Wissen über die Reproduktionsbiologie im Zusammenhang mit Lebenslaufstrategien und ökologischen Faktoren notwendig (RAKOTOARISON et al. 1996, WRIGHT 1997, SCHMELTING et al. 2000). In dieser ersten die Trocken- und Regenzeit erfassenden Langzeitstudie an dem Grauen Mausmaki, Microcebus murinus, sollen anhand von populationsökologischen Daten sowie detaillierter Verhaltensstudien an ausgewählten Fokustieren saisonale Veränderungen im Verhalten der Männchen unter Berücksichtigung der Reproduktion in Ampijoroa, Nordwest-Madagaskar, untersucht werden. 2 2 2.1 Literaturübersicht Saisonalität Aufgrund der besonderen geographischen Lage am Wendekreis des Steinbocks unterliegt Madagaskar mit einer wärmeren Regenzeit und einer kälteren Trockenzeit starken klimatischen Schwankungen (JENKINS 1990). Anhand der Verteilungsmuster von Lemurenspezies und klimatischen, geographischen sowie botanischen Kriterien unterscheidet MARTIN (1972a) sieben Subzonen in Madagaskar, die durch geographische Barrieren getrennt sind: Die drei Subzonen der Westküste werden als Trockenwald im Südwesten (SW), laubabwerfender Trockenwald im Westen (W) und laubabwerfender Trockenwald in Nordwest-Madagaskar (NW) eingeteilt (Abb. 1). Der Graue Mausmaki, Microcebus murinus, ist eine der kleinsten Primatenarten und kommt in den laubabwerfenden Trockenwäldern aller drei Subzonen der Westküste Madagaskars vor und bewohnt dort die „fine-branch-niche“ (MARTIN 1972b). Die meisten natürlichen Lebensräume sind durch saisonale Veränderungen gekennzeichnet. Regenfall und Temperatur können das Pflanzenwachstum und dadurch die Produktivität der gesamten Nahrungskette begrenzen, da alle physiologischen Prozesse, vor allem die Reproduktion, limitiert werden durch die verfügbare Nahrung (BRONSON & HEIDEMAN 1994). Als wichtigster ultimater Grund für eine Saisonalität der Fortpflanzung gilt daher die Variabilität in der Nahrungsverfügbarkeit (JANSON & CHAPMAN 1999). Je ausgeprägter saisonale Veränderungen sind, um so stärker sollte das Verhalten hierauf abgestimmt sein. Die meisten Säuger zeigen eine Tendenz zur Saisonalität hinsichtlich ihrer Fortpflanzung; viele haben eine vom restlichen Jahr klar abgegrenzte Reproduktionsphase (BRONSON & HEIDEMAN 1994). Arten, bei denen in einem Jahr oder weniger ein kompletter Reproduktionszyklus von der Paarung bis zur Entwöhnung durchlaufen werden kann, sollten eine größere Fortpflanzungssaisonalität zeigen als Arten mit längeren Zyklen (LINDBURG 1987). Die Konzentration der Geburten zu einer Zeit, in der ein großes Nahrungsangebot besteht, ist auch unter Primaten weit verbreitet (LINDBURG 1987). 3 Abb. 1. Vegetationszonen Madagaskars mit Lage des Untersuchungsgebietes (nach MARTIN 1972a, HARCOURT & THORNBACK 1990, modifiziert). 4 VAN SCHAIK & VAN NOORDWIJK (1985) schlugen als ein klassisches Verhaltensmuster für Primaten in Habitaten mit ausgeprägtem circannual-saisonalem Charakter vor, daß Paarungen in der Zeit der Nahrungsknappheit stattfinden sollten, damit die Endphase der Laktation bzw. der Beginn des Entwöhnens mit dem Klimax der Nahrungsverfügbarkeit zusammenfalle, während als alternative Strategie in Habitaten mit sogenannten Mastjahren (unregelmäßiges und nicht voraussehbares Nahrungsangebot) die Paarungszeit erst mit dem Nahrungsklimax einsetzen soll. Bei Lemuren ist bereits früh eine mögliche Korrelation zwischen dem Klimax der Nahrungsverfügbarkeit in der Regenzeit und der Entwöhnungsphase der Jungtiere beobachtet worden, die als ein Anpassungsmuster für eine erhöhte Überlebensrate der Nachkommen für die folgende Trockenzeit erklärt wird (MARTIN 1972a). Die meisten untersuchten Lemurenarten haben eine für Primaten außergewöhnlich strikte saisonale Reproduktionsphase (VAN HORN & EATON 1979, RICHARD & DEWAR 1991, ROWE 1996, aber STERLING 1993), welche unter anderem als Anpassung an das saisonale Klima und die saisonale Nahrungsverfügbarkeit interpretiert wird (RICHARD & DEWAR 1991). Auch die Tragzeiten der Strepsirhini sind im Vergleich zu den Haplorhini mit ähnlichen Körpergrößen sehr kurz (HARVEY et al.1987, YOUNG et al. 1990). YOUNG et al. (1990) stellten unter Verwendung der Relation des Geburtsgewichtes zur Tragzeit als Index für maternales Investment bei den Lemuren ein verringertes pränatales Investment in die Nachkommen fest, welches einhergeht mit einem erniedrigten Basalstoffwechsel. Diese Zusammenhänge resultieren neben der saisonalen Reproduktionsphase in einer zusätzlichen Energieersparnis, die aufgrund der besonderen ökologischen Bedingungen Madagaskars für die Lemuren notwendig sein können (SCHMID 1997). Eine ausgeprägte saisonale Reproduktion kann aber auch durch verlorene oder ausgelassene Reproduktionsmöglichkeiten mit hohen Fitneßkosten verbunden sein (KILTIE 1988). Dieser Zeitverlust ist besonders bedeutend für Arten mit kleiner Körpergröße und kürzerer Lebenserwartung (DI BITTETTI & JANSON 2000). Denn wie allgemein in anderen Säugetierordnungen, verkürzt sich auch innerhalb der Primaten die durchschnittliche Tragzeit einer Art mit Abnahme der Körpergröße (HARVEY et al. 1987, BEARDER 1987), wodurch kürzere Geburtsintervalle möglich sind. So zeigen die zu den Neuweltaffen gehörenden Callitrichiden ein bimodales Reproduktionsmuster aufgrund der hohen Kosten (in Hinsicht 5 auf Zeitverlust), die eine nur einmal im Jahr stattfindende Reproduktion bedeuten würde (DI BITTETTI & JANSON 2000). Je ausgeprägter saisonale Veränderungen sind, um so stärker muß jedoch das Verhalten und die Reproduktion hierauf abgestimmt sein. Je nach Art, Population und Individuum können sich in Abhängigkeit vom Habitat unterschiedliche Strategien zur Erhöhung des Reproduktionserfolgs ergeben. 2.2 Nahrungsökologie im Kontext der Reproduktion Die Saisonalität im Nahrungsangebot in Tropenwäldern verlangt von den meisten Primatenarten ausreichende und schnelle Flexibilität in Nahrungspräferenzen, da bevorzugte Nahrungen verschwinden oder neu auftreten können (JANSON & CHAPMAN 1999). Die zu den Lemuren gehörenden Propithecus sp. legten z.B. während der Trockenzeit, in der Nahrung mit niedrigem Energiegehalt den Großteil der Diät ausmachen, die kürzesten Tageswegstrecken zurück, wodurch der Energieverbrauch bei knapper Nahrungsverfügbarkeit minimiert werden soll (MEYERS & WRIGHT 1993). Je kürzer und vorhersehbarer eine Periode von Nahrungsreichtum ist, um so deutlicher sollte die Reproduktionsphase von der übrigen Zeit des Jahres abgehoben sein. Auch die Art der Diät sollte den Grad der Saisonalität bestimmen: Tiere, deren Nahrung vor allem aus saisonal verfügbaren Ressourcen wie z.B. Früchten und Arthropoden besteht, sollten einem höheren Selektionsdruck auf eine saisonale Paarungszeit unterliegen als Tiere, deren Nahrung weniger saisonal bedingt ist wie z.B. Blätter und Pflanzenexsudate (DI BITTETTI & JANSON 2000). Kleinere Primatenspezies sollten einen hohen Anteil ihres Nahrungsbedarfes durch energiereiche Nahrungsquellen wie Insekten decken, um genügend Energie für den erhöhten Stoffwechselbedarf zu haben (FLEAGLE 1988). Aufgrund schwieriger Beobachtungsbedingungen (Tiergröße, Vegetationsdichte, Regenfall) werden bei kleinen, arborealen Primatenspezies oft indirekte Erfassungsmethoden verwendet. Basierend auf Kotuntersuchungen schlußfolgerte z.B. ATSALIS (1999) auf das Freßverhalten von Microcebus rufus, einer im Regenwald Ostmadagaskars vorkommenden Schwesterart zu M. murinus: Früchte, vor allem der Art Bakerella, sollten ein Hauptnahrungsbestandteil von M. rufus sein. Kotuntersuchungen alleine spiegeln jedoch nicht das gesamte Nahrungsspektrum wider (HARDING 1981). Leicht verdauliche Nahrungsbestandteile wie Baumharze, Nektar oder Insektensekrete lassen sich hierdurch nicht erfassen oder weiche Pflanzenteile ohne 6 hohen Fasergehalt sowie Larven oder Raupen nur sehr bedingt feststellen (WHITAKER 1988, ATSALIS 1999). In zahlreichen saisonal reproduktiven Primaten- und anderen Säugerarten kann bei den Männchen kurz vor Beginn der Paarungszeit eine Zunahme des Körpergewichtes, des Hodenvolumens (FIETZ 1998, SCHMID & KAPPELER 1998, PULLEN et al. 2000) und ein Einsetzen der Spermatogenese festgestellt werden (DU MOND & HUTCHINSON 1967, FUENTES et al. 1991, WALKDEN-BROWN et al. 1994), wobei der Beginn der sexuellen Aktivität um den Zeitraum des höchsten Körpergewichtes beobachtet wurde (PASQUALINI et al. 1986). Die Zunahme des Körpergewichtes der Männchen ist nicht notwendigerweise mit dem Regenfall korreliert, dem Hauptfaktor für ein reichhaltigeres Nahrungsangebot, so daß andere Faktoren hieran beteiligt sein können wie z.B. ein veränderter Hormonstoffwechsel (WALKDEN-BROWN et al. 1994). Für die Männchen ist vor allem die Paarungszeit selbst mit energetischen Kosten verbunden. Bei zahlreichen männlichen Säugern (z.B. Hausrind, See-Elefant, Rhesusmakakke, Grauer Mausmaki, Fettschwanzmaki) können während der Paarungszeit Gewichtsabnahmen festgestellt werden (BOYD et al. 1989, DEUTSCH et al. 1990, BERCOVITCH & NÜRNBERG 1996, RADESPIEL 1998, MÜLLER 1999), die endokrinologisch bedingt sein könnten (PASQUALINI et al. 1986) oder auf eine verminderte Nahrungsaufnahme und/oder gesteigerte Aktivität zurückgeführt werden. Wenn die Erlangung und Aufrechterhaltung des Zugangs zu Weibchen durch die Qualität eines Männchens bedingt sind, dann kann als Konsequenz auch der Nahrungszustand und das Freßverhalten der Männchen einen direkten oder indirekten Einfluß auf den männlichen Reproduktionserfolg haben (BERCOVITCH & NÜRNBERG 1996). So können z.B. auch durch unterschiedliche Nahrung Unterschiede in der Effizienz der Spermatogenese hervorgerufen werden (OLDHAM et al. 1978, BRONSON & HEIDEMAN 1994). 2.3 Bedeutung der Schlafplatzwahl Schutz vor Prädatoren gilt im allgemeinen als Hauptgrund für die Schlafplatzwahl bei Primaten, vor allem bei kleineren Spezies (MARTIN 1972a, HAMILTON 1982, KAPPELER 1998, RADESPIEL et al. 1998, DI BITETTI et al. 2000). Die Verfügbarkeit von 7 Schlafplätzen ist ein bedeutender Faktor für den Grad des Prädationsrisikos und der Nutzung des Aktionsraumes in vielen terrestrischen Primatenspezies (S.A. ALTMANN 1974, HAMILTON 1982). Da häufig genutzte Schlafplätze leichter von Prädatoren entdeckt werden könnten, sollten bei einem hohen Prädatorendruck Individuen möglichst viele verschiedene Schlafplätze in unterschiedlichen Nutzungsmustern verwenden (HRDY 1977). Andererseits sollten besonders sichere Schlafplätze so oft wie möglich aufgesucht werden (RADESPIEL et al. 1998). Eine gemischte Strategie könnte sein, neben häufig wechselnden, einige bevorzugte und wiederholt genutzte Schlafplätze zu haben (DI BITETTI et al. 2000). Soziale Interaktionen können jedoch auch die Schlafplatzwahl beeinflussen, indem Schlafplätze gewählt werden, die soziale Kontakte zu Paarungspartnern (SCHWAGMMEYER 1995, RADESPIEL 1998, PETERS 1999) oder anderen Sozialpartnern erleichtern (SARIKAYA 1999, DI BITETTI et al. 2000). So kommt es z.B. beim nachtaktiven Spektraltarsier (Tarsius spectrum) an 20 % der am Schlafplatz verbrachten Zeit zu sozialen Interaktionen, die sich vor allem zwischen Mutter und Jungtier, aber auch zwischen Adulten (hier: Adulte Weibchen und Männchen) ereignen (GURSKY 2000). 2.4 Männliche Reproduktion Die sexuelle Selektion als eine besondere Form der natürlichen Selektion (DARWIN 1871) begünstigt Individuen, die ihren Reproduktionserfolg in Relation zur Lebenszeit maximieren (DIXSON 1997). Es wird hierbei zwischen zwei grundlegenden Mechanismen der sexuellen Selektion unterschieden: Der intrasexuellen Konkurrenz vor allem der Männchen um Paarungspartner (male-male competition) und der intersexuellen Konkurrenz durch die Auswahl von Paarungspartnern nach bestimmten Merkmalen vorwiegend durch Weibchen (female choice). Der geschlechtstypische Unterschied in diesen beiden Mechanismen der sexuellen Selektion hat seinen Ursprung im unterschiedlichen Investment der Geschlechter in die Nachkommen (TRIVERS 1972). Während für die Weibchen die Nachkommenaufzucht und die dafür benötigten Ressourcen die limitierenden Faktoren des Reproduktionserfolges darstellen, ist der potentielle Fortpflanzungserfolg der Männchen von dem Zugang zu fertilen Weibchen abhängig (EMLEN & ORING 1977, CLUTTON-BROCK 1989, DAVIES 1991). Der Wettbewerb um den Reproduktionserfolg kann bei den Männchen in einen präkopulativen und einen postkopulativen Wettbewerb eingeteilt werden. 8 2.4.1 Präkopulativer Wettbewerb Bei vielen Arten führen direkte Auseinandersetzungen der Männchen um Weibchen (contest competition) zu einer stabilen Dominanzhierarchie, in der dominante Männchen bevorzugten Zugang zu rezeptiven Weibchen haben (CLUTTON-BROCK et al. 1982, DEWSBURY 1982, BERCOVITCH & NÜRNBERG 1996, DIXSON 1997). Der Sexualdimorphismus kann dabei besonders ausgeprägt sein, da Größe und Stärke sowie bessere Waffen wie z.B. große Eckzähne dazu beitragen, Weibchen als Paarungspartner monopolisieren zu können (CLUTTON-BROCK 1984). So führten z. B. bei Rhesusmakakken (Macaca mulatta) Paarungen mit mehreren Weibchen zu größerer Nachkommenschaft und dementsprechend zu einem höheren Reproduktionserfolg, welcher mit einer Anzahl von Faktoren assoziiert war wie hoher Dominanzstatus, hohes Körpergewicht, großes Hodenvolumen und guter physischer Körperkondition (BERCOVITCH & NÜRNBERG 1996). Die Abwesenheit von Sexualdimorphismus in Körpergröße oder Caninuslänge bei den Lemuren wird dahingehend interpretiert, daß der männliche Reproduktionserfolg der Lemuren nur geringfügig durch physische, präkopulatorische Auseinandersetzungen beeinflußt wird (KAPPELER 1993). Bei solitär lebenden Arten mit promiskem Paarungssystem, wo rezeptive Weibchen räumlich weit verteilt und Östren nicht vorhersehbar sind, ist die aktive Suche ohne aggressive Auseinandersetzung von Männchen nach Paarungspartnern von entscheidender Bedeutung (TRIVERS 1972). Bei diesem als scramble competition bezeichneten Wettbewerb (WELLS 1977) sind Fähigkeiten, die den Paarungserfolg am meisten beeinflussen, wie die Aktionsraumgröße und das Aufspüren von östrischen Weibchen, nicht notwendigerweise mit der Körpergröße korreliert (SCHWAGMEYER 1994, FISHER & LARA 1999). Männchen vom Dreizehnstreifenerdhörnchen, Spermophilus tridecemlineatus, mit einem größeren Aktionsraum haben auch einen größeren Reproduktionserfolg; während sich in der Paarungszeit der Aktionsraum stark vergrößert, verringert sich dieser abrupt und drastisch, sobald alle Weibchen der Population belegt sind (SCHWAGMEYER 1988). Die Dynamik der Aktionsraumgröße kann daher ein Ausdruck möglicher Paarungsaktivität sein. Auch bei nachtaktiven Lemuren konnte festgestellt werden, daß Männchen ihre Aktionräume während der Paarungszeit stark vergrößern, um so möglicherweise vermehrt rezeptive Weibchen als Paarungspartner zu treffen (KAPPELER 1997, FIETZ 1999, RADESPIEL 2000, SCHWAB 9 2000). Die zurückgelegte Wegstrecke während der Paarungszeit kann ebenfalls Hinweise auf einen möglichen Paarungserfolg geben: RAADSMA et al. (1983) fanden bei Rindern eine starke Korrelation zwischen der zurückgelegten Wegstrecke und der durchschnittlichen Anzahl von belegten Kühen zu Anfang der Paarungszeit, wenn Bullen am aktivsten sind. Treffen allerdings während der Suche mehrere Männchen gleichzeitig auf ein östrisches Weibchen, kann in der direkten Auseinandersetzung das Körpergewicht einen entscheidenden Einfluß auf den Zugang zum Weibchen und den Paarungserfolg haben (FISCHER & LARA 1999, SCHMID 1999, PULLEN et al. 2000). So waren z.B. bei der nachtaktiven Prosimierart Galago moholi, für die das Modell der Spermienkonkurrenz (s.u.) in einem dispersen Paarungssystem zuzutreffen scheint, an 88 % der beobachteten Kopulationen schwerere Männchen beteiligt (PULLEN et al. 2000). Wenn Weibchen lokal in hoher Dichte auftreten, wird der Wettbewerb zwischen Männchen verstärkt und kann zur Bildung von Männchenkoalitionen auch bei solitär lebenden Spezies führen (z.B. bei Geparden (CARO 1994) oder Waschbären (GEHRT & FRITZELL 1998)). Bei Karnivoren können Langzeitassoziationen, die den reproduktiven Zugang zu Weibchen ermöglichen, auch Unterschiede im Reproduktionserfolg der Koalitionspartner aufweisen (PACKER & PUSEY 1982, CARO 1994). Primaten zeichnen sich durch eine besondere Vielfalt in ihren sozialen Organisationsformen aus (CHENEY 1987, FLEAGLE 1988). Neben Langzeitkoalitionen (SMUTS 1985, NOE 1986) treten bei ihnen Koalitionen auf, die eher kurzzeitigen Interaktionen entsprechen (HARCOURT 1992). NOE (1986) definiert daher Koalitionen als jedes Ereignis, in dem Individuen ihre Kräfte verbinden, wobei ein Individuum dem anderen Hilfe leistet oder zwei bzw. mehrere Individuen direkte Aggression auf das gleiche Ziel zur gleichen Zeit richten. In 42 % der Koalitionen von männlichen Löwen sind die Individuen nicht miteinander verwandt (PACKER & PUSEY 1982). Unter Primaten ist die Bildung von Koalitionen häufig, wobei Verwandtschaften oft eine fundamentale Rolle spielen (HARCOURT & DE WAAL 1992, VAN SCHAIK 1996). Hierbei sind Assoziationen und Koalitionen von Männchen seltener als bei Weibchen (VAN SCHAIK 1996). Dieses hat seinen Ursprung im geschlechtsspezifischen Investment in die Fitneß: Bei Spezies mit in der Regel nur einem Nachkommen pro Paarung kann sich nur ein Männchen erfolgreich mit dem Weibchen paaren, während Nahrungsquellen 10 bei Koalitionsbildungen geteilt oder gar erst erschlossen werden können (VAN HOFF & VAN SCHAIK 1992). Die Bildungen von Koalitionen können jedoch vereinfacht werden, wenn die Männchen miteinander verwandt sind. Bei einigen Spezies mit ausgesprochenen Männchenbindungen entwickeln die Männchen hoch differenzierte Beziehungen mit Groomingpartnern und Koalitionsbildungen (VAN HOFF & VAN SCHAIK 1992, 1994). Diese Spezies sind durch ein promiskes Paarungssystem mit wahrscheinlich ausgeprägter Spermienkonkurrenz gekennzeichnet (HARCOURT 1996). Bei nachtaktiven Prosimiern wurde dem Sozialverhalten und möglichen sozialen Interaktionen lange keine größere Bedeutung zugemessen, da Individuen im allgemeinen allein in der Nacht gesehen wurden (MARTIN 1995). Die meisten dieser Arten wurden daher lange als solitär bezeichnet. Unmittelbare Nähe ist jedoch nicht unbedingt erforderlich, um miteinander kommunizieren und soziale Interaktionen ausführen zu können. Rufe dienen wenigstens drei wichtigen sozialen Funktionen: Zusammenbringen von Individuen und Verstärkung von Koalitionen, Distanzhalten von Konkurrenten und Verminderung von Konflikten, Alarmrufe als Warnung vor Gefahren (MARLER 1968, ZIMMERMANN 1995). Distanzkommunikation über Vokalisation und Olfaktorik als auch zwischenzeitliche soziale Begegnungen können ebenso zur individuellen Erkennung, der Wahl eines Sozialpartners und der Synchronisation von Aktivitäten beitragen und so auch bei nachtaktiven Lemuren zu einem Netzwerk von individualisierten Sozialbeziehungen führen (STERLING 1993). RADESPIEL (2000) verwendet dafür bei M. murinus den Ausdruck „individualisierte Nachbarschaft“. Bereits PAGES-FEUILLADE (1988) vermutete aufgrund von Aktionsraumüberlappungen und Interaktionen zwischen Männchen ein komplizierteres Sozialgefüge für M. murinus als vormals angenommen, wobei es der Klärung bedarf, ob es sich um ein saisonales Phänomen und/oder eine Abhängigkeit vom Habitat handelt. Eine andere Form des präkopulativen Wettbewerbs ist die Unterdrückung der Reproduktion von konkurrierenden Männchen. Sie ist meist auf olfaktorische oder streßvermittelte Mechanismen zurückzuführen, wie bei Nagern dokumentiert ist (VANDENBERGH 1983, RICH & HURST 1999, HUMPHRIES et al. 1999). Neben der Markierung des Territoriums können durch das Setzen von Duftmarken sowohl Dominanzstatus über Konkurrenten (GOSLING 1982, HURST 1993), als auch Signale an das andere Geschlecht über die Qualität 11 als potentieller Paarungspartner vermittelt werden (RICH & HURST 1998, HURST & RICH 1999). Auch bei Lemuren wurde das Setzen von Duftmarken in Verbindung gebracht mit dem Dominanzstatus (SCHILLING et al. 1984, SCHILLING & PERRET 1987, IZHARD 1990, PERRET 1992, KRAUS et al. 1999). So konnte für z.B. Propithecus verreauxi beobachtet werden, daß dominante Männchen fast dreimal mehr Duftmarken setzten als subdominante Männchen. Nur bei dominanten Tieren war eine nennenwerte Zunahme des Hodenvolumens vor der Paarungszeit zu verzeichnen, welche allerdings nicht gemessen, sondern nur visuell ermittelt wurde (KRAUS et al. 1999). Eine andere Studie an der gleichen Tierart kam zu dem Ergebnis, daß ältere, vermutlich dominante Männchen häufiger kopulierten als junge, vermutlich subdominante Männchen (BROCKMANN 1994). 2.4.2 Postkopulativer Wettbewerb Als postkopulative Verhaltensanpassungen dienen alle Verhaltensweisen eines Männchens, welche die Wahrscheinlichkeit seines eigenen Fortpflanzungserfolges nach der Paarung erhöhen, wie z.B. das Bewachen eines Weibchens nach der erfolgten Paarung, das mate guarding (DEWSBURY 1988, MØLLER & BIRKHEAD 1989). Hierdurch sollen weitere Paarungen des Weibchens mit anderen Männchen verhindert werden. Auch bei M. murinus konnte mate guarding beobachtet werden (PETERS 1999). Sexualdimorphismus kann fehlen, wenn die physische Auseinandersetzung nur eine untergeordnete Rolle beim intrasexuellen Wettbewerb spielt (RICHARD 1992). Wenn Männchen rezeptive Weibchen nicht monopolisieren können, kann Spermienkonkurrenz (sperm competition) als postkopulativer Wettbewerbsmechanismus zu einem entscheidenden Faktor werden für den reproduktiven Erfolg der Männchen (PARKER 1970). Dieser Fall tritt vor allem in promisk-dispersen Paarungssystemen ein. Bei ihnen kommt es nur zu kurzzeitigen, nicht exklusiven Begegnungen von einzelnen Individuen, die sonst in der Regel verstreut in einem Gebiet anzutreffen sind (DIXSON 1997). Die Spermienproduktion ist proportional zur Anzahl der Sertolizellen, und die Anzahl der Sertolizellen gilt als die kritische biologische Bestimmungsgröße für die Hodengröße (BARDIN et al. 1994, SETCHELL et al. 1994, SHARPE 1994). Relativ große Hodenvolumina gelten daher als Ausdruck für den postkopulativen Wettbewerb und 12 Spermienkonkurrenz (HARCOURT et al. 1981, DIXSON 1987). Das Paarungssystem korreliert mit der Hodengröße und beeinflußt daher wahrscheinlich die Hodengröße: Männchen in Mehr-Männchenpaarungssystemen haben signifikant größere Hoden in Relation zur Körpergröße als in Ein-Männchensystemen, unabhängig von der Länge der Paarungszeit (HARCOURT et al. 1995). Wenn eine kurze Paarungszeit verbunden ist mit häufigen Kopulationen, so ist andererseits eine Selektion auf hohe Spermienproduktion wahrscheinlich, um eine ausreichende Spermienzahl pro Ejakulation zu erhalten, welche ihrerseits zur Selektion von größeren Hoden führt. Bei wiederholten Ejakulationen innerhalb einer relativ kurzen Zeitspanne kann die Kapazität der männlichen Reproduktion beschränkt sein: Eine Abnahme der Anzahl der Spermien und/oder anderer Parameter pro Ejakulat nach wiederholten Ejakulationen konnte bei zahlreichen Tierarten (Rind, Hund, Schwein, Kaninchen, Ratte, Schaf, Haushuhn, Pute, Schmetterling, Fruchtfliege, Moskito, Strudelwurm) und dem Menschen nachgewiesen werden (OLDEREID et al. 1984, RUANGSBOON & VISUTAKUL 1985, LEVIN et al. 1986, Übersicht in AUSTIN & DEWSBURY 1986). So werden bei Ratten in späteren Ejakulationen nur etwa 10 - 21 % der Anzahl der Spermien frühzeitiger Ejakulationen erreicht. Während in kurzzeitig aufeinanderfolgenden Kopulationstests bei der ersten Paarung 83 % der Weibchen trächtig werden, können im siebten Paarungsversuch nur noch 17 % der Weibchen konzipieren (AUSTIN & DEWSBURY 1986). Sowohl die Anzahl der Spermatozoa im Nebenhoden als auch das Gewicht des Nebenhodens verringern sich nach Ejakulationen (RUANGSBOON & VISUTAKUL 1985, HARCOURT 1991). Wiederholte Paarungen mit verschiedenen, aufeinanderfolgenden Weibchen können daher den Nachteil mit sich bringen, daß ein individuelles Weibchen nicht konzipieren kann oder daß, wenn Weibchen nicht monopolisiert werden können, das Sperma dieses Männchens nicht erfolgreich konkurrieren kann mit dem Sperma anderer Männchen, die sich vorher oder nachher mit dem gleichen Weibchen paaren (AUSTIN & DEWSBURY 1986). Methoden wie etwa die Zählung überlebender Spermatiden nach der Homogenisierung des Hodens, die sehr genau die Spermienproduktion messen können, sind für die meisten Freilandstudien nicht geeignet, bei denen man eine einfach zu handhabende in vivo Methode zur Erfassung der Spermiogenese benötigt (WALKDEN-BROWN et al. 1994). Die 13 verläßlichste Methode zur indirekten Messung der Spermienproduktion ist in zahlreichen Spezies die Hodengröße, mit moderaten bis hohen Korrelationskoeffizienten zwischen Hodengröße und Spermatogenese (AMANN 1970, CURTIS & AMANN 1981, SWANEPOEL et al. 1993, WALKDEN-BROWN et al. 1994). 2.5 2.5.1 Der Graue Mausmaki – Stand der Forschung Systematik M. murinus ist eine der kleinsten und phylogenetisch ursprünglichsten Primatenarten mit nachtaktiver Lebensweise (z.B. MARTIN 1972a, DUTRILLAUX 1979, SCHILLING & PERRET 1987). In seiner Verhaltensökologie werden Ansätze zum Verständnis der Lebensweise und Evolution der Vorfahren rezenter Primaten gesucht. Aus diesem Grund wird gerade diese Art als Modell für evolutiv frühe Sozialsysteme bei Primaten herangezogen (SCHILLING & PERRET 1987). M. murinus kann systematisch wie folgt eingeordnet werden (nach YODER 1997): Klasse: Mammalia Ordnung: Primates Unterordnung: Strepsirhini Überfamilie:Lemuroidea Familie: Cheirogaleidae Gattung: Microcebus Art: M. murinus Wie bei den meisten Strepsirhini, ist auch bei M. murinus ein Tapetum lucidum als reflektierende Schicht hinter der Retina des Auges vorhanden, welche als Anpassung an die Nachtaktivität gesehen wird (MARTIN 1973, 1995, ROWE 1996). Neben dem akustischen Sinn (ZIMMERMANN 1995) ist der Geruchssinn bei Mausmakis sehr gut ausgeprägt mit einem funktionsfähigen und gut entwickelten Vomeronasalorgan (SCHILLING 1987, SCHILLING & PERRET 1987). Erwachsene Tiere sind einheitlich graubraun gefärbt, ca. 60 g schwer mit einer mittleren Körperlänge von 12 - 13 cm und einer Schwanzlänge von ca. 13 cm (MARTIN 1973, PETTER et al. 1977, TATTERSALL 1982, ZIMMERMANN et al. 14 1998). Im natürlichen Lebensraum der Grauen Mausmakis gibt es eine Trennung in eine etwa viermonatige Regenzeit von Dezember bis März und eine etwa achtmonatige Trockenzeit von April bis November (HLADIK 1980, SORG & ROHNER 1996, SCHMELTING et al. 2000). 2.5.2 Nahrungspektrum Als Nahrung von M. murinus werden Früchte, Insekten, Blumen, Baumharze, Nektar, Pflanzen- und Insektensekrete, kleinere Wirbeltiere und Blätter angesehen (MARTIN 1972a, 1972b, 1973, HLADIK et al. 1980, BARRE et al. 1988, CORBIN & SCHMID 1995). Als Hauptbestandteil der Nahrung gelten Früchte, während Insekten nur opportunistisch, soweit verfügbar, (1972b) aufgenommen werden (MARTIN 1972b, HLADIK et al. 1980). MARTIN vermutete, daß sich Mausmakis je nach Habitat auf verschiedene Nahrungsressourcen spezialisieren. ATSALIS (1999) nahm jedoch an, daß trotz der Unterschiede im Habitat von M. rufus (Regenwald) und M. murinus (Trockenwald) beide Arten aufgrund der Ähnlichkeiten im Lebenszyklus der untersuchten Populationen ein ähnliches Freßverhalten mit Früchten als den Hauptbestandteil der Nahrung aufweisen. 2.5.3 Torporphasen Als eine Strategie des Überdauerns von Zeiten mit Nahrungsknappheit in niedriger Umgebungstemperatur gilt der Eintritt in den Trockenschlaf, den Torpor, der für M. murinus im Westen und Südwesten Madagaskars festgestellt wurde und Gegenstand zahlreicher Studien ist (PETTER 1978, PETTER-ROUSSEAUX 1980, ORTMANN et al. 1996, ORTMANN & HELDMAIER 1997, SCHMID 1997, 1999, SCHMID & KAPPELER 1998). MARTIN (1972a) schlußfolgerte nach Ausführungen von WEIDHOLZ (1932), daß der Eintritt in den Torpor vorrangig temperaturabhängig sei und nicht durch verkürzte Tageslänge, Nahrungsknappheit oder Trockenheit hervorgerufen wird. Im Trockenwald des Südwesten Madagaskars (20°04‘ S, 44°39‘ W) können die Temperaturen über Nacht im Juni und Juli unter 5°C fallen (SCHMID 1997, 1999, SCHMID & KAPPELER 1998). Hier treten vor allem die Weibchen in den Torpor, der bis zu sieben Monate andauern kann. Da die Weibchen zu dieser Zeit inaktiv sind, ergibt sich besonders in den kältesten Monaten der Trockenzeit ein stark zugunsten der Männchen verschobenes Geschlechterverhältnis bei Fangaktionen (FIETZ 1998, SCHMID & KAPPELER 1998, SCHMID 1999). Um Aussagen 15 zu einem geschlechtsspezifischen Vorhandensein von Langzeittorpor treffen zu können, kann daher das Geschlechterverhältnis bei Fangaktionen herangezogen werden. Auch bei M. rufus im Regenwald der Ostküste wird das Vorkommen von saisonalem Torpor vermutet (ATSALIS 2000). 2.5.4 Schlafplätze MARTIN (1972b) charakterisierte 22 von 32 gefundenen Schlafplätzen von Mausmakis als Baumhöhlen und sieben als Blattnester, die sich bei einem Durchmesser von ca. 20 – 25 cm gut konstruiert im dichten Laub befinden; nur in drei Fällen wurden Tiere schlafend im Blattwerk bzw. Gestrüpp vorgefunden. Im Kirindy wurden Mausmakis nach FIETZ (1995) und SCHMID (1997) in Höhlen und Baumspalten vorgefunden. In Studien im Kirindy waren alle 35 erfaßten Schlafplätze Baumhöhlen (FIETZ 1995), bzw. es wurde von 50 registrierten Schlafplätzen nur einmal ein M. murinus ohne zusätzlichen Schutz im dichten Laub vorgefunden (SCHMID 1997). Die übrigen Schlafplätze waren Baum-/Asthöhlen und Baumspalten, während Blattnester nie beobachtet wurden (SCHMID 1997). In einer Studie in Ampijora über zwei kurze Zeiträume während der Trockenzeit wurden vorrangig Schlafhöhlen (N = 38 bzw. 39) und seltener Blattnester (N = 10 bzw. 1) identifiziert, ohne daß Tiere frei schlafend vorgefunden wurden (RADESPIEL 1998). Blattnester sollen öfter von Männchen als von Weibchen genutzt worden sein, wobei unklar blieb, ob die Tiere selbst Nestbau betrieben. Es wird eine intersexuelle Konkurrenz vermutet um Baumhöhlen, die als bessere und sicherere Schlafplätze angesehen werden (RADESPIEL 1998). EHRESMANN (2000) hingegen konnte bei 118 Schlafplätzen von M. murinus während der Trockenzeit keine Nestkonstruktionen feststellen. Während dieser Zeit wurden neben offenen Schlafplätzen von den Männchen bevorzugt Baumhöhlen (außerhalb der Paarungszeit im Mittel zu 62 % bzw. in der Paarungszeit zu 76 %) aufgesucht, wobei Schlafplätze vom Beobachter auch oft nicht genau lokalisiert werden konnten (im Durchschnitt zu 31 % außerhalb der Paarungszeit bzw. zu 15 % in der Paarungszeit). In einer sechswöchigen Feldstudie zwischen August und Anfang Oktober in Ampijoroa, Nordwest-Madagaskar, über Schlafgruppenzusammensetzung von M. murinus nutzte jedes Männchen seine Schlafplätze allein und exklusiv, während die Weibchen überwiegend zusammenschlafend vorgefunden wurden (RADESPIEL 1998, RADESPIEL et al. 1998). In 16 einer Folgestudie im gleichen Gebiet wurden die Männchen an dem überwiegenden Teil der Kontrolltage alleine an einem Schlafplatz aufgefunden; nur einmal ab Mitte Oktober bildeten zwei Männchen für eine Dauer von 11 Tagen eine Schlafgemeinschaft gegen Ende der Untersuchungszeit (RADESPIEL 2000). PAGES-FEUILLADE (1988) konnte zwischen Ende September und Anfang November insgesamt viermal zwei Männchen finden, die sich gemeinsam einen Schlafplatz teilten und vermutet, daß es sich um Tiere eines gleichen Wurfes handeln könne. EHRESMANN (2000) fand in einer achtmonatigen Feldstudie während der Trockenzeit bei höchstens fünf gleichzeitig besenderten Männchen nur einmal Mitte November zwei Männchen gleichzeitig an einem Schlafplatz. RADESPIEL (2000) schlug vor, daß intrasexuelle Konkurrenz der Männchen um Zugang zu Weibchen zu einem gewissen Grad von Intoleranz führen und damit verantwortlich für das überwiegend gefundene Alleinschlafen der Männchen sein sollte, welches im Kontrast zu den Schlafgemeinschaften der Weibchen stehe. 2.5.5 Reproduktionsbiologie Wie die meisten Lemuren haben auch die Grauen Mausmakis eine saisonale Fortpflanzungsphase. Die Weibchen von M. murinus bringen nach 2 Monaten Tragzeit (in Gefangenschaft 60,2 ± 1,7 Tage) 1 bis 4 Jungen zur Welt (PERRET 1982, WROGEMANN et al. 2000). In Gefangenschaft konnte bei nicht konzipierenden Weibchen im Abstand von 45 55 Tagen ein zweiter (PETTER-ROUSSEAUX 1962, GLATSTON 1979, HARVEY et al. 1987) bzw. dritter Östrus (PERRET 1982) oder selbst ein vierter Östrus (WROGEMANN et al. 2000) festgestellt werden. Es ist bekannt, daß M. murinus unter Laborbedingungen zweimal Jungtiere innerhalb der Reproduktionsphase gebären können (2 von 11 Weibchen, ANDRIANTSIFERANA et al. 1974; bzw. 1 von 33 Weibchen, PERRET 1982). Basierend auf Fangdaten in der Nähe von Morondava, West-Madagaskar, postulierte MARTIN (1972a, 1972b) in der ersten Freilandstudie an M. murinus, daß es nach der ersten Laktation zu einer zweiten Trächtigkeit und somit einer zweiten Geburtensaison zwischen Januar und März kommen könne. Nach bisherigen Erkenntnissen geht die Hauptpaarungszeit von M. murinus in Ampijoroa, Nord-West-Madagaskar von Mitte September bis Mitte Oktober (RADESPIEL 1998, 2000, PETERS 1999, SARIKAYA 1999). Nach Ende der Paarungszeit im September/Oktober 17 konnten in früheren Studien in Ampijoroa im November Kopulationversuche an zwei Weibchen beobachtet werden (PETERS 1999, SARIKAYA 1999). Während zu einem Kopulationsversuch keine weiteren Weibchendaten wie vorausgegangener Östrus oder Geburten vorhanden waren, wurde bei dem anderen Weibchen aufgrund der Daten ein vorausgegangener Abort vermutet (SARIKAYA 1999). Ob diese Weibchen in jener Reproduktionssaison erfolgreich reproduzierten, ist unbekannt. In der vorliegenden Studie sollen daher die Monate September bis November eine besondere Berücksichtigung erfahren. Die Reproduktionsphase von M. murinus in einem anderen Gebiet im Südwesten Madagaskars hingegen beginnt nicht vor Mitte Oktober1 (FIETZ 1998, ZIMMERMANN 1998), wobei das höchste Hodenvolumen im Oktober erreicht wird (SCHWAB 2000). Die Paarungszeit ist dort darüber hinaus auf ca. 4 Wochen im Jahr beschränkt (EBERLE & KAPPELER 1999). Als eine Besonderheit im Markierverhalten von Mausmakis ist neben dem Anogenitalmarkieren und dem Mundwinkelreiben (Kopfmarkieren) an einem Substrat das Urinwaschen zu nennen, welches sowohl bei Männchen als auch Weibchen auftritt (SCHILLING & PERRET 1987, BÜSCHING et al. 1998). Dabei urinieren die Tiere in die gewölbte Hand und reiben anschließend schnell ihre Fußsohle der gleichen Körperseite zweibis dreimal an der Hand ab. Die ganze Verhaltenssequenz wird dann meist mit den Gliedmaßen der anderen Körperseite wiederholt. Untersuchungen an M. murinus in Gefangenschaft zeigten, daß die Häufigkeit des Markierens des dominanten Tieres einer Gruppe zu Beginn der Paarungszeit stetig ansteigt und während des Proöstrus ein Maximum zeigt (GLATSTON 1983, LEBEC 1984). Ebenfalls wurde im Labor festgestellt, daß Pheromone im Urin von dominanten Männchen die Gonadenfunktion von subdominaten Männchen inhibieren und deren sexuelle Aktivität unterdrücken können (SCHILLING et al. 1984, SCHILLING & PERRET 1987). Bei M. murinus wurde aufgrund von Beobachtungen aus Gefangenschaftshaltungen mit klaren Dominanzverhältnissen zwischen Männchen und monopolisierbaren Paarungen zunächst auf ein polygynes Paarungssystem geschlossen (PERRET 1977, 1985). Zahlreiche Untersuchungen über Fortpflanzung und Sozialstruktur sind im Labor unter kontrollierten 1 EBERLE, Göttingen 2000 18 Bedingungen durchgeführt worden (PERRET 1977, PETTER-ROUSSEAUX 1980, SCHILLING & PERRET 1987, PERRET 1992, LINDEMANN 1996). Hierbei kamen teilweise widersprüchliche Ergebnisse zustande. Bei Untersuchungen von PERRET (1992) an Grauen Mausmakis blieben einmal etablierte Rangordnungen zwischen Männchen konstant, und subdominante Männchen wurden in ihrer Fortpflanzung inhibiert. In einer anderen Untersuchung (KUGEL 1993) bildete sich zwar eine lineare Rangfolge unter den Männchen aus, es schien jedoch kein Männchen in seiner Reproduktion inhibiert zu sein. LINDEMANN (1996) konnte nachweisen, daß unter Laborbedingungen Rangwechsel zwischen den Männchen auch während einer Reproduktionssaison auftreten können und vermutet, daß unterschiedliche Laborbedingungen wie z.B. Käfig- und Gruppengrößen und Verwandtschaftsgrade zu verschiedenen Ergebnissen führten. Weiter konnte in dieser Studie nachgewiesen werden, daß Paarungen sowohl bei dominanten als auch subdominanten Männchen vorkommen. Jedoch kamen nur bei dominanten Männchen ungestörte Paarungen mit den Weibchen vor. Dominante und subdominante Männchen könnten somit unterschiedliche Strategien verfolgen, um ihren Paarungserfolg zu erhöhen. Die Laborergebnisse deuteten darauf hin, daß es einen Zusammenhang zwischen dem Körpergewicht und dem sozialen Status eines Männchens gibt (PERRET 1992, LINDEMANN 1996). Bei Studien über Sozial- und Paarungssysteme wie auch Überlebensstrategien muß jedoch immer überprüft werden, in wieweit die im Labor gewonnenen Ergebnisse ins Freiland übertragbar sind. Die Gruppenzusammensetzung in Gefangenschaft und der zur Verfügung stehende Aktionsraum entsprechen nicht den natürlichen Verhältnissen im Freiland. Deshalb könnten sich die Mechanismen, die den Reproduktionserfolg im Freiland steigern, von denen in Gefangenschaft unterscheiden (FIETZ 1999). Frühere Beobachtungen von Microcebus murinus im Freiland führten zur Hypothese der Existenz sogenannter „population nuclei“, mit Weibchen und einem/wenigen zentralen, dominanten Männchen im Zentrum und vielen subdominanten Männchen in der Peripherie (MARTIN 1972b). Innerhalb der Populationskerne sollte ein Geschlechterverhältnis von zwei bis vier Weibchen zu einem Männchen herrschen (PETTER 1962, MARTIN 1972b). Zentrale Männchen sollen durch ihre Duftmarken periphere, subdominante Männchen in ihrer Reproduktion inhibieren können (SCHILLING & PERRET 1987). Erst durch Ausfall eines 19 zentralen Männchens soll ein peripheres Männchen diese Lücke besetzen und sich fortpflanzen können. Dies wurde nach neueren systematischen Freilandstudien in Frage gestellt. Eine Monopolisierung der Weibchen konnte nicht festgestellt werden (z.B. RADESPIEL 1998). Dennoch konnte bei den Männchen von M. murinus auch Verhalten beobachtet werden, daß auf contest competition und mate guarding hinzudeuten scheint (PETERS 1999) Die Aktionsräume der Männchen sind während der Paarungszeit größer als die der Weibchen, aber sie überlappen sowohl innerhalb als auch zwischen den Geschlechtern (LEBEC 1984, PAGES-FEUILLADE 1988, BARRE et al. 1988, RADESPIEL 1998). Die Männchen scheinen auf der Suche nach reproduktiven Weibchen umherzuziehen, da die Aktionsräume der Männchen innerhalb der Hauptpaarungszeit signifikant größer sind als außerhalb dieser Zeit (RADESPIEL 1998). SCHMID & KAPPELER (1998) nehmen an, daß eine Zunahme des Körpergewichtes kurz vor der Paarungszeit den Paarungserfolg von männlichen M. murinus erhöht. Nach FIETZ (1995) und PETERS (1999) scheint die Größe der Aktivitätsräume von dem Körpergewicht der Männchen abzuhängen: Schwerere Männchen sollen entsprechend größere Aktivitätsräume nutzen als leichtere Männchen. Die Abwesenheit von Sexualdimorphismus von M. murinus in der Körpergröße (FIETZ 1995, aber KAPPELER 1991) und der Eckzahngröße (KAPPELER 1993) deutet darauf hin, daß der männliche Reproduktionserfolg nicht so sehr vom physischen Wettbewerb vor der Paarung, sondern vielmehr vom postkopulativen Wettbewerb abhängt (CLUTTON-BROCK 1991, KREBS & DAVIES 1996). Dafür spricht auch, daß die Hoden der Männchen vergleichsweise groß sind (DIXSON 1987, KAPPELER 1996). SPÜHLER (1935) konnte an aus dem Südwesten Madagaskars stammenden M. murinus histologisch nachweisen, daß sich die auf etwa das Achtfache vergrößerten Hoden gegen Ende der Trockenzeit (Ende Oktober) in voller Spermiogenese befinden, wobei aber auch bereits erste Anzeichen einer beginnenden Involution auftraten. Diese Ergebnisse entsprechen Studien an anderen sich saisonal fortpflanzenden Tieren im Freiland, bei denen das Klimax der Spermiogenese und des Hodenvolumens mit der Paarungszeit zusammenfällt (DU MOND & HUTCHINSON 1967, FUENTES et al. 1991). 20 Die Studien aus neuerer Zeit aus dem Freiland legen bei M. murinus daher aufgrund von Daten zum Sexualmonomorphismus, Hodengröße, räumlicher Verteilung und postkopulatorischen Mechanismen ein promiskes Paarungssystem nahe, bei dem Männchen im als scramble competition genannten Wettbewerb (WELLS 1977) über die aktive Suche nach dispersen, rezeptiven Weibchen miteinander konkurrieren (SCHMID & KAPPELER 1998, FIETZ 1999, RADESPIEL 2000, SCHMELTING et al. 2000). Abhängig von den physischen Voraussetzungen, der Mobilität und den kognitiven Möglichkeiten, wie z.B. räumliches Erinnerungsvermögen könnten einige alternative Paarungsstrategien für jedes individuelle Männchen von M. murinus existieren (RADESPIEL 2000). Oft sind aber nicht genügend Daten über längere Zeiträume an größeren Tierzahlen vorhanden, die eine detaillierte Betrachtung der Ergebnisse und Rückschlüsse auf Reproduktionsstrategien ermöglichen würden (z.B. FIETZ 1999, PETERS 1999). 2.6 Methodischer Hintergrund und Zielsetzung Direkte Beobachtungen sind am leichtesten durchführbar an relativ seßhaften Tieren, die sich langsam fortbewegen und an den Beobachter habituiert sind oder im offenen Habitat leben (WHITE & GARROT 1990). Die kryptische Lebensweise von nachtaktiven Primaten, gepaart mit ihrer dispersen räumlichen Verteilung in unübersichtlichem Gelände machen aber direkte Verhaltensbeobachtungen im Freiland extrem schwierig. Muster von Aktionsraumüberlappungen zwischen Individuen sind daher Schlüsselparameter, die zur Charakterisierung von Sozialsystemen bei nachtaktiven Prosimiern verwendet werden, wobei die effektivste Methode zur Erfassung von individuellen räumlichen Bewegungen und sozialen Interaktionen die direkte Beobachtung von mit Radiotransmittern individuell gekennzeichneten Tieren ist (STERLING et al. 2000). In der Genauigkeit der Lokalisation unterliegt die Triangulation als indirekte Methode durch Kreuzpeilung der direkten Beobachtung. Andererseits können durch die Triangulation Daten von mehreren Individuen gleichzeitig gesammelt werden; sie gilt daher als die effektivste Methode zur Erfassung von Aktionsraumüberlappungen und Zugang zu Sozialpartnern (STERLING et al. 2000). Wenngleich eine Kombination von Triangulation und kontinuierlicher Fokusbeobachtung wünschenswert wäre, die Daten im Makrobereich (d.h. Überlappungensgrade in der Raumnutzung) und Mikrobereich (d.h. direkte soziale Interaktionen zwischen Individuen) 21 liefern würde, konnten STERLING et al. (2000) bei 27 seit 1977 veröffentlichten Studien an nachtaktiven Prosimiern keine Studie ausmachen, die sowohl Triangulation als auch Fokusbeobachtung für die Aufenthaltsbestimmung verwendete. Beide sind aber gleichermaßen wichtig, um Erkenntnisse zu gewinnen über Sozialsysteme bei nachtaktiven Prosimiern. In den mir weiter bekannten Studien, die beide Methoden verwendeten, „wurden aufgrund der schwierigen Beobachtungsbedingungen nur exemplarisch“ (RADESPIEL 1998) an drei (RADESPIEL 1998) bzw. vier Weibchen (SARIKAYA 1999) oder vier Männchen (PETERS 1999) Beobachtungen über kurze Zeitabschnitte durchgeführt (Gesamtdauer der Beobachtungen zwischen 32 h 5 min (RADESPIEL 1998) und 66 h 42 min (PETERS 1999)). Gerade bei den Lemuren sind jedoch detaillierte Langzeitstudien an verschiedenen Populationen in unterschiedlichen Habitaten nötig, um Informationen über Sozial- und Paarungssysteme der jeweiligen Spezies zu erlangen, da bei ihnen im Vergleich zu den Anthropoidea größere Flexibilität innerhalb einer Art herrscht (KAPPELER 1993). Bisherige Feldstudien zu M. murinus erstreckten sich über 6- bis 8-monatige Beobachtungszeiten während der Trockenzeit und der Hauptpaarungszeit (MARTIN 1972, SCHMID 1997, EHRESMANN 2000) oder über kürzere, bis zu 3 Monate dauernde Perioden, die um den Zeitraum der Hauptpaarungszeit angesiedelt waren (PAGES-FEUILLADE 1988, BARRE et al. 1988, FIETZ 1995, RADESPIEL 1998, PETERS 1999, SARIKAYA 1999). Langzeitstudien über die gesamte Reproduktionsphase, beginnend mit der Vergrößerung der Hoden der Männchen vor der Paarungszeit bis zum Ende der Regenzeit, sind für M. murinus bisher in keinem Gebiet durchgeführt worden. Ziel der hier vorliegenden erstmals durchgeführten Langzeitstudie über einen gesamten Jahreszyklus ist daher, erstmals das Verhalten von M. murinus in Nordwest-Madagaskar unter besonderer Berücksichtigung der Reproduktionsbiologie der Männchen vom Anfang bis zum Ende der Reproduktionszeit zu erfassen. Hierdurch sollen das Verhalten und die physische Kondition charakterisiert werden, die für den Reproduktionserfolg von Männchen von Bedeutung erscheinen. Zudem soll eine Basis für populations- und artübergreifende Vergleiche geschaffen werden. Hierfür werden systematische Fang- Wiederfangaktionen durchgeführt, die Aufschluß über die Populationsökologie geben sollen. Neben der Bestimmung der Populationsgröße wird zur Beurteilung möglicher saisonaler Torporphasen 22 auch das monatliche Geschlechterverhältnis ermittelt. Monatliche Erfassung der Hodenvolumina und Körpergewichte der gefangenen Männchen sollen zur Charakterisierung der physischen Kondition und ihrer Veränderung herangezogen werden. Durch die Besenderung von ausgewählten Individuen sollen durch die Kombination von Triangulation und kontinuierlicher Fokusbeobachtung erstmals Langzeitdaten im Makro- und Mikrobereich des Verhaltensspektrums für diesen Zeitraum registriert werden. Die tägliche Schlafplatzerfassung der Sendertiere dient dem Zweck, saisonale Verhaltensmuster in der Schlafplatzwahl und ihrer Bedeutung für das Überleben als auch eventuelle soziale Interaktionen (Konkurrenz, Koalitionen) aufzudecken. Neben der Ermittlung der Aktionsraumgrößen und der Nachtwanderstrecken soll unter anderem versucht werden, Rufund Markieraktivität sowie das Freßverhalten direkt zu erfassen. Durch Verknüpfung der genannten Techniken soll versucht werden, mögliche Fortpflanzungstaktiken der Männchen zu charakterisieren, die abhängig von ihrem individuellen Zustand wie z.B. Gewicht, Hodenvolumen, Alter und Erfahrung sein könnten. Vor dem Hintergrund der aktuellen Befundlage können bei männlichen Grauen Mausmakis folgende Reproduktionstaktiken postuliert werden, die in dieser Arbeit untersucht werden sollen: 1. Dominante Männchen sind Männchen mit überdurchschnittlich großen Hodenvolumina, überdurchschnittlich hohen Körpergewichten und großen Aktionsräumen. Dominante Männchen haben ausschließlichen Zugang zu Weibchen. Sie inhibieren subdominante Männchen mit kleinen Hodenvolumina und kleinen Aktionsräumen. 2. Ein nachweisbares Dominanzverhältnis mit reproduktiver Unterdrückung zwischen den Männchen existiert nicht. Alle Männchen können potentiell Zugang zu Weibchen haben. Sie konkurrieren durch prä- und postkopulativen Wettbewerb. Hierbei sind folgende Reproduktionstaktiken denkbar: 2a) Männchen mit überdurchschnittlich hohen Körpergewichten können längere Nachtwanderstrecken als leichte Männchen zurücklegen, da der Energieverbrauch und somit die Körperkondition mit der zurückgelegten Strecke korreliert und haben daher größere Aktionsräume und zu mehr Weibchen Kontakt als leichte Männchen. 23 2b) Residente Männchen, die länger als ein Jahr im gleichen Gebiet leben, verfügen über eine bessere Kenntnis des Raumes und der Verteilung der limitierenden Ressourcen wie Schlafplätze und Weibchen als zugewanderte Männchen oder Jungtiere. Residente Männchen haben daher größere Aktionsräume und zu mehr Weibchen Kontakt als nicht residente Männchen. 24 3 3.1 Material und Methoden Untersuchungsgebiet Das Untersuchungsgebiet liegt im laubabwerfenden Trockenwald im Nordwesten Madagaskars (16°35’ südlicher Breite und 46°82’ östlicher Länge von Greenwich, 200 m über NN, Abb.1) in einem ca. 130 000 ha großen Naturreservat Madagaskars, das zwei Schutzgebiete einschließt: Das Forstschutzgebiet Réserve Forestière d’Ampijoroa sowie das Naturschutzgebiet Réserve Naturelle Intégrale de l’Ankarafantsika (JENKINS 1990). Der Wald ist phytogeographisch dem trockenen Subzonobiom der paläotropisch-afrikanischen Biomgruppe (des Zonobioms II) zuzuordnen (WALTER & BRECKLE 1984). Die Vegetation wird der Pflanzengemeinschaft Dalbergia-Commiphora-Hildegardia zugerechnet (JENKINS 1990). 3.1.1 Untersuchungsgebiet jardin botanique A Die Studie wurde im Waldgebiet « jardin botanique A » (JBA) durchgeführt, welches sich 2 km westlich der Station Forestière Ampijoroa befindet (Abb. 2). JBA ist genau vermessen und kartiert und hat eine Größe von 30.63 ha. Über die gesamte Fläche ist es durch 1 m breite und jeweils ca. 50 m voneinander entfernte Wege in ein Wege-Raster-System unterteilt; in der östlichen Hälfte ist zusätzlich ein Feingrid mit Pfaden im Abstand von ungefähr 10 x 10 m angelegt zwecks besserer Beobachtungsmöglichkeiten der dort lebenden Lemuren. Jeder Kreuzungspunkt ist durch ein dazugehöriges Baumschild gekennzeichnet. 3.1.2 Lemuren Neben den beiden Mausmaki-Arten M. murinus (Abb. 3) und M. ravelobensis kommen im Untersuchungsgebiet noch wenigstens sechs weitere Lemurenarten vor: Die ebenfalls nachtaktiven Arten Cheirogaleus medius, Lepilemur edwardsi, Avahi occidentalis, zwei kathermerale Arten Eulemur fulvus fulvus und Eulemur mongoz sowie der diurnale Propithecus verreauxi coquereli (MITTERMEIER et al. 1994, ZIMMERMANN et al. 1998). 25 Abb. 2. Untersuchungsbiet JBA Abb. 3. Microcebus murinus in JBA 26 3.1.3 Prädatoren Unter den mindestens neun im Ankarafantsika vorkommenden Schlangenspezies (GLAW & VENCES 1994) finden sich in Ampijoroa auch die bereits als Mausmaki-Prädatoren beschriebenen (GOODMAN et al. 1993) Arten Ithycyphus miniatus sowie die zur Familie der Boidae gehörenden Sanzinia madagascariensis (GLAW & VENCES 1994) und Acrantophis madagascariensis (eigene Beobachtungen). Auch die endemische Schleichkatzenart Cryptoprocta ferox, deren Prädatorenstatus für Microcebus ssp. in Kirindy (Westmadagaskar) nachgewiesen wurde (HAWKINS 1998), konnte beobachtet werden (eigene Beobachtungen). Zu den drei in Ampijoroa bekannten Eulenarten (LANGRAND 1990) zählen auch Tyto alba und Asio madagascariensis, ebenfalls Mausmakiprädatoren (GOODMAN et al. 1993). 3.2 Klima Der Trockenwald in Ampijoroa wird durch ein ausgeprägtes saisonales Klima mit einer kühleren achtmonatigen Trockenzeit von April bis November und einer wärmeren viermonatigen Regenzeit von Dezember bis März beeinflußt. Mitarbeiter der AnganokaZuchtstation des Durrell Wildlife Conservation Trust in Ampijoroa führen tägliche Temperatur- und Maximaltemperaturen Niederschlagsmessungen an der Station mit Erfassung der Minimal- und durch. Freundlicherweise wurden die zum Studienzeitraum (Mai 1998 bis April 1999) zugehörigen Daten zur Verfügung gestellt (vergl. Abb. 4). Im kältesten Monat Juli betrug die minimale Durchschnittstemperatur 15.4 °C (Extremwerte: 12.0 °C; 20.5 °C) und die maximale Durchschnittstemperatur 32.2 °C (Extremwerte: 31.0 °C; 34.5 °C). Erste vereinzelte Regenfälle gab es im Oktober (39.2 mm Gesamtniederschlag). Der regenreichste Monat war der Dezember mit 338 mm Gesamtniederschlag bei minimaler Durchschnittstemperatur von 21.8 °C (Extremwerte: 19.0 °C; 24.5 °C) und maximaler Durchschnittstemperatur von 33.8 °C (Extremwerte: 30.0 °C; 38.0 °C). 27 3.3 Untersuchungszeitraum Vom 13. Juli 1998 bis zum 08. April 1999 führte ich die Freilanduntersuchungen in Ampijoroa durch. Für die Monate Mai und Juni 1998 standen mir dankenswerter Weise die von Blanchard Randrianambinina und Solofonirina Rasoloharijaona erhobenen FangWiederfangdaten zur Verfügung. 3.4 Tiere 3.4.1 Individuelle Markierung und Vermessung Die Untersuchungen wurden an einer durch Fang-Wiederfang in JBA erfaßten Population von M. murinus durchgeführt. Jedes gefangene Tier wurde individuell gekennzeichnet, indem ihm ein Mikrotransponder (Transpondertyp ID-100, Fa. Telinject, D - Römerberg) subkutan injiziert wurde. Durch ein Transponderlesegerät (TROVAN LID-500, Fa. Telinject, D Römerberg) kann dieser Nummerncode lebenslang abgelesen werden, sofern das Tier den Transponder nicht kurz nach der Markierung verliert (Austritt durch die Injektionsstelle). Mit einer speziellen Ohrmarkierung durch kleine Einschnitte mit einer feinen Augenschere im Randbereich der Ohren (FIETZ 1995, RADESPIEL 1998) war eine zusätzliche individuelle Kennzeichnung eines jeden Neufangs gegeben. Zur Vereinfachung der Datenverwaltung wurden für die so markierten Tiere fortlaufende Tiernummern vergeben, wobei die letzten beiden Ziffern für das Jahr des Erstfanges stehen. An der Station wurden alle erstmals gefangenen Mausmakis individuell markiert, vermessen, gewogen und das Geschlecht bestimmt. Das Körpergewicht der gefangenen Tiere wurde mit einer Federwaage (Pesola, Messbereich bis 300 g), an die ein Baumwollbeutel mit dem Tier eingehängt werden konnte, auf 1 g genau bestimmt. Das Gewicht des Beutels wurde anschließend abgezogen. 3.4.2 Reproduktionsstatus Der Reproduktionsstatus der Tiere wurde bestimmt. Weibchen wurden nach RADESPIEL (1998) und BÜSCHING et al. (1998) in folgende Kategorien eingeteilt: Interöstrus, Proöstrus, Östrus, Postöstrus, Trächtigkeit und Laktation. 28 Bei den Männchen wurden mit einer Präzisonsschublehre (Kanon, Meßbereich bis 15 cm, Genauigkeit 0,1 mm) die Hodenmaße aufgenommen und nach BERCOVITCH (1989) das Hodenvolumen als Ellipsoidkörper berechnet. Bei der Vermessung kann nicht in Hoden und Nebenhoden differenziert werden. Das Hodenvolumen bezieht sich daher immer auf beide Hoden mit Nebenhoden: Hodenvolumen = 3.14 x Breite gesamt x (mittlere Länge)² 6 Die aufgenommenen morphometrischen Daten aller gefangenen Männchen der Population wurden miteinander verglichen und die saisonale Entwicklung analysiert. Unter Berücksichtigung der Weibchendaten sollen hierdurch Rückschlüsse auf den Beginn und das Ende der saisonalen Fortpflanzungsperiode gezogen werden. 3.4.3 Besenderung von Tieren Insgesamt wurden 12 männliche M. murinus mit Halsbandsendern (Fa. Biotrack, GB Dorset) ausgestattet. Ein Senderhalsband hat ein Gewicht von ca. 2.5 g. Die Toleranzgrenze für Sender liegt bei ca. 5 % des Körpergewichts des Tieres (COCHRAN 1980, KENWARD 1987). Daher wurden nur Mausmakis besendert, deren Körpergewicht mindestens 45 g betrug. Die Senderfrequenzen lagen zwischen 150 und 151 MHz. Verwendet wurden TW-4 Sender mit einer angegebenen Lebensdauer von drei bzw. fünf Monaten. Die letzteren waren nötig, da bereits erste Erfahrungen vorlagen, daß es mit Einsetzen der Regenzeit zu einer verringerten Fangbarkeit von Mausmakis kommen (PETERS 1999, SARIKAYA 1999) und dadurch der Austausch von Sendern Schwierigkeiten bereiten kann. Acht Tieren konnten am Ende der Untersuchungen die Sender wieder abgenommen werden. Die Peilanlage bestand aus einem Empfänger (TR-4 Receiver, Fa. Telonics, USA - Mesa, Arizona) mit einer Peilantenne (RA-14K, Rubber Ducky H, Fa. Telonics, USA - Mesa, Arizona). Die Empfangsreichweite betrug hierbei je nach Vegetationsdichte und Witterungsverhältnissen zwischen 40 und 100 m. Bei Bedarf konnte mit einer größeren Antenne (Fa. AWEK flelectronic GmbH, D – Schwülper) die Empfangsreichweite um etwa das Vierfache gesteigert werden. 29 3.5 Populationsökologie 3.5.1 Fang und Wiederfang Tab. 1. Fangaktionen Fangaktion Datum Mai 98 Jun 98 Jul 98 Aug 98 Sep 98 Okt 98 Nov 98 Dez 98 Jan 99 Feb 99 Mrz 99 Apr 99 17.-22.05. 17.-22.06. 13.-18.07. 16.-21.08. 15.-20.09. 10.-15.10. 11.-16.11. 10.-15.12. 04.-08.01. 30.01.-03.02. 01.-05.03. 29.03.-02.04. In monatlichen Abständen wurden Fangaktionen in JBA durchgeführt. Es wurden Lebendfallen (Sherman-traps, 23.5 cm x 8 cm x 9 cm) verwendet, welche an den Wegekreuzungen des Hauptwegesystems in 1 bis 2 m Höhe in Astgabeln befestigt wurden. Eine reguläre Fangaktion umfaßte drei Fangnächte in einem Zwei-Tagesintervall (Tab. 1). Insgesamt wurden 1180 Fallen während der regulären Fangaktionen aufgestellt. Zusätzliche Fangtage wurden durchgeführt, wenn z.B. in einer regulären Fangaktion nicht ausreichend geeignete Sendertiere gefangen wurden oder defekte Sender ausgewechselt werden mußten. Hierbei gewonnene Daten über Körpergewicht und Hodenvolumen der Männchen wurden berücksichtigt, um die Entwicklung dieser Parameter möglichst kontinuierlich und umfassend zu erfassen. In die Analyse der regulären Fangaktionen und die Berechnung der Populationsgröße gingen die Daten zusätzlicher Fangtage nicht mit ein. Im Mai und Juni 1998 wurden 90 Fallen pro Fangnacht aufgestellt, ab Juli wurden im Feingrid zwischen zwei Hauptwegen, die ca. 100 m voneinander entfernt waren, zusätzlich 10 Fallen aufgestellt. Daraus resultieren 100 aufgestellte Fallen pro Fangnacht ab Juli 1998. Die Fallen wurden am späten Nachmittag mit möglichst überreifen Bananen beködert und in den Monaten Juli bis November am darauffolgenden Morgen bei Sonnenaufgang kontrolliert. Leere Fallen wurden geschlossen und gefangene Tiere zur Station gebracht. Ab Dezember, als mit laktierenden Weibchen zu rechnen war, wurden die Kontrollgänge zwischen 2.30 Uhr und 3.30 Uhr begonnen. Ab diesem Zeitpunkt wurden nur Fallen mit Männchen eingesammelt. Bei den in die Fallen gegangenen Weibchen wurde an Ort und Stelle der Reproduktionsstatus erhoben und die Tiere anschließend frei gelassen. So war sichergestellt, daß laktierende Weibchen noch innerhalb der Nachtphase zu ihren Jungen zurückkehren konnten. 30 3.5.2 Fallennutzung Fangergebnisse werden beeinflußt durch die Anzahl und Verteilung der aufgestellten Fallen. Die Fallen waren gleichmäßig über JBA verteilt mit einem Abstand von höchstens etwa 50 m zwischen zwei Fallen. Ausgehend von Aktionsraumberechnungen von M. murinus (vergl. LEBEC 1984, PAGES-FEUILLADE 1988, BARRE et al. 1988, RADESPIEL 1998) wurde angenommen, daß jeder Mausmaki mindestens eine Falle erreichen konnte. Für jede Fangaktion wurde der Grad der Fallennutzung berechnet, d.h. wieviel Prozent der aufgestellten Fallen von Mausmakis und ggf. von anderen Tieren tatsächlich belegt waren. Hierdurch kann abgeschätzt werden, ob die Anzahl der Fänge möglicherweise durch die Anzahl der aufgestellten Fallen limitiert wurde. 3.5.3 Bestimmung der Populationsgröße Die meisten Populationen verändern sich kontinuierlich in ihrer Größe aufgrund von Geburten, Todesfällen, Immigrationen und Emigrationen und werden daher offene Populationen genannt (KREBS 1989). Unter Anwendung der Jolly-Seber Methode (KREBS 1989) können Populationsdichte, Überlebenswahrscheinlichkeit und Zu- oder Abnahme einer offenen Population berechnet werden. Als Voraussetzung für die Jolly-Seber Methode müssen gelten: 1. Jedes Individuum hat die gleiche Wahrscheinlichkeit gefangen zu werden, unabhängig davon, ob es markiert oder unmarkiert (Erstfang) ist. 2. Jedes markierte Individuum hat die gleiche Überlebenswahrscheinlichkeit von einer Fangperiode bis zur nächsten. 3. Individuen verlieren nicht ihre Markierungen, und Markierungen werden nicht übersehen. 4. Die Zeit der Fangaktion ist vernachlässigbar in Relation zu den Fangintervallen. Die Tiere wurden individuell gekennzeichnet (mit Mikrotranspondern), was für die Annahme der ersten drei Vorraussetzungen nötig ist. Mikrotransponder werden in der Tiermedizin bei zahlreichen Tierarten zur schmerzfreien und dauerhaften individuellen Markierung eingesetzt. Die subkutan injizierten Mikrotransponder beeinträchtigen oder behindern die markierten Tiere in keiner Weise bei der Ausführung ihrer Lebensgewohnheiten (RIVAL 1999). Somit sind diese Voraussetzungen für die Anwendung der Jolly-Seber Methode gegeben. 31 Die geschätzte Populationsgröße Nt kann berechnet werden durch die Formel: Nt = Mt /αt Wobei Mt = (st +1) Zt + mt Rt + 1 und αt = mt + 1 nt + 1 st = Anzahl der freigelassenen Individuen nach der Fangaktion t Zt = Anzahl der Individuen, die vor Fangaktion t, aber nicht in t und wieder in einer Fangaktion nach t gefangen worden sind. Rt = Anzahl der st Individuen, die in einer späteren Fangaktion wiedergefangen werden. mt = Anzahl der gefangenen Individuen in Fangaktion t, die bereits markiert waren. nt = Gesamtzahl der in Fangaktion t gefangenen Individuen. Zur Schätzung der Konfidenzintervalle wird die Formel nach KREBS (1989) angewandt. Die Annahme der gleichen Fangbarkeit aller Tiere muß vor Anwendung der Jolly-Seber Methode getestet werden, um zu erfassen, wie verläßlich die errechneten Schätzungen sind. Ungleiche Fangbarkeit ist im wesentlichen auf drei Gründe zurückzuführen (EBERHARDT 1969): 1. Verhalten des Tieres in Fallennähe. 2. Lerneffekte bereits gefangener Tiere, die Fallen zu meiden oder bevorzugt in diese zu gehen. 3. Ungleiche Fangbarkeit aufgrund der Lage der Fallen. Die Annahme der gleichen Fangbarkeit in einer offenen Population wurde mit dem LeslieChitty-Chitty Test (LESLIE et al. 1953) überprüft. Hier wird die Anzahl Z‘t der tatsächlichen Neufänge bis zur Fangaktion t verglichen mit der erwarteten Anzahl von Neufängen. Der Beobachtungswert Z‘t ergibt sich aus: Z’t obs = st - mt Der Erwartungswert wird berechnet durch: Z’t exp = (Mt - mt + st) - Mt / αt + dt αt + 1 wobei dt = Anzahl der in Fangaktion t gefangenen Tiere, die nicht in die Population zurückkehren. 32 Als Ergänzung zur Jolly-Seber Methode wurde zusätzlich die Minimum Number of Animals known Alive (MNA-Methode; PETRUSEWICZ & ANDRZEJEWSKI 1962) berechnet. Die MNA-Methode beruht darauf, auch die Tiere im Gebiet als anwesend zu bewerten, wenn sie in Fangaktionen vorher und nachher in Lebendfallen gefangen werden konnten. Diese Tiere werden zu der Anzahl der in der Fangaktion gefangenen Tiere addiert. Die untersuchte Population setzte sich aus allen im Untersuchungszeitraum gefangenen Grauen Mausmakis zusammen. Da für jedes Tier das Geschlecht bestimmt wurde, konnte das Geschlechterverhältnis für den gesamten Untersuchungszeitraum errechnet werden. Um eine mögliche Verschiebung des Geschlechterverhältnisses im Verlauf der Studie zu erfassen, wurde es zusätzlich für jede Fangperiode getrennt analysiert. 3.6 Sendertiere Auswahlkriterien für die Besenderung eines Männchens waren sein Körpergewicht bei seinem ersten Fang im Untersuchungszeitraum, sein Fangort und das Jahr seines Erstfanges im Untersuchungsgebiet. Es sollten sowohl schwere als auch leichte Männchen besendert werden. Zur Beurteilung dieses Kriteriums wurde das Körpergewicht aller in der gleichen Fangaktion gefangener M. murinus - Männchen gemittelt. Als schwere Männchen wurden Tiere angesehen, deren Körpergewicht über dem Mittelwert lag, leichte Männchen waren solche mit Körpergewichten unterhalb des Mittelwertes. Der Fangort sollte im Bereich des Feingrid liegen, da dort die Bedingungen für direkte Verhaltensbeobachtungen aufgrund des engmaschigen Wegesystems geeigneter waren als in den anderen Bereichen von JBA. Männchen, die bereits in Vorjahren im Untersuchungsgebiet gefangen worden waren, wurden als Alttiere oder residente Männchen bezeichnet, 1998 erstmals gefangene Tiere als Erstfänge oder nicht-residente Männchen. Nach der ersten regulären und der ersten zusätzlichen Fangaktion konnten zehn als geeignet erscheinende M. murinus - Männchen besendert werden (Tab. 2). Dies waren fünf bereits aus den Vorjahren bekannte Männchen (residente Männchen) und fünf 1998 zum ersten Mal gefangene Tiere (nicht-residente Männchen). Das Tier 125-96 hatte bei seinem Erstfang im Juli 1998 keinen Mikrochip, sondern nur eine alte Ohrmarke. Aufgrund der molekulargenetischen Analyse der erneut genommenen Gewebeprobe konnte dieses Tier im nachhinein eindeutig als das Männchen 125-96 identifiziert werden (eigene Ergebnisse, unveröffentlicht). 33 Von den fünf residenten Männchen wurden vier als „schwere Männchen“ klassifiziert, die übrigen Sendertiere als „leichte Männchen“. Nach täglichen Schlafplatzkontrollen über einen Monat und einer Triangulationsphase wurde am 20.08.1998 einem ungeeigneten Männchen (52-98), welches sich nur außerhalb von JBA bewegte, der Sender abgenommen und ein anderes Männchen besendert. Das ergab ab August fünf „schwere“ (vier Alttiere, ein Erstfang) und fünf „leichte“ (vier 1998 erstmals gefangene Männchen, ein Alttier) für weitergehende Untersuchungen. Tab. 2. Besenderte M. murinus Männchen Tier Körpergewicht* besendert am Senderausfall Senderabnahme 78-98 Leicht 16.07.98 ab 23.03.99 nicht möglich 68-98 Leicht 16.07.98 23.01.-26.02.99 29.03.99 55-97 Leicht 16.07.98 ab 21.03.99 29.03.99 75-95 Schwer 16.07.98 ab 24.03.99 29.03.99 94-98 Leicht 19.07.98 ab 16.12.98 nicht möglich 007-97 Schwer 19.07.98 ab 23.03.99 29.03.99 52-98 Leicht 19.07.98 20.08.98 125-96 Schwer 21.07.98 ab 27.03.99 29.03.99 84-98 Leicht 21.07.98 17.11.98 111-96 Schwer 21.07.98 ab 01.12.98 nicht möglich 26-98 Schwer 22.08.98 02.11.-10.12.98 nicht möglich 110-96 Leicht 03.02.99 01.03.-18.03.99 29.03.99 Körpergewicht*: Leicht / Schwer = Unter bzw. über dem Mittel aller zum gleichen Zeitpunkt gefangenen M. murinus – Männchen. Am 02.11.1998 war ein Sender vorzeitig ausgefallen. Das betreffende Männchen 26-98 konnte am 11.12.1998 gefangen und der defekte Sender gegen einen neuen ausgetauscht werden, so daß für dieses Tier vom 02.11. – 10.12.1998 keine Daten vorliegen. Das Sendermännchen 84-98 wurde am 17.11.1998 tot aufgefunden, so daß für dieses Tier von diesem Zeitpunkt an keine Daten mehr vorliegen. Im Dezember fielen zwei weitere Sender aus und die Tiere (111-96, 94-98) konnten bis Projektende nicht mehr wiedergefangen werden. Das Männchen 110-96, welches mit einem der vorgenannten Tiere zweimal zusammen am gleichen Schlafplatz anzutreffen war, ist daraufhin am 03.02.1999 zusätzlich besendert worden. 34 3.6.1 Fallennutzung durch Sendermännchen Die Möglichkeit der täglichen Lokalisation der Sendertiere bei intaktem Sender erlaubt eine genauere Betrachtung der Fangbarkeit der Sendertiere. In einer Fangaktion haben Tiere, welche sich im Fallengebiet aufhalten, insgesamt dreimal die Möglichkeit, in eine Falle zu gehen. Wenn bekannt ist (durch tägliche Schlafplatzkontrollen), ob sich das jeweilige Tier während der Fangaktion im Gebiet aufhält, kann berechnet werden, wie oft ein Sendertier die Möglichkeit genutzt hat, in eine Falle zu gehen. Bei vorzeitigem Senderausfall kann nicht ausgeschlossen werden, daß sich das Tier nicht mehr im Gebiet befindet. In der weiteren Analyse kann ein solches Tier daher nicht mehr berücksichtigt werden. Unterschiedliche prozentuale Anteile deuten auf unterschiedliche Fallennutzung hin. 3.6.2 Schlafplätze Täglich nach Sonnenaufgang wurden für die besenderten Tiere die Schlafplätze bestimmt und markiert. Vom 18.07.1998 bis zum 04.04.1999 sind von allen Sendermännchen insgesamt 1244 (427 verschiedene) genutzte Schlafplätze erfaßt und charakterisiert worden. Lokalisation Für die Lokalisation der Schlafplätze wurden die Tiere mit dem Empfänger und der Peilantenne geortet. Am Ort des Signaloptimums wurden die Tiere optisch (gegebenenfalls mit einem Fernglas für höhere Baumregionen) gesucht. Nicht einsehbare Baumhöhlen wurden mit einem Transponderlesegerät auf eventuell vorhandene und bereits markierte Tiere kontrolliert. Für Schlafhöhlen über 2.20 m Höhe stand eine Aluminium-Steckleiter (bis auf 5 m verlängerbar) zur Verfügung. Mit Hilfe des Transponderlesegerätes konnten unbesenderte, aber gechipte Tiere identifiziert werden, falls diese zusammen mit einem Fokusmännchen den Schlafplatz nutzten. Die Entfernung in Metern und die Richtung (ermittelt mit einem Südhalbkugelkompaß) des Schlafplatzes zum nächstgelegenen und bereits vermessenen Punkt wurde notiert und später auf einer Karte von JBA für jedes Sendertier festgehalten. Jeder Schlafplatz bekam eine ID-Nummer und wurde mit dauerhaften Aluminiumbaumschildern versehen. 35 Qualität Für die weitergehenden Untersuchungen wurde jeder Schlafplatz eingeteilt in eine der beiden Kategorien A) Baumhöhle oder B) offen im Gestrüpp/Blattwerk. Zur Kategorie A) zählten neben Baumhöhlen alle anderen verdeckten Plätze wie Asthöhlen oder Rindenhülsen. Zur Kategorie B) zählten offene Plätze im Gestrüpp, Blattwerk oder zwischen Laubblättern sowie Plätze in Astgabeln oder unter Spinnweben. 3.6.3 Radiotelemetrie Die nächtlichen Aktivitäten der Sendertiere sollten durch unterschiedliche Methoden erfaßt werden, um einen Einblick in die Fortpflanzungsstrategien und mögliche Unterschiede zwischen einzelnen Männchen zu gewinnen. Zur Bestimmung der Aktionsräume und der Aufenthaltsorte der Sendermännchen wurde die Methode der Radiotelemetrie angewandt. Zur indirekten Lokalisation, bei der kein Sichtkontakt zu den Tieren nötig ist, wurde die Triangulationsmethode verwendet. Bei der direkten Verhaltensbeobachtung wurde ein Tier ebenfalls mit Hilfe des Sender-Empfängersystems bis zur Herstellung eines Sichtkontaktes angepeilt und anschließend direkt beobachtet. Triangulationsmethode Bei der Triangulationsmethode werden durch Kreuzpeilung von bekannten Standorten aus der jeweilige Aufenthaltsort eines besenderten Tieres ermittelt. Sind die Koordinaten beider Standorte bekannt, so lassen sich mit Hilfe der Peilwinkel die Koordinaten des Aufenthaltortes berechnen (WHITE & GARROTT 1990). Diese Berechnungen wurden mit dem Computerprogramm TRACKASC durchgeführt (GANZHORN 1996). Bei einer genügend großen Anzahl von Aufenthaltsorten pro Tier kann die Aktionsraumgröße des Tieres für den Triangulationszeitraum bestimmt werden. Voraussetzung hierfür ist die Unabhängigkeit der Datenpunkte, d.h. es sollte zwischen zwei Peilungen desselben Tieres ein Zeitintervall liegen, der es dem Tier ermöglicht, theoretisch jeden Ort in seinem Aktionsraum zu erreichen (SWIHAR & SLADE 1985, WHITE & GARROTT 1990). Die älteste und meistangewandte Methode zur Bestimmung des Aktionsraumes ist die des Minimum- Konvex-Polygons (MOHR 1947, WHITE & GARROTT 1990, KENWARD & HODDER 36 1996). Es wird gebildet durch die Verbindung der äußeren Aufenthaltsorte zu einem KonvexPolygon. Diese Fläche wird anschließend berechnet. Ab 30 Aufenthaltsorten pro Tier werden in der Regel stabile Minimum-Konvex-Polygone erhalten (KENWARD & HODDER 1996). Minimum-Konvex-Polygone wurden mit dem Programm RANGESV (KENWARD & HODDER 1996) auf der Basis aller Aufenthaltsorte (100 %-Polygon) berechnet. 100 %Polygone sind weit gebräuchlich zur Bestimmung von Aktionsräumen und daher hilfreich bei Vergleichen, wenngleich ein Aktionsraum durch einen einzelnen Wert unter Umständen stark beeinflußt werden kann (HARRIS et al. 1990). Tab. 3. Triangulationsphasen Triangulation Datum Jul 98 Aug 98 Sep 98 Okt 98 Nov 98 Jan 99 Feb 99 Mrz 99 22. - 31.07. 22. - 30.08. 21. - 27.09. 24. - 30.10. 15. - 19.11. 17. – 28.01. 17. – 22.02. 21. – 25.03. Monatlich wurden Triangulationsphasen in (Tab. den 3) in Nächten der jeweils zwei hintereinander folgenden, ca. sechsstündigen Schichten trianguliert (18°° Uhr bis 24°° Uhr und 0°° Uhr bis 6°° Uhr, d.h. Sonnenuntergang bis Sonnenaufgang). Die besenderten Tiere wurden im Karussellverfahren trianguliert, d.h. eines nach dem anderen bei einer in jeder Triangulationsnacht unterschiedlichen Reihenfolge. Nach RADESPIEL (1998), PETERS (1999) und SARIKAYA (1999) wurde als Zeitintervall 35 – 60 min zwischen zwei Lokalisationsbestimmungen für ein Tier gewählt. Über den gesamten Triangulationszeitraum wurden im Mittel für jedes einzelne Tier 49 Aufenthaltsorte in jeder Triangulationsphase bestimmt (Minimum 29 Aufenthaltsorte, Maximum 55 Aufenthaltsorte). Aktionsraumüberlappungen Mit Hilfe des Programms RANGESV wurden die prozentualen Überlappungsgrade der Aktionsräume untereinander in jeder Triangulationsphase berechnet. Die Anzahl der nicht überlappenden Aktionsräume wurde der der sich überlappenden Aktionsräume gegenübergestellt. Zur Beurteilung der Qualität der Überlappungen wurde eine Matrix der Sendertiere zueinander erstellt (Anteil Überlappung Tier A zu Tier B, Anteil Überlappung Tier B zu Tier A etc.). Paare ohne gemeinsame Überlappungen wurden von der weiteren 37 Analyse ausgeschlossen. Anschließend wurden die prozentualen Überlappungen in zehn verschiedene Gruppen (0-10 % Überlappung, 10-20 % Überlappung etc.) eingeteilt und monatsweise verglichen. Zusätzlich wurde der durchschnittliche Überlappungsgrad für sich überlappende Aktionsräume errechnet. 3.6.4 Verhaltensbeobachtungen Die direkten nächtlichen Verhaltensbeobachtungen erfolgten nach dem focal-animal-sampling (J. ALTMANN 1974) mit einem Fokustier pro Beobachtung als continuous recording (MARTIN & BATESON 1992). Die Daten wurden aufgenommen mit einem Psion Workabout 1MB Hand Held Computer (Fa. Noldus, NL - Wageningen), nachdem eine Konfiguration mit Event-Recording Programm für Psion Workabout erstellt worden war. Die Analyse der Daten erfolgte mit dem OBSERVER-Programm (Fa. Noldus, NL - Wageningen). Fokusbeobachtungen Die Zeiträume größter Aktivität scheinen im ersten und dann wieder im letzten Drittel der Nacht zu liegen (MARTIN 1972b). Während der Fokusbeobachtungen (Tab. 4) wurde daher jedes besenderte Männchen in einer Nacht für jeweils zwei dreistündige Intervalle am Anfang und Ende der Nacht beobachtet. Die Reihenfolge der Männchen war randomisiert. Der Beginn des ersten Zeitintervalls lag zwischen 17.46 Uhr und 18.29 Uhr, der Beginn des zweiten Zeitintervalls zwischen 2.49 Uhr und 2.02 Uhr. Die unterschiedlichen Anfangszeiten sind durch die kürzer werdenden Nächte zum Ende des Südwinters hin zu erklären, da die ersten drei Stunden nach Verlassen des Schlafplatzes und die vermeintlich letzten drei Stunden vor Aufsuchen des Schlafplatzes erfaßt werden sollten. Beim ersten Intervall wurden die Tiere an ihren Schlafplätzen aufgesucht und mit dem Fokusprotokoll begonnen, sobald die Tiere das erste Mal aus der Schlafhöhle schauten oder an offenen Plätzen sitzend die Umgebung beobachteten. Im zweiten Nachtabschnitt wurden die Tiere anhand des Peilsignals geortet und beim ersten Sichtkontakt mit dem Protokoll begonnen. Suchte das Fokustier im zweiten Zeitintervall einen Schlafplatz mindestens 150 min nach Beobachtungsbeginn auf, so wurde 15 min vor dem Schlafplatz gewartet und dann bei Nichtveränderung die Beobachtung beendet. Bei starken Regenfällen mußte teilweise vor dem eigentlichen Fokusende 38 abgebrochen werden, wenn die technischen Geräte aufgrund der eindringenden Feuchtigkeit vorzeitig versagten. Insgesamt wurden 331h 13min 12sec nächtliche Fokusbeobachtungen an M. murinus – Männchen analysiert (Tab. 4). Tierkontakt bestand in insgesamt 128h 4min 37sec. Als Tierkontakt wurde gewertet, wenn das Tier vom Beobachter gesehen werden konnte. Da im November erneut östrische Weibchen gefangen werden konnten, was auf den Beginn einer zweiten Paarungszeit hindeutete, wurde im November eine weitere Fokusphase am Ende des Monats durchgeführt. Hierdurch sollten mögliche Interaktionen im Reproduktionskontext erfaßt werden. Tab. 4. Fokusbeobachtungen Fokusphasen Datum Sep 98 02. - 14.09. Okt 98 29.09. - 09.10. Anfang Nov 98 30.10. - 09.11. Ende Nov 98 19. - 28.11. Jan 99 08. – 18.01. Feb 99 05. – 15.02. Mrz 99 05. – 19.03. Beobachtungszeit Anteil Tierkontakt N beobachtete Tiere 59.28 h 56.36 h 48.37 h 46.15 h 40.46 h 41.86 h 38.74 h 45.30 % 44.30 % 40.70 % 32.50 % 32.50 % 37.70 % 33.50 % 10 10 9 8 7 7 7 Während der Beobachtungen wurden, wenn möglich, die Aufenthaltshöhe, der Aufenthaltsort, Bewegungs- und Fressaktivität sowie Sozial-, Ruf- und Markierverhalten bestimmt. Aufenthaltshöhe Die als durchgehender state (MARTIN & BATESON 1992) definierte Aufenthaltshöhe eines Tieres wurde in sechs Kategorien eingeteilt: Am Boden, bis 1 m Höhe, 1 – 2 m Höhe, 2 – 5 m Höhe, über 5 m Höhe und unbekannte Höhe. Die einzelnen Höhen wurden geschätzt. In der Kategorie „unbekannte Höhe“ bestand kein Tierkontakt. Nachtwanderstrecken Die Nachtwanderstrecken wurden während der Fokusbeobachtungen mit dem Psion Workabout Hand Held Computer festgehalten. Markante Punkte, die auf der Wegstrecke eines Tieres lagen wie z.B. Kreuzungspunkte des Feingrid/Wegegitternetzes oder markierte 39 Schlafbäume wurden chronologisch eingegeben. Diese zusätzlich in die Fokusprotokolle mit aufgenommenen Daten wurden bei der Auswertung auf Karten von JBA übertragen und miteinander verbunden. Zwischen dem Endpunkt des ersten Intervalls und dem Anfangsaufenthaltsort des zweiten Intervalls einer Fokusnacht wurde eine Gerade gezogen als mindestens zurückgelegte Wegstrecke. Der so insgesamt mindestens zurückgelegte Weg eines jeden Tieres pro Fokusnacht wurde von Hand auf der Karte vermessen. Verhaltenskategorien Als Verhaltenskategorien wurden solitäre Verhaltensweisen, soziale Interaktionen sowie die Laut- und Markieraktivitäten der Sendermännchen aufgenommen. Als solitäre Verhaltensweisen gelten solche, die unabhängig von anderen Tieren ausgeführt wurden: • Autogrooming (eigene Fellpflege) • Ruhen (Sitzen auf einer Stelle, am Schlafplatz als auch während der Nachtwanderung) • Lokomotion (Fortbewegung) • Fressen (Nahrungsaufnahme). Das Fressverhalten wurde weiter spezifiziert hinsichtlich der Nahrungsquelle. Nahrungskategorien waren Insekten, Früchte, Insektensekret, Baumexsudate, unbekannte bzw. nicht erkennbare Nahrung oder Sonstiges. Als Insektensekret wurden die stark zuckerhaltigen Absonderungen (HLADIK et al. 1980) der Homopteralarven Flatidia coccinea bezeichnet. Die Larven leben während der Trockenzeit und sind dann in Kolonien anzutreffen (HLADIK et al. 1980, CORBIN & SCHMID 1995, eigene Beobachtung). Ihr zunächst flüssiges Sekret tropft auf Äste, Blätter und Boden und trocknet dort zu einer weißen, kristallinen Masse, die von Mausmakis aufgeleckt wird (CORBIN & SCHMID 1995, eigene Beobachtung). In die Kategorie Baumexsudate fielen Baumharze oder Blütennektar. In der Kategorie unbekannte Nahrung konnte nicht erkannt werden, um welche Art der Nahrung es sich handelte. Hier nicht aufgeführte Nahrung kam in die Kategorie „Sonstiges“. Hierzu gehörten z.B. Spinnen oder kleinere Geckos als Beutetiere. Futterbäume wurden mit gelben Markierbändern gekennzeichnet, auf denen Datum und Futterkategorie vermerkt wurde. Von den Futterbäumen wurden Blätter und, wenn möglich, Früchte und Blüten als 40 Bestimmungsproben gesammelt und in einer Pflanzenpresse aufbewahrt. Diese Proben wurden von wissenschaftlichen Mitarbeitern des Parc Botanique et Zoologique de Tzimbazaza in Antananarivo nach Familie und gegebenenfalls Gattung und Art bestimmt. Als soziale Interaktionen wurden solche Verhaltensweisen definiert, welche in Zusammenhang mit anderen Mausmakis ausgeführt wurden. Diese Aktivitäten wurden weiter unterteilt in A) soziopositive und B) sozionegative Verhaltensweisen. In A) wurden als Kategorien aufgenommen: • Nähe (Das Fokustier bewegt sich in einem Umkreis von bis zu etwa 4 m zu einem anderen Tier). • Kontaktsitzen (Das Fokustier und ein anderes Tier sitzen mit Körperkontakt zusammen). • Allogrooming (Das Fokustier und ein anderes Tier betreiben gegenseitige Fellpflege). • Kopulation (Das Fokustier kopuliert mit einem Weibchen). In B) wurden als Kategorien aufgenommen: • Jagen (Das Fokustier jagt ein anderes Tier) • Fliehen (Das Fokustier flieht vor einem anderen Tier) • Kämpfen (Das Fokustier kämpft mit einem anderen Tier) Als Sozialpartner wurden aufgenommen: • Bekanntes Tier (Dem Beobachter bekanntes Tier, z.B. anderes Sendertier, Schlafplatzpartner) • Unbekanntes Männchen • Unbekanntes Weibchen • Unbekanntes Tier (Geschlecht des Sozialpartners für den Beobachter nicht zu erkennen) Die Zeitdauer der solitären Verhaltensweisen und der Sozialaktivitäten wurde in Beziehung gesetzt zur Tierkontaktzeit (Zeit, in der der Beobachter Sichtkontakt zum Fokustier besaß). Für jede einzelne Verhaltenskategorie wurde der Medianwert aller Fokusmännchen für jede Fokusphase berechnet. Unabhängig von der Zeitdauer wurden die Häufigkeiten der soziopositiven und sozionegativen Sozialaktivitäten für die Monate ausgewertet, in denen der Medianwert der Sozialaktivität größer Null war. Aufgrund der geringen Zeitdauer der einzelnen Sozialaktivitäten eines jeden Tieres wurden die Daten der jeweiligen Kategorie pro 41 Tier zusammengefaßt. Es wurde dann berechnet, wieviele Fokusmännchen eine bestimmte Sozialaktivität in der jeweiligen Fokusphase zeigten. Hinsichtlich der Bewertung der Nahrungszusammensetzung wurde angenommen, daß bei gleichem Nahrungsangebot während einer Fokusphase die verschiedenen Tiere auch die gleiche Nahrung nutzen. Daher wurden die Anteile der einzelnen Nahrungskomponenten aus der Gesamtdauer der Verhaltenskategorie „Fressen“ für jede Fokusphase berechnet. Markier- und Lautaktivitäten wurden als Ereignisse, als sogenannte events aufgenommen. Hierbei wurde daher nur die Häufigkeit, nicht jedoch die Dauer eines einzelnen Verhaltens protokolliert. Ein Verhalten wurde als event aufgenommen, wenn es sich nur über einen relativ kurzen Zeitraum erstreckte, wie z.B. eine bestimmte Körperbewegung oder Vokalisationen (MARTIN & BATESON 1992). Bei der Auswertung wurde für eine Fokusphase jeder event zunächst in Relation zur Tierkontaktzeit gesetzt. Zur besseren Übersichtlichkeit wurde das Verhalten anschließend auf die Frequenz pro Stunde umgerechnet und der Median über die beobachteten Tiere für jede Fokusphase ermittelt. In der Kategorie Markieraktivität wurden als events folgende Verhaltensweisen aufgenommen: • Urinwaschen (Tier uriniert in die gewölbte Hand und reibt anschließend schnell die Fußsohle der gleichen Körperseite zwei-bis dreimal an der Hand ab) • Anogenitalmarkieren (Tier rutscht mit der Genital- und Afterregion über das Substrat) • Kopfmarkieren (Tier reibt mit den Mundwinkeln über das Substrat). In der Kategorie Lautaktivität wurden als events aufgenommen die Verhaltensweisen: • Triller (Kontaktruf, gehäuft in der Paarungszeit, ZIMMERMANN & LERCH 1993) • Langpfiffe (Kontaktruf, ZIMMERMANN 1995) • Kurzpfiffe (Achtungsruf, ZIMMERMANN 1995) • Grunzer (Lautäußerung bei Verteidigung, ZIMMERMANN 1995) • Tsäks (Lautäußerung im agonistischen Kontext, ZIMMERMANN 1995). Da Tsäks meist bei Körperkontakten zwischen zwei Tieren auftreten und in Kampfsequenzen oft von beiden Tieren geäußert werden, können agonistische Kontakte auch mit Hilfe der 42 Tsäkhäufigkeit quantifiziert werden. In dieser Untersuchung wurden daher alle Tsäks als events in das Fokusprotokoll aufgenommen, an denen das Fokustier beteiligt war. 3.7 Datenverarbeitung und statistische Verfahren Die Datenverarbeitung fand mit Hilfe der Programme Word 97, Excel 97, Corel Draw 8.0, Statistica 5.0. und S-PLUS2000 statt. Die Aktionsraumanalyse wurde mit den Programmen TRACKASC (GANZHORN 1996) und RANGESV (KENWARD & HODDER 1996) durchgeführt. Die Auswertung der Fokusprotokolle wurde mit dem OBSERVER Base Package der Fa. Noldus (NL – Wageningen) vorgenommen. Die statistische Auswertung geschah computergestützt (Statistica 5.0). Welcher Test zur Überprüfung der Aussagekraft der Daten eingesetzt wurde, ist im jeweiligen Ergebnisteil angegeben. Grundsätzlich gilt bei allen Tests eine angenommene Irrtumswahrscheinlichkeit α = 0,05 als Signifikanzgrenze, d.h. daß bei allen Ergebnissen mit p < 0,05 die Nullhypothese zurückgewiesen wurde. Als Trend wurden Werte von p zwischen 0,05 und 0,1 angesehen. Zur Verdeutlichung werden in Diagrammen die Signifikanzen durch das Zeichen „ * “ kenntlich gemacht. Vergleich von ein oder zwei Stichproben Um auf Unterschiede innerhalb von einer oder zwischen zwei Stichproben zu prüfen, wurde nach Bedarf und Prüfung auf Abhängigkeit der Daten der Chi-Quadrat-Test, der Fisher-ExactTest sowie der Wilcoxon-Vorzeichenrangtest für abhängige Paare verwendet (SOKAL & ROHLF 1980, SIEGEL 1987). Korrelationen Mit Hilfe des Rangkorrelationskoeffizienten rs nach Spearman wurde die Beziehung zwischen zwei Variablen untersucht (SOKAL & ROHLF 1980). 43 4 4.1 Ergebnisse Saisonale Dynamik der Gesamtpopulation Die saisonale Dynamik des Wetters ist zusammen mit den Fangergebnissen eines jeden Monats in Abb. 4 dargestellt. Abb. 4. Ergebnisse der monatlichen Fangaktionen in Bezug zum Wetter in Ampijoroa ‘98/’99 Vereinzelte Niederschläge gibt es Ende Oktober (24. und 28.10.1998, nach der OktoberFangaktion) und im November (insgesamt an vier Tagen 54 mm Niederschlag). Ab Dezember 44 (insgesamt an 19 Tagen 338 mm Niederschlag) kann vom eigentlichen Beginn der Regenzeit gesprochen werden, die bis März (an 11 Tagen 226.3 mm Niederschlag) andauert. Die Trockenzeit dauert von April bis November mit niedrigsten Durchschnittstemperaturen um 16°C im Juli und August. 4.1.1 Fallennutzung Aufgrund früherer Aktionsraumanalysen wird davon ausgegangen, daß die Verteilung der Fallen keinen entscheidenden Einfluß auf die Fangergebnisse hat. Um zu überprüfen, ob durch die Anzahl der aufgestellten Fallen die Fangbarkeit limitiert ist, wird der Anteil genutzter Fallen pro Fangaktion berechnet. Bei einem sehr hohen Anteil belegter Fallen sollte die Wahrscheinlichkeit größer sein, daß ein Tier aufgrund einer bereits belegten Falle nicht gefangen werden kann. Zum überwiegenden Teil werden M. murinus und M. ravelobensis gefangen. Im Untersuchungszeitraum werden vereinzelt endemische Kleinnager und Geckos (letztere nur in der Regenzeit) gefangen, sowie zweimal ein Cheirogaleus medius (ebenfalls in der Regenzeit). Die meisten Fallen sind im September belegt (94 von 300). Selbst in diesem Fall sind mehr als 2/3 der aufgestellten Fallen nicht belegt (Abb. 5). Es ist daher davon auszugehen, daß die Fangbarkeit von M. murinus nicht durch die Anzahl der aufgestellten Fallen limitiert ist (RADESPIEL 1998). 35% M. ravelobensis M. murinus Anteil belegter Fallen 30% 25% 20% 15% 10% 5% 0% Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr Abb. 5. Anteil belegter Fallen in % in JBA, unterteilt in M. murinus und M. ravelobensis. 45 4.1.2 Fänge und Wiederfänge Während des Untersuchungszeitraumes werden in den regulären Fangaktionen insgesamt 105 (68 Männchen, 37 Weibchen) verschiedene Individuen von M. murinus in JBA gefangen (Abb. 4). Drei Tiere (ein adultes Männchen, ein adultes Weibchen und ein Jungtier, dessen Geschlecht nicht eindeutig bestimmt werden konnte) werden nur jeweils einmal außerhalb der regulären Fangaktionen gefangen, zwei weitere Männchen nur in den Randgebieten außerhalb von JBA. Diese fünf Tiere werden daher bei der Analyse nicht weiter berücksichtigt. Zu jedem Zeitpunkt lassen sich sowohl Männchen als auch Weibchen von M. murinus in JBA fangen. 35 % der 68 Männchen (N = 24) sind aus den Vorjahren bekannt (durch Transponder und Ohrmarken eindeutig identifiziert). Im Frühjahr 1999 werden 12 juvenile Männchen erstmals gefangen im Vergleich zu vier juvenilen Weibchen. Beim monatsweisen Vergleich der Fangergebnisse werden diese Jungtiere nicht berücksichtigt, um zu gewährleisten, daß nur Tiere in die Analyse eingehen, die die Chance hatten, zu jedem Zeitpunkt in eine Falle zu gehen. Zwischen den Monaten der Trockenzeit kann kein signifikanter Unterschied hinsichtlich der Anzahl gefangener M. murinus beobachtet werden (χ² = 6.6, df = 7 n.s.). Während der Regenzeit kann ein Rückgang der Anzahl gefangener Tiere beobachtet werden. Verwendet man als Modell eine einfache lineare Regression der Fangzahlen für die Monate Oktober bis Januar (d.h. während der Monate, in denen man eine stete Abnahme der Fangzahlen beobachten kann (Abb. 4), zeigt sich eine signifikante Abnahme der Fangzahlen über diesen Zeitraum (Fangzahl = βOkt + βFolgemonat , β^Okt = 34.4, p < 0.005, β^Folgemonat = -9.1, p < 0.02). Nach dem Ende der Regenzeit zeichnet sich im April wieder eine häufigere Fangbarkeit der Tiere ab. Da eine einfache lineare Regression nur über mindestens vier Monate berechnet werden kann, läßt sich dieser Anstieg statistisch nicht belegen. 4.1.3 Geschlechterverhältnis Während des Untersuchungszeitraumes werden in JBA insgesamt 56 verschiedene, adulte Männchen und 33 verschiedene, adulte Weibchen gefangen. Dies entspricht einem Verhältnis von 1.7 Männchen auf ein Weibchen. Ausgehend von der Anzahl gefangener Individuen pro Fangaktion ergeben sich die in Tab. 5 ersichtlichen monatlichen Geschlechterverhältnisse. 46 Die in der Regenzeit 1998/1999 geborenen Tiere (12 Männchen, 4 Weibchen) werden im Frühjahr 1999 nicht mitgerechnet. Tab. 5. Geschlechterverhältnis. Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr 4.1.4 Selbst Verhältnis ♂/♀ 2.00 1.46 1.42 1.13 1.80 1.25 1.75 1.25 1.33 0.56 0.56 1.27 in den Verschiebungen Monaten des mit den stärksten Geschlechterverhältnisses kann jedoch keine signifikante Abweichung von einem ausgewogenen Geschlechterverhältnis (1:1) festgestellt werden (Mai, χ² = 1.37, n.s. bzw. Fisher-Exact-Test: Februar und März jeweils p = 0.7, n.s.). Populationsgröße Die Annahme gleicher Fangbarkeit aller Tiere der Population ist für verschiedene Zeitabschnitte getestet worden, um die zuverlässigste Schätzung der Populationsgröße zu ermitteln. Der Zeitraum von August bis März ergibt den geeignetsten Schätzbereich, wenngleich der Beobachtungswert Z’t obs noch immer 21 % unter dem Erwartungswert Z’t exp liegt (Leslie-Chitty-Chitty Test: Z’t obs = 35, Z’t exp = 44.33). Die Populationsgröße für JBA bewegt sich zwischen 30 und 45 (Jolly-Seber) bzw. zwischen 23 und 39 Tieren nach der MNA-Methode (Tab. 6). Tab. 6. Populationsgrößen von M. murinus in JBA nach der MNA- und der Jolly-Seber Methode nach monatlichen Fangaktionen. Konfid. Aug Sep Okt Nov Dez Jan Feb Mrz MNA-Methode Jolly-Seber Methode Konfidenzintervalle Jolly-Seber 5% 95 % 35 37 39 45 39 41 29 32 26 30 23 31 25 31 26 35 33 42 35 48 37 45 26 35 23 33 17 40 22 36 23 42 Anhand der Berechnungen ist die Population mit 39 (MNA-Methode) bzw. 45 (Jolly-Seber) M. murinus im September am größten. Die kleinste Population wird im Januar (MNA- 47 Methode: 23 Tiere) bzw. im Dezember (Jolly-Seber: 30 Tiere) ermittelt. Sowohl mit der MNA-Methode als auch nach Jolly-Seber ist somit während der Regenzeit eine Abnahme der Populationsgröße in JBA zu verzeichnen (MNA-Methode: 23 - 26 Tiere; Jolly-Seber: 30 – 35 Tiere). Bei einer Größe von 30.63 ha für JBA ergeben sich die in Tab. 7 ersichtlichen Populationsdichten von 0.75 – 1.27 (MNA-Methode) bzw. 0.98 – 1.48 (Jolly-Seber) Tieren pro Hektar. Tab. 7. Populationsdichten von M. murinus pro Hektar. Aug Sep Okt Nov MNA-Methode Jolly-Seber Methode 1.14 1.27 1.22 1.48 1.27 1.35 0.95 1.06 Dez Jan Feb Mrz 0.85 0.98 0.75 1.01 0.82 1.02 0.85 1.13 4.1.5 Saisonale Dynamik von Körpergewicht und Hodenvolumen Um die Fortpflanzungsaktivität von M. murinus in Nord-West-Madagaskar zeitlich eingrenzen zu können, werden die mit der Reproduktion verbundenen Parameter Hodenvolumen und Körpergewicht der Männchen über die Monate verglichen. Körpergewicht Zu Beginn der Studie im Mai beträgt das Körpergewicht der gefangenen Männchen durchschnittlich 51 g (N = 16, Min = 28, Max = 62, SD = 7.8; Abb. 6). Im Juni werden die geringsten Körpergewichte gemessen mit durchschnittlich 49 g (N = 19, Min = 30, Max = 59, SD = 7.2). Die Maxima werden in der Trockenzeit im August mit 56 g (N = 18, Min = 38, Max = 63, SD = 6.4) und in der Regenzeit im Februar mit einem durchschnittlichen Körpergewicht von 58 g (N = 5, Min = 51, Max = 65, SD = 5.9) erreicht. Die Körpergewichte aller Männchen steigen kontinuierlich von Juni bis August signifikant an (WilcoxonVorzeichenrangtest, ZJun-Jul = 2.71, N = 13, p < 0.01; ZJul-Aug = 2.40, N = 12, p < 0.02). In den folgenden Monaten bis zum Ende der Trockenzeit im November fällt es stetig ab. Bereits vom November zum Dezember, dem Beginn der Regenzeit, zeichnet sich als Trend eine erneute Zunahme der Körpergewichte ab (Wilcoxon-Vorzeichenrangtest, ZNov-Dez = 1.69, N = 8, p = 0.09), die ihr Maximum im Februar erreicht. Zum Ende der Regenzeit sinkt das 48 Körpergewicht wieder auf einen Durchschnittswert von 52 g (N = 24, Min = 42, Max = 63, SD = 6.3) im April. 66 62 N=16 Körpergewicht in g 58 N=8 N=18 N=10 N=18 N=20 N=23 N=25 N=5 N=6 N=24 N=19 54 * 50 * 46 42 38 ±Std. Dev. ±Std. Err. Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr Mean Abb. 6. Dynamik der Körpergewichte aller gefangenen Männchen (Mai 1998 - April 1999). Hodenvolumen Die geringsten Hodenvolumina sind im April (MW = 60 mm³, N = 24, Min = 0, Max = 129, SD = 52.8), Mai (MW = 23 mm³, N = 16, Min = 0, Max = 86, SD = 31.7) und Juni (MW = 63 mm³, N = 19, Min = 0, Max = 251, SD = 79.3) zu ermitteln (Abb. 7). Bei etwa jeweils 40 % der Tiere befinden sich zu diesen Zeitpunkten die Hoden nicht im Skrotum, was einem meßbaren Hodenvolumen gleich Null entspricht. Die größten Hodenvolumina sind im August zu messen, unmittelbar vor der Paarungszeit mit durchschnittlich 1502 mm³ (SD = 481.7, Min = 424, Max = 2284). Die Zunahme der Körpergewichte mitten in der Trockenzeit geht einher mit dem Anstieg der Hodenvolumina. Diesem signifikanten Anstieg (WilcoxonVorzeichenrangtest, ZJun-Jul = 2.93, N = 13, p < 0.005; ZJul-Aug = 3.18, N = 13, p < 0.005) folgt eine signifikante Abnahme der Hodenvolumina im September und Oktober (WilcoxonVorzeichenrangtest, ZAug-Sep= 2.19, N = 10, p < 0.03; ZSep-Okt= 3.18, N = 13, p < 0.005). Im November kann eine erneute signifikante Zunahme der Hodenvolumina festgestellt werden (Wilcoxon-Vorzeichenrangtest, ZOkt-Nov = 3.40, N = 15, p < 0.005). Aufgrund der niedrigen 49 Fangzahlen kann die Entwicklung der Hodenvolumina von Dezember zu Januar nur an vier Tieren festgehalten werden. Die Abnahme des Hodenvolumens stellt sich als Trend dar (Wilcoxon-Vorzeichenrangtest, ZDez-Jan= 1.83, N = 4, p < 0.07). In den weiteren aufeinanderfolgenden Monatsvergleichen können keine statistischen Unterschiede festgestellt werden. Wird Januar mit April verglichen, kann eine signifikante Abnahme der Hodenvolumina belegt werden (Wilcoxon-Vorzeichenrangtest, ZJan-Apr = 2.02, N = 5, p < 0.05). N=18 2000 Hodenvolumen in mm³ 1600 N=18 1200 * N=25 800 400 0 N=16 * N=20 N=10 N=23 ** N=8 N=5 N=6 * N=19 N=24 Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr ±Std. Dev. ±Std. Err. Mean Abb. 7. Dynamik der Hodenvolumina aller gefangenen Männchen (Mai 1998 - April 1999). Korrelation von Körpergewicht und Hodenvolumen Tab. 8. Spearman Rangkorrelation Körpergewicht und Hodenvolumen N R t(N-2) p < 0.61 3.19 0.01 Jun 19 0.52 2.91 0.01 Jul 25 0.57 2.81 0.02 Aug 18 0.49 2.27 0.05 Sep 18 23 0.61 3.54 0.01 Okt 0.75 4.73 0.01 Nov 20 0.13 0.36 n.s. Dez 10 Die Körpergewichte korrelieren der positiv mit Männchen ihren Hodenvolumina in den Monaten Juni bis November (Tab. 8). Im Dezember zeigt sich kein signifikanter Zusammenhang zwischen diesen Variablen. 50 4.2 Saisonale Dynamik im Verhalten der Sendermännchen 4.2.1 Fallennutzung durch Sendermännchen Bei den Sendermännchen läßt sich durch die Fallennutzung die Fangbarkeit genauer kalkulieren. Im Juli hat jedes der 10 Sendermännchen dreimal die Möglichkeit (entspricht 30 Fangmöglichkeiten, Tab. 9), in eine Falle zu gehen, da sich mit Gewißheit alle Tiere zu diesem Zeitpunkt in JBA aufhalten. Insgesamt werden diese Fangmöglichkeiten nur 15 Mal genutzt, was einem Anteil von 50 % entspricht. Dieser Nutzungsanteil bewegt sich in der Trockenzeit auf relativ hohem Niveau, sackt aber ab Januar ab, um wieder im April anzusteigen. Tab. 9. Anteil der Fallennutzung aller Sendermännchen pro Fangaktion Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr Total N Möglichkeiten, 30 30 30 30 30 27 24 24 24 24 273 gefangen zu werden Anteil genutzter Fallen 50 % 50 % 63 % 57 % 43 % 59 % 8 % 25 % 8 % 42 % 42 % Betrachtet man die Fängigkeit für jedes einzelne Individuum für den gesamten Zeitraum von Juli bis April in Tab. 10, wird ersichtlich, daß es unter den Sendermännchen Tiere gibt, die sehr selten in die Fallen gehen, d.h. schlecht fangbar sind (Tier 68-98 nur 17 %) während andere sehr häufig in den Fallen zu finden sind (z.B. Tier 75-95 in 73 % der Fälle). Tab. 10. Fallennutzung der Sendertiere Für den gesamten Zeitraum ist die Gruppe Tier Jul - Apr Jul - Dez Jan - Apr 17 % 22 % 8% 68-98 30 % 50 % 0% 26-98 33 % 33 % * 94-98 33 % 42 % verstorben 84-98 40 % 67 % 0% 78-98 43 % 67 % 8% 007-97 44 % 53 % * 111-96 47 % 50 % 42 % 125-96 70 % 89 % 42 % 55-97 73 % 78 % 67 % 75-95 jedoch relativ homogen mit geringen Total 42 % 56 % 24 % *Sender ausgefallen, Tier nicht lokalisbar in eine Falle zu gehen, ist Tier 68-98 nur Schwankungen um den ermittelten Wert der Gesamtfallennutzung von 42 %. Die Nutzung für den Zeitraum von Juli bis Dezember liegt insgesamt und für jedes Individuum höher, doch auch hier gibt es individuelle Unterschiede. Während Tier 55-97 neun von zehn Möglichkeiten nutzt, jedes fünfte Mal in einer Falle anzutreffen. 51 Für den Zeitraum von Januar bis April sind die individuellen Unterschiede noch deutlich ausgeprägter. Obwohl die Tiere 26-98 und 78-98 anwesend sind, gehen sie kein einziges Mal in eine Falle, Tier 75-95 hingegen nutzt 67 % der Möglichkeiten, in eine aufgestellte Falle zu gehen. Für den gesamten Zeitraum von Juli bis April gibt es keine deutlichen Unterschiede in der Fallennutzung zwischen den Sendertieren, wenngleich es zumindest zwischen einzelnen Tieren in bestimmten Zeiten (hier Januar bis April) eine unterschiedliche Fangbarkeit geben kann. Die individuelle Fangbarkeit der Sendertiere ändert sich ebenfalls mit dem Wechsel der Jahreszeiten. Diese Umstände müssen bei der Beurteilung der errechneten Populationsgröße nach der Jolly-Seber Methode berücksichtigt werden. 4.2.2 Schlafplätze Vom 18.07. 1998 bis zum 04.04.1999 sind von allen Sendermännchen insgesamt 1244 (427 verschiedene) genutzte Schlafplätze erfaßt und charakterisiert worden (Abb. 8, Tab. 12). 4.2.2.1 Saisonale Nutzungsunterschiede Während der Trockenzeit bis Ende November bevorzugen die Männchen als Schlafplätze Baumhöhlen (hierzu zählten auch Asthöhlen und Rindenhülsen, die den Tieren ein geschlossenes Versteck bieten) gegenüber offenen, sich im Gestrüpp befindenden Schlafplätzen. Baumhöhlen werden in dieser Zeit 2.3mal häufiger genutzt als offene, ungeschützte Plätze. Dieses Verhalten ändert sich drastisch mit Beginn der Regenzeit im Dezember. In nur noch 10 % der Fälle werden während der Regenzeit Höhlen als Schlafplätze aufgesucht, an den anderen Tagen wählen die Tiere frei zugängliche Schlafplätze (Tab. 11). Tab. 11. Tägliche Schlafplatzwahl der Sendermännchen Schlafplatzqualität Jul - Nov Dez - Apr in Höhlen offen im Gestrüpp 568 248 52 376 Verhältnis Höhle/Gestrüpp 2.3 0.1 Auch die Nutzungsdauer eines Schlafplatzes, d.h. wie oft ein Tier denselben Schlafplatz benutzt, ändert sich deutlich mit Einsetzen der Regenzeit. In der Trockenzeit scheinen die Männchen individuell bevorzugte Schlafplätze zu haben, zu denen sie häufig zurückkehren (bis zu 27 Mal, z.B. Tiere 84-98 und 55-97; Tab. 12). Nur durchschnittlich 15.4 % der Tage während der Trockenzeit verbringen die Tiere an einem Schlafplatz, den sie nur dieses eine 52 Mal nutzen. Knapp die Hälfte (49.1 %) der Tage von Juli bis November sind die Tiere an Schlafplätzen vorzufinden, die sie zwischen 6 und 28 Mal aufsuchen. Dieses Verhalten ändert sich in der Regenzeit. An 35.5 % der Tage sind die Männchen an einem Schlafplatz anzutreffen, den sie danach nicht wieder nutzen, an 21.5 % der Tage kehren sie nur ein einziges Mal zum jeweiligen Schlafplatz zurück. Daraus resultiert, daß die Tiere an mehr als der Hälfte der Tage (57 %) während der Regenzeit einen Schlafplatz nur ein- bis zweimal Randweg JBA aufsuchen. 53 54 4.2.2.2 Soziale Schlafkonstellationen Insgesamt finden sich an 37 Kontrolltagen Fokusmännchen gemeinsam mit anderen Mausmakis an Schlafplätzen. An den anderen Kontrolltagen nutzen die Fokustiere den Schlafplatz alleine. Von Juli bis August teilt sich ein leichtes Männchen (Erstfang) viermal einen Schlafplatz mit einem bereits 1997 gefangenen Weibchen. Weitere gemeinsame Schlafplatznutzungen werden erst wieder zwischen dem 09.10. und dem 30.11.1998 beobachtet. Ab dem 09.10.1998 nutzen insgesamt 16 M. murinus - Männchen (sieben Fokustiere und sieben markierte Tiere, zwei unmarkierte Männchen) 33 Mal gemeinsam einen Schlafplatz (Tab. 13). Tab. 13. Häufigkeiten der gemeinsamen Schlafplatznutzung von M. murinus - Männchen ID.N° 78-98 68-98 94-98 26-98 84-98 55-97 007-97 75-95 111-96 125-96 111-96 153-96 114-96 110-96 125-96 34-97 123-97 55-97 113-98 109-98 78-98 68-98 ?♂ 1 1 1 1 1 1 1 1 1 1 7 13 5 4 1 2 2 13 1 1 1 1 1 1 ?♂ = unbekannte Männchen 27 Mal befinden sich zwei markierte Tiere an einem Platz, sechsmal nutzen drei Männchen gemeinsam denselben Schlafplatz. Teilweise schlafen die Tiere nur einmal mit einem anderen Männchen an einem Platz, teilweise bis zu 16 Mal mit einem oder zwei verschiedenen Männchen zusammen. Auffällig ist, daß nur Tiere mehr als einmal zusammenschlafen, die bereits aus den Vorjahren bekannt waren und jeweils aus dem gleichen Erstfangjahr stammen. 55 Tab. 14. Schlafplatznutzung Höhle N°30 Datum/ID N° 111-96 125-96 ♂♂ 29.10.98 x 30.10.98 x 31.10.98 x x 01.11.98 x x 113-98 02.11.98 x 03.11.98 x 110-96 04.11.98 x 05.11.98 06.11.98 07.11.98 x 08.11.98 x 09.11.98 x x 10.11.98 x x 114-96 11.11.98 x 12.11.98 Fangtag 13.11.98 x x 14.11.98 Fangtag 15.11.98 x x 153-96 16.11.98 Fangtag 17.11.98 x x 18.11.98 x x 153-96 19.11.98 x x 153-96 20.11.98 x 110-96 21.11.98 x 114-96 22.11.98 x 153-96 23.11.98 x 24.11.98 x x 153-96 25.11.98 x 26.11.98 27.11.98 x x 28.11.98 x 29.11.98 x x = Tier befindet sich in der Höhle Die gemeinsame Nutzung konzentriert sich vor allem auf einzelne Höhlen. Beispielhaft ist die Nutzung von einer Schlafhöhle in Tab. 14 aufgeführt. Abgesehen von der Nacht vom 31.10.1998 auf den 01.11.1998 sind in dieser Höhle nur Männchen anzutreffen, die bereits 1996 das erste Mal gefangen worden sind. Hierbei handelt es sich vorrangig um die Männchen 111-96 und 125-96 und daneben drei andere Altfänge. Nur am 01.11.1998 ist neben diesen auch ein 1998 erstmals gefangenes Männchen (Tier 113-98) vorzufinden. 56 4.2.2.3 Schlafplatzwahl und Prädatoren Im gesamten Untersuchungszeitraum kann ein Fall von Prädation an einem Schlafplatz dokumentiert werden. Männchen 007-97 wurde vorher siebenmal mit Männchen 34-97 gemeinsam in einem Schlafplatz angetroffen. Am 05.11.1998 teilen sich beide Tiere ebenfalls eine Schlafhöhle, einen toten Baumstumpf mit einer Eingangsöffnung von 7 cm Durchmesser in 1.40 m Höhe. Am Abend desselben Tages vor Beginn der Fokusbeobachtung wird Tier 3497 mit schweren Bißverletzungen im Hals- und Brustbereich sowie am linken Arm tot in der Höhle aufgefunden. Der Körper des Tieres saß auf halber Höhe zum Ausgang fest, so daß dem sich unterhalb befindlichen Fokustier 007-97 der Ausgang versperrt war. Nach Aufbruch der Höhle und der Befreiung von 007-97 wird dieses Tier in der folgenden Zeit nur noch einmal am 20.11.1998 mit einem unbekannten Männchen gemeinsam an einem Schlafplatz angetroffen. 4.2.2.4 Konkurrenz um Schlafplätze Bei Fokusbeobachtungen kann mehrfach beobachtet werden, wie Tiere, die häufiger zusammen schlafen, sich kurz vor Tagesanbruch treffen, gegenseitig Fellpflege betreiben und dann den Schlafplatz aufsuchen. Auch Triller und Kurzpfiffserien von sich bereits am Schlafplatz befindenden Männchen können protokolliert werden, die bei Eintreffen eines bestimmten Männchens aufhören. Bei in der Regel nicht zusammen schlafenden Männchen kann Konkurrenz um Schlafplätze beobachtet werden. Um dies zu verdeutlichen, soll eine Fokussequenz beschrieben werden. Ausschnitt einer Fokusbeobachtung: Am 21.11.1998 um 4.45 Uhr morgens nähert sich Fokusmännchen 78-98 einer Baumhöhle (Höhleneingang in 3.80 m Höhe), die zu diesem Zeitpunkt bereits von Männchen 111-96 besetzt ist. Bei Annäherung auf 1 m stößt 111-96 in der Höhle sitzend Grunzlaute aus, worauf 78-98 sich entfernt und in ca. 10 m Abstand zur Höhle im Geäst sitzen bleibt. Nach 1 min nähert sich 78-98 erneut bis auf ca. 4 m an, entfernt sich dann aber endgültig. Um 4.49 Uhr errreicht 78-98 eine andere ca. 20 m entfernte Baumhöhle und schnuppert an deren Eingang in 4.50 m Höhe, wobei Männchen 113-98 aus dem Inneren der Höhle ebenfalls Grunzlaute 57 ausstößt. Das Fokustier entfernt sich auch von dieser Höhle. Um 4.55 Uhr wird 78-98 in einem 0.4 m hohen und hohlen Baumstumpf wiedergefunden, ca. 10 m von der zweiten Höhle entfernt. Es verläßt diesen Platz jedoch wieder und klettert um 4.57 Uhr in die vorherige Höhle zu Tier 113-98, ohne daß weitere Reaktionen von einem der beiden Tiere zu sehen oder zu hören sind. Etwa 5 m vom oben genannten Baumstumpf entfernt befindet sich die Baumhöhle N° 30 mit einer Eingangsöffnung in 3 m Höhe. An diesem Tag wird Höhle N° 30 von den Männchen 125-96 und 114-96 gemeinsam genutzt (Tab. 14). 4.2.3 Verhaltensbeobachtungen Insgesamt wurden 331h 13min 12sec nächtliche Fokusbeobachtungen an Männchen von M. murinus analysiert. Tierkontakt bestand in 128h 4min 37sec. 4.2.3.1 Aufenthaltshöhe Im monatsweisen Vergleich der Aufenthaltshöhen kann man erkennen, daß die Tiere im Laufe der Monate ihre Aktivitäten vom bodennahen Bereich in die oberen Baumregionen verlagern (Abb. 9). Nur bei Beginn der Fokusbeobachtungen im September und Oktober sind die Tiere auch am Boden anzutreffen (2.5 % bzw. 2.8 % der Zeit). Auch die Aufenthaltshöhen bis zu 2 m werden in dieser Zeit sehr viel häufiger gewählt als in den darauffolgenden Monaten. Im März schließlich befinden sich die Tiere in mehr als 43 % der Beobachtungszeit in den oberen Baumregionen über 5 m Höhe. M rz Feb Jan N ov Ende >5m N o v A n fa n g 2 -5 m 1 -2 m O kt 0 -1 m B oden S ep t 0% 5% 10% 15% 20% 25% 30% 35% 40% 45% 50% A n te il d e r A u fe n th a lts h ö h e a n d e r m o n a tlic h e n B e o b a c h tu n g s z e it Abb. 9. Aufenthaltshöhen der Sendermännchen während der monatlichen Fokusphasen. 58 4.2.3.2 Nahrungsverhalten Der jeweils verwendete Zeitanteil für die Aufnahme der unterschiedlichen Nahrungskategorien ändert sich ebenfalls im Verlauf der Monate und scheint durch das unterschiedliche Nahrungsangebot in den jeweiligen Zeiträumen geprägt (Abb. 10). Zeitanteil an der monatlichen Nahrungsaufnahme 100% 90% 80% 70% 60% 50% 40% 30% 20% 10% 0% Sep Okt Nov Anfang Nov Ende Jan Feb M rz Baumexsudat* 75.8% 74.5% 77.6% 34.0% 95.8% 29.5% 52.6% Früchte 4.1% 2.3% 14.4% 27.8% 1.3% 61.5% 40.7% Insekten 4.9% 8.5% 2.3% 32.5% 0.3% 6.9% 6.7% unbekannt 12.2% 1.4% 1.3% 5.7% 2.6% 2.1% Insektensekret 0.2% 12.3% 4.4% sonstiges 2.8% 0.9% Abb. 10. Anteil für die einzelnen Nahrungskategorien in Relation zur insgesamt pro Monat aufgewandten Zeit (=100 %) in der Verhaltenskategorie „Nahrungsaufnahme“. Baumexsudat* = Im Januar ausschließlich Blütennektar von Canthium sp. (Rubiaceae). In der Trockenzeit werden vor allem Baumexsudate (Baumharze) aufgenommen (bis zu 77.6 %, Anfang November). Als Nahrungsbäume können hier vor allem Calantica gerasifolia aus der Familie der Flacourtiaceae bestimmt werden, aber auch Alleanthus sp. aus der Familie der Moracea sowie Legumineum sp. aus der Familie der Leguminaceae. Das auf Zweige und den Boden tropfende Insektensekret der nur in der Trockenzeit vorhandenen Larven von F. coccinea wird ebenfalls von den Mausmakis aufgeleckt. Nach dem Einsetzen der ersten heftigen Regenfälle kurz vor Beginn der Regenzeit ändert sich das Nahrungsspektrum. Die dann massenhaft auftretenden Insektenimago sind zu 32.5 % Bestandteil der Nahrung. In die Kategorie Baumexsudate fallen von September bis Ende November ausschließlich Baumharze. Im Januar hingegen nehmen die Tiere fast ausschließlich den nur zu dieser Zeit vorhandenen Blütennektar von Canthium sp. aus der Familie der Rubiaceae auf. Im Februar sind die Blüten bereits verblüht und die Tiere nehmen wieder, wie auch im März, Baumharze 59 zu sich. Wenn Früchte vorhanden sind, werden diese ebenfalls gefressen. Im Laufe der Regenzeit tragen die Bäume vermehrt Früchte, die dann auch einen Großteil der Nahrung ausmachen (bis zu 61.5 %, im Februar). Als fruchttragende Nahrungsbäume sind zu nennen Garessia sp. (Clusiaceae), Grewia sp. (Tiliaceae), Maerna cylindrocarpa (Capparidaceae), Mystroxylon sp. (Celastraceae) und Noronhia boinensis (Oleaceae). Diese Nahrungsquellen befinden sich in höheren Baumregionen, in denen dann auch die Mausmakis anzutreffen sind (Abb. 9). 4.2.3.3 Aktivitätsbudgets In Abb. 11 sind die Medianwerte der prozentualen Anteile einer Verhaltenskategorie in Relation zur Kontaktzeit zum Fokustier in den jeweiligen Fokusphasen dargestellt. 100.0% Median Verhalten/Kontaktzeit 90.0% 80.0% 70.0% 60.0% 50.0% 40.0% 30.0% 20.0% 10.0% 0.0% Sep O kt N ov A nfang N ov E n de Jan F eb M rz Soziale A ktivität 1 .3 % 0.0% 1.5% 1.3% 1 .0 % 0 .0 % 0.0% A utogro om ing 0 .8 % 2.4% 1.2% 1.7% 3 .5 % 3 .9 % 4.3% Fressen 4 .8 % 1 7.8% 1 3.5% 9.7% 18.6% 17.8% 1 3.4% R uh en 21.3% 2 3.9% 1 6.9% 29 .6 % 26.0% 21.9% 3 1.1% Lokom otion 32.1% 3 2.8% 1 9.1% 25 .5 % 23.2% 28.9% 2 8.4% visuell n icht erkennbar 28.7% 1 5.7% 3 8.6% 25 .9 % 19.2% 20.2% 2 1.6% Abb. 11. Mediane der Verhaltenskategorien der Fokusmännchen pro Fokusphase. Insgesamt betrachtet setzt sich der Großteil des Aktivitätsbudgets aus der Trias Fressen, Lokomotion und Ruhen zusammen. Ab Anfang November nimmt die für die eigene Fellpflege (Autogrooming) beanspruchte Zeit (1.2. %) von Monat zu Monat stetig zu bis auf einen Anteil von 4.3 % im März. Im September und Ende November wird die wenigste Zeit in die Nahrungsaufnahme investiert (Median 4.8 % bzw. 9.7 %). Soziale Aktivitäten treten nur im September (1.3 %), in den beiden Fokusphasen im November (1.5 % bzw. 1.3 %) und 60 im Januar (1.0 %) im Median für alle Fokusmännchen auf. Der Zeitraum von September bis Januar wird daher bei der Analyse der sozialen Interaktionen besonders berücksichtigt. 4.2.3.4 Markier- und Lautaktivität Bei der Markieraktivität konnte nur Urinwaschen in nennenswerter Frequenz bei allen Individuen festgestellt werden. Die Medianwerte sind in Tab. 15 ersichtlich. Die Zunahme des Urinwaschens im Oktober (von 1.9mal pro Stunde im September auf 5.7mal im Oktober) bzw. Ende November (von 2.8mal pro Stunde Anfang November auf 4.8mal Ende November) kann statistisch nicht belegt werden. Zu keiner Zeit korreliert das Urinwaschen mit anderen aufgenommenen Verhaltensweisen oder Merkmalen wie Lautaktivität, Aktionsraumgröße oder Gewicht (Spearman-Rangkorrelation rs , n.s.) Tab. 15. Urinwaschen: Median der Häufigkeit pro Stunde in jeder Fokusphase. Sep Okt Nov Anfang Nov Ende Jan Feb N Fokustiere 9 10 9 8 7 7 Median 1.9 5.7 2.8 4.1 0.5 0.6 Minimum 0 0 0 0 0 0 Maximum 4.7 8.9 8.8 8.5 5.5 2.0 Unteres Quartil 1.5 0.0 0.0 0.5 0.0 0.4 Oberes Quartil 2.8 8.4 4.2 7.0 2.5 1.0 Mrz 7 0.0 0 2.3 0.0 0.9 In den Tab. 16 bis 18 sind die Häufigkeiten der einzelnen Lautaktivitäten pro Stunde in jeder Fokusphase dargestellt. Bei den drei Lautgruppen Kurzpfiffe, Triller und Tsäks zeigt sich eine signifikante Abnahme der Häufigkeit von September nach Oktober (Wilcoxon- Vorzeichenrangtest September - Oktober, N = 10: Kurzpfiffe: Z = 2.07, p < 0.04; Triller: Z = 2.19, p< 0.03; Tsäks: Z = 2.07, p < 0.04). Tab. 16. Kurzpfiffe: Median der Häufigkeit pro Stunde in jeder Fokusphase. Sep Okt Nov Anfang Nov Ende Jan Feb N Fokustiere 9 10 9 8 7 7 Median 1.8 0.0 0.0 2.0 0.0 0.0 Minimum 0.0 0.0 0.0 0.0 0.0 0.0 Maximum 14.4 3.1 6.7 13.8 4.6 0.4 Unteres Quartil 0.7 0.0 0.0 0.0 0.0 0.0 Oberes Quartil 3.8 0.9 0.0 4.7 3.8 0.0 Mrz 7 0.0 0.0 7.8 0.0 6.3 61 Tab. 17. Triller: Median der Häufigkeit pro Stunde in jeder Fokusphase. Sep Okt Nov Anfang Nov Ende Jan N Fokustiere 9 10 9 8 7 Median 3.1 0.0 0.3 2.6 0.5 Minimum 0.0 0.0 0.0 0.0 0.0 Maximum 27.2 3.4 9.4 16.0 38.9 Unteres Quartil 0.6 0.0 0.0 0.0 0.0 Oberes Quartil 7.2 0.0 1.9 7.9 5.0 Feb 7 0.0 0.0 4.8 0.0 0.0 Mrz 7 1.2 0.0 5.6 0.0 3.8 Tab. 18. Tsäks: Median der Häufigkeit pro Stunde in jeder Fokusphase. Sep Okt Nov Anfang Nov Ende Jan N Fokustiere 9 10 9 8 7 Median 0.7 0.0 1.2 0.9 0.9 Minimum 0.0 0.0 0.0 0.0 0.0 Maximum 4.6 2.3 2.4 2.1 8.0 Unteres Quartil 0.5 0.0 0.0 0.5 0.0 Oberes Quartil 2.8 0.0 2.2 1.1 3.7 Feb 7 0.0 0.0 0.0 0.0 0.0 Mrz 7 0.0 0.0 1.3 0.0 0.0 Bei den Tsäks wird wiederum im November eine signifikante Zunahme protokolliert (Wilcoxon-Vorzeichenrangtest ZOkt-Nov Anfang = 2.20, p < 0.04 bzw. ZOkt-Nov Ende = 2.37, p < 0.03, Abb. 12). 4 N=7 Tsäkhäufigkeit pro Stunde 3 N=9 N=10 2 N=8 1 * * N=10 * 0 Sep Okt Nov Nov Anfang monat Ende Jan N=7 N=7 Feb ±Std. Dev. ±Std. Err. Mrz Mean Abb. 12. Tsäkhäufigkeit zwischen September und März (umgerechnet pro Stunde). 62 Bei den anderen beiden Lautgruppen stellt sich diese Zunahme als Trend dar (Triller, ZOkt-Nov Ende = 1.78, p < 0.08 bzw. Kurzpfiffe ZOkt-Nov Ende = 1.78, p < 0.08). Mit Abnahme der Sozialkontakte im Februar kommt es auch zu einer signifikanten Abnahme der Tsäkhäufigkeiten (Wilcoxon-Vorzeichenrangtest, ZJan-Feb = 2.02, p < 0.05). In den Nächten, in denen Paarungen beobachtet werden können (s.u.), geben die Männchen zahlreiche Triller und Kurzpfiffserien von sich. So werden in der Fokusnacht im Januar für das Männchen 68-98, als es mit einem unbekannten Weibchen kopuliert, umgerechnet 38.9 Triller pro Tierkontaktstunde erfaßt, was dem Maximum für diesen Zeitraum entspricht. Der Medianwert im Januar liegt hingegen nur bei 0.5 Trillern pro Stunde. Für dieses Männchen werden in dieser Nacht ferner 4.6 Kurzpfiffserien pro Stunde protokolliert, während der Medianwert der Kurzpfiffe im Januar gleich Null ist. Kurzpfiffe und Triller werden jedoch nicht nur im Kontext mit östrischen Weibchen geäußert, sondern anscheinend auch zur Kontaktaufnahme mit bestimmten bekannten Männchen. So kann z.B. im November das Männchen 111-96 beobachtet werden, wie es am Ende einer Fokusnacht eine Schlafhöhle aufsucht und an dessen Eingang sitzend wiederholt Kurzpfiffserien und Triller von sich gibt. Beim Eintreffen des Männchens 125-96 verstummt das Fokustier und beide Individuen ziehen sich in die Schlafhöhle zurück. (Insgesamt nutzen diese beiden Individuen 13 Mal gleichzeitig einen Schlafplatz, vergl. Kap. 4.2.2.2 Soziale Schlafkonstellationen). Bestimmte andere Männchen hingegen werden bei ihrem Eintreffen an einem Schlafplatz von dort sitzenden Männchen durch Grunz- oder Tsäklaute wieder vertrieben (vergl. Kap. 4.2.2.4 Konkurrenz um Schlafplätze). Langpfiffe werden von den Männchen nur sehr selten geäußert. Bei zwei sehr ausgedehnten Langpfiffserien kann beobachtet werden, wie die Individuen jeweils eine Sanzinia madagascariensis im Geäst entdecken und anschließend für etwa 5 min Langpfiffe abgeben. Andere Mausmakis scheinen auf die Laute zu reagieren: Von anderen sich in der Nähe befindenden Individuen können daraufhin ebenfalls Langpfiffe gehört werden. Wie auch bei der Markieraktivität können keine Korrelationen der Lautaktivität mit anderen analysierten Daten wie Markieraktivität, Aktionsraumgröße (s.u.) oder Körpergewicht festgestellt werden (Spearman-Rangkorrelationskoeffizient rs , n.s.). 63 4.3 Fortpflanzungsstrategien der Sendermännchen 4.3.1 Körpergewicht und Hodenvolumen der Sendermännchen Körpergewicht Nach der Erfassung der monatlichen mittleren Körpergewichte aller gefangener M. murinus Männchen ist das Körpergewicht eines jeden Sendermännchens zu dem aller Männchen in Bezug gesetzt worden (Tab. 19). Bei vier Tieren (alle Tiere bereits aus Vorjahren bekannt = residente Männchen) liegt das Körpergewicht immer über Mittelwert, bei dem drei jeweiligen Tieren (ein monatlichen residentes Männchen (55-97) , zwei 1998 erstmals gefangene Männchen) jedesmal darunter. Drei 1998 erstmals gefangene Männchen sind nicht eindeutig zu kategorisieren: Mal liegt ihr jeweiliges Körpergewicht unter, mal über dem Monatsmittel. Tab. 19. Körpergewicht Sendertiere Tier-ID Körpergewicht in Relation 75-95 + 111-96 + 125-96 + 007-97 + 55-97 94-98 84-98 78-98 -+ 68-98 -+ 26-98 -+ - = Körpergewicht immer unter dem monatlichen Mittelwert. + = Körpergewicht immer über dem monatlichen Mittelwert. -+ = Körpergewicht mal unter, mal über dem monatlichen Mittelwert. Hodenvolumen Die Dynamik der Hodenvolumina der Sendermännchen entspricht der der Gesamtpopulation (Abb. 13). Hierbei verhält sich die Entwicklung der Hodenvolumina aller Fokusmännchen gleichsinnig: Bei jedem Fokustier steigt das Hodenvolumen vor der Paarungszeit an und nimmt während und nach der Paarungszeit ab. Bis August ist ein signifikanter Anstieg zu verzeichnen (Wilcoxon-Vorzeichenrangtest, ZJun-Jul = 2.02, N = 5, p < 0.05; ZJul-Aug = 2.67, N = 9, p < 0.01), anschließend eine Abnahme im September und Oktober (WilcoxonVorzeichenrangtest, ZAug-Sep= 1.96, N = 8, p < 0.05; ZSep-Okt= 2.52, N = 8, p < 0.02) und erneute Zunahme im November (Wilcoxon-Vorzeichenrangtest, ZOkt-Nov = 2.52, N = 8, p < 64 0.02). Die Abnahme des Hodenvolumens von Dezember zu Januar stellt sich als Trend dar (Wilcoxon-Vorzeichenrangtest, ZDez-Jan= 1.83, N = 4, p < 0.07). In den folgenden Monaten bleibt es, wie auch bei der Gesamtpopulation, vermindert. Sendertiere Hodenvolumen in mm³ 2000 N=9 1600 N=9 * 1200 * N=10 800 N=9 N=9 N=7 * * N=4 N=3 * 400 N=3 N=5 0 N=5 N=5 Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr ±Std. Dev. ±Std. Err. Mean Abb. 13. Dynamik der Hodenvolumina der Sendermännchen (Mai 1998 – April 1999). 4.3.2 Soziale Interaktionen Die sozialen Interaktionen wurden in verschiedene Verhaltenskategorien unterteilt. In Tab. 20 ist die Anzahl der Fokusmännchen dargestellt, die eine der aufgelisteten Verhaltenskategorien während der Fokusbeobachtungen zeigten. Zeitdauer oder Frequenzen eines Verhaltens sind hier nicht dargestellt. Im Vergleich der Fokusphasen untereinander können unterschiedliche Qualitäten der sozialen Interaktionen festgestellt werden. Im September befinden sich sieben von neun Fokusmännchen in der Nähe von anderen Mausmakis und sechs Fokustiere fliehen mindestens einmal vor anderen Sozialpartnern. In dieser Zeit (Anfang September) werden keine Kopulationen beobachtet. Gleich zu Beginn der Fokusphase für Oktober am 30.09.1998 wird eine Kopulation beobachtet. In Verbindung mit dieser Kopulation zeigt das Fokusmännchen (Tier 26-98) auch anderes Sozialverhalten (Nähe, Kontaktsitzen, Fliehen und Jagen). Es bleibt die einzige 65 Kopulation, die in dieser Fokusphase beobachtet werden kann. Im Zusammenhang mit allen weiteren beobachteten Kopulationen (N = 4) während des Untersuchungszeitraumes können keine direkten Auseinandersetzungen zwischen Männchen beobachtet werden. Insgesamt werden im Oktober nur wenige Interaktionen beobachtet und es sind daran nur wenige Fokustiere beteiligt. Anfang November kann in vier von neun Fokusbeobachtungen Kontaktsitzen mit einem Sozialpartner protokolliert werden (September und Oktober nur jeweils einmal). In diesem Monat, in dem auch erstmals zusammen schlafende Männchen beobachtet werden, tritt ebenfalls erstmals gegenseitige Fellpflege (Allogroomen) auf. Ende November werden in der Kategorie „Nähe“ ähnliche Relationen wie im September erreicht (sechs von acht Fokustieren befinden sich in der jeweiligen Fokusnacht in der Nähe eines Sozialpartners). Fliehen hingegen kommt nicht vor, aber zwei Tiere können bei Kopulationen beobachtet werden. Bemerkenswert erscheint folgende Tatsache: Mit einem Weibchen, das um den 21. November Jungtiere bekommen hatte (vergl. SCHMELTING et al. 2000), findet am 28. November durch ein Männchen (125-96) eine Kopulation statt. Letzte Kopulationen werden Anfang Januar gesehen. Drei von sieben Fokusmännchen werden in diesem Monat von anderen Interaktionspartnern vertrieben. Im März, in dem es kaum Tiere mit Aktionsraumüberlappungen gibt (Abb. 23), können auch keine sozialen Interaktionen erfaßt werden. Tab. 20. Anzahl der Fokusmännchen pro Verhalten im Sozialkontext in jeder Fokusphase. Sep Okt Nov Anfang Nov Ende Jan Feb Mrz N Fokustiere 9 10 9 8 7 7 7 Nähe 7 3 4 6 4 2 Kontaktsitzen 1 1 4 1 3 Allogroomen 3 2 3 1 Fliehen 6 2 2 3 Jagen 2 1 1 1 Kopulation 1 2 2 66 Das Verhalten kann nach Auftreten im soziopositiven und im sozionegativen Kontext aufgeteilt werden. In Tab. 21 ist für jedes Fokustier die aufgetretene Häufigkeit, soweit bekannt, der jeweilige Sozialpartner und schließlich insgesamt die Häufigkeit von Begegnungen pro Stunde während der Fokusbeobachtungen bis Januar aufgelistet. Aus Tab. 21 ist ersichtlich, daß das Männchen 75-95 absolut und relativ die meisten soziopositiven Begegnungen hat: 11 Begegnungen, was bei 9.2 Stunden Fokuskontakt mit dem Tier von September bis Januar einer Rate von 1.2 Begegnungen pro Stunde entspricht. Bei diesem Männchen und dem Tier 26-98, welches eine ähnlich hohe Begegnungsrate (1.1 Begegnungen pro Stunde) hat, können die häufigsten soziopositiven Kontakte mit Weibchen festgestellt werden (jeweils sechsmal). Tier 26-98 kann zweimal bei Paarungen mit Weibchen beobachtet werden, einmal mit einem unbekannten Weibchen und einmal mit dem Weibchen 91-98. Um dieses östrische Weibchen kam es zuvor in derselben Nacht zu direkten Auseinandersetzungen, resultierend in anhaltenden Verfolgungsjagden mit den anderen Fokusmännchen 68-98, 84-98 und 007-97. Bei der anschließenden 20 min dauernden Paarung sind andere Tiere nicht mehr anwesend und die Paarung verläuft ohne Störung von außen. Aufgrund dieser Ereignisse resultiert für das Männchen 26-98 die höchste Rate mit 0.8 sozionegativen Begegnungen pro Stunde, bemessen an der Gesamtfokuskontaktzeit. Das Männchen 007-97 hat ebenfalls 0.8 sozionegative Begegnungen pro Stunde, unter den acht festgestellten Interaktionspartnern kann kein bekanntes Tier ausgemacht werden. Zusammengefaßt haben die Fokusmännchen zwischen 0.5 - 1.2 soziopositive und 0.1 - 0.8 sozionegative Begegnungen pro Stunde zwischen September und Januar. 67 68 4.3.3 Aktionsräume: Saisonale Dynamik Die mittlere Aktionsraumgröße der Männchen beträgt im Juli 1.54 ha (Abb. 14). Die Vergrößerung der Aktionsräume im August ist noch als Trend zu werten (WilcoxonVorzeichenrangtest, ZJul-Aug = 1.95, N = 9, p < 0.06). Im September ist eine signifikante Vergrößerung der Aktionsräume zu verzeichnen (Wilcoxon-Vorzeichenrangtest, ZAug-Sep = 2.60, N = 10, p < 0.02). Es werden in diesem Monat durchschnittlich die größten Aktionsräume gemessen (Mittelwert: 2.97 ha). In der darauffolgenden Triangulationsphase im Oktober ist eine signifikante Aktionsraumverkleinerung zu verzeichnen auf ein Mittel von 1.72 ha (Wilcoxon-Vorzeichenrangtest, ZSep-Okt = 2.60, N = 10, p < 0.01). Die erneute Vergrößerung der Aktionsräume im November (Mittelwert 2.54 ha) läßt sich statistisch nicht für alle Tiere belegen (Wilcoxon-VorzeichenrangtestOkt-Nov , N = 8, n.s.). Von November bis Januar ist eine signifikante Verkleinerung der Aktionsräume festzustellen (Wilcoxon- Vorzeichenrangtest, ZNov-Jan = 2.20, N = 6, p < 0.03). Die Aktionsraumgrößen von Mitte Januar bis Mitte März bewegen sich im Mittel zwischen 1.48 ha und 0.7 ha. 4.5 N=10 4.0 N=8 Aktionsraumgröße in ha 3.5 3.0 N=10 * * 2.5 2.0 1.5 1.0 N=10 N=9 N=7 * N=7 N=7 0.5 0.0 Mai Jun Jul Aug Sep Okt Nov Dez Jan Feb Mrz Apr Abb. 14. Dynamik der Aktionsraumgrößen der Sendermännchen. ±Std. Dev. ±Std. Err. Mean 69 Korrelationen zwischen Aktionsraumgröße, Hodenvolumen und Körpergewicht: Zu keiner Zeit kann eine Korrelation zwischen Aktionsraumgröße und Hodenvolumen festgestellt werden (Rangkorrelationkoeffizient nach Spearman n.s.). Das Körpergewicht der Sendermännchen korreliert nur im September positiv mit den ermittelten Aktionsraumgrößen desselben Monats (Rangkorrelationskoeffizient nach Spearman, N = 9, R = 0.7, p < 0.05; Abb. 15). Trotz der signifikanten Vergrößerung der Aktionsräume von Oktober zu November kann im November keine Korrelation von Aktionsraumgröße und Körpergewicht der Sendermännchen festgestellt werden (Rangkorrelationskoeffizient nach Spearman, rs = 0.42, N = 8, n.s.). Aktionsraumgröße = -6.561 + .17090 * Körpergewicht Korrelation: R = 0.72656 5.0 4.5 Aktionsraumgröße in ha 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 48 50 52 54 56 58 60 62 64 Regression 95% confid. Körpergewicht in g Abb. 15. Korrelation von Aktionsraumgröße und Körpergewicht im September 1998. Die Monate der Paarungszeit sollen genauer betrachet werden (Tab. 22). Es fällt auf, daß die Dynamik der Aktionsräume von September bis Oktober für das Tier 111-96 der allgemeinen Tendenz der Männchen entgegengerichtet ist. Während bei allen Tieren im Oktober kleinere Aktionsräume als im September und November ermittelt werden, wird für dieses Männchen 70 im Oktober ein größerer Aktionsraum gemessen als in den Monaten September und November. Tab. 22. Aktionsraumgrößen der Sendermännchen in ha. Tier September Oktober 75-95 2.85 1.64 125-96 4.55 1.55 111-96 3.74 4.17 007-97 3.70 2.43 55-97 3.36 1.59 68-98 3.46 1.27 78-98 3.29 1.11 94-98 1.82 1.06 26-98 1.87 1.39 84-98 1.05 0.95 November 4.42 2.96 1.44 3.72 2.30 2.02 2.20 1.24 Senderausfall verstorben Diese Ergebnisse können in Vierfeldertafeln eingeteilt werden nach residenten Männchen (= Altfänge) und Erstfänge mit über oder unter dem Median liegenden Aktionsräumen (Tab. 23 und Tab. 24). Tab. 23. Erste Paarungszeit (September). Aktionsraum in Relation Resident Erstfang zum Medianwert Groß 4 1 Klein 1 4 Tab. 24. Zweite Paarungszeit (November). Aktionsraum in Relation Resident Erstfang zum Medianwert Groß 4 0 Klein 1 3 Bei der Fragestellung „Haben residente Männchen zur Paarungszeit größere Aktionsräume als Erstfänge?“ kann die Null-Hypothese nur mit einer Wahrscheinlichkeit von 90 % (FisherExact-Test, p = 0.103 n.s.) für September bzw. 93 % für November (Fisher-Exact-Test, p = 0.071 n.s.) zurückgewiesen werden. 4.3.4 Aktionsraumüberlappungen Die räumliche Anordnung und Überlappungen der Aktionsräume sind in den Abb. 16 bis 23 dargestellt. Optisch kann bereits erfaßt werden, daß es im September (Abb. 18) und November (Abb. 20) mehr Überlappungen und größere gemeinsame Überschneidungsflächen gibt als in anderen Monaten, z.B. im März (Abb. 23). 71 N 50 m Randweg JBA Abb. 16. Nächtliche Aktionsräume der Sendermännchen im Juli 1998. N 50 m Randweg JBA Abb. 17. Nächtliche Aktionsräume der Sendermännchen im August 1998. 72 N 50 m Randweg JBA Abb. 18. Nächtliche Aktionsräume der Sendermännchen im September 1998. N 50 m Randweg JBA Abb. 19. Nächtliche Aktionsräume der Sendermännchen im Oktober 1998. 73 N 50 m Randweg JBA Abb. 20. Nächtliche Aktionsräume der Sendermännchen im November 1998. N 50 m Randweg JBA Abb. 21. Nächtliche Aktionsräume der Sendermännchen im Januar 1999. 74 N 50 m Randweg JBA Abb. 22. Nächtliche Aktionsräume der Sendermännchen im Februar 1999. N 50 m Randweg JBA Abb. 23. Nächtliche Aktionsräume der Sendermännchen im März 1999. 75 Die Anzahl der Überlappungen und der Überlappungsgrad (d.h. wieviel Prozent des eigenen Aktionsraumes mit einem anderen Tier geteilt wird) können quantifiziert werden. Der Überlappungsgrad ist der prozentuale Anteil des eigenen Aktionsraumes, der mit einem bestimmten anderen Tier geteilt wird. So überlappt sich im Februar der Aktionsraum von 5597 zu 47.4 % mit dem von 007-97, während sich nur 22.8 % des ermittelten Aktionsraumes von 007-97 mit dem von 55-97 überschneiden (Abb. 22). Pro Monat kann der Aktionsraum eines Tieres theoretisch mit dem jedes anderen Tieres überlappen. Bei z.B. 10 ermittelten Aktionsräumen pro Monat sind 90 Überlappungspaare möglich (jeder Aktionsraum überlappt mit sich selbst zu 100 % und wird nicht berücksichtigt). Nach Berechnung sämtlicher Überlappungsgrade können die einzelnen Paare in Klassen mit unterschiedlichen Überlappungsgraden eingeteilt werden. In Tab. 25 sind die Anzahl der Paare in den jeweiligen Klassen der Überlappungsgrade monatsweise dargestellt. Tab. 25. Anzahl der Paare pro Überlappungsgrad. Überlappungsgrad Jul Aug >0-10 % 22 22 10-20 % 6 14 20-30 % 6 6 30-40 % 7 9 40-50 % 4 7 50-60 % 4 4 60-70 % 0 3 70-80 % 0 1 80-90 % 1 0 90-100 % 0 0 Paare insgesamt 90 90 Anzahl Überlappungspaare insgesamt 50 66 Durchschnittl. Überlappungsgrad 21 % 24 % Sep 13 5 16 12 17 8 7 5 2 3 90 88 39 % Okt 13 9 12 7 2 1 3 2 1 0 90 50 26 % Nov 15 6 12 6 4 3 2 3 0 1 56 52 29 % Jan 5 2 5 3 1 0 0 0 0 0 42 16 19 % Feb Mrz 4 2 2 0 2 0 0 1 1 2 1 0 0 1 0 0 0 0 0 0 42 42 10 6 19 % 32 % Im September und dann wiederum im November gibt es anteilig die meisten Überlappungen (88 von 90 bzw. 52 von 56), welche einhergehen mit der Vergrößerung der Aktionsräume zu dieser Zeit. Nach Berechnung der Gesamtfläche aller an Überlappungen beteiligter Aktionsräume und der Größe der gemeinsam genutzten Fläche kann der durchschnittliche Überlappungsgrad pro Monat ermittelt werden. Auch die durchschnittlichen Überlappungsgrade vergrößern sich im September und November (der Monat März kann 76 außer Acht gelassen werden, da nur sechs von 42 Paaren überhaupt Überlappungen aufweisen). Bei einer rein zentrifugalen Ausdehnung dürften sich die Überlappungsgrade selbst nicht vergrößern. Diese Ergebnisse hingegen lassen auf eine in alle Richtungen gehende Ausdehnung der Aktionsräume schließen, welche auch optisch erfaßt werden kann, wenn man die Lage und Ausdehnung der einzelnen Aktionsräume auf der Karte von JBA für die Monate August bis November vergleicht (vergl. Abb. 17 bis 20). Von den mehr als einmal zusammen schlafenden Männchen waren nur die beiden Tiere 11196 und 125-96 zu gleichen Zeiten besendert. Die prozentualen Überlappungsgrade der Tiere zueinander in den jeweiligen Monaten sind in Tab. 26 dargestellt. Tab. 26. Überlappungsgrade der Aktionsräume zusammen schlafender Männchen. Triangulationsphase 111-96 mit 125-96 125-96 mit 111-96 Juli 31.1 % 50.3 % August 19.6 % 14.6 % September 70.5 % 85.5 % Oktober 21.5 % 8.1 % November 70.4 % 34.0 % Werden die Daten der zusammen schlafenden Männchen verglichen und eingeordnet in die unterschiedlichen Kategorien der Überlappungspaare in Tab. 25, so wird ersichtlich, daß die Aktionsraumüberlappungen dieser beiden zusammen schlafenden Männchen zu Beginn der Paarungszeiten im September und November im oberen Bereich der Verteilung liegen, während sich in den Monaten August und Oktober der Anteil des gemeinsam genutzten Aktionsraumes nicht von dem Gros der übrigen Aktionsraumüberlappungen unterscheidet. 4.3.5 Nachtwanderstrecken Während der Fokusbeobachtungen im September legen die Männchen mit durchschnittlich 1028 m die längsten Nachtwanderstrecken zurück (Abb. 24). Im Oktober nehmen die Wegstrecken signifikant auf durchschnittlich 821 m ab (Wilcoxon-Vorzeichenrangtest, ZSepOkt = 2.19, N = 10, p = 0.03). Ende November werden im Durchschnitt wieder längere Nachtwanderstrecken zurückgelegt (Mittelwert: 869 m). Die kürzesten Wegstrecken werden im März mit durchschnittlich 583 m ermittelt. Der Verlauf dieses Diagramms ähnelt dem der Dynamik der Aktionsraumgrößen (Abb. 14). Allerdings korreliert nur im Monat März, in dem die kleinsten Aktionsräume gemessen werden, die zurückgelegte Wegstrecke aus der 77 Fokusbeobachtung positiv mit der durch Triangulation ermittelten Aktionsraumgröße desselben Monats (März, Rangkorrelationskoeffizient nach Spearman, N = 6, rs = 0.9, p < 0.01). 1400 Nachtwanderstrecken in m 1200 N=10 N=8 N=10 1000 N=7 * 800 N=7 N=6 N=6 600 400 ±Std. Dev. ±Std. Err. Mean 200 Sep Okt Nov Nov AnfangMonate Ende Jan Feb Mrz Abb. 24. Zurückgelegte Wegstrecken während der Fokusphasen. Das bedeutet, daß sowohl Männchen in einem kleinen Aktionsraum größere Wegstrecken zurücklegen können als auch Männchen mit einem großen Aktionsraum nicht unbedingt viel Strecke laufen müssen. Faßt man die Ergebnisse der Triangulation und der Nachtwanderstrecken des gleichen Monats in eine Karte zusammen, kann ein Eindruck gewonnen werden, ob und wie der über mehrere Tage ermittelte Aktionsraum innerhalb einer Nacht genutzt wird. Hierbei muß die methodisch bedingte sukzessive Datenaufnahme berücksichtigt werden. Als Beispiele sind hier Ergebnisse aus einer Paarungszeit (November, Abb. 25) und außerhalb der Paarungszeit (März, Abb. 26) dargestellt. 78 N Distanz zwischen Ende erster und Start zweiter Beobachtung der Fokusnacht: 50 m Randweg JBA Abb. 25. November 1998: Aktionsraum (durch Triangulation ermittelt) in Relation zu den Nachtwanderstrecken. Aktionsraum N 50 m Randweg JBA Abb. 26. März 1999: Aktionsraum (durch Triangulation ermittelt) in Relation zu den Nachtwanderstrecken. 79 Im November ist der ermittelte Aktionsraum für Tier 75-95 fast kongruent mit der zurückgelegten Strecke in der Fokusnacht. Das Tier hat den vorher ermittelten Aktionsraum von einem bis zum anderen Ende durchlaufen und dabei eine relativ kurze Wegstrecke zurückgelegt (800 m). Für die Tiere 125-96 und 68-98 ergibt sich kein solch hoher Deckungsgrad. Sie nutzen zusätzlichen Aktionsraum, der zuvor nicht erfaßt worden ist. Bemerkenswert ist, daß 125-96 und 68-98 scheinbar das gleiche, zusätzliche Gebiet explorieren wie Tier 75-95. Die beiden erstgenannten Männchen legen dabei eine größere Wegstrecke zurück (Tier 125-96: 1063 m bzw. Tier 68-98: 1088 m) als das Tier 75-95 (800m). Bei allen drei Tieren können während dieser Fokusbeobachtungen Kontakte zu anderen Mausmakis beiderlei Geschlechts protokolliert werden. Männchen 125-96 ist in der Fokusnacht des 27. auf den 28. November 1998 bei einer Kopulation beobachtet worden. Außerhalb der Paarungszeit sind die genutzten Gebiete der Nachtwege überwiegend kongruent mit den vorher bestimmten Aktionsräumen (als Beispiel: Abb. 26). 4.3.6 Zugang zu Weibchen Aufgrund der Beobachtungen von Kopulationen im September und November sollen für diese Monate der potentielle Zugang der Männchen zu Weibchen dargestellt werden. Hierfür werden die Fangorte der Weibchen eines Monats gezählt, die innerhalb des für diesen Monat berechneten Aktionsraumes eines Männchens liegen. Zusätzlich werden die Männchen nach ihrem Körpergewicht und der jeweiligen Aktionsraumgröße im September und November klassifiziert (Tab. 27). Die Tiere lassen sich nach zwei Gesichtspunkten klassifizieren: Zum einen in schwere und leichte Männchen, zum anderen in residente Männchen und Erstfänge. Hierbei fällt auf, daß die Aktionsräume der bereits in früheren Jahren gefangenen Männchen im allgemeinen größer sind als bei erstmals 1998 gefangenen Männchen. Vier Altfänge haben in allen Fangaktionen ein hohes, d.h. über dem Monatsmittel aller gefangenen Männchen liegendes Körpergewicht. Das Körpergewicht des Altfanges 55-97 hingegen liegt immer unter dem Mittel, dieses Männchen hat aber gleichfalls große Aktionsräume. Große Aktionsräume beinhalten in der Regel mehr Weibchenfangorte. 80 Tab. 27. Zugang zu Weibchen in Relation zum Alter, Körpergewicht und Aktionsraumgröße ♂♂ Körpergewicht1 Aktionsraum größer(+) oder kleiner (-) als der Median Sep. Nov. Im Aktionsraum gefangene ♀♀² Sep. Nov. 5 3 55-97 + + 5 3 75-95 + + 5 3 111-96 + + 4 2 007-97 + + + 4 3 125-96 + + + -+ 6 2 78-98 -+ 4 2 68-98 + 1 2 94-98 n.v. 3 n.v. 84-98 -+ n.v. 1 n.v. 26-98 1 Körpergewicht immer unter (-) oder über (+) dem Monatsmittel aller gefangener Männchen (N=66). -+ = Körpergewicht variiert und kann nicht nach den vorherigen Kriterien eingeteilt werden. n.v. = Daten nicht vorhanden. ²Anzahl aller in JBA gefangener Weibchen: Sep. N = 11; Nov. N = 8. 81 5 Diskussion 5.1 Methodenvergleich: Nachtwanderstrecken und Aktionsräume In der vorliegenden Studie ist erstmals ein direkter methodischer Vergleich in der Erfassung von Aktionsräumen und Nachtwanderstrecken von M. murinus möglich. Wie die Größe der Aktionsräume nahm auch die Länge der gemessenen Nachtwanderstrecken in der Paarungszeit zu und anschließend wieder ab. Nach der Reproduktionsperiode war die mit beiden Methoden bestimmte Fläche und Lage überwiegend deckungsgleich und die Aktionsraumgröße korrelierte mit der Nachtwanderstrecke. Der Vergleich der Lage der durch Triangulation ermittelten Aktionsräume mit den Ergebnissen der während der Fokusbeobachtungen erfaßten Nachtwanderstrecken zeigte, daß die Tiere in einer Nacht den während mehrerer Nächte indirekt bestimmten Aktionsraum vollständig nutzen können und nicht einzelne Bereiche des Aktionsraumes in aufeinander folgenden Nächten zu explorieren scheinen. In der Reproduktionsperiode konnten während der direkten Fokusbeobachtung aber auch Nachtwanderstrecken ausgemacht werden, die weit über die scheinbaren Grenzen der indirekt bestimmten Aktionsräume hinausgehen können. Dieses kann verschiedene Gründe haben. Unter Berücksichtigung der sukzessiven Methodendurchführung könnte es sein, daß die Männchen während der Paarungszeit in den verschiedenen Wochen unterschiedliche Gebiete aufsuchen, um auf östrische Weibchen zu treffen. Dieses würde gestützt durch die Annahme, daß im Freiland Östren der Weibchen zufällig und nicht synchronisiert aufzutreten scheinen (EBERLE & KAPPELER 1999). Zum anderen sind bei der nächtlichen indirekten Aktionsraumbestimmung Meßungenaugigkeiten und -fehler nicht auszuschließen, die nur durch eine rigorose Kontrolle der aufgenommenen Daten und der Eliminierung aller fragwürdigen Datenpunkte minimiert werden kann. Hierdurch kann es zu einer virtuellen Verkleinerung des tatsächlichen Aktionsraumes kommen, der dann aber bei der direkten Beobachtung erfaßt wird. Auch das gewählte Zeitintervall von 30 bis 60 min zwischen zwei zu ermittelnden Aufenthaltsorten kann bei einer hohen „Reisegeschwindigkeit“ eines Tieres zu groß sein, da 82 bei z.B. sternförmigen Wanderstrecken weiter entfernt gelegene Aufenthaltsorte in dem Intervall zwischen zwei aufeinanderfolgenden Messungen liegen und somit nicht erfaßt werden könnten. Dieses ist wahrscheinlicher während der Paarungszeit, in der die Männchen innerhalb einer Nacht auf der Suche nach rezeptiven Weibchen weite Strecken zurücklegen. Die in meiner Studie ermittelten Nachtwanderstrecken, die auf den Fokusbeobachtungen der ersten und letzten drei Nachtstunden (zuzüglich einer Geraden zwischen Endpunkt der ersten und erneutem Startpunkt der zweiten Fokusphase) beruhen, entsprachen mit durchschnittlich 1.03 km im September und 0.82 km im Oktober annähernd den über eine gesamte Nacht in früheren Studien im gleichen Gebiet gemessenen Wanderstrecken: BARRE et al. (1988) konnten in einer Studie zwischen September und Oktober feststellen, daß die Männchen bei Aufzeichnungen der Wegstrecke über eine gesamte Nacht durchschnittlich 1.30 km pro Nacht zurücklegten. Bei PAGES-FEUILLADE (1988) betrugen die Nachtwanderstrecken einer gesamten Nacht für die Männchen zwischen Ende September und Anfang November im Schnitt 0.76 km ± 0.26 km. Es scheint sich daher zu bestätigen, daß die Aktivitätsmaxima der Männchen, wie von MARTIN (1972b) vermutet, am Anfang und am Ende einer Nacht liegen und eine jeweils dreistündige Beobachtungsphase am Anfang und Ende ausreichend sind, um Nachtwanderstrecken zu postulieren. Dennoch sind Verhaltensbeobachtungen in dem bisher nicht erfaßten Zeitraum in der Mitte der Nacht zweckmäßig, da dann z.B. vermehrt soziale Interaktionen stattfinden könnten, bei denen die Tiere dann keine weiten Strecken zurücklegen müßten. Aufgrund dieser Zusammenhänge und den Ergebnissen der Nachtwanderwege erscheint es mir sinnvoll, nach besagter Datenkontrolle die Aktionsräume von M. murinus als MinimumKonvex-Polygon zu 100 % zu erfassen ohne eine weitere Minimierung auf einen sogenannten Hauptaktionsraum (core area) vorzunehmen (z.B. RADESPIEL 1998, 2000, EHRESMANN 2000). Der gesamte durch Triangulation erfaßte Aktionsraum (100 % Minimum-KonvexPolygon) scheint bereits kleiner zu sein als der wirkliche Aktionsraum und entspricht daher schon einem Hauptaktionsraum. Bei einer geringen Anzahl zu beobachtender Individuen sind Fokusbeobachtungen mit Aufenthaltsbestimmung bei M. murinus der Triangulation vorzuziehen, da neben annähernd gleichem Informationsgehalt zum Aufenthaltsort bzw. zur Lage und Größe des 83 Aktionsraumes weitere direkte Verhaltensdaten erfaßt werden können. Die Ergebnisse meiner Untersuchung zeigen, daß unter Berücksichtigung möglicher Habitateinflüsse klar begrenzte Zeiträume für den Vergleich von Nachtwanderstrecken von M. murinus notwendig sind, da es gerade um die Paarungszeit herum innerhalb relativ kurzer Zeiträume zu signifikanten Änderungen der zurückgelegten Nachtwanderstrecken kommen kann. 5.2 5.2.1 Saisonalität Populationsökologie Die in meiner Studie berechneten Populationsdichten schwankten saisonal zwischen 75 und 148 Tieren/km² je nach Fangmonat und Berechnungsmethode. Die geringsten Populationsdichten wurden in der Mitte der Regenzeit, die größten Populationsdichten gegen Ende der Trockenzeit ermittelt. Für diese saisonalen Schwankungen können verschiedene Ursachen diskutiert werden. Zum einen könnten tatsächlich weniger Tiere während der Regenzeit in dem untersuchten Gebiet leben. Die Abnahme der Population könnte bedingt sein durch eine verstärkte Abwanderung aus dem Gebiet, wie von RADESPIEL (1998) postuliert. Hiergegen sprechen folgende Tatsachen: Wenn es in jedem Jahr zu diesem Zeitpunkt eine Abwanderung ohne gleichzeitige Zuwanderung geben würde, so könnte es keine stabile Populationsgröße über einen längeren Zeitraum geben und die Population würde von Jahr zu Jahr abnehmen und schließlich zusammenbrechen. Die in der Trockenzeit ermittelten Populationsgrößen entsprechen jedoch den seit 1995 jährlich in kürzeren Studien mit gleicher Methodik ermittelten Populationsgrößen (RADESPIEL 1998, SARIKAYA 1999, EHRESMANN 2000). Eine Abwanderung ohne Zuwanderung zur Regenzeit aus dem Untersuchungsgebiet in Nachbargebiete und eine Zuwanderung aus den Nachbargebieten erst zur Trockenzeit in das Untersuchungsgebiet macht biologisch keinen Sinn, wenn davon ausgegangen wird, daß Untersuchungs- und Nachbargebiete den gleichen biologischen Prozessen unterliegen. Eine tatsächliche Abnahme der Population könnte aber auch durch eine zur Regenzeit erhöhte Prädation bedingt sein. Hierfür würde das gehäufte Auftreten von Schlangen als potentielle Prädatoren während der Regenzeit sprechen (eigene Beobachtung). Der einzige in meiner 84 Studie nachgewiesene Fall von Prädation eines Mausmakis ereignete sich allerdings am Ende der Trockenzeit. Durch Geburten und Migration der Jungtiere am Ende der Regenzeit und einer folgenden Abnahme der Prädation könnten sich die Populationen während der Trockenzeit konsolidieren. Über saisonal unterschiedliches Beuteverhalten möglicher Prädatoren ist jedoch wenig bekannt (GOODMAN et al. 1993). Zum anderen könnten nur scheinbar weniger Mausmakis im untersuchten Gebiet leben, da weitere Tiere mit der verwendeten Methode nicht erfaßt werden. Die mit dieser Methode berechneten Populationsgrößen sind direkt abhängig von der Anzahl der gefangenen Individuen. Diese nahm mit dem Einsetzen der Regenzeit signifikant ab. Auch bei den sich nachweislich im Untersuchungsgebiet aufhaltenden Sendermännchen wurde eine herabgesetzte Fangbarkeit in der Regenzeit beobachtet. Die jahreszeitlich unterschiedliche Fallennutzung der sich permanent im Untersuchungsgebiet aufhaltenden Sendermännchen und die Ergebnisse der Fokusbeobachtungen hinsichtlich des Freßverhaltens geben einen Hinweis auf andere wahrscheinliche Ursachen der Schwankungen der berechneten Populationsdichten. Während der Regenzeit können die Tiere auf ein größeres und reichhaltigeres Nahrungsangebot an Insekten, Früchten und Nektar zurückgreifen, wodurch sich nicht mehr die Notwendigkeit ergeben könnte, die mit Bananen beköderten Fallen aufzusuchen. Wie in dieser Arbeit dargestellt, schienen die Tiere in der Regenzeit zudem eine andere Aufenthaltshöhe als die der aufgestellten Fallen (1 – 2 m Höhe) zu bevorzugen. Die Aufenthaltshöhe einer Falle sollte die Fangbarkeit aber nicht entscheidend beeinflussen, wenn diese mit einer bevorzugten Nahrung beködert ist. Von überreifen Bananen kann angenommen werden, daß sie aufgrund des ausgeprägten Geruchsinns der Mausmakis (SCHILLING 1987, SCHILLING & PERRET 1987) auch aus weiterer Entfernung wahrgenommen werden können. Während der Studie konnte weiter der Eindruck gewonnen werden, daß mit Zunahme des Nahrungsangebotes die Qualität und der Zustand der als Köder vorgesehenen Bananen von entscheidender Bedeutung für den Fangerfolg zu sein scheint (EHRESMANN 2000). Als offene Frage ergibt sich, ob die Höhe der aufgestellten Fallen zur jeweiligen Jahreszeit ebenfalls die Fangergebnisse beeinflußt. 85 Unter Berücksichtigung der vorangegangenen Überlegungen könnte sich folgendes Modell ergeben: Aufgrund des hohen Prädationsdruckes nimmt die Population ständig ab. Mit dem Ende der Trockenzeit und dem Beginn der Regenzeit nimmt dieser Effekt zu. Mit dem Beginn der Regenzeit führen Verhaltensänderungen (d.h. andere Nahrungspräferenzen) zu einer geringeren Fallennutzung. Dieses führt zu einer scheinbar verstärkerten Populationsabnahme, die größer ausfällt als die tatsächlich vorhandene Populationsabnahme. Geburten und die anschließende Migration der Jungtiere zwischen den Gebieten am Ende der Regen- bzw. zu Beginn der Trockenzeit konsolidieren die Populationen. Die im gleichen Gebiet auf Transektzählungen zu Anfang der Regenzeit basierenden Populationsdichten von 42±19 Tiere/km² (GANZHORN 1988) liegen unter den ermittelten Populationsdichten dieser Studie, die auf der Fang-Wiederfangmethode beruhen. Weiterführende, vergleichende Studien zu unterschiedlichen Methoden der Ermittlung der Populationsgrößen als auch experimentelle Untersuchungen zu Nahrungspräferenzen, die ebenfalls das Fallenverhalten beeinflußen könnten, wären daher wünschenswert, um ein möglichst genaues Bild über die Zuverlässigkeit der jeweiligen Methoden zu haben. 5.2.1.1 Geschlechterverhältnis Über den gesamten Zeitraum von einem Jahr betrachtet, konnte in meiner Studie selbst in den Monaten mit den stärksten Verschiebungen des Geschlechterverhältnisses keine signifikante Abweichung von einem ausgewogenen Geschlechterverhältnis (1:1) festgestellt werden. Zu Beginn der jeweiligen Paarungszeit (s. Kap. 5.3.) im September und November wurden jedoch stärkere Verschiebungen des operanten Geschlechterverhältnisses (1:1.8 bzw. 1:1.75) zugunsten der Männchen beobachtet. Auch RADESPIEL (1998) fand in Ampijoroa ein operantes Geschlechterverhältnis von ungefähr zwei Männchen zu einem Weibchen in der Zeit zwischen Mitte August bis Mitte Oktober. Folgende Erklärungen wären denkbar: Erstens vergrößern die Männchen in diesen Zeiten ihre Aktionsräume durch die Suche nach rezeptiven Weibchen. Die Aktionsräume der Männchen sind hierbei sehr viel größer als die der Weibchen (RADESPIEL 1998). Mit einem größeren Aktionsraum besteht für die Männchen auch eine größere Wahrscheinlichkeit, auf eine aufgestellte Falle zu treffen und daher gefangen zu werden. 86 Zweitens ist die Paarungszeit für die Männchen mit energetischen Kosten verbunden. Bei den untersuchten Männchen kam es neben signifikant verlängerten Nachtwanderstrecken und vergrößerten Aktionsräumen auch vermehrt zu agonistischen Auseinandersetzungen. Gleichzeitig konnte ein im Mittel verringerter Zeitaufwand für die Nahrungsaufnahme beobachtet werden. Unter Berücksichtigung des knappen Nahrungsangebotes während der Trockenzeit könnten die Männchen in diesen Monaten vermehrt die mit Bananen beköderten Fallen aufsuchen, um ihren erhöhten Energiebedarf zu decken. Hierdurch kann sich ebenfalls ein leicht zugunsten der Männchen verschobenes Geschlechterverhältnis während der Paarungszeit ergeben. 5.2.1.2 Saisonaler Torpor Für Ampijoroa zeigt sich, daß bei M. murinus keine längeren Perioden von Torpor vorkommen. Zu keiner Zeit konnte eine signifikante Änderung des Geschlechterverhältnisses festgestellt werden. Diese Befunde bestätigen Ergebnisse einer Langzeitstudie über die Trockenzeit im gleichen Untersuchungsgebiet (EHRESMANN 2000). Sie stehen im Widerspruch zu Ergebnissen aus Westmadagaskar, wo vor allem Weibchen für die kältesten Monate in einen Trockenschlaf eintreten und es dadurch zu einem stark zugunsten der Männchen verschobenem Geschlechterverhältnis kommt (SCHMID & KAPPELER 1998). Diese aufgezeigten Unterschiede zwischen beiden Populationen könnten auf klimatische Unterschiede der beiden Habitate aus den unterschiedlichen Subzonen Madagaskars (MARTIN 1972a) zurückzuführen sein, da der Eintritt in den Torpor vorrangig temperaturabhängig zu sein scheint (WEIDHOLZ 1932, MARTIN 1972a). Während im Kirindy die Temperaturen in den kältesten Monaten Juni und Juli unter 5°C fallen können (SCHMID 1997, 1999) liegt in Ampijoroa die Minimaltemperatur der beiden kältesten Monate Juni und Juli bei durchschnittlich etwa 16°C (niedrigster Temperaturwert 12.0 °C). 5.2.2 Schlafplatzwahl Mit meiner Studie konnten erstmals saisonal klar voneinander abzugrenzende Unterschiede in der Schlafplatzwahl der Männchen nachgewiesen werden. Diese könnten für Überlebensstrategien und somit für den Lebensreproduktionserfolg von großer Bedeutung sein, da z.B. saisonale Veränderungen im Habitat, Prädatorendruck und/oder Parasitenbefall 87 jeweils andere Verhaltensstrategien begünstigen. Im folgenden sollen die Ergebnisse der einzelnen Zeitabschnitte diskutiert werden. 5.2.2.1 Trockenzeit In der Trockenzeit hatten die von mir untersuchten Männchen neben häufig wechselnden einige bevorzugte und wiederholt genutzte Schlafplätze. In diesem Zeitraum wurden mehr als doppelt so häufig Höhlen den offenen Schlafplätzen vorgezogen. Bei Untersuchungen während der Trockenzeit war bei M. murinus im Gegensatz zur Zwillingsart M. ravelobensis in der Regel kein Fluchtverhalten sondern ein Verharren am Schlafplatz zu beobachten (EHRESMANN 2000). M. murinus sollten daher Höhlen als sichere Versteckmöglichkeit vor Prädatoren bevorzugen (SCHMID 1997, RADESPIEL 1998). Isolierende Eigenschaften der Baumhöhlen, die für die Mausmakis in den Kältephasen eine zusätzliche Energieersparnis bringen sollen (SCHMID 1997), wurden ebenfalls diskutiert (RADESPIEL 1998), wenngleich berücksichtigt werden muß, daß die von SCHMID (1997) im Kirindy erfaßten starken Temperaturamplituden während eines Tages als auch die niedrigen Minimaltemperaturen sowie saisonale Torporphasen, die allesamt für eine Bedeutung der Isolationseigenschaften bei der Schlafplatzwahl sprechen, in Ampijoroa nicht vorkommen. Besonders sichere Schlafplätze sollten so oft wie möglich aufgesucht werden (RADESPIEL et al. 1998). Dieses könnte der Fall gewesen sein bei den individuell bevorzugten Schlafplätzen der einzelnen Männchen mit häufiger Wiederkehrrate. Da häufig genutzte Schlafplätze leichter von Prädatoren entdeckt werden könnten (HRDY 1977), sollten Individuen neben einigen bevorzugten und wiederholt genutzten auch häufig wechselnde Schlafplätze haben (DI BITETTI et al. 2000). Während der Trockenzeit scheinen sich die männlichen M. murinus dieser von DI BITETTI et al. (2000) für Callitrichiden postulierten Überlebensstrategie entsprechend zu verhalten. 5.2.2.2 Schlafgemeinschaften am Ende der Trockenzeit Am Ende der Trockenzeit konnten zwischen Männchen 33 Mal Schlafgruppenbildungen ohne Weibchenbeteiligung beobachtet werden. 16 verschiedene Männchen schliefen mindestens 88 einmal mit einem anderen Männchen zusammen. Nur residente Männchen konnten mehr als einmal gemeinsam an einem Schlafplatz beobachtet werden. Die Bildung von rein männlichen Schlafgruppen scheint daher zu diesem Zeitpunkt kein außergewöhnliches Phänomen zu sein, wenngleich es in früheren Studien nicht oder nicht in diesem Maße erfaßt worden ist (FIETZ 1995, SCHMID 1997, PETERS 1999, RADESPIEL 2000, EHRESMANN 2000). Die Abwesenheit von Schlafgruppenbildung unter Männchen wurde von RADESPIEL (2000) als Mechanismus intrasexueller Konkurrenz um Weibchen während der Paarungszeit interpretiert, welcher zur Intoleranz zwischen Männchen führen solle. Wäre dieses der alleinige Grund, so hätten allerdings außerhalb der Paarungszeit zu Beginn der Trockenzeit männliche Schlafgruppen auftreten sollen (aber EHRESMANN 2000). Denn nach der Hypothese der zusätzlichen Energieersparnis durch gegenseitige Körperwärme bei Schlafgruppen (SCHMID 1997) wären Schlafgruppen gerade in der kälteren Trockenzeit von Vorteil. Für die in meiner Studie in Ampijoroa erhobenen Befunde ist auch die für Kirindy entwickelte „Energiesparhypothese“ aufgrund anderer Gegebenheiten (s.o.) weniger plausibel, zumal in dem Zeitraum, in dem die Tiere zusammen schliefen, die höchsten monatlichen Durchschnittstemperaturen gemessen wurden. Eine andere Erklärung für die Bildung von Schlafgemeinschaften am Ende der Trockenzeit könnte eine veränderte Feindvermeidungsstrategie aufgrund des veränderten Prädationsdrucks sein. Am Ende der Trockenzeit konnte eine beginnende Aktivität von Schlangen als mögliche Mausmakiprädatoren (GOODMAN et al. 1993) festgestellt werden (eigene Beobachtung). Dies könnte die Bildung von Allianzen und Schlafgemeinschaften der ansonsten einzeln schlafenden Männchen favorisieren. Prädatoren könnten von einzelnen Individuen frühzeitiger wahrgenommen werden, wenn andere Individuen z.B. Alarmrufe ausstoßen (MARLER 1968, ZIMMERMANN 1995). Dieses könnte der Fall gewesen sein bei den auf die Präsenz einer Baumboa Sanzinia madagascariensis mit ausgedehnten Langpfiffserien reagierenden Fokustieren (Kap. 4.2.3.4). Außerdem ist die Chance größer, selbst einem Prädator zu entkommen, der einen Schlafplatz ausfindig gemacht hat, wenn sich noch mindestens ein weiteres Individuum am Schlafplatz befindet, wie ebenfalls beobachtet werden konnte (Kap. 4.2.2.3). Als sicher erscheinende Schlafplätze könnten gemeinsam gegen andere Konkurrenten verteidigt werden (NOE 1986), wie die beschriebene Verhaltenssequenz um die Schlafplatzkonkurrenz vermuten läßt (Kap. 4.2.2.4). 89 Erste Ergebnisse bei M. murinus in Gefangenschaft weisen darauf hin, daß soziale Interaktionen zwischen Tieren der gleichen Altersgruppe sehr viel ausgeglichener (z.B. gemeinsame Schlafboxteilung, Allogrooming) sind als zwischen Tieren unterschiedlicher Altersgruppen (PICQ 1992). Interessanterweise wurden in dieser Freilandstudie nur ältere Männchen des gleichen „Fangjahrgangs“ mehrmals gemeinsam am gleichen Schlafplatz angetroffen und konnten bei der gegenseitigen Fellpflege beobachtet werden. Teilweise handelte es sich um bis zu vier Individuen, die in unterschiedlichen Konstellationen zusammen schlafen. Unter Primaten kann die Bildung von Koalitionen öfter bei Tieren beobachtet werden, die miteinander verwandt sind (VAN HOFF & VAN SCHAIK 1992, 1994). Bei einer möglichen, wenngleich sehr selten erreichten Anzahl von vier Jungen pro Wurf bei M. murinus (PERRET 1982) könnte es sich bei den festgestellten Schlafplatzpartnern grundsätzlich um Wurfgeschwister handeln. Jedoch ist die Wahrscheinlichkeit sehr gering, daß alle vier Jungtiere eines Wurfes männlich sind (PETTER-ROUSSEAUX 1962, MARTIN 1972b, GLATSON 1979, aber PERRET 1982) und trotz des hohen Prädationsrisikos (GOODMAN et al. 1993) noch nach drei Jahren im Gebiet anzutreffen sind; bereits in Gefangenschaft wurde von einer Jungtiermortalitätsrate von ca. 30 % berichtet (GLATSTON 1979, PERRET 1982). Es könnten aber auch zeitgleich aufgewachsene Jungtiere verschiedener Mütter sein, die selbst eine Schlafgemeinschaft bildeten, da konstante Schlafgemeinschaften bei Weibchen relativ häufig auftreten (RADESPIEL 1998, SARIKAYA 1999, EHRESMANN 2000). Ob diese oder gänzlich andere Mechanismen für die Bildung und Zusammensetzung der Männchenassoziationen verantwortlich sind, kann hier nicht abschließend geklärt werden. Hierfür wären unter anderem molekulargenetische Verwandtschaftsanalysen hilfreich. 5.2.2.3 Regenzeit Mit dem Einsetzen der Regenzeit änderten die Männchen gänzlich ihre Schlafplatzpräferenzen. Die in der Trockenzeit mehr als doppelt so häufig als Schlafplätze festgestellten Höhlen konnten in der Regenzeit in nur noch etwa 10 % der Fälle beobachtet werden. Den überwiegenden Teil verbrachten die Männchen tagsüber offen im Gestrüpp oder Blattwerk schlafend. Ab Anfang November nahm die für die eigene Fellpflege (Autogrooming) beanspruchte Zeit im Mittel von Monat zu Monat stetig zu bis auf einen 90 Anteil von 4.3 % aller beobachteten Verhaltensweisen im März. Während die Männchen in der Trockenzeit neben oft wechselnden auch einige bevorzugte Schlafplätze hatten, wechselten sie fast täglich die Schlafplätze während der Regenzeit. Hierfür gibt es verschiedene mögliche Erklärungen, die sich gegenseitig nicht ausschließen: Die fast täglich wechselnden Schlafplätze könnten eine Überlebensstrategie zur Vermeidung von Prädatoren und/oder Parasiten bei veränderter Umwelt sein. Durch den häufigen und intensiven Niederschlag sind zahlreiche in der Trockenzeit als Schlafplätze genutzte Baumhöhlen mit Wasser gefüllt und somit für die Mausmakis unbrauchbar (eigene Beobachtung). Während der Regenzeit konnten Schlangen sowohl am Tag als auch in der Nacht häufig im Wald beobachtet werden, die auch sehr gut in Baumhöhlen eindringen können, aus denen es dann für die Mausmakis kein Entkommen mehr gibt. Ein häufig wechselnder Schlafplatz mit zu allen Seiten möglichen Fluchtwegen könnte für die Männchen von Vorteil sein, zumal ein dichtes Blätterdach einen gewissen Schutz vor Witterungseinflüssen gibt. In der Regenzeit könnten die Männchen auch vermehrt von Ektoparasiten befallen sein. Durch zunehmende Fellpflege könnte daher versucht werden, die Parasitenbürde zu mindern. So konnten bei den Tiervermessungen während der Fangaktionen in dieser Zeit Ektoparasiten festgestellt werden, die jedoch nicht weiter bestimmt und quantifiziert wurden. Eine weitere Verhaltensmaßnahme zur Verminderung des Parasitenbefalls könnte sein, den Schlafplatz (fast) täglich zu wechseln. Denn einzelne Entwicklungsstadien von Ektoparasiten können auch in der Umgebung überleben und den Wirt anschließend befallen (BÜRGER 1992) oder, wie z.B. die Milbenart Dermanyssus gallinae, den Wirt an seinem Schlafplatz nur zur Nahrungsaufnahme befallen und ansonsten am Schlafplatz versteckt leben (KUTZER 1992). Eine qualitative und quantitative Bestimmung der Parasitenbürde unter Berücksichtigung saisonaler Einflüsse von freilebenden Mausmakis wäre zur Beantwortung dieser zweiten Vermutung hilfreich. 5.2.2.4 Das Phänomen der Blattnester Während des gesamten Untersuchungszeitraumes konnte ich die Männchen von M. murinus bei allen 1244 charakterisierten Schlafplatzwahlen nie in Blattnestern angetreffen, wie sie bei 91 MARTIN (1972a, 1972b) beschrieben werden. In Ampijoroa konnten im Untersuchungsjahr nur für Weibchen Blattnester entdeckt werden (eigene Beobachtungen), während die Männchen offen im dichten Laubwerk schliefen. Dieses entspricht einer während der Trockenzeit in Ampijoroa durchgeführten Studie (EHRESMANN 2000, aber RADESPIEL et al. 1998) und den in West-Madagaskar vorgefundenen Verhältnissen (FIETZ 1995, SCHMID 1997). Diese Ergebnisse stehen im Widerspruch zu den von RADESPIEL et al. (1998) beschriebenen Verhältnissen im gleichen Untersuchungsgebiet, bei denen Männchen im Gegensatz zu Weibchen vermehrt in Blattnestern schlafen sollten. Als wahrscheinlichste Erklärung für diesen Widerspruch erscheint mir eine unterschiedliche Interpretation des von MARTIN (1972b) definierten Begriffes eines Blattnestes. Auch hier wären weitere Untersuchungen von Vorteil. Bislang konnten Mausmakis nicht beim Bau von Blattnestern beobachtet werden, dennoch vermute ich, daß die Weibchen von M. murinus diese Blattnester selbst anlegen. Wenn Mausmakis verlassene Blattnester anderer Tierarten nutzen würden, so hätten zumindest einige Male bei den 1244 Schlafplatzkontrollen auch Männchen in den von MARTIN (1972b) beschriebenen Blattnestern angetroffen werden sollen, denn es könnte für Mausmakis eine leicht zugängliche und dennoch sicherere Alternative zum offenen Schlafen im Gestrüpp sein. Die Männchen benötigen jedoch nicht wie die Weibchen auch in der Regenzeit konstante und von Witterungseinflüssen besser geschützte Schlafplätze für die erfolgreiche Jungenaufzucht (RADESPIEL 1998, EHRESMANN 2000, beide allerdings Trockenzeit). Der Bau eines Blattnestes in jeder neuen Nacht wäre für die Männchen ein Energie- und Zeitaufwand, der in keiner Relation zum gewonnenen Nutzen zu stehen scheint. Gleiches gilt für die Trockenzeit, in der noch vermehrt Baumhöhlen und weniger frische Blätter zur Verfügung stehen. 5.2.3 Nahrungsspektrum Die ausgeprägte Saisonalität, der das Untersuchungsgebiet unterliegt, hat auch Auswirkungen auf das Nahrungsverhalten der Mausmakis, wie durch meine Verhaltensbeobachtungen belegt werden konnte. Je nach Jahreszeit und Monat erschlossen die Tiere saisonal verschiedene Nahrungsquellen. In der Trockenzeit waren dies vor allem Baumexsudate und Insektensekrete, zu Anfang der Regenzeit Insekten und Früchte, Nektar in der Folgezeit und gegen Ende der Regenzeit Früchte sowie wiederum Baumexsudate. 92 Es kann damit die Vermutung von MARTIN (1972b) bestätigt werden, daß sich Mausmakis je nach Verfügbarkeit auf verschiedene Nahrungsressourcen spezialisieren und nicht, wie von ATSALIS (1999) vermutet, Früchte generell den Hauptbestandteil der Nahrung ausmachen. Während meiner Verhaltensbeobachtungen konnten die Männchen in der Trockenzeit erstmals auch bei der Aufnahme von Insektensekret beobachtet werden. Bislang konnte nur bei Weibchen die Aufnahme des Insektensekretes festgestellt werden (SARIKAYA 1999, PETERS 1999), dessen Verteilung im Wald auch die Aktionsraummuster von Weibchen beeinflussen soll (CORBIN & SCHMID 1995). Es kann daher die Vermutung widerlegt werden, daß es sich bei dem Insektensekret um eine geschlechtsspezifische Nahrungsressource handeln soll (PETERS 1999). Nur drei Gattungen der in Ampijoroa als Nahrungsquellen für M. murinus identifizierten Bäume (Grewia sp., Noronhia sp., Canthium sp.) konnten bei Beobachtungen an Lemuren im Kirindy ebenfalls als Nahrungsquellen in der Regenzeit bestimmt werden, wobei allerdings Informationen zu Mausmakis in jenem Gebiet fehlen (GANZHORN & KAPPELER 1996). Nur MARTIN (1973) konnte ebenfalls Canthium sp. als Nahrungsbaum von M. murinus identifizieren. Die anderen in Ampijoroa als Nahrungsbäume identifizierten sechs Gattungen (Calantica sp., Alleanthus sp. Legumineum sp., Garessia sp., Maerna sp., Mystroxylon sp.) konnten mit dieser Studie erstmals als Nahrungsressourcen für Lemuren bestimmt werden. Wie M. murinus in Ampijoroa, verzehrt Cheirogaleus medius im Kirindy ebenfalls die Früchte von Grewia sp.. Während in Ampijoroa die Früchte von Noronhia sp. M. murinus als Nahrung dienen, verzehrt im Kirindy Lepilemur ruficaudatus hiervon die Blätter. Canthium sp., dessen Blütennektar in meiner Studie mehr als 95 % der beobachteten Nahrung im Januar ausmacht, ist auch ein Nahrungsbaum für Lepilemur ruficaudatus. Im Gegensatz zu M. murinus verzehrt L. ruficaudatus die Blüten, Früchte und Blätter (GANZHORN & KAPPELER 1996). Die Koexistenz verschiedener Lemurenarten im gleichen Gebiet kann begünstigt werden durch die Besetzung unterschiedlicher Nahrungsnischen (GANZHORN 1988). Dieses kann geschehen durch Erschließung gänzlich anderer Nahrungsquellen wie z.B. Baumarten, die für andere Lemuren keine Rolle spielen. Dieses könnte für M. murinus der Fall sein bei den bislang für andere Lemuren unbekannten Gattungen der Nahrungsbäume. Bei gleichen 93 Nahrungsbäumen kann eine Nutzung der unterschiedlichen Nahrungsbestandteile wie in diesem Falle z.B. Früchte oder Blätter hilfreich sein. Für eine detaillierte Betrachtung sind jedoch genauere Daten zu aufgenommenen Nahrungsbestandteilen und –menge für die einzelnen Lemurenarten unerläßlich. Qualitative Analysen der einzelnen Nahrungsquellen könnten Aufschluß Verhaltensbeobachtungen über zu den jeweiligen unterschiedlichen Energiegehalt Jahreszeiten geben. unter Weitere besonderer Berücksichtigung der Nahrungsökologie sowie damit einhergehende Analysen von Kotproben sollten durchgeführt werden, um saisonale Veränderungen im Kontext der Nahrungsökologie und ihre Bedeutung detaillierter zu erfassen. 5.2.4 Mausmakis und ihre Bedeutung als Blütenbestäuber Aufgrund meiner Fokusbeobachtungen konnte erstmals festgestellt werden, daß M. murinus nicht die Blüten oder andere Teile von Canthium sp. verzehrt, sondern nur den Nektar aufleckt, wobei sich der Pollen im Fell der Schnauzenregion ansammelt. M. murinus könnte deshalb eine wichtige Rolle bei der Pflanzenbestäubung und damit für die Regeneration von Waldgebieten haben. Eine Bedeutung der meisten Vogelarten, Fledermäuse und Nager, die in anderen Tropengemeinschaften als Pflanzenbestäuber fungieren oder Pflanzensamen verbreiten, ist für den Aufbau und die Erhaltung des Waldes bereits nachgewiesen. Diese Tierarten sind in Madagaskar jedoch nur spärlich vertreten (RICHARD & DEWAR 1991, WRIGHT 1997). Daher könnten Lemuren eine ungewöhnlich wichtige Rolle in der Pflanzenbestäubung spielen, welches praktische Bedeutung für den Naturschutz hat (RICHARD & DEWAR 1991). Da es schwierig ist zu beweisen, daß ein Tier als Blütenbestäuber einer Pflanze fungiert, kann der Nachweis vor allem bei tropischen Arten gewöhnlich nur indirekt gebracht werden. Während einige Lemurenspezies wie Eulemur rubiventer, Varecia variegata oder Cheirogaleus major als Pflanzenbestäuber im Regenwald Madagaskar gefunden wurden (OVERDORFF 1992, NILSSON et al. 1993, KRESS et al. 1994) sind vergleichbare Hinweise für den Trockenwald der Westküste rar (GANZHORN & KAPPELER 1996). Für Varecia variegata variegata als Bestäuber von Ravenala madagascariensis ist z.B. Nektar die Hauptnahrungsquelle, wenn er der Jahreszeit entsprechend vorhanden ist. 22 % der 94 Freßzeit wird im Jahresdurchschnitt für die Nektaraufnahme verwendet (KRESS et al. 1994). Weiter konnte nicht beobachtet werden, daß V. variegata die Blüten von Ravenala madagascariensis selbst verzehrt oder zerstört. Eine große Anzahl von Pollen aber sammelt sich nach den Blütenbesuchen im Fell der Tiere an. Neben morphologischen Pflanzencharakteristika und kalorimetrischen Nektaranalysen werden von KRESS et al. (1994) bezüglich der Pflanzenbestäubung durch V. variegata vier Argumente angeführt: Konsistenter (und vermutlich einziger) Besucher der Blüten, sichtbarer Transport des Pollens im Fell zwischen verschiedenen Blüten, Unversehrtheit der Blüten während der Nektaraufnahme und Hauptnahrungsquelle zu bestimmten Zeiten des Jahres. Alle vier genannten Punkte treffen auch für M. murinus und Canthium sp. zu, so daß für M. murinus die Funktion als Blütenbestäuber von Canthium sp. wahrscheinlich ist. Es sollten jedoch weiterführende Studien, die Untersuchungen über morphologische Pflanzencharakteristika sowie kalorimetrischen Nektaranalysen beinhalten, durchgeführt werden, um diese Vermutung zu bestätigen. 5.2.5 Aufenthaltshöhen In meiner Untersuchung konnte ich feststellen, daß in den verschiedenen Monaten unterschiedliche Aufenthaltshöhen vermehrt genutzt wurden. Während die Tiere in der Trockenzeit auch am Boden und häufig in geringen Höhen bis 2 m vorzufinden waren, wurden mit dem Beginn der Regenzeit die mittleren (2 – 5 m) und am Ende die höheren Baumregionen ab 5 m bevorzugt. Die ermittelten monatlichen Unterschiede in den Aufenthaltshöhen der Sendertiere interpretiere ich als direkt im Zusammenhang mit dem Freßverhalten stehend. Das auf Zweige und zu Boden tropfende Insektensekret von F. coccinea wurde während der Trockenzeit aufgeleckt, wodurch sich die Tiere auf den Boden oder die bodennahen Bereiche begaben und sich so die niedrigeren Aufenthaltshöhen der Tiere während der anfänglichen Fokusphasen erklären lassen. Auch das Baumexsudat wurde vor allem im unteren, dickeren Stammbereich der Bäume zwischen ca. 1 bis 3 m aufgenommen. Gegen Ende der Regenzeit befanden sich die meisten der aufgenommenen Früchte im Kronenbereich der Bäume ab 5 m, wodurch sich die Tiere den Großteil der Zeit in diesen höheren Baumregionen aufhielten. Die von 95 MARTIN (1972b) angenommene bevorzugte Aufenthaltshöhe von M. murinus zwischen 2 – 4 m, kann daher nicht generell angenommen werden, sondern wäre demnach vielmehr abhängig vom Nahrungsangebot. 5.3 Reproduktionsbiologie der Männchen Je ausgeprägter saisonale Veränderungen sind, um so stärker muß auch das Verhalten und die Reproduktion hierauf abgestimmt sein. Je nach Art, Population und Individuum können sich in Abhängigkeit vom Habitat unterschiedliche Strategien zur Erhöhung des Reproduktionserfolgs ergeben. 5.3.1 Paarungszeit Es kann mit dieser Studie erstmals belegt werden, daß im Freiland für M. murinus zwei zeitlich klar voneinander getrennte Paarungszeiten mit damit korrelierenden Geburtenzeiten vorkommen können. Die Eingrenzung der Paarungszeit erfolgt aufgrund der Analysen der Hodenvolumina, der Aktionsräume und der Verhaltensbeobachtungen an den Männchen als auch der vorhandenen Daten zum Auftreten östrischer Weibchen im Untersuchungsgebiet (SCHMELTING et al. 2000). Die Zunahme der Hodenvolumina etwa einen Monat vor dem Auftreten erster östrischer und proöstrischer Weibchen im September (SCHMELTING et al. 2000), die Vergrößerung und die zunehmenden Überlappungsgrade Nachtwanderstrecken der Männchen und der Aktionsräume der Männchen, längere das Auftreten im Paarungskontext stehender sozialer Interaktionen wie z.B. Werberufe und Kopulationen markierten den Beginn der Paarungszeit mit etwa Mitte September und bestätigten frühere Ergebnisse aus dem gleichen Untersuchungsgebiet für diesen Zeitraum der (ersten) Paarungszeit (RADESPIEL 1998, PETERS 1999, SARIKAYA 1999). Eine Kopulation eines Sendermännchens wurde Ende September beobachtet, weitere Kopulationen erst wieder Ende November und Anfang Januar. Die Verkleinerung der Aktionsräume und die geringeren Überlappungsgrade der Männchen im Oktober korrespondierten mit der Verringerung der Hodenvolumina. Während im September und November verstärkt Sozialaktivitäten beobachtet werden konnten, wurde im Oktober eine Abnahme der sozialen Interaktionen festgestellt. Ich interpretiere diese Zeit als 96 Ruhephase innerhalb der Reproduktionssaison. Auch bei anderen Tierarten wurde die Dynamik der Aktionsraumgröße als ein Ausdruck möglicher Paarungsaktivität gesehen (SCHWAGMEYER 1994, FISHER & LARA 1999). Eine zweite Vergrößerung der Aktionsräume mit vermehrten Überlappungen im November ging einher mit einem zweiten Anstieg der Hodenvolumina und der Zunahme sozialer Interaktionen. Ende November konnte eine Kopulation eines Sendermännchens mit einem Weibchen festgestellt werden, welches etwa eine Woche zuvor einen Wurf Jungtiere geboren hatte. Hierdurch kann auf den Beginn einer zweiten Paarungszeit gefolgert werden. Diese dauerte bis Anfang Januar an, wo letzte Kopulationen beobachtet werden konnten. In der darauffolgenden Triangulationsphase im Januar sind die Aktionsräume bereits wieder signifikant kleiner. Jedes der in einer Parallelstudie beobachteten elf Fokusweibchen brachte zwischen Ende November und Anfang Dezember einen Wurf Jungtiere zur Welt. Neun dieser Fokusweibchen hatten einen zweiten Wurf zwischen Mitte Februar und Anfang März (SCHMELTING et al. 2000). Als nachteilig für die Interpretation der durchgeführten Untersuchung kann die sukzessive Datenaufnahme der verschiedenen angewandten Methoden gesehen werden. Nach theoretischer Überlegung wäre eine gleichzeitige Anwendung der Fang-Wiederfang-Aktionen (zur kontinuierlichen Erfassung der männlichen und weiblichen Reproduktionsstadien) und permanenter Fokusbeobachtungen (in denen zur Erfassung aller sozialer Interaktionen alle Tiere gleichzeitig beobachtet werden sollten) optimal. Praktisch ist dieses jedoch nicht durchführbar, da sich bereits Fokusbeobachtungen und Fangaktionen ausschließen und nur nacheinander durchgeführt werden können. Die gegenseitig ganzheitliche Betrachtung der verschiedenen Daten erlaubt dennoch eine genauere Interpretation: Innerhalb einer Fortpflanzungsperiode durchläuft M. murinus in Ampijoroa zwei zeitlich klar voneinander getrennte Paarungszeiten. Die erste Paarungszeit beginnt im September und endet etwa Mitte Oktober, die zweite beginnt etwa Mitte November und endet Anfang Januar. Die bereits in früheren Studien beobachteten Kopulationen im November könnten damit den Beginn der zweiten Paarungszeit in jener Fortpflanzungsperiode markiert haben (PETERS 1999, SARIKAYA 1999). MARTIN (1972a) ist in seinen Berechnungen davon ausgegangen, daß eine zweite Paarungszeit erst nach Ende der ersten Laktation einsetzen könne, um dann 97 bei einer von November bis April andauernden Regenzeit genügend Ressourcen für die erfolgreiche Aufzucht des zweiten Wurfes zu haben. In Ampijoroa ist die eigentliche Regenzeit auf die Monate Dezember bis März beschränkt. Durch einen unmittelbar nach der Geburt einsetzenden post partum Östrus und die dann wiederum sexuell aktiven Männchen ergibt sich für M. murinus in Ampijoroa die Möglichkeit, zwei Würfe innerhalb der nahrungsreichen Regenzeit erfolgreich groß zu ziehen. Dieses steht im Kontrast zum Kirindy (West-Madagaskar) mit nur einer ca. vierwöchigen Paarungszeit pro Regenzeit (EBERLE & KAPPELER 1999). Ursache dieser Unterschiede könnte die dort später einsetzende Paarungszeit und der in der Trockenzeit vorhandene Torpor der Tiere darstellen. Bei einer anschließenden zweiten Paarungszeit könnte die energiezehrende Endphase der Laktation mit dem Einsetzen der Trockenzeit zusammenfallen und Jungtiere als auch laktierende Weibchen nicht genügend Zeit haben, die benötigten Energiereserven für die Torporphase aufzubauen. Die im Nordwesten und Westen Madagaskars vorherrschenden unterschiedlichen klimatischen Bedingungen und Habitate scheinen daher unterschiedliche Lebenslaufstrategien zu begünstigen. Eine Freilandstudie an Galagos (Galago moholi, PULLEN et al. 2000), die mit einer vier- bis fünfmonatigen Regenzeit ähnlichen saisonalen Schwankungen wie M. murinus in Ampijoroa unterworfen sind, ergab, daß auch bei Galagos zwei abgegrenzte Paarungszeiten vorkommen können, wenngleich ein post partum Östrus im Freiland eher seltener zu sein scheint. Hierbei muß berücksichtigt werden, daß sowohl die Tragzeit mit durchschnittlich 123 Tagen als auch die Säugezeit mehr als doppelt so lang ist als bei M. murinus (VAN HORN & EATON 1979, PERRET 1982). Die aus der ersten Paarungszeit hervorgehenden Jungtiere von G. moholi werden zu Beginn der nahrungsreichen Regenzeit entwöhnt. Aufgrund der längeren Trag- und Säugezeiten findet die Endphase der Laktation bzw. die Entwöhnung der Jungtiere der zweiten Paarungszeit aber erst in der unvorteilhaften, weil nahrungsarmen, Trockenzeit statt. Diese Befunde stehen im Einklang mit der klassischen Hypothese zum Zeitpunkt einer saisonalen Reproduktion, die Paarungen während der Nahrungsknappheit begünstigt, damit die energiezehrende Endphase der Laktation bzw. die Entwöhnung der Jungtiere mit dem Nahrungsklimax zusammenfällt (VAN SCHAIK & VAN NOORDWIJK 1985, LINDBURG 1987). In Ampijoroa hingegen scheint eine zweite Paarungszeit von M. murinus eher die 98 Regel zu sein. Dieses wird begünstigt durch die sehr kurzen Trag- und Säugezeiten, so daß die Endphase der zweiten Laktation bereits gegen Ende der Regenzeit eintritt, wenn die dann reifen Früchte noch einen Großteil der Nahrung bestimmen, wie in meiner Untersuchung für die Männchen nachgewiesen wurde. Die Populationen von M. murinus im Nordwesten Madagaskars könnten daher ein bisher unbekanntes Beispiel sein, wie die zwei Hypothesen von VAN SCHAIK & VAN NOORDWIJK (1985) zum optimalen Zeitpunkt der Reproduktion (Paarungen während der Nahrungsknappheit bzw. Paarungen während des Nahrungsklimax) für eine Primatenart bestätigt werden können. 5.3.2 Physische Kondition und Reproduktionsstatus Die Körpergewichte der Männchen korrelierten positiv mit den Hodenvolumina in den Monaten Juni bis November. Von Juli bis August konnte ein Anstieg auf die Maximalwerte während der Trockenzeit in beiden Parametern verzeichnet werden mit einem anschließenden gemeinsamen Abfall im September und Oktober. Die signifikante Zunahme im November konnte nur für die Hodenvolumina festgestellt werden. Bei den Männchen nahm das Körpergewicht gegen Ende der Trockenzeit ab. Im September und Ende November zu Beginn der jeweiligen Paarungszeit investierten die Männchen die wenigste Zeit in die Nahrungsaufnahme. In diesen Zeiten wurden dagegen die größten Aktionsräume und die längsten zurückgelegten Wegstrecken gemessen. Erst mit dem Einsetzen der Regenzeit konnte eine Zunahme des Körpergewichtes festgestellt werden. Die vor Beginn der Paarungszeit einsetzenden Sexualfunktionen der Männchen scheinen sich auf die Körpergewichte auszuwirken. Dieses könnte auf das erstmals von DU MOND & HUTCHINSON (1967) bei Totenkopfaffen (Saimiri sciureaus) beschriebene fatted male phenomenon bei einsetzender saisonaler Spermiogenese zurückzuführen sein. Hierbei ändert sich der Habitus des Männchens zu Beginn der Reproduktionsphase, welcher bedingt ist durch Gewichtszunahme und ein dichteres Fell besonders im Bereich des Oberkörpers. Bei M. murinus konnten jedoch keine Fellveränderungen oder ähnliches festgestellt werden, sondern allein eine Zunahme der Hodenvolumina. 99 Wenn nicht mehr Energie als nötig für andere Organsysteme aufgewendet wird, könnte die Effizienz der aufgrund von saisonalen Veränderungen in der Photoperiode einsetzenden Spermatogenese (PERRET & AUJARD 2000) dann durch eine veränderte Nahrung weiter gesteigert werden (OLDHAM et al. 1978, BRONSON & HEIDEMAN 1994). Es scheint daher, daß männliche M. murinus die gesamte Energie in die unmittelbar der Reproduktion dienenden Organe investieren und nicht in sekundäre Geschlechtsmerkmale. Dieses steht im Einklang mit der Hypothese, daß der männliche Reproduktionserfolg der Lemuren nur geringfügig durch physische, präkopulatorische Auseinandersetzungen beeinflußt wird (KAPPELER 1993). Die Vermutung, daß eine Zunahme des Körpergewichtes kurz vor der Paarungszeit den Paarungserfolg von männlichen M. murinus erhöht (SCHMID & KAPPELER 1998), wären aufgrund dieser Befunde vor allem auf die postkopulativen Mechanismen der Spermienkonkurrenz zurückzuführen (PARKER 1970). Das Körpergewicht von männlichen M. murinus zur bzw. vor der Paarungszeit scheint daher auch ein Ausdruck des reproduktiven Potentials zu sein. Die Ergebnisse und Überlegungen sind Argumente gegen die Vermutung, daß das Körpergewicht der Männchen ausschließlich als Zeichen guter physischer Kondition entscheidend ist für die zurückgelegte Strecke und die Größe der Aktionsräume. Neben der gesteigerten Aktivität bei gleichzeitiger Nahrungsknappheit könnte für den Gewichtsverlust der Männchen auch die nach dem Einsetzen der Paarungszeit signifikante Abnahme des Hodengewichtes ursächlich sein, welche ihrerseits wiederum auf eine Verminderung bzw. ein Sistieren der Spermatogenese und/oder gesteigerte Kopulationstätigkeit zurückgeführt werden könnte. Die mit dem Einsetzen der Regenzeit zunehmenden Körpergewichte könnten durch das dann reichhaltigere Nahrungsangebot und geänderten Nahrungspräferenzen der Tiere bedingt sein. Auch bei einer Studie an monogamen Cheirogalus medius im gleichen Untersuchungsgebiet konnte bei Männchen ein Gewichtsverlust vor allem gegen Ende der Trockenzeit im September festgestellt werden. Dieses wird zurückgeführt auf die gesteigerte Aktivität der Männchen in der Vorpaarungszeit durch Verteidigung des Zugangs zum Paarungspartner, während zur gleichen Zeit die verfügbare Nahrung rar ist (MÜLLER 1999). 100 Die Bestimmung der Hodenvolumina von Primaten in vivo kann Meßungenauigkeiten vor allem zwischen einzelnen Untersuchern unterliegen (HARCOURT et al. 1995). Absolute Werte von in vivo Bestimmungen aus unterschiedlichen Studien können daher nicht zwangsläufig miteinander verglichen werden, sondern eher die relativen Entwicklungen. Dennoch entsprechen die Ergebnisse der in dieser Studie vorgenommenen in vivo Bestimmung der Hodenvolumina an männlichen M. murinus mit einem Mittelwert von 1.07 ccm während der Trockenzeit im September denen bereits 1935 von SPÜHLER in Sektionen post mortem ermittelten Werten: „eine volumetrische Berechnung ergab für den Hoden des Fettkleidtieres 0.14 ccm Inhalt, für jenen des in Spermiogenese befindlichen Trockenzeitmännchens aber 1.16 ccm, d.h. etwa das 8fache Volumen (SPÜHLER 1935)“. Neben sich in voller Spermiogenese befindlichen Abschnitten konnte SPÜHLER auch bereits Abschnitte beginnender Involution feststellen. Aufgrund dieser Befunde gehe ich davon aus, daß der von SPÜHLER (1935) histologisch ermittelte Bezug von Hodenvolumen und Spermiogenese auch für die von mir untersuchten Mausmakis zutrifft. In Ampijoroa konnte in dieser Studie an der untersuchten Population nach den maximalen Hodenvolumina im August ein zweiter Anstieg der Hodenvolumina im November gemessen werden, nachdem es zuvor zu einer Regression gekommen war. Interessanterweise konnte SCHWAB (2000) aber auch bei männlichen M. murinus im Kirindy eine erneute Zunahme im zweiten Monat nach den ermittelten Höchstvolumina der Hoden feststellen, nachdem die Hodenvolumina im vorangegangenen Monat zunächst reduziert waren. Allerdings soll es in West-Madagaskar nur eine Paarungszeit pro Fortpflanzungsperiode geben (EBERLE & KAPPELER 1999). Weiterführende Untersuchungen in jenem Gebiet, die Fokusbeobachtungen an individuell unterscheidbaren Tieren über die gesamte Regenzeit mit einschließen, sind nötig für eine genauere vergleichende Betrachtung Reproduktionsbiologie der beiden Populationen in den unterschiedlichen Habitaten. der 101 5.3.3 Mögliche Reproduktionsstrategien Die Ergebnisse meiner Arbeit deuten darauf hin, daß männliche M. murinus in einem promisken Paarungssystem über scramble competition (WELLS 1977) und Spermienkonkurrenz um den Reproduktionserfolg zu konkurrieren scheinen. Damit können Vermutungen neuerer Freilandstudien bestätigt werden (SCHMID & KAPPELER 1998, FIETZ 1999, RADESPIEL 2000). Da jedoch in dieser Arbeit auch direkte agonistische Auseinandersetzungen zwischen Männchen um östrische Weibchen festgestellt werden konnten, hat vermutlich neben scramble competition und Spermienkonkurrenz auch contest competition eine Bedeutung für den Zugang zu rezeptiven Weibchen und den Reproduktionserfolg (PETERS 1999). Bei dieser einzigen beobachteten direkten Auseinandersetzung mehrerer Männchen um ein östrisches Weibchen, verpaarte sich mit dem Weibchen ein Männchen, welches sich nicht durch ein überdurchschnittlich hohes Körpergewicht auszeichnete. Nur aus dieser einen Beobachtung läßt sich jedoch nicht auf einen Zusammenhang von Körpergewicht und Paarungserfolg bei contest competition schließen, wie er bei anderen Tierarten mit scramble competition polygyny beobachtet wurde (FISCHER & LARA 1999, PULLEN et al. 2000) oder von einigen Autoren für Mausmakis vermutet wird (SCHMID 1999, PETERS 1999). Eine größere Anzahl von Beobachtungen als auch molekulargenetische Analysen zur Klärung von Vaterschaften sind notwendig zur Beantwortung dieses Aspektes. Für die innerartliche Kommunikation können Rufe von großer Bedeutung sein (MARLER 1968). Während meiner Untersuchungen im Freiland konnten die Lautäußerungen Triller, Kurzpfiffe, Tsäks im Paarungskontext festgestellt werden: Triller und Kurzpfiffe bei Kontaktaufnahme zu Weibchen, Tsäks bei Auseinandersetzungen mit anderen Männchen und nicht paarungsbereiten Weibchen. Dieses entspricht bisherigen Ergebnissen aus dem Labor (ZIMMERMANN 1995, vergl. BÜSCHING et al. 1998). Nach der Paarungszeit nimmt die Häufigkeit der Lautaktivität signifikant ab. Die in meiner Studie festgestellten Kontaktaufnahmen an Schlafplätzen mit wechselseitigen Rufen zwischen Männchen sind bislang noch nicht bei Männchen, wohl aber bei Weibchen (PAGES-FEUILLADE 1988) beobachtet worden. 102 Erstmals konnte somit beobachtet werden, daß Triller und Kurzpfiffe nicht nur im Paarungskontext bei Sexualpartnern geäußert werden, sondern auch eine Bedeutung für soziale Männchenbindungen zu haben scheinen. Es kann mit dieser Studie daher die Vermutung bekräftigt werden, daß M. murinus ein weitaus komplizierteres Sozialgefüge (PAGES-FEUILLADE 1988) besitzt als bisher angenommen, mit sich individuell kennenden Sozialpartnern (RADESPIEL 2000) auch unter den Männchen. Im meiner Freilandstudie kam es zur Paarungszeit bei allen gefangenen Männchen zu einer starken Vergrößerung der Hoden. Das am häufigsten beobachtete Urinwaschen konnte in allen Fokusphasen beobachtet werden, wenngleich es im Mittel in der Paarungszeit vermehrt erfaßt wurde. Statistische Unterschiede zwischen einzelnen Männchen konnten nicht ermittelt werden. Die Aktionsräume der Männchen wiesen hohe Überlappungsgrade auf, in jedem Aktionsraum konnten während der Paarungszeiten Weibchen gefangen werden. Das gehäufte Auftreten des Urinwaschens während der Paarungszeit könnte ein Signal sowohl an das andere Geschlecht über die Qualität als potentieller Paarungspartner als auch an Konkurrenten sein (GOSLING 1982, RICH & HURST 1998, HURST & RICH 1999). Hierbei sind Unterschiede zwischen einzelnen Individuen in der Häufigkeit nicht unbedingt ausschlaggebend, da sowohl die Zusammensetzung des Urins als auch der Zeitpunkt des Markierens Auskunft über die Qualität des Markers geben können (HUMPHRIES et al. 1999). Dennoch zeigten Untersuchungen an M. murinus in Gefangenschaft, daß die Häufigkeit des Markierens des dominanten Tieres einer Gruppe zu Beginn der Paarungszeit stetig ansteigt (GLATSTON 1983, LEBEC 1984). Aufgrund der kryptischen Verhaltensweise und der schwierigen Beobachtungsbedingungen kann davon ausgegangen werden, daß nur ein sehr geringer Anteil vom Beobachter überhaupt erkannt werden konnte. Mögliche individuelle Unterschiede könnten deshalb nicht erfaßt worden sein. Da das Urinwaschen zu jeder Fokusphase und somit auch außerhalb der Paarungszeit festgestellt worden ist, könnte dieses Verhalten aber auch zur Markierung von besonderen Ressourcen wie Schlaf- und Freßplätzen dienen. So konnte das Urinwaschen von PETERS (1999) gehäuft in der unmittelbaren Umgebung der Schlafplätze beobachtet werden. Eine Inhibition der Gonadenfunktion von subdominanten durch dominante Männchen durch Pheromone im Urin, wie sie von SCHILLING & PERRET (1987) im Labor festgestellt 103 wurde, läßt sich damit in meiner Untersuchung nicht belegen, da aufgrund der Entwicklung der Hodenvolumina alle Männchen sexuell aktiv zu sein scheinen. Auch LINDEMANN (1996) konnte im Labor keine sexuelle Inhibition feststellen, wenngleich es unter Laborbedingungen einen Zusammenhang zwischen dem Körpergewicht und dem sozialen Status eines Männchens zu geben scheint (PERRET 1992). In meiner Untersuchung im Freiland konnte ich keine Monopolisierung mit ausschließlichem Zugang zu Weibchen während der Paarungszeit feststellen. Die Hypothese eines klaren Dominanzverhältnisses unter Männchen mit ausschließlichem Zugang zu Weibchen nur für Tiere mit überdurchschnittlich großen Hodenvolumina, überdurchschnittlich hohen Körpergewichten und großen Aktionsräumen, während andere Männchen sexuell inhibiert werden, kann aufgrund der Befundlage daher nicht gestützt werden. 5.3.4 Reproduktionsstrategien von M. murinus: Ein neues Modell Zugang zu Weibchen und Paarungserfolg wird oft mit Körpergröße und –gewicht in Verbindung gebracht, selten wird jedoch das Alter und damit die Erfahrung eines Individuums in Betracht gezogen (POSTON 1997). Hier soll die letzte der anfangs aufgestellten Hypothesen von alters- und erfahrungsabhängigen Reproduktionsstrategien ohne reproduktive Unterdrückung bei männlichen M. murinus im Freiland anhand der Befunde erörtert werden. Im September korrelierte die Aktionsraumgröße der Sendermännchen mit deren Körpergewicht; aber auch hier hatte ein residentes, jedoch leichtes Männchen (Tier 55-97) einen ebenfalls über dem Mittel liegenden Aktionsraum. Zu Beginn der zweiten Paarungszeit im November hatte es einen vergleichsweise großen Aktionsraum. Dieses Männchen hatte im Gegensatz dazu im Vorjahr, in dem es das erste Mal im Untersuchungsgebiet gefangen worden war, einen immer unter dem Mittelwert liegenden Aktionsraum (PETERS 1999). Zu beiden Paarungszeiten hatten jeweils vier von fünf residenten Männchen einen größeren Aktionsraum als die anderen Sendertiere, während von den Neufängen nur einmal ein Männchen im September einen über dem Mittel liegenden Aktionsraum aufwies. Das am längsten bekannte Männchen 75-95 hatte in der zweiten Paarungszeit den weitaus größten Aktionsraum und in der Zeit zwischen September und Januar die meisten soziopositiven 104 Begegnungen, die zu einem Großteil mit unbekannten Weibchen stattfanden, wobei es vergleichsweise kurze Nachtwanderstrecken zurücklegte. Aufbauend auf den Befunden meiner Untersuchung und unter kritischer Betrachtung der in der Einleitung aufgestellten Reproduktionstaktiken soll ein Modell entwickelt werden, das über weitere Verhaltensanalysen und genetische Untersuchungen überprüft werden kann und in Abb. 27 vereinfacht dargestellt wird. Es wird postuliert, daß bei M. murinus alters- und erfahrungsabhängige Fortpflanzungsstrategien auftreten. Konkurrenz um Ressourcen, Paarungskonkurrenz und Inzuchtvermeidung werden als mögliche ultimate Ursachen für Abwanderungen und Dispersion angesehen (GREENWOOD 1980, MOORE & ALI 1984, WASER 1985). Erste molekulargenetische Ergebnisse deuten darauf hin (RADESPIEL, SCHMELTING unveröffentlicht), daß die Weibchen philopatrisch zu sein scheinen und die Männchen abwandern. Zugewanderte (junge) Männchen müßten sich daher zunächst in dem für sie unbekannten Gebiet etablieren und zurechtfinden. Ihnen fehlt anfangs die Erfahrung und Kenntnis zahlreicher verstreut liegender Nahrungsquellen und möglicher Paarungspartner und sie hätten demnach kleinere Aktionsräume als residente Männchen. Alle Männchen haben aber potentiell Zugang zu Weibchen. Rezeptive Weibchen sind räumlich weit verteilt und Östren nicht vorhersehbar, wodurch die aktive Suche ohne aggressive Auseinandersetzung von Männchen nach Paarungspartnern von entscheidender Bedeutung ist (TRIVERS 1972). Es kommt nur zu kurzzeitigen, nicht exklusiven Begegnungen von einzelnen Individuen, die sonst in der Regel verstreut in einem Gebiet anzutreffen sind (DIXSON 1997). Da die Weibchen in diesem promisk-dispersen Paarungssystem nur schwierig monopolisiert werden können, könnten sich diese neuen Männchen trotzdem mit (den wenigen) Weibchen paaren, die sich in ihrem kleineren Aktionsraum befinden. Für ältere, erfahrenere Männchen wäre das Gebiet besser bekannt und sie könnten ein größeres Gebiet nach rezeptiven Weibchen durchstreifen bzw. gezielt weiter entfernte Weibchen aufsuchen. Je nach individueller Erfahrung müßten dadurch längere (bei ungerichteter Suche) oder nur kurze (bei gezieltem Aufsuchen) Wegstrecken zurückgelegt werden. Durch größere Aktionsräume können mehr Weibchen erreicht werden (SCHWAGMEYER 1994, FISHER & LARA 1999). Wenn sich jedoch Männchen mit großen Aktionsräumen innerhalb der relativ kurzen Paarungszeit mit (fast) allen in ihrem Aktionraum 105 vorkommenden Weibchen paaren, kann dies den Nachteil mit sich bringen, daß ein individuelles Weibchen nicht konzipieren kann aufgrund verminderter Spermienqualität oder daß das Sperma dieses Männchens nicht erfolgreich konkurrieren kann mit dem Sperma anderer Männchen, die sich vorher oder nachher mit dem gleichen Weibchen paaren (vergl. AUSTIN & DEWSBURY 1986). Somit könnte es bei zahlreichen Paarungen auch mit weiter entfernten Weibchen zu einer Art „Verdünnungeffekt“ des Reproduktionserfolges älterer Männchen kommen, während der Reproduktionserfolg neu zugewanderter bzw. junger Männchen mit kleineren Aktionsräumen und einer kleineren Anzahl durchgeführter Kopulationen vermehrt im Nahbereich des für diese Tiere neuen Gebietes zu erwarten wäre. Hierdurch wäre der Reproduktionserfolg von Inzestpaarungen stark verringert oder ganz verhindert und es könnte immer wieder zu einer Erneuerung und Durchmischung des Genpools kommen. Aktionsraum residentes Tier (R) Aktionsraum Zuwanderer (Z) Weibchen trächtig (R = Vater) Weibchen trächtig (Z = Vater) Weitere Paarungspartnerinnen im Gebiet Abb. 27. Modell altersabhängiger männlicher Reproduktionsstrategien von M. murinus während der Paarungszeit. 106 Ein entscheidender Unterschied zu der von MARTIN (1972b) aufgestellten Hypothese der Existenz sogenannter „population nuclei“, mit Weibchen und einem/wenigen zentralen, dominanten Männchen im Zentrum und vielen subdominanten Männchen in der Peripherie liegt vor allem darin, daß es in meinem Modell keinen „Populationskern“ gibt und sich vielmehr alle Männchen in ihren Aktionsräumen überlappen und Zugang zu Weibchen haben können. 5.4 Es Ausblick ist unmöglich, den Verhaltensbeobachtungen Reproduktionserfolg zu erfassen. eines Hierfür Männchens sowie für nur die anhand von Analyse der Fortpflanzungsstrategien innerhalb einer Population sind molekulargenetische Analysen unerläßlich (FLEISCHER 1996). Denn selbst wenn Kopulationen beobachtet werden, können keine Aussagen über den Reproduktionserfolg gemacht werden, sobald mehrere Männchen involviert sind. Es ist extrem schwierig, aufgrund der kryptischen Lebensweise und des Sozial- und Paarungssystems von M. murinus, Kopulationen zu beobachten und unmöglich, in Fallen gefangene Jungtiere exakt dem jeweiligen Muttertier zuzuordnen. Zusammen mit den hier gelieferten Verhaltensdaten sollten deshalb aufbauend auf den Befunden dieser Arbeit Genanalysen durchgeführt werden, um Verwandtschaftsgrade und Vater- und Mutterschaften nachzuweisen und sie mit den Verhaltensstrategien in Beziehung zu setzen. Dieses wird eine detailliertere Analyse der fitneßrelevanten Fortpflanzungs- und Lebenslaufstrategien des Grauen Mausmakis erlauben. 107 6 Zusammenfassung Ziel dieser Studie ist es, erstmals Daten zur saisonalen Aktivität der Lemurenart Microcebus murinus über einen gesamten Jahreszyklus im laubabwerfenden Trockenwald von Ampijoroa, Nordwest-Madagaskar, zu erfassen unter besonderer Berücksichtigung der Reproduktionsstrategien der Männchen. Von Mai 1998 bis April 1999 wurden mit der FangWiederfangmethode 105 (68 Männchen, 37 Weibchen) verschiedene Individuen in einem ca. 30 ha großen Untersuchungsgebiet gefangen. Die errechnete Populationsdichte schwankte zwischen 75 Tieren/km² in der Regenzeit und 148 Tieren/km² in der Trockenzeit. In allen Monaten des Jahres konnten sowohl Weibchen als auch Männchen gefangen werden. In keinem Monat wurde eine signifikante Abweichung von einem ausgewogenen Geschlechterverhältnis (1:1) festgestellt. Saisonaler Torpor konnte weder bei Männchen noch bei Weibchen festgestellt werden. Vor Beginn der Paarungszeit im September nahmen die Hodenvolumina und Körpergewichte aller gefangenen Männchen zu und während der Paarungszeit wieder signifikant ab. Eine erneute Zunahme der Hodenvolumina wurde im November festgestellt. 12 mit Radiotransmittern ausgestattete Männchen wurden in Hinblick auf Schlafplatzwahlen, Nahrungsverhalten, soziale Interaktionen, Nachtwanderstrecken und Aktionsraumnutzung untersucht. Die Männchen wiesen saisonal voneinander abzugrenzende Strategien in der Schlafplatzwahl auf, die bedingt sein könnten durch saisonale Veränderungen im Habitat, Prädatorendruck und/oder Parasitenbefall. 1244 (427 verschiedene) Schlafplätze wurden erfaßt. In der Trockenzeit schliefen die Männchen im Mittel mehr als doppelt so häufig in Höhlen als an offenen und ungeschützten Plätzen. Die Tiere hatten einige bevorzugte Schlafplätze, zu denen sie bis zu 27 Mal zurückkehrten. Am Ende der Trockenzeit konnten zwischen Männchen 33 Mal Schlafgruppenbildungen ohne Weibchenbeteiligung beobachtet werden. Nur residente Männchen schliefen mehr als einmal zusammen. In der Regenzeit waren ca. 90 % der aufgesuchten Schlafplätze offen im Gestrüpp/Blattwerk vorzufinden. An mehr als der Hälfte der Tage suchten die Tiere einen Schlafplatz ein- bis zweimal auf. Mehr als 331 Stunden nächtlicher Fokusbeobachtungen wurden analysiert. Die bevorzugte aufgenommene Nahrung und die Aufenthaltshöhe wechselten monatlich und schienen den saisonalen Veränderungen der Vegetation angepaßt zu sein. In der Trockenzeit konnten als Nahrung vor allem Baumexsudate und 108 Insektensekrete, zu Anfang der Regenzeit Insekten und Früchte, Nektar in der Folgezeit und gegen Ende der Regenzeit Früchte sowie wiederum Baumexsudate beobachtet werden. In der Regenzeit könnten Mausmakis eine wichtige Rolle bei der Blütenbestäubung der Baumart Canthium sp. spielen, an der die Männchen im Januar fast ausschließlich während des Nahrungsaufnahme beobachtet wurden, ohne bei der Nektaraufnahme die Blüten zu zerstören. Es konnte mit dieser Studie erstmals belegt werden, daß bei M. murinus im Freiland zwei zeitlich klar voneinander getrennte Paarungszeiten mit damit korrelierenden Geburtenzeiten innerhalb einer Fortpflanzungsperiode vorkamen. Die erste Paarungszeit begann im September, gefolgt von einer Ruhephase beginnend ab etwa Mitte Oktober. Die zweite Paarungszeit begann Ende November und dauerte bis Anfang Januar. Die meisten sozialen Interaktionen wurden im September und November beobachtet, Kopulationen im September, November und Anfang Januar. Die ermittelten Nachtwanderstrecken waren am längsten im September (Mittelwert: 1028 m) und Ende November (Mittelwert: 869 m) und am kürzesten im März (Mittelwert: 538 m). Die größten Aktionsräume hatten die Männchen im September (Mittelwert: 2.97 ha) und November (Mittelwert: 2.54 ha), die kleinsten im März (Mittelwert: 0.7 ha). Die relativ meisten und größten Aktionsraumüberlappungen wurden im September und November festgestellt. Größere Aktionsräume beinhalteten in der Regel mehr Weibchenfangorte. In der ersten Paarungszeit korrelierten die Aktionsraumgrößen der Männchen mit deren Körpergewichten. Aber die Größe des Aktionsraumes scheint auch von der räumlichen Erfahrung eines Männchens abzuhängen. Zu beiden Paarungszeiten hatten vier von fünf residenten Männchen größere Aktionsräume als vier von fünf (erste Paarungszeit) bzw. drei von drei (zweite Paarungszeit) Männchen, die während der Studie erstmals im Untersuchungsgebiet gefangen worden waren (junge oder nicht-residente Männchen). Die Ergebnisse dieser Studie geben erstmals Hinweise darauf, daß es bei männlichen M. murinus erfahrungsabhängige Fortpflanzungsstrategien geben könnte. 109 7 Summary Barthel Schmelting Seasonal activity and reproduction in male grey mouse lemurs (Microcebus murinus, J.F. Miller 1777) in Northwestern Madagascar. The aim of this study is to examine, for the first time, the seasonal activity of the lemur species Microcebus murinus in a complete annual cycle in the dry deciduous forest of Ampijoroa, Northwestern Madagascar, specifically concerning male reproductive strategies. From May 1998 to April 1999 a total of 105 (68 males, 37 females) different individuals were captured, in a study site of approx. 30 ha, using the mark-recapture method. The calculated population density ranged between 75 animals/km² in the rainy season and 148 animals/km² in the dry season. Both males and females were caught throughout all months of the year. No significant deviation from an even sex ratio (1:1) was observed during any month of the year. No prolonged periods of seasonal torpor occurred neither in males nor in females. Prior to the beginning of the mating season in September, the testes volume and the body weight of all captured males increased significantly and then decreased during the mating season. A second increase of the testes volume was observed in November. 12 radiocollared males were studied with respect to sleeping sites, feeding behaviour, social interactions, nightly path lengths and home ranges. The males were found to follow seasonally specific strategies with regards to sleeping site choices, which could be due to seasonal changes in vegetation, predation pressure and/or parasitic load. 1244 (427 different) sleeping sites were determined. In the dry season, males slept twice as often in holes than in exposed and unsheltered sites. The animals had some preferred sleeping sites, to which they returned up to 27 times. At the end of the dry season male sleeping groups (without any female participation) were observed 33 times. Only resident males slept together more than once. In the rainy season approx. 90 % of the chosen sleeping sites were exposed in the open foliage. In over half of the cases animals slept in the same sleeping site no more than twice. More than 331 h of nocturnal focal observations were analysed. The preferred diet and forest layer use by the animals changed monthly and seemed to be dependent on seasonal changes of the vegetation. During the dry season, the observed diet consisted mainly of tree exudates and insect secretions, at the beginning of the rainy 110 season, the diet changed towards insects and fruits, followed by nectar and at the end of the rainy season towards fruits and tree exudates. It is proposed that mouse lemurs could play an important role in the pollination of Canthium sp. during the rainy season. In January, the observed males fed almost exclusively on this tree species, licking nectar without destroying the flowers. Within this study, it has been proven, for the first time, that in the wild M. murinus had two distinct mating seasons with correlating birth seasons within one breeding season. The first mating season took place in September, followed by an interception starting in mid October. The second started at the end of November and lasted until the beginning of January. Most social interactions were recorded in September and November, copulations were observed in September, November and the beginning of January. The longest nightly path lengths were measured in September (mean: 1028 m) and at the end of November (mean: 869 m) and the shortest in March (mean: 538 m). The males had the largest home ranges in September (mean 2.97 ha) and November (mean 2.54 ha) and the smallest in March (mean 0.7 ha). The largest and relative number of home range overlaps were detected in September and November. In general, larger home ranges included more female capture sites. In the first mating season (but not in the second mating season) the home range size of the males correlated with their body weight. Furthermore, the home range size within each mating season seemed to be related to the spatial experience of a male. In each mating season four out of five resident males had larger home ranges than four out of five (first mating season) resp. three out of three (second mating season) males captured the first time in this field study (young or non resident males). The results of this study indicated for the first time, that male M. murinus might develop experience-dependent reproductive strategies. 111 8 Literaturverzeichnis ALTMANN, J. 1974. Observational study of behavior: sampling methods. Behaviour 49: 227267. ALTMANN, S.A. 1994. Baboons, space, time and energy. Amer Zool 14: 221-248. AMANN, R.P. 1970. Sperm production in rates. In: The Testis. Vol. 1. Development. Anatomy, and Physiology. Hrsg. W.R. Johnson, W.R. Gromes, N.L.Vandemark. New York: Academic Press. S. 433. ANDRIANTSIFERANA, R., Y. RARIJAONA, A.RANDRIANA 1974. Observations sur la reproduction du microcèbe (Microcebus murinus, MILLER 1777) en captivité à Tananarive. Mammalia 38: 234-243. ATSALIS, S. 1999. Diet of the brown mouse lemur (Microcebus rufus) in Ranomafana National Park, Madagascar. Int. J. Primatol. 20(1): 193-229. ATSALIS, S. 2000. Spatial distribution and population composition of the brown mouse lemur (Microcebus rufus) in Ranomafana National Park, Madagascar, and its implications for social organisation. Am. J. Primatol. 51: 61-78. AUSTIN, D. & D.A. DEWSBURY 1986. Reproductive capacity of male laboratory rats. Physiology & Behavior 37: 627-632. BARDIN, C.W., C.Y. CHENG, N.A. MUSTOW, G.L. GUNSALUS 1994. The sertoli cell. In: The physiology of Reprodution (2nd Edn) Hrsg. E. Knobil & J.D. Neill. New York: Raven Press Ltd. S. 1291-1333. BARRE, V., A. LEBEC, J.J. PETTER, R. ALBIGNAC 1988. Etude du Microcèbe par radiotracking dans le forêt de l’Ankarafantsika. In: L’Equilibre des Ecosystèmes Forestiers à Madagascar. Actes d’ un Seminaire International. Hrsg. L. Rakotavao, V. Barre, J. Sayer. Gland: IUCN S. 61 – 71. BEARDER, S.K. 1987. Lorises, Bushbabies, and Tarsiers: diverse societies in solitary foragers. In: Primate Societies. Hrsg. B.B. Smuts, D.L. Cheney, R.M. Seyfarth, R.W. Wrangham, T.T. Struhsaker. Chicago & New York: University of Chicago Press. S. 11-24. 112 BERCOVITCH, F.B. & P. NÜRNBERG 1996. Socioendocrine and morphological correlates of paternity in rhesus macaques (Macaca mulatta). J. Repro. Fert. 107: 59-68. BERCOVITCH, F.B. 1989. Body size, sperm competiton and determinants of reproductive success in male savanna baboons. Evolution 43:1507-1521. BOYD, G.W., D.D. LUNSTRA, L.R. CORAH 1989. Serving capacity of crossbred yearling beef bulls. Single-sire mating behavior and fertility during average heavy maing loads at pasture. J. Anim. Sci. 67(1): 60-71. BROCKMANN, D.K. 1994. Reproduction and mating system of Verreaux’s Sifaka, Propithecus verreauxi, at Beza Mahafaly, Madagascar. Yale University. Ph.D. thesis. BRONSON, F.H. & P.D. HEIDEMAN 1994. Seasonal Regulation of Reproduction in Mammals. In: The Pysiology of Reproduction. Hrsg. E. Knobil & J.D. Neill. New York: Raven Press Ltd. S. 541-573. BÜRGER, H.J. 1992. Epidemiologie. Grundlagen der Parasitenbekämpfung. In: Veterinärmedizinische Parasitologie. Hrsg. J. Eckert, E. Kutzer, M. Rommel, H.J. Bürger, W. Körting. Berlin, Hamburg: Verlag Paul Parey. S. 69-86. BÜSCHING, C.D., M. HEISTERMANN, J.K. HODGES, E. ZIMMERMANN 1998. Multimodal oestrus advertisement in a small nocturnal prosimian, Microcebus murinus. Folia Primatol. 69(suppl 1): 295-308. CARO, T.M. 1994. Cheetahs of the Serengeti Plains: Group living in an asocial species. Chicago: University of Chicago Press. CHENEY, D.L. 1987. Interactions and Relationships between Groups. In: Primate Societies. Hrsg. B.B. Smuts, D.L. Cheney, R.M. Seyfarth, R.W. Wrangham, T.T. Struhsaker. Chicago & New York: Chicago University Press. S. 267 - 281. CLUTTON-BROCK, T.H. 1984. Size, sexual dimorphism and polygyny in primates. In: Size and Scaling in Primate Biology. Hrsg. W.L. Jungers. New York: Plenum Press S. 51 - 60. CLUTTON-BROCK, T.H. 1989. Mammalian mating systems. Proc. R. Soc. Lond. B. 236: 339372. 113 CLUTTON-BROCK, T.H. 1991. The evolution of sex differences and the consequences of polygyny in mammals. In: The development and integration of behaviour. Hrsg. P.Bateson. Cambridge: University Press S. 229 - 253. CLUTTON-BROCK, T.H., F.E. GUINNESS, S.D. ALBON 1982. Red deer: the behaviour and ecology of two sexes. Chicago: University of Chicago Press. COCHRAN, W.W. 1980. Wildlife telemetry. In: Wildlife Management Techniques Manual, 4th edition. The Wildlife Society, Washington. S. 507-520. CORBIN, G.D. & J. SCHMID 1995. Insect secretions determine habitat use patterns by a female lesser mouse lemur (Microcebus murinus). Am. J. Primatol. 37: 317-324. CURTIS, S.K. & R.P. AMANN 1981. Testicular development and establishment of spermatogenesis in holstein bulls. J. Anim. Sci. 53(6): 1645-1657. DARWIN, C. 1871. The decent of man, and selection in relation to sex. London: Murray. DAVIES, N.B. 1991. Mating systems. In: Behavioural Ecology. An Evolutionary Approach. Hrsg. J.R. Krebs & N.B. Davies. Oxford: Blackwell Scientific Publications. S. 263 294. DEUTSCH, C.J., M.P. HALEY, B.J. LE BOEUF 1990. Reproductive effort of male northern elephants seals: estimates from mass loss. Can. J. Zool. 68: 2580-2593. DEWSBURY, D.A. 1982. Dominance rang, copulatory behaviour, and differential reproduction. Quart. Rev. Biol. 57: 135-159. DEWSBURY, D.A. 1988. Copulatory behaviour as courtship communication. Ethology 79: 218-234. DI BITETTI, M.S. & C.H. JANSON 2000. When will the stork arrive? Patterns of birth seasonality in neotropical primates. Am. J. Primatol. 50: 109-130. DI BITETTI, M.S., E.M.L. VIDAL, M.C. BALDOVINO, V. BENESOVSKY 2000. Sleeping site preferences in tufted capuchin monkeys (Cebus apella nigritus) Am. J. Primatol. 50: 257-274. DIXSON, A.F. 1987. Observations on the evolution of the genitalia and copulatory behaviour in male primates. J. Zool. Lond. 213: 423 - 443. 114 DIXSON, A.F. 1997. Evolutionary perspectives on primate mating systems and behavior. Annals New York Acad. Sci. 807: 42-61. DU MOND, F.V. & T.C. HUTCHINSON 1967. Squirrel monkey reproduction: The fatted male phenomenon and seasonal spermatogenesis. Science 158: 1067-1070. DUTRILLAUX, B. 1979. Chromosomal evolution in primates: tentative phylogeny from Microcebus murinus (Prosimian) to man. Hum. Genet. 48: 251 - 314. EBERHARDT, L.L. 1969. Population estimates from recapture frequencies. J. Wildl. Manage. 33: 28-39. EBERLE, M. & P.M. KAPPELER 1999. Mating strategies of gray mouse lemurs (Microcebus murinus). Abstract. Primatologie im nächsten Jahrhundert. 6. Kongress der Gesellschaft für Primatologie. Utrecht: Universiteit Utrecht. S. 21. EHRESMANN, P. 2000. Ökologische Differenzierung von zwei sympatrischen MausmakiArten (Microcebus murinus und M. ravelobensis) im Trockenwald NordwestMadagaskars. Univ. Hannover. Dissertation. EMLEN, S.T. & L.W. ORING 1977. Ecology, sexual selection and the evolution of mating systems. Science 197: 215-223. FIETZ, J. 1995. Paarungs- und Sozialsystem des Grauen Mausmaki (Microcebus murinus, Cheirogaleidae; J.F. Miller 1777) im laubabwerfenden Trockenwald WestMadagaskars. Univ. Tübingen. Diplomarbeit. FIETZ, J. 1998. Body mass in wild Microcebus murinus over the dry season. Folia Primatol. 69(suppl 1): 183-190. FIETZ, J., 1999. Mating system of Microcebus murinus. Am. J. Primatol. 48: 127-133. FISHER, D.O. & M.C. LARA 1999. Effects of body size and home range on access to mates and paternity in male bridled nailtail wallabies. Anim Behav. 58: 121-130. FLEAGLE, J.G. 1988. Primate Adaptation and Evolution. San Diego: Academic Press Inc. 115 FLEISCHER, R.C. 1996. Application of Molecular Methods to the Assessment of Genetic Mating Systems in Vertebrates. In: Molecluar Zoology: Advances, Strategies, and Protocols. Hrsg. J.D. Ferrais, & S.R. Palumbi. New York: Wiley-Liss Inc. S. 133 161. FUENTES, L.B., N. CARAVACA, L.E. PELZER, L.A. SCARDAPANE, R.S. PIEZZI, J.A. GUZMAN 1991. Seasonal variations in the testis and epididymis of vizcacha (Lagastomus maximus maximus). Biol. Reprod. 45: 493-497. GANZHORN, A. 1996. TRACKASC, A. Ganzhorn. GANZHORN, J.U. & P.M. KAPPELER 1996. Lemurs of the Kirindy forest. Primate Report 46: 257-274. GANZHORN, J.U. 1988. Food partitioning among Malagasy primates. Oecologica 75: 436-450. GANZHORN, J.U., B. RAKOTOSAMIMANANA, L. HANNAH, J. HOUGH, L. IYER, S. OLIVIERI, S. RAJAOBELINA, C. RODSTROM, G. TILKIN 1997. Priorities for biodiversity conservation in Madagascar. Primate Report 48-1, June 1997. GANZHORN, J.U., P.C. WRIGHT, J. RATSIMBAZAFY 1999. Primate communities: Madagascar. In: Primate Communities. Hrsg. J.G. Fleagle, C.H. Janson, K.E. Reed. Cambridge: Cambridge University Press. S. 75-89. GEHRT, S.D. & E.K. FRITZELL 1998. Resource distribution, female home range dispersion and male spatial interactions: group structure in a solitary carnivore. Anim. Behav. 55: 1211-1227. GLATSTON, A.R. 1979. Reproduction and behaviour of the lesser mouse lemur (Microcebus murinus, Miller 1777) in captivity. University of London. Ph.D. thesis. GLATSTON, A.R. 1983. Olfactory communication in the lesser mouse lemur (Microcebus murinus). In: Perspectives in Primate Biology. Hrsg. P.K. Seth. New Delhi: Today and Tomorrow’s Printers and Publishers. S. 63-73. GLAW, F. & M. VENCES 1994. Amphibians and Reptiles of Madagascar. Köln: M. Vences & F. Glaw Verlags GbR. 116 GOODMAN, S. M., S. O’CONNOR, O. LANGRAND 1993. A review of predation on Lemurs: Implications for the evolution of social behavior in small, nocturnal primates. In: Lemur social systems and their ecological basis. Hrsg. P.M. Kappeler & J.U. Ganzhorn. NewYork: Plenum Press. S. 51-66. GOSLING, L.M. 1982. A re-assessment of function of scent marking in territories. Z. Tierpsychol. 60: 89-118. GREEN, G.M. & R.W. SUSSMANN 1990. Deforestation history of eastern rain forests of Madagascar from satellite images. Science 248: 212-215. GREENWOOD, P.J. 1980. Mating systems, philopatry and dispersal in birds and mammals. Anim. Behav. 28: 1140-1162. GURSKY, S. 2000. Sociality in the spectral tarsier, Tarsius spectrum. Am. J. Primatol. 51: 89101. HAMILTON, W.J. 1982. Baboon sleeping site preferences and relationships to primate grouping patterns. Am. J. Primatol. 3: 41-53. HARCOURT, A.H. & F.B.M. DE WAAL 1992. Coalitions and Alliances in Humans and other Animals. Oxford: Oxford University Press. HARCOURT, A.H. 1991. Sperm competition and the evolution of nonfertilizing sperm in mammals. Evolution 45: 314-328. HARCOURT, A.H. 1992. Coalitions and alliances: are primates more complex than non primates? In : Comparative Socioecology. Hrsg. V. Standen & R.A. Foley. Oxford: Blackwell Scientific Publications. S. 223-242. HARCOURT, A.H. 1996. Sexual selection and sperm competition in primates: What are male genitalia good for? Evol. Anthropol. 5: 121-129. HARCOURT, A.H., A. PURVIS, L. LILES 1995. Sperm competition: mating system, not breeding season, affects testes size of primates. Functional Ecology 9: 468-476. HARCOURT, A.H., P.H. HARVEY, S.G. LARSON, R.V. SHORT 1981. Testis weight, body weight, and breeding system in primates. Nature 293: 55. 117 HARCOURT, C. & J. THORNBACK 1990. Lemurs of Madagascar and the Comoros - The IUCN Red Data Book. Gland, Schweiz. HARDING, R.S.O. 1981. An order of omnivores, non-human primate diets in the wild. In: Omnivorous Primates, Gathering and Hunting in Human Evolution. Hrsg. R.S.O. Harding, G. Teleki. New York: Columbia University Press. S. 191-214. HARRIS, S., W.J. CRESSWELL, P.G. FORDE, W.J. TREWELLA, T. WOOLLARD, S. WRAY 1990. Home range analysis using radio-trackig data – a review of problems and techniques particulary as applied to the study of mammals. Mammal Review 20: 97-123. HARVEY, P.H., R.D. MARTIN, T.H. CLUTTON-BROOK 1987. Life History in Comparative Perspective. In: Primate Societies. Hrsg. B.B. Smuts, D.L. Cheney, R.M. Seyfarth, R.W. Wrangham, T.T. Struhsaker. Chicago & New York: University of Chicago Press. S. 181-196. HAWKINS, C.E. 1998. Behaviour and ecology of the fossa, Cryptoprocta ferox (Carnivora: Viverridae) in a dry deciduous forest, western Madagascar. University of Aberdeen. Ph.D. thesis. HLADIK, C.M. 1980. The dry forest of the west coast of Madagascar: Climate, phenology, and food available for prosimians. In: Nocturnal Malagasy Primates. Ecology, Physiology and Behaviour. Hrsg. P. Charles-Dominique, H.M. Cooper, A. Hladik C. Hladik, E. Pagès, P.G. Pariente, A. Petter-Rousseaux, A. Schilling. New York: Academic Press. S. 3-40. HLADIK, C.M., P. CHARLES-DOMINIQUE, P.P. PETTER 1980. Feeding strategies of five nocturnal prosimians in the dry forest of the west coast of Madagascar. In: Nocturnal Malagasy Primates. Ecology, Physiology and Behaviour. Hrsg. P. CharlesDominique, H.M. Cooper, A. Hladik C. Hladik, E. Pagès, P.G. Pariente, A. PetterRousseaux, A. Schilling. New York: Academic Press. S. 41-71. HRDY, S.B. 1977. The langurs of Abu: female and male strategies of reproduction. Cambridge, Massachusetts: Harvard Press. 118 HUMPHRIES, R.E., D.H.L. ROBERTSON, R.J. BEYNON, J.L. HURST 1999. Unravelling the chemical basis of competitive scent marking in house mice. Anim. Behav. 58: 11771190. HURST, J.L. & T.J. RICH 1999. Scent marks as competitive signals of mate quality. In: Advances in Chemical Communication in Vertebrates. Hrsg. R.E. Johnson, D. Muller-Schwarze & P. Sorensen. New York: Plenum. S. 209-226. HURST, J.L. 1993. The priming effects of urine substrate marks on interactions between male house mice, Mus musculus domesticus. Anim. Behav. 45: 55-81. IZARD, M.K. 1990. Social influences on the reproductive success and reproductive endocrinology of prosimian primates. In: Socioendocrinology of Primate Reproduction. Hrsg. T.E. Ziegler & F.B. Bercovitch. New York: Willey-Liss. S. 159186. JANSON, C.H. & C.A. CHAPMAN 1999. Resources and primate community structure. In: Primate communities. Hrsg. J.G. Fleagle, C.H. Janson, K.E. Reed. Cambridge University Press. S. 237-267. JENKINS, M.D. 1990. Profil de l’environement. Gland, Cambridge: IUCN, PNEU, WWF. KAPPELER, P.M. & J.U. GANZHORN 1993. The evolution of primate communities and societies in Madagascar. Evol. Anthropol. 2: 159-171. KAPPELER, P.M. 1991. Patterns of sexual dimorphism in body weight among prosimian primates. Fol. Primatol. 57: 132-146. KAPPELER, P.M. 1993. Sexual selection and lemur social systems. In: Lemur social systems and their ecological basis. Hrsg. P.M. Kappeler & J.U. Ganzhorn. NewYork: Plenum Press. S. 223-239. KAPPELER, P.M. 1996. Intrasexual selection and testis size in strepsirhine primates. Behav. Ecol. 8: 10-19. KAPPELER, P.M. 1997. Intrasexual selection in Mirza coquereli: evidence for scramble competition polygyny in a solitary primate. Behav. Ecol. Sociobiol. 45: 115-127. 119 KAPPELER, P.M. 1998. Nests, tree holes, and evolution of primate life histories. Am. J. Primatol. 46: 7-33. KENWARD, R.E. & K.H. HODDER, 1996. RANGES V, An analysis system for biological location data. Institute of Terrestrial Ecology, UK. KENWARD, R.E. 1987. Radio tagging and the analysis of animal movements. In: Micorcomputers in environmental biology. Chapter 6. Oxford: IRL Press. KILTIE, R.A. 1988. Gestation as a constraint on the evolution of seasonal breeding in mammals. In: Evolution of life histories of mammals. Hrsg. M.S. Boyce. New Haven: Yale University Press. S. 257-289. KRAUS, C., M. HEISTERMANN, P.M. KAPPELER 1999. Physiological Suppression of Sexual Function of Subordinate Males: A Subtle Form of Intrasexual Competition Among Male Sifakas (Propithecus verreauxi)? Physiology & Behavior 66(5): 855-861. KREBS, C.J. 1989. Estimating abundance: Mark-and-recapture techniques. In: Ecological Methodology. Hrsg. C.J. Krebs. New York: HarperCollins Publishers. S. 15-63. KREBS, C.J. & N.B. DAVIES 1996. Die Überprüfung von Hypothesen in der Verhaltensökogie. In: Einführung in die Verhaltensökologie. Hrsg. C.J. Krebs, N.B. Davies. Berlin, Wien: Blackwell Wissenschaftsverlag. S. 27-54. KRESS, W. J., G. E. SCHATZ, M. ANDRIANIFAHANANA, H. S. MORLAND 1994. Pollination of Ravenala madagascariensis (Strilitzeaceae) by lemurs in Madagascar: Evidence of an archaic coevolutionary system? Am. J. Botany 81(5): 542-551. KUGEL, S. 1993. Verhaltensbiologische und bioakustische Untersuchungen zur strukturellen Variabilität des Soziallautes „Triller“ beim Mausmaki (Microcebus murinus, Miller, 1777). Univ. Stuttgart-Hohenheim. Diplomarbeit. KUTZER, E. 1992. Dermanyssidose. In: Veterinärmedizinische Parasitologie. Hrsg. J. Eckert, E. Kutzer, M. Rommel, H.J. Bürger, W. Körting. Berlin, Hamburg: Verlag Paul Parey. S. 736-737. LANGRAND, O. 1990. Guide to the Birds of Madagascar. New Haven: Yale University Press. 120 LEBEC, A. 1984. Relation entre le comportement agressif du Microcèbe mâle, les autres comportements et la physiologie sexuelle. Rôle de quelque facteurs déterminants. Université de Paris VI. Thèse 3ème cycle. LESIE, P.H., D. CHITTY, H. CHITTY 1953. The estimation of population parameters from data obtained by means of the capture-recapture method. III. An example of the practical applications of the method. Biometrika 40: 137-169. LEVIN, R.M., J. LATIMORE, A.J. WEIN, K.N. VAN ARSDALEN 1986. Correlation of sperm count with frequency of ejaculation. Fertility and Sterility 45: 732-734. LINDBURG, D.G. 1987. Seasonality of reproduction in primates. In: Comparative Primate Biology, Vol 2B: Behavior, Cognition, and Motivation. Hrsg. G. Mitchell & J. Erwin. New York: Alan R.Liss. S. 167-218. LINDEMANN, A. 1996. Einfluß von Dominanz auf das Reproduktionsverhalten und das akustische Verhalten bei männlichen Mausmakis (Microcebus murinus). Univ. Hannover. Diplomarbeit. MARLER, P. 1968. Aggregation and dispersal: two functions in primate communication. In: Primates: Studies in Adaptation and Variability. Hrsg. P.C. Jay. New York: Holt, Rinehart & Winston. S. 420-438. MARTIN, P. & P. BATESON 1992. Measuring behaviour: An introductory guide. 2nd edn. London: Cambridge University Press. S. 48-69. MARTIN, R.D. 1972a. Review lecture: Adaptive radiation and behaviour of the Malagasy lemurs. Philosoph. Transact. Roy. Soc. Lond. B. 264: 295-352. MARTIN, R.D. 1972b. A preliminary field-study of the lesser mouse lemur (Microcebus murinus, J.F. Miller 1777). Z. Tierpsychol. 9: 43-89. MARTIN, R.D. 1973. A review of the behaviour and ecology of the lesser mouse lemur (Microcebus murinus, J.F. Miller 1777). In: Comparative Ecology and Behaviour of Primates. Hrsg. R.P. Michael & J.H. Crook. London: Academic Press. S. 1-68. 121 MARTIN, R.D. 1995. Prosimians: From obscurity to distinction? In: Creatures of the dark: The nocturnal prosimians. Hrsg. L. Alterman, G.A. Doyle, M.K. Izard. New York: Plenum Press. S. 535-563. MEYERS, D.M. & P.C. WRIGHT 1993. Resource tracking: Food availability and Propithecus seasonal reproduction. In: Lemur social systems and their ecological basis. Hrsg. P.M. Kappeler & J.U. Ganzhorn. NewYork: Plenum Press. S. 179-192. MITTERMEIER, R. A., I. TATTERSALL, W.R. KONSTANT, D.M. MEYERS, R.B. MAST 1994. Lemurs of Madagascar. Washington, D. C.: Conservation International. MITTERMEIER, R.A., W.R. KONSTANT, M.E. NICOLL, O. LANGRAND 1992. Lemurs of Madagascar: An action plan for their conservation 1993-1999. Gland, Schweiz: ICUN. MOHR, C.O. 1947. Table of equivalent populations of North American small mammals. Am. Midl. Nat. 37: 223-249. MØLLER, A.P. & T.R. BIRKHEAD 1989. Copulatory behaviour in mammals: Evidence that sperm competition is widespread. Biol. J. Linn. Soc. 38: 119-131. MOORE, J. & R. ALI 1984. Are dispersal and inbreeding avoidance related? Anim. Behav. 32: 94-112. MÜLLER, A.E. 1999. Aspects of social life in the fat-tailed dwarf lemur (Cheirogaleus medius): Inferences from body weights and trapping data. Am. J. Primatol. 49: 265280. NILSSON, L. A., E. RABAKONANDRIANINA, B. PETTERSSON, R. GRUNMEIER 1993. Lemur pollination in the malagasy rainforest liana Strongylodon craveniae (Leguminosae). Evolutionary trends in plants 7(2): 49-56. NOE, R. 1986. Lasting alliances among adult male savannah baboons. In: Primate Ontogeny, Cognition, and Social Behaviour. Hrsg. J.G. Else & P.C. Lee. Cambridge: Cambridge University Press. S. 381-392. OLDEREID, N.B., J.D. GORDELADZE, B. KIRKHUS, K. PURVIS 1984. Human sperm characteristics during frequent ejaculations. J. Reprod. Fert. 71: 135-140. 122 OLDHAM, C.M., N.R. ADAMS, P.B. GHERHADI, D.R. LINDSAY, J.B. MACKINTOSH 1978. The influence of level of feed intake on sperm-producing capacity of testicular tissue in the ram. Aust. J. Agric. Res. 29: 173-179. ORTMANN, S. & G. HELDMAIER 1997. Spontaneous daily torpor in malagasy mouse lemurs. Naturwissenschaften 84: 28-32. ORTMANN, S., J. SCHMID, J.U. GANZHORN, G. HELDMAIER 1996. Body temperature and torpor in a malagasy small primate, the mouse lemur. In: Adaptations to the Cold, 10th International Hibernation Symposium. Hrsg. F. Geiser, A.J. Huber, S.C. Nicol. Armidale: University of New England Press. S. 55-61. OVERDORFF, D. J. 1992. Differential patterns in flower feeding by Eulemur fulvus rufus and Eulemur rubriventer in Madagascar. Am. J. Primatol. 28(3): 191-203. PACKER, C. & A.E. PUSEY 1982. Cooperation and competition within coalitions of male lions: kin selection or game theory. Nature 296: 740-742. PAGES-FEUILLADE, E. 1988. Modalités de l’occupation de l’espace et relations interindividuelles chez un prosimien nocturne malgache (Microcebus murinus). Folia Primatol. 50: 204 - 220. PARKER, G.A. 1970. Sperm competition and its evolutionary consequences in insects. Biol. Rev. 45: 525-567. PASQUALINI, T., O. COLILLAS, M.A. RIVAROLA 1986. Testicular and serum testosterone variations in squirrel monkey during saesonal cyclicity. J. Androl. 7: 298-302. PERRET, M. & F. AUJARD 2000. Regulation by photoperiod of seasonal changes in body weight and reproductive function in the gray mouse lemur (Microcebus murinus): Differntial responses by sex. Am. J. Primatol. 21: in Druck. PERRET, M. 1977. Influence du groupement social sur l’activation sexuelle saisonnière chez le mâle de Microcebus murinus (Miller, 1777). Z. Tierpsychol. 60: 47 - 65. PERRET, M. 1982. Influence du groupement social sur la reproduction de la femelle de Microcebus murinus (Miller, 1777). Z. Tierpsychol. 43: 159 - 179. 123 PERRET, M. 1985. Influence of social factors on seasonal variations in plasma testosterone levels of Microcebus murinus (Miller, 1777). Z. Tierpsychol. 69: 265-280. PERRET, M. 1992. Environmental and social determinants of sexual function in the male lesser mouse lemur (Microcebus murinus). Folia Primatol. 59: 1-25. PETERS, C. 1999. Intrasexuelle Konkurrenz bei Grauen Mausmaki-Männchen (Microcebus murinus) in Nordwest-Madagaskar. Univ. Göttingen. Diplomarbeit. PETRUSEWICZ, K. & R. ANDRZEJEWSKI 1962. Natural history of the free-living population of house mice (Mus musculus L.) with particular reference to groupings within the population. Ecologia Polska, Series A. 10: 85-122. PETTER, J.J. 1962. Recherches sur l’ecologie et l’ethologie des lemuriens malgaches. In: Mem. du Musée d’Histoire Naturelle. Serie A: Zoologie Nr. 27. PETTER, J.J. 1978. Ecological and physiological adaptations of five sympatric nocturnal prosimians to seasonal variations in food production. In: Recent Advances in Primatology, Vol. 1. Hrsg. D.J. Chivers & J. Herbert. London: Academic Press. S. 211-223. PETTER, J.J., R. ALBIGNAC, Y. RUMPLER 1977. Faune de Madagascar: Mammifières lémuriens, Vol. 44. Tananarive, Orstom/Paris, CNRS. PETTER-ROUSSEAUX, A. 1962. Recherche sur la biologie de la réproduction de Primates inférieurs. Mammalia 26(suppl. 1): 7-88. PETTER-ROUSSEAUX, A. 1980. Seasonal activity rhythms, reproduction and body weight variations in five sympatric nocturnal prosimians in simulated light and climatic conditions. In: Nocturnal Malagasy Primates. Hrsg. P. Charles-Dominique, H.M. Cooper, A. Hladik C. Hladik, E. Pagès, P.G. Pariente, A. Petter-Rousseaux, A. Schilling. New York: Academic Press. S.137 – 152. PICQ, J.L. 1992. Aging and social behaviour in captivity in Microcebus murinus. Folia Primatol. 59: 217-220. POSTON, J.P. 1997. Dominance, access to colonies, and queues for mating opportunities by male boat-tailed grackels. Behav. Ecol. Sociobiol. 41: 89-98. 124 PULLEN, S.L., S.K. BEARDER, A.F. DIXSON 2000. Preliminary observations on sexual behavior and the mating system in free-ranging lesser galagos (Galago moholi). Am. J. Primatol. 51: 79-88. RAADSMA, H.W., T.N. EDEY, B.M. BINDON, L.R. PIPER 1983. Behaviour and mating performance of paddock-mated beef bulls. Anim. Reprod. Sci. 6: 159. RADESPIEL, U. 1998. Die soziale Organisation des grauen Mausmakis (Microcebus murinus, J.F. Miller 1777). Berlin: Verlag Köster. Univ. Hannover. Dissertation. RADESPIEL, U. 2000. Sociality in the gray mouse lemur (Microcebus murinus) in Northwestern Madagascar. Am. J. Primatol. 51: 21-40. RADESPIEL, U., S. CEPOK, V. ZIETEMANN, E. ZIMMERMANN 1998. Sex-specific usage patterns of sleeping-sites in grey mouse lemurs (Microcebus murinus) in Northwestern Madagaskar. Am. J. Primatol. 46: 77-84. RAKOTOARISON, N., H. ZIMMERMANN, E. ZIMMERMANN 1996. Hairy-eared dwarf lemur (Allocebus trichotis) discovered in a highland rain forest of eastern Madagascar. In: Biogéographie de Madagascar. Hrsg. W.R. Lourenço. S. 275-282. RICH, T.J. & J.L. HURST 1998. Scent marks as reliable signals of the competitive ability of mates. Anim. Behav. 56: 727-735. RICH, T.J. & J.L. HURST 1999. The competing countermarks hypothesis: reliable assessment of competitive ability by potential mates. Anim. Behav. 58: 1027-1037. RICHARD, A.F. &. R.E. DEWAR 1991. Lemur ecology. Ann. Rev. Ecol. Syst. 22: 145 - 175. RICHARD, A.F. 1992. Aggressive competition between males, female-controlled polygyny and sexual monomorphism in a malagasy primate, Propithecus verreauxi. J. Hum. Evol. 22: 395-406. RIVAL, F. 1999. Identification par puce électronique (IPPE) des reptiles. Le Point Vétérinaire 30(197): 163-165. ROWE, N. 1996. The pictorial guide to living primates. New York: Pongonias Press. S. 27-51 RUANGSOMBOON, O. & P. VISUTAKUL 1985. Effect of mating on sperm numbers and weight of the epididymis. Contraception 32(2): 217-221. 125 SARIKAYA, Z. 1999. Fortpflanzungsstrategien von Weibchen des Grauen Mausmakis (M. murinus) in Nordwest-Madagaskar. Univ. Göttingen. Diplomarbeit. SCHILLING, A. & M. PERRET 1987. Chemical signals and reproductive capcity in a male prosimian primate (Microcebus murinus). Chemical sense 12: 143 - 158. SCHILLING, A. 1987. L’organe voméronasal des mammifères. J. Physiol. Norm. Pathol. 81: 221-278. SCHILLING, A., M. PERRET, J. PREDINE 1984. Sexual inhibition in a prosimian primate: a Pherormone-like effect. J. Endocrinol. 102: 143-151. SCHMELTING, B., P. EHRESMANN, H. LUTERMANN, B. RANDRIANAMBININA, E. ZIMMERMANN 2000. Reproduction of two sympatric mouse lemur species (Microcebus murinus and Microcebus ravelobensis) in north-west Madagascar: First results of a long term study. In: Diversity and Endemism in Madagascar. Hrsg. W.R. Lourenço & S.M. Goodman. S.165-176. SCHMID, J. & P.M. KAPPELER 1998. Fluctuating sexual dimorphism and differential hibernation by sex in a primate, the gray mouse lemur (Microcebus murinus). Behav. Ecol. Sociobiol. 43: 125-132. SCHMID, J. 1997. Torpor beim Grauen Mausmaki (Microcebus murinus) in Madagaskar: Energetische Konsequenzen und ökologische Bedeutung. Univ. Tübingen. Dissertation. SCHMID, J. 1999. Sex-specific differences in activity patterns and fattening in the gray mouse lemur (Microcebus murinus) in Madagascar. J. Mammol. 80: 749-757. SCHWAB, D. 2000. A preliminary study of spatial distribution and mating system of pygmy mouse lemurs (Microcebus cf myoxinus). Am. J. Primatol. 51: 41-60. SCHWAGMEYER, P.L. 1988. Scramble-competition polygyny in an asocial mammal: Male mobility and mating success. Am. Nat. 131(6): 885-892. SCHWAGMEYER, P.L. 1994. Competitive mate searching in thirteen-lined ground sqirrels (Mammalia, Sciuridae): Potential roles of spatial memory. Ethology 98: 265-276. 126 SETCHELL, B.P. S. MADDOORS, D.E. BROOKS 1994. Anatomy, vasculature, innervation, and fluids of the male reproductive tract. In: The Physiology of Reprodution (2nd Edn) Hrsg. E. Knobil & J.D. Neill. New York: Raven Press Ltd. S. 1063-1434. SHARPE, R.M. 1994. Regulation of spermatogenegis. In: The Physiology of Reproduction. Hrsg. E. Knobil & J.D. Neill. New York: Raven Press Ltd. S. 1363-1434. SIEGEL, S. 1987. Nichtparametrische statistische Methoden. Fachbuchhandlung für Psychologie. Verlag Eschborn. SMUTS, B.B. 1985. Sex and friendship in baboons. New York: Aldine. SOKAL, R.R. & F.J. ROHLF 1980. Biometry. New York: W. H. Freeman and Company. SORG, J.-P. & U.ROHNER 1996. Climate and tree phenology of the dry deciduous forest of the Kirindy Forest. In: Ecology and economy of a tropical dry forest in Madagascar. Primate Report 46: 57 - 80. SPÜHLER, O. 1935. Genitalzyklus und Spermiogenese des Mausmakis. Z. f. Zellforschung u. mikr. Anatomie. 23: 442-463. STERLING, E.J. 1993. Patterns of range use and social organisation in aye-ayes (Daubentonia madagascariensis) on Nosy Mangabe. In: Lemur social systems and their ecological basis. Hrsg. P.M. Kappeler & J.U. Ganzhorn. NewYork: Plenum Press. S. 1-10. STERLING, E.J., N. NGUYEN, P.J. FASHING 2000. Spatial patterning in nocturnal prosimians: A review of methods and relevance to studies of sociality. Am. J. Primatol. 51: 3-19. SWANEPOEL, F.J.C., P.C. LUBOUT, J. CHRISTIE 1993. The relationship of scrotal circumferences to histological testicular parameters and sperm reserves. J. S. Afr. Vet. Ass. 64(3): 126-127. SWIHAR, R.K. & N.A. SLADE 1985. Testing for independence of observations in animal movements. Ecology 66:1176-1184. TATTERSALL, I. 1982. The Primates of Madagascar. New York: Columbia University Press. TATTERSALL, I. 1993. Madagascar’s lemurs. Scientific American 268(1): 110-117. TRIVERS, R. 1972. Parental investment and sexual selection. In: Sexual selection and the decent of man, 1871 - 1971. Hrsg. B. Campbell. Chicago: Aldine. S. 136-179. 127 VAN HOOFF, J. & C.P. VAN SCHAIK 1992. Cooperation in competition: the ecology of primate bonds. In: Coalitions and alliances in humans and other animals. Hrsg. A.H. Harcourt & F.B.M. de Waal. Oxford: Oxford University Press. S. 357-389. VAN HOOFF, J. & C.P. VAN SCHAIK 1994. Male bonds: affilative relationships among nonhuman primate males. Behaviour 130: 309-337. VAN HORN, R.N., G.G. EATON 1979. Reproductive physiology and behavior in prosimians. In: The study of Prosimian Behavior. Hrsg. G.A. Doyle & R.D. Martin. New York: Academic Press. S. 79-122. VAN SCHAIK, C.P. & M.A. VAN NOORDWIJK 1985. Interannual variability in fruit abundance and the reproductive seasonality in sumatran long-tailed macaques (Macaca fascilularis). J. Zool. Lond. 206: 533-549. VAN SCHAIK, C.P. 1996. Social evolution in primates: The role of ecological factors and male behaviour. Proc. Brit. Acad. 88: 9-31. VANDENBERGH, J.P. 1983. Pheromones and reproduction in mammals. New York: Academic Press. WALKDEN-BROWN, S.W., B.J. RESTALL, W.A. TAYLOR 1994. Testicular and epididymal sperm content in grazing cashmere bucks: Seasonal variation and prediction from measurements in vivo. Reprod. Fert. Dev. 6: 727-736. WALTER, H. & S.W. BRECKLE 1984. Ökologie der Erde. Band 2: Spezielle Ökologie der tropischen und subtropischen Zonen. Stuttgart: Gustav Fischer Verlag. WASER, P.M. 1985. Does competition drive dispersal? Ecology 66: 1170-1175. WEIDHOLZ, A. 1932. Bemerkungen zum Trockenschlaf der Zwerglemuren. Zool. Gart. Leipzig (N.F.) 5: 282-285 WELLS, K.D. 1977. The social behaviour of anuran amphibians. Anim. Behav. 25: 666-693. WHITAKER, J.O. 1988. Food habitat analysis of insectivorous bats. In: Ecological and Behavioral Methods for the Study of Bats. Hrsg. T.H. Kunz. Washington DC: Smithsonian Institution Press. S.177-211. 128 WHITE, G.C. & R.A. GARROTT 1990. Analysis of Wildlife Radio-Tracking Data. New York: Academic Press. WRIGHT, P.C. 1997. The future of biodiversity in Madagascar. In: Natural change and human impact in Madagascar. Hrsg. S.M. Goodman, B.D. Patterson. Washington: Smithsonian Press. S. 381-405. WROGEMANN, D., U.RADESPIEL, E. ZIMMERMANN 2000. Comparison of reproductive characteristics and changes in body weight between captive populations of rufous and gray mouse lemurs. Am. J. Primatol. 21: in Druck. YODER, A.D. 1997. Back to the future: A synthesis of strepsirhine systematics. Evol. Anthropol. 6(1): 11-22. YOUNG, A.L., A.F. RICHARD, L.C. AIELLO 1990. Female dominance and maternal investment in strepsirhine primates. Am. Nat. 135: 473-488. ZIMMERMANN, E. & C. LERCH 1993. The complex acoustic design of an advertisement call in male mouse lemurs (Microcebus murinus, Prosimii, Primates) and sources of its variation. Ethology 93: 211-224. ZIMMERMANN, E. 1995. Acoustic communication in nocturnal prosimians. In: Creatures of the dark. Hrsg. L. Alterman, G.A. Doyle & K. Izard. New York: Plenum Press. S. 311330. ZIMMERMANN, E. 1998. Waldgeister der Tropen – die nachtaktiven Lemuren Madagaskars. Biologie in unserer Zeit. 28(5): 294-303. ZIMMERMANN, E., S. CEPOK, N. RAKOTOARISON, V. ZIETEMANN, U. RADESPIEL 1998. Sympatric Mouse Lemurs in north-west Madagascar: A new rufous mouse lemur species (Microcebus ravelobensis). Folia Primatol. 69: 106-114. 129 9 Anhangstabelle Anhangstabelle. Zeitanteil der Verhaltensweisen an der Kontaktzeit der Fokusbeobachtungen. Verhaltensweise Fokusphase N Median Autogrooming Autogrooming Autogrooming Autogrooming Autogrooming Autogrooming Autogrooming Fressen Fressen Fressen Fressen Fressen Fressen Fressen Lokomotion Lokomotion Lokomotion Lokomotion Lokomotion Lokomotion Lokomotion Ruhen Ruhen Ruhen Ruhen Ruhen Ruhen Ruhen Soziale Aktivität Soziale Aktivität Soziale Aktivität Soziale Aktivität Soziale Aktivität Soziale Aktivität Soziale Aktivität visuell nicht erkennbar visuell nicht erkennbar visuell nicht erkennbar visuell nicht erkennbar visuell nicht erkennbar visuell nicht erkennbar visuell nicht erkennbar Sep Okt Nov Anfang Nov Ende Jan Feb Mrz Sep Okt Nov Anfang Nov Ende Jan Feb Mrz Sep Okt Nov Anfang Nov Ende Jan Feb Mrz Sep Okt Nov Anfang Nov Ende Jan Feb Mrz Sep Okt Nov Anfang Nov Ende Jan Feb Mrz Sep Okt Nov Anfang Nov Ende Jan Feb Mrz 9 10 9 8 7 7 7 9 10 9 8 7 7 7 9 10 9 8 7 7 7 9 10 9 8 7 7 7 9 10 9 8 7 7 7 9 10 9 8 7 7 7 0.8 % 2.4 % 1.2 % 1.9 % 4.3 % 3.5 % 3.9 % 4.8 % 17.8 % 13.5 % 9.7 % 18.6 % 17.8 % 13.4 % 32.1 % 32.8 % 19.1 % 25.5 % 23.2 % 28.9 % 28.4 % 21.3 % 23.9 % 16.9 % 29.6 % 26.0 % 21.9 % 31.1 % 1.3 % 0.0 % 1.5 % 1.3 % 1.0 % 0.0 % 0.0 % 28.7 % 15.7 % 38.6 % 25.9 % 19.2 % 20.2 % 21.6 % Minimum Maximum 0.1 % 0.0 % 0.1 % 0.7 % 0.0 % 0.4 % 0.2 % 1.2 % 3.1 % 2.1 % 3.4 % 4.7 % 9.3 % 6.9 % 25.5 % 9.7 % 12.0 % 11.5 % 16.1 % 18.4 % 19.3 % 10.5 % 13.3 % 7.6 % 19.3 % 21.1 % 12.1 % 10.4 % 0.0 % 0.0 % 0.0 % 0.0 % 0.0 % 0.0 % 0.0 % 16.2 % 5.9 % 11.5 % 13.5 % 14.5 % 10.1 % 4.1 % 3.3 % 6.2 % 8.5 % 10.6 % 6.8 % 5.7 % 13.1 % 25.2 % 26.2 % 53.0 % 14.0 % 36.7 % 41.9 % 27.4 % 41.4 % 48.1 % 40.6 % 36.3 % 31.9 % 44.6 % 46.4 % 42.7 % 81.2 % 53.3 % 58.0 % 53.5 % 42.0 % 51.9 % 7.9 % 13.2 % 11.5 % 11.0 % 6.8 % 2.6 % 0.0 % 51.7 % 38.6 % 45.5 % 33.9 % 44.2 % 38.9 % 22.6 % Unteres Quartil 0.7 % 1.6 % 0.3 % 1.1 % 1.4 % 1.1 % 0.9 % 3.7 % 6.3 % 4.8 % 4.9 % 6.6 % 10.0 % 8.2 % 30.2 % 29.6 % 14.1 % 20.0 % 17.2 % 23.8 % 23.7 % 13.0 % 20.1 % 13.2 % 27.6 % 22.3 % 16.8 % 13.0 % 0.2 % 0.0 % 0.0 % 0.1 % 0.0 % 0.0 % 0.0 % 21.3 % 10.0 % 23.3 % 17.4 % 15.2 % 12.3 % 18.5 % Oberes Quartil 2.6 % 4.2 % 3.2 % 2.3 % 4.8 % 4.6 % 10.7 % 8.0 % 23.3 % 16.6 % 12.9 % 27.0 % 21.9 % 18.0 % 36.1 % 38.6 % 24.2 % 34.1 % 27.5 % 44.5 % 41.8 % 31.1 % 36.0 % 41.7 % 45.2 % 29.8 % 28.7 % 43.9 % 4.2 % 0.2 % 1.9 % 2.6 % 5.3 % 0.6 % 0.0 % 40.7 % 19.1 % 41.1 % 31.4 % 27.4 % 24.9 % 22.3 % Danksagung Mein Dank gilt Frau Prof. Dr. Elke Zimmermann für die engagierte Betreuung und das Anvertrauen dieses Themas, welches mir gezeigt hat, daß es auch noch andere Fragestellungen geben kann als die mir in dieser Zeit wohl am häufigsten gestellte Frage: „Was willst Du denn damit später mal machen?“ Dorothea Wrogemann möchte ich für das Korrekturlesen ebenso danken wie für die zahl- und hilfreichen Diskussionen, Anleitungen und Anregungen, als ich mir in der Auswertungsphase und beim Zusammenschreiben selbst oft diese Frage stellte. Ute Radespiel sei gedankt für das Korrekturlesen und die intensive Diskussionsbereitschaft, die zum Gelingen dieser Arbeit beigetragen haben. Den madagassischen Institutionen, Behörden und Verantwortlichen danke ich für die mir gegebene Möglichkeit, die Forschungsarbeiten auf Madagaskar auszuführen. Stellvertretend sollen die Commission Tripartite, ANGAP, DEF und Prof. Berthe Rakotosamimanana genannt sein. Den Mitarbeitern der Anganoka-Zuchtstation des Durrell Wildlife Conservation Trust in Ampijoroa sei für die zur Verfügung gestellten Wetterdaten gleichermaßen gedankt wie den Mitarbeitern von Conservation International für die gewährte Gastfreundschaft auf der Forschungsstation in Ampijoroa und in Mahajanga. Heike Lutermann habe ich einen Teil der aufgenommenen Triangulationsdaten zu verdanken. Für die Monate Mai und Juni 1998 standen mir dankenswerter Weise die von Blanchard Randrianambinina und Solofonirina Rasoloharijaona erhobenen Fang-Wiederfangdaten zur Verfügung. Den beiden möchte ich auch besonders danken für die gemeinsam erlebte Zeit in Madagaskar. Mivadibadika ny fiainana eto antany! Während der Madagaskar-Aufenthalte der field assistants Jess Myers, Marianne Soisalo, Ares Jové Rénon, Oliver Matzke und Stefan Witte wurde das Arbeiten in Ampijoroa sehr erleichtert. Für ihren unermüdlichen Arbeitseinsatz und die Ausdauer, nachtein nachtaus einem german researcher und anderen Männchen in „hoher Reisegeschwindigkeit“ dicht auf den Fersen zu bleiben durch teilweise noch dichteres Gestrüpp, möchte ich mich sehr bedanken. Mike Bruford, Stephen Clifford, Angela Formia, Benoit Goossens, Kathrine Jeffreys und Kathrine Little danke ich für die angenehme Atmosphäre im Lab G10 der Cardiff University, wo ich einige Zeit auch mit dem Zusammenschreiben dieser Arbeit verbracht habe. Oliver Pierson, Jess Myers und Stephen Clifford danke ich für die vielen Kleinigkeiten, die erheiterten. Meike möchte ich danken für die „um 1/16 länger dauernde“ Doktorandenzeit. An dieses 1/16 denke ich besonders gern zurück und freue mich auf alle kommenden. Mein großer Dank geht an meine Eltern, von denen ich Liebe und Vertrauen erfahren habe „bei allem, was ich auch angestellt habe“.