Lupus erythematodes - alexander
Werbung

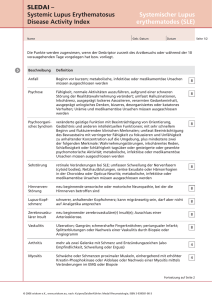
Immunerkrankungen Kollagenosen Systemischer Lupus erythematodes Synonym: Lupus erythematodes disseminatus (LED) Definition und Epidemiologie Der generalisierte (systemische) Lupus erythematodes (SLE) ist eine generalisierte, multisystemische Autoimmunerkrankung, die in ihrem chronisch rezidivierenden Verlauf alle Organe betreffen kann und besonders an Haut, Gelenken, Nieren und serösen Häuten zu Schädigungen führt. Sie ist durch das Auftreten von Autoantikörpern charakterisiert, die gegen Zellkernkomponenten (antinukleäre Antikörper, ANA), doppelsträngige DNA (Anti-ds-DNA-Antikörper) oder Histone (AntiHiston-Antikörper) gerichtet sind und keine Organspezifität aufweisen. Daneben können Autoantikörper gegen Protein-PhospholipidKomplexe (Antiphospholipid-Antikörper) bzw. gegen Erythrozyten, Leukozyten und Thrombozyten vorkommen. Die Autoantikörper können über Typ-III oder Typ-IV-Hypersensitivitätsreaktionen Zell- und Gewebeläsionen verursachen. Inzidenz liegt bei 5-10/100 000/Jahr. Über 85% der Betroffenen sind Frauen, wobei die Altersstufen von 20-40 Jahren überwiegen. Der „late-onset-SLE“ tritt nach dem 55. Lebensjahr auf (w : m = 2 : 1). Ätiologie und Pathogenese Die genaue Ätiologie ist weitgehend unklar. Diskutiert werden jedoch exogene Faktoren wie die UV-Bestrahlung, die bei ca. 20% der Patienten zu einer systemischen Generalisierung führen kann. Außerdem ist eine Induktion des SLE durch Medikamente möglich (medikamentös induzierter SLE -> milderer Verlauf): Antihypertensiva (Hydralazin, Reserpin), Antiarrhythmika (Procainamid, Chinidin), Antiepileptika (Carbamazepin), Tuberkulostatika, Thyreostatika. Auch Viren (EBV, CMV) wird eine Bedeutung beigemessen. Prävalenz ist bei Familienangehörigen des ersten und zweiten Grades deutlich erhöht. Die Haplotypen B8/DR-3 und B7/DR-2 sowie Komplementdefekte scheinen für einen SLE zu prädisponieren. Ablagerungen von Immunkomplexen an den Glomeruli, periglomerulären Nierenkapillaren, epidermalen Basalmembranen der Plexus choroideus sowie kleine und mittlere Arterien der Haut, Lunge, Gelenke und ZNS spielen eine zentrale Rolle in der Immunpathogenese. Durch die gestörte Phagozytose (= Clearance) frühapoptotischer Zellen wird der Detritus sekundär-nekrotischer Zellen vom fehlgesteuerten Immunsystem als fremd erkannt, woraufhin durch die verlängerte Exposition intrazellulärer und nukleärer Autoantigene Antikörper durch polyklonale B-Zell-Aktivierung gebildet werden: Initiierung der Autoimmunerkrankung. Die Immunkomplexe können sich aufgrund der reduzierten Clearance in Gefäßwänden verschiedener Organe ablagern und eine Komplement- und Thrombozytenaktivierung anstoßen. Die entstehende Vaskulitis provoziert einen Gefäßverschluss mit entsprechender Organschädigung. Hinzu kommt eine verminderte Aktivität und Anzahl regulatorischer T-Zellen sowie eine gestörte Elimination autoreaktiver B- und T-Zellen. Klinik und Verlauf des SLE sind sehr variabel. Die klinische Diagnose wird hierbei nach den Kriterien des American College of Rheumatology (ACR) gestellt (Tab. 1). Gefordert ist der gleichzeitige oder serielle Verlauf von mindestens 4 der 11 Kriterien. Zu den in der Akutphase im Vordergrund stehenden Allgemeinbeschwerden zählen wechselnde Arthralgien, Müdigkeit, Lymphknotenschwellungen, verstärkte Photosensibilität und plötzliche Fieberschübe. Im chronisch-rezidivierenden Verlauf gesellen sich mannigfaltige Organmanifestationen hinzu: • Klinik und Verlaufsformen • • • • • • • • Tab.1: SLE-Diagnosekriterien (nach ACR, 1997) • Schmetterlingserythem • diskoide Hautläsionen • Photosensibilität • orale/nasale Schleimhautulzera • nichterosive Arthritis • Serositis • Nephritis (Protein- und Zylindrurie) • neuropsychiatrische Auffälligkeiten • hämatologische Befunde • antinukleäre Antikörper • Autoantikörper (Anti-ds-DNS) Hautveränderungen (> 70%) haben der Erkrankung ihren Namen gegeben (lupus = Wolf): o Schmetterlingserythem an Wangen und Nasenrücken mit Aussparung der Nasolabialfalten o diskoider Lupus: Papeln mit Schuppenbildung und follikulärer Hyperkeratose o Photosensibilität der Haut nach Lichtexposition o oronasale Läsionen o Kopfhautbefall mit vernarbender Alopezie o Hautvaskulitis (Livedovaskulitis, leukozytoklastische Vaskulitis) Gelenke: nicht-destruktive Polyarthritis an peripheren Gelenken (Synovialitis) o deformierende Gelenkkapselschrumpfung im Fingerbereich typisch für den SLE seröse Häute: Pleuritis, Perikarditis und Peritonitis werden als Polyserositis häufig beobachtet o mit Erguss einhergehende serofibrinöse Entzündung kann zu Verwachsungen und Fibrosen führen Herz: außer der Perikarditis kommt eine nichtbakterielle verruköse Endokarditis (Libman-Sacks) vor, die jede Klappe betreffen kann; selten ist eine Myokarditis o außerdem vorzeitige Arteriosklerose mit KHK-Manifestation und erhöhtem Infarktrisiko Nierenbeteiligung (60-70%) in Form der Lupusnephritis: o Immunkomplex-Glomerulonephritis o signifikante Proteinurie (> 0,5 g/d) und granulierte Zylinder oder Akanthozyten im Urinsediment o Ödeme (Nephrotisches Syndrom) und renoparenchymatöse Hypertonie Nervensystem (60%): Krampfanfälle, Psychosen, Migräne, depressive Verstimmtheit und Sehstörungen Gefäßsystem: Raynaud-Syndrom und Thrombophilie sowie arterielle Verschlüsse durch AntiphospholipidAntikörper-Syndrom Lunge: selten interstitielle Lupuspneumonie oder Alveolitis mit Übergang in chronische Lungenfibrose hämatopoetische Auffälligkeiten: Leukopenie, Thrombozytopenie und Antikörper gegen Gerinnungsfaktoren Bildquelle Abb.1: Böcker et al.: Pathologie, Urban & Fischer Verlag, 4. Auflage, S. 1152 © April 2010 by Alexander Jörk Friedrich-Schiller-Universität Jena 1 Immunerkrankungen Kollagenosen Systemischer Lupus erythematodes Klinik und Verlaufsformen Häufig ist eine chronisch-rezidivierende rezidivierende Verlaufsform des SLE. Zwischen den wechselnden Krankheitsschüben kommt es zu mehr oder weniger andauernden den Remissionen durch ein auslösendes Moment (Medikamente, Sonnenlichtexposition, mentale Stresssituation). Insgesamt leben 85-90% 90% der Patienten nach 10 Krankheitsjahren. In den ersten Krankheitsjahren Krankheitsjahr sind die akute Erkrankung selbst und nd Infektionen unter der Immunsuppression die häufigste Todesursache, später vor allem atherosklerotisch bedingte Herz-Kreislauf-Komplikationen. Bei ca. 40% der Betroffenen n kommt es zum SLE mit sekundärem Antiphospholipid-Syndrom.. Dabei bilden sich Antikörper gegen Phospholipid-Protein-Komplexe: Anti-Cardiolipin Cardiolipin und Anti-beta-2-Glykoprotein. Im Vordergrund der klinischen Symptomatik stehen die erhöhte Neigung zu venösen und arteriellen Thrombosen. Chronisch diskoider Lupus erythematodes (CDLE): Hautlupus mit günstiger Prognose (nur bei 5 % entwickelt sich SLE), wobei sich druckschmerzhafte Plaques von schuppenden schuppe Hyperkeratosen mit rötlich-entzündlichem entzündlichem Randsaum und zentraler Atrophie zeigen. zeigen Subakuter kutaner Lupus erythematodes (SCLE): nimmt hinsichtlich Klinik und Prognose eine Mittelstellung zwischen dem chronisch-kutanem kutanem und dem systemischen LE ein und zeichnet sich neben Psoriasis-ähnlichen ähnlichen Rundherden auf UV-Licht exponierter Haut auch teilweise durch Arthralgien, Myalgien und eine Nierenbeteiligung N mit milder Symptomatik aus. Diagnose Die Diagnose basiert auf dem klinischen Erscheinungsbild (ACR-Kriterien) und dem Labor. Im Blutbild fallen eine normochrome normochro Anämie, Thrombopenie und Leukopenie auf. Außerdem erhöhtes C-reaktives reaktives Protein, erniedrigte C3- und C4Werte sowie erhöhtes C3d. Die Komplementwerte (C3d) und der Titer der Anti-dsDNA-Antikörper werden als serologische Verlaufsparameter zur Abschätzung der Krankheitsaktivität herangezogen. Einzige inzige pathognomonische Antikörper sind Antikörper gegen doppelsträngige DNA (dsDNA) und das Sm-(Smith)-Protein. Über ber Biopsie können immunhistologische Immunkomplexablagerungen an der Basalmembran der Glomerula (Abb.1) 1) und der Haut nachgewiesen werden (sog. Lupus-Banden). ). Zum Ausschluss des ZNS-Befalls ZNS sollten bildgebende Verfahren (MRT und CT) eingesetzt werden. Therapie Präventiv sollten schubauslösende Faktoren gemieden gem werden, wie etwa eine direkte Sonnenbestrahlung der Haut oder verursachende Medikamente. Medikamente Die Therapie ie richtet sich nach der Schwere der Erkrankung und Organmanifestation. Beim SLE mit blandem Verlauf können nichtsteroidale Antirheumatika (NSAR) ( oder eine Basistherapie von Cortison mit Chloroquinderivaten ausreichend sein. Steht teht die Arthritis im Vordergrund, ist Methotrexat indiziert. indiziert Bei lebensbedrohlicher Nieren- und Herzbeteiligung muss die immunsuppressive mmunsuppressive Therapie (Prednisolon) um Cyclophosphamid und Azathioprin erweitert erwei werden. Neue Therapieoptionen bei schweren Verläufen sind der Anti-CD20-Antikörper Antikörper Rituximab und die autologe Stammzelltransplantation. Bei diskoidem Lupus sind in der Regel steroidhaltige Externa und Retinoide ausreichend. Abb.1: Lupusnephritis (oben: Verdickung glomerulärer Kapillarschlingen; unten: IgGIgG Ablagerung in den Kapillarschlingen) Kapillarschlingen Zusammenfassung Abb.2: Symptome des SLE Bildquelle Abb.1: Böcker et al.:: Pathologie, Urban & Fischer Verlag, 4. Auflage, S. 1152 © April 2010 2 by Alexander Jörk Friedrich--Schiller-Universität Jena 2