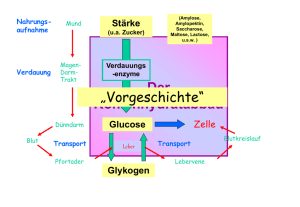
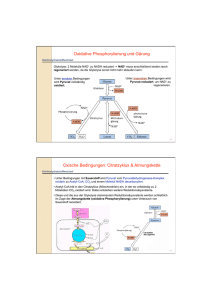
Glukosestoffwechsel
Werbung

© MLach Kommentare bitte an Seite 1 05.09.2003 Glukosestoffwechsel Glykolyse Bedeutung Die Glykolyse kann anaerob oder aerob ablaufen. Somit besteht selbst unter hypoxischen bzw. anoxischen Bedingungen für die Zellen die Chance einen Minimalbedarf an ATP zu gewinnen. Insbesondere der arbeitende Muskel ist in der Lage so eine erhebliche Energieproduktion zu gewährleisten. Bei der aneroben Glykolyse dient das bei der Oxidation von 3Phosphoglyzerinaldehyd gewonnenen NADH/H+ zur Reduktion des gebildeten Pyruvat zu Laktat. Pyruvat + NADH/H+ Laktat + NAD+ Diese Reaktion dient der Vermeidung eines erhöhten NADH/H+-Spiegels im Zytosol der Zelle, der einen hemmenden Einfluss auf die Pyruvatdehydrogenase hat. Gleichzeitig wird NADH/H+ wieder regeneriert und die Glykolyse kann zur ATP- und Pyruvatbildung aufrechterhalten werden. Das durch die Laktatdehydrogenase aus Pyruvat gebildete Laktat diffundiert aus der Zelle, gelangt auf dem Blutweg zur Leber und kann zu Glukoneogenese verwendet werden. Diesen Kreislauf des Laktat bezeichnet man auch als Corri-Zyklus. Die aerobe Glykolyse verläuft bis zum Pyruvat, das dann zu Azetyl-CoA dekarboxyliert wird. Ein Alternativweg der aneroben Glykolyse ist die alkoholische Gärung die im Stoffwechsel von Bakterien und Hefen stattfindet. Im Zuge der alkoholischen Gärung wird Pyruvat von der Pyruvatdekarboxylase zu Azetaldehyd dekarboxyliert das nachfolgend von der Alkoholdehydrogenase unter Verbrauch von NADH zu Ethanol reduziert wird. Diese Reaktion bildet eine Analogie zur Reaktion der Laktatdehydrogenase. Denn hierdurch wird ebenso NADH zu NAD+ oxidiert und kann erneut der Glykolyse für die Glyzerinaldehyd-3-Phosphat-Dehydrogenasereaktion zur Verfügung stehen. Die alkoholische Gärung hat für den Menschen insofern nur eine marginale Bedeutung, da von der Darmflora auf diese Weise geringe Ethanolmengen produziert werden, die nach Resorption im Blut erscheinen. Der resorbierte Ethanol kann einen Blutspiegel von 0,01 Promille erreichen. 1. Schritt: Pyruvat → Azetaldehyd + CO2 2. Schritt: Azetaldehyd + NADH/H+ → Ethanol + NAD+ Bilanz Ausgehend von Glukose kann die aerobe Glykolyse wie folgt bilanziert werden: Glukose + 2 ADP + 2 NAD+ + 2 Pan → 2 Pyruvat + 4 ATP + 2 NADH/H+ + 2 H2O © MLach Kommentare bitte an Seite 2 05.09.2003 Der Energiegewinn bei der aneroben Glykolyse beträgt somit 2 mol ATP pro mol Glukose. Da das gebildete NADH/H+ zur Aufrechterhaltung der Glykolyse benötigt wird findet es keine Berücksichtigung in der Bilanz der ATP-Bildung. Unter aeroben Bedingungen kann es für weitere Stoffwechselprozesse verwendet werden. Lokalisation Die Glykolyse findet im Zytosol der Zellen statt. Ablauf der Glykolyse Substratbereitstellung dient der Fixierung der Glukose im Zytosol der Zelle. Glukose-6Phosphat wird von der Hexosekinase I insulinunabhängig synthetisiert. Die Hexokinase I phosphoryliert unspezifisch nahezu alle Hexosen, wird von Galaktose jedoch gehemmt. Die Insulinunabhängigkeit der Hexokinase I erlaubt daher beispielsweise Fruktose nach direkter Phosphorylierung in die Glykolyse einzuschleusen. Dieser Mechanismus spielt für den Kohlenhydratstoffwechsel insulinpflichtigen Diabetiker eine wichtige Rolle da Fruktose insulinunabhängig in die Zellen aufgenommen wird. In der Leber und in den β-Zellen des Pankreas existiert eine glukosespezifische Hexokinase IV (Glukokinase). Diese ist aufgrund ihres höheren Km-Wertes mit einer ca. 50fach niedrigeren Glukoseaffinität (Km = 10 mmol) als die Hexokinase I (Km = 0,1 mmol), erst bei erhöhten Glukosespiegeln aktiv und fungiert in Verbindung mit den GLUT-2 Transporter als Glukosesensor. Bei einem höheren Glukosespiegel können auf diese Weise blutzuckersenkende und glukoseverwertende Mechanismen in Gang gesetzt werden. Regulierte Enzyme oder katalysiert die Phosphorylierung der Glukose. Die Hexokinase ist wird durch Glukose-6-Phosphat allosterisch gehemmt (feed backHemmung). , katalysiert die erste irreversible Reaktion der Glykolyse und wird als Schrittmacherenzym auf vielfältige allosterische Weise reguliert. Die allosterische Regulation ist von der Energieladung und dem Substratangebot abhängig. Eine hohe Energieladung der Zelle die durch einen hohen ATP und Zitratbestand gekennzeichnet ist hemmt die Phosphofruktokinasereaktion. ADP und AMP aktivieren die Phosphofruktokinase allosterisch (Pasteur-Effekt). Weitaus bedeutsamer ist die Regulation der Phosphofruktokinase durch Fruktose-2,6Bisphosphat. Dieser Signalmetabolit wird bei einem hohen Fruktose-6Phosphatangebot durch die Phosphofruktokinase 2 (PFK2) gebildet (feed forwardStimulierung). Fruktose-2,6-Bisphosphat aktiviert die Phosphofruktokinase allosterisch indem es die Affinität zum Fruktose-6-Phosphat erhöht und die ATPAffinität vermindert. Die PFK2 ist ein interkonvertierbares bifunktionelles Enzym das als Phosphatase oder als Kinase arbeiten kann. In seiner phosphorylierten Form fungiert es als Phosphatase die Fruktose-2,6-Bisphostphat hydrolysiert. Im dephosphorylierten Zustand wiederum fungiert die PFK2 als Kinase und katalysiert die Synthese des Fruktose-2,6-Bisphostphates. Die Phosphorylierung der PFK2 erfolgt über die Proteinkinase A deren Aktivierung in der Leber wiederum ein Resultat der Glukagonwirkung ist. © MLach Kommentare bitte an Seite 3 05.09.2003 ist für die so genannte Substratkettenphosphorylierung verantwortlich. Hierbei wird ein anorganisches Phosphat unter Ausnutzung der freigesetzten Oxidationsenergie des Glyzerinaldehyd-3-Phosphats in eine energiereiche organische Säureanhydridbindung am C1 des 3-Phosphoglyzerat eingeführt. Diese Reaktion verläuft in zwei Schritten, zunächst reagiert das Glyzerinaldehyd-3Phosphat mit einer Sulfhydrylgruppe des Enzyms. Der erste Schritt ist die Reaktion der Aldehydgruppe des Glyzerinaldehyd3-Phosphats mit einer Sulfhydrylgruppe des Enzyms. Unter Oxidation der Aldehydgruppe des Glyzerinaldehyd-3-Phosphats durch das NAD+ entstehen eine Thioesterbindung und ein Hydridion das von NAD+ gebunden wird. Im nachfolgenden Reaktionsschritt erfolgt eine phosphorylytische Spaltung der Thioesterstruktur durch ein anorganisches Phospat das unter Ausbildung von 1,3Bisphosphoglyzerat einen Teil der Reaktionsenergie in einer Säureanhydridbindung konserviert. O S C R NAD+ O NADH/H+ Enzym S C R Enzym NADH+ NAD+ Pi O OH S C R S C R H Enzym Enzym NAD+ NAD+ SH H R C R C Enzym O-PO3 O O NAD+ ! wird durch 2,3-Bisphophoglyzerat allosterisch aktiviert. Sie kann auch einen Alternativweg zum 2,3-Bisphophoglyzerat katalysieren. Das 2,3Bisphophoglyzerat dient in Erythrozyten der allosterischen Regulation der Sauerstoffaffinität des Hämoglobins. Bei Abzweigen des 2,3-Bisphophoglyzerat aus der Glykolyse kommt es zum Verlust einer energiereichen Phosphatbindung, so dass weniger als 2 Mol ATP/mol Glukose gebildet werden. Unter hypoxischen Bedingungen können im Erythrozyten bis 20 % 2,3-Bisphophoglyzerat entstehen. " ist katalysiert den nichtoxidativen irreversiblen Transfer des Phosphatrestes vom PEP auf ADP und ist somit die zweite Reaktion bei der in der Glykolyse ATP gebildet wird. Die Pyruvatkinase ist ein interkonvertierbares Enzym, das durch Phosphorylierung inaktiviert wird. In der Leber ist dieser Mechanismus für die Hemmung der Glykolyse durch Glukagon von großer Bedeutung. Bei einem niedrigen Blutzuckerspiegel und der dadurch induzierten Glukagonfreisetzung aus den α-Zellen des Pankreas werden an den Hepatozyten über die Glukagonrezeptoren Adenylatzyklasen aktiviert. Diese erhöhen ihrerseits den intrazellulären cAMP-Spiegel. Der erhöhte cAMP-Bestand wiederum aktiviert seinerseits eine Proteinkinase A welche die Pyruvatkinase phosphoryliert und damit deaktiviert. Pyruvatkinase unterliegt weiterhin der Regulation durch Fruktose-1,6-Bisphosphat über eine allosterische Aktivierung (feed-forward), ATP und Aladin hemmen bei einem hohen Spiegel die Pyruvatkinase allosterisch. © MLach Kommentare bitte an Seite 4 05.09.2003 Weiter beteiligte Enzyme existiert in zwei Isoformen Aldolase A und B die sich in ihrer Spezifität für Fruktose-6-Phosphat und Fruktose-1-Phosphat unterscheiden. Glykolytisch wird vor allem die ubiquitäre Aldolase A aktiv, während die Aldolase B nur in der Leber vorkommt und Fruktose-1-Phosphat bevorzugt. Die Substratspezifität liegt bei der Aldolase A Im Verhältnis Fruktose-1,6-bisphosphat:Fruktose-1-Phosphat = 50:1 und bei der Aldolase B im Verhältnis 1:1. Aldolase B spaltet Fruktose-1,6-bisphosphat zu Dihydroxyazetonphosphat und Glyzerinaldehyd-3-Phosphat in Verhältnis 97:3. # ! katalysiert die Isomerisierung des Dihydroxyazetonphosphat zu Glyzerinaldehyd-3-Phosphat. Das Reaktionsgleichgewicht liegt auf der Seite des Dihydroxyazetonphosphat, die Reaktion wird indes durch den ständigen Abfluss des Glyzerinaldehyd-3-Phosphats begünstigt. $ Irreversible enzymatische Schritte sind die Reaktionen der • Hexokinase • Phosphofruktokinase • Pyruvatkinase © MLach Kommentare bitte an Seite 5 05.09.2003 Reaktionsfolge der Glykolyse CH2OH CH2O-PO3 ATP ADP O Hexokinase phosphoryliert Glukose zu Glukose-6Phosphat; Verbrauch von 1 mol ATP. O OH HO OH HO OH OH O3P-OH2C Isomerisierung des Glukose-6-Phosphats zu OH OH CH2OH O HO Fruktose-6-Phosphat OH OH ATP Irreversible Phosphorylierung des Fru-6-P zu Fruktose-1,6-Bisphosphat, Schrittmacherreaktion ADP O3P-OH2C CH2O-PO3 O HO Aldolasereaktion: Spaltung von Fru-1,6-biphosphat zu Glyzerinaldehyd-3-Phosphat und OH OH Dihydroxyazetonphosphat HC O H2C O PO3 Isomerisierung der Triosen HC OH C O H2C O PO3 H2C OH Oxidation 3-Phosphoglyzerinaldehyd zu 1,3-Bisphosphoglyzerat; + Substratkettenphosphorylierung; NADH/H -Bildung NAD+ O O PO3 C NADH/H+ HC OH Transphosphorylierung von 1,3-Bisphosphoglyzerat zu 3-Phosphoglyzerat; Transfer anhydritischen Phosphatrestes auf ADP unter ATP-Bildung Mutasereaktion: Umlagerung der Phosphatgruppe vom C3 auf C2 unter Bildung von 2-Phosphoglyzerat zur Vorbereitung der Enolasereaktion H2C O PO3 ADP ATP O C O O H2C O PO3 O Alternativ Glukoneogenese C O H2O CH2 ADP ATP O C O C O NADH/H+ NAD+ CH3 CO2 Anaerob: Laktat-Dehydrogenasereaktion unter Verbrauch des in der Glykolyse gebildeten + NADH/H zur Laktatbildung Aerob: Pyruvat-Dehydrogensereaktion zur Dekarboxylierung von Pyruvat zu Azetyl-CoA H2C OH C O PO3 Pyruvatkinase katalysiert die ATP-Bildung durch Übertragung der Phosphatgruppe des PEP auf ADP unter Bildung von Pyruvat Folgereaktionen unter Verwendung des Pyruvats O HC O PO3 HC OH Enolasereaktion: Enolase bildet durch H2OAbspaltung die zweite energiereiche Phosphatbindung (Enolester) im Phosphoenolpyruvat (PEP) C O CH3 O C S C O C OH CoA Azetyl-CoA CH3 Laktat © MLach Kommentare bitte an Seite 6 05.09.2003 Regulation der Glykolyse Enzym Aktivator Hexosekinase Phosphofruktokinase ADP/AMP, Fruktose-6-Phosphat, hepatisch: Fruktose2,6-Bisphosphat Glyzerinaldehyd-3phosphatdehydrogenase NAD Pyruvatkinase Fruktose-1,6Bisphosphat + Inhibitor Induktion Repression Glukose-6-Phosphat Insulin Glukagon ATP, Zitrat, Protonen Insulin Glukagon Insulin Glukagon NADH/H + ATP, Zitrat, Alanin, Glukagon: PKA (Phosphorylierung) KH-Mangel, induziert über eine Förderung der Glukoneogenese und Glykogenolyse einen Anstieg des Glukose-6-Phosphatspiegels und damit eine Hexokinase I. Es resultiert daher eine Drosselung der Glykolyse. Hemmung Folgende Mechanismen liegen dem zugrunde: KH-Mangel erhöht den Glukagonspiegel der über die Proteinkinase A Einfluss auf die Pyruvatkinase, Hemmung durch Phosphorylierung, und die PFK2, Aktivierung der Phosphataseaktivität und somit Verminderung des Fruktose-2,6-Bisphosphat nimmt. Mit der Abnahme von Fruktose-2,6-Bisphosphat entfällt der wichtigste allosterische Aktivator der PFK1. Die Phosphorylierung der hepatischen Pyruvatkinase reduziert deren Affinität zum allosterischen Aktivator Fruktose-1,6-Bisphosphat und erhöht im Gegensatz dazu die Affinität zum allosterischen Inhibitor ATP. Im Resultat wird die Aktivität der Pyruvatkinase deutlich reduziert. % & ! erhöhte Lipolyse stellt dem Stoffwechsel vermehrt freie Fettsäuren zur Verfügung. Im Verlauf der hierdurch stimulierten β-Oxidation wird also verstärkt Azetyl-CoA gebildet. Somit resultiert ein Anstieg des Azetyl-CoA-Spiegels. Das Azetyl-CoA wird nun über den Zitratzyklus der Endoxidation zugeführt. Die gesteigerte Endoxidation bedingt einen Anstieg des ATP-Spiegels in den Mitochondrien in dessen Folge die mitochondriale Isozitratdehydrogenase gehemmt wird. Infolgedessen führt die Blockade des Zitratzyklus zu einem Rückstau des mitochondrialen Zitrats der verbunden ist mit einem verstärkten Übertritt von Zitrat in das Zytosol. Im Resultat der erhöhten Endoxidation von Azetyl-CoA steigen somit die zytosolischen Spiegels des Zitrat und des ATP. Während ATP und Zitrat können nun allosterisch hemmend auf die Phosphofruktokinase 1 und die Pyruvatkinase einwirken. Zusätzlich induzieren insulinantagonistischen Glukokortikoide die Genexpression von Schlüsselenzymen der Glukoneogenese. , stimuliert die Glykolyse und hemmt die Glukogeogenese, indem die erhöhte Substratbereitstellung von Fruktose-6-Phosphat und dessen Folgeprodukte insbesondere Fruktose-1,6-Bisphosphat die Pyruvatkinase und Fruktose-2,6Bisphosphat die Phosphofruktokinase 1 aktivieren. '& ( © MLach Kommentare bitte an Seite 7 05.09.2003 Darüber hinaus induziert ein erhöhter Insulinspiegel die Genexpression glykolytischer Enzyme und führt über eine Dephosphorylierung der PFK2 in der Leber zur Aktivierung der Fruktose-6-Phosphat-2-Kinaseaktivität und damit zur Erhöhung des Spiegels von Fruktose-2,6-Bisphosphat. Glukoneogenese Bedeutung Die Glukoneogenese dient der Bereitstellung von Glukose für glukosesensible Organe (Erythrozyten, Gehirn, Nierenmark u.a.) und der Gewährleistung der Homöostase des Blutzuckerspiegels. Darüber hinaus dient die Glukose der Biosynthese von Reserve- und Strukturpolysacchariden sowie von Fruktose in den Samenbläschen und der Laktose in der laktierenden Mamma. Biosynthese Bilanz Ausgehend von Pyruvat kann die Glukoneogenese wie folgt bilanziert werden: 2 Pyruvat + 4 ATP + 2 GTP + 2 NADH + 2 H+ + 6 H2O → Glukose + 4 ADP + 2 GDP + 6 Pan + 2 NAD+ ; G0’ = - 37,7 kJ/mol Die Glukoneogenese ist energieaufwendig und läuft unter Verbrauch von 6 energiereichen Phosphaten und 2 mol NADH/H+ ab. Benötigt werden je 1 Mol ATP für die Reaktion des Pyruvat zu Oxalazetat und 3-Phosphoglyzerat zu 1,3Bisphosphoglyzerat. Die Reaktion von Oxalazetat zu Phosphoenolpyruvat erfordert ein mol GTP das energetisch einem mol ATP äquivalent ist. Lokalisation Zur Glukoneogenese sind nur die Leber als Hauptproduzent sowie die Nieren im Hungerzustand sowie die im beschränkten Umfang die Mukosazellen befähigt. Entscheidend für eine erfolgreiche Glukoneogenese ist das Vorkommen der Schlüsselenzyme der Glukoneogenese die lediglich in der Leber und den Nieren vollständig vorhanden ist. Zu den entscheidenden Enzymen zählen die • Pyruvatkarboxylase • PEP-Karboxykinase • Fruktose-1, 6-bisphosphatase im Zytosol • Glukose-6-Phosphatase am endoplasmatischen Retikulum (Leitenzym(!)). Die o.g. Gewebe verfügen über die genannten Enzyme, im Gegensatz dazu fehlt dem Muskelgewebe die Glukose-6-Phosphatase. Daher bleibt im Muskelgewebe die Glukoneogenese auf der Stufe des Glukose-6-Phosphates stehen und der Muskel kann keine Glukose ins Blut abgeben. Substratbereitstellung : die proximalen Tubuluszellen der Niere bevorzugen für die Glukoneogenese Glutamat und Alanin, deren Abbau gleichzeitig Ammoniak liefert. Stattdessen bevorzugt die Leber hauptsächlich Alanin für die Synthese von Glukose. ( #! ) © MLach Kommentare bitte an Seite 8 05.09.2003 aus den Erythrozyten und der Muskulatur wird über den Cori-Zyklus der Leber zur Glukoneogenese zugeführt. * " : als das Bindeglied zwischen Laktat, Alanin und Oxalazetat des TCC. als Intermediate des Zitratzyklus werden über Oxalazetat der Glukoneogenese zugeführt. & ) wird bei der Lipolyse im Fettgewebe frei. Da die Adipozyten keine Glyzerolkinase besitzen tritt das Glyzerol in das Blut über und wird von den Hepatozyten daraus extrahiert. Diese können das Glyzerol über eine Dehydrogenasereaktion zu Glyzerinaldehyd oxidieren und nach Phosphorylierung mittels Glyzerinaldehydkinase als Glyzerinaldehyd-3-phosphat in den Syntheseweg der Glukoneogenese einschleusen. die im Zuge der β-Oxidation zu Azetyl-CoA abgebaut werden können nicht zur Glukoneogenese beitragen. Eine Ausnahme stellt das bei der β-Oxidation ungeradzahliger Fettsäuren entstehende Propinyl-CoA dar. Das nach Karboxylierung durch die Propinat-Kaboxylase und Umlagerung des entstandenen Methyl-MalonylCoA zu Succinyl-CoA über den Zitatzyklus seinen Eingang in die Glukoneogenese findet. ) Cori- und Alaninzyklus Für die Versorgung mit den glukogenen Substraten Laktat und Alanin die in der Peripherie gebildet werden kommen zwei Kreisläufe des Cori-Zyklus (Laktat-Zyklus ) und der Alanin-Zyklus zum Einsatz. Im Laktatzyklus wird das im Muskel bei verstärkter Arbeit unter anaeroben Bedingungen produzierte Laktat der Leber zur Glukoneogenese zugeführt, die ihrerseits Glukose für die anaerobe Glykolyse liefert. Analog dient der Alaninzyklus dem Transport von Pyruvat und Stickstoff zur Leber. In der Peripherie des Körpers fungiert Pyruvat als Akzeptor von Aminogruppen, die im Aminosäurestoffwechsel durch Transaminierungen desaminiert werden. In der Leber wird der überschüssige Aminostickstoff nach Desaminierung des Alanins als Harnstoffoff eliminiert. Das zurückbleibende Pyruvat dient dann der unter anderem der Glukoneogenese. Glukose Laktat Laktat Cori-Zyklus NAD+ NAD+ NADH/H+ NADH/H+ Glukoneogense Pyruvat Pyruvat Glykolyse NH3+ Harnstoffsynthese Leber NH3+ Alaninzyklus Alanin Alanin Blut Muskel © MLach Kommentare bitte an Seite 9 05.09.2003 Schlüsselenzyme " & ist ein biotinabhängiges Enzym das Azetyl-CoA als allosterischen Aktivator benötigt (Regulation von V-Typ). Die Aktivierung durch Azetyl-CoA dient als wichtiger physiologischer Regulationsmechanismus der PEP-Karboxylase. Für die Karboxylierung des Pyruvats ist zusätzlich ATP notwendig. ATP dient als Energielieferant für die Anlagerung des CO2 an das Koenzym Biotin. Mn2+ Oxalazetat + ADP + Pi + 2 H+ Pyruvat + CO2 + ATP + H2O Die Reaktion der PEP-Karboxylase dient zudem als anaplerotische Reaktion im Zitratzyklus zur Auffüllung mit Oxalazetat wenn dessen Intermediate für Biosynthesen abgezweigt werden. Die PEP-Karboxylase ist in den Mitochondrien, in der Leber zusätzlich im Zytosol (1:1) lokalisiert. Gehemmt wird die Pyruvatkarboxylase durch einen hohen ADPBestand in der Zelle. Das mitochondriale synthestisierte Oxalazetat kann die innere Mitochondrienmembran nicht passieren. Daher erfolgt zunächst eine Hydrierung des OAA zu Malat, welches dann als Transportform des Oxalazetats über den Malatshuttle/Dikarboxylatcarrier in das Zytosol transferiert wird. Im Zytosol erfolgt eine Rückbildung des Oxalazetats durch NAD+-abhängiger Oxidation des Malats. Das hierfür verantwortliche Enzym ist die zytosolischen Malatdehydrogenase. Zytosol O C O O NAD+ C O NADH/H+ C O C OH CH2 CH2 C O O Malat C O O Oxalazetat Malatshuttle Mitochodrium O O C O C O ADP; Pi C O ATP C O CH2 CH3 C CO2 Pyruvat O O Oxalazetat NADH/H+ O C O NAD+ C OH CH2 C O O Malat + & ein zytosolisches Enzym, das Oxalazetat unter GTP-Verbrauch zu Phosphoenolpyruvat dekarboxyliert. Diese Reaktion verläuft stets in Richtung der PEP-Bildung, da das Enzym nur eine geringe Affinität zum Kohlendioxid hat und darum schlecht fixieren kann. Somit wird das Reaktionsgleichgewicht in Richtung PEP-Bildung verlagert. Ein erhöhter ADP-Bestand in der Zelle hemmt die PEPKarboxykinase. Oxalazetat + GTP PEP + C2O + GDP © MLach Kommentare bitte an Seite 10 05.09.2003 unterliegt der allosterischen Regulation durch Fruktose-2,6-bisphosphat. Ein Anstieg dieses Metaboliten ist ein Indikator für einen ausreichenden Glukosebestand in den Zellen, daher hemmt Fruktose-2,6bisphosphat die Fruktose-1,6-bisphosphatase. Des Weiteren hemmt ein hoher AMP-Spiegel die Fruktose-1,6-Bisphosphatase. Ein hoher zytosolischer Zitratspiegel als Zeichen eines hohen Substratangebotes in der Zelle aktiviert die Fruktose-1,6Bisphosphatase, dient somit einer verstärkten Glukose-6-Phosphatsynthese und der Glukoneogenese. , - Fruktose-1,6-bisphosphat + H2O Fruktose-6-Phosphat + Pi katalysiert den letzten Schritt der Glukoneogenese bei dem die Freisetzung von Glukose vollzogen wird. Lediglich die Leber, der Darm un die Nieren verfügen über Glukose-6-phosphatase und sind damit zur Glukoseabgabe an das Blut befähigt. Die Glukose-6-phosphatase ist ein membranständiges Enzym, das so in die Membran des glatten endoplasmatischen Retikulums integriert, dass das katalytische Zentrum ins Lumen des ER orientiert ist. Hierdurch ist es erforderlich, dass Glukose-6-Phosphat über einen Transporter in das Lumen des ER aufgenommen und die Spaltprodukte Glukose und Pi aus dem Lumen transportiert werden müssen. Der hierzu benötigte Glukosetransporter ist identisch mit dem Transporter der Zellmembran. Die zytosolische Seite der Glukose-6-Phosphatase wird durch ein Ca2+-bindendes Protein stabilisiert. © MLach Kommentare bitte an Seite 11 05.09.2003 Reaktionsfolge Glukoneogenese O O C C O Oxalazetat wird über die zytosolische PEP-Karboxykinase unter GTP-Verbauch zu Phosphoenolpyruvat (PEP) dekarboxyliert. CH2 C O O GTP CO2 PEP-Karboxykinase GDP CH2 O3P O C C O O H2O O O C O HC OH O C Umkehr des glykolytischen Enolase- und Mutasereaktion zur Synthese des 3-Phosphoglyzerats aus Phosphoenolpyruvat HC O PO3 H2C O PO3 H2C OH ATP ADP O Phosphorylierung und Reduktion des 3-Phosphoglyzerats zu 3-Phosphoglyzerinaldehyd O PO3 C HC OH H2C O PO3 NADH/H+ NAD++ Pi HC O H2C O PO3 HC OH C O H2C O PO3 H2C OH O3P-OH2C CH2O-PO3 O HO OH OH Fruktose-1,6 Bisphosphatase Pi O3P-OH2C CH2OH Isomerisierung von Fruktose-6-Phosphat zu Glukose-6-Phosphat OH CH2O-PO3 O O OH HO OH OH OH Dephosphorylierung des Fruktose-1,6-Bisphosphates durch die Fruktose-1,6-Bisphosphatase CH2OH O HO OH Isomerisierung der Triosen und Umkehr der glykolytischen Aldoselasereaktion für die Verknüpfung von Dihydroxyazetonphosphat mit 3-Phosphoglyzerinaldehyd zu Fruktose-1,6-Bisphosphat Pi HO Glukose-6-Phosphatase OH OH Glukose-6-Phosphat kann in der Leber, den Nieren und im Darm mittels der dort vorhandenen Glukose-6-Phosphatase zu Glukose dephosphoryliert werden. Regulation Die Glukoneogenese wird gehemmt durch Insulin und gesteigert durch Glukokortikoide, Glukagon u. Adrenalin. ATP begünstigt die Umwandlung von OAA in PEP, ATP-Mangel fördert die Bildung von Zitrat unter Verbrauch von Oxalazetat und Azetyl-CoA. © MLach Kommentare bitte an Seite 12 Zusammenhang zwischen Glykolyse und Glukoneogense 05.09.2003 © MLach Kommentare bitte an Seite 13 05.09.2003