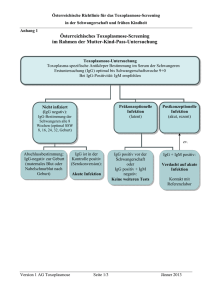
Innovative Assays für eine hohe Testeffizienz
Werbung

Stanze Falz Einstecktasche für Inlays ElecsysT TORCH Diagnostik Innovative Assays für eine hohe Testeffizienz Roche Diagnostics Deutschland GmbH Sandhofer Straße 116 68305 Mannheim Roche Diagnostics (Schweiz) AG Industriestrasse 7 CH-6343 Rotkreuz, ZG www.roche.ch Roche Diagnostics GmbH Engelhorngasse 3 A-1210 Wien www.roche.at COBAS, ELECSYS und LIFE NEEDS ANSWERS sind Marken von Roche. © 2011 Roche Diagnostics. Alle Rechte vorbehalten. www.roche.de 06439730990 ➀ 0511 - U4 U1 Einstecktasche für Inlays Das sichere Fundament für die Therapieentscheidung U2 U3 cobasT modular platform Flexible Konfigurationen für maßgeschneiderte Lösungen Mit der cobasT modular platform (cobasT 4000 und 6000 analyzer series und cobasT 8000 modular analyzer series) hat Roche ein auf gemeinsamer Architektur beruhendes Plattformkonzept entwickelt, das maßgeschneiderte Lösungen für verschiedenste Auslastungs- und Testszenarien ermöglicht. cobasT modular platform ist darauf ausgelegt die Komplexität im Laborbetrieb zu reduzieren und effiziente und kompatible Lösungen für eine vernetzte Zusammenarbeit zu liefern. cobasT 8000 modular analyzer series Großes Volumen <c 502> <e 602> <c 701> cobasT 6000 analyzer series Mittleres Volumen <c 501> 4 38 Konfigurationen <c 702> 7 Konfigurationen <e 601> cobasT 4000 analyzer series Kleines Volumen <c 311> Flexible und intelligente Lösungen • Multiple Konfigurationen mit maßgeschneiderten Lösungen für höhere Effizienz und Produktivität • Konsolidierung der klinischen Chemie und Immunchemie mit mehr als 200 Parametern zur Optimierung von Kosten und Workflow • Zukunftssicherheit durch einfache Anpassung an geänderte Durchsatz- und Parameteranforderungen • Konsistenter Umgang mit Hardware, Software und Reagenzien für weniger Schulungsaufwand und hohe Mitarbeiterflexibilität • Konsistente Patientenresultate durch ein universelles Reagen­ zienkonzept <e 411> 3 Konfigurationen Pränatale und perinatale TORCH Diagnostik 1 Unter der im Jahr 1971 von Nahmias et al. eingeführten Abkürzung TORCH sind Pathogene zusammengefasst, die gefährliche Infektionen bei Neu- und Ungeborernen verursachen. Die Liste beinhaltet die Erreger Toxoplasma und Rubella, das Cytomegalievirus (CMV), sowie das Herpes Simplex Virus (HSV) und ist aufgrund ihrer Unvollständigkeit inzwischen nicht mehr zeitgemäß. Heute werden daher zahlreiche weitere Infektionen unter dem Begriff TORCH angeführt: • Toxoplasmose • Other (andere): Treponema pallidum (Syphilis), Hepatitis B, Hepatitis E, Coxsackie Virus, Eppstein-Barr Virus (EBV), Parvovirus B19, Varizella-Zoster Virus uvm. • Rubella • Cytomegalievirus (CMV) • Herpes Simplex Virus (HSV) Obwohl es sich teilweise um chronische Infektionen handelt, verlaufen sie bei ansonsten gesunden Erwachsenen in der Regel asymptomatisch. Bei Müttern besteht im Fall einer Primärinfektion während der Schwangerschaft jedoch ein hohes Übertragungs­ risiko auf den Embryo, häufig mit verheerenden Auswirkungen für das ungeborene Kind. Im Fall von Sekundär- oder reaktivierten Infektionen ist das entsprechende Risiko jedoch als gering anzusehen. In der heutigen Klinik ist TORCH-Screening ein vielfach angefordertes Testspektrum zur Untersuchung von Säuglingen und schwangeren Frauen auf kongenitale, perinatale und neonatale Infektionen. Hierbei bestimmen die Krankengeschichte der Patien­ tin, beson­dere Risikofaktoren, sowie nationale Bestimmungen die diagnostische Vorgehensweise. Hauptsächlich erfolgen die Tests während des ersten Schwangerschaftstrimesters, können bei Verdacht jedoch auch an Neugeborenen durchgeführt werden. Im Fall der meisten TORCH-Pathogene basiert das anfängliche Screening auf dem Nachweis spezifischer Antikörper. Ziel der TORCH-Diag­nostik ist die Bestimmung des Immunstatus der Mutter, um eine Unterscheidung zwischen akuten und vergangenen Infektionen während der Schwangerschaft zu ermöglichen. Anamnese und pränatales Screening spielen eine wichtige Rolle bei der Vermeidung vertikal übertragener Infektionen. Heute sind zahlreiche sensitive und spezifische kommerzielle Tests zur serologischen Diagnose dieser Erkrankungen erhältlich. Die Hauptherausforderung in der Serodiagnostik besteht jedoch in der Kombination einer hohen Sensitivität und Spezifität, zweier essenziell gegensätzlicher Eigenschaften. Für eine hohe Sensitivität sind ein früher Infektionsnachweis, sowie die Erkennung aller pathogenen Varianten unerlässlich. Andererseits wird eine hohe Spezifität zur Vermeidung von Unsicherheiten und bestätigender Nachtests benötigt. 5 Der Parasit Toxoplasma gondii 2 –12 Toxoplasma gondii ist ein ubiquitärer intrazellulärer Parasit, von dem nahezu alle warmblütigen Wirbeltiere betroffen sein können. Gewöhnlich führen Infektionen zu einer lebenslangen Persistenz der Protozoen in Muskel- und Nervengeweben. Groben Schätz­ ungen zufolge sind 25 – 50 % der Weltbevölkerung Träger des Parasiten, wobei jedoch gravierende geographische und regionale Unterschiede bestehen. Typische Infektionsquellen sind der Verzehr halb- oder ungegarten Fleisches, sowie die Aufnahme freier Sporen, die üblicherweise von Katzen in die Umgebung abgegeben werden. Typische Symptome einer akuten Infektion sind in ansonsten gesunden Personen eine unspezifische Serokonversionskrankheit, sowie in seltenen Fällen intensiver Kopfschmerz, Lymphadenopathie und Muskelschmerzen. Immungeschwächte Patienten erleiden jedoch deutlich schwerere oder gar tödliche Krankheitsverläufe. In der großen Mehrheit aller Fälle verläuft eine chronische Erkrankung subjektiv asymptomatisch. Allerdings verdichten sich Hinweise dafür, dass zerebrale Toxoplasmazysten im betroffenen Individuum zu Verhaltens- und weiteren Veränderungen führen können. Die von Toxoplasma ausgehende Hauptgefahr besteht in der vertikalen Übertragung des Erregers durch eine schwangere Frau mit Primärinfektion. 5 –10 % derartiger Schwangerschaften enden in einem Spontanabort weitere 8 – 10 % führen zur Geburt eines Kindes mit schweren Augen- und /oder Hirnschädigungen und 10 –13 % der überlebensfähigen Neugeborenen weisen Sehbehinderungen auf. Auch bei augenscheinlich symptomfrei geborenen Kindern kann es weiterhin zu Chorioretinitis oder einer mentalen Retardierung im Kindes- oder jungen Erwachsenenalter kommen. Die Inzidenz der primären Toxoplasmose während der Schwangerschaft beträgt in Westeuropa ungefähr 0,5 – 0,6 %, und ist somit deutlich höher als beispielsweise die Inzidenz des kongenitalen Hypothyreoidismus, welcher in 0,02 – 0,03 % aller überlebensfähigen Neugeborenen auftritt. Aus diesen Gründen ist ein Screening vor Schwangerschaft oder Geburt in vielen Ländern und weiten Teilen der Bevölkerung wünschenswert oder gar verpflichtend. Toxoplasmosescreenings basieren auf dem Nachweis der serologischen Marker Toxoplasma IgG und IgM. Im Gegensatz zu anderen Infektionen können IgM Antikörper bei chronischem Verlauf lange Zeit im Körper persistieren, was eine Diagnose bedeutend verkompliziert und möglicherweise Zusatzuntersuchungen notwendig macht. Obwohl diagnostische Strategien sich regional, und sogar lokal unterscheiden, ist ein wie unten gezeigter Algorithmus plausibel. Mit der Untersuchung und bei Indikation auch Überwachung der Schwangeren Patientin sollte angesichts der verfügbaren therapeutischen Möglichkeiten so früh wie möglich begonnen werden. Start Durchführung Toxo IgG/IgM Test IgG neg. IgM neg. IgG pos. IgM neg. IgG neg. IgM pos. IgG pos. IgM pos. grenz­ wertig/ gering Keine Immunität Erworbene Immunität Vermeidung einer Primärinfektion Vergangene Infektion wahrscheinlich Beginnende Infektion unspezifische IgM Toxo IgG Avidität Erneuter IgG Test nach 3 Wochen stabil Erneuter Test während der Schwangerschaft Start Toxo IgG Titer Erneuter Test nach 3 Wochen Ende Infektion 2 Monate vor 1. Probe Start Bild 1: Empfohlener Algorithmus zur serologischen Toxoplasma gondii Diagnostik bei immunkompetenten Patienten 2, 8 6 hoch Infektion vor 4 Monaten Erhöhung (2 – 4 fach) Aktuelle Infektion 2 Monate vor 1. Probe Evtl. weitere Schritte notwendig Der empfohlene Screeningprozess beginnt mit dem Nachweis spezifischer Toxoplasma IgG und IgM Antikörper, sodass prinzi­ piell vier mögliche Markerkonstellationen vorliegen können: IgG negativ, IgM negativ Eine solche Konstellation wird in Toxoplasma-naïven Patienten beobachtet. Diese Frauen hatten bislang keinen Kontakt mit Toxoplasma und haben daher keine erworbene Immunität. Da noch jeder Kontakt mit dem Pathogen zu einer Primärinfektion führen kann, benötigen sie besondere medizinische Betreuung und Beratung. Regelmäßige Toxoplasma-Tests werden empfohlen. Der Verzehr von halb- oder ungegartem Fleisch sollte unterlassen, und Katzen, Katzenstreu, sowie Hunde gemieden werden. Allgemeine Hygienemaßnamen sollten strikt befolgt, und der Verzehr von Früchten, Gemüse oder Salat in ungewaschener Form vermieden werden. IgG positiv, IgM negativ Diese Frauen waren in der Vergangenheit mit Toxoplasma in Kontakt und sind nun vermutlich Trägerinnen nicht-proliferierender Zysten. Aufgrund ihrer erworbenen Immunität ist die Wahrscheinlichkeit für eine vertikale Übertragung und embryonale Folgeschäden marginal, wenn nicht gar vernachlässigbar. IgG positiv, IgM positiv Dies ist das interpretativ schwierigste Resultat. Zur Vermeidung falscher Annahmen durch persistierende oder unspezifische IgM wird an dieser Stelle ein IgG Aviditätstest empfohlen. Bei hoher Avidität fand eine Infektion vor mehr als 4 Monaten statt. Der Nachweis von IgM-Antikörpern kann in diesem Fall ver­ mutlich durch persistierende IgM oder eine unspezifische Stimulation des Immunsystems erklärt werden. Ist die Avidität gering oder im Grenzbereich, besteht ein Risiko für den Fötus. Ein zusätzlicher quantitativer IgG Test an einer drei Wochen nach dem ersten Test entnommenen Probe kann die weitere Behandlungsplanung erleichtern. Im Fall eines stabilen IgG Titers liegt die Infektion mehr als 2 Monate vor der ersten Probenahme zurück. Wird jedoch ein merklicher Anstieg des IgG Titers gemessen, so ist möglicherweise von einer weniger als 2 Monaten alten Infektion auszugehen, was einer großen Gefahr für den Fötus entspricht. IgG negativ, IgM positiv Zwei mögliche Szenarien führen zu dieser Konstellation: 1. Eine aufkommende Infektion vor der IgG Serokonversion 2. Unspezifisches IgM Eine solche Situation wird durch Wiederholung der Tests mit frischen Proben nach ca. 3 Wochen geklärt. Im Fall von unspezifischem IgM sollten sich die Ergebnisse nicht von der ersten Probe unterscheiden. Im Fall einer aufkommenden Infektion sollte IgG zu diesem Zeitpunkt detektierbar sein. 7 Rubellavirus 13 – 32 Virologie Das Rubellavirus ist die einzige bekannte Rubivirus-Spezies und gehört zur Familie der Togaviridae. Das RNA-Genom des Rubella­ virus kodiert für 2 nicht-strukturelle und 3 strukturelle Proteine: Das Kapsidprotein C, sowie die beiden Hüllproteine E1 und E2. Sein pathogener Mechanismus ist noch nicht vollständig verstanden, jedoch gibt es Indizien für einen p53-abhängigen Prozess. Nach Replikation und Translation werden neue Viruspartikel assembliert und verlassen die Wirtszelle durch Knospung. Übertragung Postnatal wird das Virus durch die Luft übertragen. Es gibt keinen Trägerstatus; das Reservoir besteht aus Infizierten, die das Virus durch Tröpfchen aus den oberen Atemwegen verbreiten. Ein Patient ist ca. 1 Woche vor Beginn bis 1 Woche nach Ende der symptomatischen Phase infektiös. Pränatal kann das Virus von einer schwangeren Frau mit Primärinfektion durch die Plazenta an den Fötus weitergegeben werden (vertikale Übertragung). Nosographie Röteln (Rubella) sind die durch das Rubellavirus verursachte Erkrankung. Es handelt sich um eine typische Kindheitsinfektion, die üblicherweise mild oder gar subklinisch verläuft. Normalerweise erfolgt eine Erholung bei Kindern binnen 1 – 3 Tagen. Bei Erwachsenen verläuft die Erkrankung jedoch häufig mit einer deutlich ausgeprägteren und möglicherweise längeranhaltenden Symptomatik, auch wenn diese in ansonsten gesunden Patienten selbstbegrenzend ist. Pränatale Übertragung des Rubellavirus Nach einer Inkubationszeit von 2 – 3 Wochen, in denen der Patient infektiös ist, kommt es zur Entwicklung der typischen Exantheme im Gesicht, die sich von dort auf Rumpf und Gliedmaßen ausbreiten. Üblicherweise gehen Ausschlag und Juckreiz nach 1 – 2 Tagen zurück. Im Gegensatz dazu ist eine Primärinfektion in der ersten Schwanger­ schaftshälfte mit anschließender vertikaler Übertragung des Virus ein ausgesprochen ernstzunehmendes Ereignis, welches häufig eine Fehlgeburt oder das kongenitale Röteln­syndrom nach sich zieht (engl.: congenital rubella sydrome, CRS). Andere Symptome sind leichtes Fieber (selten über 38°C), suboccipitale und posteriore zervicale Lymphadenopathie, Gelenk- 8 schmerzen (bei Erwachsenen häufig verzögert), Kopfschmerz, sowie Konjunktivitis. In ca. 20 % aller Fälle bilden sich kleine, rote Papeln auf dem Gaumensegel (Forchheimersche Flecken). Die Vertikale Übertragung des Rubellavirus ist ein ernstes Ereignis mit häufig katastrophalen Folgen für den Fötus, die bei einer früh im Schwangerschaftsverlauf auftretenden Infektion deutlich stärker ausgeprägt sind. Nach Überwindung der Plazenta kommt es zu einer Infektion des Fötus, in dem das Virus die Entwicklung von Zellen verhindert oder zu ihrer Zerstörung führt. Zahlreiche Frauen, die im ersten Schwangerschaftstrimester an Röteln erkranken, erleiden eine Fehl- oder Totgeburt. Es kommt häufig zu Frühgeburten, meist mit geringem Geburtsgewicht. Überlebt ein infiziertes Kind die Geburtsschwelle, entwickelt es möglicherweise das kongenitale Rötelnsyndrom (CRS), welches zu Blindheit, Taubheit und Herzversagen führt. Letzteres ist am häufigsten auf einen persistierenden Ductus arteriosus zurückzuführen. Des weiteren kann eine pränatale Rubellainfektion zu Hirndefekten, neonataler Thrombozytopenie, Anemie, Hepatitis, sowie zu Hautstörungen, den sogenannten „Blueberry MuffinLäsionen“ führen. Behandlung Für Röteln steht keine Behandlung zur Verfügung. Therapeutische Maßnahmen verfolgen daher eine Linderung der mit der Erkrankung einhergehenden Unannehmlichkeiten. Bei Neugeborenen mit pränatalen Röteln werden schwere Manifestationen behandelt, falls möglich. Beispielsweise können bei Katarakten und kogenitalem Herzversagen oft chirurgische Mittel angewandt werden. Prävention Gegen das Rubellavirus steht ein effektiver Impfstoff zur Verfügung, welcher heute üblicherweise im Zuge der MMR-Impfung verabreicht wird. Jede Frau im gebärfähigen Alter sollte immun gegen das Virus sein, ob durch vergangene Infektion oder Impfung. In Ländern, in denen eine Rubella-Impfung üblich ist, konnten Epidemien wirkungsvoll ausgeschaltet werden. Ein gelegentliches Aufflammen des Virus ist auf Migration aus Ländern ohne organisierte Impfprogramme zurückzuführen. Trotzdem besteht in manchen Europäischen Ländern bei einigen Eltern Widerstand gegen das Impfen von Kindern, einschließlich der MMR-Impfung. Virus im Blut IgG Virus im Mundabstrich IgM 1024 64 100 32 16 50 8 Antikörper-Titer Isolierte Virusmenge [%] Ausschlag 4 0 8 6 4 2 1 Tage vor Beginn des Ausschlags 1 2 4 6 8 10 12 Tage nach Beginn des Ausschlags 14 1 2 Monate 1 2 3 10 0 Jahre Bild 2: Serologisches Profil nach einer Rubella-Infektion. Thomas L., Laboratory and diagnosis. Frankfurt: TH-Books 2009. Diagnose Kurz nach der Infektion beginnt die Proliferation des Virus in den oberen Atemwegen. Während dieser Phase sind Patienten infektiös und das Virus im Blut detektierbar. Ungefähr 2 – 3 Wochen nach Infektion kommt es zur Bildung der typischen Exantheme, gefolgt von einer schnellen Eliminierung der Viruslast und der Entwicklung spezifischer IgM und IgG Titer. Im Laufe der Genesung wird IgM üblicherweise vollständig eliminiert, kann jedoch auch für einige Monate persistieren. IgG bleibt gewöhnlich lebenslang erhöht und schützt vor Zweitinfektionen. IgG positiv, IgM negativ 1.Ein deutlicher IgG-Titer ohne jegliche weitere Indikatoren für Rubella weist auf eine Immunität durch eine vergangene Infektion oder Impfung hin. 2.Ein grenzwertiger IgG-Titer könnte auf die Serokonversion in einer sehr frühen Infektionsphase hinweisen, in der IgM noch nicht detektierbar ist. Im Fall einer Schwangerschaft sollte der IgG-Test einige Wochen später an einer frischen Probe wiederholt werden. IgG negativ, IgM negativ 1.Die Patientin kam bisher nicht mit dem Rubellavirus in Kontakt. Frauen sind während der Schwangerschaft der Gefahr einer Primärinfektion ausgesetzt. Besteht noch keine Schwanger­ schaft, sollte nun eine Impfung erfolgen, andernfalls ist eine enge Überwachung notwendig. 2.Die Patientin befindet sich in der Inkubationszeit vor der Serokonversion. Bei Indikation kann in dieser Zeit das Virus mittels PCR direkt im Blut detektiert werden. Ansonsten werden Serokonversion und Symptome binnen weniger Wochen auftreten. IgG negativ, IgM positiv 1.Die Patientin befindet sich in den sehr frühen Phasen der Infektion, in denen es zu einer IgM-, aber noch nicht zu einer IgGAntwort gekommen ist. Im Fall einer Schwangerschaft sollte der Test einige Wochen später an einer frischen Probe wiederholt werden. 2.Es könnte sich um ein unspezifisches IgM-Resultat handeln. Auch hier kann der Befund nach einigen Wochen durch eine Testwiederholung an einer frischen Probe geklärt werden. IgG positiv, IgM positiv 1.Die Patientin leidet an einer aktuten Infektion, insbesondere mit vorhergehenden klinischen Anzeichen. Der serologische Befund kann mittels eines Rubella-IgG-Aviditätstest bestätigt werden. Tritt diese Konstellation während der Schwangerschaft auf, besteht für den Fötus ein Risiko. Zum Nachweis einer fetalen Infektion kann das Virus mittels PCR an Nabelschnurblut bestätigt werden (Cordozentese). 2.Ohne vorhergehende klinische Anzeichen kann der Befund möglicherweise auch durch unspezifisches IgM erklärt werden. Zur Klärung dieses Verdachtes kann ein IgG Aviditätstest durchgeführt werden. 9 Cytomegalievirus (CMV) 33 – 43 Das Cytomegalievirus (CMV), auch bekannt als Humanes Herpesvirus 5 (HHV 5) gehört zur Familie der Herpesviren. Es ist weltweit eines der meistverbreitesten Viren mit einer regional variierenden Trägerprävalenz zwischen 40 und nahezu 100 %. CMV wird parenteral durch Körperflüssigkeiten, Bluttransfusionen oder Organtransplantation übertragen. Eine horizontale Übertragung setzt engen intimen Kontakt voraus. CMV kann sexuell, vertikal und perinatal übertragen werden und ist in Industrieländern die meistverbreiteste virale Ursache für Geburtsdefekte. Wie alle Herpesviren kann CMV über lange Zeiträume latent im Körper persistieren und rezidiv wieder auftreten. In ansonsten gesunden Menschen verläuft die Infektion üblicherweise ohne subjektive Symptome oder mit einer milden Serokonversionskrankheit. Halsschmerzen sind verbreitet, wohingegen wenige Patienten auffälligere Symptome wie eine infektiöse Mononukleose, drüsenfieberartiges Syndrom, andauerndes Fieber, oder gar eine leichte Hepatitis aufweisen. Aktuelle Forschungsergebnisse enthüllen hingegen eine neue pathogene Seite von CMV: Infizierte Leberzellen scheinen Renin zu produzieren, das direkt mit dem RAA-System interferiert und somit zu Bluthochdruck beitragen kann. Andere Autoren weisen darauf hin, dass eine CMV-Infektion der Endothelzellen in Blutgefäßen einen Hauptgrund für Arteriosklerose darstellen kann. In immunsupprimierten Patienten haben eine Primärinfektion mit CMV oder eine Reaktivierung weitaus aggressivere Konsequenzen. Die dramatischsten Konsequenzen können sich jedoch im Zuge der Primärinfektion einer schwangeren Frau durch vertikale Übertragung des Virus an das ungeborene Kind ergeben. • Geringes Geburtsgewicht • Mikroenzephalie • Epilepsie • Petechialer Hautausschlag • Milde Hepatosplenomegalie • Ikterus Ein tödlicher Ausgang ist möglich, allerdings überleben die meisten Embryonen eine kongenitale Infektion durch eine unterstützende Therapie nach heutigem Stand. Dennoch wird es bei 80 – 90 % dieser Fälle zu späteren Komplikationen wie Haarausfall, Sehbehinderungen, sowie verschieden starken geistigen Beeinträchtigungen kommen. Es besteht eine signifikante Morbidität. Weitere 5 – 10 % der infizierten, bei der Geburt jedoch symptomfreien Säuglinge, werden im Anschluss Gehör- oder geistige Behinderungen, sowie Kordinationsstörungen von unterschiedlich starker Ausprägung entwickeln. Eine perinatale oder enterale Übertragung durch Stillen führt im Normalfall wenn überhaupt nur zu einer milden Erkrankung des Säuglings. Eine aktive Impfung steht nicht zur Verfügung. Zur Unterstützung von Patienten mit schweren Symp­tomen wird hauptsächlich ein CMV-spezifisches Hyperglobulin eingesetzt. Allerdings macht der typischerweise milde Verlauf der Erkrankung keine spezielle Behandlung Start Durchführung CMV IgG / IgM Tests IgG neg. IgM neg. IgG neg. IgM pos. IgG pos. IgM neg. IgG pos. IgM pos. 20 Wochen IgG Avidität gering bis grenzwertig Hohes gering bis grenzwertig Übertragungsrisiko hoch Gestationsalter 20 Wochen IgG Avidität hoch Keine Immunität Beginnende Infektion Vermeidung einer Primärinfektion Erworbene Immunität Vergangene Infektion wahrscheinlich Erneuter Test während der Schwangerschaft Start Erneuter Test nach 3 Wochen Rückfall möglich Möglicherweise zusätzliche Tests Maternale Virämie • Virusisolation • Blut PCR Fetale Gesundheit • Ultraschall • MRT Invasive Tests • Amniozentese • Cordozentese Stop Bild 3: Empfohlener Algorithmus zur serologischen CMV Diagnostik bei immunkompetenten Patienten 39 – 42 10 IgG neg. IgM neg. Verwendung von Proben des 1. Trimesters IgG pos. / IgM pos. Geringe Avidität IgG pos. IgM neg. IgG neg. IgM pos. Keine Primärinfektion geringes Übertragungsrisiko IgG pos. / IgM pos. Hohe Avidität Stop notwendig. Bei immunsupprimierten Patienten kann der Versuch einer antiviralen Therapie unternommen werden. Im Fall einer Schwangerschaft ist eine derartige Behandlung jedoch strikt kontraindiziert. Die anfängliche Labordiagnose einer CMV-Infektion, ob im Screeningrahmen oder bei konkretem Verdacht, basiert auf dem Nachweis spezifischer IgG und IgM Antikörper gegen das Virus. Hierbei kann das Alter der Infektion durch IgG-Aviditätstests abgeschätzt werden. IgM ist für diesen Zweck nicht immer ausreichend, da im Fall einer nicht-akuten Infektion nach Rezidivierung oder Reinfektion, sowie nach unspezifischer Immunstimulation auch persistierende IgM vorliegen können. Bestätigt wird mittels Nukleinsäuretests, im Fall des pränatalen Screenings an fetalem Gewebe (Blut oder Plazenta). Zur Schwangerschaftsüberwachung steht kein einhellig akzeptierter Screening-Algorithmus zur Verfügung. Der im Bild 3 präsentierte Algorithmus stellt jedoch mit Sicherheit die beste Lösung dar und deckt alle oben erwähnten Aspekte ab. IgG negativ, IgM negativ Die Konstellation wird in CMV-naïven Patienten beobachtet. Diese Frauen kamen in der Vergangenheit nicht mit CMV in Kontakt und besitzen daher keine erworbene Immunität. Sie können nach jedem Kontakt mit dem Pathogen an einer Primärinfektion erkranken und benötigen besondere medizinische Behandlung und Beratung. Wiederholte CMV-Tests sind während der Schwanger­schaft in regulären Abständen empfohlen. Die Einhaltung einer guten Körperhygiene sollte während der gesamten Schwangerschaft beachtet werden. Besonders wichtig ist hierbei gründliches Händewaschen mit Wasser und Seife nach Kontakt mit potenziell infektiösem Material. IgG negativ, IgM positiv Es gibt zwei Szenarien, die zu einer solchen Konstellation führen könnten: 1.Eine aufkommende Infektion, vor der IgG-Serokonversion 2.Unspezifisches IgM IgG positiv, IgM positiv Dies ist das interpretativ schwierigste Resultat. Als nächster Schritt wird nun die IgG-Avidität ermittelt. Abhängig vom entsprechenden Gestationsalter leitet ein solches Resultat nun verschiedene Bestätigungsalgorithmen ein: Liegt bei einem Gestations­ alter von bis zu 20 Wochen eine hohe Avidität vor, nimmt man an, dass die Infektion vor der Empfängnis stattgefunden hat. Dabei wird das anfänglich positive IgM Resultat einer persistierenden Immunreaktion zugeschrieben oder als unspezifisch angesehen. Weitere Messungen sind an dieser Stelle nicht notwendig. Liegt bei einem Gestationsalter von bis zu 20 Wochen eine geringe Avidität vor, so kann die Möglichkeit einer nach Empfängnis stattgefundenen Infektion nicht ausgeschlossen werden. Bestätigende Untersuchungen werden empfohlen. Liegt bei einem Gestationsalter von über 20 Wochen eine geringe oder grenzwertige Avidität vor, ist eine akute Infektion möglich und zusätzliche Untersuchungen werden empfohlen. Wird bei einem Gestationsalter von über 20 Wochen eine hohe IgG Avidität festgestellt, so müssen die CMV-Resultate archivierter Proben des ersten Schwangerschaftstrimesters in den diagnostischen Prozess einbezogen werden. Sind diese Proben mit einer hohen Avidität IgG- und IgM-positiv, kann eine akute Infektion, sowie die Notwendigkeit weiterer Maßnahmen ausgeschlossen werden. Sind die Proben des ersten Schwangerschaftstrimesters IgMnegativ und IgG-positiv, handelt es sich wahrscheinlich um eine nicht-Primärinfektion mit einem geringen Risiko einer vertikalen Übertragung, sodass auch hier keine weiteren Maßnahmen notwendig sind. Bei allen anderen Konstellationen in Proben des ersten Trimesters kann eine akute Infektion nicht ausgeschlossen werden und weitere Untersuchungen werden empfohlen. Geklärt werden kann diese Situation durch eine Wiederholung der Tests an frischen Proben nach ca. 3 Wochen. Im Fall unspezifischem IgMs sollte das Resultat dem der ersten Probe entsprechen. Im Fall einer aufkommenden Infektion sollte IgG zu diesem Zeitpunkt detektierbar sein. IgG positiv, IgM negativ Diese Frauen hatten in der Vergangenheit Kontakt mit CMV und besitzen nun eine erworbene Immunität. Wenn überhaupt existiert nur ein minimales Risiko einer vertikalen Übertragung mit Folgeschäden für den Fötus. Zwar ist eine Rezidivierung möglich, fetale Morbidität ist jedoch äußerst unwahrscheinlich. 11 Herpes Simplex Virus (HSV) 44 – 57 Herpesviren peinigen die Menschheit seit jeher. Die ersten Beweise für Herpesinfektionen gehen bis ins alte Griechenland zurück. ren Geschlechtskrankheiten und Prostituierten deutlich höher ausfielen (55 % bzw. 75 %). Virologie Bis heute wurden ca. 100 verschiedene Herpesviren identifiziert, darunter 8 humanpathogene. Orofaziale Herpesmanifestationen werden in 80 % der Fälle von HSV 1 und in den verbleibenden 20 % der Fälle von HSV 2 verursacht. Bei genitalem Herpes ist die Situation umgekehrt: HSV 1 werden 20 %, und HSV 2 80 % aller Fälle zugeschrieben. Bei Herpes Simplex Virus 1 (HSV 1) und Herpes Simplex Virus 2 (HSV 2) handelt es sich um zwei eng verwandte Viren der Gattung Simplexvirus aus der Familie der Herpesviridae, einer Unterfamilie der Alphaherpesviridae. Diese humanspezifischen Viren besitzen wie alle Herpesviren ein großes, doppelsträngiges DNA-Genom, das für über 100 Genprodukte kodiert. Das ikosaedrische Kapsid liegt eingebettet in ca. 20 verschiedenen Tegumentproteinen vor und ist von einer aus mindestens 10 Proteinen bestehenden Hülle umgeben. Übertragung und Prävalenz Postnatal erfolgt eine Übertragung normalerweise durch engen Kontakt mit virenfreisetzenden Personen. Nicht nur Sekretionen der Bläschen, sondern auch Speichel oder genitale Sekrete können Viren enthalten. Sind sichtbare Symptome vorhanden, besteht eine hohe Wahrscheinlichkeit der Übertragung, die aber auch von symptomfreien Patienten erfolgen kann. HSV 1 wird hauptsächlich durch sozialen Kontakt im Kindesalter, später im Leben jedoch auch sexuell übertragen. Bereits zum Ende der Pubertät werden hohe Seroprävalenzen spezifischer Antikörper beobachtet, welche sich im Erwachsenenalter nur noch leicht erhöhen (Deutschland: 84 – 92 %). HSV 2 wird überlicherweise sexuell durch asymptomatische Freisetzung übertragen. In gesundheitsbewussten Personen wurden Seroprävalenzen spezifischer Antikörper in einer Größenordnung von 3 – 23 % (USA) festgestellt, die jedoch bei Patienten mit ande- 12 Beide Viren können vor der Geburt auch vetikal (selten) oder perinatal bei der Entbindung übertragen werden. Derartige Infektionen können schwere oder gar tödliche Konsequenzen für den Fötus oder das Neugeborene nach sich ziehen. Nosographie Eine Primärinfektion mit HSV geht häufig mit der Ausbildung schmerzhafter wässriger Bläschen einher, aus denen ein infektiöses Exsudat austritt. Typische Infektionsherde sind Mund, Lippen (Herpes labialis) oder Genitalien (Herpes genitalis). Schwere Folge­ erscheinungen von Primärinfektionen sind selten, aber möglich und beinhalten Herpes gladiatorum, Augenherpes, Herpes-Simplex-Enzephalitis, Fazialislähmung und einige weitere Erkrankungen. Nachdem Verheilen der akuten Symptome ist das Virus nicht eliminiert, sondern der Patient wird zum Träger und die Infektion wird latent. Bei HSV 1 und HSV 2 handelt es sich um neurotrope und neuroinvasive Viren, die sich durch Eindringen in Nerven­ zellen vor dem Immunsystem verbergen. Jüngste Erkenntnisse lassen vermuten, dass eine latente HSV 1 Infektion bei bestimmten genetischen Voraussetzungen sogar ein ätiologischer Faktor bei der Enwicklung von Alzheimer sein kann. Viele Träger sind von sporadischen Reaktivierungen betroffen. Bei einem solchen Ausbruch verlassen Viren die Nervenzellen und wandern entlang des Axons zur Haut, wo diese schmerzhafte Bläschen erzeugen. Erfolgt die Übertragung perinatal, kommt es höchstwahrscheinlich zu einer Infektion des Neugeborenen, dessen unentwickeltes Immunsystem nicht in der Lage ist das Virus effektiv zu bekämpfen. Mögliche Folgeerscheinungen sind der Befall von Haut, Augen und Mund, Herpes-Simplex-Enzephalitis, Pneumonitis, Keratitis und andere Störungen mit möglicherweise tödlichem Ausgang oder irreversibler Morbidität. Das Übertragungsrisiko liegt im Falle einer häufig asymptomatisch verlaufenden maternalen Primärinfektion im Bereich von 20 – 30 %, im Falle von Rezidivierung bei 2 %. Eine pränatale (intrauterine) Infektion des Embryos ist ein vergleichsweise seltenes Ereignis, das jedoch schwere Folgen haben kann, wie ein hohes Risiko eines spontanen Schwangerschaftsabbruchs, intrauterine Wachstumsretardation, Frühgeburt, fetale Schädigung, lokal-disseminierte neurologische Morbidität, intra­ vaskuläre Koagulopathie und viele andere. Generell ist die aus einer HSV 2 Infektion folgende Morbidität höher als nach einer HSV 1 Infektion. In immunsupprimierten Patienten ist nach einer Herpes Simplex Infektion grundsätzlich von schweren Krankheitsfolgen auszu­ gehen. Diagnose Bei ansonsten gesunden Erwachsenen wird üblicherweise unter klinischen Gesichtspunkten diagnostiziert. Anspruchsvollere Prozeduren, wie die direkte Virusdetektion, Genotypisierung, sowie die serologische Demonstration spezifischer Antikörper sind eher bei immunsupprimierten Patienten indiziert oder dem Gebiet der Obstetrik zugeordnet. eines bestehenden HSV 2 IgG-Titers über einen Kaiserschnitt entscheiden muss. Die Detektion spezifischer IgM Antikörper hat aktuell keine klinische Relevanz. Primärinfektionen können ohne unmittelbare IgM Antwort veraufen, wobei jedoch ein IgM-Titer nicht notwendigerweise eine Primärinfektion nachweist. IgM Antikörper gegen HSV persistieren möglicherweise für Monate oder Jahre und können bei Reaktivierung wieder auftreten. Prophylaxe Derzeit steht kein Impfstoff zur Verfügung. Eine Verhinderung der Übertragung von HSV 1 durch soziale Kontakte in der Kindheit ist nicht realistisch. Die sexuelle Übertragung von HSV kann nur durch Vermeidung aller Hautkontakte verhindert werden. Durch Verwendung von Barrieremethoden wird die Übertragungswahrscheinlichkeit zwar reduziert, jedoch nicht eliminiert. Wie bei allen sexuell übertragbaren Erkrankungen wird die Verwendung von Kondomen in nicht-monogamen Beziehungen empfohlen. Auch die Verwendung antiviraler Medikamente trägt zu einer Verringerung des Übertragungsrisikos bei. Behandlung Derzeit steht keine kurative Behandlung gegen Herpesinfektionen zur Verfügung. Eine Reihe antiviraler Wirkstoffe (topisch und atopisch) kann jedoch zur Linderung der klinischen Konsequenzen einer Virusreaktivierung eingesetzt werden. Die Verabreichung von Virostatika ab der 36. Gestationswoche reduziert das Risiko einer Virenfreisetzung bei der Entbindung. Die Serokonversion von HSV 1 oder 2 IgG während der Schwangerschaft birgt das Risiko einer vertikalen Übertragung. Bei Genital­herpesbläschen zum Zeitpunkt der Entbindung ist ein Kaiserschnitt empfehlenswert. Allerdings ist auch eine asymptomatische Virusfreisetzung möglich, sodass der Geburtshelfer auf Basis 13 Syphilis 58 – 69 Krankheitsstadien der Syphilis Bei Erwachsenen verläuft Syphilis in drei Stadien (primäre, sekundäre, tertiäre Syphilis), zwischen denen Latenzphasen unterschiedlicher Länge liegen. Man sagt, dass bei seiner Rückkehr von den Westindischen Inseln Columbus einen blinden Passagier an Bord hatte: Treponema pallidum pallidum. Seither kam es zu einer weltweiten Ausbreitung von Syphilis, die die Menschheit geplagt und Opfer gefordert hat. Zwar konnte das Aufkommen der Antibiotika Abhilfe schaffen, jedoch erlebt Syphilis derzeit ein Comeback. Bakteriologie Der Erreger der Syphilis ist ein Bakterium der Ordnung Spiro­chae­tales, Familie Spirochaetaceae, Gattung Treponema. Spirochaetales sind gram-negative Spirochäten (griech.: gedrehtes Haar) von extrem dün­ ner und teils sehr langer Gestalt. Sie besitzen eine eng gewundene helikale Struktur und sind dank periplasmatischer Flagellen motil. Die Gattung Treponema besteht aus zwei Spezies: Pallidum und Carateum, von denen erstere in drei Subspezies unterteilt wird: Pallidum, Endemicum und Pertenue. Zwar sind diese Spirochäten aufgrund ihres ge- ringen Durchmessers unter dem Routinemikroskop nicht zu sehen, können jedoch durch Dunkelfeldmikroskopie sichtbar gemacht werden. Übertragung Syphilis wird hauptsächlich sexuell, aber auch pränatal und perinatal, in seltenen Fällen auch parenteral übertragen. Bezogen auf die sexuelle Übertragung beträgt die Chance nach einem einzelnen Kontakt mit einem infizierten Partner zu erkranken 30 %, wobei ein offensichtlicher Zusammenhang zwischen Übertragungswahrscheinlichkeit und Krankheitsstadium besteht. Der Erreger dringt durch kleinere Hautläsionen in den Wirt ein und inkubiert für mehrere Wochen. In dieser Zeit findet eine Vermehrung und Verteilung des Erregers durch lymphatische und systemische Zirkulation statt. In diesem Stadium werden keine allgemeinen Symptome beobachtet. Symptome der primären Syphilis treten 10 – 90 Tage (üblicher­weise 3 – 4 Wochen) nach Erstkontakt auf: Der Wirt reagiert inflammatorisch am Ort der Inokulation, und bildet die unter dem Begriff harter Schanker bekannte, für Syphilis charakteristische Läsion aus. Diese Ulzeration ist fast schmerzfrei, worin sich Syphilis von anderen ulzerierenden Erkrankungen wie Herpes unterscheidet. Derartige Ulcera enthalten hohe Konzentrationen von Treponema. Binnen zwei Monaten heilt der Schanker spontan aus, wodurch dem Patienten ein falsches Sicherheitsgefühl vermittelt wird. 2 – 10 Wochen nach der Primärläsion, bisweilen damit einhergehend, kommt es zur sekundären Syphilis. In diesem Stadium breiten sich zahlreiche Spirochäten im ganzen Körper aus, und verursachen einen weit gestreuten, hoch ansteckenden, mukokutanen Ausschlag. In der Regel folgt in diesem Stadium eine Start Nicht-reaktiv Kein serologischer Hinweis für eine Infektion Nicht-reaktiv <TP>-IgG zweifelhaft Wdh. <TP>-IgG Reaktiv Reaktiv oder zweifelhaft Nicht-reaktiv RPR (quant.) Nicht-reaktiv FTA-ABS Reaktiv Vermutlich Syphilis • Vergangene Infektion • Frühere Behandlung • Spät latente Syphilis • Späte Syphilis Frühe primäre Syphilis nicht auszuschließen Vermutlich falsch positiver Test Erneuter Test in 2 – 4 Wochen Vergangene Infektion nicht auszuschließen Kreuzreaktivität mit anderen SpirochätenAntigenen nicht auszuschließen Daten mit Symptomen und Behandlungs­ geschichte vergleichen Start Erneuter Test Krankengeschichte zur Interpretation notwendig Stop Bild 5: Empfohlener Algorithmus zur serologischen Syphilisdiagnostik bei immunkompetenten Patienten 69 14 Reaktiv Vermutlich Indizien für • Aktuelle Infektion • Unangemessen behandelte Infektion • Reinfektion Falsch positive Ergebnisse nicht auszuschließen generalisierte Immunantwort mit subjektiv schweren Symptomen. Patien­ten leiden häufig an Rachenschmerzen, Myalgie, generalisierter Lymphadenopathie und teils schwereren Komplikationen. Im Anschluss an die sekundäre Syphilis tritt der Wirt in eine Latenz­periode ein. In einem Zeitraum von ca. 4 Jahren nach der Infektion, kommt es häufig zu einem erneuten Aufflackern der sekundären Syphilis, dies jedoch in milderer Ausprägung. Dieses sogenannte frühe latente Stadium geht in eine späte latente Syphilis über, welche keine klare klinische Symptomatik aufweist, und bis zur Ausbildung von Symptomen einer tertiären Syphilis andauert. Bei ca. 40 % der spät latenten Patienten kommt es zur Ausbildung einer tertiären Syphilis. Charakteristisch für dieses Stadium sind granulomatöse Läsionen (Gummen) und Ranula, sowie die Entwicklung einer kardiovaskulären Syphilis und Neurosyphilis. Zur letzteren kommt es in ca. 15 % der unbehandelten Fälle gewöhnlich mehr als 5 Jahre nach Erstinfektion. Betroffen sind das zentrale Nervensystem und Rückenmark mit Demenz, Epilepsie und starker Gewichtsabnahme als mögliche Folgen. Eine durch Treponema verursachte Meningitis kann zu einer Schädigung des Hirnparenchyms führen, was progressiven Lähmungserscheinungen, sowie Einschränkungen der Rückenmarksfunktion zur Folge hat. Kardiovaskuläre Folgen erscheinen 10 – 40 Jahre nach Erstinfek­ tion und resultieren in einer tödlichen Myokaridinsuffizenz. Kongenitale Syphilis Die Seroprävalenz von T. pallidum pallidum während der Schwangerschaft ist in westlichen Ländern relativ gering (0,02 % – 4,5 %), kann jedoch in anderen Teilen der Welt deutlich höher ausfallen. Ein dramatischer Anstieg in der Verbreitung kongenitaler Syphilis wird derzeit in ländlichen Regionen Osteuropas und Zentralasiens beobachtet. Es besteht eine enge Korrelation zwischen dem Vorkommen primärer und sekundärer Syphilis und der Inzidenz kongenitaler Syphilis. Syphilis kann üblicherweise zwischen dem 2. und 3. Trimester vertikal von einer seropositiven Mutter an den Fötus übertragen werden. T. pallidum pallidum breitet sich darauf weitläufig über das ungeborene Kind aus, was zu einer Sepsis führt, die häufig eine Fehlgeburt oder neonatale Mortalität zur Folge hat. Auch Kinder, die die Geburtsbarriere überleben, können im späteren Leben an geistigen oder physischen Störungen leiden. Frühe kongenitale Syphilis, welche innerhalb weniger Jahre nach der Geburt auftritt, geht mit Symptomen wie Rhagaden, Pemphigus syphiliticus, syphilitischer Rhinitis und Osteochondrose einher. Späte kongenitale Syphilis kann sich während des frühen Jugendalters oder der späten Kindheit ausbilden und manifestiert sich in Form von Innenohrschwerhörigkeit, parenchymatöser Keratitis, Hutchinson-Zähnen (Hutchinson-Trias), Gummen und Läsionen im zentralen Nervensystem. Schätzungen der WHO zufolge verursacht maternale Syphilis jedes Jahr 460 000 Fehl- oder Totgeburten, 270 000 Fälle kongenitaler Syphilis und 270 000 Frühgeburten oder Fälle von geringem Geburtsgewicht. Prophylaxe und Behandlung Zum Schutz vor Syphilis steht kein Impfstoff zur Verfügung. Da es sich bei Syphilis um eine sexuell übertragbare Erkrankung handelt, schützen die Maßnahmen des Safer Sex vor einer Übertragung. Da T. pallidum pallidum jedoch durch jede beliebige Hautverletzung eindringen kann, stellt die Verwendung von Barrieremethoden keinen vollständigen Schutz dar (z.B. syphilitisches Panaritium). Syphilis kann mit Antibiotika wie Penicillin oder Tetrazyklin effektiv behandelt werden. Diagnose Eine exakte Syphilisdiagnose ist essenziell, da es sich um eine weltweite gesundheitliche Bedrohung handelt. In westlichen Ländern, insbesondere in Großstädten und anderen Brennpunkten, befindet sich die Verbreitung derzeit wieder in einem Anstieg. Die latenten Stadien der Syphilis verlaufen ohne subjektive Symptome, und jeder unentdeckte Fall birgt das Risiko ernster Konsequenzen wie Totgeburten, kongenitaler Syphilis, weiterer sexueller oder parenteraler Übertragung und tertiäter Syphilis. Andererseits können Patienten bei angemessener Diagnose effektiv behandelt werden. Die Diagnose der symptomatischen primären oder sekundären Syphilis ist häufig eindeutig und basiert auf dem klinischen Eindruck. Serologische Untersuchungen werden nur zu Bestätigungszwecken benötigt. Die asymptomatische Syphilis kann nur anhand von Laboruntersuchungen diagnostiziert werden. Prinzi­piell stehen hierzu drei Prozeduren zur Verfügung: 1. Der Direkte Nachweis von T. pallidum pallidum durch Dunkelfeldmikroskopie oder PCR 2.Ein Treponema-Antikörpertest (HetIA, HIA, Agglutination) 3.Nicht-treponemale Tests (VDRL, RPR, HIA, Agglutination) Um die Nachteile der jeweiligen Assays zu kompensieren, werden treponemale und nicht-treponemale Tests häufig zusammen durchgeführt. Ein positiver Antikörpertiter deutet auf eine frühere Exposition mit T. pallidum pallidum hin, während nicht-treponemale Tests besonders zur Therapiebeobachtung geeignet sind. 15 Glossar Anämie Reduzierter Sauerstofftransport im Blut. Verursacht durch eine verringerte Konzentration intakten Hämoglobins, des Hematokrits oder der Anzahl intakter Erythrozyten. Avidität Avidität ist ein Maß für die Stabilität von Immunkomplexen, inkl. der Affinitäten von Paratop-Epitop Interaktionen und statistischen Eigenschaften aufgrund von Mehrfachbindung. Kapsid Eine komplexe, normalerweise symmetrische, Proteinstruktur, die das virale Genom umhüllt. Katarakt Trübung der Augenlinse oder ihrer Hülle, potenziell bis zur totalen Undurchlässigkeit. Hutchinson’s Trias Komplex aus drei Symptomen, die häufig sekundär bei kongenitaler Syphilis auftreten: Innenohrschwerhörigkeit, Keratitis, Zahndeformationen. Iatrogen Durch ärztliche Maßnahmen verursacht. Ikosaedrische Symmetrie Häufigste Symmetrie von Viruspartikeln. Ein Ikosaeder besteht aus 20 identischen Dreiecken. Immunsupprimiert Patienten, die ein geschwächtes, gestörtes oder funktionsunfähiges Immunsystem aufweisen. Kann iatrogenen Ursprungs (z.B. durch immunsuppressive Therapie) oder erworben sein (z.B. AIDS). Inzidenz Anzahl Neuerkrankungen einer bestimmten Erkrankung in einer bestimmten Population während eines bestimmten Zeitraums. Chorioretinitis Gleichzeitige Entzündung der Bindehaut und der Aderhaut. Dissemination Ausbreitung. Keratitis Entzündung der Hornhaut. Ductus arteriosus Pränatal Verbindung zwischen Aorta und Pulmonalarterie. Koagulopathie Pathologische Störung der Blutgerinnung. Enzephalitis Entzündung des Gehirns. Kolitis Entzündung des Dickdarms. Endemisch Das gehäufte Auftreten einer Erkrankung in einer begrenzten Region oder Population. Konjunktivitis Entzündung der Bindehaut. Kurativ Auf Heilung ausgerichtet. Envelope Kommt in bestimmten Viren vor: Eine das Kapsid umhüllende Proteinschicht, die häufig eine Zellmembran nachahmt. Latente Infektion Enteral Zufuhr von Nährstoffen, Medikamenten oder eines Erregers über den Darm. Gleichgewicht zwischen Wirt und Erreger. Der Erreger ist vorhanden, wird aber vom Immunsystem des Wirts kontrolliert und verursacht subjektiv keine Erkrankung. Exanthem Akuter Ausschlag. Lymphadenopathie Pathologische Schwellung der Lymphknoten. Exsudat Entzündlich bedingte Absonderung. Meningitis Flagellum Fadenförmiges Gebilde auf der Ober­ fläche von Bakterien, das der Fortbewegung dient. Entzündung der Gehirn und Rückenmark umhüllenden Membranen. Mikrozephalie Enwicklungsstörung, die zu einem deutlich reduzierten Schädelvolumen führt. MMR Masern – Mumps – Röteln (Rubella). Mononukleose Durch das Epstein-Barr Virus ver­ ursachte Erkrankung. Morbidität Krankheitshäufigkeit. Mukokutane Zone Übergangsbereich zwischen Schleimhaut und Haut. Fulminant Plötzlich beginnend, heftig und schnell verlaufend. Genom Die Gesamtheit der Erbinformationen eines Organismus, kodiert in Strängen von Nukleinsäuren. Gumma Gummiartiger, verhärteter Knoten, normalerweise dermal. Vorkommen bei tertiärer Syphilis. Myalgie Muskelschmerz. Hepatosplenomegalie Gleichzeitige Vergrößerung von Leber und Milz. Naïv (Erreger) Horizontale Übertragung Übertragung eines Erregers zwischen Mitgliedern der selben Spezies, die nicht in einem Eltern-Kind Verhältnis stehen. Die Eigenschaft mit einem bestimmten Erreger in der Vergangenheit nicht in Kontakt gekommen zu sein. Neuroinvasiv In Nervenzellen eindringend. Neurotropisch Ein Virus, das nur oder bevorzugt Nerven­zellen infiziert. Nosographie Systematische Krankheitsbeschreibung. 16 Orofazial Mund und Gesicht betreffend. Seroprävalenz Osteochondritis Schmerzhafte Entzündung des Knochens oder Gelenkknorpels. The Prävalenz eines serologischen Markers in einer bestimmten Population. Suboccipital p53 Ein in zahlreichen malignen, aber auch gutartigen proliferierenden Zellen vorkommendes Protein. Es spielt vermutlich eine Rolle bei der Regulation des Zell­ zyklus, wo es die Aktivität einer Reihe von Genen steuert. Der Ort zwischen Schädel und dem ersten Halswirbel. Tegumentproteine Virale Proteine zwischen dem Nukleokapsid und dem Envelop. Thrombozytopenie Plättchenzahl unter 50 000 pro μL. Translation Von genetischer Information abhängige Biosynthese von Proteinen. Unspezifisches IgM Nicht gegen ein bestimmtes Epitop gerichtetes IgM. Vertikale Übertragung Übertragung eines Erregers von Mutter zu Kind. Zervikal Den Hals betreffend. Papel Abgegrenzte, feste Hauterhebung ohne sichtbare Flüssigkeit. Parenchym Das funktionelle Gewebe eines Organs. Pemphigus Bläschen bildende Autoimmunerkrankung, die Haut und Schleimhäute betrifft. Perinatal Zeitraum zwischen der 24. Gestationswoche und dem 7. Tag nach der Geburt. Periplasma Siehe Periplasmaraum. Periplasmaraum Der Raum zischen der innneren Zytoplasmamembran und der äußeren Membran bestimmter Bakterien. Persistentes IgM Spezifisches IgM, das nach Genesung von einer akuten Infektion persitiert. Petechialer Ausschlag Kapilarblutung in Haut oder Schleimhaut, die zu zahlreichen Stecknadelkopf-großen Hämatomen führt. Pharyngeal Den Rachen betreffend. Pneumonitis Lungenentzündung. Posterior Hinten gelegen. Prävalenz Häufigkeit einer bestimmten Krankheit in einer Population. Primärinfektion Erste Infektion eines Patienten mit einem bestimmten Erreger. Proliferierend Wuchernd, im Wachstum befindlich. RAAS Renin-Angiotensin-Aldosteronsystem. Ranula Zyste unter der Zunge, verursacht durch zurückgehaltenen Speichel. Rezidivierung Rückfall oder Wiederauftreten einer Erkrankung. Replikation Multiplikation von genetischem Material, normalerweise eines Genoms. Rhagaden Tiefe Hautfissuren. Serokonversion Der Zeitpunkt, an dem ein serologischer Marker (normalerweise ein Antikörper) nach einer Infektion detektierbar wird. Seropositiv Bezeichnet eine Probe (oder Patienten) die einen detektierbaren Titer eines serologischen Markers enthält. 17 Literatur TORCH 1 Stegmann, B.J., Carey, J.C. (2002). TORCH infections: Toxoplasmosis, Other (syphilis, varicellzoster, prarvovirus B19), Rubella, Cytomegalovirus (CMV), and Herpes infections. Curr Women’s Health Rep 2(4), 253-8. Toxoplasmose Für allgemeine Übersichtsartikel, siehe: 2 Remington, J.S., McLeod, R., Desmonts, G. (2001). Toxoplasmosis. In: J.S. Remington & J.O. Klein (ed.), Infectious Diseases of the Fetus and Newborn Infant, 5th ed., Philadelphia: W.B. Saunders, pp. 205-346. 3 Montoya, J.G., Liesenfeld, O. (2004). Toxoplasmosis. Lancet 363:1965-76. Zu Toxoplasmose in der Schwangerschaft, siehe: 4 Thulliez, P. (2001). Maternal and foetal infection. In: Joynson DHM, Wreghitt TG (ed.), Cambridge: Cambridge University Press, pp. 193-213. 5 Wong, S.Y., Remington, J.S. (1994). Toxoplasmosis in pregnancy. Clin Infedt Dis 18: 853-62. Zu Toxoplasmose in immunsupprimierten Patienten, siehe: 6 Luft, B.J., Remington, J.S. (1992). Toxoplasmic encephalitis in AIDS. Clin Infect Dis 15: 211-22. 7 Khalifa, K.E.S., Roth, A., Roth, B., Arasteh, K.N., Janitschke, K. (1994). Value of PCR for Evaluating Occurrence of Parasitemia in immunocompromised Patients with Cerebral and Extracerebral Toxoplasmosis. J Clin Microbiol 32, 2813-9. Zu persistierenden IgM, siehe: 8 Meek, B., van Gool, T., Gilis, H., Peek, R. (2001). Dissecting the IgM antibody response during the acute and latent phase of toxoplasmosis. Diagn Microbiol Infect Dis 41, 131-7. 9 Bobic, B., Sibalic, D., Djurkovic-Djakovic, O. (1991). High levels of IgM Antibodies Specific for Toxoplasma gondii in Pregnancy 12 Years after Primary Toxoplasm Infection. Gynecol Obstet Invest 31, 182-4. Zu Toxoplasmose und Verhaltensänderungen, siehe: 10 Holliman, R.E. (1997). Toxoplasmosis, Behavior, and Personality. Journal of Infection 35, 105-10. 11 Lafferty, K.D. (2006). Can the Common Brain Parasite, Toxoplasma gondii, Influence Human Culture? Proc R Soc B. 273, 2749-55. 12 Berdoy, M., Webster, J.P., Macdonald, D.W. (2000). Fatat Attraction in Rats Infected with Toxoplasma gondii. Proc Biol Sci 267(1452), 1591-4. Rubella Für allgemeine Übersichtsartikel, siehe: 13 Banatvala, J.E., Brown, D.W.G. (2004). Rubella. Lancet 363, 1127-37. 14 Best, J.M., Banatvala, J.E. (2000). Rubella. In: Zuckerman, A.J., Banatvala, J.E., Pattison, J.R. (ed.), Principles and Practice of Clinical Virology, Hoboken: John Wiley & Sons, Ltd., 387-418. 15 Best, J.M., Cooray, S., Banatvala, J.E. (2005). Rubella, 960-92. In: Topley und Wilson’s Microbiology and Microbial Infections, Vol. 2, Virology, Chapter 45. Zu Rubella in der Schwangerschaft, siehe: 16 Wesselhoeft, C. (1949). Rubella and congenital deformities. NEJM 240(7), 258-61. 17 Hanshaw, J.B., Dudgeon, J.A., Marshall, W.C. (1985). Viral diseases of the fetus and newborn. Philadelphia: W.B. Saunders. 18 Cooper, L.Z., Alford, C.A. (2001). Rubella. In: Remington JS, Klein JO (ed.), Infectious Diseases of the Fetus & Newborn Infant, 5th ed. Philadelphia: W.B. Saunders, 347-388. 19 Pustowoit, B., Lieber, U.G. (1998). Predictive Value of Serological Tests in Rubella Virus Infection during Pregnancy. Intervirology 41, 170-7. 20 Siegel, M., Fuerst, H.T., Guinee, V.F. (1971). Rubella epidemicity and embryopathy. Results of a long-term prospective study. Am J Dis Child 121(6), 469-73. 21 Edlich, R.F., Winter, K.L., Long, W.B., Gubler, K.D. (2005). Rubella and congenital rubella (German measles). J Long Term Eff Med Implants 15(3), 319-28. 22 Atreya, C.D., Mohan, K.V., Kulkarni, S. (2004). Rubella virus and birth defects: molecular insights into the viral teratogenesis at the cellular level. Birth Defects Res Part a Clin Mol Teratol 70(7), 431-7. 23 De Santis, M., Cavaliere, A.F., Straface, G., Caruso, A. (2006). Rubella infection in pregnancy. Reprod Toxicol 21(4), 390-8. 24 Weisinger, H.S., Pesudovs, K. (2002). Optical complications in congenital rubella syndrome. Optometry 73(7), 418-24. 25 Freij, B.J., South, M.A., Sever, J.L. (1988). Maternal rubella and the congenital rubella syndrome. Clin Perinatol 15(2), 247-57. 26 Lee, J.Y., Bowden, D.S. (2000). Rubella virus replication and links to teratogenicity. Microbiol Rev 13(4), 571-87. Zum Rubellavirus, siehe: 27 Frey, T.K. (1994). Molecular biology of rubella virus. Adv Virus Res 44, 69-160. Zur Rubellaimpfung, siehe: 28 Skendzel, L. (1996). Rubella Immunity. Defining the Level of Protective Antibody. Am J Clin Pathol 106, 170-4. 29 Watson, J.C., Hadler, S.C., Dykewicz, C.A., Reef, S., Phillips, L. (1998). Measles, mumps, and rubella-vaccine use and strategies for elimination of measles, rubella, and congenital rubella syndrome and control of mumps: recommendations of the Advisory Commettee on Immunization Practices (ACIP). MMWR Recomm Rep 47(RR-8), 1-57. 30 Reef, S.E., Frey, T.K., Theall, K. (2002). The changing epidemiology of rubella in the 1990s: on the verge of elimination and new challenges for control and prevention. JAMA 287(4), 464-72. 31 Plotkin, S.A. (2001). Rubella eradication. Vaccine 19(25-26), 3311-9. 32 Atkinson, W., Hamborsky, J., McIntyre, L., Wolfe, S. (eds) (2010). Epidemiology and Prevention of Vaccine-Preventable Diseases, 10th ed. Chapter 12: Rubella; Centers for Disease Control and Prevention. http://www.cdc.gov/vaccines/pubs/pinkbook/downloads/rubella.pdf [Accessed 02-September-2010] Cytomegalievirus Für allgemeine Übersichtsartikel, siehe: 33 Revello, M.G., Gerna, G. (2008). Expert Opin Med Diagn 2(5), 547-63. 34 Revello, M.G., Gerna, G. (2002). Clin Microbiol Rev 15(4), 680-715. Zu CMV in der Schwangerschaft, siehe: 35 Revello, M.G., Gerna, G. (2002). Diagnosis and Management of Human Cytomegalovirus Infection in the Mother, Fetus, and Newborn Infant. Clin Microbiol Rev 15(4), 680-715. 18 unro, S.C., Hall, B., Whybin, L.R. et al. (2005). Diagnosis of and Screening for Cytomegalovi36 M rus Infection in Pregnant Women. J Clin Microbiol 43(9), 4713-18. 37 Lazzarotto, T., Gabrielli, L., Lanari, M., et al. (2004). Congenital Cytomegalovirus Infection. Recent Advances in the Diagnosis of Maternal Infection. Hum Immunol 65, 410-5. 38 Guerra, B., Simonazzi, G., Banfi, A. (2007). Impact of diagnostic and confirmatory tests and prenatal counseling on the rate of pregnancy termination among women with positive citomegalovirus immunoglobulin M antibody titers. Am J Obstet Gynecol 196, 221-3. Zu diagnostischen und Screeningprozeduren gegen CMV, siehe: 39 Munro, S.C., Hall, B., Whybin, L.R. et al. (2005). J Clin Microbiol 43(9), 4713-8. 40 Lazzarotto, T., Gabrielli, L., Lanari, M. et al. (2004). Hum Immunol 65, 410-415. 41 Guerra, B., Simonazzi, G., Banfi, A. et al. (2007). Am J Obstet Gynecol 196, 221-223. 42 Duff, P. (2007). A thoughtful algorithm for the accurate diagnosis of primary CMV infection in pregnancy. Am J Obstet Gynecol 196, 196-197. Zu CMV in immunsupprimierten Patienten, siehe: 43 Ljungman, P. (2004). Risk of cytomegalovirus transmission by blood products to immunocompromised patients and means for reduction. Brit J Haematol 125,107-16. Herpes simplex virus Für allgemeine Übersichtsartikel, siehe: 44 Marre, R., Mertens, T., Trautmann, M., Vanek, E. (2000). Klinische Infektiologie. München Jena, pp. 578ff, 596ff, 189ff. 45 Hahn, H., Falke, D., Kaufmann, S.H.E., Ullmann, U. (2005). Medizinische Mikrobiologie und Infektiologie, 5th ed. Heidelberg: Springer, 610ff. 46 Mims, C., Dockrell, H.M. et al. (2006). Medizinische Mikrobiologie/Infektiologie, 2nd ed. München: Elsevier. Zu Anzeichen und Symptomen der Infektion, siehe: 47 Daniels, C.A., LeGoff, S.G. (1975). Shedding of infectious virus/antibody complexes from vesicular lesions of patients with recurrent herpes labialis. Lancet 20(2), 524-8. 48 Malvy, D. et al. (2007). Epidemiology of orofacial herpes simplex virus infections in the general population in France: results of the HERPIMAX study. J Eur Acad Dermatol Venereol 21(10), 1398-403. 49 Anderson, B.J. (2003). The epidemiology and clinical analysis of several outbreaks of herpes gladiatorum. Med Sci Sports Exerc 35(11), 1809-14. 50 Sanderson, I.R. et al. (1987). Eczema herpeticum: a potentially fatal disease. Br Med J 294(6573), 693-4. 51 Cordero-Coma, M. (2007). Herpetic retinitis. Herpes 14(1), 4-10. 52 Maertzdorf, J. et al. (2001). Herpes simplex virus type 1 (HSV-1)-induced retinitis following herpes simplex encephalitis: indications for brain to eye transmission of HSV-1. Ann Neurol 49(1), 104-6. 53 Klein, A., Lefebvre, P. (2007). Three consecutive episodes of acute retinal necrosis due to herpes simplex 1 over twelve years following herpetic encephalitis. Ocul Immunol Inflamm 15(5), 411-3. 54 Murakami S. et al. (1996). Bell’s palsy and herpes simplex virus: Identification of viral DNA in endoneurial fluid and muscle. Ann Intern Med 124(1), 27-30. 55 Wakisaka, H. et al. (2002). Demyelination associated with HSV-1-induced facial paralysis. Exp Neurol 178(1), 68-79. Für statistische Daten, siehe: 56 Hellenbrand, W., Thierfelder, W. et al. (2005). Seroprevalence of herpes simplex virus type 1 (HSV-1) and type 2 (HSV-2) in former East and West Germany, 1997-1998. Eur J Clin Microbiol Infect Dis 24(2), 131-5. Zum Herpes Simplex Virus, siehe: 57 Coriell, L.L., Rake, G. et al. (1950). Electron microscopy of herpes simplex. J Bacteriol 59(1), 61-68. Syphilis Für allgemeine Übersichtsartikel, siehe: 58 WHO: Focus Syphilis (2004). Nature Microbiology Reviews 2, 448-9. 59 Pickering, L.K. (ed.) (2006). Syphilis, 631-44. In: Red Book, Elk Grove Village, IL:American Academy of Pediatrics. 60 Centers for Disease Control and Prevention (2010). CDC Fact Sheet Syphilis. http://www.cdc. gov/std/syphilis/syphilis-fact-sheet-press.pdf 61 Centers for Disease Control and Prevention (2010). Primary and Secondary Syphilis – United States, 2003 – 2004. http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5510a1.htm [Accessed 02-September-2010] Zu Symptomen und Verlauf, siehe: 62 Dylewski, J., Duong, M. (2007). The rash of secondary syphilis. CMAJ 176(1), 33-5. 63 Clark, E.G., Danbolt, N. (1964). The Oslo study of the natural course of untreated syphilis: An epidemiologic investigation based on a re-study of the Boeck-Bruusgaard material. Med Clin North Am 58, 613. Zur Prävention und Behandlung von Syphilis, siehe: 64 Centers for Disease Control and Prevention (2010). How can Syphilis be Prevented? http://www.cdc.gov/std/Syphilis/STDFact-MSM-Syphilis.htm#prevent [Accessed 02-September-2010] 65 Centers for Disease Control and Prevention (2006). Sexually Transmitted Diseases Treatment Guidelines. MMWR 55(RR-11): 24-32. Für statistische Daten, siehe: 66 WHO: WHO Disease and injury country estimates 2004 (2010). http://www.who.int/healthinfo/global_burden_disease/estimates_country/en/index.html [Accessed 02-September-2010] 67 Fairley, C.K., Hocking, J.S., Medland, N.(2005). Syphilis back on the rise, but not unstoppable. Medical Journal of Australia 183(4), 172-3. 68 Fenton, K.A., Nicoll, A., Kinghorn, G. (2001). Resurgence of syphilis in England: time for more radical and nationally coordinated approaches. Sex Transm Infect 77(5), 309-10. Für diagnostische und Screeningprozeduren gegen CMV, siehe: 69 College of American Pathologists, USA (2007). http://www.cap.org/apps/docs/cap_today/feature_stories/0807SyphilisChart.pdf [Accessed 02-September-2010] Stanze Falz Einstecktasche für Inlays ElecsysT TORCH Diagnostik Innovative Assays für eine hohe Testeffizienz Roche Diagnostics Deutschland GmbH Sandhofer Straße 116 68305 Mannheim Roche Diagnostics (Schweiz) AG Industriestrasse 7 CH-6343 Rotkreuz, ZG www.roche.ch Roche Diagnostics GmbH Engelhorngasse 3 A-1210 Wien www.roche.at COBAS, ELECSYS und LIFE NEEDS ANSWERS sind Marken von Roche. © 2011 Roche Diagnostics. Alle Rechte vorbehalten. www.roche.de 06703461001 ➀ 0511 - AD U4 U1 ElecsysT Toxo IgM Testbeschreibung Elektro-Chemilumineszenz-Immunoassay (ECLIA) zur in-vitro Quantifizierung von IgM-Antikörpern gegen Toxoplasma gondii in Serum und Plasma Indikation Toxoplasmose ist eine weit verbreitete, von dem Protozoen Toxoplasma gondii verursachte Infektion. Erworben wird sie hauptsächlich durch die Aufnahme von Nahrungsmitteln, die mit von Katzen ausgeschiedenen reifen Oozysten oder mit Gewebszysten aus halb- oder ungegartem Fleisch kontaminiert wurden. In gesunden Personen ist die akute Primärinfektion meist ein subklinischer oder asymptomatischer Vorgang, der in einen chronischen Verlauf übergeht und gewöhnlich lebenslang still persistiert. Jedoch zieht eine Reaktivierung bei immunsupprimierten Patienten häufig schwere klinische Konsequenzen nach sich. Im Fall einer maternalen Primärinfektion mit T. gondii während der Schwangerschaft kann es zur einer vertikalen Übertragung des Parasiten kommen. Mögliche Konsequenzen sind Fehl- oder Totgeburten, Missbildungen, Entzündungen, sensorische Defekte und Retardierungen, die sich, falls bei der Geburt nicht vorhanden, auch zu einem späteren Lebenszeitpunkt ausbilden können. Mit dem Gestationsalter steigt die Wahrscheinlichkeit einer fetalen Infektion, wobei gleichzeitig das Risiko schwerwiegender klinischer Manifestationen sinkt. Durch eine rechtzeitige medikamentöse Therapie können bei einer akuten Infektion in der Schwangerschaft kongenitale Schäden verhindert oder gemildert werden. Die Diagnose einer T. gondii-Infektion beginnt mit dem Nachweis von Anti-Toxoplasma IgG- und IgMAntikörpern. Das Vorhandensen von IgM-Antikörpern ist indikativ für eine akute, kürzliche, oder reaktivierte Infektion. Die Diagnose einer akuten erworbenen Infektion während der Schwangerschaft wird anhand einer Serokonversion oder durch den signifikanten Anstieg eines Antikörper-Titers (IgG und / oder IgM) in aufeinanderfolgenden Proben erreicht. Häufig wird ein Toxoplasma IgG-Aviditätstest zur Gewinnung zusätzlicher Informationen durchgeführt. Testprinzip: μ-Capture Assay (Testdauer: 18 Min.) Probe mit Anti-CMV IgM Ru Ru 9 Min. biotinylierter Anti-human-IgM Schritt 1 (9 Minuten): 10 μL der Patientenprobe werden vorverdünnt und mit ruthenyliertem rekombinanten polymeren SAG1 inkubiert. Anti-Toxo IgM bildet aufgrund von Mehrfachbindung einen stabilen Immunkomplex mit diesem Antigen. Ru ruthenyliertes polymeres SAG 1 9 Min. Ru Ru Ru Messung Streptavidin-beschichtete Mikropartikel Schritt 2 (9 Minuten): Streptavidin-beschichtete paramagnetische Mikropartikel werden über biotynilierte antiMensch IgM an den Komplex gebunden. Step 3 (Messung): Die Reagenzienmischung wird in die Messzelle übertragen, wo die Mikropartikel magnetisch an der Elektrodenoberfläche fixiert werden. Ungebundene Substanzen werden anschließend entfernt. Durch eine Spannung wird nun Lumineszenz induziert und mittels eines Photomultipliers gemessen. Dabei hängt die Signalintensität von den Eigenschaften der in der Probe befindlichen Antikörper ab. ElecsysT Toxo IgM Testeigenschaften Testdauer 18 Min. Testprinzip μ-Capture Assay Cutoff Aus zwei Kalibratoren automatisch berechnet Interpretation Nicht-reaktiv: 0,8 COI Grenzwertig: 0,8 – 1,0 COI Reaktiv: 1,0 COI Probenmaterial Serum, Li-Heparin, K3-EDTA, Na-Zitratplasma Probenvolumen 10 μL Impräzision cobas e 411, E2010: 2,5 – 5,4 % cobas e 601 / e 602, E170: 1,6 – 2,4 % Relative Sensitivität 95,3 % (n = 170) 98,8 % (m = 84) Relative Spezifität 98,9 % (n = 602) 99,7 % (n = 295) Analytische Spezifität 99,1 % in einem Kollektiv aus 451 potenziell kreuzreaktiven Proben Bestellinformationen ElecsysT Toxo IgM 100 Tests 04618858190 ElecsysT Jeweils 8 × 0,67 mL 04618866190 PreciControl Toxo IgM 1 & 2 Roche Diagnostics Deutschland GmbH Sandhofer Straße 116 68305 Mannheim www.roche.de COBAS, COBAS E, ELECSYS, LIFE NEEDS ANSWERS und MODULAR sind Marken von Roche. © 2011 Roche Diagnostics. Alle Rechte vorbehalten. 06359426990 ➀ 0311 - Roche Diagnostics (Schweiz) AG Industriestrasse 7 CH-6343 Rotkreuz, ZG www.roche.ch Roche Diagnostics GmbH Engelhorngasse 3 A-1210 Wien www.roche.at ElecsysT Toxo IgG Avidität Testbeschreibung Elektrochemilumineszenz-Immunoassay (ECLIA) zur In-vitro Quantifizierung der Avidität von IgG-Antikörpern gegen Toxoplasma gondii in Serum und Plasma. Indikation Toxoplasmose ist eine häufig auftretende Infektion, die durch das Protozoon Toxoplasma gondii verursacht wird. Die Infek­ tion erfolgt vornehmlich durch die Aufnahme von kontaminierter Nahrung oder Wasser.1 Im Laufe einer Primärinfektion zeigen gesunde Menschen üblicherweise leichte Symptome oder keine Krankheitszeichen. Während einer Schwangerschaft kann sie jedoch schwere Schäden beim ungeborenen Kind zur Folge haben. Da kaum akute klinische Symptome vorliegen, wird die Diagnose einer Toxoplasma-Infektion durch den Nachweis der serologischen Marker IgG und IgM gestellt. 2 Der IgG-Aviditätstest wird als Ergänzung genutzt, um den Zeitpunkt einer Infektion genauer zu bestimmen. Testprinzip: Doppelantigen-Sandwich-Assay in einem Schritt (DAGS; 9-Minuten Prä-Inkubationszeit + 18 Minuten Testdauer) Hohe Avidität Referenz Probe mit hoher Avidität Anti-SAG-IgG Biotinyliertes rekombinantes SAG-IgG 9 Min. Ru Ru Ru Ru Ru 9 Min. Prä-Inkubation Messung 9 Min. 9 Min. 9 Min. Prä-Inkubation Streptavidinbeschichteter Mikropartikel Rekombinantes SAG1 DilToxoAv Ru 9 Min. Niedrige Avidität Messung Ru Ru Ru Ru Messung 9 Min. 9 Min. 9 Min. Prä-Inkubation Ruthenyliertes (Ru) Anti-SAG-IgG DilUni Ru Ru Ru Toxoplasma gondii-spezifisches Antigen (SAG1) bildet einen Sandwich-Komplex. Prä-Inkubationszeit (9 Minuten): Proben mit einem ElecsysT IgG-Titer 6 IU/ml werden parallel verdünnt und mit DilUni (Referenzprobe) oder DilToxoAv inkubiert. Die IgG-Antikörper gegen Toxoplasma gondii binden sich im DilToxoAv an das unmarkierte Toxoplasma gondii-spezifische Antigen (SAG1). Schritt 1 (9 Minuten): Die Proben werden mit einem biotinylierten rekombinanten Toxoplasma gondii-spezifischen Antigen (SAG1) inkubiert und mit Ruthenium markiert. Schritt 2: (9 Minuten): Nach Zugabe streptavidinbeschichteter Mikropartikel bindet der Komplex über die Biotin-Streptavidin-Kopplung an die feste Phase. Schritt 3 (Messung): Die Reagenzmischung wird in die Messzelle übertragen, wo die Mikropartikel magnetisch an der Elektrodenoberfläche immobilisiert werden. Ungebundene Substanz wird anschliessend ausgewaschen, bevor eine Chemilumineszenzreaktion durch Anlegen einer Spannung an die Elek­ trode induziert und mithilfe eines Photoverstärkers gemessen wird. ElecsysT Toxo IgG Avidität Testeigenschaften Testverfahren Doppelantigen-Sandwich-Immunoassay in einem Schritt mit verschiedenen Puffern Rückführbarkeit 3. internationaler Standard für Anti-Toxoplasma-Serum (TOXM); NIBSC Kalibrierung 2-Punkt Kalibration anhand einer Masterkurve Haltbarkeit auf dem Gerät 2 Wochen Probenmaterial Serum; Li-Heparin; K 2- und K 3 -EDTA; Na-Citrat-Plasma Testauswertung Niedrige Avidität < 70 %; Grauzone 70 – 79 %; Hohe Avidität > 80 % Präzision 0,5 – 8,7 % 100 % der Proben, die < 4 Monate nach Infektionsbeginn entnommen werden, zeigen eine niedrige Avidität im Elecys T Toxo IgG Assay. Möglicher serologischer Diagnosealgorithmus für Toxoplasma gondii bei immunkompetenten Patienten2 Start Durchführung Toxo IgG/IgM Test IgG neg. IgM neg. IgG pos. IgM neg. IgG neg. IgM pos. IgG pos. IgM pos. grenz­ wertig/ gering Keine Immunität Erworbene Immunität Vermeidung einer Primärinfektion Vergangene Infektion wahrscheinlich Beginnende Infektion unspezifische IgM Toxo IgG Avidität Erneuter IgG Test nach 3 Wochen hoch Infektion vor 4 Monaten stabil Erneuter Test während der Schwangerschaft Start Erneuter Test nach 3 Wochen Ende Start Toxo IgG Titer Erhöhung (2 – 4 fach) Infektion 2 Monate vor 1. Probe Aktuelle Infektion 2 Monate vor 1. Probe Evtl. weitere Schritte notwendig Bestellinformationen Elecsys T Toxo IgG Avidität 100 Tests = 50 Bestimmungen 05 802 571 190 PreciControl Toxo IgG Avidität je 3 × 1 ml 05 802 580 190 Literatur 1Montoya, J.G., Liesenfeld, O. (2004). Toxoplasmosis. Lancet ses, 1965-1976. 2Meek, B., van Gool, T., Gilis, H., Peek, R. (2001). Dissecting the IgM antibody response during the acute and latent phase of toxoplasmosis. Diagn Microbiol infect Dis 41, 131-137. Roche Diagnostics Deutschland GmbH Sandhofer Straße 116 68305 Mannheim www.roche.de COBAS, COBAS E, ELECSYS und LIFE NEEDS ANSWERS sind Marken von Roche. © 2012 Roche Diagnostics. Alle Rechte vorbehalten. 06653596990 ➀ 0412 - Roche Diagnostics (Schweiz) AG Industriestrasse 7 CH-6343 Rotkreuz www.roche.ch Roche Diagnostics GmbH Engelhorngasse 3 A-1211 Wien www.roche.at ElecsysT Toxo IgG Testbeschreibung Elektro-Chemilumineszenz-Immunoassay (ECLIA) zur in-vitro Quantifizierung von IgG-Antikörpern gegen Toxoplasma gondii in Serum und Plasma Indikation Toxoplasmose ist eine weit verbreitete, von dem Protozoen Toxoplasma gondii verursachte Infektion. Erworben wird sie hauptsächlich durch die Aufnahme von Nahrungsmitteln, die mit von Katzen ausgeschiedenen reifen Oozysten oder mit Gewebszysten aus halb- oder ungegarten Fleisch kontaminiert wurden. In gesunden Personen ist die akute Primärinfektion meist ein subklinischer oder asymptomatischer Vorgang, der in einen chronischen Verlauf übergeht und gewöhnlich lebenslang still persistiert. Jedoch zieht eine Reaktivierung bei immunsupprimierten Patienten häufig schwere klinische Konsequenzen nach sich. Im Fall einer maternalen Primärinfektion mit T. gondii während der Schwangerschaft kann es zur einer vertikalen Übertragung des Parasiten kommen. Mögliche Konsequenzen sind Fehl- oder Totgeburten, Missbildungen, Entzündungen, sensorische Defekte und Retardierungen, die sich, falls bei der Geburt nicht vorhanden, auch zu einem späteren Lebenszeitpunkt ausbilden können. Mit dem Gestationsalter steigt die Wahrscheinlichkeit einer fetalen Infektion, wobei gleichzeitig das Risiko schwerwiegender klinischer Manifestationen sinkt. Durch eine rechtzeitige medikamentöse Therapie können bei einer akuten Infektion in der Schwangerschaft kongenitale Schäden verhindert oder gemildert werden. Die Diagnose einer T. gondii-Infektion beginnt mit dem Nachweis von Anti-Toxoplasma IgG- und IgMAntikörpern. Der Nachweis von IgG-Antikörpern ist indikativ für eine akute oder chronische Infektion. Die Diagnose einer akuten erworbenen Infektion während der Schwangerschaft wird anhand einer Serokonversion oder durch den signifikanten Anstieg eines Antikörper-Titers (IgG und / oder IgM) in aufeinanderfolgenden Proben erreicht. Häufig wird zusätzlich ein Toxoplasma IgG-Aviditätstest durchgeführt. Testprinzip: Ein-Schritt Doppel-Antigen-Sandwich (DAGS) Assay (Testdauer: 18 Min.) 9 Min. Ru Ru biotinyliertes SAG1 Proben mit Anti-SAG1 IgG ruthenyliertes SAG1 Schritt 1 (9 Minuten): 10 μL der Patientenprobe werden mit einer Mischung von biotinyliertem und ruthenyliertem monomeren SAG1 inkubiert. In Anwesenheit entsprechender IgG-Antikörper werden Doppel-Antigen-SandwichImmunkomplexe. gebildet. Antikörper der IgM-Klasse bilden aufgrund ihrer charakteristisch geringen Paratopaffinität keine stabilen Immunkomplexe mit monomeren Antigenen aus. Ru 9 Min. Ru Messung Streptavidin-beschichtete Mikropartikel Schritt 2 (9 Minuten): Nach Zugabe Streptavidin-beschichteter, paramagnetischer Mikropartikel binden die DAGS-Komplexe über Biotin-Streptavidin an die feste Phase. Schritt 3 (Messung): Die Reagenzienmischung wird in die Messzelle übertragen, wo die Mikropartikel magnetisch an der Elektrodenoberfläche fixiert werden. Ungebundene Substanzen werden anschließend entfernt. Durch eine Spannung wird nun Lumineszenz induziert und mittels eines Photomulti­ pliers gemessen. Dabei hängt die Signal­ intensität von den Eigenschaften der in der Probe befindlichen Antikörper ab. ElecsysT Toxo IgG Testeigenschaften Testdauer 18 Min. Testprinzip Doppel-Antigen-Sandwich-Assay Kalibrierung 2-Punkt Rückführbarkeit 3. Internationaler Standard / (TOXM), NIBSC, UK Interpretation Nicht-reaktiv: 1 IU/mL Grenzwertig: 1 – 30 IU/mL Reaktiv: 30 IU/mL Probenmaterial Serum, Li-Heparin, K3-EDTA, Na-Zitratplasma Probenvolumen 10 μL Impräzision (NCCLS) cobas e 411, E2010: 2,7 – 4,0 % cobas e 601 / e 602, E170: 3,0 – 5,7 % Relative Sensitivität 100 % (n = 99,5 % (n = 100 % (n = 100 % (n = Relative Spezifität 99,8 % (n = 626) 98,8 % (n = 242) 100 % (n = 159) 99,0 % (n = 202) Analytische Spezifität 97,8 % in einem Kollektiv aus 226 potenziell kreuzreaktiven Proben 317) 192) 220) 188) Bestellinformationen Roche Diagnostics Deutschland GmbH Sandhofer Straße 116 68305 Mannheim www.roche.de COBAS, COBAS E, ELECSYS, LIFE NEEDS ANSWERS und TAQMAN sind Marken von Roche. © 2011 Roche Diagnostics. Alle Rechte vorbehalten. 06359400990 ➀ 0311 - ElecsysT Toxo IgG 100 Tests 04618815190 ElecsysT PreciControl Toxo IgG 1 & 2 Jeweils 8 × 1 mL 04618823190 Roche Diagnostics (Schweiz) AG Industriestrasse 7 CH-6343 Rotkreuz, ZG www.roche.ch Roche Diagnostics GmbH Engelhorngasse 3 A-1210 Wien www.roche.at ElecsysT Rubella IgM Testbeschreibung Elektro-Chemilumineszenz-Immunoassay (ECLIA) zur in-vitro Quantifizierung von IgM-Antikörpern gegen Rubellavirus in Serum und Plasma Indikation Das Rubellavirus verursacht Röteln, eine milde Ausschlagserkrankung, die üblicherweise während der Kindheit auftritt. Eine postnatale Infektion verursacht selten Komplikationen. Dennoch handelt es sich bei einer Primärinfektion hauptsächlich in der frühen Schwangerschaft um eine ernsthafte Bedrohung, da die vertikale Virusübertragung Fehlgeburten oder das kongenitale Rötelnsyndrom (congenital rubella syndrome, CRS) verursachen kann. Die Auswirkungen von CRS umfassen Blindheit, Taubheit, kongenitale Herzleiden, sowie mentale Retardierung. Heutige Impfprogramme haben zu einer maßgeblichen Senkung der Inzidenz akuter Röteln und CRS beigetragen. Das Vorhandensein von IgM-Antikörpern gegen das Ru­bellavirus deutet normalerweise auf eine akute Infektion hin, kann jedoch auch persistent sein. Die Serokonversion spezifischer Rubella-Antikörper oder ein deutlicher Anstieg des IgG-Titers bekräftigt die Diagnose einer akuten RubellaInfektion. Testprinzip: μ-Capture Assay (Testdauer: 18 Min.) Probe mit Anti-Rubella IgM ruthenyliertes Anti-Rubella 9 Min. biotinylierter Anti-Human-IgM Rubella-artige Partikel Schritt 1 (9 Minuten): 10 μL derPatientenprobe werden vorverdünnt und mit biotinyliertem anti-Mensch IgM und Rubella-artigen Partikeln (RLP) vorinkubiert. Anti-Rubella IgM bildet aufgrund von Mehrfachbindung stabile Immunkomplexe mit RLPs. Ru Ru 9 Min. Messung Streptavidin-beschichtete Mikropartikel Schritt 2 (9 Minuten): Ruthenylierte, Rubella-spezifische Antikörper werden zu Streptavidin-beschichteten paramagnetischen Mikropartikeln gegeben. Die Antikörper binden an freie Bindungsstellen am RLP, während die Mikropartikel über Biotin am Capture-Antikörper an den Komplex binden. Schritt 3 (Messung): Die Reagenzienmischung wird in die Messzelle übertragen, wo die Mikropartikel magnetisch an der Elektrodenoberfläche fixiert werden. Ungebundene Substanzen werden anschließend entfernt. Durch eine Spannung wird nun Lumineszenz induziert und mittels eines Photomulti­ pliers gemessen. Dabei hängt die Signal­ intensität von den Eigenschaften der in der Probe befindlichen Antikörper ab. ElecsysT Rubella IgM Testeigenschaften Testdauer 18 Min. Testprinzip μ-Capture Assay Cutoff Aus zwei Kalibratoren automatisch berechnet Interpretation Nicht-reaktiv: 0,8 COI Grenzwertig: 0,9 – 1,0 COI Reaktiv: 1,0 COI Probenmaterial Serum, Li-Heparin, K3-EDTA, Plasma Probenvolumen 10 μL Impräzision cobas e 411, E2010: 1,9 – 4,1 % cobas e 601/ e 602, E170: 2,7 – 10,9 % Sensitivität bei frühen akuten Infektionen ( 30 Tage) 80 % 96 % (n = 84) (n = 25) Relative Spezifität 98,7 % 99,0 % (n = 554) (n = 993) Analytische Spezifität 98,99 % in 390 potenziell kreuzreaktiven Proben Bestellinformationen ElecsysT Rubella IgM 100 Tests 04618831190 ElecsysT Jeweils 4 × 1 mL 04618840190 PreciControl Rubella IgM 1 & 2 Roche Diagnostics Deutschland GmbH Sandhofer Straße 116 68305 Mannheim www.roche.de COBAS, COBAS E, ELECSYS, LIFE NEEDS ANSWERS und MODULAR sind Marken von Roche. © 2011 Roche Diagnostics. Alle Rechte vorbehalten. 06359442990 ➀ 0311 - Roche Diagnostics (Schweiz) AG Industriestrasse 7 CH-6343 Rotkreuz, ZG www.roche.ch Roche Diagnostics GmbH Engelhorngasse 3 A-1210 Wien www.roche.at ElecsysT Rubella IgG Testbeschreibung Elektro-Chemilumineszenz-Immunoassay (ECLIA) zur in-vitro Quantifizierung von IgG-Antikörpern gegen Rubellavirus in Serum und Plasma Indikation Das Rubellavirus verursacht Röteln, eine milde Ausschlagserkrankung, die üblicherweise während der Kindheit auftritt. Eine postnatale Infektion verursacht selten Komplikationen. Dennoch handelt es sich bei einer Primärinfektion hauptsächlich in der frühen Schwangerschaft um eine ernsthafte Bedrohung, da die vertikale Virusübertragung Fehlgeburten oder das kongenitale Rötelnsyndrom (congenital rubella syndrome, CRS) verursachen kann. Die Auswirkungen von CRS umfassen Blindheit, Taubheit, kongenitale Herzleiden, sowie mentale Retardierung. Heutige Impfprogramme haben zu einer maßgeblichen Senkung der Inzidenz akuter Röteln und CRS beigetragen. Das Vorhandensein von IgG-Antikörpern gegen Rubella deutet auf eine Exposition durch Impfung oder Infektion in der Vergangenheit, und damit auf eine Immunität hin. Die Serokonver­ sion spezifischer Rubella-Antikörper oder ein deutlicher Anstieg des IgG-Titers bekräftigt die Diagnose einer akuten Rubella-Infektion. Der quantitative Nachweis spezifischer IgG wird zur Ermittlung des Immunstatus gegen Rubella eingesetzt. Testprinzip: Ein-Schritt Doppel-Antigen-Sandwich (DAGS) Assay / G-Capture-Assay (Testdauer: 18 Min.) Probe mit Anti-Rubella IgG biotinyliertes E1 ruthenyliertes E1 Streptavidin-beschichtete Mikropartikel Ru Ru Ru 9 Min. 9 Min. Messung Ru biotinylierter AntiRubella-artige ruthenyliertes Antihuman-IgG Antikörper Partikel Rubella Ab-Fragmente Schritt 1 (9 Minuten): 10 μL der Patientenprobe werden mit monoklonalen anti-Mensch IgG-Antikörpern, Rubella-artigen Partikeln (RLP), einem ruthenylierten monoklonalen anti-Rubella Antikörperfragment (Ab), biotinyliertem und ruthenyliertem E1 inkubiert. Ru Schritt 2 (9 Minuten): Nach Zugabe streptavidin-beschichteter paramagnetischer Mikropartikel binden die Immunkomplexe über Biotin-Streptavidin an die feste Phase. Ru Schritt 3 (Messung): Die Reagenzienmischung wird in die Messzelle übertragen, wo die Mikropartikel magnetisch an der Elektrodenoberfläche fixiert werden. Ungebundene Substanzen werden anschließend entfernt. Durch eine Spannung wird nun Lumineszenz induziert und mittels eines Photomultipliers gemessen. Dabei hängt die Signalintensität vom Rubella-IgG Titer der Probe ab. ElecsysT Rubella IgG Testeigenschaften Testdauer 18 Min. Testprinzip Doppel-Antigen-Sandwich (DAGS) Assay / G-Capture Assay Kalibrierung 2-Punkt Rückführbarkeit 1. int. Standard, humanes Anti-Rubella IgG RUBI-1-94 (NIBSC) Interpretation Nicht-reaktiv: 10 IU/mL Reaktiv: 10 IU/mL Probenmaterial Serum, Li-Heparin, K3-EDTA, Na-Citrat Plasma Probenvolumen 10 μL Impräzision cobas e 411, E2010: 3,4 – 6,4 % cobas e 601 / e 602, E170: 3,2 – 4,3 % Relative Sensitivität 1 00 % 99,9 % 100 % 100 % Relative Spezifität 97,4 % (n = 38) 100 % (n = 18) 100 % (n = 78) 100 % (n = 769) (n (n (n (n = = = = 514) 978) 120) 20) Bestellinformationen Roche Diagnostics Deutschland GmbH Sandhofer Straße 116 68305 Mannheim www.roche.de COBAS, COBAS E, ELECSYS, LIFE NEEDS ANSWERS und MODULAR sind Marken von Roche. © 2011 Roche Diagnostics. Alle Rechte vorbehalten. 06359434990 ➀ 0311 - ElecsysT Rubella IgG 100 Tests 04618793190 ElecsysT PreciControl Rubella IgG 1 & 2 Jeweils 8 × 1 mL 04618807190 Roche Diagnostics (Schweiz) AG Industriestrasse 7 CH-6343 Rotkreuz, ZG www.roche.ch Roche Diagnostics GmbH Engelhorngasse 3 A-1210 Wien www.roche.at ElecsysT HSV-2 IgG Testbeschreibung Elektrochemilumineszenz-Immunoassay (ECLIA) zum In-Vitro-Nachweis von IgG-Antikörpern gegen den Herpes-simplexVirus Typ 2 (HSV-2). Indikation Herpes-simplex-Viren vom Typ 2 (HSV-2) werden in der Regel durch sexuellen Kontakt im Zuge von asymptomatischer Viren­ freisetzung übertragen und sind zu rund 80 % für die Entstehung von Genitalherpes verantwortlich. Unter der allgemeinen Bevölkerung liegt die Verbreitung von HSV-2 Infektionen bei rund 17 – 25 %, wobei der Anteil bei Hochrisikogruppen wie AIDS-Patienten und Sexarbeiter darüber liegen kann. HSV-2 Infektionen stellen einen Risikofaktor bei der Übertragung von HIV dar und erhöhen das Ansteckungsrisiko für HIV. Die schwersten Folgen von Herpes manifestieren sich bei Neugeborenen, wobei die Übertragung des Virus zumeist während des Geburtsvorganges durch Kontakt mit dem Genitaltrakt stattfindet. Subklinische Virusfreisetzung und unerkannte Infektionen gelten als zentrale Faktoren bei der Übertragung. HSV-Infektionen im Genitalbereich werden oft nicht erkannt, wobei die rein klinische Diagnose geringe Sensitivität aufweist. Testprinzip: Zweifacher Antigen-Sandwich-Assay (DAGS, Testzeit 18 Min.) Streptavidin-beschichtetes Mikropartikel Anti-HSV-2 Probe Ru HSV-2 Antigen biotyniliert 9 Min. Ru 9 Min. Ru Messung HSV-2 Antigen ruthenyliert Schritt 1 (9 Minuten): 20 μL der Patientenprobe werden in einer Mischung aus biotynilierten und ruthenylierten HSV-2 Antigenen inkubiert. Durch die entsprechenden Antikörper bilden sich zweifache Antigen-Sandwich-Immunkomplexe. Schritt 2 (9 Minuten): Nach der Beigabe von Streptavidinbeschichteten paramagnetischen Mikropartikeln bindet der Immunkomplex durch die Wechselwirkung von Biotin und Streptavidin an die Festphase. Schritt 3 (Messung): Anschließend wird das Reaktionsgemisch in die Messzelle überführt, wo die Mikropartikel durch magnetische Wirkung auf die Oberfläche der Elektrode fixiert werden. Ungebundene Substanzen werden in weiterer Folge mit ProCell entfernt. Das Anlegen einer Spannung induziert eine Chemilumineszenzemission, die mit dem Photomultiplier gemessen wird. ElecsysT HSV-2 IgG Testeigenschaften Verwendbar mit folgenden Analyzern cobas e 601 Modul, cobas e 602 Modul, cobas e 411 Analyzer, MODULAR ANALYTICS E170, ElecsysT Analyzer Testdauer 18 Min. Testprinzip Double-Antigen-Sandwich-Assay Cutoff Automatische Berechnung anhand zweier Kalibratoren Probenmaterial Serum, Li-Heparin-Plasma, K2-EDTA-Plasma, K3-EDTA-Plasma Probenvolumen 20 μL Impräzision cobas e 411 Analyzer, ElecsysT 2010 Analyzer: 1,8 – 3,6 % cobas e 601 / cobas e 602 Modul, E170: 1,8 – 2,0 % Erwartete Werte Nichtreaktiv: 0,51 COI Grenzbereich: 0,51 – 1,0 COI Reaktiv: 1,0 COI Durchführung der Qualitätskontrolle Zur Qualitätskontrolle verwenden Sie bitte ElecsysT PreciControl HSV. Kontrollen 1 und 2 sollten mindestens einmal alle 24 Stunden als einzelne Bestimmungen laufen, wenn der Immunoassay in Verwendung ist, sowie einmal pro Reagenzienkit und nach jeder Kalibrierung. Haltbarkeit auf Gerät 28 Tage ElecsysT HSV-2 IgG Performance-Daten A. Schwangerschaftsscreening (n = 400) Elecsys® B. Sexuell aktive Erwachsene (n = 300) Vergleichstest Elecsys® 99,7 % Relative Spezifität 99,2 % 92,6 % Relative Sensitivität 92,6 % 0 10 20 30 40 50 60 70 80 90 100 Vergleichstest 99,6 % Relative Spezifität 100,0 % 100,0 % Relative Sensitivität 86,9 % 0 10 20 30 40 50 60 70 80 90 100 „Relativ“ bezieht sich auf die Ergebnisse der ElecsysT HSV-1 IgG und ElecsysT HSV-2 IgG Immunoassays in Gegenüberstellung mit Vergleichstests. Der Bestätigungstest diskordanter Proben wurde mit handelsüblichen Immunoblot-Assays durchgeführt. Proben im Grenzbereich sowie Proben mit nicht schlüssigen Ergebnissen wurden nicht in die Berechnung einbezogen. Bestellinformationen Roche Diagnostics Deutschland GmbH Sandhofer Straße 116 68305 Mannheim www.roche.de COBAS, COBAS E, ELECSYS, LIFE NEEDS ANSWERS und MODULAR sind Marken von Roche. © 2011 Roche Diagnostics. Alle Rechte vorbehalten. 06439420990 ➀ 0511 - X.X YZ ElecsysT HSV-2 IgG 100 Tests 05572193190 ElecsysT PreciControl HSV Für 4 × 3 mL 05572207190 Control Set Vials, Leerfläschchen 2 × 56 03142949122 Roche Diagnostics (Schweiz) AG Industriestrasse 7 CH-6343 Rotkreuz, ZG www.roche.ch Roche Diagnostics GmbH Engelhorngasse 3 A-1210 Wien www.roche.at ElecsysT HSV-1 IgG Testbeschreibung Elektrochemilumineszenz-Immunoassay (ECLIA) zum In-Vitro-Nachweis von IgG-Antikörpern gegen den Herpes-simplexVirus Typ 1 (HSV-1). Indikation Der Herpes-simplex-Virus vom Typ 1 (HSV-1) wird hauptsächlich über sozialen Kontakt im Kindesalter übertragen, aber auch auf sexuellem Weg in späteren Jahren. Unter der allgemeinen Bevölkerung wird die Verbreitung von HSV-1 Infektionen auf ca. 70 – 90 % geschätzt. HSV-Primärinfektionen gehen oft mit schmerzhaften, nässenden Bläschen einher, die ein infek­ tiöses Exsudat absondern. Die meistbefallenen Stellen sind der Mund, die Lippen (Herpes labialis) und die Genitalien (Herpes genitalis). Oft wiederkehrende Hautverletzungen begünstigen das Auftreten von HSV. Herpes im Mund- und Gesichtbereich geht meistens auf HSV-1 zurück, während Genitalherpes hauptsächlich durch HSV-2 verursacht wird. Darüber hinaus kommt es auch zu vertikaler Übertragung von HSV-1 und HSV-2 vor der Geburt oder während des Geburtsvorganges. Diese Art der Infektion kann schwerwiegende Folgen haben und in manchen Fällen für den Fötus bzw. das Neugeborene tödlich sein. Subklinische Virusfreisetzung und unerkannte Infektionen gelten als zentrale Faktoren bei der Übertragung. Testprinzip: Zweifacher Antigen-Sandwich-Assay (DAGS, Testzeit 18 Min.) Streptavidin-beschichtetes Mikropartikel Anti-HSV-1 Probe Ru HSV-1 Antigen biotyniliert 9 Min. Ru 9 Min. Ru Messung HSV-1 Antigen ruthenyliert Schritt 1 (9 Minuten): 20 μL der Patientenprobe werden in einer Mischung aus biotynilierten und ruthenylierten HSV-1 Antigenen inkubiert. Durch die entsprechenden Antikörper bilden sich zweifache Antigen-Sandwich-Immunkomplexe. Schritt 2 (9 Minuten): Nach der Beigabe von Streptavidinbeschichteten paramagnetischen Mikropartikeln bindet der Immunkomplex durch die Wechselwirkung von Biotin und Streptavidin an die Festphase. Schritt 3 (Messung): Anschließend wird das Reaktionsgemisch in die Messzelle überführt, wo die Mikropartikel durch magnetische Wirkung auf die Oberfläche der Elektrode fixiert werden. Ungebundene Substanzen werden in weiterer Folge mit ProCell entfernt. Das Anlegen einer Spannung induziert eine Chemilumineszenzemission, die mit dem Photomultiplier gemessen wird. ElecsysT HSV-1 IgG Testeigenschaften Verwendbar mit folgenden Analyzern cobas e 601 Modul, cobas e 602 Modul, cobas e 411 Analyzer, MODULAR ANALYTICS E170, ElecsysT Analyzer Testdauer 18 Min. Testprinzip Double-Antigen-Sandwich-Assay Cutoff Automatische Berechnung anhand zweier Kalibratoren Probenmaterial Serum, Li-Heparin-Plasma, K2-EDTA-Plasma, K3-EDTA-Plasma Probenvolumen 20 μL Impräzision cobas e 411 Analyzer, ElecsysT 2010 Analyzer: 2,5 – 2,7 % cobas e 601 / cobas e 602 Modul, E170: 1,6 – 2,2 % Erwartete Werte Nichtreaktiv: 0,6 COI Grenzbereich: 0,6 – 1,0 COI Reaktiv: 1,0 COI Durchführung der Qualitätskontrolle Zur Qualitätskontrolle verwenden Sie bitte ElecsysT PreciControl HSV. Kontrollen 1 und 2 sollten mindestens einmal alle 24 Stunden als einzelne Bestimmungen laufen, wenn der Immunoassay in Verwendung ist, sowie einmal pro Reagenzienkit und nach jeder Kalibrierung. Haltbarkeit auf Gerät 28 Tage ElecsysT HSV-1 IgG Performance-Daten A. Schwangerschaftsscreening (n = 400) Elecsys® B. Sexuell aktive Erwachsene (n = 300) Elecsys® Vergleichstest 100,0 % Relative Spezifität 92,4 % 95,6 % Relative Sensitivität 100,0 % 0 10 20 30 40 50 60 70 80 90 100 Vergleichstest 100,0 % Relative Spezifität 92,6 % 99,4 % Relative Sensitivität 100,0 % 0 10 20 30 40 50 60 70 80 90 100 „Relativ“ bezieht sich auf die Ergebnisse der ElecsysT HSV-1 IgG und ElecsysT HSV-2 IgG Immunoassays in Gegenüberstellung mit Vergleichstests. Der Bestätigungstest diskordanter Proben wurde mit handelsüblichen Immunoblot-Assays durchgeführt. Proben im Grenzbereich sowie Proben mit nicht schlüssigen Ergebnissen wurden nicht in die Berechnung einbezogen. Bestellinformationen Roche Diagnostics Deutschland GmbH Sandhofer Straße 116 68305 Mannheim www.roche.de COBAS, COBAS E, ELECSYS, LIFE NEEDS ANSWERS und MODULAR sind Marken von Roche. © 2011 Roche Diagnostics. Alle Rechte vorbehalten. 06439438990 ➀ 0511 - X.X YZ ElecsysT HSV-1 IgG 100 Tests 05572185190 ElecsysT PreciControl HSV Für 4 × 3 mL 05572207190 Control Set Vials, Leerfläschchen 2 × 56 03142949122 Roche Diagnostics (Schweiz) AG Industriestrasse 7 CH-6343 Rotkreuz, ZG www.roche.ch Roche Diagnostics GmbH Engelhorngasse 3 A-1210 Wien www.roche.at ElecsysT CMV IgM Testbeschreibung Elektro-Chemilumineszenz-Immunoassay (ECLIA) zur in-vitro Quantifizierung von IgM-Antikörpern gegen CMV in Serum und Plasma Indikation Das Cytomegalievirus (CMV) ist ein in allen humanen Populationen allgegenwärtiges Herpesvirus. Eine Übertragung findet hauptsächlich durch die Aufnahme virenbelasteter Körperflüssigkeiten statt. Die weltweite Prävalenz seropositiver Erwachsener liegt bei 40 – 100 %. In ansonsten gesunden Menschen ist eine akute Primärinfektion meist ein subklinischer oder asymptomatischer Prozess, der in einen latenten Verlauf übergeht. Jedoch ist eine Rezidivierung bei immunsupprimierten Patienten häufig mir schwerwiegenden klinischen Konsequenzen verbunden. Im Fall einer maternalen Primärinfektion mit CMV während der Schwangerschaft kann es zu einer vertikalen Übertragung des Virus kommen. Die Konsequenzen be­inhalten schwere fetale Schäden, mentale, sowie Wachstumsretardierung und Ikterus. Trotz möglicher Unauffälligkeit bei der Geburt kann es im späteren Leben zu Schwerhörigkeit oder kognitiven Defiziten kommen. Derzeit steht keine akzeptierte Therapie zur Verfügung. Die Diagnose einer CMV Infektion beginnt mit dem Nachweis von anti-CMV IgG- und IgM-Antikörpern. Für IgM-Antikörper reaktive Proben deuten auf eine akute, kürzliche, oder reaktivierte Infektion hin. Ein positives IgM-Resultat in Kombination mit einem geringen Aviditätsindex für IgG spricht für eine CMV-Primärinfektion in den letzten 4 Monaten. Die Serokonversion von CMV IgM dient ebenfalls der Diagnose einer aktuellen Infektion. Testprinzip: μ-Capture Assay (Testdauer: 18 Min.) Probe mit Anti-CMV IgM Ru 9 Min. biotinylierte Anti-human-IgM Ru Ru ruthenyliertes multimeres pp150, p52 Schritt 1 (9 Minuten): 10 μL der Patientenprobe werden vorverdünnt und mit biotinyliertem anti-MenschIgM inkubiert. Ru 9 Min. Ru Ru Messung Streptavidin-beschichtete Mikropartikel Schritt 2 (9 Minuten): Ruthenyliertes multimeres pp150 und p52 wird zu Streptavidin-beschichteten paramagnetischen Mikropartikeln gegeben. Anti-CMV IgM bildet mit diesen Antigenen aufgrund von Mehrfachbindung stabile Immunkomplexe. Schritt 3 (Messung): Die Reagenzienmischung wird in die Messzelle übertragen, wo die Mikropartikel magnetisch an der Elektrodenoberfläche fixiert werden. Ungebundene Substanzen werden anschließend entfernt. Durch eine Spannung wird nun Lumineszenz induziert und mittels eines Photomulti­ pliers gemessen. Dabei hängt die Signal­ intensität von den Eigenschaften der in der Probe befindlichen Antikörper ab. ElecsysT CMV IgM Testeigenschaften Testdauer 18 Min. Testprinzip μ-Capture Assay Cutoff Aus 2 Kalibratoren automatisch berechnet Interpretaton Nicht-reaktiv: 0,7 COI Grenzwertig: 0,7 – 1,0 COI Reaktiv: 1,0 COI Probenmaterial Serum, Li-Heparin, K2-EDTA, K3-EDTA, Plasma Probenvolumen 10 μL Impräzision cobas e 411, E2010: 2,4 – 5,3 % cobas e 601 / e 602, E170: 3,8 – 6,1 % Sensitivität 93,0 % (n 96,5 % (n 91,2 % (n 93,1 % (n 92,3 % (n Spezifität bei Routineproben 98,8 % (n = 501) 97,1 % (n = 591) 97,0 % (n = 507) Analytische Spezifität 92,3 % in 413 potenziell kreuzreaktiven Proben = = = = = 114) 57) 34) 29) 52) Bestellinformationen Roche Diagnostics Deutschland GmbH Sandhofer Straße 116 68305 Mannheim www.roche.de COBAS, COBAS E, ELECSYS, LIFE NEEDS ANSWERS und MODULAR sind Marken von Roche. © 2011 Roche Diagnostics. Alle Rechte vorbehalten. 06359477990 ➀ 0311 - ElecsysT CMV IgM 100 Tests 04784618190 ElecsysT PreciControl CMV IgM 1 & 2 Jeweils 8 × 1 mL 04784626190 Roche Diagnostics (Schweiz) AG Industriestrasse 7 CH-6343 Rotkreuz, ZG www.roche.ch Roche Diagnostics GmbH Engelhorngasse 3 A-1210 Wien www.roche.at CMV-IgG Avidität Testbeschreibung Elektrochemilumineszenz-Immunoassay (­ ECLIA) zur Bestimmung der relativen Avidität von IgG-Antikörpern gegen CMV in menschlichem Serum und Plasma Indikation Eine Probe, die mit Anti-CMV-IgG und -IgM reagiert, kann ein Hinweis auf eine akute, kürzlich abgelaufene oder reaktivierte Infektion sein. Da die symptomatische kongenitale Infektion des Fetus meistens durch eine intrauterine Übertragung nach einer Primärinfektion der Mutter bedingt ist, ist die Unterscheidung zwischen einer primären oder rezidivierten Infektion sowie von unspezifischen IgM- oder Persistenz von CMV-spezifischen IgM-Antikörpern für die Betreuung einer derartigen Schwangerschaft entscheidend. Referenz - Testprinzip: Doppelantigen-Sandwich-Assay in einem Arbeitsschritt (DAGS, Testdauer 18 Min.) analog zu CMV-IgG Probe mit Biotinylierte rekombinante hoher Avidität CMV-spezifische Antigene Anti-CMV-IgG Streptavidin-beschichtetes Mikropartikel Ru Ru 9 Min. Ru Ru Ru 9 Min. Messung Ru Ru Ru Ru Probe mit Ruthenylierte rekombinante niedriger CMV-spezifische Antigene Avidität Anti-CMV-IgG Avidität – Testprinzip: Sandwich-Assay mit zweitem Antigen in einem Arbeitsschritt unter chaotropen Bedingungen (DAGS, Testdauer 18 Min.) Probe mit Biotinylierte rekombinante hoher Avidität CMV-spezifische Antigene Anti-CMV-IgG Streptavidin-beschichtetes Mikropartikel Chaotropes Reagens Ru Ru Ru Ruthenylierte rekombinante Probe mit CMV-spezifische Antigene niedriger Avidität Anti-CMV-IgG 9 Min. Ru 9 Min. Ru Messung CMV-spezifisches Antigen 1. Schritt (9 Minuten): 50µL der Patientenprobe werden mit 50µL DilCMVAv vermischt. 20 μL der verdünnten Patienten­ probe werden mit einer Mischung aus biotinylierten und ruthenylierten monomeren CMVAntige­nen inkubiert. In Präsenz von hoch-aviden IgG-Antikörper bilden sich DoppelantigenSandwich-Immunkomplexe. Niedrig-avide IgG können unter diesen Bedingungen keine stabilen Immunkomplexe bilden. 2. Schritt 3. Schritt (9 Minuten): siehe oben (Messung): siehe oben Ergebnisberechnung Das Analysegerät berechnet automatisch die Analytkonzentration jeder Probe für beide Messungen (Referenzmessung und mit DilCMVAv behandelte Messung) in U/mL. Aviditätsberechnung [Avi %]: Avidität [Avi %] = Ergebnis der mit DilCMVAv behandelten Messung [U/mL] Ergebnis der Referenzmessung [U/mL] × 100 % Eigenschaften des CMV-IgG-Aviditätstests Testdauer 2 × 18 Min (parallel) Testprinzip Doppelantigen-Sandwich-Assay in einem Arbeitsschritt (DAGS) unter verschiedenen Pufferbedingungen Kalibrierung 2 Punkte Interpretation Niedrige Avidität: 45,0 Avi % Grauzone: 45,0 – 54,9 Avi % Hohe Avidität: 55,0 Avi % Probenmaterial Serum, Li-Heparin, K2-, K3-EDTA Plasma Probenvolumen 1 × 20 μL und 1 × 50 µL Impräzision cobas e 411, E2010: cobas e 601 / e 602, E170: 2,0 – 3,1 % 1,5 – 3,8 % Klinische Sensitivität [95 %-Konfidenzgrenze] 96,1 % 93,4 % [89,0-99,2] [86,9-97,3] n = 77, diagnostisch n = 106, schwanger Klinische Spezifität [95 %-Konfidenzgrenze] 90,9 % 100,0 % [78,3 – 97,5] [93,0 – 100] n = 44, diagnostisch n = 51, schwanger Vorschlag für einen serologischen CMV-Diagnosealgorithmus bei immunkompetenten Personen Start Durchführung CMV IgG / IgM Tests IgG neg. IgM neg. IgG neg. IgM pos. IgG pos. IgM neg. IgG pos. IgM pos. 20 Wochen IgG Avidität gering bis grenzwertig Hohes gering bis grenzwertig Übertragungsrisiko hoch Gestationsalter 20 Wochen IgG Avidität hoch Keine Immunität Beginnende Infektion Vermeidung einer Primärinfektion Erneuter Test während der Schwangerschaft Erworbene Immunität Vergangene Infektion wahrscheinlich Erneuter Test nach 3 Wochen Start Rückfall möglich Maternale Virämie • Virusisolation • Blut PCR Fetale Gesundheit • Ultraschall • MRT Invasive Tests • Amniozentese • Cordozentese Stop Roche Diagnostics Deutschland GmbH Sandhofer Straße 116 68305 Mannheim www.roche.de AMPLIPREP, COBAS, ELECSYS, LIFE NEEDS ANSWERS und TAQMAN sind Marken von Roche. © 2011 Roche Diagnostics. Alle Rechte vorbehalten. 06359612990 ➀ 0311 - Möglicherweise zusätzliche Tests Roche Diagnostics (Schweiz) AG Industriestrasse 7 CH-6343 Rotkreuz, ZG www.roche.ch IgG neg. IgM neg. Verwendung von Proben des 1. Trimesters IgG pos. / IgM pos. Geringe Avidität IgG pos. IgM neg. IgG neg. IgM pos. Keine Primärinfektion geringes Übertragungsrisiko IgG pos. / IgM pos. Hohe Avidität Stop Roche Diagnostics GmbH Engelhorngasse 3 A-1210 Wien www.roche.at ElecsysT CMV IgG Testbeschreibung Elektro-Chemilumineszenz-Immunoassay (ECLIA) zur in-vitro Quantifizierung von IgG-Antikörpern gegen CMV in Serum und Plasma Indikation Das Cytomegalievirus (CMV) ist ein in allen humanen Populationen allgegenwärtiges Herpesvirus. Eine Übertragung findet hauptsächlich durch die Aufnahme virenbelasteter Körperflüssigkeiten statt. Die weltweite Prävalenz seropositiver Erwachsener liegt bei 40 – 100 %. In ansonsten gesunden Menschen ist eine akute Primärinfektion meist ein subklinischer oder asymptomatischer Prozess, der in einen latenten Verlauf übergeht. Jedoch ist eine Rezidivierung bei immunsupprimierten Patienten häufig mir schwerwiegenden klinischen Konsequenzen verbunden. Im Fall einer maternalen Primärinfektion mit CMV während der Schwangerschaft kann es zu einer vertikalen Übertragung des Virus kommen. Die Konsequenzen be­inhalten schwere fetale Schäden, mentale, sowie Wachstumsretardierung und Ikterus. Trotz möglicher Unauffälligkeit bei der Geburt kann es im späteren Leben zu Schwerhörigkeit oder kognitiven Defiziten kommen. Derzeit steht keine akzeptierte Therapie zur Verfügung. Die Diagnose einer CMV Infektion beginnt mit dem Nachweis von anti-CMV IgG- und IgM-Antikörpern. CMV IgG-Antikörper sind ein Indikator für eine frühere Infektion, deren grober Zeitpunkt mit Hilfe eines CMV IgG Aviditätstests abgeschätzt werden kann. Die Serokonversion von CMV IgG weist auf eine aktuelle Infektion hin. Testprinzip: Ein-Schritt Doppel-Antigen-Sandwich (DAGS) Assay (Testdauer: 18 Min.) Streptavidin-beschichtete MiKropartikel Probe mit Anti-CMV IgG Ru biotinyliertes pp150, pp28, p52, p38 9 Min. Ru 9 Min. Ru Messung ruthenyliertes pp150, pp28, p52, p38 Schritt 1 (9 Minuten): 20 μL der Patientenprobe werden mit einer Mischung aus biotinylierten und ruthenylierten monomeren CMV-Antigenen inkubiert. In Gegenwart entsprechender IgG-Antikörper bilden sich Doppel-Antigen-Sandwich-Immunkomplexe. Der statistischen Verteilung entsprechend tragen diese Sandwiches teilweise gleichzeitig Biotin- und Ruthenium-Markierungen. Antikörper der IgM-Klasse bilden aufgrund ihrer charakteristisch geringen Paratop­ affinität keine stabilen Immunkomplexe mit monomeren Antigenen aus. Schritt 2 (9 Minuten): Nach Zugabe Streptavidin-beschichteter, paramagnetischer Mikropartikel binden die DAGS-Komplexe über Biotin-Streptavidin an die feste Phase. Schritt 3 (Messung): Die Reagenzienmischung wird in die Messzelle übertragen, wo die Mikropartikel magnetisch an der Elektrodenoberfläche fixiert werden. Ungebundene Substanzen werden anschließend entfernt. Durch eine Spannung wird nun Lumineszenz induziert und mittels eines Photomulti­ pliers gemessen. Dabei hängt die Signal­ intensität von den Eigenschaften der in der Probe befindlichen Antikörper ab. ElecsysT CMV IgG Testeigenschaften Testdauer 18 Min. Testprinzip Doppel-Antigen-Sandwich (DAGS) Assay Kalibrierung 2-Punkt Interpretaton Nicht-reaktiv: 0,5 U/mL Grenzwertig: 0,5 – 1,0 U/mL Reaktiv: 1 U/mL Probenmaterial Serum, Li-Heparin, K2-EDTA, K3-EDTA Plasma Probenvolumen 20 μL Impräzision cobas e 411, E2010: 3,2 – 3,9 % cobas e 601 / e 602, E170: 3,2 – 4,5 % Übereinstimmung mit handelsüblicher Methode 98,9 % (n = 532) 96,8 % (n = 616) 99,4 % (n = 520) Analytische Spezifität 96,6 % in einem Kollektiv aus 437 potenziell kreuzreaktiven Proben Bestellinformationen ElecsysT CMV IgG 100 Tests 04784596190 ElecsysT Jeweils 8 × 1 mL 04784600190 PreciControl CMV IgG 1 & 2 Roche Diagnostics Deutschland GmbH Sandhofer Straße 116 68305 Mannheim www.roche.de COBAS, COBAS E, ELECSYS, LIFE NEEDS ANSWERS und MODULAR sind Marken von Roche. © 2011 Roche Diagnostics. Alle Rechte vorbehalten. 06359469990 ➀ 0311 - Roche Diagnostics (Schweiz) AG Industriestrasse 7 CH-6343 Rotkreuz, ZG www.roche.ch Roche Diagnostics GmbH Engelhorngasse 3 A-1210 Wien www.roche.at