Ist die Metastasierung bald vorhersagbar?
Werbung

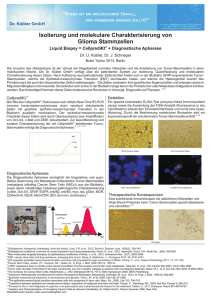
Onkologie_2_S3-34.pdf; s6; (200.00 x 275.00 mm); 21.Sep 2016 12:30:05; PDF-CMYK ab 150dpi für Prinergy; L. N. Schaffrath DruckMedien ZIRKULIERENDE TUMORZELLEN Ist die Metastasierung bald vorhersagbar? A ufgrund der hohen Mortalität maligner Krebserkrankungen wird intensiv nach Möglichkeiten geforscht, um die verschiedenen Entwicklungsstufen der Metastasierungskaskade besser verstehen zu können. Tumorspezifische Biomarker, die (verbleibende) Krebszellherde im Körper der Patienten verlässlich erkennen und die Effizienz systemischer Therapien zeitnah abbilden können, können möglicherweise einen entscheidenden Beitrag zum verbesserten Verständnis einer Krebserkrankung liefern und somit die Überlebenschancen der Patienten steigern. 8 Gegenwärtig werden im klinischen Alltag geläufig bildgebende Verfahren wie Computertomographie (CT), Röntgen, Ultraschall, Knochenszintigraphie, Magnetresonanztomographie (MRT) oder Positronen-Emissions-Tomographie (PET) zur Erkennung von Tumorerkrankungen und/oder für die Überwachung des Therapieerfolgs eingesetzt. Diese Verfahren scheinen für den Nachweis von minimalen Resterkrankungen („minimal residual disease“, MRD) allerdings nicht geeignet zu sein, so dass alternative, ultrasensitive immunzytologische Perspektiven der Onkologie 2/2016 | Deutsches Ärzteblatt Foto: eye of science/Agentur Focus Die molekulare Untersuchung blutbasierter Biomarker wie CTCs, ctDNA-Moleküle oder Exosomen bietet die Möglichkeit, tiefere Einblicke in biologische Prozesse der Metastasierungskaskade zu erlangen. Onkologie_2_S3-34.pdf; s7; (200.00 x 275.00 mm); 21.Sep 2016 12:30:05; PDF-CMYK ab 150dpi für Prinergy; L. N. Schaffrath DruckMedien oder molekulare Verfahren eingesetzt werden müssen, um verbleibende Tumorzellen im Körper der Patienten gesichert aufspüren zu können. In der Krebsforschung werden aktuell zirkulierende Tumorzellen („circulating tumor cells“, CTCs) und zellfreie, tumorzellspezifische Nukleinsäuren (ctDNA-Moleküle) als vielversprechende Biomarker diskutiert (1–3). Unter CTCs versteht man Krebszellen, die sich vom Primärtumorzellverband oder Metastasen gelöst haben und sich systemisch über das Blut- oder Lymphsystem im Körper der Patienten ausbreiten können (Grafik 1). ctDNA-Moleküle hingegen sind DNA-Bruchstücke des Tumors, die im Plasma, Serum oder auch Urin zu finden sind und überwiegend von sterbenden Tumorzellen freigesetzt werden (4). Beide Biomarker konnten bereits mit einer schlechten Prognose in Verbindung gebracht werden, wobei die Datenlage bei den CTCs wesentlich umfangreicher ist und zahlreiche multizentrische Studien umfasst (5–7). Es wird angenommen, dass ein ununterbrochener Zufluss von CTCs und ctDNA-Molekülen aus der Tumormasse erfolgt, wodurch diese Biomarker ebenfalls für die Überwachung des Krankheitsverlaufs von besonderer Bedeutung sein könnten, da sie die Tumorprogression auf zellulärer bzw. ctDNA-Ebene widerspiegeln. Basierend auf dieser Annahme ließen sich Therapieerfolge und eine frühzeitige Neubildung von Metastasen über einen gering-invasiven Eingriff leicht verfolgen. Laut aktuellen Forschungsstudien können Tumorzellen den Primärtumor schon in sehr frühen Stadien verlassen. So wurde gezeigt, dass sich einzelne Tu- morzellen bereits bei etwa 20 % der Patientinnen mit einem duktalen Carcinoma in situ (DCIS) im Knochenmark nachweisen lassen (8). Einzelne Krebszellen, die sich in neuen „metastatischen Nischen“, wie den Lymphknoten oder dem Knochenmark, angesiedelt haben, werden als disseminierte Tumorzellen („disseminated tumor cells“, DTCs) bezeichnet. Der Nachweis von DTCs wurde in zahlreichen klinischen Studien bereits als unabhängiger Marker für eine schlechte Prognose beschrieben (9). Interessanterweise scheint nur eine kleine Subpopulation von Krebszellen für die Ausbildung von Fernmetastasen verantwortlich zu sein. Diese Zellen werden als Metastase-induzierende Krebsstammzellen („metastasis-inducing cancer stem cells“, MICs) bezeichnet (10). Es wird vermutet, dass die Nische im Knochen zum Beispiel über die Sekretion von Gas6 die Stammzelltransformation der DTCs begünstigen kann (11). DTCs mit Stammzelleigenschaften besitzen ein unbegrenztes Selbsterneuerungspotenzial. Der Schlaf der Tumorzellen Manche DTCs scheinen zusätzlich in der Lage zu sein, über Monate (bis hin zu Jahren) in einem „schlafenden“ (dormanten) Zustand zu verweilen, ohne vom eigenen Körperabwehrsystem zerstört zu werden. In diesem zellteilungsinaktiven Zustand sind diese Zellen relativ resistent gegenüber dem Angriff von gebräuchlichen anti-proliferativen Chemotherapeutika (Zytostatika). Die Ursache für eine Tumorzelldormanz kann möglicherweise auf einen gestoppten oder verlangsamten Zellzyklus zurückgeführt werden. Die Mechanismen, die zur Aufhebung dieses Quelle: Joose SA et al., EMBO Mol Med 2015 GRAFIK Tumorzellen können den Tumorzellverband verlassen und ins Blut- oder Lymphgefäßsystem einwandern („circulating tumor cells“, CTCs). Für die Auswanderung der Zellen spielt möglicherweise die epithelial-mesenchymale Transition (EMT) eine entscheidende Rolle. Zum Überleben im Blutsystem müssen die Zellen Hindernisse wie Anoikis, Scherkräfte oder auch Zellen des Immunsystems überwinden. CTCs, die eine neue metastatische Nische erreicht haben, werden als disseminierte Tumorzellen (DTCs) bezeichnet. DTCs können in einem schlafenden (dormanten) Zustand verweilen oder aber eine Makrometastase bzw. weitere Metastasen induzieren (2). Perspektiven der Onkologie 2/2016 | Deutsches Ärzteblatt 9 Onkologie_2_S3-34.pdf; s8; (200.00 x 275.00 mm); 21.Sep 2016 12:30:05; PDF-CMYK ab 150dpi für Prinergy; L. N. Schaffrath DruckMedien Zustands führen sind bisher allerdings weitestgehend unbekannt. Ein wesentlicher Parameter, der die Tumorzelldormanz beeinflussen kann, ist die Gefäßneubildung (Neoangiogenese). Die Ausbildung von neuen Blutgefäßen ist für die Sauerstoff- und Nährstoffversorgung des Tumors essenziell. Die Gefäßneubildung wird durch verschiedene Botenstoffe, wie zum Beispiel VEGF oder FGF-1 reguliert. Diese Botenstoffe, die auch unmittelbar vom Tumor selbst gebildet werden können, können einen „angiogenic switch“ bewirken, wobei der Tumor von einem avaskulären in einen vaskulären Zustand übergeht (12). Dieser Prozess kann durch Sauerstoffmangel (Hypoxie), Mutationen der Tumorzellen oder die Expression von Onkogenen/Tumorsuppressorgenen induziert werden. Daneben konnte gezeigt werden, dass eine aberrante Expression des vaskulären Zelladhäsionsmoleküls-1 (VCAM-1) die Transition von einer indolenten Mikrometastase zu einer Makrometastase begünstigen kann (13). Weiterhin konnten Cheung und Kollegen aufdecken, dass die Expression von Keratin-14, einem epithelialen Strukturprotein, als Regulator für die Ausbildung von Metastasen und die Wanderung von Tumorzellverbänden (CTC-Cluster) fungiert (14). Verschiedenartige Tumore scheinen bevorzugt in ganz bestimmte Organe zu wandern („homing“). So konnten bereits Marker, wie CXCR4 oder Jagged1 mit der gezielten Metastasierung in Lymphknoten oder Knochen von Patienten in Verbindung gebracht werden (15, 16). Neben den Tumorzellen scheinen auch tumorzellspezifische Exosomen die Metastasierung zu beeinflussen. Exosomen sind 30–120 nm große Vesikel, die von einer Zelle aktiv in die Umgebung abgegeben werden. Diese Vesikel können DNA-Bestandteile, RNAs oder Proteine beinhalten und dienen als Transportvehikel oder zur Ausschleusung von Zellbestandteilen. Neueste wissenschaftliche Untersuchungen lassen die Vermutung zu, dass tumorzellspezifische Exosomen eine prämetastatische Nische bilden und über die Expression von Adhäsionsmolekülen (Integrinen) den Ort der Metastasierung regulieren (17). Prognostische Relevanz In der CTC-Forschung besitzt gegenwärtig lediglich das EpCAM-basierte CellSearch®-System eine Zulassung der US-amerikanischen Food and Drug Administration (FDA). Über dieses System lassen sich CTCs standardisiert und reproduzierbar in Blutproben (7,5 ml) von Krebspatienten nachweisen. Die Ergebnisse klinischer Studien belegen eindeutig, dass CTCs eine prognostische Relevanz für den Krankheitsverlauf der Tumorpatienten haben (6, 18, 19). Diese vielversprechenden Ergebnisse konnten nicht nur für Patienten mit bereits metastasierten Tumoren, sondern auch für Patienten mit nicht metastasierten Tumorerkrankungen gezeigt werden (20). 10 Neben der Quantifizierung ermöglicht das System auch die molekularbiologische Charakterisierung der CTCs auf therapierelevante Marker, wie zum Beispiel PSMA, EGFR, PDL1 oder HER2 (21–24). Die DETECT-Studie ist die erste klinische Interventionsstudie, in der die Charakterisierung von CTCs Eingang in die Therapieentscheidung gefunden hat. Bei dieser Studie werden Patientinnen mit HER2-negativem Primärtumor, aber HER2-positiven CTCs, randomisiert und mit dem Tyrosinkinaseinhibitor Lapatinib behandelt (25). Aufgrund der Heterogenität von Tumorzellen und EMT-assoziierten (epithelial-mesenchymale Transition) Tumorzellveränderungen, die im Verlauf der Metastasierung auftreten können, werden über die alleinige „epitheliale Selektion“ bestimmte CTC-Populationen möglicherweise nicht erfasst (26–28). Daher ist die weitere Optimierung und klinische Validierung von neuen CTC-Anreicherungsverfahren sowie der komplementäre Einsatz von ctDNA und Exosomen als weitere Komponenten der „Flüssigbiopsie“ wichtig. Eine bedeutende Aufgabe der gegenwärtigen Krebsforschung besteht nun darin, verschiedene Verfahren zum standardisierten Nachweis dieser Biomarker zu entwickeln und in der klinischen Praxis zu etablieren. Im Jahr 2015 wurde hierzu das europäische Forschungskonsortium CANCER-ID gegründet, das derzeit 37 Partnerinstitutionen umfasst (www.cancer-id.eu). Fazit ● Die molekulare Untersuchung Blut-basierter Bio- ● ● ● marker, wie CTCs, ctDNA-Molekülen oder Exosomen bietet die Möglichkeit, tiefere Einblicke in biologische Prozesse der Metastasierungskaskade zu erlangen. In naher Zukunft könnten diese Biomarker auch als prädiktive Biomarker eingesetzt werden, wodurch eine personalisierte Therapie der Krebspatienten gewährleistet werden könnte. Diese Biomarker könnten demnach als „Flüssigbiopsie“ verwendet werden und damit über die Analyse des Genom- und Expressionsprofils die Vorhersage über das Ansprechen der Patienten auf eine Therapie unterstützen. Inwiefern die „Flüssigbiopsie“ in Zukunft die derzeitige Nadelbiopsie als Goldstandard ergänzen kann, ist Gegenstand lebhafter Diskussionen. ▄ DOI: 10.3238/PersOnko/2016.09.30.02 Dr. rer. nat. Tobias M. Gorges Prof. Dr. med. Klaus Pantel Universitätsklinikum Hamburg-Eppendorf, Institut für Tumorbiologie Interessenkonflikt: Die Autoren erklären, dass kein Interessenkonflikt vorliegt. @ Literatur im Internet: www.aerzteblatt.de/lit3916 Perspektiven der Onkologie 2/2016 | Deutsches Ärzteblatt ZIRKULIE RENDE TUMORZELLEN Ist die Metastasierung bald vorhersagbar? Die molekulare Untersuchung blutbasierter Biomarker wie CTCs, ctDNA-Moleküle oder Exosomen bietet die Möglichkeit, tiefere Einblicke in biologische Prozesse der Metastasierungskaskade zu erlangen. LITERATUR 1. Alix-Panabieres C, Pantel K: Clinical applications of circulating tumor cells and circulating tumor DNA as liquid biopsy. Cancer discovery 2016; 6: 479–91. 2. Joosse SA, Gorges TM, Pantel K: Biology, detection, and clinical implications of circulating tumor cells. EMBO Mol Med 2015; 7(1): 1–11. 3. Speicher MR, Pantel K: Tumor signatures in the blood. Nature biotechnology 2014; 32: 441–3. 4. Schwarzenbach H, Pantel K: Circulating DNA as biomarker in breast cancer. Breast Cancer Research 2015; 17: 136. 5. Bettegowda C, Sausen M, Leary RJ, et al.: Detection of circulating tumor DNA in early- and late-stage human malignancies. Science translational medicine 2014; 6: 224ra24. 6. Bidard FC, Peeters DJ, Fehm T, et al.: Clinical validity of circulating tumour cells in patients with metastatic breast cancer: A pooled analysis of individual patient data. The Lancet Oncology 2014; 15: 406–14. 7. Gorges TM, Stein A, Quidde J, et al.: Improved detection of circulating tumor cells in metastatic colorectal cancer by the combination of the cellsearch(r) system and the adnatest(r). PloS one 2016; 11: e0155126. 8. Sanger N, Effenberger KE, Riethdorf S, Van Haasteren V, Gauwerky J, Wiegratz I, et al.: Disseminated tumor cells in the bone marrow of patients with ductal carcinoma in situ. Int J Cancer 2011; 129: 2522–6. 9. Pantel K, Alix-Panabieres C: Bone marrow as a reservoir for disseminated tumor cells: A special source for liquid biopsy in cancer patients. BoneKEy reports 2014; 3: 584. 10. Baccelli I, Schneeweiss A, Riethdorf S, et al.: Identification of a population of blood circulating tumor cells from breast cancer patients that initiates metastasis in a xenograft assay. Nature Biotechnology 2013; 31: 539–44. 11. Shiozawa Y, Berry JE, Eber MR, et al.: The marrow niche controls the cancer stem cell phenotype of disseminated prostate cancer. Oncotarget 2016. 12. Kareva I: Escape from tumor dormancy and time to angiogenic switch as mitigated by tumor-induced stimulation of stroma. J Theor Biol 2016; 395: 11–22. 13. Lu X, Mu E, Wei Y, et al.: Vcam-1 promotes osteolytic expansion of indolent bone micrometastasis of breast cancer by engaging alpha4beta1-positive osteoclast progenitors. Cancer Cell 2011; 20: 701–14. 14. Cheung KJ, Padmanaban V, Silvestri V, et al.: Polyclonal breast cancer metastases arise from collective dissemination of keratin 14-expressing tumor cell clusters. Proc Natl Acad Sci U S A 2016; 113: E854–63. Perspektiven der Onkologie 2/2016 | Deutsches Ärzteblatt 15. Kaifi JT, Yekebas EF, Schurr P, et al.: Tumor-cell homing to lymph nodes and bone marrow and cxcr4 expression in esophageal cancer. J Natl Cancer Inst 2005; 97: 1840–7. 16. Bednarz-Knoll N, Efstathiou A, Gotzhein F, et al.: Potential involvement of jagged1 in metastatic progression of human breast carcinomas. Clinical Chemistry 2016; 62: 378–86. 17. Hoshino A, Costa-Silva B, Shen TL, et al.: Tumour exosome integrins determine organotropic metastasis. Nature 2015; 527: 329–35. 18. Scher HI, Heller G, Molina A, et al.: Circulating tumor cell biomarker panel as an individual-level surrogate for survival in metastatic castration-resistant prostate cancer. J Clin Oncol 2015; 33(12): 1348–55. 19. Goldkorn A, Ely B, Quinn DI, et al.: Circulating tumor cell counts are prognostic of overall survival in swog s0421: A phase iii trial of docetaxel with or without atrasentan for metastatic castrationresistant prostate cancer. J Clin Oncol 2014; 32: 1136–42. 20. Rack B, Schindlbeck C, Juckstock J, et al.: Circulating tumor cells predict survival in early average-to-high risk breast cancer patients. J Natl Cancer Inst 2014; 106(5). 21. Gorges TM, Riethdorf S, von Ahsen O, Nastaly P, Rock K, Boede M, et al.: Heterogeneous psma expression on circulating tumor cells – a potential basis for stratification and monitoring of psma-directed therapies in prostate cancer. Oncotarget 2016. 22. Gasch C, Bauernhofer T, Pichler M, et al.: Heterogeneity of epidermal growth factor receptor status and mutations of kras/ pik3ca in circulating tumor cells of patients with colorectal cancer. Clinical chemistry 2013; 59: 252–60. 23. Mazel M, Jacot W, Pantel K, et al.: Frequent expression of pd-l1 on circulating breast cancer cells. Molecular Oncology 2015; 9: 1773–82. 24. Riethdorf S, Muller V, Zhang L, et al.: Detection and her2 expression of circulating tumor cells: Prospective monitoring in breast cancer patients treated in the neoadjuvant geparquattro trial. Clinical Cancer Research 2010; 16: 2634–45. 25. Bidard FC, Fehm T, Ignatiadis M, et al.: Clinical application of circulating tumor cells in breast cancer: Overview of the current interventional trials. Cancer Metastasis Rev 2013; 32: 179–88. 26. Gorges TM, Tinhofer I, Drosch M, et al.: Circulating tumour cells escape from epcam-based detection due to epithelial-to-mesenchymal transition. BMC Cancer 2012; 12: 178. 27. Hvichia GE, Parveen Z, Wagner C, et al.: A novel microfluidic platform for size and deformability based separation and the subsequent molecular characterization of viable circulating tumor cells. Int J Cancer 2016. 28. Wit S de, Dalum G van, Lenferink AT, et al.: The detection of epcam(+) and epcam(-) circulating tumor cells. Scientific Reports 2015; 5: 12270. 4