5. Tag: Chemische Bindung
Werbung

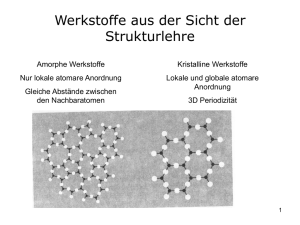
5. Tag: Chemische Bindung 1 5. Tag: Chemische Bindung 1. Edelgaskonfiguration und Oktettregel Die chemische Reaktionsfähigkeit eines Atoms wird durch seine Elektronenkonfiguration bestimmt. Teilchen mit der abgeschlossenen Elektronenkonfiguration der Edelgase sind chemisch reaktionsträge, d.h. sie sind besonders energiearm. Dies gilt nicht nur für die Edelgasatome selbst, sondern für alle Atome im Periodensystem. Aus diesem Grund versuchen alle Atome, die energiearme Edelgaskonfiguration und damit einen stabilen Zustand zu erreichen. Für viele Atome wird eine stabile Außenschale mit 8 Valenzelektronen gebildet, um die Edelgasanordnung zu erreichen. (Dies gilt für die wichtigen Hauptgruppenelemente der 2. und 3. Periode.) Diese Tendenz wird Oktett-Regel genannt. 2. Chemische Bindung Die Atome können die Edelgaskonfiguration auf verschiedene Art und Weise erreichen. Wenn sich Atome miteinander verbinden, treten Veränderungen in der Elektronenverteilung auf. Je nach der Art der Elektronenverteilung werden drei Arten von chemischer Bindung unterschieden: • Ionenbindung • Atombindung (auch: kovalente Bindung) • Metallbindung Dies sind die Grenztypen der chemischen Bindung, d.h. es existieren zwischen diesen Idealtypen fließende Übergänge. Es sollte im Folgenden immer bedacht werden, dass die treibende Kraft immer die Ausbildung der stabilen Edelgaskonfiguration ist, egal welche dieser chemischen Bindungen betrachtet wird. 2.1. Ionenbindung Die Ionenbindung kommt zustande, wenn Elektronen vollständig von Atomen einer Sorte auf Atome einer anderen Sorte übergehen. Die Atome eines der reagierenden Elemente geben Elektronen ab und werden zu positiv geladenen Ionen (Kationen). Die Atome des anderen Reaktanden nehmen die Elektronen auf und werden zu negativ geladenen Ionen (Anionen). Typisches Beispiel einer Ionenverbindung ist Natriumchlorid NaCl. Natrium hat 1 Valenzelektron. Um die Edelgaskonfiguration (des Neons) zu erreichen, gibt es ein Elektron ab und überträgt es auf 5. Tag: Chemische Bindung 2 das Chloratom, welches 7 Valenzelektronen hat, und damit die Edelgasanordnung des Argons erhält. (siehe unten) Na + Cl → Na + + Cl − Ionenverbindungen entstehen durch Vereinigung von ausgeprägt metallischen Elementen (z.B. Alkalimetalle, Erdalkalimetalle) mit ausgeprägt nicht-metallischen Elementen (z.B. Sauerstoff, Halogene), also aus Elementen, die im Periodensystem links stehen, mit Elementen, die im Periodensystem rechts stehen. Kationen und Anionen ziehen sich aufgrund ihrer entgegengesetzten elektrischen Ladung an. Diese Anziehungskraft ist ungerichtet, das bedeutet, dass sie in allen Raumrichtungen wirksam ist. Daher umgeben sich die positiven Na+ -Ionen symmetrisch mit möglichst vielen Cl--Ionen und umgekehrt. Aus den Elementen Natrium und Chlor bildet sich daher nicht eine Verbindung, die aus jeweils einem Na+ und einem Cl- -Ion besteht, sondern es entsteht ein Ionenkristall, indem die Ionen eine regelmäßige dreidimensionale Anordnung, ein Kristallgitter bilden. 2.2. Atombindung (oder kovalente Bindung) Wenn Atome von Nichtmetallen miteinander reagieren, kommt es nicht zur Bildung einer Ionenbindung, weil alle beteiligten Atome dazu tendieren, Elektronen aufzunehmen. Stattdessen binden sich zwei Atome fest über ein Elektronenpaar aneinander, das ihnen dann gemeinsam angehört. Es handelt sich hiebei also um gerichtete Bindungskräfte. Diese 1916 von Gilbert N. Lewis entwickelten Vorstellung stellt das Konzept der Atombindung dar. Dies kommt in den Lewis-Formeln zum Ausdruck, in denen Elektronen durch Punkte, Elektronenpaare durch Striche dargestellt werden. (siehe unten) Cl • + • Cl → Cl - Cl O•• + •O • → O=O Verbindungen, in denen die Atome durch kovalente Bindungen zusammengehalten werden, werden als Moleküle bezeichnet. Beispiele für solche Moleküle sind z.B. Cl2, O2, H2O, NH3. Bei den beschriebenen Molekülen entstehen gemeinsame „bindende“ Elektronenpaare. Nicht an der Bindung beteiligte Elektronen werden als „nicht-bindende“ oder „freie“ Elektronenpaare bezeichnet. Bei 5. Tag: Chemische Bindung 3 Hauptgruppenelementen entstehen bindende Elektronenpaare aus Elektronen, die sich auf der äußersten Schale (Valenzschale) der Atome befinden. Elektronen innerer Schalen sind an der Bindung nicht beteiligt. Bei den Lewis-Formeln brauchen daher nur die Elektronen der Valenzschale berücksichtigt werden. In Molekülen mit Atombindungen erreichen die Atome durch gemeinsame bindende Elektronenpaare eine abgeschlossene stabile Edelgasanordnung. 2.3. Polarisierte Bindung Selten liegen bei den Verbindungen die Grenzfälle der Ionen- oder Atombindung vor. Eine Atombindung mit absolut gleichmäßiger Verteilung der Elektronendichte zwischen den beiden Atomen gibt es nur zwischen Atomen des gleichen Elements. Wenn zwei unterschiedliche Partner durch eine kovalente Bindung verknüpft sind, ist die Elektronenladung nicht symmetrisch zwischen den beiden Atomkernen verteilt; die beiden Atome teilen sich das gemeinsame Elektronenpaar nicht gleichmäßig, ein Atom wird die Elektronen immer etwas stärker zu sich ziehen als andere. Abbildung 1 zeigt den Übergang zwischen Ionenbindung und kovalenter Bindung. So ist z.B. bei Chlorwasserstoff HCl der Chlor stärker in der Lage, die Elektronen an sich zu ziehen. Durch die ungleiche Elektronenverteilung erhält das Chloratom eine partiell negative Ladung (δ -), der Wasserstoff eine partiell positive Ladung (δ +). Eine derartige Bindung mit einem negativen und positiven Pol nennt man eine polarisierte Bindung. Abbildung 1: Übergang zwischen Ionenbindung und kovalenter Bindung 5. Tag: Chemische Bindung 4 Ein Objekt, auf dem sich zwei entgegengesetzte Ladungen des gleichen Betrags in einem bestimmten Abstand befinden, ist ein Dipol. Als Maß für die Fähigkeit eines Atoms, die Elektronen in einem Molekül an sich zu ziehen, wird auch die Elektronegativität (EN) verwendet. Je höher die EN, desto stärker die Fähigkeit des Atoms zur Bindung von Elektronen und umgekehrt. Anders ausgedrückt, je höher die Differenz der EN zwischen zwei Atomen, desto höher der ionische Charakter der Bindung, und gleichzeitig desto niedriger der kovalente Charakter der Bindung. 2.4. Metallbindung Die metallische Bindung tritt bei Metallen und Legierungen auf. Zahlreiche Atome sind zusammengefügt; jedes davon hat ein oder mehrere Außenelektronen an ein gemeinsames „Elektronengas“ abgegeben. Die dabei entstandenen positiv geladenen Ionen werden von dem negativ geladenen Elektronengas zusammengehalten. Abbildung 2 zeigt dies beispielhaft an einem Aluminiumkristall. Eine Schicht von Al3+ - Rümpfen in der Anordnung einer dichtesten Kugelpackung ist in ein Elektronengas eingebettet. Abbildung 2: Schnitt durch einen Aluminiumkristall Im Gegensatz zu den anderen Bindungsarten sind die Valenzelektronen also nicht an ein bestimmtes Atom gebunden, sondern delokalisiert und können sich im gesamten Metallgitter frei bewegen. 3. Literatur [1] E. Riedel: Anorganische Chemie. de Gruyter Verlag, Berlin, 2. Auflage (1990) [2] C.E. Mortimer: Chemie – Das Basiswissen der Chemie. Thieme Verlag, Stuttgart, 5. Auflage (1987)