Chemie Zusammenfassung - FSMB
Werbung
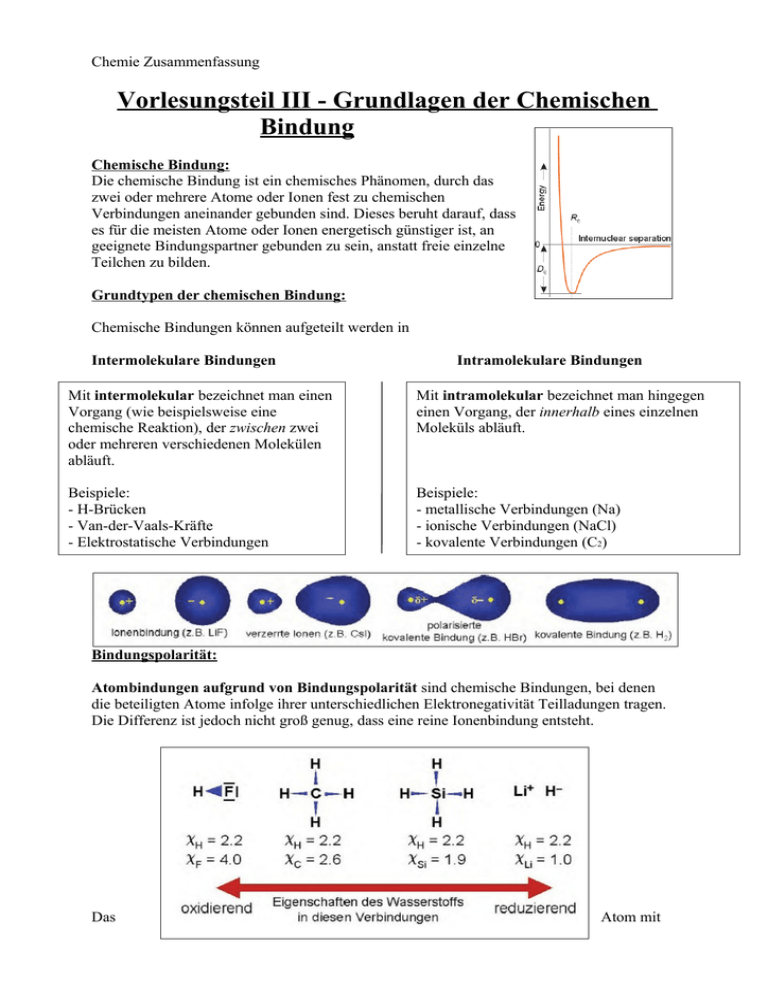
Chemie Zusammenfassung Vorlesungsteil III - Grundlagen der Chemischen Bindung Chemische Bindung: Die chemische Bindung ist ein chemisches Phänomen, durch das zwei oder mehrere Atome oder Ionen fest zu chemischen Verbindungen aneinander gebunden sind. Dieses beruht darauf, dass es für die meisten Atome oder Ionen energetisch günstiger ist, an geeignete Bindungspartner gebunden zu sein, anstatt freie einzelne Teilchen zu bilden. Grundtypen der chemischen Bindung: Chemische Bindungen können aufgeteilt werden in Intermolekulare Bindungen Intramolekulare Bindungen Mit intermolekular bezeichnet man einen Vorgang (wie beispielsweise eine chemische Reaktion), der zwischen zwei oder mehreren verschiedenen Molekülen abläuft. Mit intramolekular bezeichnet man hingegen einen Vorgang, der innerhalb eines einzelnen Moleküls abläuft. Beispiele: - H-Brücken - Van-der-Vaals-Kräfte - Elektrostatische Verbindungen Beispiele: - metallische Verbindungen (Na) - ionische Verbindungen (NaCl) - kovalente Verbindungen (C2) Bindungspolarität: Atombindungen aufgrund von Bindungspolarität sind chemische Bindungen, bei denen die beteiligten Atome infolge ihrer unterschiedlichen Elektronegativität Teilladungen tragen. Die Differenz ist jedoch nicht groß genug, dass eine reine Ionenbindung entsteht. Das Atom mit dem größeren Elektronegativitätswert (EN) zieht die bindenden Elektronen stärker zu sich heran als das Atom mit dem kleineren EN-Wert. Dadurch wird die Ladungsverteilung entlang der Atombindung asymmetrisch. Das Atom des stärker elektronegativen Elements erhält eine negative Teilladung, das Atom des schwächer elektronegativen Elements eine positive Teilladung. Diese Teilladungen sind kleiner als die Ladungen von Ionen. Die polare Atombindung stellt einen Übergang von der reinen Atombindung zur Ionenbindung dar. Valence Bond Theorie: Bei dem Modell der Valence Bond Theorie entsteht eine Valenzbindung zwischen zwei Atomen dadurch, dass jedes dieser Atome ein Elektron für eine Bindung zur Verfügung stellt. Diese beiden Elektronen bilden ein Elektronenpaar in einem bindenden Molekülorbital. Die beiden Atome im Molekül haben nun Anteil an beiden Elektronen, also am „eigenen“ Elektron und am Elektron „des Partners“. Der energetische Vorteil, der dadurch für die beiden Atome entsteht, ist die Triebkraft für die Bildung von Molekülen. Diese Art von Bindung wird auch kovalente Bindung genannt. Bei der Valence Bond Theorie wird lediglich äußerste Elektronenhülle (Valenzelektronen) berücksichtigt. Oktettregel: Die Oktettregel oder AchtElektronen-Regel besagt, dass viele Atome Moleküle oder Ionen bilden, bei denen die Zahl der äußeren Elektronen (Valenzelektronen) acht beträgt, d. h., dass die Atome bestrebt sind, die Elektronenkonfiguration eines Edelgases anzunehmen. Sie ist damit ein Spezialfall der umfassenderen Edelgasregel. Elektronenformeln nach Lewis: Die Valenzstrichformel (nach Gilbert Newton Lewis), ist ein Konzept aus der Chemie. Sie dient zur Darstellung und zum grundlegenden Verständnis der Struktur von einfachen Molekülen. Sie basiert auf der Oktettregel. Bei der Verwendung der Lewisschreibweise werden nur die äußersten Elektronen des Atoms, also die Valenzelektronen, beachtet. Dabei werden freie Elektronen als Punkt und freie Elektronenpaare als Strich dargestellt. Einfachbindung: Mehrfachbindung: Atombindung zwischen zwei Atomen ( Punkt + Punkt -> Strich ) Eine Doppel-, Dreifachbindung ist eine Form der chemischen Bindung, bei der zwei Atome über zwei,drei verschiedene Atombindungen verknüpft werden. (Doppel-, Dreifachstrich) Als Mesomerie (Resonanz) wird die Erscheinung bezeichnet, dass die in einem Molekül oder mehratomigen Ion vorliegenden Bindungsverhältnisse nicht durch eine einzige Strukturformel dargestellt werden können, sondern nur durch mehrere Grenzformeln. Als isoelektronisch bezeichnet man zwei Atome, Ionen oder Moleküle, wenn sie dieselbe Elektronenzahl und eine sehr ähnliche Elektronenkonfiguration besitzen, obwohl sie aus anderen Elementen bestehen. Hybridisierung: Hybridisierung bezeichnet die Kombination verschiedener Atomorbitalen zu so genannten Hybridorbitalen. In Abhängigkeit von der Zahl und Art der eingebrachten Atomorbitale lassen sich unterschiedliche Hybridorbitale erhalten. sp1: sp-Hybrid-Orbitale kommen zustande durch die Mischung des 2s Atomorbitals mit dem 2px-Orbital. sp2: sp²-Hybrid-Orbitale kommen zustande durch die Mischung des 2s Atomorbitals mit dem 2px-und dem 2py -Orbital. sp3: sp³-Hybrid-Orbitale kommen zustande durch die Mischung des 2s Atomorbitals mit dem 2px-,2pyund dem 2pz- Orbital. Hypervalenz In der Valenzstrichformel für Moleküle wie PF5 oder SF6 (5.-8. Hauptgruppe) muss man mehr als vier kovalente Bindungsstriche an das P- bzw. S-Atom zeichnen.Ähnlich ist es beim XeF2, bei dem sich zusammen mit den einsamen Elektronenpaaren fünf Valenzelektronenpaare am Xenon-Atom ergeben. Atome mit dieser Art von Oktett-Aufweitung werden hypervalent gennant. Bis vor kurzem wurde hier die Beteiligung von d-Orbitalen des Zentralatoms angenommen, z.B sp³d²-Hybridisierung für das Schwefel-Atom im SF6. VSPER-Theorie (Valenzelektronenpaar-Abstoßungsmodell) ermöglicht, die geometrische Anordnung der Atome in einem Molekül vorauszusagen. Regel: - In Molekülen des Typs AXn ordnen sich die Elektronenpaare in der Valenz-Energiestufe des Zentralatoms (A) so an, dass der Abstand zwischen ihnen möglichst groß wird. - Die freien Elektronenpaare (hier mit E symbolisiert) in einem Molekül vom Typ AXnEm beanspruchen mehr Raum als die bindenden Elektronenpaare und führen somit zu einer Vergrößerung der Winkel X-A-E und einer Verkleinerung der Winkel X-A-X. - Nach Möglichkeit wird stets ein großer Abstand mehrerer freier Elektronenpaare zueinander gewählt. - Elektronegative Substituenten ziehen bindende Elektronenpaare stärker an sich heran und vermindern damit deren Raumbedarf. - Mehrfachbindungen werden wie ein übergroßes Elektronenpaar gewertet und beanspruchen somit mehr Raum als Einfachbindungen. Hierbei steigt der Platzbedarf mit der Bindungsordnung. Einzelne freie Elektronen in Radikalen nehmen hingegen weniger Raum ein als freie Elektronenpaare. - Der Winkel zwischen den Elektronenpaaren mit geringerem Platzbedarf wird durch die Anwesenheit von Elektronenpaaren mit größerem Platzbedarf verkleinert. So ist beispielsweise der H-C-H-Winkel in Formaldehyd (H2C=O) kleiner als der H-C-H-Winkel in Methan (CH4). Grundlegende Strukturpolyeder: 2 EP → lineare Anordnung, 180° z.B Cl-Hg-Cl 3 EP → Dreieck, 120° 4 EP → Tetraeder, ~~109,5° 5 EP → trigonale Bipyramide, 90° axial/120° aquatorial 6 EP → Oktaeder, 90°, z.B SF6, IF5 Verzerrung der Geometrien aufgrund von Elektronegativitäten bei vier EP. Bei NH3 drückt das einsame EP wegen stärker abstoßender Wirkung (N >EN) die bindenden EP zusammen → Winkel nur noch 107°. Bei H20 105°, da die bindenden EP nun von zwei nicht bindenden EP abgestoßen werden. Strukturen sind nicht starr: Moleküldynamik Berry-Pseudorotation In einem Molekül befinden sich die Atome nicht völlig starr an einer bestimmten Position, sondern führen in Abhängigkeit von der Umgebungstemperatur Schwingungen aus. Diese sogenannten Deformationsschwingungen führen zu periodischen Änderungen von Bindungslängen und Bindungswinkeln. Als Folge dieser Deformationsschwingungen bewegen sich bei der BerryPseudorotation die beiden Atome in apikaler Position aufeinander zu, der Bindungswinkel 4– Zentralatom–5 wird von 180° auf 120° verkleinert und die Bindungslängen verkürzen sich, während zwei äquatoriale Atome sich voneinander wegbewegen, der Bindungswinkel wird hier von 120° auf 180° aufgeweitet und der Abstand zum Zentralteilchen vergrößert sich. Molekülorbitaltheorie Die MO-Theorie ist eine von zwei komplementären Möglichkeiten den Aufbau von Atombindungen zu beschreiben. Beim MO-Verfahren werden die Atomorbitale der beteiligten Atome ‚vermischt‘. Dabei spalten sie sich in bindende und antibindende Molekülorbitale auf..Mathematisch handelt es sich dabei um eine Lösung der SchrödingerGleichung für mehratomige Systeme. Regeln: -> Kombination zweier Potential führt zur Interferenz der Wellenfunktionen -> Interferenz (=Überlappung) bestimmt durch: - räumliche Nähe - energetische Nähe - Orbitalgeometrie Ψ1 + Ψ2 Für MO gelten die selben Gesetzmäßigkeiten wie für Atomorbitale, insbesonder das Pauli-Prinzip. Wie bei einem Atom sind auch bei einem Molekül Orbitale unterschiedlicher Energien zu berücksichtigen. Energie, Symmetrie, Bindung: Als σ-Bindung wird eine Bindung bezeichnet, die rotationssymmetrisch zur Bindungsachse ist. Anders ausgedrückt werden Orbitale (und deren Wellenfunktion) überlagert, d.h. s-, px-, dz2Orbitale und Mischungen (Hybride) aus diesen. π-Molekülorbitale sind nicht rotationssymmetrisch um die Verbindungslinie zwischen den Atomkernen. Es enthält eine Knotenebene in der Kernachse. σ-π-Modell Eine Doppelbindung besteht aus einer σ-Bindung und aus einer π-Bindung, wobei die Bindungspartner im sp2-hybridisierten Zustand vorliegen: drei Hybridorbitale weisen in die Ecken eines gleichseitigen Dreiecks, senkrecht dazu steht das pz-Orbital, das nicht für die Hybridisierung verwendet wurde. Die σ-Bindung entsteht durch Überlappung zweier Hybridorbitale, die π-Bindung entsteht durch Überlappung der zwei pz-Orbitale. Da beide pzOrbitale parallel zu einander stehen müssen, entsteht ein neues Molekülorbital mit einer Knotenebene. Zeichnen von MO-Diagrammen Zu beachten ist, dass bei der Linearkombination zweier AOs ein bindendes MO mit tieferer Energie als das tieferliegende AO und ein antibindendes MO mit höherliegender Energie als das höherliegende AO gebildet werden. Die Aufspaltung wird in erster Näherung von der Überlappung bestimmt. So kann man z. B. vorhersagen, dass eine σ-Bindung stärker aufspaltet als eine π-Bindung. Ligandengruppenorbitale Problem: Bei mehr als zwei Teilchen MO-Schemata unübersichtlich Lösung: LGO I) Separierung des Moleküls in Zentralatom + Liganden (Atom oder Molekül, welches über eine dative Bindung (koordinative Bindung) an ein zentrales Metall-Ion koordiniert) II) Aufstellen der mögl. Wellenfunktionen für alle Ligandenorbitale gemeinsam III) WW der LGO Ligandengruppenorbitale (LGOs) sind die Orbitale der "Liganden" die man vor der Linearkombination mit den Orbitalen des "Zentralatoms" bildet. Man geht hier von symmetrietechnischen Überlegungen aus. Einfaches Beispiel: BeH2 (linear H-Be-H, monomer ein hypothetisches Teilchen; in Realität hoch polymere Verbindung) Zuerst bildet man die LGOs der beiden 1s Orbitale der beiden H. Diese kann man wie im MO Schema von H2 nur auf zwei Arten kombinieren, einmal mit gleicher Phase, einmal mit unterschiedlicher Phase. Diese zwei Orbitale lassen sich dann mit den Orbitalen von Be wechselwirken. Das Orbital mit gleicher Phase kann mit dem s Orbital von Be wechselwirken, das pz Orbital (Molekülachse = z-Achse) kann mit dem LGO unterschiedlicher Phase wechselwirken. Die beiden anderen p Orbitale von Be können aus symmetriegründen nicht konstruktiv miteinander wechselwirken. Hieraus kann man sich dann einigermaßen ein MO-Schema basteln. π/σ-Separierung siehe S.137, oben Wichtig: strikte Trennung von VB (Valenz Bond) und MO (Molekül Orbital) Theorie!!! Van-der Waals Wechselwirkungen und Edelgase Mit Van-der-Waals-Kräften bezeichnet man die relativ schwachen nicht-kovalenten Wechselwirkungen zwischen Atomen oder Molekülen, deren Wechselwirkungsenergie mit etwa der sechsten Potenz des Abstandes abfällt. Alle Van-der-Waals-Kräfte sind im Vergleich zur Atombindung und Ionenbindung schwache Kräfte Diese Kraft tritt im Allgemeinen zwischen unpolaren (ungeladenen) Kleinstteilchen (Edelgasatome, Moleküle) auf und führt zu einer schwachen Anziehung dieser Kleinstteilchen. Edelgase Sie kommen nur atomar vor, d. h. nicht molekular, da sie chemisch nahezu keine Verbindungen eingehen können. Der Grund hierfür ist, dass die Energieniveaus (veraltet: „Schalen“) des Atoms abgeschlossen – d. h. vollständig mit Elektronen aufgefüllt. Edelgas (Elemente der VIII. Hauptgruppe) sind analog zu den Edelmetallen sehr reaktionsträge (inert). Joule-Thompson Effekt Der Joule-Thomson-Effekt tritt auf, wenn ein reales Gas oder Gasgemisch durch Drosselung (=Druckänderung) eine Temperaturänderung erfährt. Diese Erscheinung spielt eine wichtige Rolle in der Thermodynamik von Gasen und ist vor allem für die Technik von Bedeutung. Eine wichtige großtechnische Anwendung ist die Gasverflüssigung im Linde-Verfahren. Phasendiagramm Das Phasendiagramm ist ein Druck-Temperatur Diagramm, aus dem man die Bedingungen ersehen kann, unter denen ein Stoff fest, flüssig oder gasförmig ist. Tripelpunkt (auch Dreiphasenpunkt) ist der Punkt, beschrieben durch Druck und Temperatur, an dem drei Phasen eines Systems im Gleichgewicht sind. Kritische Punkt ist der Zustand eines Stoffes, der sich durch Angleichen der Dichten von flüssiger und Gasphase kennzeichnet. Die Unterschiede zwischen beiden Aggregatzuständen hören an diesem Punkt auf zu existieren. Im Phasendiagramm stellt der Punkt das obere Ende der Dampfdruckkurve dar. Die Phasenregel beinhaltet die Aussage, dass im thermodynamischen Gleichgewicht nicht beliebig viele Phasen gleichzeitig nebeneinander vorliegen können. Zudem kann man mit ihr die an einem bestimmten Punkt im Phasendiagramm maximal möglichen Freiheitsgrade bestimmen. Phasengesetz: P + F = K + 2 (Komponenten K, Phasen P, Freiheitsgrade F) Kolligative Eigenschaften (δG / δT = S; Sf < Sm < Sg) Als kolligative Eigenschaft wird eine Stoffeigenschaft bezeichnet, die nur von der Teilchenzahl (Stoffmenge), nicht aber von der Art der Teilchen oder deren chemischer Zusammensetzung abhängt. Beispiele hierfür sind die Erscheinungen der * Dampfdruckerniedrigung, * Gefrierpunktserniedrigung (Kryoskopie), * Siedepunktserhöhung (Ebullioskopie) und * Osmose (genauer des osmotischen Drucks). Ursache für die Dampfdruckerniedrigung und Siedepunktserhöhung ist z. B., dass die gelösten Substanzen das chemische Potenzial des Lösungsmittels verringern und dessen Teilchen stärker anziehen (van-der-Waals-Kräfte, Elektrolyte: Ion-Dipol-Wechselwirkung). Polare Bindungen Polare Atombindungen sind chemische Bindungen, bei denen die beteiligten Atome infolge ihrer unterschiedlichen Elektronegativität Teilladungen tragen. Die Differenz ist jedoch nicht groß genug, dass eine reine Ionenbindung entsteht. Das Atom mit dem größeren Elektronegativitätswert (EN) zieht die bindenden Elektronen stärker zu sich heran als das Atom mit dem kleineren EN-Wert. Dadurch wird die Ladungsverteilung entlang der Atombindung asymmetrisch. Das Atom des stärker elektronegativen Elements erhält eine negative Teilladung, das Atom des schwächer elektronegativen Elements eine positive Teilladung. Diese Teilladungen sind kleiner als die Ladungen von Ionen. Die polare Atombindung stellt einen Übergang von der reinen Atombindung zur Ionenbindung dar. H - Brücken Wasserstoffbrückenbindungenn sind eine Form der Nebenvalenzbindung und ihre Stärke liegt in der Regel deutlich unter denen der kovalenten Atombindung und der ionischen Bindungen. Die Wasserstoffbrückenbindung bewirkt u.a. dass Wassermoleküle zu Ketten und größeren Gruppen verbunden sind, weshalb auch warmes Wasser eine Flüssigkeit bleibt und der Siedepunkt des Wassers verhältnismäßig hoch liegt. Dieses Prinzip ist eine notwendige Voraussetzung für die meisten Lebewesen. In Proteinen sorgen Wasserstoffbrücken für den Zusammenhalt zwischen den Atomen und erhalten so die wichtigen dreidimensionalen Strukturen der Moleküle aufrecht.